核磁共振中特征质子的化学位移
不同类型质子的化学位移范围

不同类型质子的化学位移范围
不同类型质子的化学位移范围可以根据其所处的化学环境和相邻的官能团等因素而有所不同。
以下是一些常见的质子类型及其大致的化学位移范围:
1.α-质子(Aliphatic Protons):位于脂肪烷烃链上的饱和碳原
子上的质子。
其化学位移范围通常在0.5到3.0 ppm之间。
2.β-质子(Allylic/Benzylic Protons):位于烯丙基或苯甲基碳
原子上的质子。
其化学位移范围通常在1.5到5.5 ppm之间。
3.脂肪烷基质子(Aliphatic Methine Protons):位于脂肪烷烃链
上的一个碳原子上的质子。
其化学位移范围通常在0.8到2.5 ppm 之间。
4.芳香质子(Aromatic Protons):位于苯环或其他芳香环上的质
子。
其化学位移范围通常在6.5到8.5 ppm之间。
5.羟基质子(Hydroxyl Protons):位于羟基(OH)官能团上的质
子。
其化学位移范围通常在2.5到5.0 ppm之间。
需要注意的是,这些化学位移范围仅为参考值,实际情况可能会因分子结构、溶剂、温度等因素而有所偏移。
具体的化学位移范围可通过核磁共振(NMR)技术进行精确测定和分析。
NMR-核磁共振(含化学位移概念)

NMRNMR(Nuclear Magnetic Resonance)为核磁共振。
是磁矩不为零的原子核,在外磁场作用下自旋能级发生蔡曼分裂,共振吸收某一定频率的射频辐射的物理过程。
核磁共振波谱学是光谱学的一个分支,其共振频率在射频波段,相应的跃迁是核自旋在核蔡曼能级上的跃迁。
国内叫NMR,国外叫MR,因为国外比较避讳Nuclear这个单词。
目录基本原理核磁共振应用核磁共振发展动向二维核磁共振波谱的基本原理划分区域基本原理自旋量子数I不为零的核与外磁场 H0相互作用,使核能级发生2I+1重分裂,此为蔡曼分裂。
核磁共振是1946年由美国斯坦福大学布洛赫(F.Block)和哈佛大学珀赛尔(E.M.Purcell)各自独立发现的,两人因此获得1952年诺贝尔物理学奖。
50多年来,核磁共振已形成为一门有完整理论的新学科。
核磁共振应用核磁共振适合于液体、固体。
如今的高分辨技术,还将核磁用于了半固体及微量样品的研究。
核磁谱图已经从过去的一维谱图(1D)发展到如今的二维(2D)、三维(3D)甚至四维(4D)谱图,陈旧的实验方法被放弃,新的实验方法迅速发展,它们将分子结构和分子间的关系表现得更加清晰。
在世界的许多大学、研究机构和企业集团,都可以听到核磁共振这个名词,包括我们在日常生活中熟悉的大集团。
而且它在化工、石油、橡胶、建材、食品、冶金、地质、国防、环保、纺织及其它工业部门用途日益广泛。
在中国,其应用主要在基础研究方面,企业和商业应用普及率不高,主要原因是产品开发不够、使用成本较高。
但在石油化工、医疗诊断方法应用较多。
核磁共振发展动向20世纪后半叶,NMR技术和仪器发展十分快速,从永磁到超导,从60MHz到800MHz的NMR谱仪磁体的磁场差不多每五年提高一点五倍,这是被NMR在有机结构分析和医疗诊断上特有功能所促进的。
现在有机化学研究中NMR已经成为分析常规测试手段,同样,在医疗上MRI(核磁共振成像仪器)亦成为某些疾病的诊断手段。
乙炔化学位移

乙炔化学位移乙炔是一种有机化合物,化学式为C2H2。
它是最简单的炔烃,也是一种重要的工业原料。
乙炔的化学位移是指它在核磁共振(NMR)谱图中的特征峰位移。
本文将探讨乙炔化学位移的相关知识。
在核磁共振谱图中,乙炔的化学位移通常以ppm(部分百万)为单位进行表示。
化学位移与乙炔分子中的质子环境有关,不同的质子环境会导致不同的化学位移。
乙炔分子中有两个质子,一个位于碳原子上,另一个位于氢原子上。
它们分别对应着不同的峰位。
在乙炔的核磁共振谱图中,乙炔质子的化学位移通常在2.5至3.0 ppm之间。
这个范围内的峰位是由于乙炔中碳原子上的质子引起的。
乙炔的碳原子上的质子受到共轭效应的影响,使得化学位移较高。
乙炔分子中的氢原子也会对核磁共振谱图产生影响。
乙炔分子中氢原子的化学位移通常在2.0至2.5 ppm之间。
这个范围内的峰位是由于乙炔中氢原子引起的。
乙炔分子中的氢原子受到乙炔的π电子云的影响,使得化学位移较低。
乙炔的化学位移不仅受到乙炔本身结构的影响,还受到实验条件的影响。
例如,溶剂的选择、温度和pH值等因素都可能导致乙炔化学位移的变化。
因此,在进行核磁共振实验时,需要注意这些因素对乙炔化学位移的影响。
除了乙炔本身的化学位移,乙炔也可以通过与其他化合物反应产生新的化学位移。
例如,乙炔与氢气反应生成乙烯,乙烯的化学位移与乙炔有所不同。
这种反应可以通过核磁共振谱图来监测和分析。
乙炔的化学位移是指它在核磁共振谱图中的特征峰位移。
乙炔的化学位移与其分子结构和实验条件有关,可以通过核磁共振实验来确定和分析。
乙炔的化学位移是研究乙炔性质和反应的重要手段之一,对于有机化学和材料科学等领域具有重要意义。
希望通过本文的介绍,读者对乙炔化学位移有了更加全面的了解。
核磁共振氢谱(化学位移)

organochem@
影响化学位移的因素
5. 氢键:分子形成氢键后,氢核周围的电子云密度降低, 氢键:分子形成氢键后,氢核周围的电子云密度降低, 产生去屏蔽作用,化学位移向低场移动, 增大. 产生去屏蔽作用,化学位移向低场移动,δ增大.
6. 温度:大多数信号的共振位置受温度影响很小,但-OH, 温度:大多数信号的共振位置受温度影响很小, -NH和-SH在升高温度时形成氢键的程度降低,化学位移 NH和 SH在升高温度时形成氢键的程度降低 在升高温度时形成氢键的程度降低, 移向高场,δ降低. 移向高场, 降低. 7. 溶剂效应:溶剂的磁各向异性和溶质与溶剂之间形成 溶剂效应: 氢键将对溶质中不同位置的氢核的化学位移产生影响. 氢键将对溶质中不同位置的氢核的化学位移产生影响.
LOGO
核磁共振氢谱( 核磁共振氢谱(1H-NMR)
——化学位移 ——化学位移(chemical shifts) 化学位移(chemical
Produced by Jiwu Wen
organochem@
内容提要
化学位移的产生 化学位移的表示方法与测定 影响化学位移的因素 不同质子的化学位移
ν 样品 ν TMS δ= × 10 6 ν 仪器
organochem@
化学位移的表示方法与测定
四甲基硅(TMS)作为标准物质的优点 四甲基硅(TMS)作为标准物质的优点: 作为标准物质的优点:
TMS化学性质不活泼,与样品之间不发生化学反应和分子间缔合; TMS是一个对称结构,四个甲基的化学环境完全相同,不论在氢 谱还是碳谱都只产生一个吸收峰; Si的电负性小(1.9),TMS中氢核与碳核周围的电子云密度高,屏 蔽效应大,产生NMR信号所需的磁场强度比一般有机物中的氢核 和碳核产生NMR信号所需的磁场强度大得多,处于较高场,与绝 大部分样品信号不发生重叠和干扰; TMS沸点低(27℃),容易去除,有利于回收样品.
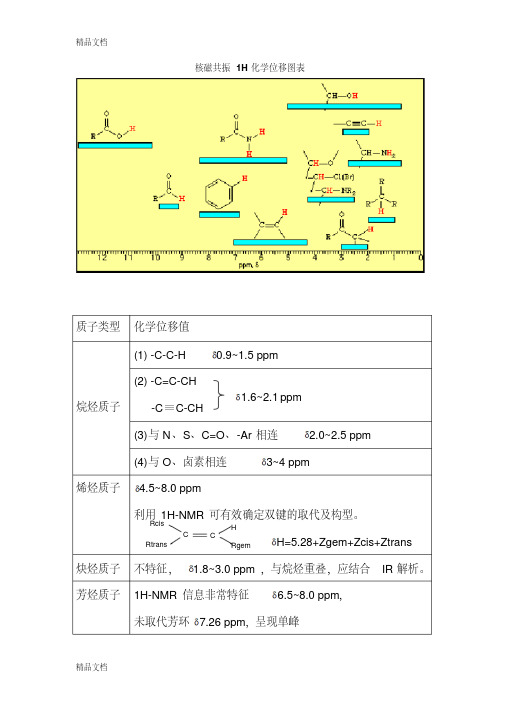
特征质子的化学位移

R2CHCOOR
2~2、2
RCH2F
4~4、5
RCOOCH3
3、7~4
RCH2Cl
3~4
RC≡CCOCH3
2~3
RCH2Br
3、5~4
RNH2或R2NH
0、5~5(峰不尖锐,常呈馒头形)
RCH2I
3、2~4
ROH
0、5~5、5(温度、溶剂
、浓度改变时影响很大)
RCONRH或ArCONRH
5~9、4
[1]
烷烃
甲烷氢的化学位移值为0、23,其它开链烷烃中,一级质子在高场δ≈9处出现,二级质子移向低场在δ≈1、33处出现,三级质子移向更低场在δ≈1、5处出现。例如:
烷烃
CH4
CH3—CH3
CH3—CH2—CH3
(CH3)3CH
δ
0、23
0、86
0、86
0、91
1、33
0、91
0、86
1、50
甲基峰一般具有比较明显的特征,亚甲基峰与次甲基峰没有明显的特征,而且常呈很复杂的峰形,不易辨认。当分子中引人其它官能团后,甲基、次甲基及亚甲基的化学位移会发生变化,但其δ值极少超出0、7~4-5这一范围。
特征质子的化学位移
由于不同类型的质子化学位移不同,因此化学位移值对于分辨各类质子就是重要的,而确定质子类型对于阐明分子结构就是十分有意义的。下表列出了一些特征质子的化学位移,表中黑体字的H就是要研究的质子。
丙酮质子的相对化学位移2.1,这种质子共振吸收处于tms的低场

丙酮质子的相对化学位移2.1,这种质子共振吸收处于tms的低场1. 引言1.1 概述丙酮是一种常见的有机溶剂和化工原料,广泛应用于化学合成、药物制造、涂料和染料等领域。
在有机化学研究中,通过核磁共振(NMR)技术可以对丙酮分子进行分析和表征。
其中,丙酮质子的相对化学位移则是一个重要的参数,可以给出关于丙酮分子结构和其它相关性质的信息。
1.2 文章结构本文将首先概述丙酮质子相对化学位移的背景和意义,然后详细介绍质子共振吸收处于三甲基硅烷(TMS)低场下的解释原理。
接着,我们将探讨影响丙酮质子相对化学位移的因素,并通过实验数据分析来验证这些因素在实际情况中的作用。
最后,我们将讨论丙酮质子相对化学位移与其结构之间可能存在的关系,并展望未来研究在此领域中的重要意义。
1.3 目的本文旨在系统地讲解丙酮质子相对化学位移及其相关内容,并深入分析影响丙酮质子相对化学位移的因素。
通过本文的阐述,读者将能够更好地理解丙酮质子相对化学位移与结构之间的关系,并对该领域的未来研究方向有所了解。
以上就是本文章“1. 引言”部分的详细内容,希望能满足您的需求。
如有任何问题,请随时提问。
2. 正文:2.1 丙酮质子的相对化学位移概述在核磁共振(NMR)光谱中,丙酮的质子信号是一个常见的实验信号。
相对化学位移是指某个原子核在强加外磁场下的共振频率与参考物质(通常为四甲基硅烷,简称TMS)的共振频率之比。
丙酮质子的相对化学位移被测定为2.1,在一般实验条件下,这个数值较为稳定。
2.2 质子共振吸收处于TMS的低场解释TMS作为一个标准参考物质,其H-NMR谱图中包含一个定义为零点的信号。
这个信号被定义为0 ppm (部分百万)。
而丙酮所产生的信号出现在更高场(消化位置),意味着它比TMS更受外界磁场影响。
这种低场位移可以通过电荷环境、溶剂效应以及分子构象等因素来解释。
2.3 影响丙酮质子相对化学位移的因素有多种因素会影响丙酮质子相对化学位移。
核磁共振化学位移

HO
O CH3
7.85ppm 7.48ppm 7.54ppm
7.26ppm
6.84ppm 7.18ppm 6.90ppm
苯甲醚
苯甲醛
溴甲烷
溴乙烷
1-溴丙烷
H 7.27
7.78
Ha
A
H
OH
C=O
H 6.73
H 7.81
OCH3 Hb
6.70
8.58
Ha1 O
COCH3
OCH3 B
Hb 8.08 Ha2 C 7.94
Cl CH2 H Cl2 CH H Cl3 C H
3.05 5.30 7.27
基团距离越远,受到的影响越小
CH3 CH2 CH2 Br
1.25 1.69 3.30
CH3F CH3OH CH3Cl CH3Br CH3I CH3-H
/ppm 4.26
3.40
3.05
2.68
2.16
0.23
cba
正屏蔽:
由于结构上的变化或介质的影响使氢核外
电子云密度增加,或者感应磁场的方向与外磁
场相反,则使谱线向高磁场方向移动(右移), 值减小,亦叫抗磁性位移。
去屏蔽:
由于结构上的变化或介质的影响使氢核外
电子云密度减少,或者感应磁场的方向与外磁
场相同,则使谱线向低磁场方向移动(左移), 值增加,亦称顺磁性位移。
优点:
12个氢处于完全相同的化学环境,只有一个 峰,
电负性 Si C, 屏蔽作用很高,一般质子的 吸收峰都出现在它的左边-----低场,
沸点低,27oC,易挥发,能与许多有机溶剂 相溶。
标准:四甲基硅(TMS),δ=0
TMS的化学位移最大,但规定 TMS=0,
十二烷基醇的核磁

十二烷基醇的核磁
十二烷基醇(C12H26O)的核磁共振氢谱(1H-NMR)主要表现为以下特征:
1. 质子的化学位移范围:根据碳链的长度和支链的存在,十二烷基醇的化学位移范围通常在0.8-
2.0 ppm(质子的共振频率)。
2. 积分面积比例:根据碳链的对称性,氢原子可分为两类。
一类是靠近支链的氢,另一类是远离支链的氢。
靠近支链的氢的积分面积比例较低,而远离支链的氢的积分面积比例较高。
3. 偶合常数:碳链上的质子之间的偶合常数约为7-11 Hz,而碳链末端的质子与相邻碳上的质子之间的偶合常数较小(约为2-4 Hz)。
4. 溶剂峰:在1H-NMR谱中,通常可以看到溶剂峰(如CDCl3、C D2Cl2、C6D6等)出现在谱图的低场区域。
5. 核磁共振氢谱的测量温度:一般控制在298 K(室温)或更高的温度。
需要注意的是,具体的核磁共振氢谱特征会受到实验条件(如溶剂、温度、磁场强度等)和样品纯度的影响。
对于不同来源的十二烷基醇,其核磁共振氢谱可能存在一定的差异。
核磁共振氢谱 (PMR或1HNMR)

核磁共振氢谱(PMR或1HNMR)核磁共振技术是20世纪50年代中期开始应用于有机化学领域,并不断发展成为有机物结构分析的最有用的工具之一。
它可以解决有机领域中的以下问题:(1)结构测定或确定,一定条件下可测定构型和构象;(2)化合物的纯度检查;(3)混合物分析,主要信号不重叠时,可测定混合物中各组分的比例;(4)质子交换、单键旋转、环的转化等化学变化速度的测定及动力学研究。
NMR的优点是:能分析物质分子的空间构型;测定时不破坏样品;信息精密准确。
NMR通常与IR并用,与MS、UV及化学分析方法等配合解决有机物的结构问题,还广泛应用于生化、医学、石油、物理化学等方面的分析鉴定及对微观结构的研究。
一、基本概念核磁共振(简称为NMR)是指处于外磁场中的物质原子核系统受到相应频率(兆赫数量级的射频)的电磁波作用时,在其磁能级之间发生的共振跃迁现象。
检测电磁波被吸收的情况就可以得到核磁共振波谱。
因此,就本质而言,核磁共振波谱是物质与电磁波相互作用而产生的,属于吸收光谱(波谱)范畴。
根据核磁共振波谱图上共振峰的位置、强度和精细结构可以研究分子结构。
发展历史1.1946 年美国斯坦福大学的F. Bloch 和哈佛大学E.M .Purcell领导的两个研究组首次独立观察到核磁共振信号,由于该重要的科学发现,他们两人共同荣获1952 年诺贝尔物理奖。
NMR发展最初阶段的应用局限于物理学领域,主要用于测定原子核的磁矩等物理常数。
2.1950 年前后W .G. Proctor等发现处在不同化学环境的同种原子核有不同的共振频率,即化学位移。
接着又发现因相邻自旋核而引起的多重谱线,即自旋—自旋耦合,这一切开拓了NMR 在化学领域中的应用和发展。
3.20 世纪60 年代,计算机技术的发展使脉冲傅里叶变换核磁共振方法和谱仪得以实现和推广,引起了该领域的革命性进步。
随着NMR 和计算机的理论与技术不断发展并日趋成熟,NMR 无论在广度和深度方面均出现了新的飞跃性进展,具体表现在以下几方面:1)仪器向更高的磁场发展,以获得更高的灵敏度和分辨率,现己有300、400、500、600MHz,甚至1000MHz 的超导NMR 谱仪;2)利用各种新的脉冲系列,发展了NMR 的理论和技术,在应用方面作了重要的开拓;3)提出并实现了二维核磁共振谱以及三维和多维核磁谱、多量子跃迁等NMR 测定新技术,在归属复杂分子的谱线方面非常有用。
有机化学基础知识点质子核磁共振光谱与化学位移的解释

有机化学基础知识点质子核磁共振光谱与化学位移的解释质子核磁共振(Proton Nuclear Magnetic Resonance,简称1H NMR)光谱是有机化学中常用的一种结构分析方法。
通过测量样品中质子核吸收和辐射特定频率的能量,可以获得有机物分子的结构信息。
在1H NMR光谱中,化学位移是一个重要的参数,用于描述质子核在磁场中的环境。
一、质子核磁共振光谱的原理质子核磁共振光谱是利用核磁共振现象进行分析的方法。
核磁共振现象是指在外加静磁场下,原子核的磁矩在射频电磁波作用下发生共振吸收和辐射的现象。
对于质子核磁共振光谱而言,主要关注的是质子核在磁场中的行为。
在质子核磁共振现象中,质子核具有自旋,并且自旋可以分为两个方向,即向上自旋和向下自旋。
外加静磁场下,向上自旋和向下自旋的能量存在微小差异,这就是质子核的磁性差异。
当样品受到射频电磁波的照射时,如果射频频率与样品中的质子核发生共振吸收,质子核就会从向下自旋跃迁到向上自旋,同时吸收特定频率的能量。
二、化学位移的概念及其解释化学位移是质子核磁共振光谱中的一个重要参数,用于描述质子核在磁场中的环境。
化学位移通常以δ值表示,单位为ppm(parts permillion)。
化学位移的数值与质子核所处的环境相关,不同化学环境的质子核在磁场中的吸收和辐射频率有所差异。
对于有机化合物而言,质子核所处的化学环境可以通过相邻原子、化学键的电性质以及分子的立体构型来揭示。
质子核所处的化学环境越不同,其化学位移数值差异就越大。
因此,化学位移提供了有机化合物中不同质子核的定位信息,有助于推断分子的结构。
三、影响化学位移的因素1. 直接影响化学位移的因素包括化学环境、相邻原子和共价键的电性质等。
例如,醛基(-CHO)和甲基(-CH3)的化学位移通常位于较低场,而酮基(-C=O-R)的化学位移则位于较高场。
2. 磁场强度也会影响化学位移。
在不同磁场强度下,质子核的共振吸收频率发生变化,从而导致化学位移出现差异。
共轭效应使质子的化学位移值

共轭效应使质子的化学位移值
共轭效应是有机化学中一个重要的概念,它能够影响质子的化学位移值。
质子的化学位移值是核磁共振(NMR)谱图中的一个重要参数,能够提供有关分子结构和化学环境的信息。
在有机分子中,共轭效应指的是共轭双键或环中的π电子系统对相邻原子的化学环境产生的影响。
共轭双键或环中的π电子系统能够通过电子共轭作用来影响相邻原子的电子密度分布,从而改变质子的化学位移值。
共轭效应可以通过改变π电子的分布来改变相邻原子的电子云密度。
当共轭双键或环中的π电子系统与相邻原子的有机基团形成共轭体系时,共轭体系中的π电子能够在整个体系中传递电子,从而改变相邻原子的电子云分布。
这种电子共轭作用可以导致相邻原子电子云的偏移,从而改变质子的化学位移值。
例如,苯环是一个典型的共轭体系。
苯环中的π电子能够在整个环中传递电子,从而改变相邻原子的电子云密度。
这种电子共轭作用导致苯环中的质子化学位移值出现了特征性的峰。
共轭效应还可以通过改变相邻原子的电荷分布来影响质子的化学位移值。
当共轭体系中的π电子系统与相邻原子的有机基团发生共轭作用时,π电子系统能够改变相邻原子的电荷分布,导致质子的化学位移值发生改变。
共轭效应是影响质子化学位移值的重要因素。
通过共轭作用,π电子能够改变相邻原子的电子云分布和电荷分布,从而影响质子的化学位移值。
在有机化学中,理解和应用共轭效应对于解读NMR谱图和确定分子结构具有重要意义。
化学位移和磁场强度的关系

化学位移和磁场强度的关系化学位移和磁场强度的关系1. 引言化学位移是核磁共振(NMR)技术中一个重要的概念,它描述了分子中核自旋受到外加磁场的影响而发生的频率偏移。
磁场强度是影响化学位移的关键因素之一。
本文旨在探讨化学位移和磁场强度之间的关系,并揭示这种关系对于分析化学和结构表征的重要性。
2. 化学位移的概念化学位移是指核自旋受到外加磁场影响后发生的频率偏移。
在核磁共振谱图中,化学位移以化学位移标尺(通常以帕斯卡为单位)表示,通常用δ表示。
化学位移的数值与分子中核自旋所受到的磁场影响相关联,其中包括局部磁场、磁场强度等因素。
3. 磁场强度对化学位移的影响磁场强度是一个重要的参数,它决定了核自旋所受到的磁场的强弱程度。
当磁场强度增加时,核自旋受到的磁场效应也增大,从而导致化学位移的变化。
具体来说,当磁场强度增加时,化学位移将向高频方向发生偏移。
这是由于磁场强度增加会导致核自旋的能级之间的能量差变大,从而导致频率偏移的加大。
4. 磁场强度与分子结构的关系磁场强度对分子结构也有重要影响。
化学位移的大小取决于核自旋周围的局部磁场,而局部磁场是由于分子结构引起的。
分子结构的不同导致了局部磁场的差异,进而影响化学位移的数值。
在实际应用中,我们可以利用核磁共振技术通过测量化学位移来推断分子的结构信息。
5. 典型实例:质子化学位移在核磁共振谱图中,质子化学位移是最常见的化学位移之一。
质子化学位移主要与质子所处环境相关,包括化学环境和电子环境等。
根据质子化学位移的不同,我们可以推断出分子中质子的位置、化学键的类型以及分子结构的一些特征。
6. 应用领域化学位移和磁场强度的关系在许多领域都有着广泛的应用。
在无机化学中,通过分析核磁共振谱图中的化学位移,可以推断出各种化合物的结构和定量信息。
在有机化学中,通过对化学位移的解读,可以确定化合物的分子式、官能团及其位置等。
在药物研发和食品检测等领域中,研究化学位移和磁场强度的关系有助于解析复杂样品的组成和结构。
不同类型质子的化学位移

不同类型质子的化学位移在核磁共振(NMR)技术中,质子(H)的化学位移是一个重要的参数。
不同的物质由于其分子结构的不同,其质子的化学位移值也各有差异。
化学位移反应了质子周围的电子环境对其磁矢量产生的影响,是NMR 谱图中区分不同化合物的重要依据。
根据分子结构和电子分布的不同,质子可以大致分为两类:一类是氢原子,它通常存在于非极性环境中;另一类是重氢原子,它通常存在于极性环境中。
这两类质子的化学位移值存在显著的差异。
氢原子的化学位移值通常较低,主要受其周围电子环境的影响。
在有机化合物中,氢原子的化学位移值通常在0-2ppm之间。
在脂溶性维生素和生物膜中,氢原子的化学位移值较低,通常在5-5ppm之间。
而在水溶性维生素和核酸中,氢原子的化学位移值则较高,通常在5-0ppm之间。
重氢原子的化学位移值则较高,主要受其周围电子环境的影响。
在有机化合物中,重氢原子的化学位移值通常在2-4ppm之间。
在醇、酚和羧酸等化合物中,重氢原子的化学位移值通常在3-4ppm之间。
而在胺、酮和醛等化合物中,重氢原子的化学位移值则较低,通常在2-3ppm之间。
不同类型质子的化学位移对于解析NMR谱图至关重要。
通过分析质子的化学位移值,我们可以推断出其所在的分子环境和电子环境,从而进一步解析化合物的结构。
质子的化学位移也广泛应用于药物研发、材料科学、生物学等领域,对于研究分子的性质和行为具有重要意义。
不同类型质子的化学位移是NMR谱分析中的关键参数,对于解析分子结构和性质具有重要意义。
通过深入理解质子化学位移的原理和影响因素,我们可以更好地利用NMR技术进行物质分析和研究。
化学实验是化学教学的重要组成部分,对于培养学生的科学素养和创新实践能力具有至关重要的作用。
然而,不同类型的化学实验具有不同的教学重点和难点,因此需要针对不同类型的实验进行教学优化,以提高教学效果。
基础操作型实验主要是为了让学生掌握基本的化学实验操作方法和技能,如药品的取用、仪器的使用、实验数据的记录和处理等。
最新核磁共振1H化学位移图表
2.16
—
—
CH3(t) 0.88 0.88 0.86 0.87 0.89 0.90
—
CH2(m) 27 1.27 1.27 1.23 1.29 1.29
—
异丙醇
CH3(d) 1.22 1.10 1.04 0.95 1.09 1.50 1.17
CH 4.04 硅脂 — 四氢呋喃
3.90 0.07
丙酮 — 2.17 2.09 2.09 1.55 2.08 2.15 2.22
乙腈 — 2.10 苯 — 7.36 叔丁醇 CH3 1.28
2.05 7.36
1.18
2.07 7.37
1.11
1.55 7.15
1.05
1.96 7.37
1.16
2.03 7.33
1.40
2.06 —
1.24
OH
—
—
4.19 1.55 2.18
3.78 0.13
3.67 3.87 3.92 4.02
—
0.29 0.08 0.10
—
CH2 1.85 1.79 1.76 1.40 1.80 1.87 1.88
CH2O 3.76 3.63 3.60 3.57 3.64 3.71 3.74
甲苯 CH3
2.36 2.32 2.30 2.11 2.33 2.32
为不干扰谱图,所用溶剂分子中的氢都应被氘取代,但难免有氢的残余(
1%左右),这样就
会产生溶剂峰;除了残存的质子峰外,溶剂中有时会有微量的
H2O 而产生水峰,而且这个
H2O 峰的位置也会因溶剂的不同而不同;另外,在样品(或制备过程)中,也难免会残留
一些杂质,在图谱上就会有杂质峰,应注意识别。
不同类型质子的化学位移甲基

而重现的测定,一般采用核磁共振峰间共振频率差异去测定。所以核
磁共振谱峰的位置均以标准物质的共振峰为参比,用相对数值表示化
学位移(Δν, δ)。通常最常采用的参比物质是四甲基硅烷(TMS)。
二、化学位移标准物质和化学位移的表示
四甲基硅烷(TMS)具有以下优点:
1. 硅的电负性(1.9)比碳的电负性(2.5)小,TMS上的氢和碳核 外电子云密度相对较高,产生较大的屏蔽效应,其位置出现于高磁场 处。
1. 共振频率差(Δν,Hz):
v v样品 - v标准 2 B0 标准 - 样品
共振频率差(Δν,Hz)与外磁场强度B0成正比。同一样品的同一磁性核 用不同MHz仪器测得的共振频率差不同。如我们假定一个峰在300 MHz仪器上对于频率为1200 Hz,如果换作600 MHz的仪器,我们 指定的峰将会是2400 Hz的位置。
二、化学位移标准物质和化学位移的表示
2. 化学位移常数(δ 值)
v样品 v标准 v标准
106
v 106 v0
标准 样品 106 1 标准
标准 样品
106
δ 值只取决于测定核与标准物质参比核间的屏蔽常数差,即反映原子 核所处的化学环境,而与外磁场强度无关。如在300 MHz仪器上的 化学位移为1200 Hz/300 MHz = 4,在600 MHz的仪器上化学位 移为2400 Hz/600 MHz = 4。
共轭取代基可使与之共轭结构中的价电子分布发生改变,从而引起质
子的化学位移变化。如醛基(-CHO)与苯环间呈吸电子共轭效应,
使苯环上总的电子云密度减少,苯环上各质子δ 值都大于未取代苯上
质子的δ值。
第三章 核磁共振氢谱2-化学位移

· B0(1-σ) 核的共振频率为: = 2
• 核外电子云密度高,屏蔽作用大(σ 值大),核的 共振吸收向高场(或低频)移动,化学位移减小。 • 核外电子云密度低,屏蔽作用小(σ 值小) ,核的
共振吸收向低场(或高频)移动,化学位移增大。
三、 化学位移的表示方法: 化学位移的差别很小,精确测量十分困难,并因仪器 不同(Bo)而不同,现采用相对数值。
7.78
Ha
6.70
OCH3 Hb
8.58
Ha1 O COCH3
Hb A OCH3 B Ha2 C
8.08
7.94
三、 化学键的各向异性效应 • 各向异性效应:氢核与某功能基因空间位置不同,
受到屏蔽作用不同,导致其化学位移不同。
• 原因:在外磁场的作用下,由电子构成的化学键
会产生一个各向异性的附加磁场,使得某些位置的
(1)屏蔽效应强,共振信号在高场区,绝大多数吸收峰 均出现在它的左边。
(2)结构对称,是一个单峰。 (3)容易回收(b.p低),与样品不反应、不缔合。 低场 9 高场
8 7 6 6 5 4 3 2 1 0 -1 -2 -3
TMS
化学位移用表示,以前也用表示, 与的关系为: = 10 -
第三章 核磁共振氢谱
3.1 核磁共振的基本原理 3.2 核磁共振仪 3.3 化学位移 3.4 影响化学位移的因素 3.5 各类质子的化学位移 3.6 自旋偶合和自旋裂分 3.7 偶合常数与分子结构的关系 3.8 常见的自旋系统 3.9 简化1H NMR谱的实验方法 3.10 核磁共振氢谱解析及应用
3.3 化学位移
5.25是乙烯的化学位移值,Z是取代基对烯氢化学位 移的影响参数(P103,表3.4)。
特征质子的化学位移

特征质子的化学位移由于不同类型的质子化学位移不同,因此化学位移值对于分辨各类质子是重要的,而确定质子类型对于阐明分子结构是十分有意义的。
下表列出了一些特征质子的化学位移,表中黑体字的H是要研究的质子。
特征质子的化学位移质子的类型化学位移质子的类型化学位移RCH30.9ArOH4.5-4.7(分子内缔合10.5~16)R2CH21.3R3CH1.5R2C=CR—OH15~19(分子内缔合)0.22RCH2OH3.4~4R2C=CH24.5~5.9ROCH33.5~4R2C=CRH5.3RCHO9~10R2C=CR—CH31.7RCOCR2—H2~2.7RC≡CH7~3.5HCR2COOH2~2.6ArCR2—H2.2~3R2CHCOOR2~2.2RCH2F4~4.5RCOOCH33.7~4RCH2Cl3~4RC≡CCOCH32~3RCH2Br3.5~4RNH2或R2NH0.5~5(峰不尖锐,常呈馒头形)RCH2I3.2~4ROH0.5~5.5(温度、溶剂、浓度改变时影响很大)RCONRH或ArCONRH5~9.4[1]烷烃甲烷氢的化学位移值为0.23,其它开链烷烃中,一级质子在高场δ≈9处出现,二级质子移向低场在δ≈1.33处出现,三级质子移向更低场在δ≈1.5处出现。
例如:烷烃CH4CH3—CH3CH3—CH2—CH3(CH3)3CHδ0.230.860.860.911.330.910.861.50甲基峰一般具有比较明显的特征,亚甲基峰和次甲基峰没有明显的特征,而且常呈很复杂的峰形,不易辨认。
当分子中引人其它官能团后,甲基、次甲基及亚甲基的化学位移会发生变化,但其δ值极少超出0.7~4-5这一范围。
环己烷的各向异性屏蔽效应[1]环烷烃能以不同构象形式存在,未被取代的环烷烃处在一确定的构象中时,由于碳碳单键的各向异性屏蔽作用,不同氢的δ值略有差异。
例如,在环己烷的椅型构象中,由于C-I上的平伏键氢处于C⑵—C⑶键及C⑸—C⑹键的去屏蔽区,而C-I上的直立键氢不处在去屏蔽区,(图环己烷的各向异性屏蔽效应)。
