废水中总铬含量的测定
总铬的测定报告

总铬的测定报告1. 引言总铬是指水中存在的六价铬(Cr(VI))和三价铬(Cr(III))的总和。
铬是一种重要的金属元素,在工业生产过程中广泛使用,但过量的铬对环境和人体健康造成严重威胁。
因此,准确测定水中总铬的含量对于环境保护和健康评估非常重要。
本报告将介绍一种测定水样中总铬含量的方法。
2. 实验方法2.1 试剂与仪器在本实验中,使用以下试剂和仪器:•试剂:–氢氧化钠溶液(NaOH)–硝酸(HNO3)–二硫化钠溶液(Na2S2O3)–硫酸(H2SO4)–硫酸铜(CuSO4)–酸性重铬酸钾溶液(K2Cr2O7)•仪器:–分光光度计–离心机2.2 实验步骤1.取一定体积的水样,并将其转移至离心管中。
2.加入适量氢氧化钠溶液调节水样的pH值。
3.加入适量硝酸溶液进行酸化处理。
4.加入硫酸铜溶液作为还原剂,还原水样中的六价铬为三价铬。
5.加入适量酸性重铬酸钾溶液,将三价铬氧化为六价铬。
6.加入二硫化钠溶液,使六价铬与二硫化钠反应生成可测定的Cr(III)-S络合物。
7.使用离心机离心分离沉淀物。
8.将上清液转移到离心管中,用分光光度计测定其吸光度。
9.通过比对标准曲线,根据吸光度确定水样中总铬的浓度。
3. 数据分析将不同浓度的标准铬溶液进行测定,得到吸光度与浓度的线性关系曲线。
然后,使用该标准曲线对实验样品的吸光度进行测定,计算出总铬的浓度。
4. 结果与讨论通过实验测定,得到样品的吸光度为0.234。
根据标准曲线,可以计算出样品中总铬的浓度为0.125 mg/L。
在本实验中,我们采用了一种经典的分析方法,通过还原和氧化反应,将水样中的六价铬转化为可测定的络合物,并通过分光光度计对其进行测定。
该方法简单、准确、灵敏,适用于水质监测和环境评估。
然而,需要注意的是,本方法只适用于水样中总铬浓度较低的情况。
对于高浓度的样品,可能需要进行稀释处理,以保证测定结果的准确性。
5. 结论本实验使用经典的分析方法测定了水样中总铬的含量,得出样品中总铬浓度为0.125 mg/L。
水样中总铬含量的测定

水样中总铬含量的测定一、背景介绍水是生命之源,对于人类的健康和环境的保护至关重要。
然而,水中的污染物质可能对人体和生态系统造成严重危害。
其中,重金属污染是一种常见且严重的问题。
而铬是一种重要的工业金属,广泛应用于许多行业中。
但是,过量的铬排放和污染会对水体造成不可逆转的影响。
因此,准确测定水样中的总铬含量对于环境保护和人类健康具有重要意义。
二、总铬的测定方法1. 分光光度法分光光度法是一种常用的测定总铬含量的方法。
该方法通过测量溶液中吸收或透射光的强度来确定物质的浓度。
在测定总铬含量时,可以选择合适的波长和试剂,如二酮试剂或酸性高铁试剂,与溶液中的总铬形成显色反应,再利用光度计测定吸光度,从而计算出总铬的浓度。
2. 原子吸收光谱法原子吸收光谱法是一种高灵敏度和高选择性的测定方法。
该方法通过将水样中的总铬转化为气态铬原子,并利用原子吸收光谱仪测定其吸收光谱,从而得到总铬的浓度。
这种方法的优点是准确度高,能够同时测定多种金属元素,但操作复杂且设备要求较高。
三、样品采集与预处理在进行总铬的测定之前,需要进行样品的采集和预处理。
样品的采集应遵循科学合理的方法,并注意避免样品的二次污染。
在采集过程中,可以选择不同的采样容器和采样点,以保证样品的代表性。
对于不同类型的水样,如地下水、地表水或废水,还需要进行不同的预处理方法,如过滤、酸化、沉淀等,以去除干扰物质,保证测定结果的准确性。
四、质控与标准曲线建立在进行总铬的测定过程中,需要进行质控和标准曲线的建立,以确保测定结果的准确性和可靠性。
质控样品可以是标准参考物质或人工合成的样品,通过与已知浓度的样品进行比对,评估测定的准确度和精密度。
标准曲线的建立是通过测定一系列已知浓度的标准溶液,绘制出浓度与吸光度之间的线性关系曲线,从而根据待测样品的吸光度,推算出其总铬的浓度。
五、测定结果的解释与评价根据测定结果,对水样中总铬含量进行解释和评价。
可以根据国家和地区的相关标准或限值要求,判断样品是否符合环境保护和健康安全的要求。
水质-总铬的测定

水质总铬的测定第一篇高锰酸钾氧化——二苯碳酰二肼分光光度法l 范围1.1 本方法适用于地面水和工业废水中总铬的测定1.2 测定范围试份体积为 50mL,使用光程长为30mm 的比色皿,μg 铬,最低检出浓度为,使用光程为10mm 的比色皿,。
1.3 干扰铁含量大于 1mg/L 显黄色,六价钼和汞也和显色剂反应,生成有色化合物,但在本方法的显色酸度下,反应不灵敏,钼和汞的浓度达200mg/L 不干扰测定。
钒有干扰,其含量高于4mg/L 时即干扰显色。
但钒与显色剂反应后10min ,可自行褪色。
2 原理总铬的测定是将三价铬氧化成六价铬后,用二苯碳酰二肪分光光度法测定。
当铬含量高时(大于1mg/L) 也可采用硫酸亚铁铵滴定法。
在酸性溶液中,试样的三价铬被高锰酸钾氧化成六价铬。
六价铬与二苯碳酰二肼反应生成紫红色化合物,于波长540nm 处进行分光光度测定。
过量的高锰酸钾用亚硝酸钠分解,而过量的亚硝酸钠又被尿素分解。
3 试剂测定过程中,除非另有说明,均使用符合国家标准或专业标准的分析纯试剂和蒸馏水,或同等纯度的水所有试剂应不含铬。
3.1 丙酮(C3H6 O)。
3.2 硫酸(H2SO4,ñ=1.84g/mL 优级纯)。
3.2.1 1+l 硫酸溶液。
将硫酸 3.2 缓缓加入到同体积的水中,混匀。
3.3 磷酸 1+1 溶液将磷酸(H3PO4,ñ=1.69g/mL)与水等体积混合。
3.4 硝酸(HNO3,ñ 1.42g/mL)。
3.5 氯仿(CHCl3)。
3.6 高锰酸钾40g/L 溶液称取高锰酸钾(KMnO4)4g 在加热和搅拌下溶于水最后稀释至100mL。
3.7 尿素200g/L 溶液称取尿素[(NH2)2CO]20g 镕于水并稀释至100mL。
3.8 亚硝酸纳20g/L 溶液称取亚硝酸钠(NaNO2)2g 溶于水并稀释至100mL 3.9 氢氧化铵1+1 溶液氨水(NH3·H2O,ñ=0.90g/mL)与等体积水混合。
火焰原子吸收分光光度法测定工业废水中总铬

火焰原子吸收分光光度法测定工业废水中的总铬摘要:含铬工业废水会给人们的生存环境和人体健康造成严重威胁。
因此,如何测定工业废水中的铬就引起了社会的广泛关注。
本文采用火焰原子吸收分光光度法测定工业废水中的总铬,分析不同条件对测定结果的影响,并得出了一些有益的结论,为总铬的测定提供参考。
关键词:火焰原子吸收分光光度法;工业废水;总铬;影响中图分类号:[f287.2] 文献标识码:a 文章编号:铬是环境中主要污染物,其化合物主要以cr(ⅱ)、cr(ⅲ)和cr(ⅵ)的形式存在,但以cr(ⅲ)和cr(ⅵ)的化合物最为常见,其毒性则以cr(ⅵ)最强。
有研究证明了cr(ⅲ)和cr(ⅵ)还原的可能性,铬的氧化状态在水中可能发生变化,因此,近年来倾向于铬的含量来规定水质标准。
本文就介绍使用火焰原子吸收分光光度法测定工业废水总铬。
1 材料与方法1.1 仪器原子吸收分光光度计,铬空心阴极灯;超纯水机。
分析时除另有说明的,其它均使用符合国家标准的分析纯化学试剂,实验用水为新制备的去离子水。
1.2试剂盐酸(hcl):p =1.19g/ml,优级纯;盐酸溶液,1+1;硝酸(hno3):p =1.42g/ml,优级纯;硝酸溶液,1+3;过氧化氢(ho):30%,优级纯;氯化铵水溶液,10%:准确称取10.00g氯化铵(nh4cl),置于小烧杯中用少量水溶解,然后全量转移到100ml容量瓶中,用水定容至标线,摇匀;铬标准贮备液,1000mg/l:冰箱中2~4℃保存;铬标准使用液,50mg/l:准确移取铬标准贮备液5ml至100ml容量瓶中,加入盐酸溶液10ml,用水稀释至标线,摇匀。
用时现配。
1.3 方法原理将试样喷入火焰,在空气-乙炔富燃火焰中形成的铬基态原子对357.9nm产生吸收。
在一定条件下,吸光度与试液中铬的浓度成正比。
1.4 配制工作曲线准确移取铬标准使用液0.00,0.50,1.00,2.00,3.00,4.00ml 于50ml容量瓶中,分别加入2.5mlnh4c1溶液和5.0ml盐酸溶液,用水定容至标线,摇匀,配制成铬含量为0,0.5,1.0,2.0,3.0,4.0mg/l的标准溶液系列。
实验一、二苯碳酰二肼比色法测定总铬——GB7466-87

实验一、高锰酸钾氧化-二苯碳酰二肼比色法测定总铬(GB7466-87)1、方法适用范围:地表水和工业废水。
2、分析原理:在酸性溶液中,三价铬被高锰酸钾氧化为六价铬,六价铬与二苯碳酰二肼反应生成紫红色化合物,可在一定条件下比色测定。
3、采样:于采样现场随机采取水样,装入玻璃瓶或塑料瓶中,加入6mol/L氢氧化钠溶液数滴,至pH=8~9,带回实验室后处理。
4、样品预处理:需要分别对蒸馏水(空白试验)和水样进行预处理。
(1)一般地面水可以直接用高锰酸钾氧化后比色测定;(2)样品中含有大量有机物时,采用硝酸-硫酸消解:取50.00ml水样于150ml锥形瓶中,加入5ml浓硝酸和3ml(1+1)硫酸,加入几粒玻璃珠,盖上表面皿,于电热板上加热蒸发至冒白烟,如溶液仍有色,可补加5ml浓硝酸,继续加热至溶液澄清,冷却。
(3)另取50.00ml的蒸馏水进行同样的操作。
5、高锰酸钾氧化:将上述溶液加水稀释至150ml,用(1+1)氨水和(1+1)硫酸调节p H至6~8,加入0.5ml(1+1)硫酸、0.5ml(1+1)磷酸,摇匀,加入4%的高锰酸钾溶液2滴,如溶液褪色,则再滴入高锰酸钾溶液2滴,保持溶液紫红色,加热煮沸至体积约为20ml,取下冷却,加入1ml20%的尿素溶液,摇匀,用滴管滴加2%的亚硝酸钠溶液,每加一滴充分摇匀,至高锰酸钾紫红色恰好褪去,稍停片刻,待溶液中气泡逸出,定量转移入50ml比色管中,定容,供测定。
6、标准曲线制作:分取5.00mg/L的六价铬的标准溶液0.00,0.20,0.50,1.00,2.00,4.00,8.00,10.00ml于50ml的比色管中,加水稀释至50ml,分别加入2ml的显色剂,摇匀,放置10min后,于540nm的波长处,以1cm比色皿,以水做参比,测定吸光度。
7、样品测定:样品溶液也与制作标准曲线相同的操作,加入显色剂,放置10min后,比色测定。
8、数据处理:(1)数据列表:方程和相关系数。
废水中总铬的测定

废水中总铬的测定摘要:采用硝酸-高氯酸消解法对样品进行消解,消解后加入氯化铵以克服共存元素的干扰,试液经过滤、定容后吸入空气-乙炔火焰中,铬的化合物被原子化,在波长357.9nm处进行定量测定。
关键词:原子吸收分光光度法;测定;废水;铬Abstract: using nitric acid-high chlorine acid digestion to sample decomposition, add resolution to overcome the elements coexist ammonium chloride interference, try filtered liquid, after the capacity of flame-inhaled air acetylene, chromium compounds are atoms, melt in the wavelength 357.9 nm place quantitatively determined.Keywords: atomic absorption spectrophotometry; Determination; Wastewater; chromium1引言目前测定总铬的主要方法是氧化-二苯碳酰二肼分光光度法,该法在测定清洁的地面水时,具有灵敏度高、检出浓度低等优点,但当样品中含有大量杂质及有机物时,二苯碳酰二肼分光光度法需要的前处理步骤较多,而且标准系列需作同样操作,操作繁复,另处在“铜铁试剂-氯仿萃取除去钼、钒、铁、铜”该步骤操作复杂,试样容易受污染或损失。
而采用火焰原子吸收分光光度法测定总铬,具有抗干扰能力强、操作简单等优点,但对于火焰原子吸收分光光度法测定总铬的具体操作及准确度,许多参考文献没有详细阐明,在此探讨该方法的精密度和准确度。
当样品含有大量有机物时需要消解,对于测定总铬,样品的消解处理方法主要有[3]:硝酸-硫酸消解、硝酸-高氯酸消解、干法灰化消解法,前者由于含有硫酸,因为硫酸会在火焰中产生分子吸收,因此在火焰原子吸收法中一般不采用硫酸进行消解,而后者由于标准系列需作同样操作,操作较多繁复,据此选择硝酸-高氯酸法进行消解。
总铬的测定

TPV Company Confidential 2004
4
设 备 4.1 4.2 4.3 分光光度计 电热板。 酸度计或PH试纸。
5
分析步骤 5.1 采样与样品的保存
实验室样品应该用玻璃瓶采集。采集时,加 入硝酸调节样品PH值小于2,在采集后尽快 测定,若要放置,不得超过24h。
TPV Company Confidential 2004
• • • •
3.6 亚硝酸钠:20g/L溶液。 3.7 铬标准储备液:0.1000g/mL。 3.8 铬标准使用液:1mg/L。 3.9 显色剂:二苯碳酰二肼(DPC),2g/L丙酮溶 液。 称取二苯碳酰二肼0.2g,溶于50mL丙酮 中,加水稀释至100mL,摇匀。贮于棕色 瓶中,置冰箱中。色变深后不能使用。
TPV Company Confidential 2004
5.3 显色 在比色管中的试液加入2mL显色剂,摇匀。10min后,以 水做参比测定吸光度。
5.4 校准溶液 向一系列150mL锥形瓶中分别吸入0.00,0.20,0.50, 1.00,2.00,4.00,6.00,8.00,和10.00 mL 铬标准使用 溶液,用水稀释50mL。之后按照测定式样的步骤进行测 定
绘制吸光度的曲线。
TPV Company Confidential 2004
5.5
结果计算
m V
总铬含量c1=
m:校准曲线上查得的试份中铬含量,μg V:试份的体积,mL 通过计算得出总铬含量
TPV Company Confidential 2004
The end
谢观赏
TPV Company Confidential 2004
总铬的测定 (二苯碳酰二肼分光光度法)
工业废水中总铬的测定

高锰酸钾氧化-二苯碳酰二肼分光光度法与原子吸收分光光度法测定工业废水中总铬含量一、实验目的(1)进一步熟悉分光光度计与原子吸收分光光度计的基本结构及使用。
(2)掌握分光光度法与原子吸收分光光度法测定工业废水水中总铬含量的原理及方法。
(3)对两种方法的特点、优劣与适用性进行比较。
二、实验原理本实验采用高锰酸钾氧化—二苯碳酰二肼分光光度法检测工业废水中总铬含量、火焰原子吸收分光光度法检验。
分光光度法是通过测定被测物质在特定波长处的吸光度,对该物质进行定性与定量分析的一种方法。
总铬的测定是将三价铬氧化成六价铬后,在酸性溶液中,试样的三价铬被高锰酸钾氧化成六价铬,六价铬与二苯碳酰二肼反应生成紫红色化合物于波长540nm 处进行分光光度测定。
过量的高锰酸钾用亚硝酸钠分解,而过量的亚硝酸钠又被尿素分解。
(1)HNO3-H2SO4消解有机物C→CO2 H→H2O N→NH3(2)Cr3+→Cr6+MnO4-+8H++5e-→Mn2++4H2OCr2O72-+14H++6e-→2Cr3++7H2O10Cr3+ +6MnO4-+11 H2O→5Cr2O72-+6 Mn2++22H+(3)除去过量的KMnO4MnO4-+8H++5e-→Mn2++4H2ONO3-+3H++2e-→NO2 -+H2O2MnO4- +5NO2 -+6H+ →5NO3- +2Mn2++2H2O(4)分解剩余的NaNO22NO2- +CO(NH2)2 +2H+→CO2+2N2+3H2O原子吸收分光光度法是基于物质所产生的原子蒸气对待测元素的特征谱线的吸收作用进行定量分析的一种方法。
溶液中的铬离子在火焰温度下转变为基态铬原子蒸气,对357.9 nm的光辐射产生吸收。
在一定条件下,吸光度与试液中总铬的浓度成正比。
三、实验仪器及试剂仪器:岛津AA-6800原子吸收分光光度计;铬空心阴极灯;无油空气压缩机;乙炔钢瓶;通风设备。
分光光度计;比色皿;50mL容量瓶;移液管;吸量管;烧杯;加热装置。
废铬液中铬含量的测定110524

ΔE03 > ΔE02 > ΔE01
Cr6+ H
+
Cr3+
H2O2
Cr2O72- + 8H+ + 3H2O2 ═ 2Cr3+ + 3O2 + 7H2O
Cr3+ + EDTA
Cr —— EDTA
原理总结
废铬液经过浓硝酸、浓硫酸消解后, 在酸性条件下用H2O2将Cr6+还原为Cr3+,
pH为5时,在煮沸条件下,Cr3+与EDTA
一、测定原理
消解→还原→配位反应→比色
(1)HNO3-H2SO4消解有机物
有机物:C → CO2 ↑ H → H2O↑ N → NO2 ↑
(2)Cr6+
H2O2 H+
Cr3+
Cr2O72- + 14H+ + 6e ═ 2Cr3+ + 7H2O
E0=1.33V
H2O2 +2H+ + 2e ═ 2H2O
2 3
m — 标准曲线上查出的Cr2O3,g;
V — 吸取分析液的体积, ml
n — 稀释倍数;
六、注意及讨论
1.Cr3+与EDTA络合条件 2.H2O2要除尽
3.Na2CO3溶液中和要小心
4.废液的稀释倍数的确定
5.铬酸钠比色法和EDTA比色法的原理不同
2CrO42- + 2H+ Cr2O72-+ 2H2O
2Na2CrO4 + H2SO4 = Na2Cr2O7 + Na2SO4 +H2O
Na2Cr2O7 + 2NaOH = 2Na2CrO4 + H2O
废水总铬含量检测安全操作及保养规程

废水总铬含量检测安全操作及保养规程废水总铬含量检测是环保监测中必不可少的一部分,正确的安全操作和保养规程能够确保检测数据准确、操作安全。
以下是废水总铬含量检测的安全操作及保养规程。
安全操作1. 应按照检测方法进行检测废水总铬含量检测的方法有多种,根据不同的检测方法,操作步骤和检测要求略有不同。
在进行检测过程中,应仔细阅读检测方法,按照要求进行检测,确保检测数据准确可靠。
2. 应做好个人防护废水中含有各种有害物质,因此在进行废水总铬含量检测时,应做好个人防护。
戴上手套、口罩、防护眼镜等防护用品,避免接触废水。
3. 应标注废水样品信息在进行废水总铬含量检测时,应标注每个废水样品的检测时间、地点、采集人员等信息,以便后续数据对比和分析。
4. 应保证实验室干净卫生废水总铬含量检测一般在实验室进行,因此实验室的干净卫生和整洁程度会直接影响检测数据的准确性。
在进行废水总铬含量检测前,应做好实验室的清洁和消毒工作。
5. 废水样品处理后,应正确处置废液和废液残渣废水样品处理后会产生废液和废液残渣,这些废液和废液残渣应按照环境保护要求正确处置,避免对环境造成污染。
保养规程1. 应保证仪器设备的完好废水总铬含量检测需要使用到各种仪器设备,如分光光度计、原子吸收光谱等。
在使用这些设备前,应仔细检查设备的完好程度,确保设备正常工作,避免对检测数据产生影响。
2. 应定期维护和保养仪器设备为确保仪器设备的正常工作,应定期进行维护和保养。
定期检查设备的性能指标、部件耐磨损情况以及接线是否松动等,及时发现和处理设备问题,保证设备正常工作。
3. 应按要求储存试剂和标准品废水总铬含量检测需要使用各种试剂和标准品,这些物品的质量直接影响检测数据的准确性。
因此,在使用这些物品前,应仔细阅读说明书并按要求储存,避免受到外界因素影响。
4. 应定期清洁和消毒实验室实验室的干净程度会直接影响检测数据的准确性。
因此,应定期清洁和消毒实验室,确保实验室干净卫生。
资料:01 水中铬的测定步骤(六价和总量铬)

实验五水中铬的测定废水中铬的测定常用分光光度法,是在酸性溶液中,六价铬离子与二苯碳酰二肼反应,生成紫红色化合物,其最大吸收波长为540nm,吸光度与浓度的关系符合比尔定律。
如果测定总铬,需先用高锰酸钾将水样中的三价铬氧化为六价,再用本法测定。
一、实验目的和要求1、掌握六价铬和总铬的测定方法;熟练应用分光光度计。
2、预习第二章第六节关于水和废水中金属化合物的测定原理和方法。
二、六价铬的测定(一)、仪器1.分光光度计,比色皿(1cm、3cm)。
2.50mL具塞比色管,移液管,容量瓶等。
(二)、试剂1.丙酮。
2.(1+1)硫酸。
3.(1+1)磷酸。
4.0.2%(m/V)氢氧化钠溶液。
5.氢氧化锌共沉淀剂:称取硫酸锌(ZnSO4·7H2O)8g,溶于100mL水中;称取氢氧化钠2.4g,溶于120mL水中。
将以上两溶液混合。
6.4%(m/V)高锰酸钾溶液。
7.铬标准贮备液:称取于120℃干燥2h的重铬酸钾(优级纯)0.2829g,用水溶解,移入1000mL容量瓶中,用水稀释至标线,摇匀。
每毫升贮备液含0.100μg 六价铬。
8.铬标准使用液:吸取5.00mL铬标准贮备液于500mL容量瓶中,用水稀释至标线,摇匀。
每毫升标准使用液含1.00μg六价铬。
使用当天配制。
9.20%(m/V)尿素溶液。
10.2%(m/V)亚硝酸钠溶液。
11.二苯碳酰二肼溶液:称取二苯碳酰二肼(简称DPC,C13H14N4O)0.2g,溶于50mL丙酮中,加水稀释至100mL,摇匀,贮于棕色瓶内,置于冰箱中保存。
颜色变深后不能再用。
(三)、测定步骤1.水样预处理(1)对不含悬浮物、低色度的清洁地面水,可直接进行测定。
(2)如果水样有色但不深,可进行色度校正。
即另取一份试样,加入除显色剂以外的各种试剂,以2mL丙酮代替显色剂,用此溶液为测定试样溶液吸光度的参比溶液。
(3)对浑浊、色度较深的水样,应加入氢氧化锌共沉淀剂并进行过滤处理。
总铬、六价铬的测定

总铬、六价铬的测定水中总铬及六价铬的测定-22-铬(Cr)的化合物常见的价态有三价和六价。
在水体中,六价铬一般以CrO、 CrO、427-HCrO三种阴离子形式存在,受水中PH值、有机物、氧化还原物质、温度、及硬度等条件4影响,三价铬和六价铬的化合物可以互相转化。
铬是生物体所必需的微量元素之一。
铬的毒性与其存在价态有关,通常认为六价铬的毒性比三价铬高100倍,六价铬更易为人体吸收且在体内蓄积,导致肝癌。
因此我国已把六价铬规定为实施总量控制的指标之一。
铬的污染来源主要是含铬矿石的加工、金属表面处理、皮革鞣制、印染等行业。
铬的测定可采用二苯碳酰二肼分光光度法、原子吸收分光光度法、等离子发射光谱法和滴定法。
清洁的水样可直接用二苯碳酰二肼分光光度法测六价铬。
如测总铬,用高锰酸钾将三价铬氧化成六价铬,再用二苯碳酰二肼分光光度法测定。
水样含铬量较高时,用硫酸亚铁铵滴定法。
水样应用瓶壁光洁的玻璃瓶采集。
如测总铬,水样采集后,加入硝酸调节PH值小于2;如测六价铬,水样采集后,加氢氧化钠调节PH约为8,保存不得超过24小时。
一、实验目的1了解水体中铬的形态分布及各形态之间的相互转化;2掌握二苯碳酰二肼分光光度法测定铬的原理和方法。
二、实验原理在酸性条件下,六价铬可与二苯碳酰二肼反应,生成紫红色配合物,该化合物最大吸收4波长为540nm,摩尔吸光系数为4×10L/(mol?cm)。
含铁量大于1mg/L的水样显黄色,六价钼和汞也和显色剂反应生成有色化合物,但在本方法的显色酸度下反应不灵敏。
钒有干扰,其含量高于4mg/L时干扰测定,但钒与显色剂反-2+2-2-应10min可自行褪色。
氧化性及还原性物质,如ClO、Fe、SO、SO等,水样有色或23混浊时,对测定有干扰,需进行预处理。
三、实验仪器50ml具塞比色管;分光光度计;电炉,锥形瓶等所用玻璃器皿要求内壁光滑,不能用铬酸洗液洗涤,可用合成洗涤剂洗涤后再用浓硝酸洗涤,然后依次用自来水、蒸馏水淋洗干净。
碱性过硫酸钾法测定废水中的总铬

碱性过硫酸钾法测定废水中的总铬摘要本文主要研究的是废水中处理总铬的改进方法,国家标准方法采用高锰酸作为氧化剂,过量的高锰酸钾用亚硝酸还原,而过量的亚硝酸钠又被尿素分解,操作过程繁琐。
本文是研究用碱性过硫酸钾代替高锰酸钾作为氧化剂测定废水中总铬的改进方法,减少将三价铬氧化成六价铬的操作步骤。
通过实验得出碱性过硫酸钾法测定水中总铬的条件以及可行性。
关键词总铬;碱性过硫酸钾;二苯基碳酰二肼;分光光度法Alkaline potassium persulfate method for the determination of total chromium in wastewaterAbstractThis paper mainly studied the wastewater handling of total chromium improved method national standard method using potassium permanganate as an oxidizing agent, an excess of potassium permanganate with nitrite reduction, the excess sodium nitrite was the decomposition of urea, the procedure is cumbersome. This article is a study with alkaline potassium persulfate instead of potassium permanganate the wastewater oxidant determination of total chromium in the improved method of reducing the oxidation of trivalent chromium hexavalent chromium steps. Obtained by experiment alkaline persulfate total chromium determination in water conditions, and feasibility.Key words total chromium, alkaline potassium persulfate, diphenyl two hydrazine, spectrophotometry目录1 绪论 (5)1.1 本课题研究的意义 (5)1.2 水中总铬的污染现状与危害 (6)1.3 现有水中总铬的测定的主要方法 (6)1.3.1 高锰酸钾氧化法 (6)1.3.2 石墨炉---原子吸收光谱法 (6)1.3.3 火焰原子吸收分光光度法 (6)1.4 本文研究的内容 (6)1.5相关标准 (7)2 实验部分 (7)2.1 仪器和试剂 (7)2.1.1 仪器 (7)2.1.2 试剂 (7)2.2 实验原理 (8)2.2.1 二苯基碳酰二肼显色原理 (8)2.2.2碱性过硫酸钾氧化法测定废水中总铬的原理 (9)2.3实验内容和方法 (9)2.3.1 试剂的配置 (9)2.3.2试验方法 (9)3 结果与讨论 (10)3.1 六价铬显色最佳条件 (10)3.1.1 吸收曲线 (10)3.1.2 显色剂用量 (12)3.1.3 六价铬显色完全时间 (12)3.2 碱性过硫酸钾氧化三价铬测定中最佳条件的选择 (13)3.2.1 氧化剂用量的确定 (13)3.2.2 加热时间的确定 (14)3.3碱性过硫酸钾与碱性过硫酸钾对三价铬氧化效率的比较. (15)3.4 碱性过硫酸钾与加热对六价铬显色的影响 (16)3.4.1 加热对六价铬的影响 (16)3.4.2 碱性过硫酸钾在不同加热时间的六价铬吸光度影响 (16)3.4.3碱性过硫酸钾对六价铬的影响 (17)3.5 碱性过硫酸钾氧化三价铬重现性 (17)3.6 标准曲线的绘制 (18)3.6.1 六价铬标准曲线的绘制 (18)3.6.2 三价铬的标准曲线 (19)3.7国家标准法测定水质的总铬 (20)3.7.1 原理 (20)3.7.2 仪器与试剂 (20)3.7.3 国标法绘制标准曲线 (21)3.8 水样测定的对照实验 (22)3.8.1 国家标准方法测定水样 (22)3.8.2 碱性过硫酸钾氧化法测定水样 (22)3.8.3 加标回收率 (23)结论 (23)致谢 (25)参考文献 (26)1 绪论1.1 本课题研究的意义重金属污染指由重金属或其化合物造成的环境污染。
工业废水中总铬的测定

工业废水中总铬的测定作者:周红蝶来源:《绿色科技》2017年第18期摘要:用火焰原子吸收光谱法测定了工业废水中的铬,结果表明:当选择合适实验条件的情况下,测定的灵敏度较高,精确度较好,应用该方法可以有效地测定工业废水中的铬。
关键词:火焰原子吸收光谱法;工业废水;铬;精确度中图分类号:X703文献标识码:A文章编号:16749944(2017)180107031引言铬是生物体所必需的微量元素之一。
铬(Cr)的化合物常见的价态有三价和六价。
在水体中,六价铬一般以CrO2-4、CrO2-7、HcrO-4三种阴离子形式存在,受水中pH值、有机物、氧化还原物、温度及硬度等条件影响,三价铬和六价铬的化合物可以相互转化。
铬的毒性与其存在价态有关,通常认为六价铬的毒性比三价铬高100倍,六价铬更易为人体吸收而且在体内蓄积,导致肝癌。
铬的污染来源主要是含铬矿石的加工、金属表面处理、皮革鞣制、印染等行业。
本文用火焰原子吸收光谱法测定工业废水中的铬,选择最佳的仪器条件,得出的结果令人满意。
该方法的校准曲线相关系数均大于0.999,灵敏度较高,操作简单、快速,精确度较好。
2实验部分2.1仪器与工作条件美国PerkinElmer公司AA400型原子吸收分光光度计;美国PerkinElmer公司的铬空心阴极灯;恒温电加热板。
依据仪器说明书和文献资料,经过试验对仪器操作条件进行了优化选择。
参考工作条件如下表1。
氯化铵水溶液,10%:准确称取10.00g氯化铵(NH4Cl),置于小烧杯中用少量水溶解,然后全量转移到100 mL容量瓶中,用水定容至标线,摇匀。
铬标准贮备液,1000 mg/L:准确称取于120℃烘干2 h并恒重的基准重铬酸钾0.2819 g,精确至±0.0001 g,置于小烧杯中用水溶解,然后全量转移到100 mL容量瓶中,加入盐酸溶液(1+1)10 mL,用水稀释至标线,摇匀。
铬标准使用液,50 mg/L:准确移取铬标准贮备液5 mL至1000 mL容量瓶中,加入盐酸溶液(1+1)10 mL,用水稀释至标线,摇匀。
总铬的测定

实验室内相对标准偏差为 1.1
8.2 再现性
实验空间总相对标准偏差为 1.4
8.3 准确度
相对误差为-0.75
第二篇 硫酸亚铁铵滴定法
1 范围 本方法适用于水和废水中高浓度(大于 1mg/L)总铬的测定
2 原理 在酸性溶液中 以银盐作催化剂 用过硫酸铵将三价格氧化成六价铬 加入少量氯化纳
1.3 干扰
铁含量大于 1mg/L 显黄色 六价钼和汞也和显色剂反应 生成有色化合物 但在本方法
的显色酸度下 反应不灵敏 钼和汞的浓度达 200mg/L 不干扰测定 钒有干扰 其含量高于
4mg/L 时即干扰显色 但钒与显色剂反应后 10min 可自行褪色 2 原理
总铬的测定是将三价铬氧化成六价铬后 用二苯碳酰二肪分光光度法测定 当铬含量高
1
3.12 铬标准溶液 1mg/L 吸取 5.00mL 铬标准贮备液(3.11)置于 500mL 容量瓶中 用水稀释至标线 摇匀 此溶液
1mL 含 1.00ìg 铬 使用当天配制 3.13 铬标准溶液 5.00mg/L
吸取 25.00mL 铬标准贮备液(3.11) 置于 500mL 容量瓶中 用水稀释至标线 摇匀 此 溶液 1mL 含 5.00ìg 铬 使用当天配制 3.14 显色剂 二苯碳酰二肼 2g/L 丙酮溶液
铬标准溶液(3.12 或 3.13) 用水稀释至 50mL 然后按照测定试样的步骤(6.1 6.2 6.3)进行
处理
从测得的吸光度减去空白试验的吸光度后 绘制以含铬量对吸光度的曲线
7 结果计算
总铬含量 c1(mg/L)按式(1)计算
c1
=
m ………………………………………………………… V
3.6 硫酸亚铁铵溶液
原子吸收光谱法测定工业废水中总铬的含量

原子吸收光谱法测定工业废水中总铬的含量摘要:为了对原子吸收法测定废水中总铬的方法进行优化,文章通过实验研究,以工业废水为水样,对仪器工作条件和操作参数进行了优化,确定了原子吸收法测定工业废水中总铬含量的最佳分析条件,验证了经优化后的方法的准确度和精密度。
关键词:工业废水;原子吸收法;铬含量铬是一种普遍存在的污染物,主要来源于电镀、冶炼、制革、制药及铬矿石的开采等。
目前,在测定废水总铬的方法中,火焰原子吸收法具有灵敏度高、准确度好等优点,是首选方法。
但这种测定方法在测定过程中容易受水样的前处理及仪器最佳操作参数的选择影响,只有做好测定分析过程中操作参数的控制,才能获得准确的测定结果。
1.实验部分1.1 主要仪器与试剂仪器:美国热电iCE3500;北京莱伯泰科微控数显电热板EH45B。
试剂:国家标准样品铬1000mg/mL(国家有色金属及电子材料分析测试中心),介质为H20;Al、As、B、Ba、Be、Bi、Cd、Co、Cr、Cu、Fe、Ga、Li、Mg、Mn、Ni、Pb、Sb、Sn、Sr、Ti、Tl、V、Zn混合液(浓度:100ug/mL,国家有色金属及电子材料分析测试中心),介质为1.5mol/LHN03;超纯水(电阻≥18.2MΩ•cm);优级纯氯化铵;优级纯盐酸;10%氯化铵溶液;3mol/LHCl。
1.2 仪器工作条件为优化测定方法,提高测定结果准确性,仪器选择的工作条件如下:波长357.9nm,灯电流12mA,光谱通带宽0.5nm,燃烧器高度8mm,空气流量5L/min,乙炔流量1.4L/min。
1.3 实验方法1.试样前处理。
将采集的制革废水加人浓HN03进行酸化处理,以保持样品的稳定性。
取50ml水样放人250ml锥形瓶中,加人10ml硝酸,在电热板上加热消解(230℃)。
蒸至10ml左右,加人2mlH202,继续消解,直至1ml左右。
取下冷却,加水溶解残渣,加人10%氯化铵溶液2ml和3mol/LHCl1Oml,定容至50ml。
水样中总铬含量的测定

水样中总铬含量的测定一、引言水是人类生存和发展的重要资源,而水质的好坏直接关系到人类的健康和生活质量。
其中,总铬含量是评价水质的重要指标之一。
总铬是指水中所有形态的铬的总和,包括六价铬和三价铬。
水中的铬主要来源于工业废水排放、农业活动和地下水中的天然铬等。
高浓度的总铬会对水生生物和人类健康造成严重影响,因此,准确测定水样中的总铬含量具有重要意义。
二、测定方法测定水样中总铬含量的方法多种多样,常用的方法包括原子吸收光谱法、电感耦合等离子体发射光谱法和草酸光度法等。
下面将详细介绍其中两种常用的方法。
1. 原子吸收光谱法原子吸收光谱法是一种常用的测定水样中总铬含量的方法。
该方法通过测量铬原子在特定波长下的吸光度来确定总铬的含量。
首先,将水样进行预处理,如调整pH值和过滤等,以去除干扰物质。
然后,使用特定的酸溶液将水样中的总铬转化为可溶性形态,并进行适当稀释。
最后,使用原子吸收光谱仪测量溶液中铬原子的吸光度,根据标准曲线计算出总铬的含量。
2. 电感耦合等离子体发射光谱法电感耦合等离子体发射光谱法是一种灵敏度高、选择性好的测定总铬含量的方法。
该方法利用电感耦合等离子体发射光谱仪测量水样中的总铬含量。
首先,将水样进行预处理,如调整pH值和过滤等。
然后,将水样中的总铬转化为可溶性形态,并进行适当稀释。
最后,将样品注入电感耦合等离子体发射光谱仪中,通过检测特定波长下的发射光谱,计算出总铬的含量。
三、测定原理测定水样中总铬含量的方法都是基于铬化合物的特定性质进行的。
原子吸收光谱法通过测量铬原子在特定波长下的吸光度来确定总铬的含量,利用了铬原子吸收特定波长的特性。
电感耦合等离子体发射光谱法则是通过测量水样中总铬的特定发射光谱来确定铬的含量,利用了铬化合物发射特定波长的特性。
四、注意事项在测定水样中总铬含量时,需要注意以下几点:1. 样品的采集和保存应按照相关标准进行,以保证样品的代表性和稳定性。
2. 仪器的校准和质控应严格执行,以保证测定结果的准确性和可靠性。
废水总铬的测定方法确认报告
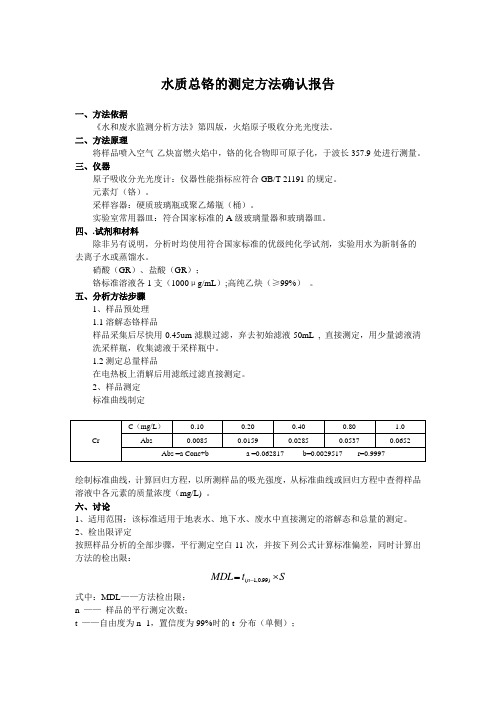
水质总铬的测定方法确认报告一、方法依据《水和废水监测分析方法》第四版,火焰原子吸收分光光度法。
二、方法原理将样品喷入空气-乙炔富燃火焰中,铬的化合物即可原子化,于波长357.9处进行测量。
三、仪器原子吸收分光光度计:仪器性能指标应符合GB/T 21191的规定。
元素灯(铬)。
采样容器:硬质玻璃瓶或聚乙烯瓶(桶)。
实验室常用器皿:符合国家标准的A 级玻璃量器和玻璃器皿。
四、.试剂和材料除非另有说明,分析时均使用符合国家标准的优级纯化学试剂,实验用水为新制备的 去离子水或蒸馏水。
硝酸(GR )、盐酸(GR );铬标准溶液各1支(1000μg/mL );高纯乙炔(≥99%) 。
五、分析方法步骤1、样品预处理 1.1溶解态铬样品样品采集后尽快用0.45um 滤膜过滤,弃去初始滤液50mL , 直接测定,用少量滤液清洗采样瓶,收集滤液于采样瓶中。
1.2测定总量样品在电热板上消解后用滤纸过滤直接测定。
2、样品测定 标准曲线制定绘制标准曲线,计算回归方程,以所测样品的吸光强度,从标准曲线或回归方程中查得样品溶液中各元素的质量浓度(mg/L) 。
六、讨论1、适用范围:该标准适用于地表水、地下水、废水中直接测定的溶解态和总量的测定。
2、检出限评定按照样品分析的全部步骤,平行测定空白11次,并按下列公式计算标准偏差,同时计算出方法的检出限:S t MDL n ⨯=-)99.0,1(式中:MDL ——方法检出限; n —— 样品的平行测定次数;t ——自由度为n -1,置信度为99%时的t 分布(单侧);S——n 次平行测定的标准偏差。
其中,当自由度为n -1=10,置信度为99% 时的t值为2.764。
3、准确度和精密度检测3.2准确度(具体数据附检测记录表)3.3加标回收率(具体数据附检测记录表)对加标回收样进行回收试验结果如下:七、结论通过对以上指标的测试,结果均符合标准方法要求,所得检出限低于方法给定检出限,精密度和准确度的测试均达到标准方法的范围,所以对此方法予以确认。
废水中铬含量的测定

废水中铬的测定实验目的(1)进一步熟悉分光光度计和原子吸收分光光度计的根本构造及使用。
(2)掌握分光光度法和原子吸收分光光度法测定工业废水水中铬含量的原理及方法。
(3)对两种方法的特点、优劣和适用性进展比拟。
分光光度法实验原理1.六价铬的测定:在酸性溶液中六价铬与二苯碳酰二肼反响生成紫红色产物,可用目视比色或分光光度法测定。
2.总铬的测定:水样中的三价铬用高锰酸钾氧化为六价铬,过量的高锰酸钾用亚硝酸钠分解,过剩的亚硝酸钠为尿素所分解,得到的清液用二苯碳酰二肼显色,测定含量。
主要仪器及试材1.主要仪器(1) 紫外可见分光光度计。
(2) 50 ml比色管。
(3) 150 ml锥形瓶2.试剂〔1〕二苯碳酰二肼溶液溶解1.20 g二苯碳酰二肼于100 ml的95%乙醇中,一边搅拌,一边参加400 ml〔1+9〕硫酸,存于冰箱中,可用1个月。
〔2〕〔1+9〕硫酸。
〔3〕铬标准储藏液溶解141.4 mg预先在105-110℃μg六价铬。
μg六价铬,临用配制。
〔5〕〔1+1〕硫酸。
〔6〕〔1+1〕磷酸。
〔7〕4% 高锰酸钾溶液。
〔8〕20% 尿素溶液。
〔9〕2% 亚硝酸钠溶液。
实验方法与步骤1.六价铬的测定〔1〕吸取50.00 ml水样,〔假设浓度太高,移入少许水样,用水稀释至50.00 ml〕,置于50 ml比色管中,如果水样混浊可过滤后测定。
μg /ml〕 0 ml、0.20 ml、0.50 ml、1.00 ml、2.00 ml、4.00 ml、6.00 ml、8.00 ml及10.00 ml,至50 ml比色管中,加水至标线。
〔3〕水样管及标准管中各加2.5 ml二苯碳酰二肼溶液,混匀,放置10 min,目视比色,如用分光光度计,那么于540 nm波长、3 cm比色皿,以试剂空白作参比,测定吸光度。
2.总铬的测定〔1〕取50.00 ml摇匀的水样置于150 ml锥形瓶中,加几粒玻璃珠,调节pH值为7。
μg /ml) 0 ml、0.20 ml、0.50 ml、1.00 ml、2.00 ml、4.00 ml、6.00 ml、8.00 ml及10.00 ml,置于锥形瓶中,加水至体积为50 ml,各参加几粒玻璃珠。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
2.指示原理
[Fe(C12H8N2)3] 3+ + e → Fe(C12H8N2)3] 2+
氧化态
还原态
浅蓝色
深红色
变色过程为
Fe(C12H8N2)3] 2+ 还原态 深红色
Cr2O72H+
Fe(C12H8N2)3] 2+ 还原态 深红色
[3F+ e(C12H8N2)3]
氧化态 浅蓝色
Fe 2+
+
3.褪色
加20%尿素1ml,再滴加0.5% NaNO到红色褪
去为无色,再震荡无气泡
NaNO2除尽
4.显色
转移洗涤到100ml容量瓶中,移取5ml二苯 胺基脲,边加边摇,并定容。
5.比色测OD值
λmax=540nm 比色皿厚度=2cm 0号管调零 平行条件ΔOD≤0.05
6.描点作图
OD
OD
A
标准溶液的ml数
5.比色测OD值
λmax=540nm 比色皿厚度=2cm 0号管调零 平行条件ΔOD≤0.05
五.计算
A×K×1000 总Cr(mg/l)= ——————
V试
A—测定OD值相当的标准溶液的体积(ml); K—标准溶液的浓度 mgCr/ml。
K=0.01mgCr/ml
6.描点作图
OD
OD
A
标准溶液的ml数
3.氧化
加50ml蒸馏水,1∶1 H2SO4 0.5ml (10滴),1∶1H3PO40.5ml(10滴), 加热微沸,加4滴0.5% KMnO4煮沸3分 钟不褪色,取下冷却。
3.褪色
加20%尿素1ml,再滴加0.5% NaNO到红色褪
去为无色,再震荡无气泡
NaNO2除尽
4.显色
转移洗涤到100ml容量瓶中,移取5ml二苯 胺基脲,边加边摇,并定容。
K1·K2 = —————— [H2S]
K1·K2·[H2S] = [S2-][ H+]2
饱和浓度[H2S]=0.1mol/L 而最大[Zn2+ ]=0.1mol/L
而:
Ksp·ZnS
[S2-] ≤ ——————
[Zn2+ ]
则: K1·K2·[H2S]
Ksp·ZnS
———————≤ ——————
(5)加二苯胺基脲显色
NH-NH-C6H5
O=C
+ Cr6+ H+
NH-NH-C6H5
D.P.C
NH-NH-C6H5
O=C
+ Cr3+
N=N-C6H5 (新生态)
苯肼羰基偶氮苯
1,5-二苯基碳酰二肼
(Diphenylcarbazide )
紫红色络合物
原理总结
利用硝酸-硫酸联合消化除去废水中的有机 物,进而在酸性条件下,加入过量的KMnO4 将Cr3+氧化为Cr6+ , 剩余的KMnO4被NaNO2 完全还原成Mn2+ ,剩余的NaNO2再在酸性条 件下被尿素分解成N2和CO2而除去,最后溶液 中仅有的Cr6+与二苯胺基脲反应生成紫红色络 合物,然后在分光光度计上测出其OD值,再 根据标准曲线,计算出总铬含量。
精称K2Cr2O70.1414g溶解洗涤转移定容到
500ml容量瓶中
0.1mgCr/ml
吸取此液10ml→100ml
0.01mgCr/ml
2.氧化
分 别 移 取 0.01mgCr/ml 的 K2Cr2O7 标准溶液0,0.5,1,2,3,4,5ml , 分 别 加 50ml 蒸 馏 水 , 加 1∶1 H2SO4 0.5ml ( 10 滴 ) , 加 1∶1H3PO40.5ml ( 10 滴 ) , 加 热 微 沸 , 加 4 滴 0.5% KMnO4煮沸3分钟不褪色,取下冷却。
六价铬 ≤ 0.5 mg/L
测定方法
Cr3+
KMnO4
Cr6+
H+ or OH-
D.P.C
显色
比色
二、酸性高锰酸钾法测定原理
消解 → 氧化 → 显色 → 比色
(1)HNO3 - H2SO4消解有机物
有机物:C → CO2 ↑ H → H2O(水汽)↑ N → NH3 ↑
(2)Cr3+ KMnO4 Cr6+ H+
2×V水样
六、讨论
1.取样 2.陈化 3.洗涤、过滤 4.捣碎滤纸 5.空白实验 7.金属离子的选择 8.溶解ZnS↓的酸
溶解ZnS↓所需的酸度
Zn2+ + S2-
ZnS↓
Ksp·ZnS=2.5×10-22 = [Zn2+ ][S2- ]
[Zn2+ ][S2- ] = Ksp·ZnS 平衡
[Zn2+ ][S2- ] > Ksp·ZnS ↓生成
MnO4- + 8H+ + 5e → Mn2+ + 4H2O E0=1.51V
NO3- + 3H+ + 2e → NO2- + H2O E0=0.94V
ΔE0=0.57V
2MnO4- + 5NO2- + 6H+ ═ 5NO3- + 2Mn2+ + 3H2O
(4)分解剩余的NaNO2
2NO2- + CO(NH2)2 + 2H+ ═ CO2 ↑+ 2N2↑ + 3H2O
ΔE0=0.399V
H2S + I2 ═ 2HI + S↓
剩余的I2用Na2S2O3滴定 I2 + 2Na2S2O3 ═ Na2S4O6 + 2NaI
原理总结
在废水样中加入醋酸锌,使其与水中的硫 化物生成硫化锌白色沉淀,过滤分离出沉 淀,加酸使沉淀溶解,与其中过量的碘液 反应,剩余的碘用硫代硫酸钠滴定,同时 做空白标定碘,从而计算出硫的含量。
ZnS↓在酸中溶解,并氧化S2移取I2标准溶液25ml + 1:1HCl溶液10 ml→暗处静置3分钟 Na2S2O3滴定剩余的I2 Na2S2O3滴定到淡黄色,加1ml淀粉,继 续滴定至蓝色消失即为终点。
取50mlH2O代替水样做空白
五、计算
硫化物(S2-,mg/L) ‖
(V0-V1)×CNa2S2O3×32.06×1000 ——————————————————
硫化物的危害
耗氧 危害农作物 水域色度污染 H2S污染空气 有产生H2S的潜在危险
测定方法
碘量法 吹气碘量法 分光光度法 贡量滴定法 微库仑法 荧光法 硫离子选择电极法 阴极溶出伏安法。
二、碘量法测定原理
S2- Zn2+
ZnS↓ HCl H2S 过量I2 S↓
+
(CV)Na2S2O3
Na2S2O3 剩余I2
12.2579g K2Cr2O7
1000ml容量瓶
2. 0.25mol/L FeSO4·(NH4)2SO4标准溶液
无机物
直链化合物 蛋白质、氨基酸 纤维 木质素 糖 脂肪 单宁
NO2Fe2+ S2SO32-
二、 K2Cr2O7法测定原理
1.反应原理 (1)K2Cr2O7在H+氧化水中的还原性物质
Cr2O72- + 14H+ + 6e ═ 2Cr3+ + 7H2O E0=1.33V
有机物:C → CO2 ↑ H → H2O↑ N → NH3 ↑
废水中总铬含量的测定
一、概述
铬的危害
Cr(Ⅲ)是生物痕量元素
Cr(VI)的毒性
致癌 刺激呼吸道、消化道 诱变作用 致敏原 损害肾功能
Cr(VI)口服致死剂量:1.5 ~1.6g
三价铬和六价铬排放标准
空气中Cr6+ : ≤ 0.05mg/m3 饮用水Cr6+ : ≤0.05mg/L 污水: 总铬 ≤ 1.5 mg/L
[H+]2
[Zn2+ ]
K1·K2·[H2S]·[Zn 2+ ] [H+] ≥ —————————
Ksp·ZnS
9.3×10-22×10-2 ≥ ——————————
2.5×10-22 ≥ 0.193 ≈ 0.2mol/L
制革污水化学耗氧量的测定
一、定义及测定意义 化学耗氧量: Chemical Oxygen Demand COD
MnO4- + 8H+ + 5e → Mn2+ + 4H2O E0=1.51V
Cr2O72- + 14H+ + 6e → 2Cr3+ + 7H2O E0 =1.33V
ΔE0=0.18V
10Cr3+ + 6MnO4- + 11H2O ═ 5Cr2O72- +6Mn2+ + 22H+
(3)除去过量的KMnO4
有色络合物
加草酸掩蔽
铁(Fe3+)与D.P.C
黄色络合物
加磷酸掩蔽
制革污水中硫化物的测定
一、概述
硫化物:溶解性的H2S、HS-、S2-以及可 溶于酸的金属硫化物,存在于悬 浮物 中,一般指总的硫化物,用 S2-(mg/L)表示。
皮革污水硫化物来源
灰碱法脱毛废液 酶脱毛当中角蛋白的分解产物 用硫化钠、多硫化钠助软浸水废液
淀粉
沉淀S2S2- + Zn(AC)2 ═ ZnS↓+2AC-
过滤分离ZnS↓
ZnS↓在酸中溶解 ZnS↓+ 2HCl═ H2S + ZnCl2
利用S2-的还原性和I2的氧化性,加入过 量I2的与S2-作用
