氨曲南杂质列表
氨曲南2010药典
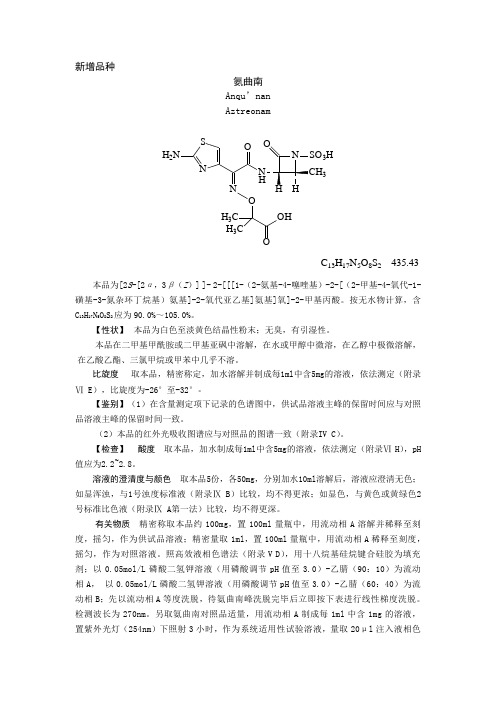
新增品种氨曲南Anqu’nanAztreonamSNH 2NNNO H 33H OH 3CH 3CO H O HC 13H 17N 5O 8S 2 435.43本品为[2S -[2α,3β(Z )] ]- 2-[[[1-(2-氨基-4-噻唑基)-2-[(2-甲基-4-氧代-1-磺基-3-氮杂环丁烷基)氨基]-2-氧代亚乙基]氨基]氧]-2-甲基丙酸。
按无水物计算,含C 13H 17N 5O 8S 2应为90.0%~105.0%。
【性状】 本品为白色至淡黄色结晶性粉末;无臭,有引湿性。
本品在二甲基甲酰胺或二甲基亚砜中溶解,在水或甲醇中微溶,在乙醇中极微溶解,在乙酸乙酯、三氯甲烷或甲苯中几乎不溶。
比旋度 取本品,精密称定,加水溶解并制成每1ml 中含5mg 的溶液,依法测定(附录Ⅵ E),比旋度为-26°至-32°。
【鉴别】(1)在含量测定项下记录的色谱图中,供试品溶液主峰的保留时间应与对照品溶液主峰的保留时间一致。
(2)本品的红外光吸收图谱应与对照品的图谱一致(附录IV C )。
【检查】 酸度 取本品,加水制成每1ml 中含5mg 的溶液,依法测定(附录Ⅵ H),pH 值应为2.2~2.8。
溶液的澄清度与颜色 取本品5份,各50mg ,分别加水10ml 溶解后,溶液应澄清无色;如显浑浊,与1号浊度标准液(附录Ⅸ B)比较,均不得更浓;如显色,与黄色或黄绿色2号标准比色液(附录Ⅸ A第一法)比较,均不得更深。
有关物质 精密称取本品约100mg ,置100ml 量瓶中,用流动相A 溶解并稀释至刻度,摇匀,作为供试品溶液;精密量取1ml ,置100ml 量瓶中,用流动相A 稀释至刻度,摇匀,作为对照溶液。
照高效液相色谱法(附录V D ),用十八烷基硅烷键合硅胶为填充剂;以0.05mol/L 磷酸二氢钾溶液(用磷酸调节pH 值至3.0)-乙腈(90:10)为流动相A , 以0.05mol/L 磷酸二氢钾溶液(用磷酸调节pH 值至3.0)-乙腈(60:40)为流动相B ;先以流动相A 等度洗脱,待氨曲南峰洗脱完毕后立即按下表进行线性梯度洗脱。
氨曲南的制备新工艺

氨曲南的制备新工艺陈凯;钟为慧【摘要】以头孢他啶侧链酸(ATTBA)为原料,首次采用酰氯法制备氨曲南,即在双(三氯甲基)碳酸酯(BTC)/三苯基氧膦(TPPO)体系作用下,现场制备酰氯盐酸盐中间体,再与trans-3(S)-氨基-4-甲基-2-氧代-1-氮杂环丁烷基磺酸反应,最后脱保护得氨曲南,总收率为40.6%.【期刊名称】《浙江化工》【年(卷),期】2013(044)007【总页数】4页(P10-13)【关键词】氨曲南;双(三氯甲基)碳酸酯;三苯基氧膦;酰氯法【作者】陈凯;钟为慧【作者单位】浙江工业大学药学院,杭州310014;浙江工业大学药学院,杭州310014【正文语种】中文氨曲南(1)是一种人工合成的单环β-内酰胺类抗生素,由美国施贵宝公司开发,1984年以商品名“Primbactam”在意大利上市,中国于1997年批准进口,2005年后以国内生产为主。
氨曲南具有抗菌谱广,疗效确切,对β-内酰胺酶稳定等特点,临床上主要用于治疗敏感革兰阴性菌所致的各种感染,如:尿路感染、呼吸道感染、腹腔感染、生殖道感染,胆道感染、皮肤及软组织感染、骨及关节感染、败血症等[1-3],具有较好的市场前景。
现阶段,氨曲南的传统合成工艺是活性酯法:该工艺以头孢他啶侧链活性硫酯,即(Z)-2-[(2-氨基噻唑-4-基)-(苯并噻唑-2-基硫基羰基)亚甲胺基氧基]-2-甲基丙酸叔丁酯(TAEM)和氨曲南主环(3),即(3S-反式)-3-氨基-4-甲基-2-氧代-1-氮杂环丁烷磺酸为原料,在三乙胺存在下合成叔丁基氨曲南(2),即[2S-[2α,3β(Z)]]-2-[[[1-(2-氨基-4-噻唑基)-2-[(2-甲基-4-氧代-1-磺基-3-氮杂环丁烷基)氨基]-2-氧代亚乙基]氨基]氧代]-2-甲基丙酸叔丁酯,然后在三氟乙酸作用下,60℃,脱去叔丁基,得到氨曲南(1)[4-6],即[2S-[2α,3β(Z)]]-2-[[[1-(2-氨基-4-噻唑基)-2-[(2-甲基-4-氧代-1-磺基-3-氮杂环丁烷基)氨基]-2-氧代亚乙基]氨基]氧代]-2-甲基丙酸。
药物研发过程中cde发补的N种情况

1 鉴于最近CDE发补及退审的频率越来越高,获得批准文号越来越难,为了让大家能尽量在前期避免不必要的失误,吸取经验,因此想看看大家的发补及退审理由,以便在自己的品种研发中,在早期完成这些CDE比较重视的实验或者工作。
我先来几个,绝对真实。
大家可以不写品种名称,仅仅供大家学习交流1、此3.1类品种没有与国外上市品种进行对比研究。
2、本品有关物质检测波长选择依据不足,未进行充分的研究。
3、请补充说明在本品合成工艺中,如何对对映异构体进行控制。
4、质量研究和标准:(1)对映异构体:建议参照中检所复核标准,将对映异构体检查增订入企业标准,限度为不得过xx%;(2)比旋度限度建议修订为xx至xx5、本品出现新的有关物质,请提供确定有关物质限度的研究资料。
度为不得过xx%;(2)比旋度限度建议修订为xx至xx2一仿制原料申报资料8:提供供二个起始原料详细合成工艺路线及质量标准(注:我们后面三步合成,二个起始原料市场供应也很多)申报资料10:a)有关物质检查方法不可靠:该品种在进行质量研究前,要了解国外标准及质控情况,根据这些背景信息,结合该品种的实际生产工艺情况,再决定研究内容及杂质限度。
首先根据合成工艺进行杂质分析,哪些是工艺中引入的杂质,哪些是降解杂质?其次参考本品的国外药典有关物质检测方法和本方法对比。
(注:我们用的可是05、10版都收载的方法,并做专属性等试验)b)对该品种的晶型进行研究进行系统研究。
3、剂型不合理。
一中药品种:胶囊改片剂,合理,批了。
胶囊改颗粒剂,不合理,毙了。
4、补充申请:变更包材要提供变更后的生产工艺及灭菌研究资料。
没有提供,不批准。
新药:有关物质需要做单个杂质的控制限度;渗透压的制定;辅料选择的安全性依据;和国外产品的对比;5、肌肉针改静脉,原料杂质没控制,退了6、我们一个3.1类原料药,发补资料如下:a、工艺:鉴于本品存在异构体,请说明工艺中如何控制异构体的产生。
b、结构研究:请提供相关的研究资料说明本品为β异构体c、质量研究和标准:(1)有关物质:方法学研究不全面,请补充提供中间体和其他已知杂质的分离研究资料,标准限度依据不足,请提供确定有关物质限度的研究资料。
氨曲南

鼠肝炎病毒3 型 MHV-3
脊髓灰质炎病毒Ⅲ型 PV3 埃可病毒6型 ECHO6 麻疹病毒 MV 水泡性口炎病毒 VSV
曾祥凤等.暨南大学组织移植与免疫学教育部重点实验室.中山大学学报(医学科学版)2006; 曾祥凤等.暨南大学组织移植与免疫学教育部重点实验室.中山大学学报(医学科学版)2006; 李凡等. 白求恩医科大学病原生物学教研室.中草药杂志2002; 2002;中国国家疾控中心实验报告 李凡等. 白求恩医科大学病原生物学教研室.中草药杂志2002;中国国家疾控中心实验报告
适应症
适用于敏感菌引起的下列感染: 适用于敏感菌引起的下列感染: 支气管炎、肺炎等下呼吸道感染; 支气管炎、肺炎等下呼吸道感染; 急性中耳炎、鼻窦炎、咽炎、扁桃体炎等上呼吸 急性中耳炎、鼻窦炎、咽炎、 道感染; 道感染; 皮肤和软组织感染; 皮肤和软组织感染; 盆腔炎性疾病; 盆腔炎性疾病; 男女性传播疾病中由沙眼衣原体所致的单纯性生 殖器感染; 殖器感染; 非多重耐药淋球菌所致的单纯性生殖器感染及由
合理应用抗生素并不是减少应用抗生素,而是将合适的抗生素正确的应用于感染。 合理应用抗生素并不是减少应用抗生素,而是将合适的抗生素正确的应用于感染。
Mike Niederman, Future in Anti-infectives Meeting (May 9, 2003)
疾病知识
每天一次,短疗程的希舒美使用简 便
孟德新
该产品是由美国Lily药厂实验室开发成功 的第二代头孢菌素类抗生素并由台湾著 名大型制药上市公司台湾生达化学制药 股份公司生产。原料来自于全球著名原 料生产基地意大利DOFAR公司。质量标 准(含量及杂质的控制)均优于国内同 种产品。
赫宁产品信息
目前赫宁在中国注册的适应症:
氨曲南说明书

注射用氨曲南之南宫帮珍创作氨曲南具有肾毒性、免疫原性弱以及青霉素类、头孢菌素类交叉过敏少等特点, 因此可用于替代氨基糖苷类药物, 治疗肾功能损害患者的需氧革兰阴性菌感染;并可在密切观察情况下用于对青霉素、头孢菌素过敏的患者.药物名称【英文名称】 Aztreonam 【其他名称】噻肟单酰胺菌素, 氨噻羧单胺菌素, 菌克单, Azactam, Primbactam, Primbactin 套装氨曲南注射剂CAS号:78110-38-0分子式:C13H17N5O8S2性状该品为白色晶体, 无臭, 在DMF,DMSO中溶解, 甲醇中微溶, 乙醇中极微溶, 甲苯, 氯仿, 乙酸乙酯中几乎不溶.药理作用该品为一种单酰胺环类的新型β-内酰胺抗生素.抗菌谱主要包括革兰阴性菌, 诸如年夜肠杆菌、克雷白杆菌、沙雷杆菌、奇异变形杆菌、吲哚阳性变形杆菌、枸橼酸杆菌、流感嗜血杆菌、绿脓杆菌及其他假单胞菌、某些肠杆菌属、淋球菌等.与头孢他定、庆年夜霉素相比、对产气杆菌、阴沟肠杆菌的作用高于头孢他定, 但低于庆年夜霉素;对绿脓杆菌的作用低于头孢他定、与庆年夜霉素相近;对其他病原菌的作用都较两者为高(对某些菌则与头孢他定接近).对质粒传导的β-内酰胺酶, 该品较第3代头孢菌素为稳定.口服不吸收, 肌注1g,1小时血浓度达峰值, 约为46μg/ml,半衰期约1.8小时;静注1g, 5分钟血药浓度约为125μ/ml, 1小时约为49μg/ml, 半衰期约1.6小时.体内分布较广, 在脓疱液、心包液、胸水、滑膜液、胆汁、骨组织、肾、肺、皮肤等部位有较高浓度;在前列腺、子宫肌肉、支气管分泌物中也有一定浓度、在脑脊液中浓度低.主要由尿排泄, 在尿中原形药物的浓度甚高.在乳汁中的浓度甚低, 为血药浓度的1%,平均0.3μg/ml,一日间母乳内总量约0.3mg.该品为第一个应用于临床的单环β内酰胺类抗生素.主要作用于需氧或兼性厌氧革兰阴性细菌和绿脓杆菌.脑膜炎球菌、淋球菌、摩拉卡他菌和流感杆菌的不产或产β内酰胺酶菌株均对该品敏感.90%以上的年夜肠秆菌、肺炎杆菌、变形杆菌属、普罗菲登菌属、摩根菌属、聚团肠杆菌、沙门菌属、志贺菌属、枸椽酸菌属可为 lmg/L或以下的该品所抑制, 其对绿脓杆菌的 MIC50和 MIC90分别为 3.1mg/L和2.5mg/L.但不动杆菌属、假单胞菌属(除绿脓杆菌外)、革兰阳性菌或厌氧菌均耐药.氨曲南主要与细菌的青霉素结合卵白3(PBP3)结合而抑制细胞壁的合成, 使细胞迅速溶解死亡.该品对细菌发生的质粒介导和年夜部份染色体介导的β内酰胺酶高度稳定, 因而许多耐药菌对该品仍呈敏感.药动学该品口服不吸收.肌注1g后, 血药峰浓度于 0.8h后达到, 为44.6mg/L,生物利用度 89.5%.分布容积广, 为 20.6L.消除半减期 1.9h.静脉推注1g(推注 10min)的即刻血药浓度 134mg/L:24h内约70%以原形由尿液排出, 约 1%~2%由粪排出.4h血透可清除该品, 25%~50%, 6h腹膜透析仅清除 10%.该品卵白结合率 45%~60%.体内分布广, 能分布到全身组织和体液中, 乳汁中含量少;脑膜炎时脑脊液内可达有效浓度.剂量与用法氨曲南可供静脉滴注、静脉注射和肌内注射给药.1.肾功能正常成人患者:①尿路感染, 1次0.5g或1g, 每8小时或12小时1次.②中度感染, 1次1g或2g, 每8小时或12小时1次.③重症感染, 1次2g, 每小时或8小时1次;每日最年夜剂量为8g.④铜绿假单胞菌感染应按重症感染剂量给药.2.儿童:1次30mg/kg, 每8小时给药1次;重症感染可增加至每6小时给药1次, 每日最年夜剂量为120mg/kg.3.肾功能不全患者:首剂与肾功能正常者相同, 维持剂量应调整, 内生肌酐清除率为10~30ml/min者, 维持剂量减半;内生肌酐清除率<10ml/min者, 维持剂量为肾功能正常患者剂量的1/4;血液透析患者每次透析后弥补首次剂量的1/8.副作用1、罕见的胃肠道反应有恶心、呕吐、腹泻.2、过敏反应如皮疹、紫癜、瘙痒等.3、有时可有肌注疼痛;静脉使用偶见静脉炎及血栓性静脉炎等.注意事项1、对青霉素过敏者或过敏体质者慎用. 氨曲南注射剂2、与氨基甙类药物(庆年夜霉素、妥布霉素及阿米卡星)联合用药具有协同抗菌作用;3、该品不成与头孢西丁配伍合用, 因可引起拮抗作用.4、对肾功能损害的病人, 应酌情调整剂量.5、过敏体质及对其他β-内酰胺类抗生素(如青霉素、头孢菌素)有过敏反应者慎用.6、可与氯霉素磷酸酯、硫酸庆年夜霉素、硫酸妥布霉素、头孢唑啉钠、氨苄青霉素钠联合使用, 但和萘呋西林、头孢拉定、甲硝唑有配伍禁忌.适应症1.尿路感染:年夜肠埃希菌、奇异变形杆菌、铜绿假单胞菌、阴沟肠杆菌、臭鼻克雷伯菌、柠檬酸杆菌、黏质沙雷菌引起的纯真性和复杂性肾盂肾炎以及反复发作性膀胱炎.2.呼吸道感染:年夜肠埃希菌、肺炎克雷伯菌、铜绿假单胞菌、流感嗜血杆菌、奇异变形杆菌、肠杆菌属和黏质沙雷菌所致的肺炎和支气管炎.3.血流感染:年夜肠埃希菌、肺炎克雷伯菌、铜绿假单胞菌、奇异变形杆菌、黏质沙雷菌和肠杆菌属引起的血流感染.4.皮肤软组织感染:年夜肠埃希菌、奇异变形杆菌、黏质沙雷菌、肠杆菌属、铜绿假单胞菌、肺炎克雷伯菌、柠檬酸杆菌引起的皮肤软组织感染(包括手术伤口感染、溃疡和烧伤创面感染).5.腹膜炎等腹腔感染:包括年夜肠埃希菌、臭鼻克雷伯菌、肺炎克雷伯菌、阴沟肠杆菌、铜绿假单胞菌、柠檬酸杆菌、黏质沙雷菌引起的腹腔感染, 常需与甲硝唑等抗厌氧菌药联合应用.6.生殖道感染:年夜肠埃希菌、肺炎克雷伯菌、肠杆菌属(包括阴沟肠杆菌)、铜绿假单胞菌、奇异变形杆菌引起的子宫内膜炎、盆腔炎等妇科感染, 常需与甲硝唑等抗厌氧菌药联合应用.剂型与规格注射用氨曲南:0.5g.禁用慎用对该品或其他单酰胺菌类药物过敏的患者应禁用该品.给药说明1、注射用氨曲南配制肌内注射液时, 每克氨曲南中至少加3ml注射用水或生理盐水作深部肌内注射.配制供静脉注射溶液, 加10ml注射用水至氨曲南药瓶中, 缓慢推注(5分钟).作静脉滴注时, 先加入至少3ml灭菌注射用水, 溶解瓶内氨曲南, 后再加入至少100ml生理盐水、糖水或糖盐水中稀释, 滴注药物浓度最高不成超越2%, 每次滴注时间30~60分钟.每瓶氨曲南粉剂中加入注射用水后必需立即用力震摇至完全溶解.不良反应个别病例有皮疹, 紫癫, 搔痒, 出血.也可有腹泻, 恶心.呕吐, 味觉改变, 黄胆及药物性肝炎.其他尚可有神经系统症状, 乏力, 眩晕等.该品与青霉素无交叉过敏反应, 但对青霉素过敏及过敏体质者, 仍应慎用.不良反应发生率约 7%, 因严重反应需中止治疗者低于 2%.罕见的不良反应有胃肠道不适、皮疹、瘙痒、血清转氨酶升高等, 年夜多轻微.该品无肝、肾毒性.罕见血小板和白细胞计数下降, 凝血时间延长.偶见氨基转移酶(ALT, AST)升高, 个别病人有阴道炎、口腔粘膜害.孕妇及哺乳期妇女用药1.本品能通过胎盘进入胎儿循环, 虽然植物实验显示其对胎儿无影响、无毒性和无致畸作用, 但孕妇仍然仅在需要时方可使用.2.可经乳汁分泌, 浓度不及母体血药浓度的1%, 哺乳妇女使用时应暂停哺乳.相互作用1.该品与丙磺舒合用可招致血药浓度轻度上升.2.该品与克林霉素、甲硝唑、庆年夜霉素等合用, 其药代动力学参数无改变.3.头孢西丁、亚胺培南等药物在体外可诱导肠杆菌属、假单胞菌属等革兰阴性菌发生高水平β内酰胺酶, 从而与氨曲南等众多β内酰胺类药物发生拮抗作用.。
氨曲南杂质的合成

O
… H
H2 N
,
\
:
Cw 4 H
M
e 舞霭
C1 5 H2 1 Ns Oa S MW : 46 3 49
8
图 1 氨 曲南 杂质 的合成 反应 式
氨 曲 南( A z t r e o n a m) 是一 种 单酰 胺环 类 的新 型 B 内酰 胺 抗 生 素 。适用 于尿 路 感染 、下 呼吸道 感 染 、血流 感 染 、皮肤 软 组织 感
染 、腹膜 炎 等腹 腔感 染 以及 生殖 道 感染 。氨 曲南具 有 肾毒性 、免 疫原 性 弱 以及青 霉素 类 、 头孢菌 素 类交 叉过 敏 少等特 点 ,因此 可 用于 替 代氨 基糖 苷 类 药物 ,治 疗 肾功 能损 害 患者 的需 氧革 兰 阴性
r a w ma t e ia r l s a n d mi l d r e a c t i o n c o n d i t i o n s . Ke y wo r d s : Az t r e o n a m; i mp u r i t y: s y n t h e s i s
【 摘 要】 以 乙酰 乙酸 叔 丁酗 为起 始物 料 ,经 亚硝 化 、烷 基 化 、水 解 、缩 合 等 一系列 反应 得到 氨 曲南 杂质 。相 比原先 的母 液浓 缩制 备 方法 ,该 新 方法 收率 高 ,成 本低 ,原 料 易得且 反 应条件 温 和 。 [ 关键 词】 氨 曲南 ;杂 质 ;合成 [ 中 圈分 类号】 T Q 【 文 献标 识码 】 A [ 文章 编号 ] 1 0 0 7 - 1 8 6 5 ( 2 0 1 5 ) 0 6 — 0 0 4 9 - 0 2
菌感 染 : 并可在 密 切观 察情 况 下 用于对 青 霉 素、 头孢 菌素 过敏 的 患者 【 l 0 】 。在 氨 曲南 的合 成过 程 中 ,会 产生 ‘ 些 副产 物 ,其 中氨 曲
瑞舒伐他汀Rosuvastatin全套杂质结构列表
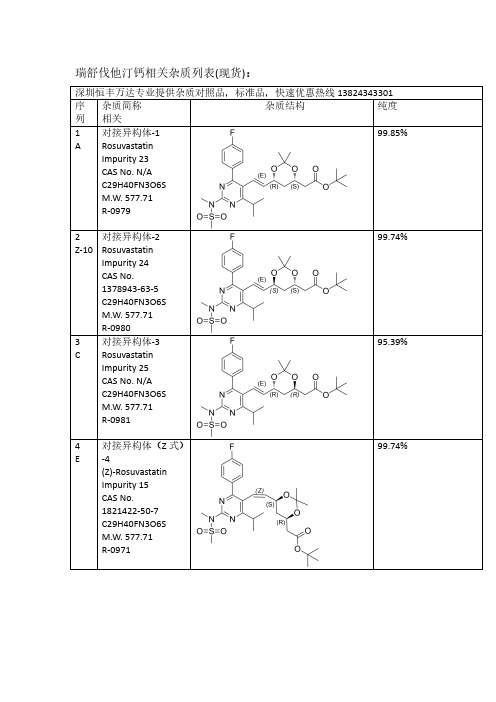
瑞舒伐他汀钙相关杂质列表(现货):深圳恒丰万达专业提供杂质对照品,标准品,快速优惠热线138****3301序列杂质简称相关杂质结构纯度1A 对接异构体-1RosuvastatinImpurity 23CAS No.N/A C29H40FN3O6S M.W.577.71R-097999.85%2Z-10对接异构体-2RosuvastatinImpurity 24CAS No.1378943-63-5C29H40FN3O6S M.W.577.71R-098099.74%3C 对接异构体-3RosuvastatinImpurity 25CAS No.N/A C29H40FN3O6S M.W.577.71R-098195.39%4E对接异构体(Z 式)-4(Z)-Rosuvastatin Impurity 15CAS No.1821422-50-7C29H40FN3O6S M.W.577.71R-097199.74%5Q对接光降解-1CAS No.N/A C29H40FN3O6S M.W.577.71R-099099.31%6P对接光降解-2CAS No.N/A C29H40FN3O6S M.W.577.71R-099299.69%7I丙酮加合物CAS No.N/A C32H46FN3O7S M.W.635.7998.23%8Z-12对接脱氟CAS No.N/AC29H41N3O6S M.W.559.72R-099399.46%9Z-16双键环氧脱丙酮叉CAS No.N/AC29H40FN3O7S M.W.593.7199.18%10B脱丙酮叉异构体-1ent-Rosuvastatin tert-Butyl Ester CAS No.615263-60-0C26H36FN3O6S M.W.537.65R-091899.90%11Z-11脱丙酮叉异构体-2(3S,5S)-Rosuvastatintert-Butyl Ester CAS No.2185805-16-5C26H36FN3O6S M.W.537.65R-097699.66%12D 脱丙酮叉异构体-3(3R,5R)-tert-ButylRosuvastatin (Rosuvastatin Impurity)CAS No.2162136-65-2C26H36FN3O6S M.W.537.65R-0911100%13F 脱丙酮叉异构体(Z 式)-4CAS No.1821422-51-8C26H36FN3O6S M.W.537.65R-099699.44%14S脱丙酮叉光降解-1CAS No.N/A C26H36FN3O6S M.W.537.65R-098999.61%15R脱丙酮叉光降解-2CAS No.N/A C26H36FN3O6S M.W.537.65R-099199.20%16J丙酮加合物脱丙酮叉Rosuvastatin EP Impurity A CAS No.1714147-49-5C29H42FN3O7S M.W.595.72R-099799.65%17Z-13无氟脱丙酮叉CAS No.N/AC26H37N3O6S M.W.519.65R-099599.17%18Z-255-甲氧基脱叉杂质RosuvastatinImpurity 42CAS No.N/A C27H38FN3O6S M.W.551.67R-0910098.80%19Z-263-甲氧基脱叉杂质RosuvastatinImpurity 47CAS No.N/A C27H38FN3O6S M.W.551.67R-0910598.65%203,5-二甲氧基脱叉杂质Rosuvastatin Impurity 44CAS No.N/A C28H40FN3O6S M.W.565.70R-0910698%21G钙盐异构体-1Rosuvastatin EP Impurity G Calcium Salt CAS No.1242184-42-4(free acid)C22H27FN3O6S.1/2Ca M.W.480.5420.0499.88%22Z-1钙盐异构体-2(3S,5S)Rosuvastatin Calcium Salt CAS No.1584149-34-7(free acid)C22H27FN3O6S.1/2Ca M.W.480.5420.04R-091598.15%23H钙盐异构体-3Rosuvastatin EP Impurity B Calcium Salt(3R,5R)-Rosuvastatin Calcium Salt CAS No.1422515-55-61094100-06-7(free acid)C22H27FN3O6S.1/2Ca M.W.480.5420.04R-091296.13%24V钙盐异构体(Z 式)-4Rosuvastatin Z-Isomer Calcium Salt CAS No.1444772-08-01445208-17-2(free acid)C22H27FN3O6S.1/2Ca M.W.480.5420.0499.51%25Z-245-甲氧基钠盐CAS No.N/AC23H29FN3NaO6S M.W.517.5599.50%26Z-273-甲氧基钠盐CAS No.N/AC23H29FN3NaO6S M.W.517.5596.83%27Z-293,5-二甲氧基钠盐CAS No.N/AC24H31FN3NaO6S M.W.531.5797.78%28U钙盐异构体光降解-5RosuvastatinImpurity 1Calcium Salt CAS No.854898-49-0854898-48-9(free acid)C22H27FN3O6S.1/2Ca M.W.480.5420.0499.75%29T 钙盐异构体光降解-6RosuvastatinImpurity 2Calcium Salt CAS No.854898-50-3854898-53-6(free base)C22H27FN3O6S.1/2Ca M.W.480.5420.0499.83%30Z-18钠盐异构体光降解-7(混合物)RosuvastatinImpurity 1Calcium SaltCAS No.N/A C22H27FN3O6S.1/2Ca M.W.480.5420.04R-093499.16%31Z-20钙盐异构体光降解-8Rosuvastatin Impurity CAS No.N/A C22H26FN3O6S M.W.479.5296.69%32Z-14钙盐无氟DesfluoroRosuvastatin Calcium Salt CAS No.N/A847849-66-5(acid)C22H28N3O6S.1/2Ca M.W.462.5420.04R-099499.78%33K 丙酮加合物钙盐Rosuvastatin EPImpurity A Calcium Salt CAS No.1714147-47-31715120-13-0(free acid)C25H33FN3O7S.1/2Ca M.W.538.6120.04R-092599.46%34M 内酯Rosuvastatin EPImpurity D CAS No.503610-43-3C22H26FN3O5S M.W.463.52R-09199.46%35N 内酯异构体CAS No.N/AC22H26FN3O5S M.W.463.5299.46%36内酯异构体CAS No.N/A C22H26FN3O5S M.W.463.5297%37Z-283-甲氧基内酯CAS No.N/AC23H28FN3O5S M.W.477.5598.97%38L5-氧代Rosuvastatin EP Impurity C freed acid CAS No.1620823-61-1(sodium salt)1422619-13-3(acid)C22H26FN3O6S M.W.479.5297.92%39Z-63-氧代3-Oxo Rosuvastatin Sodium Salt CAS No.1346606-28-71346747-49-6(acid)C22H25FN3O6S.Na M.W.478.5222.99R-091798.61%40O内酯脱水Rosuvastatin2,6-Diene Lactone Impurity CAS No.1246665-85-9C22H24FN3O4S M.W.445.5299.36%R-094141Z-44,6-二烯Rosuvastatin4,6-Diene Impurity CAS No.1422954-13-9C22H26FN3O5S M.W.463.53R-092795.44%42Z-152,6-二烯CAS NO.1422954-12-8(free acid)C22H26FN3O5S R-092695.70%43Z-8脱甲基二钠盐(体内代谢产物)N-Desmethyl Rosuvastatin Disodium Salt CAS No.371775-74-5(free base)C21H24FN3O6S.2Na M.W.465.50222.99R-09598.87%44W光降解内酯CAS No.854898-47-8C22H26FN3O5S M.W.463.5299.80%45X 光降解内酯CAS No.854898-46-7C22H26FN3O5S M.W.463.5297.84%46Z-2Z 式异构体内酯CAS No.N/A C22H26FN3O5S M.W.463.5296.52%47Z-9脱甲基内酯(体内代谢产物)N-Desmethyl Rosuvastatin Lactone CAS:1797419-58-9C21H24FN3O5S M.W.449.5097.42%48Z-7基因毒性杂质(体内代谢产物)Rosuvastatin Impurity 28CAS No.N/A C22H28FN3O7S M.W.497.54R-098498.94%49Z-5母核烯醛(工艺相关杂质)CAS No.890028-66-7C18H20FN3O3S M.W.377.4398.85%50Z-42母核无氟膦盐CAS No.N/A C34H35BrN3O2PS M.W.660.6099.14%51Y 本体脱丙酮叉CAS No.N/A C26H36FN3O6S M.W.537.6599.74%更多其他项目:雷西纳德,阿格列汀,依鲁替尼,唑吡坦,利奈唑胺,西他沙星,沙丁胺醇,罗替戈汀,丙戊酸钠,左乙拉西坦,西格列汀,特地唑胺,帕瑞昔布钠,帕布昔利布,赛乐西帕,伏硫西汀,曲格列汀,米拉贝隆,沙芬酰胺,达泊西汀,吡格列酮,达泊西汀,吉非替尼,去甲肾上素,阿昔洛韦,文拉法辛,普拉洛芬,普拉克索,曲唑酮,茚达特罗,阿扎胞苷,酮替芬,依折麦布,西那卡塞,氨曲南,替诺福韦,厄多司坦,孤法辛,雷贝拉唑,阿法替尼,依达拉奉,帕利哌酮,达比加群酯,鲁拉西酮,尼非卡兰,瑞巴派特,苯达莫司汀,利伐沙班,法舒地尔,普拉格雷,维格列汀,索非布韦,文拉法辛等。
JP日本药典(药局方)标准品汇总信息-2016-update

头孢妥仑匹酯标准品及杂质对照品
CefditorenPivoxil
117467-28-4
54
头孢地尼标准品及杂质对照品
Cefdinir
91832-40-5
55
头孢磺啶钠标准品及杂质对照品
CefsulodinSodium
52152-93-9
56
头孢他啶标准品及杂质对照品
Ceftazidime
72558-82-8
33103-22-9,33137-73-4
14
盐酸土霉素标准品及杂质对照品
OxytetracyclineHydrochloride
2058-46-0
15
硫酸卡那霉素标准品及杂质对照品
KanamycinMonosulfate
25389-94-0
16
卡鲁莫南钠标准品及杂质对照品
CarumonamSodium
37661-08-8
76
杆菌肽标准品及杂质对照品
Bacitracin(混合物)
1405-87-4
77
帕尼培南标准品及杂质对照品
Panipenem
87726-17-8
78
盐酸万古霉素标准品及杂质对照品
VancomycinHydrochloride
1404-93-9
79
盐酸匹美西林标准品及杂质对照品
PivmecillinamHydrochloride
86832-68-0
17
短杆菌肽标准品及杂质对照品
Gramicidin
1405-97-6
18
克拉霉素标准品及杂质对照品
Clarithromycin
81103-11-9
19
灰黄霉素标准品及杂质对照品
氨曲南的不良反应分析

氨 曲南 是 第 一个 成 功 用 于 临床 的单 环 1 内酰 3 一
胺类 抗生 素 ,因其 具有 高效 的抗 菌活 性和 不 良反 应
2 结 果
21 给药 途径 和剂 量 . l 3例 不 良反 应 中 , 是 静 脉滴 注给 药 , 均 是 均 且
发 生率低 而广 泛应 用 于临床 。 临床 使用 的是 冻干 粉 ,
枢 神 经 系统 反 应 及 造 血 系统 损 害 。
关 键词 氨 曲 南 : 良反 应 : 不 分析 中图分 类号 R 6 . 9 93 文献标 志码 ‘ A 文章 编 号 1 7 — 8 6 2 1 )6 5 1 0 6 3 7 0 (0 00 — 6 — 2
Байду номын сангаас
氨 曲南 ( z en m) 于 1 内酰胺 抗 生 素 中的 At o a 属 r 3 一
临用 前配 成溶 液 。氨 曲南 的过敏 原有 外源性 和 内源 性之 分 。外源 性过 敏源 主要 来 自在生 物合成 时带 入
的 残 留 量 的蛋 白多 肽 类 杂 质 : 内 源 性 过 敏 原 可 能 来
按照 SD F A核 准 的使 用 说 明 书 的要 求 合 理 用药 , 其 中每次 05 , 日 2次 1 ; 次 1 , 日 2次 的 .g 每 例 每 .g 每 0 5例 ; 每次 20 , 日 1 的 1 ; 次 20g 每 日 2 . 每 g 次 例 每 . ,
呼 吸道感 染 5例 占 3 . % , 8 6 泌尿 系统 感染 1 4 例
占 76 %, .9 腹腔 感染 3例 占 2 .8 ; 30 % 其他 4例 : 外科
手 术 预防用 药 1 , 例 外伤 2例 . 慢性 副鼻 窦炎 1 。 例
氨曲南说明书

注射用氨曲南氨曲南具有肾毒性、免疫原性弱以及青霉素类、头孢菌素类交叉过敏少等特点,因此可用于替代氨基糖苷类药物,治疗肾功能损害患者的需氧革兰阴性菌感染;并可在密切观察情况下用于对青霉素、头孢菌素过敏的患者。
药物名称【英文名称】Aztreonam 【其他名称】噻肟单酰胺菌素,氨噻羧单胺菌素,菌克单,Azactam,Primbactam,Primbactin套装氨曲南注射剂CAS号:78110-38-0分子式:C13H17N5O8S2分子量:435.43性状该品为白色晶体,无臭,在DMF,DMSO中溶解,甲醇中微溶,乙醇中极微溶,甲苯,氯仿,乙酸乙酯中几乎不溶。
药理作用该品为一种单酰胺环类的新型β-内酰胺抗生素。
抗菌谱主要包括革兰阴性菌,诸如大肠杆菌、克雷白杆菌、沙雷杆菌、奇异变形杆菌、吲哚阳性变形杆菌、枸橼酸杆菌、流感嗜血杆菌、绿脓杆菌及其他假单胞菌、某些肠杆菌属、淋球菌等。
与头孢他定、庆大霉素相比、对产气杆菌、阴沟肠杆菌的作用高于头孢他定,但低于庆大霉素;对绿脓杆菌的作用低于头孢他定、与庆大霉素相近;对其他病原菌的作用都较两者为高(对某些菌则与头孢他定接近)。
对于质粒传导的β-内酰胺酶,该品较第3代头孢菌素为稳定。
口服不吸收,肌注1g,1小时血浓度达峰值,约为46μg/ml,半衰期约1.8小时;静注1g,5分钟血药浓度约为125μ/ml,1小时约为49μg/ml,半衰期约1.6小时。
体内分布较广,在脓疱液、心包液、胸水、滑膜液、胆汁、骨组织、肾、肺、皮肤等部位有较高浓度;在前列腺、子宫肌肉、支气管分泌物中也有一定浓度、在脑脊液中浓度低。
主要由尿排泄,在尿中原形药物的浓度甚高。
在乳汁中的浓度甚低,为血药浓度的1%,平均0.3μg/ml,一日间母乳内总量约0.3mg。
该品为第一个应用于临床的单环β内酰胺类抗生素。
主要作用于需氧或兼性厌氧革兰阴性细菌和绿脓杆菌。
脑膜炎球菌、淋球菌、摩拉卡他菌和流感杆菌的不产或产β内酰胺酶菌株均对该品敏感。
最新CDE退审和发补经验汇集贴CMC部分汇总

C D E退审和发补经验汇集贴C M C部分鉴于最近CDE发补及退审的频率越来越高,获得批准文号越来越难,为了让大家能尽量在前期避免不必要的失误,吸取经验,因此想看看大家的发补及退审理由,以便在自己的品种研发中,在早期完成这些CDE比较重视的实验或者工作。
我先来几个,绝对真实。
大家可以不写品种名称,仅仅供大家学习交流1、此3.1类品种没有与国外上市品种进行对比研究。
2、本品有关物质检测波长选择依据不足,未进行充分的研究。
3、请补充说明在本品合成工艺中,如何对对映异构体进行控制。
4、质量研究和标准:(1)对映异构体:建议参照中检所复核标准,将对映异构体检查增订入企业标准,限度为不得过xx%;(2)比旋度限度建议修订为xx至xx5、本品出现新的有关物质,请提供确定有关物质限度的研究资料。
一仿制原料申报资料8:提供供二个起始原料详细合成工艺路线及质量标准(注:我们后面三步合成,二个起始原料市场供应也很多)申报资料10:a)有关物质检查方法不可靠:该品种在进行质量研究前,要了解国外标准及质控情况,根据这些背景信息,结合该品种的实际生产工艺情况,再决定研究内容及杂质限度。
首先根据合成工艺进行杂质分析,哪些是工艺中引入的杂质,哪些是降解杂质?其次参考本品的国外药典有关物质检测方法和本方法对比。
(注:我们用的可是05、10版都收载的方法,并做专属性等试验)b)对该品种的晶型进行研究进行系统研究。
补充申请:变更包材要提供变更后的生产工艺及灭菌研究资料。
没有提供,不批准。
新药:有关物质需要做单个杂质的控制限度;渗透压的制定;辅料选择的安全性依据;和国外产品的对比;我们一个3.1类原料药,发补资料如下:1、工艺:鉴于本品存在异构体,请说明工艺中如何控制异构体的产生。
2、结构研究:请提供相关的研究资料说明本品为β异构体3、质量研究和标准:(1)有关物质:方法学研究不全面,请补充提供中间体和其他已知杂质的分离研究资料,标准限度依据不足,请提供确定有关物质限度的研究资料。
注射用氨曲南(1)医药代表演示资料文档

22
43
63
58
88
79
左氧氟沙星 47 60 89
临床应用
本品用于治疗敏感需氧革兰阴性菌所致 的各种感染,如尿路感染、下呼吸道感 染、败血症、皮肤和皮肤软组织感染、 腹腔内膜感染、妇科感染、术后伤口及 烧伤、溃疡等。
本品亦用于治疗院内感染中的上述感染 (如免疫缺陷病人的医院内感染)。
临床应用
2. 小儿呼吸道及重症肺部感染的治疗:主要 用于肺炎克雷伯杆菌、大肠埃希菌、绿脓 杆菌等条件致病菌引起的肺炎、肺脓肿等;
3. 小儿尿路感染: 4. 流行性脑脊髓膜炎: 5. 菌血症和败血症:
儿科方法及用量
轻重度感染:推荐剂量为30mg/kg,每日分3次静 滴或肌注;
中重度感染:推荐剂量为30mg/kg,每日分3~4 次静滴或肌注,每日最大用量不得超过120mg/kg;
3. 脑脊髓膜炎等中枢神经系统感染:氨曲南可以透 过血脑屏障,用于治疗由脑膜炎双球菌、绿脓杆 菌等引起的神经系统感染;
4. 菌血症和败血症:用于血培养为G-菌的败血症治 疗,常需要联合克林霉素等其他抗生素治疗;
5. 胸膜炎、脓胸:穿刺液经涂片检查为G-菌的治疗;
儿科临床应用—儿科常见G-菌感染
1. 小儿腹泻、事物中毒:由大肠埃希菌、痢 疾杆菌、沙门氏菌等引起的腹泻、食物中 毒或腹腔感染;
本品不良反应较少见,全身性不良反应发生 率约1~1.3%或略低。
根据SFDA颁布的《药品不良反应报告和监测 管理办法》,重庆莱美药业制定了相应的 “药品不良反应处理管理标准”。
主动加入了药监局药品不良反应报告和监测 网,时时监测,安全有保障。
临床主要推广科室
妇科临床应用—妇科常见G-菌感染
注射用氨曲南的说明书.doc

注射用氨曲南的说明书[药品名称]常用名称:注射用氨曲南中文名称:注射用氨曲南汉语拼音:Zhusheyong Anqu’nan[主要部件]该产品的主要成分是氨曲南。
化学名称:[2S-[2α,3β(Z)]2-[[[1-(2-氨基-4-噻唑基)-2-[(2-甲基-4-氧代-1-磺基-3-氮杂环丁基)氨基]-2-氧代乙烯]氨基]氧基]-2-甲基丙酸化学结构式:分子式:C13H17N5O8S2分子量:435.43化学文摘社编号:78110-38-0辅料:精氨酸、注射用水[属性]这种产品是白色或类似白色的松散块和粉末。
[指示]该产品适用于治疗敏感需氧革兰氏阴性菌引起的各种感染,如尿路感染、下呼吸道感染、败血症、腹腔感染、妇科感染、皮肤和软组织感染,如术后伤口和烧伤、溃疡等。
它也用于治疗上述类型的医院感染(如免疫功能低下患者的医院感染)。
[规范] 0.5g(由C13H17N5O8S2计算)[用法和用量]用法:1.静脉滴注:每1g至少用3毫升注射用水溶解氨曲南,然后用适当的输液稀释(0.9%氯化钠注射液、5%或10%葡萄糖注射液或林格氏注射液),氨曲南的浓度不得超过2%,滴注时间为20-60分钟。
2.静脉注射:每瓶用6-10毫升注射用水溶解,并在3-5分钟内缓慢注入静脉。
3.肌肉注射:将氨曲南用至少3毫升注射用水或每1克0.9%氯化钠注射液溶解,并注射入深层肌肉。
单次剂量大于1克或败血症、其他严重全身感染或危及生命的感染的患者应静脉注射,最大剂量为每天8克。
当患者出现暂时性或持续性肾功能不全时:根据肾功能适当减少用量。
对于肌酐清除率小于10 ~ 30 ml/(min .1 .73m2)的肾功能损害,第一次剂量为1g或2g,后一次剂量减半。
肌酐清除率小于10毫升/(分钟.1 .73平方米),若因血液透析导致肾功能衰竭严重,第一次剂量为0 .5克、1克或2克,维持剂量为第一次剂量的1/4,间隔时间为6、8或12小时;对于严重或危及生命的感染者,每次血液透析后,将初始维持量增加初始剂量的1/8。
药物研发过程中cde发补的N种情况

1 鉴于最近CDE发补及退审的频率越来越高,获得批准文号越来越难,为了让大家能尽量在前期避免不必要的失误,吸取经验,因此想看看大家的发补及退审理由,以便在自己的品种研发中,在早期完成这些CDE比较重视的实验或者工作。
我先来几个,绝对真实.大家可以不写品种名称,仅仅供大家学习交流1、此3.1类品种没有与国外上市品种进行对比研究。
2、本品有关物质检测波长选择依据不足,未进行充分的研究。
3、请补充说明在本品合成工艺中,如何对对映异构体进行控制。
4、质量研究和标准:(1)对映异构体:建议参照中检所复核标准,将对映异构体检查增订入企业标准,限度为不得过xx%;(2)比旋度限度建议修订为xx至xx5、本品出现新的有关物质,请提供确定有关物质限度的研究资料。
度为不得过xx%;(2)比旋度限度建议修订为xx至xx2一仿制原料申报资料8:提供供二个起始原料详细合成工艺路线及质量标准(注:我们后面三步合成,二个起始原料市场供应也很多)申报资料10:a)有关物质检查方法不可靠:该品种在进行质量研究前,要了解国外标准及质控情况,根据这些背景信息,结合该品种的实际生产工艺情况,再决定研究内容及杂质限度.首先根据合成工艺进行杂质分析,哪些是工艺中引入的杂质,哪些是降解杂质?其次参考本品的国外药典有关物质检测方法和本方法对比.(注:我们用的可是05、10版都收载的方法,并做专属性等试验)b)对该品种的晶型进行研究进行系统研究。
3、剂型不合理。
一中药品种:胶囊改片剂,合理,批了。
胶囊改颗粒剂,不合理,毙了.4、补充申请:变更包材要提供变更后的生产工艺及灭菌研究资料。
没有提供,不批准。
新药:有关物质需要做单个杂质的控制限度;渗透压的制定;辅料选择的安全性依据;和国外产品的对比;5、肌肉针改静脉,原料杂质没控制,退了6、我们一个3.1类原料药,发补资料如下:a、工艺:鉴于本品存在异构体,请说明工艺中如何控制异构体的产生。
b、结构研究:请提供相关的研究资料说明本品为β异构体c、质量研究和标准:(1)有关物质:方法学研究不全面,请补充提供中间体和其他已知杂质的分离研究资料,标准限度依据不足,请提供确定有关物质限度的研究资料.(2)含量:请采用不同的机制的方法进行比较研究,以考察方法的可行性。
cde不批准原因

信息来源:cde电子刊物<化药集中审评品种案例(一)>里面的具体案例分析,同样对于我们有指导意义./dzkw.do?method=largePage&id=310986品名/受理号讨论的主要问题及结论阿德福韦酯软胶囊(CXHL06XXXXX)本品活性成分阿德福韦酯在水中几乎不溶,在二氯甲烷和乙醇、乙睛、丙酮中易溶。
本品选择大豆油为基质,药物以混悬状态存在于基质中,制备工艺未对阿德福韦酯的粒度进行研究和控制,工艺研究存在缺陷。
本品仅在质量研究中考察了样品的溶出行为,采用桨法,100rpm,选择含0.05%的十二烷基硫酸钠水溶液为介质;但是,已上市原剂型一般采用桨法,50rpm,0.01N盐酸溶液为介质,现溶出度检查条件不合理,可能无法分辨不同质量制剂的溶出行为的差异,也无法对本品与已上市原剂型的溶出行为进行比较。
本品稳定性试验仅考察了崩解时限,经加速试验6个月和长期放置12个月,崩解时间由3-6min延长为16-28min,由于未进行溶出度考察,无法判定产品质量的变化。
综上,建议不批准。
阿法骨化醇口服液(CXHL06XXXXX)本品有关物质检查采用HPLC法,样品进样量为0.05μg,检测限为0.002μg(相当于进样量的4%),无法保证杂质被有效检出。
而阿法骨化醇是稳定性差的药物,剂型通常设计为软胶囊,本品设计为口服溶液稳定性是否符合要求,必须提供翔实的稳定性试验数据。
现有关物质检查方法无法证明本品的稳定性。
建议不批准。
氨曲南及注射用氨曲南主要问题:聚合物检查和有关物质检查。
会议讨论:(1)基于文献调研和品种情况分析,目前国内外对单环类β-内酰胺抗生素的聚合物研究尚不充分,未对氨曲南聚合物的产生情况有统一的认识,未检索到氨曲南聚合物的相关文献;同时各国药典收载的氨曲南及制剂中也未对聚合物或二聚体、三聚体等进行控制(阿莫西林钠等明确会产生聚合物的品种则多采用梯度洗脱控制二聚体等)。
cde不批准原因

信息来源:cde电子刊物<化药集中审评品种案例(一)>里面的具体案例分析,同样对于我们有指导意义..cn/dzkw.do?method=largePage&id=310986品名/受理号讨论的主要问题及结论阿德福韦酯软胶囊(CXHL06XXXXX)本品活性成分阿德福韦酯在水中几乎不溶,在二氯甲烷和乙醇、乙睛、丙酮中易溶。
本品选择大豆油为基质,药物以混悬状态存在于基质中,制备工艺未对阿德福韦酯的粒度进行研究和控制,工艺研究存在缺陷。
本品仅在质量研究中考察了样品的溶出行为,采用桨法,100rpm,选择含0.05%的十二烷基硫酸钠水溶液为介质;但是,已上市原剂型一般采用桨法,50rpm,0.01N盐酸溶液为介质,现溶出度检查条件不合理,可能无法分辨不同质量制剂的溶出行为的差异,也无法对本品与已上市原剂型的溶出行为进行比较。
本品稳定性试验仅考察了崩解时限,经加速试验6个月和长期放置12个月,崩解时间由3-6min延长为16-28min,由于未进行溶出度考察,无法判定产品质量的变化。
综上,建议不批准。
阿法骨化醇口服液(CXHL06XXXXX)本品有关物质检查采用HPLC法,样品进样量为0.05μg,检测限为0.002μg(相当于进样量的4%),无法保证杂质被有效检出。
而阿法骨化醇是稳定性差的药物,剂型通常设计为软胶囊,本品设计为口服溶液稳定性是否符合要求,必须提供翔实的稳定性试验数据。
现有关物质检查方法无法证明本品的稳定性。
建议不批准。
氨曲南及注射用氨曲南主要问题:聚合物检查和有关物质检查。
会议讨论:(1)基于文献调研和品种情况分析,目前国内外对单环类β-内酰胺抗生素的聚合物研究尚不充分,未对氨曲南聚合物的产生情况有统一的认识,未检索到氨曲南聚合物的相关文献;同时各国药典收载的氨曲南及制剂中也未对聚合物或二聚体、三聚体等进行控制(阿莫西林钠等明确会产生聚合物的品种则多采用梯度洗脱控制二聚体等)。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
6-7
-100mg
Aztreonam 102579-5 10mg-25mg-50mg
3
氨曲南杂质 5
≥99
Impurity 5
9-9
-100mg
Aztreonam 99341-02 10mg-25mg-50mg
4
氨曲南杂质 6
≥99
Impurity 6
-3
-100mg
Aztreonam 87791-62 10mg-25mg-50mg
5 氨曲南杂质 32
≥99
Impurity 32
-6
-100mg
Aztreonam 80082-65 10mg-25mg-50mrity 35
-1
-100mg
广州隽沐生物主营各种杂质对照品:紫杉醇杂质,莫西沙星杂质,达托霉素杂质,
阿奇霉素杂质,帕拉米韦杂质,克拉霉素磷酸酯杂质,西格列汀杂质,林可霉素
杂质,奥拉帕利杂质,阿加曲班杂质,法莫替丁杂质,他达拉非杂质,厄洛替尼
杂质,替格瑞洛杂质等;并提供 COA、NMR、HPLC、MS、定量核磁等结构确证
图谱。
177 二 813 八 655
代理中检所/EP/BP/USP/LGC/TRC/TLC/MC/SIGMA/等品牌。
氨曲南杂质列表(部分)
序号 产品名称 英文名称 CAS 号
规格
纯度
Aztreonam 87500-74 10mg-25mg-50mg
1
氨曲南杂质 3
≥99
Impurity 3
-1
-100mg
结构式
Aztreonam 102586-3 10mg-25mg-50mg
2
氨曲南杂质 4
≥99
Impurity 4
