流式基本知识
流式细胞术基础知识

讲者:***
目录
1、流式细胞术基本定义 2、流式细胞仪介绍 3、荧光染料介绍 4、不同型号流式细胞仪简介 5、流式细胞仪应用
流式细胞术定义
流式细胞术(Flow Cytometry, 简称FCM)是一种可以快速、 准确、客观,并且同时检测单个微粒(通常是细胞)的多 项特性(多参数)的技术,同时可以对特定群体加以分选
淋巴细胞亚群分析可以了解机体在不同条件下的免疫功能 状态,主要包括细胞免疫功能和体液免疫功能。在临床上,主要用 于对免疫系统造成明显干扰的相关疾病的辅助诊断,分析疾病的发 病机理,监控疾病的病程进展,观测疗效及监测预后等等。
流式细胞仪临床应用
临床意义 CD3+ CD3+ CD4+ CD3+ CD8+ CD4+ / CD8+ B细胞 NK细胞
FITC, PE,ECD,PC5 or PECy5.5,PE-Cy7
APC, APC-Cy7
国食药监械(进)字 2014第2403463号
FITC, PE,ECD,PC5 or PC5.5,PC7
红光:638nm 紫光:405nm
APC,APC-Cy5 or APCAlexa Fluor 700, APC-Cy7 or APCAlexa Fluor
谢谢!
部分演示内容来源于网络,如有侵权,请联系删除!谢谢!
APC, APC-Cy7
浙械注准 20192220121
流式细胞仪应用
临床研究
血液,肿瘤, 药理,免疫…
环境研究
湖泊,海洋 生态研究…
生物学研究
遗传,生殖, 微生物,细胞 生物,毒理, 分子生物…
食品制药工业
食品检测、药物筛 选,疫苗研究…
1流式细胞仪基础知识介绍

FL2 1
2
3 4 FL1
FL
2
12
34
FL1
未补偿
补偿合适
补偿过度
谢谢!
谢谢!
48 53 58 0 50
48 53 58 0 50
530长 通
530短 通
48 53 58 0 50
530/30带通
电子系统 ✓ 主要作用:接收、处理光信号;将光信号转变为电信号,再将电信号数字化; ✓主要部件:光电二极管(PD)、光电倍增管(PMT)、信号处理板
信号检测原理
✓信号检测器
•光电二极管 无电流放大作用 信噪低
流式细胞仪的结构域原理 目 录
流式样本的前处理
流式数据的获取和分析
流式细胞仪实验流程
全血抗凝血 培养细胞 新鲜组织 石蜡包埋组织 体液
单细胞悬液
✓酶消化法 ✓机械法 ✓化学处理法
荧光抗体标记
上机检测
✓细胞膜抗原标记 ✓细胞浆抗原标记 ✓膜浆抗原同时标记 ✓单色标记 ✓多色标记
流式细胞仪的定义和分类
✓ 主要作用:数据分析、显示 ✓ 主要部件:电脑工作站
图 门 数据统计
•图—类型
直方图 密度图
三维立体图
散点图 等高线图
•图——坐标轴显示
线性
对数
线性坐标:将数据均匀的映射到各个像素点;一般用于显示FSC和SSC数据
对数坐标:数据做对数变换后均匀的映射到各个像素点 可以将大数据在坐标轴上压缩,小数据在坐标轴上拉伸 可用于阳性标定范围广、但阴性标定信号低,线性坐标不易于分辨的情况
光信号 单细胞悬液或生物 颗粒
分析速度高 多参数
精度高
当代最先进的细胞定量分析技 术
流式基本知识

一步一步学流式第一篇:流式细胞术的历史概要说来,流式细胞术主要包括了样品的液流技术、细胞的分选和计数技术,以及数据的采集和分析技术等。
FCM目前发展的水平凝聚了半个世纪以来人们在这方面的心血和成果。
1934年,Moldavan1首次提出了使悬浮的单个血红细胞等流过玻璃毛细管,在亮视野下用显微镜进行计数,并用光电记录装置计测的设想,在此之前,人们还习惯于测量静止的细胞,因为要使单个细胞顺次流过狭窄管道容易造成较大的细胞和细胞团块的淤阻。
1953年Crosland –Taylor根据雷诺对牛顿流体在圆形管中流动规律的研究认识到:管中轴线流过的鞘液流速越快,载物通过的能力越强,并具有较强的流体动力聚集作用。
于是设计了一个流动室,使待分析的细胞悬浮液都集聚在圆管轴线附近流过,外层包围着鞘液;细胞悬浮液和鞘液都在作层液。
这就奠定了现代流式细胞术中的液流技术基础。
1956年,Coulter在多年研究的基础上利用Coulter效应生产了Coulter 计数器。
其基本原理是:使细胞通过一个小孔,只在细胞与悬浮的介质之间存在着导电性上的差异,便会影响小孔道的电阻特性,从而形成电脉冲信号,测量电脉冲的强度和个数则可获得有关细胞大小和数目方面的信息。
1967年Holm等设计了通过汞弧光灯激发荧光染色的细胞,再由光电检测设备计数的装置。
1973年Steinkamp设计了一种利用激光激发双色荧光色素标记的细胞,既能分析计数,又能进行细胞分选的装置。
这样就基本完成了现代FCM计数技术的主要历程。
现代的FCM数据采集和分析技术是从组织化学发源的,其开拓者是Kamentsky。
1965年,Kamentsky在组织化学的基础上提出了两个新设想:(1)细胞的组分是可以用光光度学来定量测定的,即分光光度术可以定量地获得有关细胞组织化学的重要信息。
(2)细胞的不同组分可以同时进行多参数测量,从而可以对细胞进行分类。
换句话说,对同一细胞可以同时获得有关不同组分的多方面信息,用作鉴别细胞的依据。
流式基础原理

BD Biosciences Immune Function
同型对照
• 同型对照(Isotype Control) :
与实验染色的单克隆抗体特异性无关的免疫球蛋白亚型 (即Fc段相同, F(ab’)2段不同) 与染色的单克隆抗体 ①相同种属来源 ②相同免疫球蛋白及亚型 ③相同荧光素标记 ④相同剂量和浓度 ⑤但由未免疫动物血清纯化而来 用于消除由于抗体非特异性结合到细胞表面的Fc受体而产生的背 景染色 例如,标记FITC的单克隆抗体为小鼠IgG1亚类抗体,标记PE的单 克隆抗体为小鼠IgG2a亚类抗体,同型对照应用相同浓度和剂量的 未免疫小鼠血清的纯化IgG1(γ1)和IgG2a( γ2a),并分别标记 BD Biosciences Immune Function FITC和PE
染料选择-按照机器设置
4-color
FITC or Alexa 488 PE
8-color
FITC or Alexa 488 PE PE-CF594 or PE-Texas Red or PE-Alexa 610/594
Additional
FITC or Alexa 488 PE PE-CF594 or PE-Texas Red or PE-Alexa 610/594 PerCP/PerCP-Cy5.5/PE-Cy5/PECy5.5 PE-Cy7 APC or Alexa 647 APC-Cy5.5/Alexa 680 or Alexa 700 APC-H7/APC-Cy7 BV 421 Horizon V450/V500 Pacific Orange, Q-dots
FL1 FL2 638 840 245 85 160 720
流式理论试题

流式培训理论题(开卷)一、流式基本理论知识1、解释FSC和SSC。
2、解释何为荧光素、荧光信号强度、并分别解释三种流式图谱。
3、流式细胞仪能用来做什么?4、设门的目的是什么?如何设门?5、流式的对照有哪些?说明每种对照的用途。
6、解释一下调节荧光补偿的原理。
7、简述使用流式细胞仪检测细胞特异蛋白marker的实验流程。
包括每一步骤的具体操作以及需要注意的事项。
8、如何去选择抗体?9、常用的荧光染料以及其检测通道(有的不止一个通道),至少说出5个。
二、Guava流式细胞仪知识考查1、我们的流式细胞仪的型号:2、Guava流式细胞仪与普通鞘液流式细胞仪的区别,分别从优缺点以及应用范围来说明。
3、简述Guava流式细胞仪的基本组成。
4、简述guava流式细胞仪的微毛细管液流系统。
5、简述guava流式细胞仪的光路系统。
6、我们的Guava流式细胞仪的激光器和荧光通道有哪些?7、Guava流式细胞仪软件的常用模块有哪些?8、简述Guava流式的开机关机流程。
三、应用题1、小鼠中,淋巴细胞、T细胞、T helper细胞、T Cytotoxic细胞、B细胞、NK细胞、DC细胞、中心粒细胞、单核细胞的marker是什么?2、现有一特定方法得到的细胞,我们要研究里面的中心粒细胞、T细胞、T helper细胞、T Cytotoxic细胞的比例,怎么做?请采用多色标记的方法来设计,尽量减少抗体荧光素的串扰。
3、如果要研究细胞凋亡,用流式细胞仪怎么做?需要同时检测早期凋亡、晚期凋亡/死亡细胞的比例。
四、注意事项1、guava流式细胞仪对细胞密度的要求?如果细胞密度过高有什么影响?该如何处理?2、guava流式细胞仪对颗粒粒径的的要求?提取的细胞,上样前必须如何操作来避免堵塞毛细管?3、如果跑着跑着没有细胞了,可能是哪些原因?4、没有用完的96孔板怎么处理?。
流式细胞术测定植物基因组大小 一、流式细胞术的基本知识 二、植物C值分析原理

Sheath fluid
Fluorescence signals Focused laser beam
液流中心由单列 匀速运动颗粒组 成的液柱
分选系统
488 nm laser FALS Sensor
Fluorescence detector
Charged Plates
+
Single cells sorted into test tubes
流式细胞仪(Flow Cytometer)
集激光技术、电子物理技术、光电测量技术、电子计算机技术、细 胞荧光化学技术、流体力学为一体的一种新型高科技仪器。
流式细胞术特点
单细胞悬液 或生物颗粒 分析速度高 多参数 精度高 高灵敏度 无害分析 和分选
当代最先进的细 胞定量分析技术
国际两大流式细胞仪生产商:
流式细胞仪计算测量DNA 含量实际上是细胞周期的测 量,由于细胞核G1期的DNA含量反应一个细胞的倍性,因 此常用DNA含量来估计细胞倍性,包括DNA的绝对含量或相 对含量。
测量DNA的绝对含量时,须设一个已知DNA含量的标准样 品作对照,来换算出DNA的绝对含量。
样品2C DNA含量=[(样品G0/G1峰均值)/ (标准G0/G1峰均值)] ×标准2C DNA含量(pg DNA)
台式机和大型机
EPICS XL 流式 细胞分简便
使用寿命长
配备1-2根激光 细胞分选速度慢, 主要用于细胞分析
临床型(BD,FACSCalibur台式机)
特点: 分辨率高 选配多种波长和 类型激光器 可把感兴趣细胞 分选到特定培养孔 或板上(4路和24 孔板) 大型机(BD,FACSAria科研型) 适用于高速分选 和多色分析
BD 流式基础知识-qj

压力差 样本流 进样速度
Hi 10 1p0sipsi
10.8 psi
分辨率
Count
细胞周期
Count
300 280 260 240 220 200 180 160 140 120 100
80 60 40 20
0 0
340 320 300 280 260 240 220 200 180 160 140 120 100
— 例:一个双色染色的实验 抗体A FITC,抗体B PE 对应的同型对照是IgG1 FITC,IgG1 PE
那么需要准备的是 阴性对照:细胞加上IgG1 FITC,IgG1 PE 单阳性对照: FITC: 细胞加上Ab A FITC PE: 细胞加上Ab B PE
数据分析
—设门 —设定阴性与阳性群体的界限 —确定阳性与阴性细胞群体 —统计阳性或阴性细胞群体的百分率,
2. 激发并收集各种光信号
液流系统 光学系统
光学系统
• 激发光学系统:
激发光源—激光 透镜和反射镜—将激光引导到检测区域
• 接收光学系统:
滤光片等—将产生的光信号引导到对应的光学接收器
激发光学系统: 将激光引导到检测区域,产生光信号
激光
单波长 高强度 高稳定
488 nm blue 633 nm red 405 nm violet
三维点图
等高图 密度图
设门(Gating)
平均荧光强度 百分比
流式细胞仪的构造
1. 细胞样本成单列依次通过 光检测区
2. 激发并收集各种光信号
3. 光信号转换成电信号, 数字化处理
4. 数字信号传入计算机
5. 活细胞分选
液流系统 光学系统 电子系统 计算机系统 分选系统
流式知识基础介绍

流式基础介绍什么是流式细胞仪?流式细胞仪是一个重要的细胞生物学研究工具,它通过不同的液流原理(流体动力学聚焦和微毛细管聚焦)实现细胞样本在液态检测环境中的单细胞排列,经特异性抗体和相应荧光染料标记过的单个细胞样本高速依次通过激光检测点,其所标记的荧光染料分子被激光激发释放出相对应的特异光学信号。
流式细胞仪通过捕捉这些具有细胞种类和信号强度差异的光学信号,可以对数十万乃至数百万细胞样本的细胞种类进行定性定量分析。
流式细胞仪的主要科学意义,在于可以高速地获得具有统计学意义的群体数据,并具有良好的检测灵敏度。
在主要数据模式有两种:直方图---又称单参数图;散点图---又称双参数图;流式细胞仪是细胞生物学家,免疫学家,血液学家等生命科学研究领域研究者不可或缺的研究工具直方图-单参数图散点图-双参数图流式细胞仪的主要类别?目前市场上,主要有三种不同类型的流式细胞仪:分析型流式细胞仪;分选型流式细胞仪;量化成像分析流式细胞仪分析型流式细胞仪:主要是通过荧光信号强度这一单一数据参数,对不同的细胞群体进行定性定量分析,既无法看到细胞样本的形态,更无法对特定的细胞群体进行分离,单用户想要从混合细胞样本中分选获得某种特性的细胞时,传统分析型流式细胞仪则无法实现细胞的分选功能。
Guava 5 5HT 6 6HT 6-2L 6HT-2L以及8 8HT等均属于分析型流式细胞仪。
分选型流式细胞仪:主要用途除了细胞群体的分析功能外,还可以从混合细胞样本中将特定群体的细胞进行有效的分离和获取,这一过程被称之为细胞分选。
BD FACSJazz, BD FACSAriaIII, BD Influx, BEC MofloXDP 以及 BECAstrios均属于细胞分选仪的范畴。
量化成像分析流式细胞仪:量化成像分析---是指基于一系列形态学图像参数,量化地对细胞群体进行分析。
在传统流式细胞仪的分析功能基础上结合了高性能荧光显微镜的图像数据,可以实现流式数据的形态学验证。
流式细胞仪全面讲解

流式细胞仪入门----- 秦华 译目录前言第1章综述第2章液流系统第3章散射光信号及荧光信号3.1 散射光信号3.2 荧光信号第4章光电系统4.1 光平台4.2 光学滤片4.3 信号探测器4.4 阀值第5章数据分析5.1 数据采集及显示5.2 设门5.3 细胞亚群的数据分析5.4 流式细胞仪其它应用的数据分析第6章分选6.1 分选第7章激光器及光路校正7.1 激光器的工作原理7.2 光路校正第8章习题答案序论学习仪器的最好方法是操作仪器,然而在理解原理的基础上进行仪器操作无疑会起到事半功倍的作用。
本书介绍了流式细胞仪的基本知识,并从不同角度详尽阐述了各种台式机(FACScan TM,FACSort TM,FACSCalibur TM,和BD LSR)与大型机(FACS Vantage TM,FACSVantage TM SE,和FACStar PLUSTM)之间的不同,且附习题及答案。
阅读本书有助于增强读者操作仪器的动手能力和经验。
第一章综述流式细胞术是一项快速检测分析单个粒子多物理特性的高技术,通常指细胞通过激光束时在液流中的特性,即粒子的大小,密度或是内部结构,以及相对的荧光强度。
通过光电系统记录细胞的散射光信号和荧光信号可得知细胞特性。
流式细胞仪主要由三部分组成:流动室和液流系统;光路系统以及电系统。
其作用如下:z液流系统:依次传送待测样本中的细胞到激光照射区。
z光路系统:细胞由激光激发,通过光学滤片产生光信号,并传送到相应的探测器。
z电系统:把光信号转换为电信号。
对于有分选装置的仪器,电系统可初始化分选条件。
在流式细胞仪中,细胞被传送到液流中的激光照射区。
任何存在于悬液中的直径为0.2-150微米的粒子或细胞都适用于流式分析。
在实际工作中,用实体组织进行流式细胞分析往往是不可能的,分析之前必须对其进行分解。
被液滴包绕的粒子称为细胞液柱,当粒子经过激光照射区时,通过激光激发产生散射光。
含有荧光的粒子就会表现出其荧光特性。
流式细胞术原理笔记

流式细胞术原理笔记这⼏天学习了⼀下流式细胞术,资料来源是BD公司的宣传册,记了⼀些关于原理的笔记。
学完之后,我的理解就是,流式细胞术来检测细胞类型的原理类似于聚类分析。
细胞种类多,⽽不同种类之间则有区别,每⼀类细胞都有N个参数,⽽流式细胞术就是检测这些参数,把检测的结果呈现出来供⼈们分析,在分析时就可以把拥有相同或相似参数的细胞给划为⼀类。
⽽这⾥的参数主要就是荧光信号以及细胞的体积等固有信号,前者是⽤荧光染料标记的,后者则是细胞固有的。
1. 流式细胞术⽹上查到的有两个英⽂缩写,⼀个是Flow Cytometry,缩写为FCM,翻译应为流式细胞术;另外⼀个是Fluorescence-Activated Cell Sorting,缩写FACS,翻译为荧光激活细胞分拣术。
2. 流式细胞仪的基本结构⼀般分为部分:光学系统、液流系统、检测与数据处理系统、细胞分选系统(有的没有)。
FCM原理图3. 光学系统作⽤:主要为激光,检测荧光信号与散射光信号。
这⾥的过程是激光照射到已⽤荧光素标记的细胞上,细胞激发荧光信号,这个时候的荧光信号是混合的,包含各个波长的信号,再经过⼀系列透镜将混合的信号⼀个个分离出来,通过PMT(光电倍增管)来处理。
4. 液流系统:包括鞘液与流动室。
液流系统4.1 鞘液:⽆荧光本底的平衡电解质溶液,鞘液是⽤以辅助样本流被正常检测的基质液。
主要作⽤是包裹样本流的周围,与其呈层流状态,其中鞘液流速固定,⽽样品流速可调,样本流中细胞处于喷嘴中⼼位置,防⽌其靠近孔壁⽽阻塞喷孔。
鞘液与样品液的组成类似于剑鞘,"鞘"即装剑的套⼦,在外层,鞘液就是如此,剑就是含有细胞的样品。
鞘液作⽤有三:(1)约束样品位于喷嘴中⼼,提⾼测量精度;(2)防⽌样品靠近喷嘴壁,避免堵塞喷嘴;(3)鞘液成分类似于活细胞⽣存内环境,有利于保持细胞的活性状态。
4.2 流动室:被测样品在此与激光相交。
流动室由⽯英玻璃钢制成,并在⽯英玻璃中央开⼀孔径为 430×180µm 的长⽅形孔,供细胞单个流过,当经荧光染⾊或标记的单细胞悬液放⼊样品管中,被⾼压压⼊流动室内。
血液科医生常说的“流式”到底是什么?

⾎液科医⽣常说的“流式”到底是什么?流式是什么?临床常说的“流式”是流式细胞术(flow cytometry)的简称,因其检测在液体中移动的细胞或粒⼦⽽得名。
具体来说,单个细胞悬液中加⼊⼀个或多个荧光标记的抗体,抗体通过抗原抗体反应与细胞上的抗原结合。
在流式细胞仪中,细胞在鞘液中单个流动,就像红细胞单个通过⽑细⾎管⼀样通过检测⼝,仪器发出⼀个或多个激光束激发标记在细胞上的荧光物质。
从荧光物质发出的光被收集、分离、检测,其数据被传输到控制流式细胞仪的计算机供分析。
流式的临床应⽤在临床上,流式细胞术被⽤于精确检测异常细胞群,如对⾎液系统肿瘤进⾏诊断和分型,或在HIV感染时检测CD4 T淋巴细胞。
流式细胞术也可⽤于检测⽣理过程,例如移植前⼲细胞计数(CD34阳性细胞计数)或组织相容性测试。
流式为什么能够检测疾病?在正常细胞分化成熟过程中,不同的抗原会在其表⾯或内部出现或消失,通过检测这些抗原的存在或缺失,我们能够确定细胞的种类和发育阶段。
这些在⽩细胞表⾯的抗原,⼜称为⽩细胞分化抗原或簇分化抗原 (cluster of differentiation, CD)。
疾病情况下,例如⽩⾎病时,本来数量很少或本不应该出现的原始细胞,⼤量出现在⾻髓或外周⾎中,通过检测这些细胞CD分⼦表达情况,可以准确知道这些细胞的类型,以便进⾏诊断和治疗。
临床常⽤的CD分⼦见下表(Biomedical Uses of Flow Cytometry. James L. Weaver and Maryalice Stetler-Stevenson From: Molecular Biomethods Handbook, 2nd Edition. Edited by: J. M. Walker and R. Rapley ©Humana Press, Totowa, NJ 1039)。
流式的优点是什么?流式最⼤的优点就是特异性和敏感性都很好,并且检测起来速度很快。
流式细胞术的基本理论

第一节流式细胞术的基本理论节概述流式细胞术是一种对悬液中单个细胞或细胞器、质点进行快速测量和自动分析的高新技术。
该技术的特点是:测量速度快,每秒钟能测量上千个细胞,它不仅可以进行多参数相关测量,而且还可以把指定特征的细胞亚群从整个细胞群中分离出来。
本节主要介绍流式细胞仪的光学及工作原理。
知识点导航1.工作原理流式细胞仪主要由流动室及液流系统、激光器及光学系统、光电管及检测系统、计算机及分析系统四个部分组成如图17-1。
图17-1 流式细胞仪的工作原理图待测细胞被制备成单细胞悬液,经特异性荧光染料染色后置于专用样品管中,在气体压力作用下被压入流动室,流动室内充满鞘液,在鞘液作用下,细胞排成单列,沿液流的轴心一个接一个地从流动室下端的喷嘴喷出,形成细胞液柱。
液柱与高度聚焦的激光束垂直相交,细胞受到激光激发产生荧光信号和散射光信号,这些光信号通过相应的光电管和检测器被接收并转换成电信号,经放大器放大后送入计算机并进行分析显示和结果输出。
2.光学原理流式细胞仪的光学系统由激光器和若干组透镜、滤光片及小孔组成,它们分别将不同波长的荧光信号送入到不同的电子探测器。
其主要光学元件是分色反射镜(DL)和滤光片(filter),它们一般分为三类:长通滤片(long pass filter,LP)、短通滤片(short pass filter,SP)和带通滤片(band pass filter,BP)。
(1)分色反射镜(488DL、 550DL、 600DL、640DL)用于选择被测荧光波长,只允许大于特定波长的光通过,而将小于特定波长的光反射到光电检测器。
(2)长通滤片只允许特定波长以上的光通过,特定波长以下的光不能通过。
如LP620 nm滤片,只允许620 nm以上的光通过,而620 nm以下的光吸收或返回。
(3)短通滤片与长通滤片相反,允许特定波长以下的光通过,而特定波长以上的光吸收或返回。
(4)带通滤片(488BP、525BP、575BP、675BP)允许某一特定波长的光线通过,而其他波长的光全部被阻断。
流式基本原理
Volume 细胞数量r Pulled (mL) 样本体积 (mL) Cells x103/mL
60,827
308.1
2,100
4.15
1,154
308.1
2,100
0.08
26,618
308.1
2,100
1.81
2,478
308.1
2,100
0.17
正常范围 0.8 - 5.0 0.1 - 1.0 1.4 - 7.5 0.0 - 0.4
3,流式细胞术原理–细胞周期
• DNA量的周期变化检测----核酸染料标记(如PI) • 特异周期调节蛋白检测----如CDK(细胞周期蛋白
依赖的激酶)、CKI(CDK抑制剂)等。
4,细胞周期-实例
细胞周期实验: PI的DNA染色
方法: Jurkat cells were treated with either DMSO (Control; <2%) or HU-331, an apoptosis inducing cannabinoid (5 mg/mL), Cayman Chemical Company, for 6 hours. Cells were then fixed and stained with Accuri Cell Cycle Phase Determination Kit (KR-300).
FSC vs. SSC
单一平台下的细胞计数
CD45 vs. SSC
CD45 vs. SSC
Granulocytes
Eosinophils
Platelets
Monocytes Lymphocytes
计算每毫升原始血液样本中四种不同细胞群的绝对细胞数量
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
一步一步学流式第一篇:流式细胞术的历史概要说来,流式细胞术主要包括了样品的液流技术、细胞的分选和计数技术,以及数据的采集和分析技术等。
FCM目前发展的水平凝聚了半个世纪以来人们在这方面的心血和成果。
1934年,Moldavan1首次提出了使悬浮的单个血红细胞等流过玻璃毛细管,在亮视野下用显微镜进行计数,并用光电记录装置计测的设想,在此之前,人们还习惯于测量静止的细胞,因为要使单个细胞顺次流过狭窄管道容易造成较大的细胞和细胞团块的淤阻。
1953年Crosland –Taylor根据雷诺对牛顿流体在圆形管中流动规律的研究认识到:管中轴线流过的鞘液流速越快,载物通过的能力越强,并具有较强的流体动力聚集作用。
于是设计了一个流动室,使待分析的细胞悬浮液都集聚在圆管轴线附近流过,外层包围着鞘液;细胞悬浮液和鞘液都在作层液。
这就奠定了现代流式细胞术中的液流技术基础。
1956年,Coulter在多年研究的基础上利用Coulter效应生产了Coulter 计数器。
其基本原理是:使细胞通过一个小孔,只在细胞与悬浮的介质之间存在着导电性上的差异,便会影响小孔道的电阻特性,从而形成电脉冲信号,测量电脉冲的强度和个数则可获得有关细胞大小和数目方面的信息。
1967年Holm等设计了通过汞弧光灯激发荧光染色的细胞,再由光电检测设备计数的装置。
1973年Steinkamp设计了一种利用激光激发双色荧光色素标记的细胞,既能分析计数,又能进行细胞分选的装置。
这样就基本完成了现代FCM计数技术的主要历程。
现代的FCM数据采集和分析技术是从组织化学发源的,其开拓者是Kamentsky。
1965年,Kamentsky在组织化学的基础上提出了两个新设想:(1)细胞的组分是可以用光光度学来定量测定的,即分光光度术可以定量地获得有关细胞组织化学的重要信息。
(2)细胞的不同组分可以同时进行多参数测量,从而可以对细胞进行分类。
换句话说,对同一细胞可以同时获得有关不同组分的多方面信息,用作鉴别细胞的依据。
流式细胞术在细胞化学中的应用的先驱者是Van Dilla和美国的Los Alamos小组。
他们在1967年研制出流液束、照明光轴、检测系统光轴三者相互正交的流式细胞计的基础上,首次用荧光Feulgen反应对DNA染色显示出DNA的活性与荧光之间存在着线性关系,并在DNA的直方图上清楚地显示出细胞周期的各个时相。
Gohde 和Dittrich接着把这项技术推向实用,他们用流式细胞术测定细胞周期借以研究细胞药代动力学问题。
FCM用于免疫组织化学中的关键是对细胞进行免疫荧光染色,其它和在细胞化学的应用并没有多大差异。
(下图为一DNA直方图)DNA直方图第二篇:流式细胞仪的工作原理将待测细胞染色后制成单细胞悬液。
用一定压力将待测样品压入流动室,不含细胞的磷酸缓冲液在高压下从鞘液管喷出,鞘液管入口方向与待测样品流成一定角度,这样,鞘液就能够包绕着样品高速流动,组成一个圆形的流束,待测细胞在鞘液的包被下单行排列,依次通过检测区域。
流式细胞仪通常以激光作为发光源。
经过聚焦整形后的光束,垂直照射在样品流上,被荧光染色的细胞在激光束的照射下,产生散射光和激发荧光。
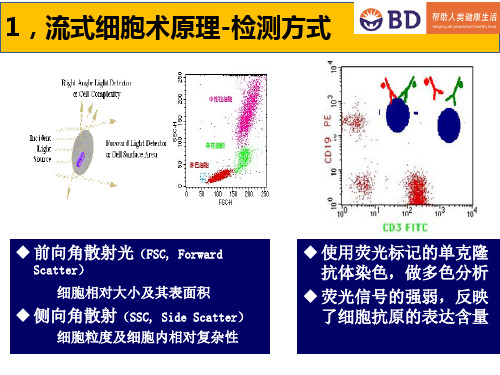
前向角散射,即FSC与细胞直径平分正相关,所以我们平时上机的时候,有时用FSC做阈值,排除碎片及其它颗粒,避免干扰。
侧向角散射,即SSC是指与激光束正交90度方向的散射信号,它对细胞膜、胞质、核膜的折射率更敏感,可以提供细胞内结构及颗粒性质的信息!因此,仅根据FSC/SSC,我们就可以分开全血样本中的淋巴细胞,单核细胞和中性粒细胞!这两种信号同时被前向光电二极管和90°方向的光电倍增管接收。
光散射信号在前向小角度进行检测,这种信号基本上反映了细胞体积的大小;荧光信号的接受方向与激光束垂直,经过一系列双色性反射镜和带通滤光片的分离,形成多个不同波长的荧光信号。
这些荧光信号的强度代表了所测细胞膜表面抗原的强度或其核内物质的浓度,经光电倍增管接收后可转换为电信号,再通过模/数转换器,将连续的电信号转换为可被计算机识别的数字信号。
计算机把所测量到的各种信号进行计算机处理,将分析结果显示在计算机屏幕上,液可以打印出来,还可以数据文件的形式存储在硬盘上以备日后的查询或进一步分析。
(下图为光学系统)检测数据的显示视测量参数的不同由多种形式可供选择。
单参数数据以直方图的形式表达,其X轴为测量强度,Y轴为细胞数目。
一般来说,流式细胞仪坐标轴的分辨率有512或1024通道数,这视其模数转换器的分辨率而定。
对于双参数或多参数数据,既可以单独显示每个参数的直方图(histogram),也可以选择二维的散点图(dot plot)、等高线图(contour)或三维立体视图(pseudo 3D散点图及三维立体图细胞的分选是通过分离含有单细胞的液滴而实现的。
在流动室的喷口上配有一个超高频电晶体,充电后振动,使喷出的液流断裂为均匀的液滴,待测定细胞就分散在这些液滴之中。
将这些液滴充以正负不同的电荷,当液滴流经带有几千伏特的偏转板时,在高压电场的作用下偏转,落入各自的收集容器中,不予充电的液滴落入中间的废液容器,从而实现细胞的分离。
也就是高中学过的带电粒子在电场中运动的原理!补充细节1:关于荧光素荧光信号主要包括两部分:①自发荧光,即不经荧光染色细胞内部的荧光分子经光照射后所发出的荧光;②特征荧光,即由细胞经染色结合上的荧光染料受光照而发出的荧光,其荧光强度较弱,波长也与照射激光不同。
自发荧光信号为噪声信号,在多数情况下会干扰对特异荧光信号的分辨和测量。
在免疫细胞化学等测量中,对于结合水平不高的荧光抗体来说,如何提高信噪比是个关键。
一般说来,细胞成分中能够产生的自发荧光的分子(例核黄素、细胞色素等)的含量越高,自发荧光越强;培养细胞中死细胞/活细胞比例越高,自发荧光越强;细胞样品中所含亮细胞的比例越高,自发荧光越强。
减少自发荧光干扰、提高信噪比的主要措施是:①尽量选用较亮的荧光染料;②选用适宜的激光和滤片光学系统;③采用电子补偿电路,将自发荧光的本底贡献予以补偿。
当应用流式细胞术对细胞表面或内部抗原进行检测时,除必要的抗体外,应用各种荧光素也是必不可少的,它包括单标记抗体荧光索、双标记抗体荧光素、三标记抗体荧光素等。
荧光素发射荧光基本原理是:荧光素受到一定波长(激发波长)的激光激发后,其原子核外的电子由于吸收了激光的能量,由原本运动处于基态轨道跃迁到激发态轨道上运动,然后当电子由激发态重新回到基础态时,释放出能量并发射出一定波长(发射波长)的荧光。
不同荧光素用不同的激发光波长的激发光来激发,所以要选择正确的激光器。
例如,FITC和FE等的微发光波长均为488nm,所以可用产生可见光的氩离子激光器,而APC和PC5等的激发波长在红光范围,需使用发射630nm波长红光的氦—氖激光器。
此外,各种荧光素的发射波长也十分重要,可以据此确定其检测所需光电倍增管性质。
如FITC,被激光激发后发射绿光,检测时要使用第一光电倍增管(即PMTl);PE则发射橙包光,需用第二光电倍增管(即PMT2);PC5和PcrCP等发射的是深红色光,这时需选择第二甚至第四光电倍增管(即PMT3或PMT4)等。
一定要注意激发波长和发射波长的区别!常用荧光素流式细胞仪测定常用的荧光染料有多种,他们分子结构不同,激发光谱和发射光谱也各异,选择荧光染料时必须依据流式细胞仪所配备的激光光源的发射光波长(如氩离子气体激光管,它的发射光波488ηm,氦氖离子气体激光管发射光波长633ηm)。
488ηm激光光源常用的荧光染料有FITC(异硫氰酸荧光素)、PE(藻红蛋白)、PI(碘化丙啶)、CY5(化青素)、preCP(叶绿素蛋白)、ECD(藻红蛋白-得克萨斯红)等。
他们的激发光和发射光波长分别是:激发光波长(ηm)发射光峰值(ηm)FITC 488 525(绿)PE 488 575(橙红)PI 488 630(橙红)ECD 488 610(红)CY5 488 675(深红)PreCP 488 675(深红)FITC和PIPI和EB 都具有嵌入到双链DNA和RNA的碱基对中并有与碱基对结合的特异性。
为了获得特异的DNA分布,染色前必须用RNA酶处理细胞,排除双链RNA的干扰。
PI和EB不能进入完整的细胞膜,因此又可以用于检测死细肥。
PI 和EB各种理化性质相似,但PI比EB的发射光光谱峰向长波方向移动,因而在作DNA和蛋白质双参数测量时,PI的红色荧光和FITC的绿色荧光更易于区分和测量。
另外,Pl比EB测得的DNA分布的变异系数(CV值)低,所以PI得到更广泛的应用。
FITC 为一种小分子荧光素,其效率(即荧光强度)取决于溶液的pH值,因此在使用FITC时应注意溶液的酸碱度。
一些流式常用名字的概念和意义:(E文版)Amplifier 放大器Electronic component of a flow cytometer that increases the signal by an adjustable factor.Aneuploid 异倍体Having an abnormal number of chromosomes. Aneuploid cells may also have an abnormal DNA content.Average The mean value, which is the total amount divided by the number of contributors.Channel 常说的荧光道数The measured value of a parameter, representing the signal intensity of an event after amplification. To appear on a plot, data for an event must fall into one of either 256 channels (0-255) or one of 1024 channels (0-1023) depending on the resolution of the plot.Compensation (荧光)补偿An electronic calculation that removes signal overlap which the optical system cannot remove. Fluorescence compensation works for specific pairs of fluorescent parameters; for example, FL1 and FL2.Cursor For FACScans: a highlight appearing in a data field that indicates you can modify this field. On a dot plot, a crosshair for drawing a polygon gate. On other flow cytometers: a line separating regions on single parameter histograms that are treated statistically separate. See marker.%CV CV值!表示其集中分散趋势。
