硫酸头孢匹罗申报资料4号
注射用硫酸头孢匹罗申报资料 第三部分:药理毒理研究资料 注射用硫酸头孢匹罗申报资料16号

注射用硫酸头孢匹罗申报资料第三部分:药理毒理研究资料注射用硫酸头孢匹罗申报资料16号
化学药品6类
第三部分药理毒理资料资料编号16
注射用硫酸头孢匹罗
药理毒理研究资料综述
研究机构:**********药业股份有限公司
研究机构地址:
研究机构电话:
资料整理人:
完成日期:2004年10月
原始资料保存处:
联系人:
联系人电话:
药品注册申请人名称:**********药业股份有限公司
化学药品6类注射用硫酸头孢匹罗申报资料16号注射用硫酸头孢匹罗药理毒理研究资料综述
一、主要药效、一般药理、急性毒性、长期毒性等资料详见原料药16号资料。
二、注射用硫酸头孢匹罗局部毒理资料综述
1.溶血试验
注射用硫酸头孢匹罗与2%兔红细胞混悬液温育,对家兔红细胞无溶血及凝聚作用,符合静脉注射用安全性检查的要求。
2. 血管刺激试验
注射用硫酸头孢匹罗静脉多次推注本品对家兔血管无明显刺激反应,表明注射用硫酸头孢匹罗血管刺激试验符合规定。
3. 过敏试验
注射用硫酸头孢匹罗,对豚鼠致敏攻击后,阳性率为0,表明该药过敏试验符合规定。
1。
硫酸头孢匹罗合成工艺的研究资料及文献资料(1
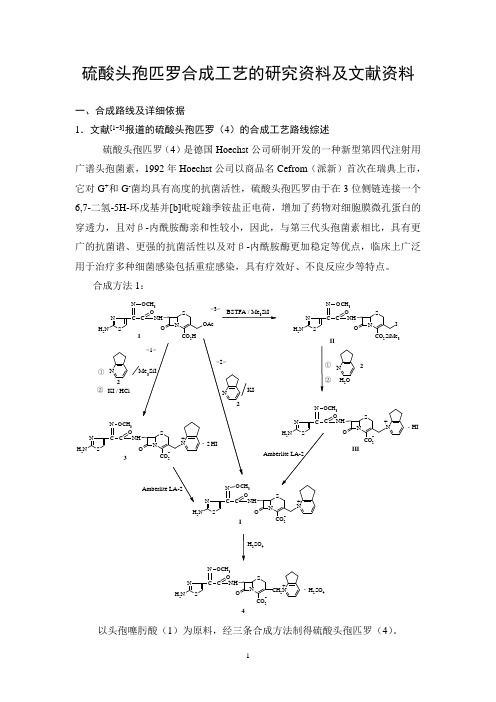
硫酸头孢匹罗合成工艺的研究资料及文献资料一、合成路线及详细依据1.文献[1~3]报道的硫酸头孢匹罗(4)的合成工艺路线综述硫酸头孢匹罗(4)是德国Hoechst 公司研制开发的一种新型第四代注射用广谱头孢菌素,1992年Hoechst 公司以商品名Cefrom (派新)首次在瑞典上市,它对G +和G -菌均具有高度的抗菌活性,硫酸头孢匹罗由于在3位侧链连接一个6,7-二氢-5H-环戊基并[b]吡啶鎓季铵盐正电荷,增加了药物对细胞膜微孔蛋白的穿透力,且对β-内酰胺酶亲和性较小,因此,与第三代头孢菌素相比,具有更广的抗菌谱、更强的抗菌活性以及对β-内酰胺酶更加稳定等优点,临床上广泛用于治疗多种细菌感染包括重症感染,具有疗效好、不良反应少等特点。
合成方法1:H 2SO 4CH 3S N O CO 2HNH CN SNH 2C NO O OAcCH 3SNOCO 2SiMe 3NHC N SNH 2C NOO IOH 2CH 3-S NOCO 2NH N SNH 2C N CO O NCH 3-CH 2NS NOCO 2NHN SNH 2C N C OO H 2SO 4CH 3-NS NOCO 2NH C N OO3N Me CH 32N SNH 2C NCOO N 1IIIII3+4KI / HCl+. 2+. H I①②I2以头孢噻肟酸(1)为原料,经三条合成方法制得硫酸头孢匹罗(4)。
<1>法:(1)在三甲基碘硅烷催化下,与6,7-二氢-5H-环戊基并[b]吡啶(2)反应生成季铵盐,再与KI/HCl 反应生成头孢匹罗二氢碘酸盐(3),3经阴离子交换树脂Amberlite LA-2中和得头孢匹罗(I ),I 与硫酸反应生成硫酸头孢匹罗(4)。
<2>法:(1)在碘化钾催化下,与6,7-二氢-5H-环戊基并[b]吡啶(2)反应生成头孢匹罗(I ),I 成盐得硫酸头孢匹罗(4)。
<3>法:(1)与BSTFA 、Me 3SiI 反应生成3-碘甲基-4-羧酸酯(II ),II 与6,7-二氢-5H-环戊基并[b]吡啶(2)反应生成季铵盐,再水解得头孢匹罗一氢碘酸盐(III ),III 经Amberlite LA-2中和、硫酸成盐得硫酸头孢匹罗(4)。
注射用硫酸头孢匹罗申报资料第四部分:临床研究资料注射用硫酸头孢匹罗申报资料28号

化学药品6类第四部分临床研究资料资料编号28注射用硫酸头孢匹罗国内外相关的临床研究资料综述研究机构:**********药业股份有限公司研究机构地址:研究机构电话:资料整理人:完成日期:2004年10月原始资料保存处:联系人:联系人电话:药品注册申请人名称:**********药业股份有限公司注射用硫酸头孢匹罗国内外相关的临床研究资料综述头孢匹罗抗菌谱广,抗菌活性强,特别适用于中性粒细胞减少患者的感染、下呼吸道严重感染、败血症、菌血症、上下尿道并发感染及皮肤和软组织感染。
一组3761例世界范围的临床疗效对照试验,全面观察了头孢匹罗的临床疗效及细菌学疗效,其中,2335例使用头孢匹罗,1409例使用对照药[1],见表1。
表1 头孢匹罗与其它药物的疗效比较对照试验结果表明头孢匹罗的临床疗效和细菌学有效率与β-内酰胺类抗生素相似甚至优于β-内酰胺类抗生素。
对11名妇科感染(子宫附件炎、子宫内膜炎、子宫旁炎、盆腔腹膜炎、直肠子宫炎,前庭大腺脓肿)患者使用头孢匹罗,1-2g/d,疗程3-7天,结果表明,临床有效率为100%,细菌清楚率为92.3%。
而对15名子宫附件炎、子宫内膜炎、小骨盆感染或前庭大腺脓肿患者使用头孢匹罗,0.5-1g,每日2次,疗程3-9天,临床证实全部有效,7株分离菌中有6株被清除。
对13名妇科感染患者使用头孢匹罗,1-2g/d,疗程5-10天,其临床有效率为100%,9株分离菌全部杀死。
在对241名妇科小骨盆炎患者临床试验中,比较头孢匹罗和头孢西丁的临床疗效,结果表明,头孢匹罗的临床有效率为91%,头孢西丁的临床有效率为89%,细菌复发率分别为6%和5%[2]。
头孢匹罗在儿科中的应用,选择457例(包含3例夹杂其它感染疾病)和243例患儿进行临床研究评价,显效率94.1%,有效率95.3%,同时发现头孢匹罗对G+ 菌感染包括金黄色葡萄球菌有效率达95%,对G-菌疗效达95.7%,对其它各种细菌有效率为94.4%。
注射用硫酸头孢匹罗申报资料 第一部分:综述资料 注射用硫酸头孢匹罗申报资料4号

注射用硫酸头孢匹罗申报资料第一部分:综述资料注射用硫酸头孢匹罗申报资料4号化学药品6类第一部分综述资料资料编号4注射用硫酸头孢匹罗对主要研究结果的总结及评价研究机构:**********药业股份有限公司研究机构地址:研究机构电话:资料整理人:完成日期:2004年10月原始资料保存处:联系人:联系人电话:药品注册申请人名称:**********药业股份有限公司注射用硫酸头孢匹罗对主要研究结果的总结及评价一、药学研究总结1.处方及制备工艺1) 处方硫酸头孢匹罗1190g无水碳酸钠242g共制成1000支2) 制备工艺a、无菌无水碳酸钠的制备取无水碳酸钠,加30~40℃的注射用水,搅拌溶解得饱和溶液(1g无水碳酸钠,加水3ml),无菌条件下用0.22µm微孔滤膜除菌过滤,蒸去大部分水,析出大量的无水碳酸钠结晶,冷却后过滤,将所得到的固体于300℃干燥2小时,得无菌无水碳酸钠固体,无菌包装,经检验合格后备用。
b、分装硫酸头孢匹罗与无水碳酸钠的混合物在无菌配料间里,按处方配比称取无菌硫酸头孢匹罗、无水碳酸钠,过80~100目筛,混和均匀,分装,封口,即得。
经过处方筛选、工艺筛选及影响因素试验确定了处方与工艺,进行了工艺验证、工艺放大及初步质量评价,确认了处方及工艺是合理可行的。
2.质量研究研究了本品的鉴别(包括化学鉴别、高效液相色谱、硫酸盐、钠盐鉴别),检查(包括有关物质、pH值、干燥失重、溶液的颜色与澄清度、装量差异、无菌和细菌内毒素及异常毒素),含量测定等方法。
建立了本品的质量标准草案。
3.稳定性研究按照新药审批办法要求对本品进行了稳定性试验。
(1)对试制样品进行光照、高温、高湿等影响因素实验,结果表明:经光照10天后,外观明显变化,有关物质略有增加,含量略有下降,表明强光照射对本品稳定性有影响,故应遮光保存。
本品在高温下存放10天后,样品的外观、水份、有关物质、含量等各项指标有较明显变化,表明高温60℃对本品的稳定性有影响,宜存放于阴凉处。
注射用硫酸头孢匹罗申报资料第二部分:药学研究资料注射用硫酸头孢匹罗申报资料13号

化学药品6类第二部分药学研究资料资料编号13注射用硫酸头孢匹罗辅料来源与质量标准研究机构:**********药业股份XX研究机构地址:研究机构:试验负责人:试验参加者:试验日期:2004年1月至2004年3月原始资料保存处:联系人:__药品注册申请人名称:**********药业股份XX注射用硫酸头孢匹罗辅料来源与质量标准辅料来源:自制。
由分析纯无水碳酸钠经处理并按自拟定的质量标准检验符合规定后制得。
后附:质量标准、检验报告及参考资料。
质量标准(草案)无水碳酸钠TansuannaSodium carbonateNa2CO3106.0 本品含Na2CO3应为99.5—100.5%。
【性状】本品为白色或类白色细颗粒粉末;有吸湿性。
本品在水中易溶解,在乙醇中不溶。
【鉴别】本品的水溶液显钠盐与碳酸盐的鉴别反应(中国药典2000年版二部附录Ⅲ)。
【检查】溶液的澄清度与颜色取本品1.0 g,加水20m1溶解后,溶液应澄清;如显色,与黄色1号标准液(中国药典2000年版二部附录ⅥA第一法)比较,不得更深。
氢氧根碱和碳酸氢盐取本品0.4g,加水20 m1使溶解,加20 m1氯化钡试液,滤过,取滤液10 m1,加酚酞指示液1 m1,溶液不得变红;将上述滤液加热至沸2分钟,溶液应澄清。
氯化物取本品1.5g,加水溶解使成25 m1,滴加盐酸使成微酸性,置水浴中加热以除尽二氧化碳,放冷,依法检查(中国药典2000年版二部附录Ⅷ A),与标准氯化钠溶液3.0 ml制成的对照液比较,不得更浓(0.002%)。
硫酸盐取本品3.0g,加水溶解使成40 m1,滴加盐酸使成微酸性,置水浴中加热以除尽二氧化碳,放冷,依法检查(中国药典2000年版二部附录Ⅷ B),与标准硫酸钾溶液溶液1.5 ml制成的对照液比较,不得更浓(0.005%)。
铵盐取本品1.0g ,加氢氧化钠试液10m1,加热,发生的蒸气遇湿润的红色石蕊试纸不得变蓝色。
注射用硫酸头孢匹罗申报资料 第二部分:药学研究资料 注射用硫酸头孢匹罗申报资料8号

注射用硫酸头孢匹罗申报资料第二部分:药学研究资料注射用硫酸头孢匹罗申报资料8号化学药品6类第二部分药学研究资料资料编号8注射用硫酸头孢匹罗制剂处方及生产工艺的研究资料及文献资料研究机构:**********药业股份有限公司研究机构地址:研究机构电话:试验负责人:试验参加者:试验日期:2004年1月至2004年4月原始资料保存处:联系人:联系人电话:药品注册申请人名称:**********药业股份有限公司注射用硫酸头孢匹罗制剂处方及生产工艺的研究资料及文献资料1.处方与制备工艺1.1 处方硫酸头孢匹罗 1190g无水碳酸钠 242g1000支1.2制备工艺1.2.1无菌无水碳酸钠的制备取无水碳酸钠,加30~40℃的注射用水,搅拌溶解得饱和溶液(1kg无水碳酸钠,加水3L),加入0.05%针用活性炭,升高温度至70-80℃并保温30分钟,脱炭;无菌条件下先用0.80µm微孔滤膜过滤,再用0.22µm微孔滤膜除菌过滤;蒸去大部分水,析出大量的碳酸钠结晶,冷却后过滤,将所得到的固体于300℃干燥2小时,得无菌无水碳酸钠固体,无菌包装,经检验合格后备用。
1.2.2分装硫酸头孢匹罗与无水碳酸钠的混合物在无菌配料间里,按处方配比称取无菌硫酸头孢匹罗、无水碳酸钠,过80~100目筛,混和均匀,分装,封口,即得。
2.处方依据、规格2.1规格依据本品参照日本藤沢药品工业株式会社的产品“Keiten®”而制定的,每瓶头孢匹罗0.5g、1.0g,本品为硫酸头孢匹罗和无水碳酸钠的无菌混合物。
由于本品成人通常用为每日1~2g,分二次静脉注射,所以本品暂确定申报1.0g规格,以后可根据临床需要增加规格。
2.2处方依据与筛选过程本品处方依据日本藤沢药品工业株式会社的产品“Keiten®”使用说明书中所提供的处方资料确定的。
由于本品为无菌分装产品,主要对无菌粉末进行物理化学性质测定,来制定合理的制备工艺。
注射用硫酸头孢匹罗申报资料10号

化学药品6类第二部分药学研究资料资料编号10注射用硫酸头孢匹罗质量研究工作的试验资料及文献资料研究机构:**********药业股份有限公司研究机构地址:研究机构电话:试验负责人:试验参加者:试验日期:2004年3月至2004年5月原始资料保存处:联系人:联系人电话:药品注册申请人名称:**********药业股份有限公司注射用硫酸头孢匹罗质量研究工作的试验资料及文献资料1 理化性质1.1 样品来源制剂来源:本公司制剂室1.2 制剂规格本品为硫酸头孢匹罗和无水碳酸钠的无菌混合物,含头孢匹罗1.0g。
1.3 性状所制得注射用硫酸头孢匹罗样品均为类白色结晶性粉末。
2 鉴别2.1 高效液相色谱法含量测定项下记录的色谱图中供试品主峰的保留时间与对照品主峰的保留时间一致。
试验结果:检验本品三批,色谱图见附图1~4,结果如下表所示。
从色谱图中可见,供试品主峰的保留时间与注射用硫酸头孢匹罗对照品主峰的保留时间一致,结果见表1。
表1 三批样品及对照品主峰的保留时间测定结果2.2 取本品20mg,加水20ml溶解加入盐酸羟胺(1→10)1ml及氢氧化钠试液2ml,放臵5分钟后,加入盐酸试液3ml及三氯化铁试液3滴,溶液呈红褐色。
2.3 取本品适量,加稀酸,即泡沸,发生二氧化碳,导入氢氧化钙试液中,即生成白色沉淀。
2.4 本品的水溶显硫酸盐的鉴别反应(《中国药典》2000年版二部附录Ⅲ)。
2.5 本品显钠盐的火焰反应(《中国药典》2000年版二部附录Ⅲ)。
3 检查3.1 有关物质采用HPLC法测定本品中的有关物质。
3.1.1 仪器系统色谱柱(250×4.6mm,5μm)。
岛津SCL-10AVP高效液相色谱仪,Diamonsil TM C183.1.2 试剂乙腈(色谱纯,Merck)磷酸(分析纯,天津市化学试剂三厂)三乙胺(分析纯,天津市化学试剂三厂)磷酸二氢铵(分析纯,北京化学试剂公司)3.1.3 色谱条件的确立3.1.3.1 流动相的选择参考本品原料的有关物质测定方法,以十八烷基硅烷键合硅胶为填充剂,磷酸二氢铵0.02mol/L溶液(用磷酸调节PH值为3.3)-乙腈(90:10),保留时间适合,峰型对称,分离度好,杂质得以充分分离,可用于有关物质测定。
注射用硫酸头孢匹罗申报资料 第二部分:药学研究资料 注射用硫酸头孢匹罗申报资料11号

注射用硫酸头孢匹罗申报资料第二部分:药学研究资料注射用硫酸头孢匹罗申报资料11号化学药品6类第二部分药学研究资料资料编号11注射用硫酸头孢匹罗药品标准草案及起草说明研究机构:**********药业股份有限公司研究机构地址:研究机构电话:试验负责人:试验参加者:试验日期:2004年3月至2004年6月原始资料保存处:联系人:联系人电话:药品注册申请人名称:**********药业股份有限公司注射用硫酸头孢匹罗质量标准(草案)注射用硫酸头孢匹罗Zhusheyong Liusuan ToubaopiluoCefpirome Sulfate for Injection本品为硫酸头孢匹罗加适量无水碳酸钠制成的无菌粉末,按平均装量计算,含头孢匹罗(C22H22N6O5S2)应为标示量的90.0%~110.0%。
【性状】本品为类白色至微黄色结晶性粉末。
【鉴别】(1)取本品(约含相当于硫酸头孢匹罗)20mg,加水20ml溶解,加入盐酸羟胺(1→10)1ml及氢氧化钠试液2ml,放置5分钟后,加入盐酸试液3ml及二氯化铁试液3滴,溶液呈红褐色。
(2)在含量测定项下记录的高效液相色谱图中,供试品主峰的保留时间应与硫酸头孢匹罗对照品主峰的保留时间一致。
(3)取本品适量,加稀酸,即泡沸,发生二氧化碳,导入氢氧化钙试液中,即生成白色沉淀。
(4)本品的水溶液呈硫酸盐的鉴别反应(中国药典2000年版二部附录Ⅲ)。
(5)本品显钠盐的火焰反应(《中国药典》2000年版二部附录Ⅲ)。
【检查】酸度取本品适量,加水制成每1ml中(约含相当于头孢匹罗)10mg的溶液,依法测定(中国药典2000年版二部附录VI H),pH值应为5.5~7.0。
溶液的澄清度与颜色取本品,加水制成每1ml中(约含相当于头孢匹罗)10mg的溶液,溶液应澄清与1号标准液(中国药典2000年版二部附录ⅪB)比较,不得更浓;若显色,与8号标准液(中国药典2000年版二部附录ⅪA第一法)比较,不得更深。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
化学药品3类第一部分综述资料资料编号4硫酸头孢匹罗对主要研究结果的总结及评价研究机构:**********药业股份有限公司研究机构地址:研究机构电话:试验负责人:资料整理人:完成日期:2004年10月原始资料保存处:联系人:联系人电话:药品注册申请人名称:**********药业股份有限公司硫酸头孢匹罗对主要研究结果的总结及评价硫酸头孢匹罗(Cefpirome Sulfate)于1992年在墨西哥和瑞典上市,商品名Cefrom。
目前已在全球近20个国家上市。
我国于1999年进口注射用硫酸头孢匹罗。
2001年,德国安万特制药股份有限公司在我国获硫酸头孢匹罗静脉注射剂(商品名:派新)的行政保护权,2004年4月26日终止行政保护。
本品在中国无专利保护,故开发本品不存在侵权问题。
头孢匹罗作为第四代头孢类抗生素,其抗菌作用更强,抗菌谱更广,并且维持有效血药浓度的时间更长,市场潜力巨大。
它通过增强细菌外膜的穿透力,对内酰胺酶稳定以及靶位蛋白亲和力强,避免了细菌耐药性,从而提高抗菌效力。
本品已在国外上市销售但尚未在国内上市销售,根据新药注册管理办法(国家药品监督管理局令第35号,2002年12月1日施行)的有关规定,本品的原料药属于化学药品3.1情况,按照申报要求,我们进行了大量的研究工作。
总结如下:1. 安全性评价1.1 主要药效头孢匹罗抗G+菌的作用强于头孢噻肟、头孢他啶、头孢替安;抗肺炎链球菌的作用比孢他啶、头孢替安强16-32倍;但抗肺炎杆菌、雷氏普罗威登斯菌活性高于头孢他啶、头孢替安4-8倍;抗大肠埃希杆菌、阴沟肠杆菌、弗罗因德氏枸橼酸杆菌、摩根氏菌、不动杆菌活性比头孢噻肟、头孢他啶、头孢替安强2-256倍。
头孢匹罗、头孢他啶对金黄色葡萄球菌的MBC分别为0.78ug/ml和12.5ug/ml,对绿脓假单胞菌的MBC分别为3.13 ug/ml和1.56 ug/ml。
头孢匹罗对肠埃希杆菌和粘质沙雷菌的杀菌能力比头孢他啶强。
研究头孢抗菌素对β-内酰胺酶细菌的抗菌作用试验,由于头孢匹罗受β-内酰胺酶的影响较小,对阴沟肠杆菌、弗罗因德枸橼酸杆菌、粘质沙雷菌的抗菌作用强,而头孢噻肟、头孢他啶和头孢替安受阴沟肠杆菌和弗罗因德枸橼酸杆菌产生的β-内酰胺酶的影响,抗菌能力大大降低。
用10只全身感染的ICR小鼠比较抗生素的体内抗菌能力,试验表明头孢匹罗有治疗作用。
对金黄色葡萄球菌引起的感染头孢匹罗的ED50为0.37mg/ml,并且抗菌作用比头孢噻肟、头孢哌酮高8-9倍,比头孢他啶强30倍;对大肠埃希杆菌、肺炎杆菌引起的感染,头孢匹罗的抗菌作用比头孢噻肟、头孢他啶、头孢哌酮强30倍,而对绿脓假单胞菌引起的感染,头孢匹罗的抗菌活性比头孢噻肟、头孢哌酮强,但比头孢他啶弱,经过两次给药后,其抗菌作用等同于头孢他啶。
1.2 一般药理观察药物对神经系统、循环系统、消化系统及血液的影响,发现给药量为250mg/kg对自发运动量、抗痉挛作用、排尿、血小板凝集没有影响;给药量为500mg/kg对自律神经系统、消化系统、坐骨神经腓肠肌、血糖、血液凝固无影响;给药量为1250mg/kg轻度增强睡眠、镇静作用,不引起体温变化;给药量为10-4mol/L能轻度缓解催产素收缩作用和对自动收缩力的抑制;给药量10-4g/ML 对红细胞膜抵抗力、横膈膜神经肌肉无影响;动物在麻醉状态下给药量为207mg/kg血压降低,心搏出量、末梢血管阻力减少;动物在麻醉状态下给药量为500mg/kg血压降低,心搏数减少、呼吸量增加;动物在麻醉状态下给药量为200mg/kg血压升高,心搏数增加。
1.3 急性毒性静脉给药高剂量注射后,小鼠轻者立即出现竖尾、全身发抖,重者四肢抽搐,呼吸急促,小便失禁。
死亡多发生在3-5分钟内。
低剂量注射后未见异常反应,亦无死亡。
死亡鼠尸检心、肝、脾、肺、肾等主要脏器,肉眼观察未见异常。
小白鼠静脉给予硫酸头孢匹罗后测得的LD50为2933.4 (2707.5-3175.6)mg/kg。
腹腔给药15min后,小鼠出现竖尾、全身发抖,活动减少,静卧,呼吸微弱。
严重者2小时后呼吸困难而死亡,死亡多发生在24h内。
48h后存活小鼠逐渐恢复正常。
死亡鼠尸检心、肝、脾、肺、肾等主要脏器,肉眼观察未见异常。
腹腔给予硫酸头孢匹罗后测得的LD50为5236.1(4767.1-5733.8)mg/kg。
1.4 长期毒性小鼠的亚慢性毒性试验结果表明头孢匹罗的肾毒性较低,给药剂量在800-1500mg/kg/d小鼠的肾功能出现损伤,进行组织学检查未见其改变,只在400mg/kg/d和1600mg/kg/d组的小鼠出现可逆性蛋白尿。
在小鼠的慢性毒性试验中,出现了与其它头孢菌素相似的溶酶体数量增多,体积增大的现象(可逆的)。
高剂量组动物出现了红细胞、血红素、血细胞比容减少,但在恢复期后又恢复到正常水平。
在试验中观察到小鼠的盲肠增大,这与毒理学无关。
肝脏重量增加,但未发现肝的病理学变化。
头孢匹罗没有直接对甲状腺细胞产生毒副作用,但能引起甲状腺的可逆性功能损伤,总体上说甲状腺的活性没有被减弱,而且甲状腺的改变仅仅在给药后,出现在高剂量组动物身上,对病人来说,这种危险不太可能出现。
1.5 致突变培养细胞染色体畸变检测试验和啮齿类动物微核试验的研究结果表明头孢匹罗没有诱变性。
1.6 生殖毒性通过腹腔静脉给药,按200-800mg/kg/d时,在大鼠的妊娠前初期、器官形成期、围产期、授乳期和按12.5-50mg/kg/d在家兔器官形成期,药物对生殖能力、妊娠、分娩、哺乳、新生儿未见影响;对幼年雄性大鼠,通过皮下给药200-1000mg/kg/d,对生殖能力,精子状态无影响。
2 有效性评价一组3761例世界范围的临床疗效对照试验,全面观察了头孢匹罗的临床疗效及细菌学疗效,其中,2335例使用头孢匹罗,1409例使用对照药[1],见表1。
表1 头孢匹罗与其它药物的疗效比较对照试验结果表明头孢匹罗的临床疗效和细菌学有效率与β-内酰胺类抗生素相似甚至优于β-内酰胺类抗生素。
对11名妇科感染(子宫附件炎、子宫内膜炎、子宫旁炎、盆腔腹膜炎、直肠子宫炎,前庭大腺脓肿)患者使用头孢匹罗,1-2g/d,疗程3-7天,结果表明,临床有效率为100%,细菌清楚率为92.3%。
而对15名子宫附件炎、子宫内膜炎、小骨盆感染或前庭大腺脓肿患者使用头孢匹罗,0.5-1g,每日2次,疗程3-9天,临床证实全部有效,7株分离菌中有6株被清除。
对13名妇科感染患者使用头孢匹罗,1-2g/d,疗程5-10天,其临床有效率为100%,9株分离菌全部杀死。
在对241名妇科小骨盆炎患者临床试验中,比较头孢匹罗和头孢西丁的临床疗效,结果表明,头孢匹罗的临床有效率为91%,头孢西丁的临床有效率为89%,细菌复发率分别为6%和5%[2]。
头孢匹罗在儿科中的应用,选择457例(包含3例夹杂其它感染疾病)和243例患儿进行临床研究评价,显效率94.1%,有效率95.3%,同时发现头孢匹罗对G+ 菌感染包括金黄色葡萄球菌有效率达95%,对G-菌疗效达95.7%,对其它各种细菌有效率为94.4%。
临床试验对其它抗生素不敏感的135例中头孢匹罗对126例为显著疗效或有效,有效率高达93.3%[3]。
试验中发现,头孢匹罗对胃肠道,心血管和中枢神经系统的不良反应很小,主要出现腹泻,心慌,恶心呕吐等症状,对酒精代谢及造血系统无影响[2];实验室检查出现GOT、GOT、总胆红素、肌酸酐、嗜酸性白细胞升高,副作用及异常值在用药期间就可恢复到正常水平[3]。
3 质量可控性评价合成路线:硫酸头孢匹罗的合成是从头孢噻肟酸开始,先与3位侧链2,3-环戊烯并吡啶缩合得头孢匹罗氢碘酸盐,然后与硫酸成盐即得硫酸头孢匹罗。
结构确证:按照硫酸头孢匹罗分子式C22H22N6O5S2.H2SO4计算,C、H和N元素分析的实验结果表明样品的组成与理论值相符。
经红外吸收光谱、紫外吸收光谱、核磁共振谱、质谱、热分析等检测及X-射线衍射分析,所得图谱均能得到合理分析,综合解析证明样品即为硫酸头孢匹罗。
质量研究工作:对本品外观进行了观察,测定了本品的引湿性、溶解度、比旋度、吸收系数。
以红外、HPLC、硫酸盐的鉴别反应、β-内酰胺化合物的鉴别反应作为鉴别;检查了本品的水分、炽灼残渣、重金属、PH、澄清度与颜色、无菌和细菌内毒素及异常毒性、干燥失重及残留溶剂。
用HPLC 归一法检查本品的有关物质,以HPLC外标法测定本品含量;根据以上研究结果制定了质量标准。
对试制样品进行光照、高温、高湿等影响因素实验,结果表明:经光照、高温(60℃)10天后,样品外观变化明显,有关物质增加,含量下降,表明强光照射、高温对本品稳定性有影响。
高湿条件下,样品的外观变化明显,水分增加,有关物质略有增加,含量略有下降,表明高湿对本品的稳定性和质量略有影响。
故本品应遮光,密封,在阴凉干燥处保存。
三批样品在模拟上市包装下加速试验6个月(40℃、RH 75%条件下),样品外观发生变化,有关物质略有增加,含量略有下降,表明样品已部分降解,故本品在密封条件下对湿热较敏感,但皆符合质量标准草案。
三批样品在模拟上市包装条件下,经25℃长期留样考察6个月,样品的有关物质有所增加、含量有所下降,但皆符合质量标准草案。
样品在6个月时有关物质已接近质量标准(草案)上限,含量接近质量标准(草案)下限。
经在冷处2℃~8℃的条件下存放长期留样考察9个月后,各项考察指标无明显变化,均符合质量标准草案,表明模拟上市包装的硫酸头孢匹罗在冷处2℃~8℃的条件下存放比较稳定。
上述研究结果表明硫酸头孢匹罗的质量是可控的。
【参考文献】[1] 陈晖等,头孢匹罗的抗菌作用与临床疗效。
国外医药抗生素分册,1995,1,16(1):37-41。
[2]任志远等。
国外医药抗生素分册2000,9,21(5):222-224。
[3] 周延安,蔡鸿生。
头孢匹罗在儿科应用的评价。
医药导报,1994,13(1):16-17。
