固体的结构与性质
无机化学——固体的结构和性质

7.1.4 Vitreous body(玻璃体) 非晶态物质:结构无序(近程可能有序)的固体物质
801℃ ; Al2O3: 2045 ℃ Crystals have anisotropy (各向异性)
graphite 导电性;从不同方向观察红宝石或蓝宝石,会发 现宝石的颜色不同,这是由于方向不同,晶体对光的吸收性 质不同。
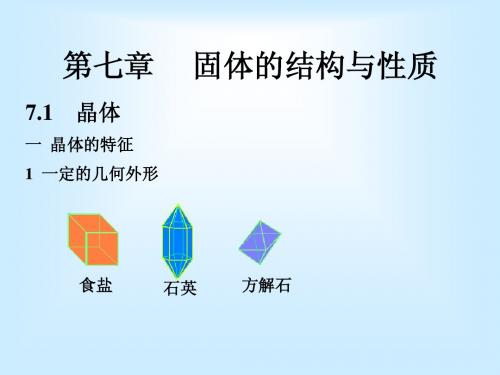
Crystalline and Amorphous ● 晶体的三大特征 1、一定的外形 2、固定的熔点 3、有各向异性。
●非晶体:玻璃,松香,石蜡,沥青等无固定外形。
●单晶(single crystal)与多晶(polycrystal)的区别:某些固 体表面上看不是晶体,结构分析仍是由极小的晶体组成的称 为微晶(minicrystal)、混晶(mixed crystal)或多晶。
●晶体与非晶体可在一定条件下互相转化。如石英玻璃。
●液晶([liquid crystal])是一类特殊的晶体,有机物质熔化后 在一定温度范围内的部分长程有序,介于液态和晶态之间的 各向异性。
●晶态比非晶态稳定 非晶态本质上是一种亚稳态,如弹性硫。
7.1.1 Crystalline and Amorphous Solids(晶体和非晶体) Solids may be either crystalline or amorphous. Crystalline solids have well-defined, regular shapes, but amorphous solids do not.
无机化学第七章固体的结构与性质

ZnS型 同质多晶现象:
高温晶下胞:N正aC立l型方形
化学组成相同而晶阳体离构子型配不位同数的:现4象
阴离子配位数:4
S2- Zn2+
例 BeO、ZnSe
7-2-3 离子晶体的稳定性
离子晶体的晶格能
晶格能——标准态下,拆开1mol离子晶体 变为气态离子所需吸收的能量
NaCl(s)
7-1-1 离子晶体的特征和性质
晶体 结点粒 粒子
类型 子种类 间作 一般性质 物质示例
用力
离子 阳、阴 晶体 离子
静电 引力
熔点较高、 活泼金属 略硬、脆, 氧化物、
熔体、溶液易导电 盐类
NaF Na+、F-
硬度2~2.5, 熔点993℃
MgF2 Mg2+、F-
F- _
Na+
_
+ _ +
硬_ 度+5, +_ _+
H 5 = -U = ? , NaCl 的晶格能 U 的相反数;
Na ( s ) H 1
Na ( g ) H 3
熔点_12+61℃_
+
_+ _ _+ _
+ + +
7-2-2 离子晶体中最简单的结构类型
AB型:NaCl型、 CsCl型、立方ZnS型
NaCl型
晶格类型:面心立方
Cl- 阳离子配位数:6 Na+ 阴离子配位数:6
例 KI、LiF、NaBr、 MgO、CaS
CsCl型
Cl- Cs+
ZnS型
S2- Zn2+
在加热时,由开始软化到完全熔化, 整 个过程中温度不断变化。
化学实验教案固体的结构与性质

化学实验教案固体的结构与性质化学实验教案:固体的结构与性质引言:固体是我们日常生活中常见的物质状态之一。
不同固体的结构与性质会对其化学性质、物理性质和应用产生重要影响。
本实验旨在通过实验操作,研究不同固体的结构与性质的关系,深化对固体基本概念的理解,并培养学生观察、记录和分析实验数据的能力。
实验材料:- 实验装置:烧杯,试管,酒精灯,玻璃滴管,试剂瓶等。
- 实验药品:氯化钠、硫酸铜、石碱、氯化铅等。
- 实验器具:移液管、酒精灯、显微镜等。
实验目的:1. 了解固体的基本概念和性质。
2. 研究不同固体的结构对性质的影响。
实验步骤:步骤一:氯化钠的结构与性质1. 取一定量的氯化钠放入烧杯中。
2. 加入适量的水,充分搅拌,观察氯化钠在水中的溶解现象。
3. 用试纸测定溶液的酸碱性质。
4. 使用显微镜观察溶液中的晶体结构。
步骤二:硫酸铜的结构与性质1. 取一定量的硫酸铜放入试管中。
2. 用酒精灯将试管加热,观察硫酸铜的颜色变化。
3. 使用显微镜观察加热后的硫酸铜颗粒的结构。
步骤三:石碱的结构与性质1. 取一定量的石碱放入烧杯中。
2. 加入适量的酸,观察石碱与酸反应的现象。
3. 用试纸测定反应产物的酸碱性质。
步骤四:氯化铅的结构与性质1. 取一定量的氯化铅放入试管中。
2. 使用显微镜观察氯化铅颗粒的结构。
3. 将试管加热,观察氯化铅在加热后的变化。
实验结果与分析:1. 氯化钠在水中溶解后形成透明的溶液,并呈现碱性。
显微镜下观察到晶体结构。
2. 硫酸铜加热后颜色变深,表明有结构或化学反应发生。
显微镜下观察到颗粒形状的变化。
3. 石碱与酸反应产生气体,并呈现酸性。
反应后产物的酸碱性质与反应前的石碱不同。
4. 氯化铅在加热后发生颜色变化,并形成新的固体产物。
结论:1. 固体的结构与性质密切相关,不同固体表现出不同的结构与性质。
2. 结构决定性质,固体的化学性质和物理性质与其结构有关。
3. 通过观察实验现象、结果和显微镜下的结构,可以帮助我们深入理解固体的结构与性质关系。
固体的结构与性质

固体的结构与性质固体是物质的一种基本状态,其结构和性质对于我们理解和应用物质至关重要。
本文将从固体的结构与性质两个方面进行探讨,帮助读者深入了解固体的特点和相关知识。
一、固体的结构固体是由原子、离子或分子组成的,其内部结构紧密有序。
常见的固体结构有晶体和非晶体两类。
1. 晶体结构晶体是由规则重复排列的三维晶体格点构成的。
按照晶格的形状分类,晶体又可分为立方晶系、四方晶系、六方晶系、正交晶系、单斜晶系和三斜晶系六类。
晶体结构的特点包括:(1)周期性:晶体结构呈现规律的重复性,几何形状具有对称性。
(2)硬度:晶体由于内部原子、离子或分子的结合力较强,因此常具有较高的硬度。
(3)透明性:某些晶体的结构对入射光具有高度的吸收和散射,从而使得它们呈现出透明的性质。
2. 非晶体结构非晶体没有明确的晶体结构,其原子、离子或分子的排列形式是无序的、杂乱的。
非晶体的特点包括:(1)无规则性:非晶体内部原子、离子或分子无明显的规律性排列,呈现无序状态。
(2)随机性:在非晶态下,固体的物理性质随着组成成分的变化呈现连续性、可调节性。
(3)折射性:非晶体对光的折射性较强,使得它们呈现出不透明的特征。
二、固体的性质固体的性质是其结构特点所决定的,在以下几个方面表现出差异:1. 密度不同结构的固体具有不同的密度。
在一定温度和压力下,晶体的密度较大,而非晶体的密度较小。
这是因为晶体的有序排列使得原子、离子或分子之间的间隙较小,而非晶体中的无序性使得间隙较大。
2. 热导率晶体的热导率一般较高,是因为晶体中原子、离子或分子的排列紧密有序,传热路径较短。
非晶体由于其无序性,传热路径较长,因此热导率较低。
3. 电导率根据固体中携带电荷的粒子类型和可移动性的不同,固体的电导率表现出多样性。
金属固体因其自由电子的存在具有优良的导电性;离子晶体由于离子在结构中的周期性排列具有较高的电离度和离子迁移性;而非金属固体的电导率则相对较低。
4. 弹性固体的弹性是指其在受力作用下产生的变形和恢复的能力。
无机化学-第七章固体的结构与性质

H 6
NaCl ( s ) H 5
Na + ( g ) +
Cl- ( g )
H 6 = f HmӨ = - 410.9 kJ·mol-1 ,NaCl的标准生成热。
由盖斯定律 H 6 = H 1 + H2 + H 3 + H 4 + H 5
所以
H 5 = H 6 - ( H1 + H 2 + H 3 + H 4 )
H 2 = 1/2 D = 119.7 kJ·mol-1 ,Cl 2 ( g ) 的离解能 D
的一半; 2021/5/31
无机化学
Na ( s ) + 1/2 Cl2 ( g )
H 1 Na ( g )
H 2 Cl ( g )
H 3
H 4
Na + ( g ) +
Cl- ( g )
H 6
NaCl ( s ) H 5
a, b, c 为六面体 边长, α, β, γ 分别是bc , ca, ab 所组成的夹 角。
晶胞在三维空间中的无限重复排列
晶格
晶体
晶胞参数 差异
七种晶系
七种晶系的性质
晶系 立方晶系 四方晶系 六方晶系 菱形晶系 正交晶系 单斜晶系 三斜晶系
七种晶系
边长
a=b=c a = b≠c a = b≠c a=b=c a≠b≠c a≠b≠c a≠b≠c
给抽象的结果赋予实质性内容,即将 晶体的结构单元置于晶格的节点上,就是 晶体。
在晶体有规律的排列中,可以找到代 表晶体结构的最小的平行六面体单位,即 晶胞。
单晶体和多晶体
单 晶 体 晶 体 多 晶 体
固体理论知识点总结

固体理论知识点总结1. 固体的结构固体的结构是固态理论研究的重要内容之一。
固体的结构可以分为晶体和非晶体两种。
晶体是一种有序排列的固体,其中原子或分子以一定的规则排列,使得晶格结构具有周期性。
晶体的结构可以被描述为晶格和基元的组合。
晶格是空间中一组平行排列的点,在每个点上放置着一个基元,即晶体的最小重复单元。
晶体的结构可以根据晶格的对称性分为立方晶系、四方晶系、六角晶系、正交晶系、单斜晶系和三斜晶系六种。
非晶体是一种没有规则排列的固体,其中原子或分子的排列没有周期性,呈现出无序的结构。
非晶体的结构通常被描述为玻璃态或凝胶态。
2. 固体的性质固体的性质是由其结构和相互作用力决定的。
固体的性质包括机械性能、导电性、磁性、光学性质等。
其中,机械性能是固体最基本的性质之一,包括硬度、弹性模量、屈服强度等。
导电性是固态物理学中的重要研究内容,固体的导电性与其电子结构和晶格结构密切相关。
磁性是固态物理学中另一个重要的性质,固体的磁性可以分为铁磁性、反铁磁性、顺磁性和抗磁性四种。
光学性质是固体的另一个重要性质,包括折射率、吸收系数、反射率等。
3. 固体的相互作用固体中原子或分子之间存在着多种相互作用力,包括离子键、共价键、金属键、范德华力等。
离子键是一种电子转移的化学键,它是正离子和负离子之间的相互吸引力。
共价键是一种共享电子的化学键,它是由两个原子之间的电子共享所形成的化学键。
金属键是金属原子之间的一种特殊相互作用力,它是由金属原子之间的自由电子形成的。
范德华力是分子之间的一种弱相互作用力,它是由分子之间的瞬时偶极子相互作用所形成的力。
4. 固体的缺陷固体中存在着各种各样的缺陷,包括点缺陷、线缺陷、面缺陷等。
点缺陷是由于晶格中一个或多个原子的缺失或额外存在而形成的缺陷,包括空位缺陷、间隙缺陷、固溶体等。
线缺陷是由于晶体中晶格排列出现错误而形成的缺陷,包括蠕滑位错、螺位错、边界位错等。
面缺陷是由于晶格中晶面的形成而引起的缺陷,包括晶界、晶粒边界、孪晶界等。
固体的结构与性质

固体的结构与性质固体是物质存在的一种状态,其分子或原子以固定的位置排列,相互间具有一定的结构和性质。
本文将探讨固体的结构特征以及对其性质的影响。
一、晶体结构晶体是固体中最有序、结构最规则的形态。
晶体的结构由重复排列的单位结构单元组成,这些结构单元通过晶体内部的转换与堆积形成整齐的晶体结构。
1. 点阵结构晶体结构的基本特征是点阵结构,即离子、分子或原子在晶体中以一定的法则排列。
常见的点阵结构包括立方晶系、四方晶系、正交晶系、斜方晶系、六方晶系和三斜晶系等。
2. 晶体面及晶胞晶体面指晶体的各个表面,其位置由晶胞决定。
晶胞是晶体中最小的结构单位,由一定数量的晶体面组成。
不同晶体的晶胞形状和大小各异,反映了各自的晶体结构。
3. 空间群空间群是描述晶体点阵结构的数学概念,它由旋转、平移、镜像操作和点群对称等元素组成。
空间群的不同反映了晶体的对称性,对晶体的性质和应用具有重要的影响。
二、非晶态结构非晶态是一种无典型结构的固体形态,其原子或分子排列无序。
非晶态是具有熵增益的形态,因而具有较高的熔点和较大的硬度。
非晶态结构的形成与快速冷却或高压下的固化有关。
1. 玻璃态玻璃是一种典型的非晶态结构,具有无序排列的原子或分子。
玻璃的制备通常通过快速冷却,使晶体无法形成有序结构,从而呈现出非晶态特征。
玻璃具有良好的透明性、热稳定性和化学稳定性。
2. 聚合物非晶态聚合物在液态聚合过程中,由于聚合物链的缩短和杂乱的分子运动,导致聚合物呈现无序排列的非晶态结构。
聚合物非晶态结构的形成直接影响了聚合物的物理性质、力学性能和热稳定性。
三、结构与性质的关系固体的结构直接影响其性质,不同结构的固体表现出不同的物理、化学性质。
以下是几个典型的例子。
1. 晶体的硬度晶体的硬度与其晶体结构以及离子或分子间的相互作用力有关。
通常,离子键和共价键较强,因此具有离子结构或共价结构的晶体通常比分子结构的晶体硬度更高。
2. 聚合物的弹性聚合物的结构对其弹性和可塑性起着关键作用。
固体的性质与结构

固体的性质与结构一、固体的定义与特点1.定义:固体是一种物质状态,具有固定的形状和体积,分子间相互作用力较强。
2.特点:固体分子的运动范围有限,排列有序,密度大,稳定性好。
二、固体的结构1.晶体结构:具有规则的几何外形,分子排列有序,如金属、食盐等。
2.非晶体结构:没有规则的几何外形,分子排列无序,如玻璃、塑料等。
三、固体的性质1.密度:单位体积内物质的质量,反映了固体的紧密程度。
2.硬度:固体抵抗外力压缩的能力,反映了分子间的相互作用力。
3.熔点:固体转变为液体的温度,与分子间的相互作用力有关。
4.沸点:固体转变为气体的温度,与分子间的相互作用力有关。
5.导电性:固体导电的能力,与自由电子的多少有关。
6.导热性:固体导热的能力,与分子间的相互作用力有关。
7.延展性:固体抵抗拉伸的能力,与分子间的相互作用力有关。
四、固体的分类1.金属固体:具有良好的导电性、导热性和延展性,如铜、铁、铝等。
2.非金属固体:如食盐(氯化钠)、白糖(蔗糖)等。
3.有机固体:如塑料、橡胶等。
五、固体的应用1.建筑材料:如水泥、砖块、钢材等。
2.电子元件:如半导体材料、集成电路等。
3.日常生活用品:如瓷器、玻璃等。
4.医药领域:如药物制剂、生物材料等。
六、固体的研究方法1.实验观察:通过实验现象来研究固体的性质与结构。
2.理论分析:运用物理学、化学等知识来解释固体的性质与结构。
3.技术手段:如X射线衍射、电子显微镜等,用于观察固体微观结构。
通过以上介绍,希望你对固体的性质与结构有更深入的了解。
在今后的学习和生活中,你可以不断探索和发现固体世界的奥秘。
习题及方法:1.习题:固体的定义是什么?请简述其特点。
方法:回顾课本中关于固体的定义和特点的描述,提取关键信息。
答案:固体的定义是具有固定的形状和体积的物质状态,其特点是分子间相互作用力较强,分子的运动范围有限,排列有序,密度大,稳定性好。
2.习题:晶体的结构具有哪些特点?请举例说明。
固体的结构与性质实验报告

固体的结构与性质实验报告实验目的:探究固体的结构与性质之间的关联,并分析实验数据得出结论。
实验材料:1. 硫酸铁(III)晶体2. 硫酸铜结晶3. 碘晶体4. 钠晶体5. 锌晶体6. 磷酸二氢氨铜(II)晶体7. 纸张8. 水杯9. 显微镜10. 试管11. 试管架12. 烧杯13. 实验台14. 草图纸实验步骤:1. 将硫酸铁(III)晶体置于试管中,用显微镜观察晶体的形态、大小和颜色,并记录在草图纸上。
2. 将硫酸铜结晶放入烧杯中,加入适量的水搅拌溶解,然后观察溶液的颜色变化,并记录下来。
3. 在另一个烧杯中放入碘晶体,加入少量的酒精,观察晶体的溶解过程,并记录观察到的现象。
4. 用钳子夹住一个钠晶体,将其放入水杯中,观察钠的性质,并记录下来。
5. 取一根锌棒,将其轻轻擦在纸张上,观察到的现象并记录。
6. 在试管中放入磷酸二氢氨铜(II)晶体,加入适量的水,观察溶液的颜色变化,并记录。
实验结果与分析:1. 硫酸铁(III)晶体常见为橙红色晶体,呈长方体状,结晶体间排列有序。
2. 硫酸铜结晶溶解后,溶液呈淡蓝色,表明硫酸铜溶解时离子分散在溶液中。
3. 碘晶体加入酒精中溶解,观察到碘晶体逐渐消失,表明碘分子在酒精中发生了离子化作用。
4. 钠放入水中,迅速发生剧烈的气化反应,同时放出氢气,钠的性质较为活泼。
5. 锌棒擦在纸张上,纸张的颜色转变为灰黑色,表明锌发生氧化反应产生氧化锌。
6. 磷酸二氢氨铜(II)晶体溶解后,溶液呈淡绿色,说明磷酸二氢氨铜(II)离子分散在溶液中。
结论:通过以上实验,我们可以得出以下结论:1. 固体的结构与性质密切相关。
硫酸铁(III)晶体、硫酸铜结晶和磷酸二氢氨铜(II)晶体的离子以无序的方式分散在溶液中,而碘和锌晶体的分子则发生了化学反应或氧化作用。
2. 固体的性质受其原子、分子或离子的活性影响。
钠晶体具有较高的活性,能与水反应产生氢气;锌则参与氧化反应生成氧化锌。
3. 固体溶解过程中,溶解度和颜色变化可以用来间接反映固体结构和性质的差异。
无机化学课件:第七章 固体的结构与性质
三态:玻璃态、高弹态、粘流态
石英玻璃:
石英玻璃: SiO2
石英光导纤维
非晶态高分子化合物
三态:玻璃态、高弹态、粘流态
玻璃态(常温下塑料) 温度很低时,线性高分子、链节都不能 运动,如同玻璃体一般坚硬。
线性高分子
高弹态(常温下橡胶)
温度升高到一定程度时,整个链还不能 运动,但其中链节可以自由运动了。 表现出很高的弹性。
用途: 耐磨材料,耐火材料,半导体材料。
二、分子晶体
分子晶体:晶格节点上排列着极性或非极性共价分子,分 子间以分子间作用力或氢键结合形成的晶体。
性质:分子晶体物质一般熔点低、硬度小、易挥发, 熔融不导电。(强极性除外)
物质:一般为非金属元素组成的共价化合物。
如:SiX4,H2O,CO2,SF6,I2等。 CO2晶体 面心立方晶格
等属此列。
3、立方ZnS型 晶胞也是正立方体,
ห้องสมุดไป่ตู้
配位数均为4,如BeO、ZnSe
离子晶体为什么会有 不同的空间构型?
CsCl型
这主要由正、负离子的半径比( r+ / r- )决定。
r+ / r-增大 , 则 C.N. 增大; r+ / r- 减小 , 则 C.N. 减小。
离子晶体空间构型除了与 r+ / r- 有关外 ,还与离子的电子构型、离子互相极化 作用以至外部条件(如温度)等有关。
四、非晶体
1、概述
微粒无序排列,无规则几何外形 无一定熔点。
射频等离子体化学气相沉积 Ge 、Si、α-Si:H、GaAs等
较
传统玻璃:硅酸盐【Na2SiO3、CaSiO3、SiO2或Na2O·CaO·6SiO2
固体与液体知识点总结

固体与液体知识点总结一、固体的性质和结构1. 固体的性质固体具有以下一些基本性质:(1) 形状稳定:固体的分子间有较强的相互作用力,使得固体具有固定的形状和体积。
(2) 不易压缩:由于固体分子间的排列比较密实,所以固体的体积很难被改变,即固体不易被压缩。
(3) 定形定容:固体分子间的相互作用力很大,所以固体的分子基本处于固定的位置,这样使得固体具有定形定容的特点。
(4) 有一定的硬度:固体由于分子排列牢固,所以具有一定的硬度,不易变形。
2. 固体的结构固体的结构可以分为晶体和非晶体两类。
晶体是由周期排列的离子、原子或分子组成,这种结构是有规则的、有序的。
而非晶体是由无序排列的离子、原子或分子组成,这种结构是无规则的、无序的。
晶体的结构又可分为离子晶体、共价晶体和金属晶体等不同类型,每种类型的晶体都有其特有的结构和性质。
非晶体则是因为其原子或分子排列是无序的,所以无固定的结构和性质。
二、液体的性质和结构1. 液体的性质液体具有以下一些基本性质:(1) 体积不定形:液体的分子间受到一定的相互作用力,使得液体具有一定的粘滞性,所以液体的体积不定形。
(2) 定容不定形:液体具有一定的粘滞性和流动性,所以液体的形状不固定但体积固定,具有定容不定形的特性。
(3) 可压缩:液体相对于固体来说,由于其分子间作用力较小,液体具有一定的压缩性。
(4) 无一定的形状和容积:液体的分子排列比较紧密,所以无一定的形状和容积。
2. 液体的结构液体的结构是由无序排列的离子、原子或分子组成,这种结构是无规则的、无序的。
液体的分子排列常常具有一定的规则,但整体上并没有固定的结构。
三、固液相转化1. 固液相转化的条件固液相转化是指物质从固态转化为液态或从液态转化为固态的过程。
固液相转化的条件主要包括温度和压力两个方面。
当物质的温度高于其熔点时,固体会转化为液体;当物质的温度低于其凝固点时,液体会转化为固体。
在一定的压力条件下,物质的固液相转化温度也是固定的,这就是物质的熔点和凝固点。
固体的三大特性

固体的三大特性固体世界里的物理性质是非常复杂的,但固体作为一种物质,其特性仍可归纳为三大特性。
首先,固体有结构,也就是它们具有一定的形状和尺寸。
其次,固体有弹性,它们有能力抵抗外力,保持自身尺寸稳定不变,此外它们也不易受外力的影响而改变形状或尺寸。
最后,固体有密度,也就是它们单位体积中所包含的质量数量,是指一体积物质的质量。
首先,固体具有结构特性,也就是它们具有一定的形状和尺寸。
在物理世界里,固体可以分为气体、液体和固体三种不同物质,其中,固体是由一些原子或分子组成的,分子在宇宙中存在一定的空间排列顺序,因此形成一个固定的结构,而这种结构就是固体的形状和尺寸。
其次,固体具有弹性特性,也就是它们有能力抵抗外力,保持自身尺寸稳定不变,此外它们也不易受外力的影响而改变形状或尺寸。
物理学上,弹性是指物质对外力变化作出反应,使物质回到其原始状态,也就是说,当外力消失时,物质能恢复原有形状和尺寸。
固体具有很强的弹性,它们可以保持其形状和尺寸的稳定性,如同一块金属放在砧板上,受到外力撞击后,能恢复原有形状,此外,它们也不易受外力的影响而改变形状或尺寸。
最后,固体具有密度特性,也就是它们单位体积中所包含的质量数量。
物理学上,密度是指单位体积内的物质质量,是由一体积物质的质量和体积所决定,也就是说,单位体积内物质所含的质量是固定的。
由于固体都具有固定的形状和尺寸,因此,可以根据固体的体积和质量来计算它的密度,公式为:密度=物质质量/物质体积。
从固体的密度可以看出,它们单位体积中所包含的质量数量,从而可以帮助我们深入了解它们的性质。
综上所述,固体具有结构、弹性和密度三大特性,这三种特性是它们具有一定形状和尺寸,有能力抵抗外力,保持自身尺寸稳定不变,也不易受外力的影响而改变形状或尺寸,以及单位体积中所包含的质量数量所决定的。
因此,我们可以根据这三种特性来了解固体的性质,进一步研究它们的物理性质。
固体的结构与热力学性质

固体的结构与热力学性质固体是物质存在的一种形态,固体的热力学性质与其结构密切相关。
在热力学中,固体有其特有的性质,如定容热容、热膨胀系数等。
而这些性质又与固体的构成、结构有着紧密的联系。
本文将从固体结构的角度来探讨固体的热力学性质。
晶体结构与热力学性质晶体是固体中的一种重要形态。
晶体由相同的基本结构单元组成,一般来说晶体结构具有非常好的规则性和对称性。
晶体的密度、热容等性质与晶体的结构密切相关。
以体心立方晶格为例,体心立方晶格中原子的密度最大,而热容也相对较大。
这是因为体心立方晶格的原子最靠近中心,原子间作用力最强。
原子间作用力越强,晶体的结合能越大,这也就意味着晶体的热容、热膨胀系数等热力学性质越高。
晶体的对称性也对其热力学性质产生影响。
晶体对称性越高,热容就越小,热膨胀系数也越小。
这是因为对称性高的晶体不易产生畸变,晶格结构更加稳定,因此热容、热膨胀系数等也就更小。
例如,氧化铝晶体的对称性比较高,因此其热容比其他物质低得多。
非晶态结构与热力学性质与晶体不同,非晶态结构的物质中不存在规则的结晶结构,其原子排列是无序的。
因此,非晶态结构的物质其热力学性质也与晶体的不同。
以非晶态金属为例,其热膨胀系数较大,这是因为其内部没有明确的原子排列规则,因此容易受到温度的影响,容易膨胀。
而且,由于其结构杂乱无章,其热容也较大,这表明其结构较不稳定。
材料的缺陷对热力学性质的影响材料的缺陷也对其热力学性质产生影响。
材料中可能存在各种缺陷,如空位、夹杂、晶界、位错等。
这些缺陷均会对材料的热力学性质产生影响。
例如,晶界是晶体中相邻晶粒之间的交界面,由于晶界的存在,晶体中存在一定的结构杂乱程度,从而导致晶体的热容、热导率等热力学性质会发生变化。
总之,固体的结构对其热力学性质是有着重要影响的。
不同结构的固体其热力学性质也会有所不同。
对于材料科学工作者来说,更深入地了解固体结构以及固体热力学性质之间的关系是非常必要的。
固体的结构与性质
二 晶体的内部结构 1 晶格 把晶体中规则排列的粒子看作几何点,叫作结点。 把晶体中规则排列的粒子看作几何点,叫作结点。将结点 按照一定方向和某种规则连接起来, 按照一定方向和某种规则连接起来,得到可以描述晶体内 部结构的空间格子,简称晶格。晶格有14种不同形状。 部结构的空间格子,简称晶格。晶格有 种不同形状。 种不同形状
晶体类型 结点上的粒子
离子晶体 正、负离 子
原子晶 体 原子 极性分 子
分子晶体 非极性分子
金属晶体 金属原子、 金属原子、金属 正离子(离子间隙 正离子 离子间隙 处有自由电子) 处有自由电子 金属键
结合力
离子键
共价键
性 质 特 征
熔、沸点 硬度 机械性能
较高 硬 脆
高 硬 不脆
分子间 力、氢 键 低 软 软
如,Na的3s1形成3s能带: Na的 形成3 能带:
(σ*3s) (σ3s)
能量较低的σ3s能带充满电子,称满带; 3s能带没 能量较低的σ3s能带充满电子,称满带;σ*3s能带没 σ3s能带充满电子 有电子,为空带,又称导带,在满带和导带之间有禁带。 有电子,为空带,又称导带,在满带和导带之间有禁带。
标准态下
Na+(g)+Cl-(g)
U=786kJ·mol-1
z1 z 2 U ∝ d
z:阴、阳离子所带电荷数 : d:核间距 :
对于晶体构型相同的离子晶体:离子所带电荷数越高、 对于晶体构型相同的离子晶体:离子所带电荷数越高、核 间距越短,晶格能越大,晶体越稳定。 间距越短,晶格能越大,晶体越稳定。 2 离子晶体的稳定性 晶格能越大,离子晶体越稳定,其熔点越高,硬度越大。 晶格能越大,离子晶体越稳定,其熔点越高,硬度越大。 思考:按熔点高低将下列物质排列: 思考:按熔点高低将下列物质排列:NaCl、MgO、CaO、KCl。 、 、 、 。 MgO > CaO >NaCl>KCl
固体的性质固体的结构与性质

固体的性质固体的结构与性质固体是一种物质的表现形态,具有固定的形状和体积。
它的结构和性质对于我们理解物质的特性以及应用具有重要的意义。
本文将探讨固体的结构和性质,从几个方面来进行论述。
一、晶体的结构和性质晶体是具有有序排列的固体,其原子、离子或者分子按照一定的几何规律排列而成。
晶体的结构决定了其特殊的性质。
1. 晶胞结构晶胞是晶体最基本的重复单元,它通过翻转和堆放形成整个晶体。
常见的晶胞结构有立方晶胞、正交晶胞、晶体晶胞等。
晶胞结构的不同决定了晶体的物理和化学性质的差异。
2. 晶体的硬度晶体的硬度是指晶体抵抗外力破坏的能力。
硬度的大小与晶体的结构和成分有关。
例如,金刚石的硬度非常高,因为它的碳原子以立方晶胞的形式排列,碳原子之间有很强的共价键连接,使得金刚石具有极高的硬度。
3. 晶体的透明性晶体的透明性指的是光线穿过晶体的能力。
晶体透明性的好坏与晶体的结构有关,通常晶体的结构是高度对称的,没有杂质或缺陷,能使光线顺利传播而不发生散射。
因此,很多晶体具有良好的透明性,如水晶、石英等。
二、非晶体的结构和性质非晶体是指原子、离子或者分子无序排列的固体,它们没有明显的晶体结构。
非晶体的结构与晶体不同,导致了其特殊的性质。
1. 非晶体的刚度非晶体在结构上缺乏长程有序性,使得原子之间的位置和方向无规律可循,因此非晶体的刚度较低。
与晶体相比,非晶体更容易变形,无法保持固定的形状。
2. 非晶体的熔化温度非晶体的熔化温度通常较低。
由于非晶体的结构较为松散,原子之间的键力较弱,因此可以在较低的温度下熔化。
3. 非晶体的光学性质非晶体的光学性质较差。
由于非晶体的结构无规则,光线在非晶体中容易散射,导致光的传播速度下降和透明度降低。
三、固体的导电性固体的导电性是固体材料中电子或正离子的运动性质,也与固体的结构和性质密切相关。
1. 金属导体金属是电子自由流动的良好导体,其导电性能与金属中的自由电子有关。
金属中的原子以一种密堆的方式排列,形成电子云,电子可以自由地在其中移动,从而形成电流。
固体的结构和性质

固体的结构和性质固体是物质的一种形态,具有固定的形状和体积,分子或离子在固定的位置上振动。
固态物质的结构和性质直接影响着物质的性质、用途和应用范围。
本文将探讨固体的结构和性质,以及它们在实际应用中的重要性。
一、固体的晶体结构固体的晶体结构是指固体中分子、离子或原子的有序排列方式。
晶体结构具有高度的有序性和周期性,可以分为原子晶体、离子晶体和分子晶体三类。
1. 原子晶体原子晶体是由相同元素的原子通过共价键或金属键组成的晶体。
常见的原子晶体包括金、银、铁等金属。
原子晶体的特点是原子间键结构强度高,导电性好,热稳定性强。
2. 离子晶体离子晶体是由正、负离子通过离子键结合而成的晶体。
典型的离子晶体包括氯化钠、氧化镁等。
离子晶体的特点是硬度高,熔点较高,导电性能差。
3. 分子晶体分子晶体是由分子通过范德华力结合而成的晶体。
常见的分子晶体有冰、石墨等。
分子晶体的特点是比较脆弱,破碎后容易分解成单独的分子。
二、固体的物理性质固体的物理性质包括密度、硬度、熔点、导电性和热膨胀等。
1. 密度固体的密度是指单位体积内所含的质量。
不同固体的密度由其成分和结构所决定,密度越大,固体通常越重。
2. 硬度固体的硬度是指其抵抗外力的能力。
常用的硬度测试方法是莫氏硬度测试,通过硬度测试可以评估固体的抗刮、抗压和抗切削等性能。
3. 熔点固体的熔点是指固体转变为液体的温度。
不同固体的熔点由其组成和结构所决定,熔点越高,固体的稳定性越强。
4. 导电性固体的导电性是指固体导电或不导电的能力。
金属晶体由于自由电子的存在而具有良好的导电性,而离子晶体和分子晶体由于离子或分子之间缺少自由电子而不导电。
5. 热膨胀固体的热膨胀是指固体体积随温度变化而发生的变化。
固体的热膨胀系数越大,其体积变化程度越大。
三、固体的化学性质固体的化学性质包括固体与其他物质的反应性、稳定性以及固体内部分子或离子的结构稳定性等。
1. 反应性固体与其他物质的反应性取决于其组成和结构。
初中化学知识点归纳固体的特性与结构

初中化学知识点归纳固体的特性与结构固体是一种物质的状态,它具有一定的形状和体积,呈现出相对稳定的结构和特性。
化学中,固体是我们研究的重要对象之一。
本文将对初中化学中固体的特性和结构进行归纳。
一、固体的特性固体与气体和液体相比,具有独特的特性,主要包括以下几个方面:1.形状和体积稳定固体具有一定的形状和体积,不易受外界影响而改变。
这是由于固体分子间的相互作用力比较强,使得分子排列有序,形成稳定的结构。
因此,固体在常温常压下呈现出固定的形态。
2.高密度由于固体分子紧密排列,分子之间的空隙较小,因此固体具有较高的密度。
相同质量的固体与气体和液体相比,占据的体积较小。
3.硬度与脆性固体的硬度和脆性是其特有的性质。
硬度指固体抵抗外力的能力,脆性则指固体在受到外力作用时会发生断裂。
这是由于固体分子之间的相互作用力的强度导致的。
4.熔点和沸点高固体的熔点和沸点较高,需要较高的温度才能使其发生熔化或汽化。
这是由于固体分子之间的相互作用力较强,需要克服较大的能量才能使其分子间距增大。
二、固体的结构固体的结构是指固体中分子或离子的排列方式和空间结构。
化学中,我们常见的固体结构主要有以下几种:1.晶体结构晶体是一种具有规则三维排列的物质。
在晶体中,分子或离子按照一定的规则排列,形成排列有序的结构。
晶体具有清晰的平面和面角,能够形成规则的晶体结构。
例如,盐类晶体中,正负离子按照一定比例和排列方式排列,形成晶体的立方结构。
2.非晶体结构非晶体是一种无法形成规则晶体结构的固体。
在非晶体中,分子或离子的排列是杂乱无序的,没有明显的平面和面角。
玻璃就是一种典型的非晶体,它的结构没有明确的规则性。
3.多晶结构多晶体是由多个晶体颗粒组成的物质。
在多晶体中,多个晶体颗粒具有不同的取向和晶格结构。
例如,金属材料常见的钢铁就是多晶体材料。
三、固体的分类根据固体的组成和性质,可以将固体分为以下几类:1.金属金属是一类特殊的固体,具有良好的导电性和导热性。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
第七章固体的结构与性质思考题1.常用的硫粉是硫的微晶,熔点为112.8℃,溶于CS2,CCl4等溶剂中,试判断它属于哪一类晶体?分子晶体2.已知下列两类晶体的熔点:(1) 物质NaF NaCl NaBr NaI熔点/℃993 801 747 661(2) 物质SiF4SiCl4SiBr4 SiI4熔点/℃-90.2 -70 5.4 120.5为什么钠的卤化物的熔点比相应硅的卤化物的熔点高?而且熔点递变趋势相反? 因为钠的卤化物为离子晶体,硅的卤化物为分子晶体,所以钠的卤化物的熔点比相应硅的卤化物的熔点高,离子晶体的熔点主要取决于晶格能,NaF、NaCl、NaBr、NaI随着阴离子半径的逐渐增大,晶格能减小,所以熔点降低。
分子晶体的熔点主要取决于分子间力,随着SiF4、SiCl4、SiBr4、SiI4相对分子质量的增大,分子间力逐渐增大,所以熔点逐渐升高。
3.当气态离子Ca2+,Sr2+,F-分别形成CaF2,SrF2晶体时,何者放出的能量多?为什么?形成CaF2晶体时放出的能量多。
因为离子半径r(Ca2+)<r(Sr2+),形成的晶体CaF2的核间距离较小,相对较稳定的缘故。
4. 解释下列问题:(1)NaF的熔点高于NaCl;因为r(F-)<r(Cl-),而电荷数相同,因此,晶格能:NaF>NaCl。
所以NaF的熔点高于NaCl。
(2)BeO的熔点高于LiF;由于BeO中离子的电荷数是LiF 中离子电荷数的2倍。
晶格能:BeO>LiF。
所以BeO的熔点高于LiF。
(3)SiO2的熔点高于CO2;SiO2为原子晶体,而CO2为分子晶体。
所以SiO2的熔点高于CO2。
(4)冰的熔点高于干冰(固态CO2);它们都属于分子晶体,但是冰分子中具有氢键。
所以冰的熔点高于干冰。
(5)石墨软而导电,而金刚石坚硬且不导电。
石墨具有层状结构,每个碳原子采用SP2杂化,层与层之间作用力较弱,同层碳原子之间存在大π键,大π键中的电子可以沿着层面运动。
所以石墨软而导电。
而金刚石中的碳原子采用SP3杂化,属于采用σ键连接的原子晶体。
所以金刚石坚硬且不导电。
5.下列说法是否正确?(1)稀有气体是由原子组成的,属原于晶体;×(2)熔化或压碎离子晶体所需要的能量,数值上等于晶格能;×(3)溶于水能导电的晶体必为离子晶体;×(4)共价化合物呈固态时,均为分子晶体,因此熔、沸点都低;×(5)离子晶体具有脆性,是由于阳、阴离子交替排列,不能错位的缘故。
√6.解释下列事实:(1)MgO可作为耐火材料;为离子晶体,熔点高。
(2)金属Al,Fe都能压成片、抽成丝,而石灰石则不能;因为金属Al,Fe为金属晶体。
而石灰石为离子晶体。
(3)在卤化银中,AgF可溶于水,其余卤化银则难溶于水,且从AgCl到AgI溶解度减小;AgF、AgCl、AgBr、AgI 随着阴离子半径的增大,阴离子的变形性增大,离子间的极化不断增强,由离子键逐步过渡到共价键。
所以溶解度逐步减小。
(4)NaCl易溶于水,而CuCl难溶于水。
Cu+是18电子构型,而Na+是8电子构型,Cu+的极化力比Na+强,所以CuCl 中几乎是以共价键结合,而NaCl是离子晶体。
所以NaCl 易溶于水,而CuCl难溶于水。
7.下列物质的键型有何不同?Cl2 HCl AgI LiF。
其键型分别为:非极性共价键、极性共价键、由离子键过渡到极性共价键、离子键。
8.已知:AlF3为离子型,AlCl3,AlBr3为过渡型,AlI3为共价型。
试说明它们键型差别的原因。
AlF3、AlCl3、AlBr3、AlI3随着阴离子半径的逐步增大,离子的变形增大,离子间的极化不断增强,因此由离子键逐渐过渡到共价键。
9. 实际晶体内部结构上的点缺陷有几种类型? 晶体内部结构上的缺陷对晶体的物理、化学性质有无影响? 有空穴缺陷、置换缺陷、间充缺陷三种。
晶体内部结构上的缺陷影响晶体的光、电、磁、声、力以及热等方面的物理及化学性能。
10. 试用能带理论说明金属导体、半导体和绝缘体的导电性能。
在外电场的作用下,金属导带中的电子作定向运动而形成电流,所以金属能导电;半导体由于禁带较窄,满带中的电子容易被激发越过禁带跃迁到导带上去,因此具有一定的导电能力;由于绝缘体的电子都在满带上,而且禁带较宽,即使在外电场的作用下,满带中的电子也难以被激发越过禁带跃迁到导带上去,因此不能导电。
11. 离子半径r(Cu+)<r(Ag+),所以Cu+的极化力大于Ag+。
但Cu2S的溶解度却大于Ag2S,何故? Cu+和Ag+均属18电子构型,尽管Cu+的极化力大于Ag+的,但是Ag+的变形性大于Cu+的,导致Ag2S的附加极化作用加大,键的共价成分增大、溶解度减小。
12.(1)今有元素X,Y,Z,其原子序数分别为6,38,80,试写出它们的电子分布式,说明它们在周期表中的位置;(2)X,Y两元素分别与氯形成的化合物的熔点哪一个高?为什么?(3)Y,Z两元素分别与硫形成的化合物的溶解度哪一个小? 为什么?(4)X元素与氯形成的化合物其分子偶极矩等于零,试用杂化轨道理论解释。
(1)(2)Y与Cl形成的化合物熔点高。
因为YCl2是离子晶体,而XCl4是分子晶体。
(3)Z与S形成的化合物溶解度小。
因为Z2+为18电子构型,其极化力、变形性都大,因而形成的硫化物离子之间的极化作用较大,键的共价程度较大,所以溶解度小;而Y2+为8电子构型,Y2+的极化力、变形性都较小,所以YS的溶解度较大。
(4)X与Cl形成XCl4化合物,X发生等性的SP3杂化,XCl4呈四面体,其分子的偶极矩等于零。
习题1.已知下列各晶体: NaF、ScN、TiC、MgO, 它们的核间距相差不大,试推测并排出这些化合物熔点高低、硬度大小的次序。
解:这些化合物熔点高低、硬度大小的次序为:TiC>ScN>MgO>NaF.2.下列物质中,试推测何者熔点最低?何者最高?(1) NaCl KBr KCl MgO (2) N2Si NH3解:(1)KBr的熔点最低,MgO最高;(2) N2的熔点最低,Si最高。
3.写出下列各种离子的电子分布式,并指出它们各属于何种电子构型?Fe3+Ag+Ca2+Li+S2-Pb2+Pb4+Bi3+4. 今试推测下列物质分别属于哪一类晶体?物质 B LiCl BCl3熔点/℃2300 605 -107.3解:B属原子晶体,LiCl属离子晶体,BCl3为分子晶体。
5. (1)试推测下列物质可形成何种类型的晶体?O2H2S KCl Si Pt(2)下列物质熔化时,要克服何种作用力?AlN Al HF(s) K2S解:(1) O 2、H 2S 为分子晶体,KCl 为离子晶体,Si 为原子晶体,Pt 为金属晶体。
(2) AlN 为共价键,Al 为金属键,HF(s)为氢键和分子间力,K 2S 为离子键。
6. 根据所学晶体结构知识,填出下表。
7. 用下列给出的数据,计算AlF 3(s)的晶格能(U )。
A1(s) —→ Al(g), 1326.4sub m H kJ mol ∅-∆=Al(g) - 3e- —→ Al 3+(g); I =I 1 + I 2 + I 3 = 5139.1 kJ·mol -1Al(s) + 3/2F 2(g) —→ AlF 3(s);11510f m H kJ mol ∅-∆=-F 2(g) —→ 2F(g); D θ(F-F) = 156.9 kJ·mol-1F(g) + e- —→ F -(g);11322A E kJ mol -=-解8. 已知KI 的晶格能U = 649kJ ·mol -1,K 的升华热190sub m H kJ mol ∅-∆=,K 的电离能I 1 = 418.9kJ ·mol -1,I 2的解离能D θ(I-I)=152.549kJ·mol -1,I 的电子亲合能E A1 = -295kJ·mol -1, I 2的升华热162.4sub m H kJmol ∅-∆=,求KI 的生成焓f m H ∅∆ ?解:9.将下列两组离子分别按离子极化力及变形性由小到大的次序重新排列。
(1)Al3+Na+Si4+(2)Sn2+Ge2+I-解:(1)极化力:Na+、Al3+、Si4+,变形性:Si4+、Al3、Na+;(2)极化力:Ge2+、Sn2+、I-,变形性:I-、Sn2+、Ge2+10.试按离子极化作用由强到弱的顺序重新排出下列物质的次序。
MgCl2SiCl4NaCl AlCl3解:SiCl4、AlCl3、MgCl2、NaCl。
11.比较下列每组中化合物的离子极化作用的强弱,并预测溶解度的相对大小。
(1) ZnS CdS HgS(2) PbF2PbCl2PbI2(3) CaS FeS ZnS解:(1) 离子极化作用由强到弱:HgS>CdS>ZnS; 溶解度由小到大:HgS<CdS<ZnS.(2) 离子极化作用由强到弱:PbI2>PbCl2>PbF2;溶解度由小到大PbI2<PbCl2<PbF2.(3) 离子极化作用由强到弱:ZnS>FeS>CaS;溶解度由小到大ZnS<FeS<CaS.。
