叶绿素实验数据表
不同环境条件下植物叶绿素a、b含量的比较(分光光度法测定)

一、实验课题名称不同环境条件下植物叶绿素a、b含量的比较(分光光度法测定)二、文献综述1.叶绿素a的生物合成过程起始物是谷氨酸,之后为5-氨基酮戊酸,两分子的ALA缩合形成胆色素原(PBG),4分子PBG相互连结形成原中卟啉IX.原卟啉IX与Mg结合形成Mg-原卟啉原IX,光下E环的环化形成,D环的还原作用和叶绿醇尾部的连接完成了整个合成过程,合成过程中的许多步骤在图中已省略2.影响叶绿素形成的条件(1)光光是影响叶绿素形成的主要条件。
从原叶绿素酸酯转变为叶绿酸酯需要光,而光过强,叶绿素又会受光氧化而破坏。
黑暗中生长的幼苗呈黄白色,遮光或埋在土中的茎叶也呈黄白色。
这种因缺乏某些条件而影响叶绿素形成,使叶子发黄的现象,称为黄化现象(etiolation)。
也有例外情况,例如藻类、苔藓、蕨类和松柏科植物在黑暗中可合成叶绿素,其数量当然不如在光下形成的多;柑橘种子的子叶及莲子的胚芽在无光照的条件下也能形成叶绿素,推测这些植物中存在可代替可见光促进叶绿素合成的生物物质。
(2)温度叶绿素的生物合成是一系列酶促反应,受温度影响。
叶绿素形成的最低温度约2℃,最适温度约30℃,最高温度约40℃。
秋天叶子变黄和早春寒潮过后秧苗变白,都与低温抑制叶绿素形成有关。
高温下叶绿素分解大于合成,因而夏天绿叶蔬菜存放不到一天就变黄;相反,温度较低时,叶绿素解体慢,这也是低温保鲜的原因之一。
(3)营养元素叶绿素的形成必须有一定的营养元素。
氮和镁是叶绿素的组成成分,铁、锰、铜、锌等则在叶绿素的生物合成过程中有催化功能或其它间接作用。
因此,缺少这些元素时都会引起缺绿症(chlorosis),其中尤以氮的影响最大,因而叶色的深浅可作为衡量植株体内氮素水平高低的标志。
(4)氧缺氧能引起Mg-原卟啉IX或Mg-原卟啉甲酯的积累,影响叶绿素的合成。
(5)水缺水不但影响叶绿素生物合成,而且还促使原有叶绿素加速分解,所以干旱时叶片呈黄褐色。
通过对室外旱池处理条件下的甘薯叶片叶绿素含量变化的研究,结果表明,水分胁迫下甘薯品种叶片中叶绿素a、b及总叶绿素含量比对照均有所下降,叶绿素a/b比值比对照也有所下降,且叶绿素a/b比值占对照百分率与品种抗旱性呈极显著负相关。
植物生理学实验-光合、呼吸速率、荧光参数测定

注意:当TPS处于测量状态时,按N键返回到主菜单,
然后再关机。
.
1 SET PLC 1:BROAD
2:UNIVERSAL
1
N
1 REC:M/A 2 INT:0/n FLO:300
1REC 2CAL 3DMP 4CLR 5CLK 6DIAG
Y
N
1 LIGHT=SUN(or LED) 2 LEAF AREA=02.5
.
3、IRGA法测定光合速率的气路系统 红外线气体分析仪只能进行CO2浓度
和H2O浓度的测定,要测定光合速率必须 与气路系统相结合。
开放式气路系统 气路系统主要有
密闭式气路系统
.
(1)开放式气路系统 公式:Pn=F×△CO2/S
稳定CO2气体
F. 值已知
△CO2
开放式气路系统的优点:
1.长时间动态监测 2.恒态测定;维持CO2稳定值 3.测定光-光合曲线:同一叶片不同光强下的光合速率 4.测定CO2-光合曲线:同一叶片不同CO2下的光合速率 5.测定光呼吸:不同气体下光合速率之差:R=Pn2-Pn21
A +/-nn.n CI nnnn 2·s-1
.正值为光合速率,负值呼吸速率。
使用LED光源,先进行光照强度的选择:
光源电源的连接
在“测定菜单”CONTROL SETTINGS
下,按Y显示: 1CO2 2H2O 3LED
按3显示:
LED LEVEL 0=0000 PRESS 0-9 OR Y
按7显示:
●植物生理学、生态学、作物栽培学、作物育 种学、林学、植物营养、病理等研究工作中, 经常需要测定光合速率,根据实验材料选择 一种快速、准确而又简便的光合速率测定方 法,以满足科学研究的需要。
实验六 叶绿素的提取、分离

叶绿素的提取、分离一、实验目的1.掌握从植物叶中提取叶绿素的方法。
2. 了解纸层层析的原理,掌握纸层析的一般操作和定性鉴定方法。
二、实验原理1. 叶绿素提取原理:叶绿素等是脂溶性的有机分子,根据相似相溶的原理,叶绿体中含有叶绿体色素(叶绿素a和b、胡萝卜素及叶黄素)等色素分子溶于有机溶剂而不溶于有极性的水。
故在研磨和收集叶绿色素时要用丙酮或乙醇等有机溶剂提取而不用水。
2. 色素分离的原理:纸层析是用滤纸作为载体的一种色层分析法,其原理主要是利用混合物中各组分在;流动相和固定相的分配比(溶解度)的不同而使之分离。
滤纸上吸附的水为固定相(滤纸纤维常能吸20%左右的水),有机溶剂如乙醇等为流动相,色素提取液为层析试样。
把试样点在滤纸的滤液细线位置上,当流动相溶剂在滤纸的毛细管的作用下,连续不断地沿着滤纸前进通过滤液细线时,试样中各组份便随着流动相溶剂向前移动,并在流动相和固定相溶剂之间连续一次有一次的分配。
结果分配比比较大的物质移动速度较快,移动距离较远;分配比较小的物质移动较慢,移动距离较近,试样中各组分分别聚集在滤纸的不同的位置上,从而达到分离的目的。
毛细管点样薄层色谱展开三、仪器和药品研钵、毛细管、漏斗、纱布、小烧杯、试管、培养皿等剪纸形状滤液基线95%酒精、丙酮、石油醚碳酸钙,石英砂四、实验步骤(1)取菠菜或其他植物新鲜叶片20g左右,洗净,用滤纸擦干,去掉叶柄和中脉剪碎,放入研钵。
(2)研钵中加入少量碳酸钙和石英砂,加4-5ml 无水乙醇,研磨至糊状,再加10ml 无水乙醇充分混匀以提取叶片匀浆中的色素,15-20分钟后,过滤入50ml锥形瓶中加塞待用。
分离:(1)取圆形定性滤纸一张(直径15cm),将其剪成滤纸条(15cm×2cm),将其2cm一端剪去两侧,中间留一长约1.5cm,宽约0.5cm的窄条,并在滤纸剪口上方用铅笔画一条直线,作为画滤液细线的基准线(注意:滤液线必须距底边1-1.5cm)。
叶绿体色素的提取、分离及定量测定

叶绿体色素的提取、分离及定量测定一、实验结果1、 滤纸带纸层析:2、 圆形滤纸层析:3、 叶绿素a 、b 含量的测定Ca=12.7A663—2.69A645 Cb=22.9A645—4.68A663推动剂边缘 胡萝卜素 叶黄素叶绿素a (蓝绿色)叶绿素b (黄绿色) 叶绿素b (黄绿色)叶绿素a (蓝绿色)叶黄素胡萝卜素推动剂边缘次数组数Ca=31.35(稀释后数据计算)Cb=15.04(稀释后数据计算)二、问题思考1、大部分植物依靠光合作用合成自身生长繁殖所需的有机物。
光合作用所需色素主要有类胡萝卜素和叶绿素。
其中直接参与光合的是叶绿素a,中心色素,其余为天线色素。
2、叶绿素为双羧酸的酯,一个羧基被甲醇酯化,另一个羧基被叶绿醇酯化。
不溶于水而溶于有机溶剂如酒精、丙酮、石油醚。
叶绿素a为蓝绿色,叶绿素b为黄绿色。
结构的基本特点为拥有一个卟啉环头部及一条叶醇链尾部。
其卟啉环头部由四个甲烯基和四个吡咯环连接而成,大环中央有一个镁原子和四个氮原子结合。
镁原子带正电荷,相连的氮原子偏于带负电荷,因此卟啉环呈极性亲水,可以与蛋白质结合。
尾部叶醇基具有疏水性,为脂溶性物质。
叶绿素a、b结构基本相同,以-CHO代替CH3即为叶绿素b。
叶绿素吸收光谱3、纸层析可行原因:a、色素可提取b、色素可以溶解于某些溶剂中c、不同类型色素在同一溶剂中溶解度不同d、色素分子不会吸附滤纸纤维上e、色素分子可以在体外条件下稳定存在4、本次实验叶绿素a、b含量比值偏低,说明实验有误差。
而由于叶绿素a含有醛基,易于被氧化,亦可导致a的含量下降。
同时由于实验在11月末进行,植物中叶绿素含量下降,a,b的比值可能会受影响。
5、实验注意事项:a、叶片要选取绿色较深的部位,去除叶脉;b、尽量先剪碎,便于之后的研磨;c、研磨前加入二氧化硅和碳酸钠,注意用量。
量少研磨不充分,叶绿素会被液泡中的有机酸破坏;量大不易过滤完全且会使色素层析时颜色变淡;d、过滤时所用棉花不可过多,否则滤液完全被棉花吸收。
叶绿素含量的测定

海洋生物学实验浮游植物叶绿素含量的测定一、实验目的:1、通过浮游植物细胞密度与单位水体叶绿素a(Chla)含量的测定,了解浮游植物数量和生物量的表示方法,并对不同粒径浮游植物加以比较。
2、学会使用采水瓶、水样固定、浓缩及浮游植物计数框的方法,掌握叶绿素a的测定方法。
二、原理:见《海洋生态学》P192-194生物量是指某一特定时间、某一特定范围内存在的有机体的量。
浮游植物是海洋生态系统的初级生产者,而初级生产水平与叶绿素a 含量存在密切关系,因而往往用叶绿素a含量来表示浮游植物的生物量。
海洋生态系统的种类组成结构以及能流、物质流特征与初级生产者的粒径大小有密切关系。
不同类型海区初级生产者的粒径组成存在很大差异,了解某一特定海区初级生产者的粒径组成,有助于深入研究海区的新生产力水平、营养平衡状态等结构、功能特征。
三、仪器与设备:1、分光光度计3、采水瓶4、抽滤器5、微孔滤膜6、冰箱7、离心机四、药品与试剂:丙硐、甲醛、MgCO3等。
五、实验步骤:1、采样:选择完站位后,以500mL、或1000mL采水瓶采取一定水层(也可几个水层比较)的水样。
2、水样处理:将所取水样分别以0.45μm微孔滤膜(叶绿素a 总量)、2μm核孔滤膜(>2μm孔径叶绿素a含量)以及先经20μm孔径筛绢过滤后再以2μm核孔滤膜(2-20μm孔径叶绿素a含量)过滤,以90%丙酮溶解滤膜后冰冻过夜。
3、数据测定:滤膜冰冻24小时后取出离心,取上清液于分光光度计测定叶绿素a含量(方法见附页),将所得不同孔径叶绿素a 含量及占叶绿素a总量比例等数据填入测定数据表中。
附:叶绿素a含量测定方法(分光光度法):A.检测限:0.02mg/m3。
B.方法概述:已知体积的海水以玻璃纤维过滤器过滤,用90%丙酮将色素从滤器上萃取出来,其浓度以分光光度法测定。
C.仪器和设备:1、分光光度计2、抽滤器3、电动吸引器4、采水瓶5、微孔滤膜6、离心沉淀器7、冰箱8、离心管D.取样方法和贮存:将0.5-10升海水经0.45μm微孔滤膜过滤。
实验二、植物叶绿素含量测定----丙酮提取法

二、植物叶绿素含量测定----丙酮提取法高等植物光合作用过程中利用的光能是通过叶绿体色素(光合色素)吸收的。
叶绿体色素由叶绿素a、叶绿素b、胡萝卜素和叶黄素组成。
叶绿体色素的提取、分离和测定是研究它们的特性以及在光合中作用的第一步。
叶片叶绿素含量与光合作用密切相关,是反眏叶片生理状态的重要指标。
在植物光合生理、发育生理和抗性生理研究中经常需要测定叶绿素含量。
叶绿素含量也是指导作物栽培生产和选育作物品种的重要指标。
[原理]叶绿素不溶于水,溶于有机溶剂,可用多种有机溶剂,如丙酮、乙醇或二甲基亚砜等研磨提取或浸泡提取。
叶绿色素在特定提取溶液中对特定波长的光有最大吸收,用分光光度计测定在该波长下叶绿素溶液的吸光度(也称为光密度),再根据叶绿素在该波长下的吸收系数即可计算叶绿素含量。
利用分光光计测定叶绿素含量的依据是Lambert-Beer定律,即当一束单色光通过溶液时,溶液的吸光度与溶液的浓度和液层厚度的乘积成正比。
其数学表达式为:A=Kbc式中:A为吸光度;K为吸光系数;b为溶液的厚度;c为溶液浓度。
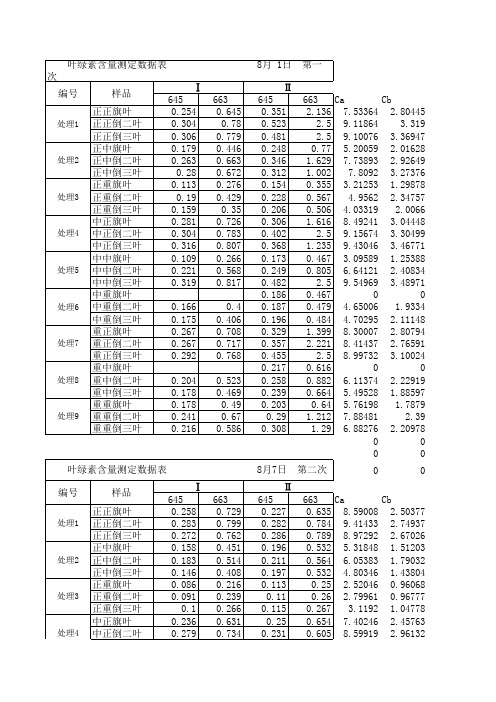
叶绿素a、b的丙酮溶液在可见光范围内的最大吸收峰分别位于663、645nm处。
叶绿素a和b 在663nm处的吸光系数(当溶液厚度为1cm,叶绿素浓度为g·L-1时的吸光度)分别为82.04和9.27;在645nm处的吸光系数分别为16.75和45.60。
根据Lambert-Beer定律,叶绿素溶液在663nm和645nm处的吸光度(A663和A645)与溶液中叶绿素a、b和总浓度(a+b)(C a、C b、C a十b,单位为g·L-1),的关系可分别用下列方程式表示:A663=82.04C a+9.27C b (1)A645=16.76C a+45.60C b(2)解方程(1)和(2)得:C a=12.7 A663—2.59 A645 (3)C b=22.9 A645—4.67 A663(4)C a十b=20.3 A645—8.04 A663(5)从公式(3)、(4)、(5)可以看出,只要测得叶绿素溶液在663nm和645nm处的吸光度,就可计算出提取液中的叶绿素a、b浓度和叶绿素总浓度(a+b)。
植物含量测定实验报告

植物含量测定实验报告1. 引言植物含量测定实验是植物学研究中常用的实验方法之一。
通过测定植物体内的水分含量、叶绿素含量和干物质含量,可以了解植物的生长状况和生理状态。
本实验旨在通过测定不同植物样本的含量,比较它们的生长状况,为进一步研究提供数据支持。
2. 实验设计2.1 实验目的- 测定植物样本的水分含量- 测定植物样本的叶绿素含量- 测定植物样本的干物质含量- 比较不同植物样本的含量差异2.2 实验材料和仪器- 植物样本(不同种类植物或同一种类植物不同处理)- 称量仪- 烘干器- 榨汁器- 叶绿素测定仪2.3 实验步骤1. 收集植物样本,并记录样本的来源和处理信息。
2. 手工切碎植物样本,以便更好地测定水分和干物质含量。
3. 将切碎的样本称重,并记录初始重量。
4. 将样本放入烘干器中,烘干至恒重(重量不再发生变化),称重并记录干重。
5. 计算并记录样本的水分含量和干物质含量。
6. 使用榨汁器榨取植物样本的汁液,并记录榨汁液的重量。
7. 使用叶绿素测定仪测定榨汁液中的叶绿素含量,并记录结果。
3. 实验结果3.1 植物样本的含量测定结果以下为实验测定得到的植物样本含量数据(以百分比表示):样本编号水分含量干物质含量叶绿素含量-样本1 68.2 31.8 2.5样本2 73.5 26.5 3.2样本3 65.9 34.1 2.83.2 植物样本的含量差异比较通过比较不同植物样本的含量数据,可以得出以下结论:1. 植物样本1、2、3的水分含量分别为68.2%、73.5%和65.9%,样本2的水分含量最高,样本3的水分含量最低。
2. 植物样本1、2、3的干物质含量分别为31.8%、26.5%和34.1%,样本3的干物质含量最高,样本2的干物质含量最低。
3. 植物样本1、2、3的叶绿素含量分别为2.5%、3.2%和2.8%,样本2的叶绿素含量最高,样本1的叶绿素含量最低。
4. 结论本实验通过测定不同植物样本的水分含量、干物质含量和叶绿素含量,并对结果进行比较,得出以下结论:1. 不同植物样本的水分含量存在显著差异,这可能与植物的生长环境和生理特性有关。
不同环境条件下植物叶绿素a、b含量地比较

一、实验课题名称:不同环境条件下植物叶绿素a、b含量的比较二、选题背景或文献综述:《植物生理学实验指导》(第四版)、《植物生理学》(第六版)、上网查阅相关资料阴生植物也称“阴性植物”,是在较弱的光照条件下生长良好的植物,但并不是阴生植物对光照强度的要求越弱越好,而是必须达到阴生植物的补偿点,植物才能正常生长,阳生植物也称“阳性植物”,光照强度对植物的生长发育及形态结构的形成有重要作用,在强光环境中生长发育健壮,在阴蔽和弱光条件下生长发育不良的植物称阳性植物,这类植物要求全日照,并且在水分、温度等条件适合的情况下,不存在光照过强的问题。
阳生植物和阴生植物的区别:关于光的饱和点和补偿点光是光合作用的能量来源,光照强度直接影响光合速率,在其它条件都适宜的情况下,在一定范围内,光合速率随光照强度提高而加快,当光照强度高到一定数值后,光照强度再提高而光合速率不再加快,这种现象叫光饱和现象。
开始达到光饱和现象的光照强度称为光饱和点,在光饱和点以下,随着光照强度减弱,光合速率减慢,当减弱到一定光照强度时,光合作用吸收二氧化碳量与呼吸释放二氧化碳的量处于动态平衡,这时的光照强度称为光补偿点。
此时植物制造有机物量和消耗有机物量相等,不同类型植物的光饱和点和补偿点是不同的,阳性植物的光饱和点和补偿点一般都高于阴性植物。
结构和特性的区别:阴生植物的叶片的疏导组织比阳生植物稀疏,以叶绿体来说,阳生植物有较大的基粒,基粒片层数目多的多,叶绿素含量也高,阴生植物在较低的光照条件下充分的吸收光线,叶绿素a/叶绿素b的比值小,能够强烈的利用蓝紫光,阳性植物叶片小而厚,表面具蜡质或绒毛,叶脉密,单位面积内气孔多,叶绿素含量高,体内含盐分多,渗透压高,可以抗高温干旱,阳生植物的气孔一般在叶片下表皮分布的数量多于上表皮,这样可以避免阳光直晒而减少水分散失,阳生植物的呼吸速率高于阴生植物。
区分阳生植物与阴生植物,主要是根据植物对光照强度需要的不同,阳生植物要求充分直射日光才能生长或生长良好,阴生植物适宜于生长在荫蔽环境中,它们在完全日照下反而生长不良或不能生长,阳生植物和阴生植物之所以能适应不同光照,是与它们的生理特征和形态特征不同有关,以光饱和点来说,阳生植物的光饱合点是全光照(即全部太阳光照)的100%,而阴生植物是全光照的10%~50%。
HJ897-2017水质-叶绿素a的测定验证报告

方法验证报告项目名称:水质叶绿素a的测定方法名称:《水质叶绿素a的测定分光光度法》HJ897-2017报告编写人:参加人员:审核人员:报告日期:1 实验室基本情况1.1 人员情况实验室检测人员已通过标准《水质叶绿素a的测定分光光度法》HJ897-2017的培训,熟知标准内容、检测方法及样品数据采集和处理等,考核合格,得到公司技术负责人授权上岗。
表1参加验证人员情况登记表1.2 检测仪器/设备情况表2主要仪器基本情况1.3 检测用试剂情况表3主要试剂及溶剂基本情况1.4 环境设施和条件情况实验室具有校准合格的温湿度计,环境可以控制在标准要求范围内,满足检测环境条件。
另外实验室配备了洗眼器、喷淋设施、护目镜、灭火器等的安全防护措施,符合实验室安全内务的要求。
2 实验室检测技术能力2.1方法原理将一定量样品用滤膜过滤截留藻类,研磨破碎藻类细胞,用丙酮溶液提取叶绿素,离心分离后分别于750nm、664nm、647nm、630nm波长处测定提取液的吸光度,根据公式计算水中叶绿素a的浓度。
2.2.样品的采集按照GB/T14581、HJ/T91和HJ494中的相关规定进行样品的采集。
样品的采集用有机玻璃采水器采集水面下0.5m样品,采样体积为1L,在样品中加入1ml碳酸镁悬浊液,以防止酸化引起色素溶解。
2.2.样品的保存样品采集后应在0℃-4℃避光保存、运输,24h内运送至检测实验室过滤(若样品24h 不能送达检测实验室,应现场过滤,滤膜避光冷冻运输)。
2.3试样的制备2.3.1过滤在过滤装置上装好玻璃纤维滤膜。
确定取样200ml(根据水体的营养状态确定取样体积富营养和中营养过滤体积为100-200ml,贫营养过滤体积为500-1000ml),用量筒量取200ml混匀的样品,进行过滤,最后用少量的蒸馏水冲洗滤器壁。
过滤时负压不超过50kpa,在样品刚刚完全通过滤膜时结束抽滤,用镊子将滤膜取出,将有样品的一面对折,用滤纸吸干滤膜水分。
叶绿素a、b含量的测定(分光光度计法和SPAD叶绿素仪法)

实验四叶绿素a、b含量的测定(分光光度计法和SPAD叶绿素仪法)植物叶面积的测定(仪器法、画纸称重法)一、实验目的:1.掌握叶绿素的提取方法及叶绿素含量测定的两种方法;2.学会使用VIS-723G和723N(new)的分光光度计的比色杯较正和定波长的两个程序;仪器法、复印称重法测定植物叶面积3.学会SPAD叶绿素仪和AM-300手持式叶面积仪的使用4.了解CB-1102便携式光合蒸腾测定仪二、实验原理:略、三、实验步骤:1.叶绿素a、b含量的测定(分光光度计法)P373人一组,实验材料为大红花成熟叶和嫩叶a)叶绿体色素的提取(0.5g叶片剪碎,加少量石英砂和碳酸钙用95%乙醇研磨,提取定容至25mL)b)稀释至5倍后测A665nm和A649nmc)计算(请列出计算公式)•更正:• 1.请用95%乙醇取代丙酮提取叶绿素。
• 2. 仍用书本上所列的公式。
2.叶绿素a、b含量的测定(SPAD叶绿素仪法)3人一组,实验材料为灰莉叶片实验原理:1.SPAD-502 叶绿素仪通过测量叶片在两种波长光学浓度差方式650nm 和940nm来确定叶片当前叶绿素的相对数量。
2.测量值是通过对在二个不同波长区域,叶片传输光的数量进行计算,在这二个区域叶绿素对光吸收不相同的。
这二个区域是红光区(对光有较高的吸收且不受胡萝卜素影响)和红外线区(对光的吸收极低)。
SPAD—502叶绿素仪使用说明一)电池安装1、按照电池盒上面的箭头标定方向旋转,打开电池盒盖。
2、放入盒内两节AA号码电池,并确信是按照指示放入电池。
3、必须是碱性或是碳—锌电池。
不要混淆电池型号和新旧电池。
4、把电池盒盖按照上面箭头方向旋转,直到盖子和仪器比较适当为止,不能太紧。
5、当电源开关打到ON的位置时,如果电源符号出现在显示屏上,表示电池已经耗尽,应该更换电池了。
如果电源符号没有出现,检查一下电池是否正确地插入或是否有电。
二)调零无论什么时候关闭电源之后需要在打开时,都需要调零。
分光光度法测定叶绿素含量

一、实验目的1.了解植物组织中叶绿素的分布及性质。
2.掌握测定叶绿素含量的原理和方法。
二、实验原理叶绿素广泛存在于果蔬等绿色植物组织中,并在植物细胞中与蛋白质结合成叶绿体。
当植物细胞死亡后,叶绿素即游离出来,游离叶绿素很不稳定,对光、热较敏感;在酸性条件下叶绿素生成绿褐色的脱镁叶绿素,在稀碱液中可水解成鲜绿色的叶绿酸盐以及叶绿醇和甲醇。
高等植物中叶绿素有两种:叶绿素a 和b ,两者均易溶于乙醇、乙醚、丙酮和氯仿。
叶绿素的含量测定方法有多种,其中主要有:1.原子吸收光谱法:通过测定镁元素的含量,进而间接计算叶绿素的含量。
2.分光光度法:利用分光光度计测定叶绿素提取液在最大吸收波长下的吸光值,即可用朗伯—比尔定律计算出提取液中各色素的含量。
叶绿素a 和叶绿素b 在645nm 和663nm 处有最大吸收,且两吸收曲线相交于652nm 处。
因此测定提取液在645nm 、663nm 、652nm 波长下的吸光值,并根据经验公式可分别计算出叶绿素a 、叶绿素b和总叶绿素的含量。
三、仪器、原料和试剂仪器分光光度计、电子顶载天平(感量0.01g)、研钵、棕色容量瓶、小漏斗、定量滤纸、吸水纸、擦境纸、滴管。
原料新鲜(或烘干)的植物叶片试剂1. 96%乙醇(或80%丙酮)2. 石英砂3. 碳酸钙粉四、操作步骤取新鲜植物叶片(或其它绿色组织)或干材料,擦净组织表面污物,去除中脉剪碎。
称取剪碎的新鲜样品2g ,放入研钵中,加少量石英砂和碳酸钙粉及3mL95%乙醇,研成均浆,再加乙醇10mL ,继续研磨至组织变白。
静置3~5min 。
取滤纸1张置于漏斗中,用乙醇湿润,沿玻棒把提取液倒入漏斗,滤液流至100mL 棕色容量瓶中;用少量乙醇冲洗研钵、研棒及残渣数次,最后连同残渣一起倒入漏斗中。
用滴管吸取乙醇,将滤纸上的叶绿体色素全部洗入容量瓶中。
直至滤纸和残渣中无绿色为止。
最后用乙醇定容至100mL ,摇匀。
取叶绿体色素提取液在波长665nm 、645nm 和652nm 下测定吸光度,以95%乙醇为空白对照。
实验一植物叶绿素含量测定丙酮提取法

实验一鱼类回避胁迫实验一、实验目的1. 了解污染物胁迫下鱼类的回避行为。
2. 学会用鱼类回避实验监测水体污染物的方法。
3. 了解回避反应的生理效应。
二、实验原理回避行为,是指水生动物,特别是游泳能力强的水生动物,能主动避开受污染的水区,游向未受污染的清洁水区的行为。
有些化学物质甚至利用化学分析仪器都难以检测到,但通过回避试验,便能反映出水体的混合污染状况的实际毒性。
人们利用鱼类的这种回避特性,设计控制不同浓度的污染区、非污染区(清水区)及污染混合区(污水与清水混合区)的模拟设施,借以检定鱼类的回避能力,对判定水污染状况和工业废水的处理程度,都有一定的实用价值。
鱼类回避反应,是通过嗅觉、味觉、视觉,侧线及其他感受器而实现的。
嗅觉器官可感受水中化学成分、食物及其他鱼类皮肤分泌物等所引起的化学刺激,是引起鱼类行为反应的重要器官之一。
味蕾是感觉器,广泛分布于鱼类的口腔、触须及表皮等部位,对水中有些重金属离子(如汞、铜、锌等),具有很高的敏感性。
当环境中的污染物达到回避阈值时,就会引起鱼类对外界环境刺激的行为反应而出现的短期的逃避行为。
因此,通过鱼类这种短期的转移与逃避可直观地反应环境中理化性质的恶化、水的变质等。
三、试剂与材料1. 试剂:0.2~2.0 mg/L NH3水溶液2. 材料:非洲鲫鱼(Tilapiamossambica)为26.9克最宜。
试验前先经室内驯养七天以上。
驯养期间每天投喂豆饼粉。
3. 仪器与器皿:自制的鱼类回避槽。
其结构如图所示。
四、实验步骤1. 在回避槽中装入适量的清水,槽一端的污染区和对照区各放供试鱼20条。
2. 在污染区中投加NH 3,打开阀门,观察鱼类是否逃避到回避槽另一端的混合区。
如果没有鱼游走,继续增加NH 3的投加量,直到有第一条鱼游到混合区。
记录此时NH 3的投加量,即为最小效应量。
3. 继续增加NH 3的投加量,并同时计算游到回避槽另一端混合区鱼的数量。
4. 当供试鱼一半数量游到的回避槽另一端混合区时,记录此时NH 3的投加量,即为半数效应量。
实验五富营养化湖中叶绿素含量的测定

实验五富营养化湖中叶绿素含量的测定姓名:叶素芬学号:22320102201142 同组人:徐凯芳班级:10环科实验日期:2012.11.29一.实验目的1.掌握叶绿素的测定原理及方法2.评价水体的富营养化状况二.实验方法原理1.关于水体富营养化富营养化:富营养化是指生物所需的氮、磷等营养物质大量进入湖泊、河口、海湾等缓流水体,引起藻类及其它浮游生物迅速繁殖,水体溶氧量下降,鱼类及其它生物大量死亡的现象。
大量水华死亡的水生生物沉积到湖底,被微生物分解,消耗大量的溶解氧,使水体溶解氧含量急剧降低,水质恶化,以致影响到鱼类的生存,大大加速了水体的富营养化过程。
水体出现富营养化现象时,由于浮游生物大量繁殖,往往使水体呈现蓝色、红色、棕色、乳白色等,这种现象在江河湖泊中叫水华(水花),在海中叫赤潮。
3.关于叶绿素含量的测定许多参数可用作水体富营养化的指标,常用的是总磷、叶绿素-a含量和初级生产率的大小。
测定水体中叶绿素的含量,可将色素用丙酮萃取,根据叶绿素提取液对可见光谱的吸收,利用分光光度计在某一特定波长测定其吸光度,即可用公式计算出提取液中各色素的含量。
根据朗伯—比尔定律,某有色溶液的吸光度A与其中溶质浓度C和液层厚度L成正比,即A=αCL,式中:α为比例常数。
当溶液浓度以百分浓度为单位,液层厚度为1cm时,α为该物质的吸光系数。
各种有色物质在不同波长下的吸光系数可通过测定已知浓度的纯物质在不同波长下的吸光度而求得。
如果溶液中有数种吸光物质,则此混合液在某一波长下的总吸光度等于各组分在相应波长下吸光度的总和,这就是吸光度的加和性。
欲测定叶绿体色素混合提取液中叶绿素a、b、c的含量,只需测定该提取液在三个特定波长(663、645、630nm)下的吸光度A,并根据叶绿素a、b、c在该波长下的吸光系数即可求出其浓度。
附表:表1:湖泊富营养化的叶绿素a评价标准指标类型贫营养型中营养型富营养型叶绿素a浓度(μg/L)﹤4 4-10 10-150三.实验试剂和仪器1.试剂:MgCO3悬液(已配制),90%的丙酮溶液(已配制) MgCO3粉末水样(采样时间:2012年11月29日采样地点:厦门大学校本部芙蓉湖)2.仪器:V-1100D可见分光光度计(厂家:MAPADA),比色杯(2cm,2个),马头牌架盘药物天平BP-II型(上海医用激光仪器厂)TG16-WS台式高速离心机(湖南湘异仪器开发有限公司),TMTD-8222 三用恒温水箱(上海精宏实验设备有限公司,MIKRO22R台式冷冻离心机(厂家:HETTICH)塑料离心管(6支),刻度离心管(1支),量筒(100mL,1支,10mL,1支),具塞试管(25mL,1支),移液管(1mL,1支),药匙(1把),黑色塑料薄膜,橡皮筋,烧杯(500mL,1个),胶头滴管(数根)、洗瓶(1个)四.实验步骤1.清洗玻璃仪器(已由老师完成)悬液,将水样分别装2、离心水样:用量筒取水样210mL倒入烧杯中,用1mL移液管移取1.00mL MgCO3入6支大的塑料离心管中,每支离心管加入35mL。
测叶绿素荧光实验报告

一、实验目的1. 了解叶绿素荧光的产生原理及其与光合作用的关系;2. 掌握叶绿素荧光仪的使用方法;3. 通过实验,探究不同光强对叶绿素荧光的影响。
二、实验原理叶绿素荧光是指叶绿素在光合作用过程中,吸收光能后,电子从叶绿素分子中激发出来,经过一系列传递,最终以荧光的形式释放出来。
叶绿素荧光的产生与光合作用密切相关,荧光强度可以反映光合作用的强度。
本实验采用叶绿素荧光仪,通过测量叶绿素荧光强度,分析不同光强对叶绿素荧光的影响。
三、实验材料与仪器1. 实验材料:新鲜叶片(如菠菜、油菜等)2. 实验仪器:叶绿素荧光仪、光合仪、电子天平、剪刀、尺子等四、实验步骤1. 样品制备:选取新鲜叶片,用剪刀剪成适当大小的碎片,称取0.1g左右,置于研钵中;2. 叶绿素提取:向研钵中加入少量石英砂和碳酸钙粉,加入3~5ml 95%乙醇,研磨至组织变白;3. 滤液制备:将研磨好的样品过滤,收集滤液;4. 荧光测量:将叶绿素荧光仪的光源对准叶片,调整光强,记录荧光强度;5. 不同光强实验:重复上述步骤,改变光强,记录不同光强下的荧光强度;6. 数据处理:分析不同光强对叶绿素荧光的影响。
五、实验结果与分析1. 叶绿素荧光的产生原理:叶绿素分子吸收光能后,电子从叶绿素分子中激发出来,经过一系列传递,最终以荧光的形式释放出来;2. 不同光强对叶绿素荧光的影响:实验结果显示,随着光强的增加,叶绿素荧光强度也随之增加,但在一定范围内,荧光强度与光强呈线性关系;3. 荧光强度与光合作用的关系:荧光强度可以反映光合作用的强度,荧光强度越高,光合作用越强。
六、实验结论1. 叶绿素荧光的产生与光合作用密切相关,荧光强度可以反映光合作用的强度;2. 不同光强对叶绿素荧光有显著影响,在一定范围内,荧光强度与光强呈线性关系。
七、实验注意事项1. 实验过程中,注意保持样品的新鲜,避免样品失水;2. 实验操作要规范,确保实验结果的准确性;3. 注意实验安全,避免化学品对人体造成伤害。
2-4叶绿素a测定

实验题目: 湖塘水体叶绿素a测定姓名:学号:班级:组别:第一组指导教师:1.实验概述1.1实验目的及要求(1)初步了解叶绿素a测定的原理和常规测定方法;(2)通过实验,掌握叶绿素。
的测定方法及富营养化水样的前处理方法;(3)熟练掌握抽滤装置及分光光度计的使用。
1.2实验原理浮游植物的主要光合色素是叶绿素((Chlorophyll),常见的有叶绿素a、b和c。
叶绿素a (chl-a >存在于所有的浮游植物中,大约占有机物干重的1-2%,是估算浮游植物生物量的重要指标,因此浮游植物叶绿素a含量的测定成为浮游植物生物量的重要指标而被广泛应用。
浮游植物叶绿素a的测定方法有许多种,根据所使用的仪器可以分为高效液相色谱法<HPLC法)、荧光光度计法和分光光度计法等。
高效液相色谱法能够很精确地测定各种光合色素的含量,但由于仪器昂贵,分析操作步骤繁琐,一般不能用于野外大量样品的快速分析。
荧光光度计也能够精确地测定叶绿素a的含量,特别是能够测定叶绿素a含量较低的样品,但由于分析过程中容易受其他色素或色素衍生物的干扰,也不利于快速分析各类不同的野外样品。
因此,分光光度计法成为最常用的浮游植物叶绿素a含量的测定方法。
在所有分光光度计法中,根据所用的色素萃取液分为了丙酮法、甲醇法和乙醇等,再根据比色所用的,又分为单色法和多色法(例如单色丙酮法和四色丙酮法)等。
主要的细胞破碎法有研磨、低温冻融、超声破碎等。
尽管丙酮现在仍厂泛用于实际分析中,但由于丙酮的萃取效率比较差,特别是对蓝藻的叶绿素a的萃取效率比较低,使得甲醇和乙醇成为替代丙酮的色素萃取剂。
不过,甲醇对人体毒害性大,且在酸化过程中容易产生误差,于是,乙醇成为现在广泛应用的叶绿素a的萃取剂。
超声破碎法因快速、提取效率高等特点也被研究者所青睐。
本实验介绍一种以热乙醇为萃取溶剂,结合超声细胞破碎法为基础的叶绿素a含量侧定方法。
2.实验内容2.1实验方案设计每组选择一个池塘,实地取水样,测定水样的叶绿素a含量。
实验5分光光度法测定青菜中的叶绿素

实验结果表明,青菜中叶绿素的含量与吸光度之间具有良好的
03
线性关系,且该方法具有较高的精密度和重现性。
对未来研究的展望
进一步优化实验条件,提高方 法的灵敏度和准确性,例如改 进提取方法、优化波长选择等 。
深入研究叶绿素的结构与功 能关系,探讨其在植物生长 和逆境胁迫中的生理作用。
ABCD
将该方法应用于其他蔬菜或 植物中叶绿素的测定,以验 证其普适性和可靠性。
朗伯-比尔定律
吸光度与物质浓度及光程 长成正比,是分光光度法 定量分析的理论基础。
标准曲线绘制
标准溶液配制
使用已知浓度的叶绿素标 准品配制系列浓度的标准 溶液。
标准溶液测定
在相同条件下,测量各浓 度标准溶液在特定波长下 的吸光度。
标准曲线绘制
以吸光度为纵坐标,浓度 为横坐标,绘制标准曲线, 并得到吸光度与浓度的线 性关系式。
漏斗和滤纸:用于过滤研 磨后的青菜汁液。
研钵和研杵:用于研磨青 菜样品。
容量瓶、移液管、吸量管等: 用于准确配制和移取溶液。
实验步骤
01 1. 样品处理
02 2. 过滤
03 3. 测定吸光度
04
05
4. 标准曲线绘制 5. 结果计算
取适量青菜样品,剪碎后 放入研钵中,加入少量石 英砂和适量无水乙醇,充 分研磨至汁液呈绿色。
将研磨后的青菜汁液通过 漏斗和滤纸过滤,收集滤 液。
取适量滤液,用分光光度 计在特定波长下测定其吸 光度。同时,以无水乙醇 为参比溶液,调零分光光 度计。
取不同体积的已知浓度的 叶绿素标准溶液,分别加 入无水乙醇定容至相同体 积,得到一系列不同浓度 的标准溶液。以浓度为横 坐标,吸光度为纵坐标, 绘制标准曲线。
绿色果蔬分离叶绿素及其含量测定

绿色果蔬分离叶绿素及其含量测定一、引言叶绿素存在于果蔬、竹叶等绿色植物中。
叶绿素在植物细胞中与蛋白质结合成叶绿体,当细胞死亡后,叶绿素即游离出来,游离叶绿素很不稳定,对光或热较敏感;在酸性条件下生成绿褐色脱镁叶绿素,加热可使反应加速;在稀碱液中可水解为叶绿酸盐(鲜绿色)、叶绿醇和甲醇。
高等植物中叶绿素有a、b两种,二者都易溶于乙醇、乙醚、丙酮和氯仿中。
叶绿素的含量测定方法多种,其中有:(1)原子吸收光谱法:测定镁含量,可以间接算出叶绿素含量。
(2)分光光度法:测定叶绿素提取液的最大吸收波长的光密度,然后通过公式计算获得叶绿素含量数据。
此法快速、简便。
其原理如下:叶绿素a、叶绿素b对645nm和663nm波长的光有强吸收峰,且两吸收曲线相交于652nm处。
因此,测定提取液在645nm、663nm、652nm波长下的光密度,并根据经验公式计算,可分别得到叶绿素含量数据。
V叶绿素a含量=[12.7(D663)—2.69(D645)]×————(mg/g鲜重)1000×WV叶绿素b含量=[22.9(D645)—4.68(D663)]×—————(mg/g鲜重)1000×WV总叶绿素a含量=[20.0(D645)+8.02(D663)]×————(mg/g鲜重)1000×W如果只要求测定总叶绿素含量,则只需测定一定浓度提取液在652nm波长的光密度。
其总叶绿素含量按下式计算:D 652 V总叶绿素=————×————(mg/g鲜重)34.5 1000×WD——表示在所指定波长下,叶绿素提取液的光密度读数;V——为叶绿素丙酮提取液的最终体积(mL);W——为所用果蔬组织鲜重(g)。
二、实验材料、试剂与仪器绿叶青菜,黄瓜,玻璃砂。
丙酮。
分光光度计。
三、实验步骤(一)叶绿素提取及含量测定均匀称取青菜样品5g于研钵中,加入少许玻璃砂(约0.5-1g),充分研磨后倒入100mL 容量瓶中,然后用丙酮分几次洗涤研钵并倒入容量瓶中,用丙酮定容至100mL。
叶绿素
0.635 0.457 0.661 0.67 0.357 0.445 0.399 0.73 0.775 0.614 0.399 0.435 0.379 0.351 0.371 0.577
0.209 0.213 0.449 0.26 0.127 0.187 0.139 0.251 0.267 0.261 0.147 0.183 0.148 0.135 0.127 0.189
14 645 0.278 0.336 0.277 0.234 0.237 0.225 0.22 0.184 0.186 0.233 0.241 0.228 0.2 0.222 0.214 0.211 0.254 0.225 0.166 0.205 0.233 0.162 0.17 0.19 0.181
Ⅱ
样品 正正旗叶 正正倒二叶 正正倒三叶 正中旗叶 正中倒二叶 正中倒三叶 正重旗叶 正重倒二叶 正重倒三叶 中正旗叶 中正倒二叶
处理2
处理3
处理4
645 0.227 0.282 0.286 0.196 0.211 0.197 0.113 0.11 0.115 0.25 0.231
处理4
处理5Leabharlann 处理6Ⅱ第一次 Ⅰ 663 Ca Cb 2.136 7.53364 2.80445 2.5 9.11864 3.319 2.5 9.10076 3.36947 0.77 5.20059 2.01628 1.629 7.73893 2.92649 1.002 7.8092 3.27376 0.355 3.21253 1.29878 0.567 4.9562 2.34757 0.506 4.03319 2.0066 1.616 8.49241 3.04448 2.5 9.15674 3.30499 1.235 9.43046 3.46771 0.467 3.09589 1.25388 0.805 6.64121 2.40834 2.5 9.54969 3.48971 0.467 0 0 0.479 4.65006 1.9334 0.484 4.70295 2.11148 1.399 8.30007 2.80794 2.221 8.41437 2.76591 2.5 8.99732 3.10024 0.616 0 0 0.882 6.11374 2.22919 0.664 5.49528 1.88597 0.64 5.76198 1.7879 1.212 7.88481 2.39 1.29 6.88276 2.20978 0 0 0 0 第二次 0 0 Ⅰ 663 Ca Cb 0.635 8.59008 2.50377 0.784 9.41433 2.74937 0.789 8.97292 2.67026 0.532 5.31848 1.51203 0.564 6.05383 1.79032 0.532 4.80346 1.43804 0.25 2.52046 0.96068 0.26 2.79961 0.96777 0.267 3.1192 1.04778 0.654 7.40246 2.45763 0.605 8.59919 2.96132
