实验一 201402总蛋白测定 (2)
总蛋白实验测定实验报告

一、实验目的1. 掌握双缩脲试剂法测定血清总蛋白的原理和方法;2. 熟悉实验操作步骤,提高实验技能;3. 了解血清总蛋白的临床意义及检测方法。
二、实验原理血清总蛋白(Total Protein,TP)是指血液中所有蛋白质的总和,包括白蛋白、球蛋白、纤维蛋白原等。
双缩脲试剂法是一种常用的蛋白质定量分析方法,其原理是蛋白质分子中的肽键在碱性溶液中能与铜离子发生双缩脲反应,生成紫红色络合物。
该络合物在540nm处的吸光度与蛋白质含量在一定范围内呈线性关系,通过测定吸光度可计算出蛋白质含量。
三、实验材料与仪器1. 实验材料:(1)血清样本:采集患者空腹静脉血,分离血清;(2)双缩脲试剂:硫酸铜、酒石酸钾钠、碘化钾;(3)NaOH溶液:6.0mol/L;(4)蛋白质标准液:60~70g/L;(5)试管、移液器、分光光度计等。
2. 仪器:(1)分光光度计;(2)恒温水浴锅;(3)移液器;(4)试管架。
四、实验步骤1. 标准曲线的绘制:(1)取6支试管,分别加入0、0.5、1.0、1.5、2.0、2.5mL蛋白质标准液;(2)向各试管中加入6.0mol/L NaOH溶液1.5mL;(3)向各试管中加入双缩脲试剂A液1.0mL;(4)混匀,室温放置10分钟;(5)向各试管中加入双缩脲试剂B液4.0mL;(6)混匀,室温放置10分钟;(7)以空白管调零,在540nm波长下测定吸光度;(8)以蛋白质浓度为横坐标,吸光度为纵坐标,绘制标准曲线。
2. 血清总蛋白的测定:(1)取血清样本0.5mL,按照步骤1的操作进行测定;(2)以标准曲线为依据,计算血清总蛋白含量。
五、实验结果与分析1. 标准曲线绘制:根据实验数据绘制标准曲线,计算线性回归方程。
2. 血清总蛋白测定:根据标准曲线,计算血清总蛋白含量。
3. 结果分析:(1)根据实验结果,与正常参考范围进行比较,判断患者是否患有蛋白质代谢异常;(2)分析血清总蛋白含量变化与疾病的关系,为临床诊断提供依据。
生化总蛋白实验报告

1. 理解生化总蛋白测定的原理和意义。
2. 掌握双缩脲试剂法测定血清总蛋白的操作步骤。
3. 学习如何通过实验结果分析血清总蛋白的含量及其临床意义。
二、实验原理血清总蛋白的测定通常采用双缩脲试剂法。
该法基于蛋白质分子中的肽键在碱性条件下与铜离子(Cu2+)反应,生成紫红色的络合物。
紫红色络合物的颜色深浅与蛋白质的含量成正比,通过比色法可以定量测定蛋白质的含量。
三、实验材料1. 实验试剂:- 小牛血清- 6.0mol/L NaOH 溶液- 双缩脲试剂(包括硫酸铜、酒石酸钾钠、碘化钾)- 标准蛋白质溶液- 比色皿- 移液器- 离心机- 吸管- 酶标仪2. 实验仪器:- 恒温水浴箱- 移液器- 离心机- 酶标仪1. 样品制备:取一定量的血清样品,按照要求进行稀释。
2. 标准曲线制作:取标准蛋白质溶液,按照试剂说明书进行稀释,制备一系列不同浓度的标准溶液。
将标准溶液分别加入比色皿中,加入适量的双缩脲试剂,混匀后放入恒温水浴箱中反应一定时间。
3. 样品测定:将制备好的血清样品按照步骤2进行操作。
4. 比色:将反应后的样品放入酶标仪中,在特定波长下测定吸光度。
5. 数据处理:根据标准曲线和样品的吸光度,计算样品中蛋白质的含量。
五、实验结果1. 标准曲线的制作:通过绘制标准曲线,得到吸光度与蛋白质浓度的关系。
2. 样品测定:根据标准曲线和样品的吸光度,计算样品中蛋白质的含量。
六、讨论和分析1. 实验原理:双缩脲试剂法测定血清总蛋白是一种常用的方法,具有操作简便、准确度高等优点。
2. 实验结果分析:通过实验结果可以了解样品中蛋白质的含量,从而评估样品的蛋白质水平。
3. 临床意义:血清总蛋白的测定在临床医学中具有重要意义,可以用于评估患者的营养状况、肝功能等。
七、注意事项1. 实验操作过程中应严格控制试剂的加入量,避免误差。
2. 样品制备过程中应避免污染,保证实验结果的准确性。
3. 实验操作过程中应遵守实验室安全规范,确保人身安全。
血清总蛋白测定双缩脲试剂法

血清总蛋白测定(双缩脲试剂法)生物化学实验报告姓名:学号:专业年级:组别:生物化学与分子生物学实验教学中心实验名称血清总蛋白测定(双缩脲试剂法)实验日期2014-11-21 实验地点第五实验室合作者指导老师评分教师签名批改日期一、实验目的1、掌握双缩脲测定血清总蛋白的基本原理、操作;2、熟悉血清总蛋白的临床意义;3、了解双缩脲法测定血清总蛋白的特点和注意事项。
二、实验原理(一):双缩脲反应在碱性溶液中,双缩脲(H2NOC-NH-CONH2)能与Cu2+作用,形成紫色或紫红色的络合物,这个反应叫做双缩脲反应。
两分子尿素加热脱氨缩合成的双缩脲(H2N-OC-NH-CO-NH2),因分子内含有两个邻接的肽键,在碱性溶液中可与Cu2+发生双缩脲反应,生成紫红色络合物;蛋白质分子含有大量彼此相连的肽键(-CO-NH-),同样能在碱性条件下与Cu2+发生双缩脲反应,生成的紫红色络合物,且在540nm处的吸光度与蛋白质的含量在10~120g/L范围内有良好的线性关系。
三、材料与方法:实验材料样品:大牛血清试剂:双缩脲试剂、蛋白质标准液(70g/L)、生理盐水(0.9%)器材:试管、加样枪、刻度吸管、洗耳球设备:1100分光光度计、水浴锅实验步骤取3支试管,做好标记(B空白对照,S标准液,U为待测大牛血清),按下表操作:加入物(ml) B (空白)S (标准)U(待测)大牛血清(1:10)- - 0.5蛋白标准液(1:10)- 0.5 -0.9%氯化钠溶液0.5 - -双缩脲试剂 4.0 4.0 4.0a.各管混匀,观察各试管颜色b.将各试管置于37℃水浴锅中加热20min,观察颜色c.将试管中的液体倒入比色杯中,置于1100分光光度计的样品槽内,在波长540nm,以空白管调零,测S和U管吸的光度。
d.测定结束后,将比色杯中的样品回收进试管依据公式算出结果四、结果与讨论:(一):实验结果1、实验现象:a、在实验中首先加入双缩脲试剂,再依次加入0.9%氯化钠溶液、蛋白质标准液、相应的大牛血清后溶液没有明显的颜色变化,呈淡蓝色透明状;b、水浴20分钟之后,B试管试管显淡蓝色;S试管和U试管显浅紫色且S试管的颜色比U试管的颜色稍深。
总蛋白定量测定-原理-方法

总蛋白定量测定/原理/方法1、原理磺基水杨酸为生物碱试剂,能沉淀蛋白质,但对白蛋白的沉淀能力比球蛋白强,加适量硫酸钠后,沉淀白、球蛋白的能力趋于一致,与标准蛋白浊度对比进行定量测定。
2、试剂磺基水杨酸-硫酸钠试剂(SS-S)磺基水杨酸3.0g无水硫酸钠7.0g蒸馏水加至100ml过滤后,储存于棕色瓶中,如显色或混浊则不能用。
3、方法(1)制备标准曲线含蛋白200、400、800、1200、1600mg/L的稀释混合人血清标准系列各0.5ml,加SS-S试剂4.5ml,搜|索整理充分混匀,7~15分钟后,用420nm波长比浊,以吸光度为纵坐标,蛋白质浓度为横坐标,绘制标准曲线。
(2)样品检测取待测脑脊液标本各0.5ml于两只试管中,其中一只试管加SS-S试剂4.5ml,另一试管加154mmol/L的NaCl溶液4.5ml作为标本空白管。
在与标准曲线相同的条件下比浊,所得得吸光度可从标准曲线上求得蛋白质浓度。
4、注意事项(1)脑脊液如有多量细胞或混浊,应先离心以除去。
如蛋白质浓度过高,应先行用生理盐水稀释后重新测定。
(2)加入SS-S试剂的操作手法和速度、室温及比浊前的放置时间都会影响实验结果。
故操作时应注意控制加入试剂的方式和比浊时间与标准管一致。
应随气温改变,勤作标准曲线。
5、正常参考值腰穿CSF蛋白含量:0.2~0.4g/L池穿CSF蛋白含量:0.1~0.25g/L侧脑室穿刺CSF蛋白含量:0.05~0.15g/L脑脊液蛋白质含量与年龄成正比,儿童含量较低,成人稍高,老年人又比成年人高。
6、临床意义脑脊液蛋白质含量增高,为血脑屏障被破坏的标志。
颇受临床工作者的重视。
蛋白质含量增高常见于下列情况:(1)中枢神经系统炎症。
脑部感染时,脑膜和脉络丛毛细血管通透性增加,蛋白质分子容易透过,首先是白蛋白增高,随后是球蛋白和纤维蛋白增高。
(2)神经根病变。
如急性感染性多发性神经炎(Guillain-Barre综合征),多数病例有蛋白质增高,而细胞数正常或接近正常,即蛋白-细胞分离现象。
02 实验二 蛋白质的定量测定方法
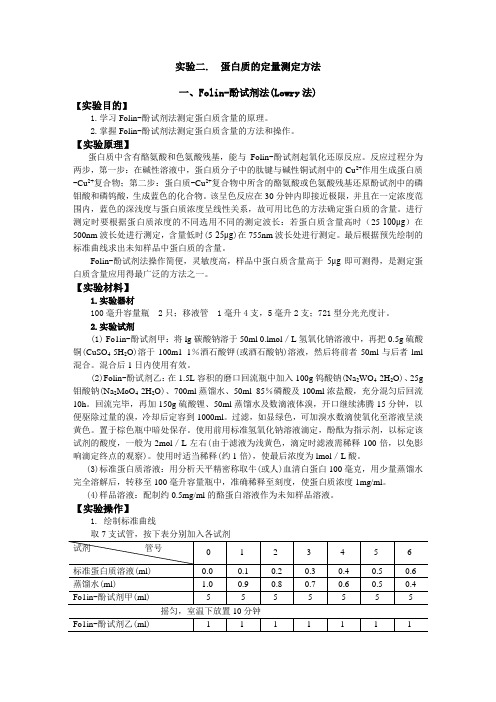
实验二. 蛋白质的定量测定方法一、Folin-酚试剂法(Lowry法)【实验目的】1.学习Folin-酚试剂法测定蛋白质含量的原理。
2.掌握Folin-酚试剂法测定蛋白质含量的方法和操作。
【实验原理】蛋白质中含有酪氨酸和色氨酸残基,能与Folin-酚试剂起氧化还原反应。
反应过程分为两步,第一步:在碱性溶液中,蛋白质分子中的肽键与碱性铜试剂中的Cu2+作用生成蛋白质-Cu2+复合物;第二步:蛋白质-Cu2+复合物中所含的酪氨酸或色氨酸残基还原酚试剂中的磷钼酸和磷钨酸,生成蓝色的化合物。
该呈色反应在30分钟内即接近极限,并且在一定浓度范围内,蓝色的深浅度与蛋白质浓度呈线性关系,故可用比色的方法确定蛋白质的含量。
进行测定时要根据蛋白质浓度的不同选用不同的测定波长:若蛋白质含量高时(25-100μg)在500nm波长处进行测定,含量低时(5-25μg)在755nm波长处进行测定。
最后根据预先绘制的标准曲线求出未知样品中蛋白质的含量。
Folin-酚试剂法操作简便,灵敏度高,样品中蛋白质含量高于5μg即可测得,是测定蛋白质含量应用得最广泛的方法之一。
【实验材料】1.实验器材100毫升容量瓶 2只;移液管 1毫升4支,5毫升2支;721型分光光度计。
2.实验试剂(1) Fo1in-酚试剂甲:将lg碳酸钠溶于50ml 0.lmol/L氢氧化钠溶液中,再把0.5g硫酸铜(CuSO4·5H2O)溶于100m1 1%酒石酸钾(或酒石酸钠)溶液,然后将前者50ml与后者lml 混合。
混合后1日内使用有效。
(2)Folin-酚试剂乙:在1.5L容积的磨口回流瓶中加入100g钨酸钠(Na2WO4·2H2O)、25g 钼酸钠(Na2MoO4·2H2O)、700ml蒸馏水、50ml 85%磷酸及100ml浓盐酸,充分混匀后回流10h。
回流完毕,再加150g硫酸锂、50ml蒸馏水及数滴液体溴,开口继续沸腾15分钟,以便驱除过量的溴,冷却后定容到1000ml。
实验二 血清总蛋白测定(双缩脲法)

实验二血清总蛋白测定(双缩脲法)实验二血清总蛋白测定(双缩脲法)血清总蛋白是血清中所有蛋白质的总称,正常人含量为60-80g/L。
按不同的分离方法可将血清蛋白质分为不同的组分。
从目前临床生化实际应用上,血清总蛋白分为清蛋白和球蛋白两大类,其中球蛋白又分为α1球蛋白、α2球蛋白、β球蛋白、γ球蛋白四种。
正常成人每天所合成的血清蛋白质中,清蛋白及大部分α1、α2、β球蛋白是肝脏合成的,γ球蛋白(大部分是免疫球蛋白)则主要来源与浆细胞。
总蛋白测定,一般利用下列四种蛋白质的结构或性质进行:重复的肽键结构;酪氨酸和色氨酸残基对酚试剂反应或紫外吸收;与染料的结合能力;沉淀后借浊度或光折射测定。
目前临床应用最广泛的方法是利用蛋白质分子中的多个肽键与双缩脲试剂显色法。
【目的】1. 熟悉血清总蛋白测定的原理及基本操作。
2. 掌握血清总蛋白测定的临床意义。
【原理】蛋白质分子中的肽键(-CONH-)在碱性条件下能与Cu2+ 作用形成紫红色络合物。
此呈色反应与双缩脲(H2N-OC-NH-CO-NH2)在碱性溶液中与Cu2+ 作用产生紫红色的反应相似,故称为双缩脲反应。
反应中溶液颜色的深浅与蛋白质的含量成正比,可用分光光度法定量检测蛋白质的含量。
凡具有两个以上肽键结构的化合物均有此反应,因此双缩脲反应广泛用于肽及蛋白质定性、定量检测。
【器材】恒温水浴箱、分光光度计、刻度吸管、微量移液管、试管、试管架。
【试剂】1.6mol /L NaOH溶液称取NaOH (优级纯)240g ,溶解于新鲜蒸馏水中并加至1000ml 。
置聚乙烯瓶内盖紧室温保存。
2. 双缩脲试剂精确称取结晶硫酸铜(CuSO4·5H20)3.0g,酒石酸钾(NaKC4H4O6·4H2O) 9.0g,碘化钾(KI)5.0g,用500m1新鲜蒸馏水溶解。
在搅拌下,加入6mol /L 氢氧化钠溶液100ml ,最后加蒸馏水稀释至1000ml 。
置聚乙烯瓶内盖紧室温保存。
实验二血清总蛋白测定_图文

血清TP常用双缩脲法测定,凯氏定氮法 可作为血清总蛋白二级标准品的定值方法。 其他方法可用于尿液、脑脊液、胸腹腔积液、 组织提取液、纯化蛋白等样品中TP的测定。
本实验采用双缩脲法测定血清中总蛋白含量。
实验原理
试剂与器材
试剂与标本 1、6 mol/L NaOH 溶液 2、双缩脲试剂(硫酸铜结晶、酒石酸钠钾、碘化钾) 3、双缩脲空白试剂 4、60~70 g/L 蛋白质标准液 5、血清
参考区间
测定管 吸光度
标准管 吸光度
× 标准液浓度
正常成人血清总蛋白浓度: 立位行走:64~83 g/L
静 卧: 60~78 g/L 新生儿总蛋白浓度较低,随后逐月上升,1年后达成人水平。
临床意义
血清TP浓度下降:
常见于血清白蛋白含量下 降,少数由免疫球蛋白含 量的明显下降引起;其他 血清蛋白质减少,一般不 能在TP浓度中得到反映。
主要器材 分光光度计
操作步骤
加入物 空白管 标准管×2
蒸馏水 0.05
-
标准液
-
0.05
血清
-
-
双缩脲试剂 4.0
4.0
测定管×2 - - 0.05 4.0
混匀后于37℃水浴15 min,以蒸馏水调零, 540 nm处测定各管吸光度。
标准液浓度:70.0g/L。
结果计算
血清总蛋 白浓度(g/L) =
特点
操作简便、灵敏度高,可用于尿液和脑脊液 蛋白质浓度低的样品测定。 但各种蛋白质形成的浊度有较大的差别,影 响浊度形成的干扰因素多。
方法
双缩脲法
原理
蛋白质中的连续肽键在碱性溶液中可与铜离 子作用产生紫色的络合物,再进行比色测定。
特点
测定总蛋白的实验报告

测定总蛋白的实验报告测定总蛋白的实验报告引言:蛋白质是构成生物体的基本组成部分,对于生命体的正常运行起着重要的作用。
因此,准确测定总蛋白的含量对于了解生物体的生理状态以及疾病的发展具有重要意义。
本实验旨在通过比色法测定标准蛋白溶液的浓度,进而推算出待测样品中蛋白质的含量。
实验材料与方法:材料:1. 标准蛋白溶液(浓度已知)2. 待测蛋白样品3. 二甲基亚砜(DMSO)4. 高纯度水5. 试剂盒(含有测定总蛋白的试剂)方法:1. 准备标准曲线:按照试剂盒说明书的要求,使用标准蛋白溶液制备一系列不同浓度的标准溶液。
2. 处理样品:将待测蛋白样品与DMSO按照一定比例混合,使其溶解。
3. 测定吸光度:使用紫外可见分光光度计,将标准溶液和待测样品的吸光度值分别测定,并记录下来。
4. 构建标准曲线:将标准溶液的浓度与吸光度值制作成标准曲线。
5. 计算待测样品中蛋白质的含量:根据待测样品的吸光度值,利用标准曲线,推算出待测样品中蛋白质的浓度。
结果与讨论:通过实验测得标准曲线如下图所示(图中吸光度值为纵坐标,浓度为横坐标):[插入标准曲线图]根据标准曲线,我们可以推算出待测样品中蛋白质的浓度。
在本实验中,我们测得待测样品的吸光度值为X,通过标准曲线可以得到其对应的蛋白质浓度为Y。
因此,我们可以得出待测样品中蛋白质的含量为Y。
在实验过程中,我们需要注意一些实验条件的控制,以保证测定结果的准确性。
首先,标准溶液的配制需要精确,避免误差的积累。
其次,在测定吸光度时,需要注意光程的一致性,以保证测量的准确性。
此外,待测样品的处理也需要谨慎,避免外界因素对蛋白质含量的影响。
总结:本实验通过比色法测定总蛋白的含量,通过标准曲线的构建和推算,得到了待测样品中蛋白质的含量。
实验结果对于了解生物体的生理状态以及疾病的发展具有重要意义。
在实验过程中,我们需要精确控制实验条件,以保证测定结果的准确性。
此外,实验的结果还可以为进一步的研究提供参考和基础。
总蛋白测定的方法

总蛋白测定的方法总蛋白(Test for Total Protein) 旨在测定体内所有蛋白质的总量,是一项简单而又广泛应用的生化检测指标。
其结果可作为判断人体内蛋白营养状况,水平测量肝、肾、肠、免疫系统的功能等的参考依据,也可以作为血液等液体的生化检测参数。
总蛋白测定方法有很多种,下面将介绍主要的两种方法。
方法一:生物学法该方法是利用多肽和蛋白质酸碱性的性质,通过起酸沉淀和加碱溶解的方式来测定总蛋白的含量。
下面是详细步骤:步骤1:准备样本。
收集血清或者其他生物组织中的Dose值(大多数情况下使用牛血清蛋白作为基准),样本前需要禁食8小时以上,防止干扰元素如糖原,脂类等影响结果。
步骤2:降低pH值。
将样本溶液加入少量的盐酸或者乙酸降低pH值到4.2-4.4使得大约85%的蛋白质沉淀。
步骤3:沉淀过滤。
利用蛋白质的天然性质,混匀后的样本进行磨光过滤或脱水过滤,过滤器垫层吸收杂质,而蛋白质沉淀则留下。
步骤4:加碱溶解。
加入碳酸氢钠溶液,使沉淀液体重点溶解,并用计量仪器尺度进行稀释。
步骤5:使用光度计测定样品。
准备好测量方法表,通过比较基准蛋白质溶液的浓度和样品的吸光度来测定到精确的总蛋白浓度。
使用重复检测的方式提高测量精度,避免干扰因素,如样品的色差干扰等。
方法二:化学分析法该方法是利用汞离子与自由氨基酸反应,从而与蛋白质结合并转化为乳白色的复合物,根据生成的复合物的厚度及黄色的程度来测定总蛋白的含量。
下面是详细步骤:步骤1:准备样本和化学试剂。
选择牛血清蛋白或其它生物体中的Dose值作为基准,还需要乙酸钠,塔希底蓝试剂,氢氧化钠,氨水等。
步骤2:加塔希底蓝试剂。
将不同化学试剂混合,加入样品或其稀释液,通过加热和搅拌的方式混合蛋白质和草酸钾对应形成复合物。
部分蛋白质可以被化合物分离,在此过程中,残液颜色转变成乳白色。
步骤3:加入氢氧化钠。
加入一定量的氢氧化钠使乳白色混合液呈现黄色的颜色,并再次翻转混合,这是由于氨基酸随着pH 增加而聚集。
02 血清总蛋白浓度测定

① 血清中水分增多,血清被稀释。如静脉注射过多低渗溶液或因各 种原因引起的水钠潴留。
② 营养不良和消耗增加,长期食物中蛋白质含量不足,或慢性肠道 疾病引起吸收不良,使体内缺乏合成蛋白质的原料;或因长期患 消耗性疾病,如严重结核病、甲状腺机能亢进或恶性肿瘤等,均 可造成血清总蛋白浓度降低。
-
50l蒸馏水-来自-双缩脲试剂3.0
3.0
混匀。37℃水浴10min后,540nm波长比色。
空白管
- -
50l
3.0
【结果记录】 A测定=
A标准= C标准=
【计算】
血清总蛋白(g/L)=A测/A标×标准总蛋白浓度(g/L)
【结果分析讨论】
【临床意义】
实验时间:
带课教师:
批阅时间: 成绩: .
7
3
2. 蛋白质与双缩脲试剂反应
2. 蛋白质与双缩脲试剂反应
4
操作
【操作】
取三支试管,分别标明测定管、标准管和空白管,然后 按下表加样。
试剂(ml) 血清标本 标准血清(70.0g/L) 生理盐水 双缩脲试剂
测定管
50l
- -
3.0
标准管 -
50l
-
3.0
空白管 - -
50l
3.0
混匀,置25℃水浴箱30分钟(或37℃水浴箱10分钟),取出 后在波长540nm处,用分光光度计进行比色,以空白管调零, 读取各管吸光度值。
血清总蛋白浓度测定
(双缩脲法)
河南科技大学医学院 生物化学与分子生物学教研室
【目的】
【目的】
1. 掌握双缩脲法测定血清总蛋白的 原理。
2. 熟悉操作过程及其临床意义。
总蛋白鉴定实验报告

一、实验目的1. 掌握蛋白质的鉴定原理和操作方法;2. 学会使用双缩脲试剂检测蛋白质;3. 了解蛋白质在生物体内的作用和重要性。
二、实验原理蛋白质是生命活动的基本物质之一,具有多种生物学功能。
在生物化学研究中,蛋白质的鉴定是基础工作之一。
本实验采用双缩脲试剂法对蛋白质进行鉴定,其原理如下:双缩脲试剂法是一种常用的蛋白质定量方法。
蛋白质分子中含有大量的肽键(-CO-NH-),在碱性条件下,肽键可以与Cu2+离子发生反应,生成紫红色的络合物。
该络合物在540nm处的吸光度与蛋白质含量呈线性关系,因此可以通过测定吸光度来计算蛋白质的含量。
三、实验材料与仪器1. 实验材料:- 蛋白质样品(如牛奶、鸡蛋清等)- 双缩脲试剂A(硫酸铜溶液)- 双缩脲试剂B(氢氧化钠溶液)- 0.1mol/L NaOH溶液- 0.01mol/L CuSO4溶液- 721型分光光度计- 移液器- 试管- 烧杯- 移液管2. 仪器:- 电子天平- 磁力搅拌器- 恒温水浴锅四、实验步骤1. 样品制备:取一定量的蛋白质样品,用蒸馏水稀释至适当浓度。
2. 混合试剂:取2ml蛋白质样品,加入2ml 0.1mol/L NaOH溶液,混匀。
3. 显色反应:向混合液中加入2ml 0.01mol/L CuSO4溶液,混匀。
4. 恒温:将混合液放入恒温水浴锅中,水浴加热5分钟。
5. 吸光度测定:在540nm波长下,用721型分光光度计测定混合液的吸光度。
6. 结果计算:根据标准曲线计算蛋白质样品的浓度。
五、实验结果与分析1. 标准曲线绘制:取一系列已知浓度的蛋白质标准品,按照上述步骤进行操作,得到吸光度值。
以蛋白质浓度为横坐标,吸光度值为纵坐标,绘制标准曲线。
2. 蛋白质浓度测定:根据实验测得的吸光度值,在标准曲线上查找对应的蛋白质浓度。
六、讨论与心得1. 双缩脲试剂法是一种简单、快速、灵敏的蛋白质定量方法,适用于多种蛋白质样品的测定。
2. 在实验过程中,需要注意以下几点:a. 混合试剂时要迅速,避免反应时间过长导致颜色褪去;b. 恒温水浴温度应控制在50-60℃,过高或过低都会影响实验结果;c. 在测定吸光度时,要确保比色皿清洁、干燥,避免杂质干扰。
总蛋白实验报告

一、实验目的1. 掌握双缩脲试剂法测定血清总蛋白的原理和操作步骤。
2. 了解血清总蛋白测定的临床意义和注意事项。
3. 培养实验操作技能和数据处理能力。
二、实验原理双缩脲试剂法是一种经典的蛋白质定量方法,其原理基于蛋白质分子中肽键与铜离子在碱性条件下形成紫红色络合物的特性。
在一定浓度范围内,蛋白质含量与紫红色络合物的吸光度成正比。
通过测定吸光度,可以计算出样品中的蛋白质含量。
三、实验材料1. 实验试剂:6.0mol/L NaOH溶液、双缩脲试剂(硫酸铜、酒石酸钾钠、碘化钾)、蛋白质标准液、待测血清样品。
2. 仪器:分光光度计、移液器、试管、烧杯、试管架等。
四、实验步骤1. 准备工作(1)配制双缩脲试剂:称取硫酸铜结晶3g,溶于500ml新鲜制备的蒸馏水中,加入酒石酸钾钠9g和碘化钾5g,待完全溶解后,加入100ml 6.0mol/L NaOH溶液,最后用蒸馏水定容至1L。
(2)配制蛋白质标准液:用定值参考血清或标准白蛋白配制蛋白质标准液,浓度为60~70g/L。
(3)将待测血清样品进行适当稀释。
2. 实验操作(1)取试管若干,编号,分别加入0.5ml蛋白质标准液、0.5ml待测血清样品(或稀释后的血清样品)和0.5ml蒸馏水作为空白对照。
(2)向每个试管中加入1.0ml双缩脲试剂,混匀。
(3)将试管置于水浴中加热5分钟,取出冷却至室温。
(4)用分光光度计在540nm波长处测定各管吸光度。
3. 数据处理(1)绘制标准曲线:以蛋白质标准液浓度为横坐标,吸光度为纵坐标,绘制标准曲线。
(2)根据待测血清样品的吸光度,从标准曲线上查得对应的蛋白质浓度。
五、实验结果与分析1. 标准曲线绘制:以蛋白质标准液浓度为横坐标,吸光度为纵坐标,绘制标准曲线。
2. 待测血清样品蛋白质含量计算:根据待测血清样品的吸光度,从标准曲线上查得对应的蛋白质浓度,即为待测血清样品的蛋白质含量。
六、讨论、心得1. 双缩脲试剂法测定血清总蛋白是一种快速、简便、准确的方法,广泛应用于临床检验和生物化学研究。
测定总蛋白的方法

测定总蛋白的方法测定总蛋白的方法主要包括以下几种:1.双缩脲法:这是一种常用的蛋白质定量方法。
蛋白质中的肽键(-CONH-)在碱性条件下与Cu2+络合成紫红色复合物,产生的颜色强度在肯定范围内与蛋白质含量成正比。
双缩脲试剂与蛋白质中的肽键反应,形成紫色复合物,通过比色法或分光光度法测定其吸光度,进而推算出总蛋白的含量。
2.溴甲酚绿法:溴甲酚绿是一种酸性染料,它与蛋白质结合后颜色会发生变化。
通过测量溶液中颜色的变化,可以间接测定总蛋白的浓度。
3.凯氏定氮法:这是一种经典的蛋白质定量方法。
通过将样品中的蛋白质消解,使其中的氮转化为氨气,然后用酸吸收氨气并进行定量分析,从而计算出总蛋白的含量。
将血清与强酸一起加热消化,使血清中的含氮化合物转化为铵盐,再加碱使铵盐成为氨进经蒸馏分别出来,最终用酸滴定测定氮量,按每克氨相当于6.25g蛋白质计算蛋白质的浓度。
4.电泳法:电泳技术可以根据蛋白质的电荷和分子量差异将其分离,并通过染色或免疫印迹等方法进行定量或定性分析。
5.免疫分析法:利用特异性抗体与蛋白质的结合反应,如酶联免疫吸附测定(ELISA)、免疫比浊法等,来检测总蛋白的含量。
6.质谱法:质谱技术可以精确测定蛋白质的质量和含量,常用于蛋白质组学研究和复杂样品中的总蛋白分析。
7.酚试剂法:蛋白质分子中的酪氨酸残基和色氨酸残基能够和酚试剂中的磷钨酸-磷钼酸反应生成蓝色化合物。
8.紫外分光光度法:蛋白质分子内的色氨酸、酪氨酸等芳香族氨基酸可使蛋白质溶液在280nm波特长有一汲取峰,依此性质可用于蛋白质定量。
9.染料结合法:在酸性环境中,蛋白质分子解离出的-NH3+,可与染料的阴离子产生颜色反应。
常用的染料有氨基黑、考马斯亮蓝等。
10.比浊法:用某些酸类(如二氯醋酸、磺基水杨酸等)和血清蛋白质结合产生沉淀,然后测定其浊度。
这些方法各有优缺点,如凯氏定氮法结果精确,但操作复杂;双缩脲法简便、精确、重复性好,但灵敏度稍差;紫外分光光度法敏感且简便,但受尿酸和胆红素干扰;染料结合法操作简便、重复性好、灵敏度高,但特异性不高;比浊法操作简便,但准确性较差。
血清总蛋白实验报告

一、实验目的1. 了解血清总蛋白在人体生理和病理过程中的作用。
2. 掌握血清总蛋白测定的原理和方法。
3. 通过实验操作,提高实验技能和数据分析能力。
二、实验原理血清总蛋白是血液中所有蛋白质的总和,包括白蛋白、球蛋白和纤维蛋白原等。
血清总蛋白含量的测定对临床诊断具有重要意义,如肝脏疾病、肾脏疾病、营养不良等。
实验原理:血清(浆)中蛋白质的肽键(-CO-NH-)在碱性溶液中能与2价铜离子作用生成稳定的紫红色络合物。
这种紫红色络合物在540nm处的吸光度与血清蛋白含量在一定范围内呈正比关系。
三、实验材料1. 实验试剂:6.0mol/L NaOH溶液、双缩脲试剂(硫酸铜、酒石酸钾钠、碘化钾)、蛋白质标准液、血清样品等。
2. 实验器材:分光光度计、移液器、试管、试管架、吸管等。
四、实验步骤1. 标准曲线绘制(1)取6个试管,分别加入0、0.2、0.4、0.6、0.8、1.0mL蛋白质标准液,然后加入2.0mL 6.0mol/L NaOH溶液。
(2)在每支试管中加入0.4mL双缩脲试剂,摇匀。
(3)室温放置10分钟。
(4)在540nm波长下,以空白管调零,测定各管吸光度。
(5)以蛋白质浓度为横坐标,吸光度为纵坐标,绘制标准曲线。
2. 样品测定(1)取3个试管,分别加入0.2mL血清样品、0.2mL蒸馏水和0.2mL 6.0mol/L NaOH溶液。
(2)按照标准曲线绘制步骤进行操作。
(3)在540nm波长下,以空白管调零,测定各管吸光度。
3. 结果计算(1)根据样品测定吸光度,从标准曲线上查得蛋白质浓度。
(2)计算血清总蛋白含量。
五、实验结果与分析1. 标准曲线绘制根据实验数据绘制标准曲线,得到线性方程:y = 0.062x + 0.015,R² = 0.99。
2. 样品测定血清样品1、2、3的吸光度分别为0.60、0.55、0.50,查得蛋白质浓度分别为60.0mg/L、55.0mg/L、50.0mg/L。
总蛋白测定方法

总蛋白测定方法
总蛋白测定那可是超重要的事儿!咱先说说测定方法的步骤吧。
嘿,你想想,这就好比一场精心策划的实验大冒险。
首先,取适量样本,就像厨师挑选新鲜食材一样认真。
然后,通过特定的试剂进行反应,看着颜色变化,哇,那场面就像变魔术一样神奇。
接着,用仪器测量反应后的结果,这一步可不能马虎,得像侦探寻找线索一样仔细。
注意事项也不少呢!样本的采集和保存得严格把关,不然结果可能就不靠谱啦。
就像做蛋糕,材料不好,蛋糕能好吃吗?试剂的使用要准确,可不能乱倒一通。
仪器也得校准好,不然就像没瞄准的枪,能打中目标吗?
说到安全性,只要按照规范操作,那基本没啥大问题。
就像走在平坦的大路上,只要不瞎折腾,就不会摔跤。
稳定性也不错哦,只要条件控制好,结果就比较可靠。
这就像盖房子,基础打得牢,房子就不会歪。
总蛋白测定的应用场景可广啦!在医院里,能帮助医生诊断疾病,你说重要不重要?在科研领域,也是个得力助手呢。
它的优势也很明显,快速、准确、方便。
就像有个超级小助手,随时为你服务。
给你举个实际案例吧。
有个病人身体不舒服,医生通过总蛋白测定,发现了问题所在,及时进行治疗。
如果没有这个测定方法,那可就像在黑暗中摸索,啥也不知道。
总蛋白测定就是这么牛!它是我们了解身体和进行科学研究的好帮手,一定要好好利用它。
测定总蛋白的实验报告

测定总蛋白的实验报告引言蛋白质是生物体内的重要构成成分之一,对于了解生物体的生理过程具有重要意义。
测定总蛋白的方法有多种,本实验选用了经典的比色法来进行测定。
实验目的本实验的目的是通过比色法测定给定样品中总蛋白的含量。
实验原理比色法是一种常用的蛋白质定量方法,其基本原理是利用蛋白质与某些试剂形成可测定吸光度的复合物,通过测定吸光度的变化来判断蛋白质的含量。
实验步骤以下是测定总蛋白的实验步骤:1.准备工作:将实验室用具洗净,并确保仪器的正常工作状态。
2.样品处理:将待测样品进行必要的处理,如稀释或离心等,以适应实验要求。
3.制备标准曲线:按照一定的浓度比例,配制一系列已知浓度的蛋白质标准溶液。
4.反应操作:将标准溶液和待测样品分别与试剂按照一定比例混合,使其反应发生。
5.吸光度测定:将混合后的溶液置于分光光度计中,设定波长并记录吸光度数值。
6.绘制标准曲线:根据已知标准溶液的吸光度值和浓度,绘制标准曲线。
7.测定待测样品:以同样的方法将待测样品进行吸光度测定,并根据标准曲线计算其蛋白质含量。
实验结果与分析根据吸光度测定的数据,我们绘制了标准曲线,并计算出待测样品的蛋白质含量。
以下是实验结果的示例数据:标准溶液浓度 (mg/mL) 吸光度 (A)0.1 0.250.2 0.450.4 0.850.6 1.250.8 1.651.02.05根据标准曲线,我们可以得出待测样品的吸光度为1.35。
通过插入标准曲线的方程,计算出待测样品的蛋白质含量为0.7 mg/mL。
结论通过本实验,我们成功地利用比色法测定了给定样品中总蛋白的含量,并得出了最终结果为0.7 mg/mL。
这项实验结果为后续的研究提供了重要的数据支持。
实验改进与展望在实验过程中,我们可以进一步改进的地方有:1.优化样品处理方法,以提高实验的准确性和精确性。
2.使用更精密的仪器和试剂,提高实验的敏感度和可靠性。
3.进一步扩大标准曲线的浓度范围,以适应更广泛的蛋白质浓度范围。
实验一蛋白质含量的测定

〔Ⅱ〕实验部分实验一蛋白质含量测定法本实验的目的是学会各种蛋白质含量的测定方法。
了解各种测定方法的基本原理和优缺点。
蛋白质含量测定法,是生物化学研究中最常用、最基本的分析方法之一。
目前常用的有四种古老的经典方法,即定氮法,双缩尿法(Biuret法)、Folin-酚试剂法(Lowry法)和紫外吸收法。
另外还有一种近十年才普遍使用起来的新的测定法,即考马斯亮蓝法(Bradford法)。
其中Bradford法和Lowry法灵敏度最高,比紫外吸收法灵敏10~20倍,比Biuret法灵敏100倍以上。
定氮法虽然比较复杂,但较准确,往往以定氮法测定的蛋白质作为其他方法的标准蛋白质。
值得注意的是,这后四种方法并不能在任何条件下适用于任何形式的蛋白质,因为一种蛋白质溶液用这四种方法测定,有可能得出四种不同的结果。
每种测定法都不是完美无缺的,都有其优缺点。
在选择方法时应考虑:①实验对测定所要求的灵敏度和精确度;②蛋白质的性质;③溶液中存在的干扰物质;④测定所要花费的时间。
考马斯亮蓝法(Bradford法),由于其突出的优点,正得到越来越广泛的应用。
一、微量凯氏(Kjeldahl)定氮法样品与浓硫酸共热。
含氮有机物即分解产生氨(消化),氨又与硫酸作用,变成硫酸氨。
经强碱碱化使之分解放出氨,借蒸汽将氨蒸至酸液中,根据此酸液被中和的程度可计算得样品之氮含量。
若以甘氨酸为例,其反应式如下:CH2COOH|+ 3H2SO4 →2CO2 + 3SO2 +4H2O +NH3 (1)NH22NH3 + H2SO4→(NH4)2SO4(2)(NH4)2SO4 + 2NaOH →2H2O +Na2SO4 + 2NH3(3)反应(1)、(2)在凯氏瓶内完成,反应(3)在凯氏蒸馏装置中进行。
为了加速消化,可以加入CuSO4作催化剂,K2SO4以提高溶液的沸点。
收集氨可用硼酸溶液,滴定则用强酸。
实验和计算方法这里从略。
计算所得结果为样品总氮量,如欲求得样品中蛋白含量,应将总氮量减去非蛋白170 / 13氮即得。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
全国高等医药院校医学检验专业规划教材 临床生物化学检验实验指导 (第二版)
3.本法也可用于血清总蛋白浓度的标化, 但显色温度须控制在(25±1)℃的范围内, 以及使用经过校正的高级分光光度计(波长 带宽≤2nm,比色杯光径为准确1.0cm)进行 比色。然后再按下式计算标化结果:
血清总蛋白(g / L) Au ARB AB 5.1
24
全国高等医药院校医学检验专业规划教材 临床生物化学检验实验指导 (第二版)
唯一的缺点是灵敏度较低,比酚试剂法低约 100倍。但本法的检出限为0.2~1.7g/L,已 能满足临床生化检验的需要。 本法是临床测定血清总蛋白质首选最方便、 最实用的常规方法。 临床上常见的血清蛋白定量法主要有双缩脲 法、临床折射计法、染料结合法和免疫比浊 法。
方法评价
双缩脲显色反应仅和蛋白质中肽键数成正比关 系,与蛋白质的种类、分子量及氨基酸的组成无 明显关系,各种蛋白质的显色程度基本相同。 本法重复性好,RCV为4%,CCV为3.9%;线性范围 为0~140g/L;本法干扰少,使用单一的稳定试 剂,操作简便、快速,既适于手工操作,也便于 自动化分析,已被推荐为测定血清总蛋白的参考 方法。
8
全国高等医药院校医学检验专业规划教材 临床生物化学检验实验指导 (第二版)
1、剂量反应曲线的建立方法
当建立一个新的分析方法的浓度范围尚未 确定时,为了能够较准确地测定出该方法的浓 度范围,不同浓度的设置宜适当多些,浓度间 隔要小些。此曲线除了标准浓度过高部分发生 弯曲(因浓度过高时,吸光粒子之间的平均距 离减小,粒子的电荷分布发生改变,使其相关 系数发生改变,导致对Beer定律的偏离)外, 其余大部分都呈直线,我们即可选取此直线段 浓度范围作为该方法的分析范围。
0.298
0.1
22
全国高等医药院校医学检验专业规划教材 临床生物化学检验实验指导 (第二版)
式中0.298为蛋白质双缩脲络合物的比吸光 系数。即按Doumas双缩脲试剂的标准配方, 在上述规定的测定条件下,双缩脲反应液 中蛋白质浓度为1.0g/L时的吸光度。
23
全国高等医药院校医学检验专业规划教材 临床生物化学检验实验指导 (第二版)
B
U
血清
-
0.1
标准液
-
-
蒸馏水
0.1
-
双缩脲试剂
5.0
5.0
37℃10min,在波长540nm处比色,以空白管调零,测定各管吸光度。查 标准曲线得结果:
4
全国高等医药院校医学检验专业规划教材 临床生物化学检验实验指导 (第二版)
实验结果1
2、仪器编号 操作者 日期 室温
管号
1
2
3
4
5
6
吸光度1
吸光度2
25
结果计算
直接从校准曲线上查得 从回归方程中计算 以校准曲线第3管的吸光度和浓度来计算, 计算公式为 血清总蛋白=AU/As×Cs
17
全国高等医药院校医学检验专业规划教材 临床生物化学检验实验指导 (第二版)
参考范围
附表 血清TP与年龄和体位的关系
早产儿
36~60 g/L ≥3岁
60~80g/L
新生儿
12
全国高等医药院校医学检验专业规划教材 临床生物化学检验实验指导 (第二版)
2.血清总蛋白校准曲线制作
从血清总蛋白的剂量反应曲线已知其 线性上限可达140g/L,因而要求在此范围 内制作校准曲线。校准曲线可提供实际检 测系统中浓度和吸光度的已知关系,从而 计算出标本的测定浓度。
13
全国高等医药院校医学检验专业规划教材 临床生物化学检验实验指导 (第二版)
全国高等医药院校医学检验专业规划教材 临床生物化学检验实验指导 (第二版)
实验一 血清总蛋白测定及其校准曲线制作
1
全国高等医药院校医学检验专业规划教材 临床生物化学检验实验指导 (第二版)
实验报告要求
实验目的 实验原理(仅限于本实验) 主要器材(可省略) 操作方法(以表格为主) 实验结果(以表格为主、原始数据) 计算(公式)与结果 讨论(对原理和方法学、对测定结果、影 响因素等)
2
全国高等医药院校医学检验专业规划教材
临床生物化学检验实验指导 (第二版)
操作方法
1、系列标准浓度配制及校准曲线测定操作
管号
1
140g/L蛋白标准液 (ul)
0
2
3
4
5
6
20
40
60
80
100
去离子水(ul) 100 80
60
40
20
0
双缩脲试剂(ml) 5.0 5.0 5.0 5.0 5.0 5.0
40
20
0
双缩脲试剂(ml) 5.0 5.0 5.0 5.0 5.0 5.0
相当于蛋白质(g/L) 0 28.0 56.0 84.0 112.0 140.0
各管平行做3管,充分混匀,37℃10min,在波长540nm处比色,以第1管 或蒸馏水调零,测定各管吸光度。
16
全国高等医药院校医学检验专业规划教材 临床生物化学检验实验指导 (第二版)
46~70g/L
1周龄
成人 44~76g/L 非卧床
7月龄~1岁 51~73g/L 卧床
1~2岁
56~75 g/L
64~83g/L 60~78g/L
18
全国高等医药院校医学检验专业规划教材 临床生物化学检验实验指导 (第二版)
临床意义
1.血清总蛋白浓度降低 蛋白质合成障碍 蛋白质丢失增加:严重烧伤;大出血;肾 病综合征。 营养不良或消耗增加 血浆稀释
平均吸光度
相当于蛋白质(g/L) 0 剂量反应曲线 y=ax+b
28.0 r2=
56.0
84.0 112.0 140.0
5
全国高等医药院校医学检验专业规划教材
临床生物化学检验实验指导 (第二版)
实验结果2
2、仪器编号 操作者 日期 室温 管号
U1
U2
吸光度1
吸光度2 平均吸光度
相当于蛋白质(g/L)
光度,用目测法绘出一条通过零点、呈45度角 的直线,使直线所通过各点的垂直距离最短。
10
全国高等医药院校医学检验专业规划教材 临床生物化学检验实验指导 (第二版)
3、对剂量反应曲线线性的评价
(1)审核平行管吸光度,对其中的离群值进 行检验剔除。简单的方法是将吸光度相差 大于0.005的数据弃去。
(2)建立线性回归方程y = a + bx ,a为截 距,b为斜率。
相当于蛋白质(g/L) 0 28.0 56.0 84.0 112.0 140.0
各管平行做3管,37℃10min,在波长540nm处比色,以第1管或蒸馏水调 零,测定各管吸光度。
3
全国高等医药院校医学检验专业规划教材 临床生物化学检验实验指导 (第二版)
操作方法
2、双缩脲法测定血清总蛋白操作步骤
加入物(ml)
19
全国高等医药院校医学检验专业规划教材 临床生物化学检验实验指导 (第二版)
临床意义
2.血清总蛋白浓度增高 蛋白质合成增加:多发性骨髓瘤。 血浆浓缩:如急性脱水 外伤性休克 慢性肾上腺皮质功能减退
20
全国高等医药院校医学检验专业规划教材 临床生物化学检验实验指导 (第二版)
注意事项
1.黄疸血清、严重溶血;葡萄糖、酚酞及溴磺酞钠 对本法有明显干扰,故用标本空白管来消除。
9
全国高等医药院校医学检验专业规划教材 临床生物化学检验实验指导 (第二版)
2、校准曲线(实际工作中使用)的制备方法
(1)以5-7点为宜,标准物浓度都必须在吸光度-浓 度线性范围的限度内。
(2)每个浓度平行测定3-5管,取平均数作图。 (3)用经过校正的1级吸量管的同一刻度段准确加
标准液,尽可能减少加样误差。 (4)在直角坐标纸上以横坐标为浓度,纵坐标为吸
。
以校准曲线第3管的吸光度和浓度来计算,计算公式为
血清总蛋白g/L=AU/As×84
6
全国高等医药院校医学检验专业规划教材 临床生物化学检验实验指导 (第二版)
实验目的
1、掌握血清总蛋白测定原理和方法 2、掌握校准曲线的概念、作用和制作方法 3、熟悉方法影响因素和方法评价
7
全国高等医药院校医学检验专业规划教材 临床生物化学检验实验指导 (第二版)
2.高脂血症混浊血清会干扰比色,可采用下述方法 消除:取2支带塞试管或离心管,各加待测血清 0.1ml,再加蒸馏水0.5ml和丙酮10ml,塞紧并颠 倒混匀10次后离心,倾去上清液,将试管倒立于 滤纸上吸去残余液体。向沉淀中分别加入双缩脲 试剂及双缩脲空白试剂,再进行与上述相同的其 他操作和计算。
21
(3)计算相关系数r,一般校准曲线的r值要 求为0.9999或0.9997以上。
11
全国高等医药院校医学检验专业规划教材 临床生物化学检验实验指导 (第二版)
实验原理
1.血清总蛋白测定
血清(浆)中蛋白质的肽键(-CO-NH-)在碱性溶液 中能与2价铜离子作用生成稳定的紫红色络合物。此 反应和两个尿素分子缩合后生成的双缩脲(H2N-OCNH-CO-NH2)在碱性溶液中与铜离子作用形成紫红色的 反应相似,故称之为双缩脲反应。这种紫红色络合 物在540nm处有明显吸收峰,吸光度在一定范围内与 血清蛋白含量呈正比关系,经与同样处理的蛋白质 标准液比较,即可求得蛋白质含量。
37℃10min,在波长540nm处比色,以空白管调零,测定各管吸光度。
15
全国高等医药院校医学检验专业规划教材
临床生物化学检验实验指导 (第二版)
操作方法
2、系列标准浓度配制及校准曲线测定操作
管号
