吸收的概念化工原理
化工原理第九章 吸收

p
* A
cA H
或
cA* HpA
H——溶解度系数 ,单位:kmol/m3·Pa或kmol/m3·atm。
H是温度的函数,H值随温度升高而减小。
易溶气体H值大,难溶气体H值小。
溶解度系数H与亨利系数E间的关系
pA*
cA H
,
pA*
ExA, xA
cA c
E
c H
设溶液的密度为 kg / m3,浓度为 c kmol / m3 ,则
20.6.19
气相: 液相:
yA
nA n
xA
nA n
yA yB yN 1 xA xB xN 1
质量分数与摩尔分数的关系:
xA
nA n
mw A
/ MA
mw A / M A mw B / MB mw N
/ MN
wA/M A
wA/M A wB/MB wN/M N
20.6.19
第二节 气液相平衡
一、气体的溶解度 二、亨利定律 三、气液相平衡与吸收过程 的关系
20.6.19
一、气体的溶解度
1、气体在液体中溶解度的概念
气体在液相中的溶解度 :气体在液体中的饱和浓度 cA*
表明一定条件下吸收过程可能达到的极限程度。
2、溶解度曲线
对于单组分物理吸收,由相律知
f c 2 322 3
2、质量比与摩尔比
质量比:混合物中某组分A的质量与惰性组分B
(不参加传质的组分)的质量之比。 wA mA mB
摩尔比:混合物中某组分的摩尔数与惰性组分摩 尔数之比。
气相:
YA
nA nB
液相: X A
nA nB
20.6.19
化工原理 第六章 吸收

不同的溶质在同一个溶剂中的溶解度不同,溶解度很大的
气体称为易溶气体,溶解度很小的气体称为难溶气体;同
一个物系,在相同温度下,分压越高,则溶解度越大;而
分压一定,温度越低,则溶解度越大。这表明较高的分压
和较低的温度有利于吸收操作。在实际吸收操作过程中,
溶质在气相中的组成是一定的,可以借助于提高操作压力
.
第二节 吸收中的气液相平衡
相平衡关系随物系的性质、温度和压力而异,通常由
实验确定。图6-3是由实验得到的SO2和NH3在水中的溶解度
曲线,也称为相平衡曲线。图中横坐标为溶质组分(SO2、
NH3)在液相中的摩尔分数
x
,纵坐标为溶质组分在气相中
A
的分压 p A 。从图中可见:在相同的温度和分压条件下,
体,该值很小。
2.2注意事项
①亨利定律只适用于稀溶液,如常压下难溶或少溶气体的吸收, 否则就有偏差;
②只适用于与溶剂不发生化学反应的气体的吸收;
③溶解度系数随温度升高而降低,即T↑,H↓;
④应用于较高压强时,如5atm以上,分压应以逸度代替;
⑤为了使用方便,亨利定律可以改写成以下形式:
pA ExA, yA mxA,
图6-4 吸收平衡线
.
第二节 吸收中的气液相平衡
2.相平衡线在吸收过程中的应用 2.1判断吸收能否进行。由于溶解平衡是吸收进行的极限,所以, 在一定温度下,吸收若能进行,则气相中溶质的实际组成 Y A 必须大 于 则与过液程相反中向溶进质行含,量为成解平吸衡操时作的。组图成6-4Y中A ,的即A点YA 为 Y实A。 际若操出作现点Y,A 若 AY 点A 时位, 于平衡线的上方,则 YA为吸Y A 收过程;若A点在平衡线上,YA=YA*,体 系达平衡,吸收过程停止;当A点位于平衡线的下方时,则YA<YA*,为解 吸过程。 2.2 确定吸收推动力。显然,YA>YA*是吸收进行的必要条件,而差 值 △YA=YA-YA* 则是吸收过程的推动力,差值△YA越大,则吸收速率必 然越大。 2.3同理,若以液相为研究对象,在一定条件下,要让吸收过程能进 行,则液相中溶质的实际组成XA必须小于与实际气相中溶质含量YA成平 衡时的液相组成XA*,即XA<XA*,差值△XA=XA* -XA即为吸收过程的推动力, 该值越大,吸收速率也就越大。否则,过程必为解吸操作。
《化工原理吸收》课件

03 常用的模拟方法包括物理模型模拟、数学模型模 拟和实验模拟等。
吸收过程的优化策略
01
吸收过程的优化策略是通过调整操作条件和设备参数
来提高吸收效果的方法。
02
优化策略通常包括选择合适的吸收剂、优化操作条件
、改进设备结构和操作参数等。
增加流速可以提高溶质的 传递速率,但同时会增加 设备的投资和能耗。
04
吸收设备与流程
吸收设备的类型与特点
填料塔
结构简单,易于制造, 适用于气体流量较小、 溶液组成较低的情况。
板式塔
传质效率高,处理能力 大,适用于气体流量较 大、溶液组成较高的情
况。
喷射器
结构简单,操作方便, 适用于气体流量较小、 溶液组成较低的情况。
THANK YOU
感谢各位观看
溶解度与相平衡的关系
物质在气液两相中的溶解度差异是吸收过程得以进行的驱动力。
亨利定律与相平衡
亨利定律:气体在液体中的溶解度与该气体在气液界 面上的分压成正比。
输标02入题
亨利定律的数学表达式:(Henry's Law):(c = kP)
01
03
亨利定律的应用:通过测量气体的溶解度和气液界面 上的分压,可以计算出亨利常数,进而了解物质在特
03
优化策略的目标是提高吸收效果、降低能耗和减少环
境污染等。
06
吸收的实际应用
工业废气的处理
工业废气处理
吸收法可用于处理工业生产过程中产生的废气,如硫氧化物 、氮氧化物等有害气体。通过吸收剂的吸收作用,将有害气 体转化为无害或低害物质,达到净化废气的目的。
化工原理之有关吸收的基本理论

化工原理之有关吸收的基本理论吸收是化工工艺中常用的操作之一,其基本原理是利用溶液中组分的亲和力,使其被吸附到吸收剂表面或内部而从气相或液相中去除。
本文将介绍吸收的基本原理、影响吸收效率的因素以及常用的吸收剂和吸收塔设计等方面的内容。
一、吸收原理吸收是一种质量传递过程,化学吸收可以分为气液吸收和液液吸收两种类型。
1.气液吸收气液吸收是利用气体和液体之间的相互作用,从气相中去除有害或有用的组分,使气相在液态吸收剂中被溶解或被吸附到其表面上。
气体在液体中的溶解度和化学平衡有关,也与吸收液体的物理、化学性质有关,主要包括吸收液体的pH值、粘度、表面张力、渗透性、活性、极性等。
2.液液吸收液液吸收是一种纯化分离和萃取的操作过程。
一般是利用两种不相溶的液体之间的界面质量传递过程,从一种溶液中分离、去除有害或有用的化学性质不同的组分,例如萃取精制中间体、脱色、脱酸等。
吸收过程中,液体中吸收剂与吸收物之间的反应确定了吸收的效率。
吸收反应可以分为化学吸收和物理吸收。
化学吸收是指吸收剂与dissolved phase 中的吸收物之间发生反应,例如H2SO4 与SO2 的反应:SO2 +H2O + 1/2O2 →H2SO4物理吸收是指吸收剂通过对分子间力的作用力将吸收物与吸收剂分子吸附在一起,例如气体分子通过范德华力来作用于吸收剂分子。
二、影响吸收效率的因素吸收效率受许多因素的影响,其中包括吸收剂的物理和化学特性、进料浓度和流量、温度、压力和气液物理化学性质等。
1.吸收剂性质吸收剂的物理和化学特性对吸收效率有着重要影响。
吸收剂的表面张力、极性、分子量和黏度等属性都会影响它与气体或液体相互作用及吸附的能力。
吸收剂的HFAC值(Henry气液分配系数)是衡量吸收效率的重要参考指标。
2.浓度和流量吸收剂的浓度和进料流量在吸收过程中扮演着关键的角色。
当进料浓度较高或流量过大时,吸附剂不能迅速吸收吸收物,从而限制了吸收过程中的质量传递速率。
化工原理吸收
(-2 27
液相: N Az D L ' cC sm (ic-c )作k业L(:ic-复c习)所讲(2 。-218 4 )
2.2.6 吸收过程的机理
1、双膜理论
(1)目的:建立传质速率方程。
(2)双膜理论 ①传质过程
②双膜理论基本论点:
1)相界面,滞流膜层,分子扩散;
2)相界面处达于平衡;
3)流体主体为湍流, dc A 0,膜层内存在 dc A 。
式中: D — 分子扩散系数,m2/s;
(2 -26)
DE一 涡流扩散系数,m2/s;
dcA/dz 一 沿z方向的浓度梯度,kmol/m4;
J — 扩散通量,kmol/(m2·s)。
DE不是物性,与湍动程度有关。
气相: N AR D G T p P B z( m- p p i)k G (- p p i)
NA不涉及传递形式。
推导NA计算式:
NA=JA
-D
dCA dZ
- D dpA RT dZ
(2-15)
稳定过程,NA为常数。因而
dp A dZ
NA
Z
D
dZ-
pA2dpA
0
RTpA1 dZ
也是常数, 故pA~Z为直线关系。
N AR DT (A P Z -1P A)2
(2 -16
9
二、一组分通过另一停滞组分的扩散
平衡分压
p*
一、亨利(Henry)定律
P总不高,T一定, p*=E x (2-1)
x
实际浓度
说明:1、 p*、x 、E(亨利系数,压强单位 )
推导:1m3:
2、适用于 t 一定,理想溶液。E为该 t 下纯溶质p°;
吸收的应用化工原理

吸收的应用化工原理1. 吸收的基本概念•吸收是一种分离和净化技术,用于从气相或液相中吸收目标物质。
•吸收通常通过将气体或液体与吸收剂接触,并利用化学反应或物理吸附使目标物质在吸收剂中富集。
2. 吸收的应用领域•吸收在化工工艺中广泛应用,特别是以下几个领域:–气体净化:用于去除废气中的有害气体,净化环境。
–溶剂回收:通过吸收可回收有机溶剂,实现资源的高效利用。
–气体分离:利用吸收剂选择性吸收特定组分,实现气体分离。
–烟气脱硫:用吸收剂吸收烟气中的二氧化硫,减少大气污染。
3. 吸收的原理•吸收过程通常遵循质量传递和相平衡原理。
•质量传递:目标物质在气相和液相之间传递的速率取决于质量传递系数、浓度差和相接触面积。
•相平衡:气相和液相中目标物质的浓度达到平衡后,吸收过程停止。
4. 吸收的关键参数•吸收剂选择:根据目标物质的特性选择适合的吸收剂,如活性碳、沸石、液体溶剂等。
•吸收器设计:考虑吸收塔高度、内部填料或板式结构等因素,以获得高效的吸收效果。
•操作条件:包括温度、压力和流量等参数,对吸收效果有重要影响。
•目标物质浓度:初始浓度和收率对吸收过程的效果具有重要影响。
5. 吸收的优缺点•优点:–高效:吸收过程可以达到较高的分离效率。
–灵活性:通过调整操作条件和吸收剂选择,可以适应不同的体系。
–应用广泛:适用于气态和液态混合物的分离。
•缺点:–能耗较高:吸收过程需要提供能源以实现质量传递。
–吸收剂处理:吸收剂饱和后需要进行再生或处理。
–设备复杂性:需要设计和运行吸收塔等设备。
6. 吸收的发展趋势•新材料研究:开发更高效的吸收剂,提高吸收过程的效率。
•节能减排:优化吸收工艺,降低能耗和排放。
•过程集成:将吸收与其他分离技术相结合,实现资源的综合利用。
•自动化控制:利用先进的自动化技术,提高吸收过程的稳定性和控制精度。
7. 结论吸收是一种重要的应用化工原理,广泛应用于气体净化、溶剂回收、气体分离等领域。
通过质量传递和相平衡原理,吸收可以实现目标物质的分离和净化。
化工原理吸收

化工原理吸收化工原理吸收是化工工程中常见的一种物质分离和净化方法,通过气体或液体在吸收剂中的传质过程,将目标组分从混合物中分离出来。
吸收过程在化工生产中具有广泛的应用,例如在石油化工、化肥、环保等领域都有着重要的地位。
首先,吸收过程的基本原理是利用吸收剂对目标组分的亲和力,将目标组分从混合物中吸收到吸收剂中。
在吸收过程中,需要考虑到吸收剂的选择、操作条件的控制以及设备的设计等方面的因素。
吸收剂的选择需要考虑到目标组分的亲和力、溶解度、稳定性以及再生难易度等因素,以及对环境的影响。
操作条件的控制包括温度、压力、流速等参数的选择,这些参数对吸收效果有着重要的影响。
设备的设计需要考虑到传质效果、能耗、设备成本等方面的因素,以实现经济、高效的吸收过程。
其次,吸收过程的机理包括气液传质和界面传质两种方式。
气液传质是指气体和液体之间的物质传递过程,通常发生在气体通过液体时,目标组分从气相传递到液相中。
界面传质是指气液界面上的物质传递过程,通常发生在气体与液体接触的表面上,目标组分从气相传递到液相中。
这两种传质方式在吸收过程中起着重要的作用,需要根据具体的情况选择合适的传质方式。
最后,吸收过程的影响因素包括吸收剂的性质、操作条件、设备设计等多方面因素。
吸收剂的性质包括选择合适的吸收剂、控制吸收剂的浓度、再生吸收剂等,这些因素对吸收效果有着重要的影响。
操作条件的选择需要考虑到吸收剂的流速、温度、压力等参数,以实现高效、经济的吸收过程。
设备设计需要考虑到传质效果、能耗、设备成本等因素,以实现吸收过程的优化。
综上所述,化工原理吸收是一种重要的物质分离和净化方法,具有广泛的应用前景。
通过对吸收过程的基本原理、机理和影响因素的认识,可以更好地设计和操作吸收设备,实现高效、经济的吸收过程,为化工生产提供有力的支持。
化工原理 PPT 第2章 吸收

中溶质达到饱和,组成不再增加为止,这种状
态称为相际动平衡,简称相平衡或平衡。 平衡分压:平衡状态下气相中的溶质分压,又称饱和 分压。
平衡组成:平衡状态下液相中的溶质组成,又称饱和
组成。
14
溶解度 C A :气体在液体中的饱和组成。
2.溶解度的意义 1)表明一定条件下,吸收过程可能达到的极限 程度;
m
202 .6 p
从气相分析 y*=mx=23.94×0.01=0.24<y=0.3 故SO2必然从气相转移到液相,进行吸收过程。 y 0.3 x* 0.0125 m 23.94 以液相摩尔分数表示的吸收推动力为: ∆x=x*-x=0.0125-0.01=0.0025 以气相摩尔分数表示的吸收推动力为: ∆y= y - y*=0.3-0.24=0.06
1.判断传质进行的方向
①气、液相组成(yi,xi)在平衡线上方(P点): 相对于液相组成xi 而言, 气相浓度为过饱和 ( yi yi* ),溶质 A 由气 相向液相转移。 相对于气相组成yi 而言, 液 相 浓 度 欠 饱 和 ( xi xi* ),故液相有吸 收溶质 A 的能力。
y yi
释放溶质
P
yi* f ( xi )
yi*
o xi
吸收溶质
xi*
x
结论:若系统气、液相组成(yi , xi)在平衡线上方,则体系 将发生从气相到液相的传质,即吸收过程。
27
②气、液相组成(yi,xi)在平衡线下方(Q点): 相对于液相组成xi 而言 气相浓度为欠饱和 * ( yi y),溶质 A 由液相 i 向气相转移。 相对于气相组成yi而言实 际液相浓度过饱和 ( xi xi* ),故液相有释放 溶质 A 的能力。
化工原理2012-9 吸收

y+dy x+dx 单位体积填料的有效传质面积a h H dh NAadh=GBdY=LSdX, NA=KY(Y-Y*) y x KYa(Y-Y*) dh= GBdY
四、填料层高度的计算:
∫0Hdh= ∫YaYb(GB/KYa)dY/(Y-Y*)
yb
xb
23
H=(GB/KYa)∫YaYbdY/(Y-Y*) 同理可推出:H= (LS/Kxa)∫XaXbdX/(X*-X)
G,y
Lx
Gb,yb
G、L、y、x----塔中任一截面处的 Lb,xb 气相、液相kmol/h流量和吸收质 摩尔分率。
GB、LS---气相中惰性气体、液相 中吸收剂的kmol/h流量
20
GB=G(1-y), Ls=L(1-x) Y=y/(1-y), X=x/(1-x) GB(Yb-Ya)=Ls(Xb-Xa) 全塔物料衡算:
8
亨利定律:
稀溶液,气体的溶解平衡关系可以表示成过原点 的直线。其函数表达式为: Henry定律: pA*=ExA 溶解关系:cA*=HpA 拉乌尔定律: pA=pA°xA
相平衡关系:y*=mx
E---亨利系数[Pa]; m---相平衡常数;
H---溶解度系数[kmol/(m3kPa)]。
气体越易溶,H越大,E越小;
(Yb-Ya)/(Xb-Xa)=Ls/GB
对虚线方块作物料衡算: GB(Y-Ya)=Ls(X-Xa) Y=(Ls/GB)X+(Ya-LsXa/GB) -----逆流吸收操作线方程
此方程为一直线,斜率=Ls/GB称为液气比
若并流吸收:Y=-(Ls/GB)X+(Ya+LsXa/GB)
并流吸收操作线方程,(直线)
化工原理第五章吸收(传质理论之一)超详细讲解

被吸收NH3的体积: VNH3=80*(0.25-0.053) =15.8 m3
传热过程
吸收过程
理论 将对流给热视为壁 实质 附近滞流层的热传
导过程—付立叶定
将吸收视为A穿过相界面附 近滞流双膜的分子扩散过 程—费克定律
At
T
T
t
t
A1 (T tw1 ) A2 (tw2 t )
N
DAC
DgP
RTpBg
A(
Dl (CA CS
CSl
p )
pi) A(Ci C)
作业: P185 7
§5-3 吸收速率
吸收速率决定吸收达到平衡的时间,决定吸收操作的 生产强度,是吸收设备选型和设备设计的重要依据。
一、吸收速率定义:NA= dnA/dτ 对于稳定吸收过程:NA=nA/τ mol(A)/s 吸收过程是物质的相转移过程,通过扩散方式进行。
二、扩散 1、分子扩散:物质以分子热运动方式穿过静止或滞流流 体的传递过程——特点:传递速率慢。 2 、对流扩散:物质以相对运动方式穿过湍流流体的传递 过程——特点:传递速率快。
A(Ci
C) =klA(Ci-C)
kl
DlCT
lCS
所以,可用界面附近气膜中的扩散速率:
NA=kgA(p-pi) 或液膜中的扩散速率:
计算吸收速率。
NA=klA(Ci-C)
作业: P185 12、13
六、吸收速率方程 1 气膜吸收分速率方程
化工原理吸收

化工原理吸收吸收是一种常见而重要的分离技术,在化工过程中广泛应用。
吸收是利用溶剂以物理或化学方式从气体、液体或固体中分离出物质的过程。
它在化工领域中的应用十分广泛,涵盖了多个行业,如石油化工、化肥、合成材料等。
吸收的基本原理是根据物质的相互作用力,并通过在溶剂中形成物质被吸附、溶解或反应的方式来实现物质的分离和纯化。
吸收过程一般分为两个阶段:传质和相平衡。
传质过程指的是溶质从气体、液体或固体相向吸收剂的传递过程。
相平衡指的是溶质在吸收剂中的浓度达到平衡状态。
吸收的过程可以通过多种方式实现。
其中最常见的是气体吸收。
气体吸收是将气态物质通过接触与吸收剂接触,然后进入吸收剂中的过程。
气体吸收的过程中,常使用物理吸收和化学吸收的方式进行。
物理吸收主要是利用溶质分子在吸收剂中溶解的溶解度差异来进行分离。
根据溶解度和吸收剂的选择,物理吸收一般具有以下几个特点:易于操作、能耗较低、对条件要求不高、纯化程度较低。
常用的吸收剂包括水、有机溶剂和溶液。
化学吸收则是通过物质在吸收剂中发生化学反应,使溶质与吸收剂发生反应,产生新的物质,在产生反应的同时将溶质分离出来。
化学吸收一般具有下面几个特点:通过反应能够得到较高的吸收效果;能够得到较高纯度的产品;操作较复杂,条件苛刻;产生的副产物难以处理。
常用的吸收剂包括酸、碱、氧化剂等。
化学吸收和物理吸收在实际应用中往往结合使用,通过化学反应实现更高效的物质分离。
在工业生产中,常常使用吸收塔进行吸收操作。
吸收塔是一个用于进行气体吸收的设备,一般由填料、进料与出料管道以及循环泵组成。
填料可以增加界面面积,提高吸收效果。
除了气体吸收外,液体吸收也是常见的一种吸收形式。
液体吸收一般是将液态物质通过接触与吸收剂接触并吸收的过程。
液体吸收主要用于分离和纯化液态物质,常见的应用有酸碱中和、有机溶剂回收等。
总之,吸收是一种常用的化工分离技术,通过物理吸收和化学吸收的方式,实现物质的分离和纯化。
化工原理吸收课后问题详解

化工原理吸收课后问题详解一、吸收的基本概念和原理吸收是化工过程中一种常用的物质分离技术,它通过将气体或液体溶质溶解到溶剂中,从而实现对溶质的分离和回收。
吸收过程中,溶剂与溶质之间发生物质传递和质量转移,达到了分离和纯化的目的。
吸收过程中存在一些重要的基本概念和原理,包括以下几个方面:1. 吸收剂:吸收剂是指用于吸收过程中溶解溶质的溶剂。
吸收剂的选择应根据溶质的性质、吸收过程的要求以及经济因素等综合考虑。
2. 溶质:溶质是指需要被吸收的气体或液体物质。
溶质的选择应根据吸收过程的目的和要求来确定。
3. 吸收塔:吸收塔是吸收过程中的主要设备,它通常由填料或板式结构构成,用于增加吸收剂与溶质之间的接触面积,促进质量传递和物质转移。
4. 质量传递:质量传递是指吸收过程中溶质从气相或液相传递到吸收剂中的过程。
质量传递的速率受到多种因素的影响,包括质量传递系数、液相浓度、气相浓度、温度等。
5. 质量传递系数:质量传递系数是衡量吸收过程中质量传递速率的重要参数,它表示单位时间内单位面积的质量传递量。
质量传递系数受到吸收剂和溶质性质、温度、压力等因素的影响。
6. 质量平衡:质量平衡是吸收过程中的重要原理之一,它描述了吸收剂和溶质之间质量传递的平衡状态。
质量平衡方程可以通过质量传递系数、液相浓度、气相浓度等参数来表示。
二、吸收过程中的影响因素吸收过程中存在许多影响因素,这些因素会对吸收效果和过程性能产生重要影响。
以下是吸收过程中常见的影响因素:1. 吸收剂的选择:吸收剂的选择应根据溶质的性质、吸收过程的要求以及经济因素等综合考虑。
吸收剂的选择应具有良好的溶解性能、较低的蒸汽压、稳定性好等特点。
2. 溶质的性质:溶质的性质对吸收过程有重要影响。
溶质的溶解度、相对挥发性、稳定性等特性会影响吸收过程的效果和稳定性。
3. 温度:温度是影响吸收过程的重要因素之一。
温度的升高可以增加溶质的溶解度和质量传递速率,但同时也会增加能耗和操作难度。
化工原理 第八章 吸收

水吸收NH3、HCl。
三、传质阻力分析
1 1 1 K x mk y k x
液相阻力控制(液膜控制):当 1/mky<<1/kx,则 1/Kx≈1/kx。 此时传质阻力集中于液相。 液膜控制的条件:
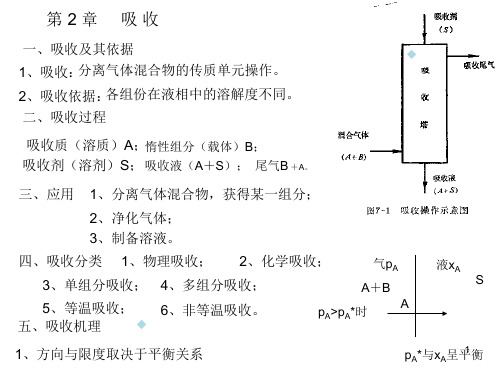
分在液体溶剂中溶解度的差异来 分离气体混合物的操作。
溶质A(吸收质):能溶于液体的组分 惰性组分B:不能溶于液体的组分 吸收剂S:吸收操作所用的溶剂
吸收液(溶液):溶有溶质的溶液
吸收尾气:排出的气体,主要成分为惰性气体,还含有残余溶 质
8.1 概述
吸收在化工中的应用: 1.制取化工产品 将气体中需要的成分用指定的溶剂吸收出来,成为液态产 品。如:用水吸收HCl、NO2制取工业盐酸和硝酸。 2.分离气体混合物 工业上利用吸收分离气体混合物。热甲碱法吸收二氧化碳。 3.从气体中回收有用组分 用洗油回收粗苯或二氯乙烷。 4.气体净化 ①原料气的净化。 ②尾气、废气的净化以保护环境。 5.生化工程 菌体在发酵罐中培养。发酵罐中要给予大量的空气以维持 微生物的正常代谢,要应用空气中的氧在水中吸收这一过程。
总传质速率方程
N A K y ( y y*) N A K x ( x* x ) N A K G ( p A p* A) N A K L (C * A CA)
总传质系数与分传质系数的关系
1 1 1 K G kG HkL 1 1 1 m K y k y kx 1 H 1 K L kG k L
(3)挥发性 (4)黏性 (5)其它
不易挥发 粘度要低 无毒,无腐蚀性,不易燃烧,不发泡。 价廉易得,化学稳定性等
化工原理_吸收

一、目的 1.制取产品及回收有用物质,如用水吸HCL气体制取
对于单组分物理吸收其组分数为3,根据相律其自由度为:
溶质在液相中的浓度受T、P以及Pe的影响:
当T、P确定后则:
式中 Pe为溶质组分的分压,Pa。
(2). 相平衡关系的表示法
相平衡关系与体系的温度、压力以及本身物性相关,对吸收 混合气中低浓度溶质组分形成稀溶液时,其溶解度曲线用亨利 定律描述,为通过原点的一直线:
( Pe=Ex) 式中
Pe-溶质组分在气相的平衡分压,Pa; x-溶质组分在液相的组成,摩尔分数; E-亨利系数,kPa/(kmol·)。
亨利定律的其他表现形式: Pe=C/H C-溶质组分在液相中的摩尔浓度(Koml/m3)
ye=mx ye- A在液相中的mol分数(Koml/ Koml)
各亨利系数之间的关系:
3. 实现解吸操作一般有三种方法 1)加热;2)减压;3) 令惰性气体通过溶液,在吸收操作中往往可用上述三种 方法的不同联合方案进行
煤气生产中从焦炉煤气中回收苯的生产过程
焦炉煤气在吸收塔内与洗 油(贫油)逆流接触煤气 中粗笨蒸汽被贫油吸收, 吸收后的洗油称为富油, 从塔底流出;富油经换热 器升温后从塔顶进入解吸 塔,过热蒸汽(惰性气体) 从解吸塔底进塔,经解吸 后的洗油称为贫油,贫油 经换热器降温后再进入吸 收塔循环使用。于解吸塔 顶引出的气体为过热
盐酸; 在生产过程中,有些混合气的副产品必须回收,如 煤气中的芳烃,可采用洗油吸收方法回收芳烃获得粗苯.
化工原理吸收

化工原理吸收
化工原理中的吸收操作是一种常见的气体和液体分离技术。
通过将气体溶解在液体中,可以有效地将气体成分从气相转移到液相中。
吸收过程的基本原理是利用液体对气体的亲和力来实现分离。
通常,吸收塔中的液体称为溶液或吸收液,而气体称为被吸收物质或吸收剂。
在吸收过程中,气体在吸收液中的分子间发生物理或化学吸附,从而被有效地捕集和固定在液体中。
当溶液饱和或达到一定浓度时,吸收过程结束。
吸收操作常用于以下方面:
1. 气体净化:吸收操作可以去除气体中的污染物质,如二氧化硫、氨气等。
通过选择适当的吸收剂和调整操作条件,可以有效地将这些有害物质从气体中去除。
2. 气体回收:吸收操作可用于回收有用气体。
例如,在石油炼制过程中,吸收操作常用于回收烃类气体或气体中的有机物。
3. 气体分离:吸收操作可以实现气体的分离和回收。
根据气体在吸收液中的溶解度差异,可以将混合气体分离成不同组分的吸收器。
吸收操作的关键参数包括吸收剂的选择、操作温度、压力、气体流量和溶液流量等。
合理地选择和控制这些参数可以提高吸收操作的效果和经济性。
总之,吸收操作是一种重要的化工分离技术,可用于气体净化、
气体回收和气体分离等应用领域。
通过合理选择吸收剂和调整操作条件,可以实现高效、经济的气体和液体分离过程。
化工原理吸收

稳定性好:即 吸收剂在储存 和使用过程中 稳定性较好, 不易分解或变 质
吸收剂的选择
在实际应用中,常用的吸收剂包 括水、醇、酮、醚等有机溶剂以
及酸、碱等无机溶液
选择哪种吸收剂需要根据具体的 分离要求和条件来确定
PART 4
吸收设备
吸收设备
1 吸收设备是实现吸收过程的重要工具 2 常见的吸收设备有填料塔、板式塔和喷淋塔等 3 这些设备的主要区别在于塔内气液接触的方式和流动状态 4 填料塔内装有固体填料,液体从填料表面流下时形成薄膜,气体通过时与薄膜相接触而发生吸收 5 板式塔内装有多层塔板或筛板,气体通过塔板时形成鼓泡层,与液体充分接触 6 喷淋塔内液体从顶部喷淋而下,气体自下而上流动,气液在塔内逆流接触 7 根据不同的工艺要求和物料特性,可以选择适合的吸收设备
选择合适的吸收 剂是实现高效吸 收的关键。吸收 剂应具备以下特
点
吸收剂的选择
溶解度大:即 能够大量吸附 待分离的气体 组分
选择性好:即 对所需分离的 气体组分具有 较高的吸附能 力,而对其他 组分的吸附能 力较低
挥发性低:即 吸收剂不易挥 发,以减少损 失
无毒、无腐蚀 性:即不会对 设备造成腐蚀 或污染环境
与吸收剂分子发生相互作用,气体分子
被吸收剂分子吸附而溶解在吸收剂中
05
吸 收 剂 可 以a选a择a 性 地 吸 附 某 种 气 体 或 多
种气体,从而实现气体的分离和净化
03
溶 解 后 的 气a体a分a 子 在 吸 收 剂 中 扩 散 , 最
终达到气液平衡状态
PART 3
吸收剂的选择
吸收剂的选择
20XX
化工原理吸收
-
1 吸收的定义 3 吸收剂的选择 5 吸收的应用
(完整版)化工原理吸收

0
20 40 60 80 100 120
pNH3/kPa
250
200 150
0 oC 10 oC
100 50
20 oC
30 oC 40 oC
50 oC
0
20 40 60 80 100 120
pSO2/kPa
在相同条件下,NH3 在水中的溶解度较 SO2 大得多。 用水作吸收剂时,称 NH3 为易溶气体,SO2为中等溶解气体, 溶解度更小的气体则为难溶气体(如O2 在 30℃ 和溶质的分压 为 40kPa 的条件下,1kg 水中溶解的质量仅为 0.014g)。
• 此外所选用的溶剂尽可能满足无腐蚀性,粘度小,无毒,不燃,价廉
易得等条件。
2020/8/12
projects of Dr.Hao
9
气液两相的接触方式
连续接触(也称微分接触):气、 液两相的浓度呈连续变化。如填 料塔。
溶剂 溶剂
规整填料
散装填料
塑料丝网波纹填料 塑料鲍尔环填料
级式接触:气、液两相逐级接 触传质,两相的组成呈阶跃变 化。 如板式塔。
吸收与解吸流程
projects of Dr.Hao
苯 水 过热蒸汽
3
吸收操作的用途:
(1) 制取液体产品 用吸收剂吸收气体中某些组分而获得 产品。如硫酸吸收SO3制浓硫酸,水吸收甲醛制福尔马林 液,用水吸收氯化氢制盐酸等 。 (2) 分离混合气体 吸收剂选择性地吸收气体中某些组分以 达到分离目的。例如石油馏分裂解生产出来的乙烯、丙烯, 还与氢、甲烷等混在一起,可用分子量较大的液态烃把乙烯、 丙烯吸收,使与甲烷、氢分离开来 。
5
第二节 吸收的基本原理
一、气-液相平衡关系
化工原理 第六章 吸收

③ 一定体系,E=f(T),T↑,E↑; 易溶体系E小,难溶体系E大。 ④ 数值取得:实验测定,外推x→0 ( 低浓);查有关手册。
亨利定律的其他形式
1)p*~C:
H——溶解度系数 ,单位:kmol/m3· Pa或kmol/m3· atm。
H是温度的函数,H值随温度升高而减小。
易溶气体H值大,难溶气体H值小。
2. 一组分通过另一停滞组分的扩散
若截面2(气液界面)只 允许A通过(B、S不 能),A扩散后会留下 空位,必须由左侧联通 管中的气体(A+B)来 补充,以保证P=const., 此时,产生一个趋向于 界面的递补流动——总 体流动,其方向与A的 扩散方向一致。
• 总体流动通量为N,混合气总浓度为C,则
对于双组分混合物,在总压不高,各处温度均匀 的前提下,也有
C总 CA CB 常数
dC A dC B dz dz
J A JB
dCB dC A J A J B ( DBA ) DAB dz dz
DAB DBA D
J A cAuDA
2.2.2 气相中的稳态分子扩散
气相中溶质的摩尔数 y Y 气相中惰性组分的摩尔数 1 y
X Y x ,y 1 X 1 Y
y mx得,
*
Y mX * 1 Y 1 X
*
mX Y 1 (1 m) X
*
当溶液浓度很低时,X≈0, 上式简化为:
Y mX
*
【例1】已知10℃时,1atm下氨水的浓度为 10gNH3/100gH2O, 其平衡气相分压,pNH3=5.57kPa 氨水密度:ρ≈1000 kg/m3 求:E、H、m。
D PA 2 pA1 dp A RT
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
吸收的概念化工原理
吸收是一种常见的分离和纯化过程,它通过将一种物质(吸收剂)与另一种物质(被吸收物质)接触,使被吸收物质从气态或液态转移到吸收剂中。
吸收的概念化工原理如下:
1. 物质接触:吸收剂与被吸收物质之间需要有足够的接触面积,以便有效地传递质量和能量。
2. 传质:被吸收物质通过物质界面的传质过程,从气态或液态相转移到吸收剂中。
传质可以通过扩散、对流和反应来实现。
3. 反应:在吸收过程中,被吸收物质与吸收剂之间可能发生化学反应。
这些反应可以改变被吸收物质的化学性质,从而实现分离和纯化。
4. 热量传递:吸收过程可能涉及热量的传递,特别是在吸收剂中发生吸热或放热反应时。
热量的传递可以影响吸收过程的效率和控制。
5. 设备设计:吸收过程需要适当的设备来实现物质接触、传质、反应和热量传递。
吸收塔是常用的吸收设备,它通常由填料或板式结构组成,以提供大量的接触表面积。
吸收在许多工业和环境应用中都有广泛的应用,例如气体净化、溶剂回收、气体吸附等。
了解吸收的概念化工原理对于优化吸收过程的设计和操作至关重要。
