2-3-2范德华力、氢键及其对物质性质的影响与溶解性 59....ppt
合集下载
范德华力和氢键、溶解性【上课用】PPT课件

2021
41
练习:共价键、离子键、范德华力和氢键是形成
晶体的粒子之间的四种作用力。下列晶体:
①Na2O2 ②固体氨 ③NaCl ④SiO2 ⑤冰 ⑥干冰,其中含有三种作用力的是( )
A.①②③
B.①②⑥
C.②⑤
D.⑤⑥
2021
42
练习:氨在水中的溶解度在常见气体中最大,下
列因素与氨的水溶性没有关系的是( )
思考:NH3为什么极易溶于水?NH3溶于水是形成N-
H…O还是形成O-H…N?
溶质与溶剂分子之间的氢键作用,使溶质溶 解度增大,氢键作用力越大,溶解性越好。
NH3溶于水形成氢 键示意图如右,正
是这样,NH3溶于
水溶液呈碱性
2021
14
3.氢键的键能一般小于40kJ/mol,强 度介于化学键和范德华力之间.因此氢
邻羟基苯甲醛(熔点:-7℃)
对羟基苯甲醛
(熔点:115-117℃)
分子间氢键使物质熔点升高
分子内氢键使物质熔点降低
2021
16
(1)分子间氢键
氢键普遍存在于已经与N、O、F形成共价
键的氢原子与另外的N、O、F原子之间。
如:HF、H2O、NH3 相互之间
C2H5OH、CH3COOH、H2O相互之间 (2)分子内氢键
量与Y原子的孤对电子方
向一致,即以H原子为
中心三个原子尽可能在
一条直线上。这样可使X
与Y的距离最远,斥力最
小,形成的氢键强。
2021
19
讨论:我们在学习化学的过程中还有什么地方能 用氢键的知识来解释的? (1)水的特殊物理性质 (2)蛋白质结构中存在氢键 (3)核酸DNA中也存在氢键 (4)甲醇易溶于水 (5)乙醇与水互溶
氢键课件ppt

第三节 分子的性质
分子间作用力
分子间存在着将分子聚集在一起的作 用力,这种作用力称为分子间作用力.常见 的为范德华力和氢键
二、范德华力及其对物质性质的影响 范德华力的特点
(1)广泛存在(由分子构成的物质) (2)作用力弱、是短程力 (3)主要影响物质的物理性质(熔沸点)
由分子构成的
化学键与范德华力的比较
21.14 431.8
23.11 366
26.00 298.7
范德华力很弱,约比化学键能小1-2数量级
二、范德华力及其对物质性质的影响
(2) 范德华力与相对分子质量的关系
分子
HCl HBr
HI
相对分子 质量
范德华力 (kJ/mol)
36.5 21.14
81 23.11
128 26.00
结构相似,相对分子质量越大,范德 华力越大
六、无机含氧酸分子的酸性
含氧酸的强度取决于中心原子的电 负性、原子半径、氧化数。
当中心原子的电负性大、原子半径 小、氧化数高时,使O-H键减弱,酸 性增强。
无机含氧酸强度的变化规律
同周期的含氧酸,自左至右,随 中心原子原子序数增大 ,酸性增强。
同一族的含氧酸,自上而下,随 中心原子原子序数增大 ,酸性减弱。
2.表示: X—H…Y (X、Y为N、O、F)
F
F
H
H
H
H
F
F
3.氢键的形成条件: (1)在X—H…Y表示的氢键中,H原子位于X、Y间 (2)X、Y所属元素具有很强的电负性,很小的原子半
径,如N、O、F等。 4.键参数:键长指X和Y的距离
键能指X—H…Y分解为X—H 和Y所需要的能量
为什么冰会浮 在水面上呢?
分子间作用力
分子间存在着将分子聚集在一起的作 用力,这种作用力称为分子间作用力.常见 的为范德华力和氢键
二、范德华力及其对物质性质的影响 范德华力的特点
(1)广泛存在(由分子构成的物质) (2)作用力弱、是短程力 (3)主要影响物质的物理性质(熔沸点)
由分子构成的
化学键与范德华力的比较
21.14 431.8
23.11 366
26.00 298.7
范德华力很弱,约比化学键能小1-2数量级
二、范德华力及其对物质性质的影响
(2) 范德华力与相对分子质量的关系
分子
HCl HBr
HI
相对分子 质量
范德华力 (kJ/mol)
36.5 21.14
81 23.11
128 26.00
结构相似,相对分子质量越大,范德 华力越大
六、无机含氧酸分子的酸性
含氧酸的强度取决于中心原子的电 负性、原子半径、氧化数。
当中心原子的电负性大、原子半径 小、氧化数高时,使O-H键减弱,酸 性增强。
无机含氧酸强度的变化规律
同周期的含氧酸,自左至右,随 中心原子原子序数增大 ,酸性增强。
同一族的含氧酸,自上而下,随 中心原子原子序数增大 ,酸性减弱。
2.表示: X—H…Y (X、Y为N、O、F)
F
F
H
H
H
H
F
F
3.氢键的形成条件: (1)在X—H…Y表示的氢键中,H原子位于X、Y间 (2)X、Y所属元素具有很强的电负性,很小的原子半
径,如N、O、F等。 4.键参数:键长指X和Y的距离
键能指X—H…Y分解为X—H 和Y所需要的能量
为什么冰会浮 在水面上呢?
范德华力和氢键及其对物质性质的影响 PPT课件

HF: F—H…F
H2O: O—H…O
NH3:
N—H…N
NH3和H2O: O—H…N
3.氢键的特点 (1).饱和性和方向性
a.由于 H 的体积小,1 个 H 只能形成一个氢键;
b.由于 H 的两侧电负性极大的两原子的负电排斥, 使(A — H ···B —)中A和B两个原子一般在H原子 两侧且呈直线排列。除非其它外力有较大影响时, 才改变方向。
Waals,1837~1923年)。荷兰科学家, 1910年获得诺贝尔物理奖。1837年6 月1日,生于莱顿。1873年,他获得 莱顿大学的博士学位,在论文中他 首次证明了分子体积以及分子间作 用力的存在。这种把分子聚集在一 起的作用力,叫做分子间作用力即
范德华力。
一、范德华力
1.使分子聚集在一起的作用力,其实质是电性引力。
范德华力和氢键及其对物 质性质的影响
夯实基础:
范德
华力 一、范德华力
和氢
键及
其对
物质
性质 的
二、氢键
影响
思考与交流
1、降温加压气体为什么会液化? 2、降温时液体为什么会凝固?
—— 分子间存在一种使其聚集在一起的 作用力!
这种把分子聚集在一起的作用力,叫做 分子间作用力也称为范德华力。
资 料
范德瓦尔斯(J.D.van der
有分子内氢键 沸点: 44 - 45 ℃
(2).溶解度
若溶质与溶剂之间能形成氢键,物质的溶解度 较大。例如:NH3极易溶于水。
(3).物质的硬度
若分子之间存在氢键,物质的硬度增大!
(4).物质的密度——使物质密度反常!
例如:水的固体(冰)密度小于液体!
Why:冰的密度小于水的密度?
H2O: O—H…O
NH3:
N—H…N
NH3和H2O: O—H…N
3.氢键的特点 (1).饱和性和方向性
a.由于 H 的体积小,1 个 H 只能形成一个氢键;
b.由于 H 的两侧电负性极大的两原子的负电排斥, 使(A — H ···B —)中A和B两个原子一般在H原子 两侧且呈直线排列。除非其它外力有较大影响时, 才改变方向。
Waals,1837~1923年)。荷兰科学家, 1910年获得诺贝尔物理奖。1837年6 月1日,生于莱顿。1873年,他获得 莱顿大学的博士学位,在论文中他 首次证明了分子体积以及分子间作 用力的存在。这种把分子聚集在一 起的作用力,叫做分子间作用力即
范德华力。
一、范德华力
1.使分子聚集在一起的作用力,其实质是电性引力。
范德华力和氢键及其对物 质性质的影响
夯实基础:
范德
华力 一、范德华力
和氢
键及
其对
物质
性质 的
二、氢键
影响
思考与交流
1、降温加压气体为什么会液化? 2、降温时液体为什么会凝固?
—— 分子间存在一种使其聚集在一起的 作用力!
这种把分子聚集在一起的作用力,叫做 分子间作用力也称为范德华力。
资 料
范德瓦尔斯(J.D.van der
有分子内氢键 沸点: 44 - 45 ℃
(2).溶解度
若溶质与溶剂之间能形成氢键,物质的溶解度 较大。例如:NH3极易溶于水。
(3).物质的硬度
若分子之间存在氢键,物质的硬度增大!
(4).物质的密度——使物质密度反常!
例如:水的固体(冰)密度小于液体!
Why:冰的密度小于水的密度?
2.3.2《 范德华力和氢键》PPT课件-人教版高二化学选修3

【答案】C【解析】氢键属于分子间作用力,其大小介 于范德华力和化学键之间,不属于化学键,分子间氢键的 存在,加强了分子间作用力,使物质的熔、沸点升高,A 项错误,C项正确;在冰和水中都存在氢键,而H2O的稳定 性主要是由分子内的O—H的键能决定,B、D项错误。
(人教版选修3) 第 二章《分子结构与性质》
。
(人教版选修3) 第 二章《分子结构与性质》
【问题探究3】(3)在第ⅤA、ⅥA、ⅦA族元素的氢化物 中,为什么NH3、H2O、HF三者的相对分子质量分别小于 同主族其他元素的氢化物,但熔、沸点却比其他元素的氢 化物高?
因为NH3、H2O、HF三者的分子间能形成氢 键,同主族其他元素的氢化物不能形成氢键,所以它们的 熔点和沸点高于同主族其他元素的氢化物。
(人教版选修3) 第 二章《分子结构与性质》
【归纳小结】范德华力对物质性质的影响有哪些?
(1)范德华力越大,物质的熔、沸点越高。 ①组成和结构相似的分子,相对分子质量越大,范德华力越大, 物质的熔、沸点越高。如熔、沸点I2>Br2>Cl2>F2,HCl<HBr<HI。② 组成相似、相对分子质量相近的物质,分子的极性越大,物质的熔、 沸点越高。如熔、沸点CO>N2(CO为极性分子);又如有机物的同分异 构体中,通常支链越多,分子对称性越好,分子极性越小,物质的 熔、沸点越低(沸点:正戊烷>异戊烷>新戊烷)。(2)溶质分子与溶 剂分子间的范德华力越大,则溶质分子的溶解度越大。如CH4和HCl 在水中的溶解情况,由于CH4与H2O分子间的作用力很小,故CH4几乎 不溶于水,而HCl与H2O分子间的作用力较大,故HCl极易溶于水;同 理,Br2、I2与苯分子间的作用力较大,故Br2、I2易溶于苯中,而 H2O与苯分子间的作用力很小,故H2O很难溶于苯中。
范德华力和氢键及其对物质性质的影响 PPT课件

在273K、101kpa时,O2在水中的溶解度 比N2大,因为O2与水分子的作用力比N2与水 分子的作用力大。
在273K、101kpa时,CO在水中的溶解度
比N2大,因为CO与水分子的作用力比N2与水
分子的作用力大。
返
回
你能从下图中得到什么信息?如何用 分子间作用力解释曲线形状?
一些氢化物的沸点
结论:
O2N
OH
例7、氨气溶于水时,大部分NH3与H2O 以氢键(用“…”表示)结合形成NH3·H2O 分子。根据氨水的性质可推知NH3·H2O的
结构式为( B )
例5、下列现象与化学键有关的是( C )
A.F2、Cl2、Br2、I2单质的熔点依次升高 B.H2O的沸点远高于H2S的沸点 C.H2O在高温下也难分解 D.干冰气化
B.H2O的沸点比HF的高,可能与氢键有关;
C.氨水中有分子间氢键;
D.氢键X—H…Y的三个原子总在一条直线 上。
例15、卤素单质从F2到I2在常温常压 下的聚集状态由气态、液态到固态的
原因是( B )
A.原子间的化学键键能逐渐减小
B.范德华力逐渐增大
C.原子半径逐渐增大
D.氧化性逐渐减弱
例16、罗马大学Fulvio Cacace等人获得了极 具图N键理所吸论示收研(与1究6白7意磷k义JP热4的相量N似,4分)生。子成已,知1Nm断4分o裂l子N1≡结mN构o键l 如N放—右 出 942 kJ 热量。由此判断下列说法正确的是
无方向性 无饱和性
有方向性 有饱和性
有方向性 有饱和性
范德华力
氢键
共价键
强度比较
共价键>氢键>范德华力
①分子极性和相对 分子质量等
分子间作用力(范德华力、氢键)课件2022-2023学年下学期高二化学人教版(2019)选择性必修2

“—”表示共价键 , “…”表示形成的氢键(X、Y一般为N、O、F)。
教材:P57图2-25
O—H … O
不仅氟化氢分子之间、氨分子之间存在氢键, 而且它们跟水分子之间也存在氢键
类型
N—H … N 水分子间
NH3分子间 HF分子间
F—H … F 氨水中
HF水溶液中
1
2
O—H···O
N—H···N
F—H···F
23.11
HCl 36.5
21.14
(1)组成和结构相似的分子,相对分子质量越大,范德华力越大 (2)相对分子质量相同或相近时,分子的极性越大,范德华力越大
分子
CO N2
相对分子质量
28 28
分子的极性
极性 非极性
范德华力(kJ•mol-1)
8.75 8.50
6. 范德华力对物质性质的影响:
单质 F2 Cl2 Br2 I2
一、范德华力
1. 概念: 范德华(van der Waals)是最早研究分子间普 遍存在作用力(把分子聚集在一起的作用力)的科 学家,因而把这类分子间作用力称为范德华力。
2. 本质:分子间的一种静电作用
3. 特点:
(1)广泛存在于分子之间 (2)只有分子充分接近时才能体现 (3)范德华力一般没有方向性和饱和性。只要分子 周围空间允许,总是尽可能多的吸引其他分子。 (4)范德华力很弱,比化学键的键能小1~2数量级 (通常小10-100倍)大约只有几到几十 KJ•mol-1
的大小以五或六原子环 最稳定。分子内氢键可
这里的氢键,不属于分子间作用力,属 于分子内官能团之间的作用力。
以使分子更稳定。且分 子内氢键会削弱分子间 氢键形成.
9.氢键对物质物理性质的影响:
2-3-2范德华力、氢键及其对物质性质的影响与溶解性 59张 PPT课件

氢键。
第二章 分子结构与性质
3.氢键的表示方法
氢键通常用X—H……Y—表示,其中X、Y为N、O、F,
“—”表示共价键,“……”表示形成的氢键。例如,水中的 人
教
氢键表示为:O—H……O—。
版 化
学
第二章 分子结构与性质
说明:
①氢键中电负性强的原子可以是同种原子,也可以是
不同种原子。
人
教
② 氢 键 的 键 长 定 义 为 X—H…Y 的 长 度 , 而 不 定 义 为
2.范德华力的影响因素
影响范德华力的主要因素有分子的相对分子质量、分
子的极性等。
人
教
(1)组成和结构相似的物质,相对分子质量越大,范德
版 化
学
华力越大,如
分子 Ar
范德华
力 /kJ·mo
8.50
l-1
CO HI 8.75 26.00
HBr 23.11
HCl 21.14
第二章 分子结构与性质
(2)分子的极性越强,范德华力越大。 (3)温度升高,范德华力减小。
人 教 版 化 学
第二章 分子结构与性质
3.范德华力对物质性质的影响
(1)对物质熔、沸点的影响
一般来说,分子晶体中范德华力越大,物质的熔、沸 人
教
点越高。具体如下:
版 化
学
①组成和结构相似的物质,随着相对分子质量的增大,
分子间的范德华力逐渐增大,它们的熔、沸点逐渐升高。
如下图中的曲线所示:
第二章 分子结构与性质
版 化
学
第二章 分子结构与性质
若不断地升高温度,实现“雪花→水→水蒸气→氧气
和氢气”的变化。在变化的各阶段被破坏的粒子间的主要
高中化学选修三2.3.2范德华力和氢键课件
子数时,该分子为非极性分子,此时分子的空间结构对称;假设中心原子的
化合价的绝对值不等于其价电子数,那么分子的空间结构不对称,其分子为
极性分子,具体实例如下:
分子
BF3
中心原子化合价 绝对值
3
CO2 4
PCl5 5
中心原子 价电子数
3
4
5
分子极性
非极性 非极性 非极性
SO3 6
6 非极性
H2O 2
6 极性
• (3)氢键的类型
分子内氢键(不属于分子间作用力)
同种分子间氢键:缔合分子
分子间氢键(属于分子间作用力)
不同种分子间氢键
• 尽管人们将氢键归结为一种分子间作用力,但是氢键既可以存在于分 子之间,也可以存在于分子内部的原子团之间。
• 如邻羟基苯甲醛分子内的羟基与醛基之间存在氢键,对羟基苯甲醛存 在分子间氢键(如图)。
第二章 分子结构与性质 第三节 范德华力及氢键
〔第二课时〕
古蔺 陈志华
学习目标 1.知道范德华力、氢键对物质性质的影响。 2、复习键的极性、分子的极性的判断 3、杂化理论、配合物理论等的习题复习
范德华力
1.范德华力 (1)范德华力的定义
降温加压时气体会液化,降温时液体会凝固,这一事实说明,分子 之间存在着相互作用力,它把分子聚集在一起,因而把这类分子间作 用力称为范德华力。其实质是静电作用。 说明: ①范德华力广泛存在于分子之间,只有分子间才有范德华力。属于分 子间的电性作用力。 ②范德华力很弱,约比共价键小1~2个数量级。 ③范德华力只影响分子的物理性质,它无方向性和饱和性。
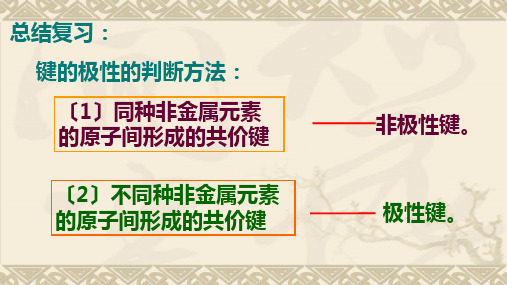
总结复习: 键的极性的判断方法: 〔1〕同种非金属元素 的原子间形成的共价键
〔2〕不同种非金属元素 的原子间形成的共价键
范德华力和氢键ppt课件

Cl2
71 -101.0 -34.6
Br2 160 -7.2 58.8
I2
254 113.5 184.4
范德华力越大,物质熔沸点越高
篮球比赛是根据运动队在规定的比赛 时间里 得分多 少来决 定胜负 的,因 此,篮 球比赛 的计时 计分系 统是一 种得分 类型的 系统
练习:
下列叙述正确的是: A.氧气的沸点低于氮气的沸点 B、稀有气体原子序数越大沸点越高 C、分子间作用力越弱分子晶体的熔点越低 D、同周期元素的原子半径越小越易失去电 子
例如:O2> N2
HI>HBr>HCl
CO >N2
篮球比赛是根据运动队在规定的比赛 时间里 得分多 少来决 定胜负 的,因 此,篮 球比赛 的计时 计分系 统是一 种得分 类型的 系统
二、范德华力及其对物质性质的影响
科学视野
壁虎与范德华力
篮球比赛是根据运动队在规定的比赛 时间里 得分多 少来决 定胜负 的,因 此,篮 球比赛 的计时 计分系 统是一 种得分 类型的 系统
溶质分子与溶剂分子的结构越相似, 相互溶解越容易。
溶质分子的分子间力与溶剂分子的分 子间力越相似,越易互溶。
PtCl2(NH3)2可以形成两种固体,一种为淡黄 篮球比赛是根据运动队在规定的比赛时间里得分多少来决定胜负的,因此,篮球比赛的计时计分系统是一种得分类型的系统 色,在水中的溶解度小,另一种为黄绿色,在
五. 手性
1. 手性:镜像对称,在三维空间里不能重叠。 2. 手性异构体
具有完全相同的组成和原子排列的一对分子,如同 左手与右手一样互为镜像,却在三维空间里不能重叠, 互称手性异构体。 3. 手性分子:有手性异构体的分子叫做手性分子。
《范德华力和氢键》上课课件(省级优质课获奖案例)

21.14 23.11 26.00 8.75 8.50
共价键键能 (kJ/mol)
431.8
366
298.7
745
结论:范德华力很弱, 比化学键的键能小1-。2个 数量级
(2)范德华力与分子的极性的关系:
分子
相对分子 质量
分子的极性
熔点/ºC
沸点/ºC
CO
28 极性分子 -205.05 -191.49
的影响
大,物质熔 气)的溶解性、熔沸点 沸点越高 都产生影响
物质的稳定 性
范德华力和氢键
[问题探究]
分子间作用力
冰融化成水是物理变化还是化学变化? 冰融化过程中有没有破坏其中的化学键? 为什么冰融化过理性质 .
一、范德华力及其对物质性质的影响 (1)范德华力大小
分子
HCl HBr HI CO Ar
范德华力 (kJ/mol)
二、氢键及其对物质性质的影响 1、为什么H2O的相对分子质量比H2S的小, 而熔、沸点比H2S的高得多? 2、哪些分子间易形成氢键?为什么?
3、氢键有哪些特征?以H2O为例进行说明。 4、为什么邻羟基苯甲醛比对羟基苯甲醛的熔沸点低?将氢键表示出来进行 说明。 5、如何理解HCL 、HBR、HI的键能逐渐降低,而熔、沸点逐渐增大?
HI
128
26.00
-50.8 -35.4
结论3: 对组成和结构相似的物质,相对分子质量 越大,范德华力越大,熔沸点越高 。
影响范德华力大小的因素:
(1)范德华力很弱,约比化学键小1~2个数量级
(2) 相对分子质量相近的物质,分子的极性越大, 范德华力越大,熔沸点越高。
(3) 组成和结构相似的分子,相对分子质量越大, 范德华力越大,熔沸点越高。
2020-2021学年化学人教版选修3课件:2-3-2 范德华力和氢键

二、氢键及其对物质性质的影响
1.概念 氢键是一种 分子间作用力 。它是由已经与 电负性 很强的原子(如 N、F、O)形成共价键的 氢原子 与另一个分 子中或同一分子中 电负性 很强的原子之间的作用力。
2.表示方法 氢键通常用 A—H…B— 表示,其中 A、B 为 N、O、F 中的一种,“—”表示 共价键 “…”表示形成的 氢键 。
之间普遍存在的相互作用力,它使
得许多物质能以一定的凝聚态(固态液态)存在。
2.特征
(1)范德华力约比化学键能小 1~2 个数量级。
(2)无方向性和饱和性。
3.影响因素 (1)分子的极性越大,范德华力 越大 。
(2)结构和组成相似的物质,相对分子质量越大,范德华 力 越大 。
4.对物质性质的影响 范德华力主要影响物质的 物理 性质,如熔点、沸点;化 学键主要影响物质的 化学 性质。范德华力越大,物质熔沸 点 越高 。
知识点一 范德华力与物质的性质
分子间作用力:分子和分子之间存在着一种把分子聚集在 一起的相互作用称为分子间作用力。范德华力和氢键是两种常 见的分子间作用力,是比化学键弱得多的作用力。
1.范德华力及特点 (1)范德华力的存在: 由气体在降低温度、增大压强时能够凝结成液态或固态(在 这个过程中,气体分子间的距离不断缩小,并由不规则运动的 混乱状态转变成为有规则的排列状态)的事实可以证明分子间存 在着相互作用,即分子间存在范德华力。
(2)溶质分子与溶剂分子间的范德华力越大,则溶质分子的 溶解度越大。如 CH4 和 HCl 在水中的溶解情况,由于 CH4 与 H2O 分子间的作用力很小,故 CH4 几乎不溶于水,而 HCl 与 H2O 分子间的作用力较大,故 HCl 极易溶于水;同理,Br2、I2 与苯分子间的作用力较大,故 Br2、I2 易溶于苯中,而 H2O 与苯 分子间的作用力很小,故 H2O 很难溶于苯中。
分子间作用力(范德华力、氢键)高二化学同步课件(人教版2019选择性必修2)

科学 技术 社会
夏天经常见到许多壁虎在墙壁或天花板上爬却掉不下来,为什么?
近年来,有人用计算机模拟,证明壁虎的足与墙体之间的作用力在本 质上是它的细毛与墙体之间的范德华力。
练习2.人们熟悉的影片《蜘蛛侠》为我们塑造了一个能飞檐走壁、过高楼 如履平地的蜘蛛侠,现实中的蜘蛛能在天花板等比较滑的板面上爬行,蜘
【思考与讨论】为什么沸点H2O、HF、NH3沸点依次降低? 已知固态H2O、HF、NH3的氢键键能和结构如下:
单个氢键的键能是(HF)n>冰>(NH3)n, 而平均每个分子含氢键数:冰中2个, (HF)n和(NH3)n只有1个,气化要克服的 氢键的总键能是冰>(HF)n>(NH3)n
注意:氢键的键长一般定义为A—H…B的长度,而不是H…B的长度。
F-H…F > O-H…O > O-H…N > N-H…N
②有饱和性、方向性
a.方向性 X—H…Y三个原子一般在同一方向上 原因是在这样的方向上成键两原子电子云之间的排斥力最小,体系最稳定。
b.饱和性 每个裸露的氢原子核只能形成一个氢键,每个孤电子对也只能形成一个氢键。
→每个水分子与4个水分子相邻 →水分子以氢键相连接,含1molH2O的冰中,最多可形成2mol氢键。
蛛之所以不能从天花板上掉下的主要原因是( C )
A.蜘蛛脚的尖端锋利,能抓住天花板 B.蜘蛛的脚上有“胶水”,从而能使蜘蛛粘在天花板上 C.蜘蛛脚上的大量细毛与天花板之间的范德华力这一“黏力”使蜘蛛不 致坠落 D.蜘蛛有特异功能,能抓住任何物体
【情景引入】一些氢化物的沸点 →对于同一主族非金属元素氢化物
1. 范德华力及其对物质性质的影响 (1) 含义:
把分子聚集在一起的作用力称为分子间作用力,又叫范德华力。
