蛋白质相互作用与定量蛋白质组学ppt课件
合集下载
蛋白质的定性定量分析课件(共54张PPT)

芳香族氨基酸的紫外吸收
优 点 • 快速
• 对蛋白质无破坏性
缺 点 • 不是严格的定量,适用于测定蛋
白质粗提液
• 核酸可引起强干扰作用 •芳香族氨基酸含量差异可以起误 差
计算方法 • 标准曲线法
• 蛋白质浓度 (mg/ml)
=1.45×A280-0.74×A260
注意事项
• 石英比色杯 • 调零所用溶液 • 配制标准蛋白所用溶液
PVDF膜 尼龙膜
0.22 um 0.45 um
80-100 ug/cm2
170-200 ug/cm2
< 20kD不易丢失 容量大、强度高
480 ug/cm2
用于核酸
电转移装置
电转移示意图
电转移装置
4. 靶蛋白的免疫学检测
➢ 封闭
— 对转移膜上的潜在结合位点进行封闭 ,防止抗体非特异性结合在膜上,降低背 景颜色
液280 nm的光吸收值是分析 蛋白质的分子量范围 15~200 KD之间
SDS-PAGE凝胶的制备 二、凝胶过滤层析测定蛋白质的相对分子量
溶液中蛋白质含量的快速简 这一方法可用来快速检测溶液中是否含有
注意:在叠放硝酸纤维素膜、聚丙烯酰胺凝胶时,膜与胶之间要紧密贴在一起,中间不能有任何气泡 !
便的方法
一、免疫印迹分析的应用
➢ 对蛋白质进行定性分析
➢ 对蛋白质进行半定量分析 ➢ 信号转导分析
➢生物大分子相互作用分析
二、免疫印迹分析的基本流程
制备蛋白样品 电泳分离蛋白
转移至固相膜
蛋白质转移
封闭非特异结合位点
与第一抗体温育反应
抗体检测
与第迹操作流程图
1. 样品的制备
优 点 • 终产物稳定
相互作用蛋白质组学ppt课件

相互作用蛋白质组学
1
• 蛋白质是生命过程的真正执行者,蛋白质相互作 用与生命健康息息相关。因此,蛋白质互作研究 也是基础生命科学的一个重点研究领域.
• 生物体的生理功能主要由细胞中的蛋白质控制和 调节。其中,多数蛋白质是通过与配体结合或是 作为蛋白质复合物中的一部分参与细胞的代谢过 程。因此,研究蛋白质间的相互作用是理解生命 活动的基础。
1. 基本概述 2. 基本过程 3. 应用与优缺点
4
基本概述
• 酵母双杂交系统( Yeast two-hybrid system,Y2H)是1989年由Fields等提出并初步 建立的,主要用于研究真核生物的蛋白质。
• 该系统利用了酵母的转录激活因子GAL4,含有的两个结构域,DNA结合域 (DNA binding domain,BD)及转录激活域(activation domain,AD),将已知基因 (诱饵基因)和靶基因分别构建在含BD及AD质粒载体上,将两种质粒共同 转化酵母感受态细胞,若B此间结合时,则会导致位于侧翼的 BD与AD在空间上接近,呈现GAL4转录因子的完全活性,激活下游的报告基 因表达,从而在特定的选择性培养基上生长。
1. 基本概述 2. 基本过程 3. 优缺点
14
基本概述
• 免疫共沉淀(Co-Immunoprecipitation, Co-IP)是以抗体和抗原之间的专 一性作用为基础的、用于研究蛋白质相互作用的经典方法。
• 原理:当细胞在非变性条件下被裂解时,完整细胞内存在的许多蛋白 质-蛋白质间的相互作用被保留了下来。如果用蛋白质X的抗体免疫 沉淀X,那么与X在体内结合的蛋白质Y也能沉淀下来。
存在于蛋白质之间的微弱的或暂时的相互作用;
12
缺点
1. 分析蛋白间的相互作用定位于细胞核内,而许多蛋白间的 相互作用依赖于翻译后加工,如糖基化、二硫键形成等, 这些反应在核内无法进行;
1
• 蛋白质是生命过程的真正执行者,蛋白质相互作 用与生命健康息息相关。因此,蛋白质互作研究 也是基础生命科学的一个重点研究领域.
• 生物体的生理功能主要由细胞中的蛋白质控制和 调节。其中,多数蛋白质是通过与配体结合或是 作为蛋白质复合物中的一部分参与细胞的代谢过 程。因此,研究蛋白质间的相互作用是理解生命 活动的基础。
1. 基本概述 2. 基本过程 3. 应用与优缺点
4
基本概述
• 酵母双杂交系统( Yeast two-hybrid system,Y2H)是1989年由Fields等提出并初步 建立的,主要用于研究真核生物的蛋白质。
• 该系统利用了酵母的转录激活因子GAL4,含有的两个结构域,DNA结合域 (DNA binding domain,BD)及转录激活域(activation domain,AD),将已知基因 (诱饵基因)和靶基因分别构建在含BD及AD质粒载体上,将两种质粒共同 转化酵母感受态细胞,若B此间结合时,则会导致位于侧翼的 BD与AD在空间上接近,呈现GAL4转录因子的完全活性,激活下游的报告基 因表达,从而在特定的选择性培养基上生长。
1. 基本概述 2. 基本过程 3. 优缺点
14
基本概述
• 免疫共沉淀(Co-Immunoprecipitation, Co-IP)是以抗体和抗原之间的专 一性作用为基础的、用于研究蛋白质相互作用的经典方法。
• 原理:当细胞在非变性条件下被裂解时,完整细胞内存在的许多蛋白 质-蛋白质间的相互作用被保留了下来。如果用蛋白质X的抗体免疫 沉淀X,那么与X在体内结合的蛋白质Y也能沉淀下来。
存在于蛋白质之间的微弱的或暂时的相互作用;
12
缺点
1. 分析蛋白间的相互作用定位于细胞核内,而许多蛋白间的 相互作用依赖于翻译后加工,如糖基化、二硫键形成等, 这些反应在核内无法进行;
蛋白质组学PPT课件

代谢性疾病蛋白质组学研究通过对糖尿病、肥胖症等代谢 性疾病相关蛋白质的分析,发现了一些与代谢过程密切相 关的关键蛋白质。这些蛋白质涉及糖代谢、脂肪代谢等多 个方面,为药物研发和个体化治疗提供了新的思路和靶点 。同时,对代谢性疾病蛋白质组学的研究也有助于深入了 解疾病的发病机制,为疾病的预防和治疗提供科学依据。
蛋白质组学揭示基因表达 的复杂性
蛋白质组学研究关注基因表达的最终产物蛋白质,揭示了基因表达的复杂性和多样性 。蛋白质的表达和功能受到多种因素的影响 ,如翻译后修饰、蛋白质相互作用等,这些
因素在基因组学研究中难以全面考虑。
蛋白质组学与代谢组学的关系
代谢组学为蛋白质组学提供上下文
代谢组学研究生物体内小分子代谢物的变化,为蛋白质组学提供了上下文和背景。蛋白 质的功能和表达往往与代谢物的变化相互关联,了解代谢物的变化有助于更深入地理解 Nhomakorabea02
蛋白质组学研究技术
蛋白质分离技术
双向凝胶电泳技术
通过改变电泳的pH值和电场强度, 将复杂的蛋白质混合物分离成多 个有序的蛋白质带,以便后续的 鉴定和分析。
蛋白质芯片技术
将蛋白质固定在固相支持物上, 通过与特定的配体或抗体相互作 用,实现对蛋白质的快速、高通 量筛选和检测。
蛋白质免疫沉淀技
术
利用抗体与目标蛋白质的特异性 结合,将目标蛋白质从复杂的混 合物中分离出来,常用于蛋白质 相互作用的研究。
详细描述
癌症蛋白质组学研究通过对癌症细胞和正常细胞蛋白 质表达谱的比较,发现了一系列与癌症发生发展相关 的关键蛋白质。这些蛋白质涉及细胞信号转导、细胞 周期调控、细胞凋亡等多个方面,为癌症治疗提供了 潜在的药物靶点。
案例二:神经退行性疾病蛋白质组学研究
蛋白质组学及技术介绍PPT通用课件.ppt

拖尾"point streaking") 。
3.二相SDS-PAGE
丙烯酰胺/甲叉双丙烯 酰胺溶液
分离胶缓冲液
10%(w/v)过硫酸铵 溶液
(30.8%T,2.6%C):30%(W/V)丙烯酰胺和 0.8%甲叉双丙烯酰胺的水溶 液。将 300g 丙烯酰胺和 8g 甲叉双丙烯酰胺溶解于去离子水中,最后用去离
研究 内容
蛋白质的研究内容主要有两方面:
1、结构蛋白质组学:主要是蛋白质表达模型的研究,包括蛋白质氨基酸序列 分析及空间结构的解析种类分析及数量确定; 2、功能蛋白质组学:主要是蛋白质功能模式的研究,包括蛋白质功能及蛋白 质间的相互作用。
研究 内容
蛋白质组学可分为三个主要领域: 1、蛋白质的微特性以供蛋白质的规模化鉴定和他们的后翻译饰; 2、“差异显示”蛋白质组学供蛋白质水平与疾病在广泛范围的有力应用比 较; 3、应用特定的分析技术如质谱法(包括串联质谱法、生物质谱法)或酵母 双杂交系统以及其他蛋白质组学研究新技术研究蛋白质-蛋白质相互作用。
该方法所研究的蛋白均是在体内经过翻译后修饰的,并且是可 分离的天然状态的相互作用蛋白复合物,能够反映正常生理条件下的 蛋白质间相互作用
蛋白质相互作用
2、酵母双杂交系统:
该系统利用真核细胞调控转录起始过程中,DN A结合结构域(binding domain,BD)识别DNA上的特异序列并使转录激活结构域(activation domain, AD)启动所调节的基因的转录这一原理,将己知蛋白X和待研究蛋白Y的基 因分别与编码AD和BD的序列结合,通过载体质粒转入同一酵母细胞中表 达,生成两个融合蛋白。若蛋白X和Y可以相互作用,则AD和BD在空间上 接近就能形成完整的有活性的转录因子,进而启动转录,表达相应的报告 基因;反之,如果X和Y之间不存在相互作用,报告基因就不会表达。这样, 通过报告基因的表达与否,便可确定是否发生了蛋白质的相互作用。
3.二相SDS-PAGE
丙烯酰胺/甲叉双丙烯 酰胺溶液
分离胶缓冲液
10%(w/v)过硫酸铵 溶液
(30.8%T,2.6%C):30%(W/V)丙烯酰胺和 0.8%甲叉双丙烯酰胺的水溶 液。将 300g 丙烯酰胺和 8g 甲叉双丙烯酰胺溶解于去离子水中,最后用去离
研究 内容
蛋白质的研究内容主要有两方面:
1、结构蛋白质组学:主要是蛋白质表达模型的研究,包括蛋白质氨基酸序列 分析及空间结构的解析种类分析及数量确定; 2、功能蛋白质组学:主要是蛋白质功能模式的研究,包括蛋白质功能及蛋白 质间的相互作用。
研究 内容
蛋白质组学可分为三个主要领域: 1、蛋白质的微特性以供蛋白质的规模化鉴定和他们的后翻译饰; 2、“差异显示”蛋白质组学供蛋白质水平与疾病在广泛范围的有力应用比 较; 3、应用特定的分析技术如质谱法(包括串联质谱法、生物质谱法)或酵母 双杂交系统以及其他蛋白质组学研究新技术研究蛋白质-蛋白质相互作用。
该方法所研究的蛋白均是在体内经过翻译后修饰的,并且是可 分离的天然状态的相互作用蛋白复合物,能够反映正常生理条件下的 蛋白质间相互作用
蛋白质相互作用
2、酵母双杂交系统:
该系统利用真核细胞调控转录起始过程中,DN A结合结构域(binding domain,BD)识别DNA上的特异序列并使转录激活结构域(activation domain, AD)启动所调节的基因的转录这一原理,将己知蛋白X和待研究蛋白Y的基 因分别与编码AD和BD的序列结合,通过载体质粒转入同一酵母细胞中表 达,生成两个融合蛋白。若蛋白X和Y可以相互作用,则AD和BD在空间上 接近就能形成完整的有活性的转录因子,进而启动转录,表达相应的报告 基因;反之,如果X和Y之间不存在相互作用,报告基因就不会表达。这样, 通过报告基因的表达与否,便可确定是否发生了蛋白质的相互作用。
蛋白组学定量蛋白质组学.ppt

但是仅仅进行鉴定并不能提供用以阐明蛋白质的功 能的全部信息,监控蛋白质的表达水平对阐明细胞 体内存在的各种生物进程是非常重要的。因此,定 量蛋白质组学作为蛋白质组学研究的重要一部分被 提出来。
2
常用研究方法
以质谱技术为基础的化学标记定量方法 荧 光 差 示 双 向 凝 胶 电 泳 技 术 ( F-2D-
质量变化依赖于氮原子数目,因此对未 知的蛋白质难以进行定量。
10
(二)稳定同位素标记的必需氨基酸体 内标记(SILAC法)
高等动物细胞的生长中需要一些必需氨基酸的摄入,如赖氨酸 (Lys)、亮氨酸(Leu)、苯丙氨酸(Phe)等,这些氨基酸细胞自身 无法合成,需要从外界摄入补充。
在培养细胞时,可以在培养介质中特异的加入用稳定同位素标 记的某一种必需氨基酸,在经过适当的培养时间后,细胞中合 成的含有这类氨基酸的蛋白质几乎都掺入了标记的氨基酸 。
31
MCAT策略流程:定性
Lys只在Trypsin酶切后的末端,所以产生的b离子都没有被修饰;所有的y 离子带Lys,因此被修饰。
在MS/MS图谱上,所有的b离子是单一条带出现,所有的y离子是成对出现, 丰度比例一样,且相差同样的m/z。
容易区分b离子和y离子,容易读出氨基酸序列。
32
MCAT策略流程:定量
36
–COOH羧基标记
通过对羧基酯化进行 标记
用H和D标记的甲醇酯 化标记,来定量研究 蛋白质表达量的差异
37
羧基酯化标记进行蛋白定量研究
比例=2 : 1
38
缺点:
特异性不是很好,在C末端和Asp和 Glu残基上都有标记,且效率不均
采用的标记条件容易引起天冬酰胺 (Asn)和谷氨酰胺(Gln)的去酰胺
2
常用研究方法
以质谱技术为基础的化学标记定量方法 荧 光 差 示 双 向 凝 胶 电 泳 技 术 ( F-2D-
质量变化依赖于氮原子数目,因此对未 知的蛋白质难以进行定量。
10
(二)稳定同位素标记的必需氨基酸体 内标记(SILAC法)
高等动物细胞的生长中需要一些必需氨基酸的摄入,如赖氨酸 (Lys)、亮氨酸(Leu)、苯丙氨酸(Phe)等,这些氨基酸细胞自身 无法合成,需要从外界摄入补充。
在培养细胞时,可以在培养介质中特异的加入用稳定同位素标 记的某一种必需氨基酸,在经过适当的培养时间后,细胞中合 成的含有这类氨基酸的蛋白质几乎都掺入了标记的氨基酸 。
31
MCAT策略流程:定性
Lys只在Trypsin酶切后的末端,所以产生的b离子都没有被修饰;所有的y 离子带Lys,因此被修饰。
在MS/MS图谱上,所有的b离子是单一条带出现,所有的y离子是成对出现, 丰度比例一样,且相差同样的m/z。
容易区分b离子和y离子,容易读出氨基酸序列。
32
MCAT策略流程:定量
36
–COOH羧基标记
通过对羧基酯化进行 标记
用H和D标记的甲醇酯 化标记,来定量研究 蛋白质表达量的差异
37
羧基酯化标记进行蛋白定量研究
比例=2 : 1
38
缺点:
特异性不是很好,在C末端和Asp和 Glu残基上都有标记,且效率不均
采用的标记条件容易引起天冬酰胺 (Asn)和谷氨酰胺(Gln)的去酰胺
蛋白质组学及其应用PPT课件

3、Zheng M, Hu K, Liu W, Li H, Chen J, Yu X. Proteomic analysis of different period excretory secretory products from Clonorchis sinensis adult worms: molecular characterization, immunolocalization, and serological reactivity of two excretory secretory antigens-methionine aminopeptidase 2 and acid phosphatase. Parasitol ResMar;112(3):1287-97. 2013
7、Jun Pang, Weipeng Liu, Xiaopeng Liu, Liaoyuan Li, Youqiang Fang, Qipeng Sun, Shaojun Liu, Mingtao Li, Zulan Su, Xin Gao. Profiling protein markers associated with lymph node metastasis in prostate cancer by DIGE-based proteomics analysis. J Proteome Res. 2010;9:216226. 8、Yan-Xin Luo, Ji Cui, Lei Wang,,Dian-Ke Chen. Identification of cancer-associated proteins byproteomics and downregulation of b-tropomyosinexpression in colorectal adenoma and cancer. Proteomics Clin. Appl. 2009 9、Jing Luo, Jine Yang, Bing-Yun Yu, Wei Liu, Mingtao Li, Shi-Mei Zhuang. Identification of Siah-interacting protein as a potential regulator of apoptosis and curcumin resistance. Oncogene. 2010; 29(48):6357-6366 10、Liu W, Zhou XW, Liu S, Hu K, Wang C, He Q, Li M. Calpain-truncated CRMP-3 and -4 contribute to potassium deprivation-induced apoptosis of cerebellar granule neurons. Proteomics. 2009 Jul;9(14):3712-28. 11、Wang J, Wu S, Jin X, Li M, Chen S, Teeling JL, Perry VH, Gu J. Retinoic acid-inducible gene-I mediates late phase induction of TNF-alpha by lipopolysaccharide. J Immunol. 2008 Jun 15;180(12):8011-9. 12、Kang L, Yang ZL, Liu W, Zhang LJ, Liu SJ, Huang MJ, Li MT, Wang JP. (2008) Serum proteomic variation study in patients with Crohn disease. Zhonghua Wei Chang Wai Ke Za Zhi. 2008 May;11(3):266-9. 13、Fu H, Dou J, Li W, Luo J, Li KC, Lam CS, Lee NT, Li M, Han Y. Mecamylamine prevents neuronal apoptosis induced by glutamate and low potassium via differential anticholinergicindependent mechanisms. Neuropharmacology. 2008 Mar;54(4):755-65.
7、Jun Pang, Weipeng Liu, Xiaopeng Liu, Liaoyuan Li, Youqiang Fang, Qipeng Sun, Shaojun Liu, Mingtao Li, Zulan Su, Xin Gao. Profiling protein markers associated with lymph node metastasis in prostate cancer by DIGE-based proteomics analysis. J Proteome Res. 2010;9:216226. 8、Yan-Xin Luo, Ji Cui, Lei Wang,,Dian-Ke Chen. Identification of cancer-associated proteins byproteomics and downregulation of b-tropomyosinexpression in colorectal adenoma and cancer. Proteomics Clin. Appl. 2009 9、Jing Luo, Jine Yang, Bing-Yun Yu, Wei Liu, Mingtao Li, Shi-Mei Zhuang. Identification of Siah-interacting protein as a potential regulator of apoptosis and curcumin resistance. Oncogene. 2010; 29(48):6357-6366 10、Liu W, Zhou XW, Liu S, Hu K, Wang C, He Q, Li M. Calpain-truncated CRMP-3 and -4 contribute to potassium deprivation-induced apoptosis of cerebellar granule neurons. Proteomics. 2009 Jul;9(14):3712-28. 11、Wang J, Wu S, Jin X, Li M, Chen S, Teeling JL, Perry VH, Gu J. Retinoic acid-inducible gene-I mediates late phase induction of TNF-alpha by lipopolysaccharide. J Immunol. 2008 Jun 15;180(12):8011-9. 12、Kang L, Yang ZL, Liu W, Zhang LJ, Liu SJ, Huang MJ, Li MT, Wang JP. (2008) Serum proteomic variation study in patients with Crohn disease. Zhonghua Wei Chang Wai Ke Za Zhi. 2008 May;11(3):266-9. 13、Fu H, Dou J, Li W, Luo J, Li KC, Lam CS, Lee NT, Li M, Han Y. Mecamylamine prevents neuronal apoptosis induced by glutamate and low potassium via differential anticholinergicindependent mechanisms. Neuropharmacology. 2008 Mar;54(4):755-65.
蛋白质组学Proteomics-PPT课件.ppt

ICAT的优点
• ICAT具有广泛的兼容性,主要表现在:(1) 能够兼容分析任何条件下体液、细胞、组 织中绝大部分蛋白质;(2)烷化反应即使在 盐、去垢剂、稳定剂(如SDS、尿素、盐酸 胍等)存在下都可进行;(3)只需分析含Cys 残基的肽段,从而降低了蛋白质混合物分 析的复杂性;(4)ICAT战略允许任何类型的 生化、免疫、物理的分离方法,因此能很 好地定量分析微量蛋白质。
双向凝胶电泳
• 首先利用等电点聚焦来分离不同等电点的 蛋白,再利用SDS-PAGE来分离不同分子 量的蛋白,其分辨率是非常高的。微克级 的蛋白质就可以被很好的分辨开了。
基质辅助的激光解吸电离技术
(MALDI)的发展
• 日本岛津公司的田中耕一的工作,是质谱分析发 展的一个主动力。 1987年,在第二届中-日质谱 分析联合讨论会上,田中耕一论述了软激光解吸 附技术可以使蛋白质分子离子化。一年之后,他 的这篇创造性的论文发表在Rapid Communications in Mass Spectrometry上。田中 耕一的工作为基质辅助的激光解吸电离技术 (Maldi)打下了基础。2019年,他和弗吉尼亚联 邦大学的John B Fenn,由于他们对软吸附电离 方法上的贡献一起被授予了该年度诺贝尔化学奖
应用实例
• 1.通过比较给药前后细胞的蛋白质组, 鉴别出毒理学的蛋白质标志物 。
• 2. 疟疾疫苗的研究。
ICAT技术
同位素标记的亲和标签(isotope-coded affinity tag, ICAT)技术作为一种体外标记稳定同位素的相对定量方法, 已经成为重要的蛋白质组学定量分析方案。2019年,Gygi 等人用化学方法合成一种能和半胱氨酸反应的亲和试剂, 称为稳定同位素编码的亲和标签,它有轻链和重链(稳定重 同位素)两种形式,可以在体外标记不同状态下的蛋白质样 品,酶解并用亲和柱分离纯化被标记的肽段后,再用质谱 进行分析,和体内标记法一样也能够得到成对的峰表示不 同样品中肽段及对应蛋白质含量的差异。这种稳定同位素 亲和标签技术可以广泛地应用在细胞和组织的定量蛋白质 组学分析上,提供精确的蛋白质相对定量数据。
蛋白质组学定量研究常见方法-PPT课件

辉骏生物:fitgene/
免费服务热线:400-699-1663
1:双向电泳
基于2D-PAGE 的经典定量分 析方法。 1、样品准备 和定量:抽提 对照组和各种 不同实验组的 蛋白质。 2、蛋白质分 离:蛋白质经 过2D-PAGE分离 后染色(银染、 考染等)。 3、蛋白质的 定性与定量分 析:通过与对 照组相Image Master 7.0分 析出实验组中 差异点,质谱 鉴定差异点蛋 白质,同时应用 软件分析出其 表达量的变化。
4:化学标记法—ICAT
ICAT法的缺点: (1)它不能用于标记不含半胱氨酸或半胱氨酸含量低的蛋白质。 (2)ICAT分子量相对较大(约500Da),与蛋白质连接后可能会造成分子 的空间位阻 (3)ICAT分子量相对较大(约500Da),由于在MS分析中标签仍保留在每 个肽上,使得在碰撞诱导解吸(CID)条件下,很容易被片段化,那么标签特 异化的片段离子就会使串联质谱分析标记肽段的过程复杂化, (4) ICAT分子量相对较大(约500Da),这对小肽而言是一个较大的修饰 物,会增加数据库搜索的复杂性 (5)标记时通常需要延长时间来保证ICAT与蛋白质充分结合,这可能会造 成赖氨酸、组氨酸、色氨酸、酪氨酸发生氨基酸局部衍化。 (6)与原子结合的硫醚键化学稳定性较低,可能会自发发生β -消除反应 使部分标签断裂。
蛋白质组学定量研究常见方法
辉骏生物:fitgene/
免费服务热线:400-699-1663
蛋白质组学定量研究常见方法
1:常规双向电泳 2:DIGE 3:15N等同位素标记 4:ICAT 5:iTRAQ 6:SILAC
辉骏生物:fitgene/
免费服务热线:400-699-1663
《蛋白质组学》课件

蛋白质组学技术
本节将介绍蛋白质组学常用的实验技术和分析方法,包括质谱、二维电泳、 蛋白质结构预测等。
蛋白质组学应用领域
本节将探讨蛋白质组学在生物医药、农业和环境科学等领域的应用,展示其 广泛的研究价值。
蛋白质组学研究的重要性
本节将详细解释为何蛋白质组学研究对于解决生物学中的关键问题和推动科学进步具有重要意义。
《蛋白质组学》PPT课件
欢迎观看《蛋白质组学》PPT课件,本课程将介绍蛋白质组学的概念、技术、 应用领域和重要性,以及它的发展趋势。
课程介绍
本节将介绍蛋白质组学的基本概念和研究对象,以及在生物学研究中的重要 性。
蛋白质组学概述
本节将对蛋白质组学的研究内容、方法和技术进行概述,帮助您理解蛋白质组学的基本原理。
蛋白质组学的发展趋势
本节将展望析和应用拓展等方面。
结论和要点
本节将总结蛋白质组学课程的要点和结论,帮助您加深对蛋白质组学的理解 和应用。
蛋白质相互作用课件

27
发现新的相互作用蛋白质
AD AD
B-Pr 基因库
DB
UAS lacZ
B-Pr
基因库
Y
DB
UAS lacZ
.
B-Pr
基因库
28
确定蛋白质间相互作用的功能基团
Protein A
1
2
3
4
1
2
3
3
白
兰
白
B-Pr
.
29
鉴定和分析已有的蛋白质间的相互作用
B-Pr
A-Pr
兰:相互作用
白:不相互作用
.
30
.
42
Donor is excited at the maximum absorbance wavelength (380 nanometers) of the donor
Acceptor signal is increased at
the acceptor emission maximum
. (510 nanometers)
.
32
UAS llaaccZZ
Auto activation
DB
X
UAS lacZ
AD
Y
.
33
NoSUCCESS
THANK YOU
Image
2024/10/14
.
34
Phage display(噬菌体展示)
.
35
Phage display(噬菌体展示)
Phage display的最大优点是数量大
各种不同的tag。许多
.
19
GST pull down
GST Fusion Protein Purification
蛋白质组学及技术介绍通用课件

详细描述
蛋白质组学技术可以对蛋白质相互作用进行系统研究,发现新的药物靶点,并对药物作用过程中蛋白 质的应答变化进行监测,从而对新药进行有效的筛选和评价。同时,蛋白质组学还可以用于研究药物 的作用机制,解析药物在体内的生物过程,为新药的研发提供重要的理论支持。
生物进化研究
总结词
蛋白质组学在生物进化研究中的应用主要表 现在对不同物种间蛋白质结构和功能的比较 分析,揭示生物进化的规律和机制。
动物实验伦理
减少动物使用
尽量采用其他替代方法,减少动物的使用数量和痛苦。
优化实验方案
在必须使用动物的情况下,应优化实验方案,尽量减少动物的痛苦 和死亡。
严格遵循法律法规
遵守国家和地区的动物保护法律法规,确保实验的合法性。
数据共享与知识产权保护
数据共享
鼓励在学术领域内共享数据,促进科研合作和知识进步。
详细描述
蛋白质组学通过对不同物种间相似蛋白质的 同源性进行分析,可以发现物种间的亲缘关 系和进化历程。同时,蛋白质组学还可以通 过对蛋白质结构和功能的比较分析,发现物 种间在适应环境变化过程中产生的蛋白质变 异和进化机制。这些研究对于深入理解生物
进化的过程和机制具有重要意义。
04
蛋白质组学研究展望
通过测定蛋白质的氨基酸序列,确定蛋白质的组成和 结构。
质谱分析
通过测量蛋白质离子的质量和电荷比值,推断蛋白质 的分子量和肽链组成。
数据库搜对,确定蛋白质的身份。
蛋白质定量技术
同位素标记技术
01
通过同位素标记目标蛋白质,利用其与未标记蛋白质在质谱中
鉴定蛋白质之间的相互作用关系,了解蛋白 质的功能网络。
蛋白质修饰分析
研究蛋白质的翻译后修饰,如磷酸化、糖基 化、乙酰化等,以揭示其调控机制。
蛋白质组学技术可以对蛋白质相互作用进行系统研究,发现新的药物靶点,并对药物作用过程中蛋白 质的应答变化进行监测,从而对新药进行有效的筛选和评价。同时,蛋白质组学还可以用于研究药物 的作用机制,解析药物在体内的生物过程,为新药的研发提供重要的理论支持。
生物进化研究
总结词
蛋白质组学在生物进化研究中的应用主要表 现在对不同物种间蛋白质结构和功能的比较 分析,揭示生物进化的规律和机制。
动物实验伦理
减少动物使用
尽量采用其他替代方法,减少动物的使用数量和痛苦。
优化实验方案
在必须使用动物的情况下,应优化实验方案,尽量减少动物的痛苦 和死亡。
严格遵循法律法规
遵守国家和地区的动物保护法律法规,确保实验的合法性。
数据共享与知识产权保护
数据共享
鼓励在学术领域内共享数据,促进科研合作和知识进步。
详细描述
蛋白质组学通过对不同物种间相似蛋白质的 同源性进行分析,可以发现物种间的亲缘关 系和进化历程。同时,蛋白质组学还可以通 过对蛋白质结构和功能的比较分析,发现物 种间在适应环境变化过程中产生的蛋白质变 异和进化机制。这些研究对于深入理解生物
进化的过程和机制具有重要意义。
04
蛋白质组学研究展望
通过测定蛋白质的氨基酸序列,确定蛋白质的组成和 结构。
质谱分析
通过测量蛋白质离子的质量和电荷比值,推断蛋白质 的分子量和肽链组成。
数据库搜对,确定蛋白质的身份。
蛋白质定量技术
同位素标记技术
01
通过同位素标记目标蛋白质,利用其与未标记蛋白质在质谱中
鉴定蛋白质之间的相互作用关系,了解蛋白 质的功能网络。
蛋白质修饰分析
研究蛋白质的翻译后修饰,如磷酸化、糖基 化、乙酰化等,以揭示其调控机制。
蛋白质相互作用PPT课件

蛋白质组学是应用各种技术研究蛋白质组 的一门新兴科学。
其目的是从整体的角度分析细胞内动态变 化的蛋白质组分、表达水平与修饰状态, 了解蛋白质之间的相互作用与联系,揭示 蛋白质功能与细胞生命活动规律。
9. 3 蛋白质相互作用网络
蛋白质的相互作用(PPI, Protein-protein interaction)是指蛋白质分子之间的相关性, 并从生物化学、信号转导和遗传网络的角 度研究这种相关性。
有一些蛋白质可以以单体 的形式发挥作用,但是大 部分的蛋白质都是和伴侣 分子或是与其他蛋白质一 起发挥作用的。
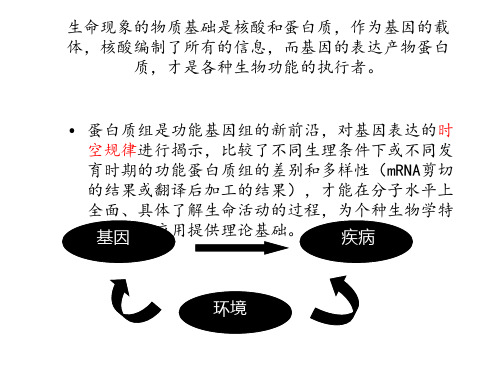
基因组计划--大量的新基因不断被发现,然而单纯的 基因组DNA序列尚不能解答许多生命问题。基因是相对静 态的,而基因编码的产物—蛋白质则是动态的,具有时空 性和调节性,是生物功能的主要体现者和执行者。蛋白质 的表达水平、存在方式以及相互作用等直接与生物功能相 关。
抵御外来细菌和病毒的抗体及免疫类物质,当蛋白质充足时, 一旦需要这些抗体和免疫物质在数小时内就可以增加数百倍。
参与细胞的信号转导,调控细胞的发育和凋亡,及至生物体的 命运。
形成生物体的渗透压,引发生物体的各种活动,例如肌肉的做 功等。
3.运输载体
蛋白质是生物体内很多重要的代谢物和营养素的载体。 氧、脂类、维生素、矿物质与微量元素都需要利用各种蛋白质运输到
5. 生物分子网络具有度的负关联 性
度的负关联性;
具有度大的节点趋向于连接度小的节点的特点
在蛋白质相互作用的网络中:
度非常大的蛋白质节点不直接相连 与度比较小的蛋白质节点相连接
6.生物分子网络具有一定的鲁棒性和适应性
生物分子网Biblioteka 具有鲁棒性: 即对于外界环境的变化或者内部个体之间的不相容有着一定的 承受能力,这与生物分子网络无标度的拓扑性质息息相关。拥 有不同度值的节点对移除表型的影响差异很大。当移除网络中 的多数非关键节点基因时,几乎没有明显的表型影响。
蛋白质的相互作用研究方法课件.ppt

蛋白质的相互作用研究方法课件
四、Bimolecular Fluorescent Complementation
蛋白质的相互作用研究方法课件
蛋白质的相互作用研究方法课件
五、Yeast Two-Hybrid Systerm
蛋白质的相互作用研究方法课件
1.原理 酵母双杂交系统由Fields和Song等首先在研究真
蛋白质的相互作用研究方法课件
蛋白质的相互作用研究方法课件
2008年诺贝尔化学奖
蛋白质的相互作用研究方法课件
GFP主要应用: • 对活细胞中的蛋白质进行准确定位及动态观察
可实时原位跟踪特定蛋白在细胞生长、分裂、分化过 程中或外界刺激因子的作用下的时空表达, 如某种转录因 子的核转位、蛋白激酶C的膜转位等。
GFP基因与分泌蛋白基因连接后转染细胞, 可动态观察 该分泌蛋白分泌到细胞外的过程
GFP基因与定位于某一细胞器特殊蛋白基因相连,就能 显示活细胞中细胞核、内质网、高尔基体、线粒体等细胞 器的结构及病理过程。
膜蛋白的移动 (Fluorescence Recovery After Photobleaching FRAP ) • 蛋白之间的相互作用(FRET) • 报告分子 将GFP的基因连在特殊的启动子的后面,可以检 测基因表达的时间和部位。
容易检测 分子量小
Douglas Prasher was the 不需要其它底物
first person to realize the potential of GFP as a tracer molecule.
Douglas Prasher 1992 克隆了GFP基 因
蛋白质的相互作用研究方法课件
核基因转录调控中建立。 典型的真核生长转录因子, 如GAL4、GCN4、
四、Bimolecular Fluorescent Complementation
蛋白质的相互作用研究方法课件
蛋白质的相互作用研究方法课件
五、Yeast Two-Hybrid Systerm
蛋白质的相互作用研究方法课件
1.原理 酵母双杂交系统由Fields和Song等首先在研究真
蛋白质的相互作用研究方法课件
蛋白质的相互作用研究方法课件
2008年诺贝尔化学奖
蛋白质的相互作用研究方法课件
GFP主要应用: • 对活细胞中的蛋白质进行准确定位及动态观察
可实时原位跟踪特定蛋白在细胞生长、分裂、分化过 程中或外界刺激因子的作用下的时空表达, 如某种转录因 子的核转位、蛋白激酶C的膜转位等。
GFP基因与分泌蛋白基因连接后转染细胞, 可动态观察 该分泌蛋白分泌到细胞外的过程
GFP基因与定位于某一细胞器特殊蛋白基因相连,就能 显示活细胞中细胞核、内质网、高尔基体、线粒体等细胞 器的结构及病理过程。
膜蛋白的移动 (Fluorescence Recovery After Photobleaching FRAP ) • 蛋白之间的相互作用(FRET) • 报告分子 将GFP的基因连在特殊的启动子的后面,可以检 测基因表达的时间和部位。
容易检测 分子量小
Douglas Prasher was the 不需要其它底物
first person to realize the potential of GFP as a tracer molecule.
Douglas Prasher 1992 克隆了GFP基 因
蛋白质的相互作用研究方法课件
核基因转录调控中建立。 典型的真核生长转录因子, 如GAL4、GCN4、
蛋白质组学PPT课件
蛋白质组定义
1,基因组表达的全部蛋白质。 2,在一种细胞/组织内存在的全部蛋白 质。
Proteome
• 1994 M.Wilkins and K.W.Williams
•
Macquarie University in Sydney
• Total Proteins Complement of a Genome
环境
ቤተ መጻሕፍቲ ባይዱ
REAL COMPLEXITY…
IS IN CELLULAR ROTEOMES • BEYOND THE GENOME… • Tissue Specific Expression • Alternate Splicing, (1/3 of all genes) • Post-Translational Modifications
Functional
Proteomics
• During human development, cell express different proteins
• Normal and cancer cells express different proteins
• Cell treated with and without drug express different proteins
– Types and Level:
– Signal Sequence cleavage – Glycosylation
– Phosphorylation – Farnylation – Isoprenylation – Acetylation
• All combine > 100-1000 fold increase in complexity
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
增殖。
15
其他新的双杂交系统:
分离的泛素系统
split-ubiquitin syatem. (PNAS, 1996,91:10340-10344) 利用泛素的功能特点。 当分别与泛素N端和C端部分融合的两 个蛋白质相互作用时,使分离的泛素的 两部分靠近,泛素专一性的蛋白酶就会 识别泛素,导致报道蛋白的解离释放。
3
蛋白质相互作用控制着生命过程的各个方面
4
Yeast Two Hybrid Mass Spectrometry
5
二、酵母双杂交技术及进展
Yeast Two-Hybrid,Y2H.
Fields S. and Song O.:
Nature, 1989, 340: 245-246
研究蛋白质相互作用的方法,利用转 录因子组件式(modular)结构的性 质。Y2H 就是将需要研究的蛋白质设 计成“诱饵”,以钓出能与诱饵蛋白 发生物理相互作用的蛋白质(被捕食 蛋白质)。
22
特点:
快速、安全,不需标记物和染料, 还可检测蛋白-核酸及其它分子间的相 互作用。
SPR DNA生物传感器可用于基因 突变的检测、PCR产物测定、病毒检 测等。
23
六、蛋白质间连锁图的建立
已建立酿酒酵母1548个蛋白质间 2358个相互作用网络:
Fields, S. Lab: Nat. Biotechnology 2000,18:1257-1261.
Nature, 2000,403:623-627.
线虫:148个相互作用: Walhout A.J. et al.: Science, 2000, 287: 116-122.
19
四、噬菌体展示技术 (Phage display)
噬菌体展示技术是利用噬菌体的外壳蛋白与目的 蛋白或多肽融合表达,将目的蛋白表达在噬菌体颗粒 的外部,在蛋白质水平上进行“Biopanning”体外筛 选,十分适用于酶与其配体或抑制剂、抗原决定簇、 细胞表面受体的筛选等等。这个筛选的过程很简单, 将目标肽或蛋白质固定于平板上,铺上噬菌体,噬菌 体外壳融合蛋白与目标肽结合,不能结合的噬菌体颗 粒将被洗掉,再将结合的噬菌体洗下,进行扩增培养, 再进行一到两次的轮回,就能够分离到特定的噬菌体 颗粒。
14
分离杂交系统,split-hybrid system 利用2个相互整合的报告基因。
细胞质中的双杂交系统:
SOS招募系统:
SOS recruitment system
利用Ras信号传导途径的基本性质:
两种蛋白相互作用,就会将hSos
(人的鸟苷酸交母细胞在限制温度下成活和
6
一个单转录因子有: DBD: DNA binding domain DNA结合结构域。 AD:Activation domain, 转录激活结构域:能激活RNA聚合
酶起始转录。
7
诱饵蛋白B + DBD:不能起始转录 被捕食蛋白的ORF + AD:不能起始转录。 当诱饵蛋白和被捕食蛋白在同一细胞中 表达,如发生相互作用, RNA聚合酶将 启动报告基因His3转录,合成组氨酸, 如His3不表达,细胞不能生长。
16
单杂交系统,one hybrid system DNA和蛋白质间相互作用。 鉴定与特定DNA序列直接作用的蛋白质。
三杂交系统,three hybrid system RNA或小分子配体和蛋白质的相互作用
三者共同作用,才能激活转录。
17
三、酵母双杂交技术在蛋白质组 学中的应用
Interactome 互作组:全面详尽的 蛋白质相互作用图谱。
21
五、表面等离子体共振技术 SPR Surface Plasmon Resonance
研究蛋白质相互作用的新方法。如 瑞典BIACORE的单元蛋白质芯片。
将诱饵蛋白作为配基,固化在几十 纳迷厚的金属膜表面,加入含猎物蛋 白的溶液,如有相互作用会特异性结 合形成蛋白质复合物,使金属膜与溶 液界面的折射率上升,导致共振角度 改变。
病毒、细菌、酵母、线虫等。 T7噬菌体:首先用于大规模Y2H分析:
55个有25个相互作用。 丙型肝炎病毒HCV:编码10个成熟蛋白, 有5个相互作用。
18
酿酒酵母:6000多个ORF, 1996完成 基因组,P. et al.,
第九章
蛋白质相互作用与定量 蛋白质组学研究技术
1
主要内容:
蛋白质相互作用主要研究技术 酵母双杂交技术进展 TAP(Tandem Affinity Purification)技术进展 自动化、高通量酵母双杂交技术和TAP技术 定量蛋白质组学研究技术
2
一、蛋白质相互作用
Protein-Protein Interactions
20
噬菌体展示技术(Phage display)
· Ph.D.-7 Phage Display Peptide Library Kit · Ph.D.-12 Phage Display Peptide Library Kit · Ph.D.-C7C Phage Display Peptide Library Kit · Ph.D. Peptide Display Cloning System
8
Fields S. and Song O.
A novel genetic system to detect protein-protein interactions.
Nature, 1989, 340: 245-246
9
10
11
12
优点: 酵母细胞几乎能表达所有生物基因。
缺点: 并非所有蛋白质能在酵母核内正常
行使功能,不正确的蛋白质折叠结构: 假阳性 假阴性
13
Y2H开始以转录因子Gal4为基础,依靠 招募RNA聚合酶II激活转录。
1997:Marsoliter等建立以RNA聚合酶III 为基础的Y2H,假阳性率更低。
反向双杂交系统:reverse two-hybrid system. 构建反向筛选的报告基因(URA3, U合成所必需),蛋白质互作激活报告基因 表达,使细胞不能成活。
24
七、酵母双杂交技术方法
