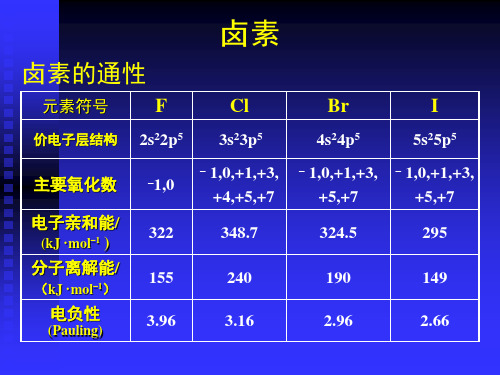
卤素的通性.
卤素
(b)
K2MnF6+2SbF5
423K
2KSbF5+MnF4
MnF3+1/2F2 ↑
2. 氯的制备:
工业上利用离子交换膜法电解NaCl水溶液生产Cl2
2Cl-(aq) 2H2O(l) + 2eCl2(g) + 2e2OH-(aq) + H2(g)
实验室用氧化剂MnO2、KMnO4
与浓盐酸反应制取Cl2 。
空气驱出的 Br2 被碳酸钠溶液吸收后歧 化生成溴化钠和溴酸钠,用 H2SO4 酸 化时发生反歧化反应重新生成 Br2:
3 Br2 + 3 Na2CO3 5 HBr + HBrO3 5 NaBr + NaBrO3 + 3 CO2 3 Br2 + 3 H2O
2Br-(aq) + Cl2(g) → Br2(l) + 2Cl-(aq)
ZrO2 (s) + 2 CCl4 (g)
高温
TiCl4(l) + 2 CO (g)
ZrCl4 (s) + 2 COCl2 (g)
● 以水合金属氯化物为起始物的脱水反应:
FeCl3· 6H2O + 6 SOCl2 (l)
FeCl3· 6H2O
△,干燥HCl气流
回流
FeCl3 (s) + 6 SO2 (g) + 12 HCl (g)
3 卤素单质的制备
卤素在自然界中主要以氧化数为-1的卤化物存在。因 此,制备卤素单质都是用氧化其相应卤化物的方法。
1. 氟的制备: 电解法
1886年 Moissan 采用溶有少量 KF 的HF 液体做 电解液,电解槽用 Pt-In 合金, U 形管中装有 NaF 吸收 HF: 阳极(无定型炭)
大学无机化学第14章 卤素
4
ø2
(0.4556 1 1.0774 1)V 0.7665 V 2
ø3
(0.6126 6 - 1.0774 1)V 0.5196 V 5
12
(2)
0.7665
BrO
3
0.5357
BrO
-
0.4556
Br2
1.0774
Br
-
0.5196
Br2、BrO 可以歧化。
13
电解液中,常加入少量的氟化物如LiF、 AlF3等,以降低电解质的熔点,减少HF的挥 发。阳极和阴极用隔板隔开,气体氟经过 净化后,以17.7~17.8 MPa的压力压入特 22 制钢瓶中。
2-3
2、合成法 1986年Karl Chrite 首次 用化学方法合成了F2: (1)4KMnO4+4KF+20HF==4K2MnF6+10H2O+3O2 ↑ (2)SbCl5+5HF====SbF5+5HCl 423K (3)2K2MnF6+4SbF5 ==== 4KSbF6+2MnF3+F2 ↑
注意: 氟与稀碱反应是 2F2+2OH-=2F-+OF2+H2O 氟与浓碱反应是 2F2+4OH-=4F-+O2+2H2O 卤素与碱反应是制备次卤酸盐和卤酸盐的 常用方法,在酸性条件下均可发生反岐化反 应
3Br2+2OH-=5Br-+BrO3-+3H2O
5Br-+BrO3-+6H+= 3Br2+3H2O
-
(3) 因为 BrO 能歧化 ,不稳定。 所以 Br 2 (l) 与 NaOH 混合最稳定的产物
第12章 卤素

当碱液较浓时,则OF2被分解放出O2 :
2 F2 4 OH 4 F O 2 2 H 2 O
四、卤素单质的制备和用途
1. F2的制备
(1) 电解法 从 1768 年发现 HF 以后,直到1886 年得到 F2 历时 118 年。 1886年 Moissan 采用溶有
少量 KF 的HF 液体做电解液,
1 MnF 3 F2 2
(3) 实验室制法
K 2 PbF 6
△ △
K 2 PbF 4 F2
BrF5 (g)
BrF3 (g) F2
IF 2 AsF5 (s) 2KF 473K KIF 6 KAsF6 F2
2. Cl2的制备
(1) 电解饱和食盐水
阳极: 阴极: 2 Cl Cl 2 2 e 2 H 2 O 2 e H 2 2 OH
(X Cl, Br) (X Cl, Br, I)
3 X 6 OH 5 X XO ② 2 3 3 H 2O
温度
所进行的反应
Cl2
Br2 I2
T≤ 20 ℃ T > 70 ℃ T= 0 ℃ T>0℃ 任何温度
① ② ① ② ②
2 F2 2 OH ( 2﹪ ) 2 F OF2 H 2 O
电解槽和电极用 Pt-In 合金,U
形管中装有 NaF 吸收 HF:
2HF(l)( 含KF) H 2 F2
电解, 249K
目前氟的工业制备技术已有了很大的改进: ① 电解KHF2和无水HF的熔融混合物。
阳极: 2 F F2 2 e 阴极: 2 HF 2 2 e H 2 4 F
共价型卤化物 :氟化物△fGØ 最负。
第十七章卤素

第十七章卤素
第十七章 卤素
四、卤素的氧化物
§17.2 单质及化合物
卤素的氧化物
氧化态 -1 +1 +4 +5 +6 +7
F
OF2
Cl
Cl2O ClO2
Cl2O6 Cl2O7
第十七章卤素
第十七章 卤素
§17.2 单质及化合物
3. 卤酸及盐
(1)卤酸的酸性及氧化性
卤酸的酸性和氧化性
卤酸 HClO3
酸性 强酸
电对 ClO3-/Cl2
E /V 1.47
HBrO3 强酸 BrO3-/Br2 1.52
HIO3 中强酸 IO3-/I2
1.19
HClO3酸第十性七章最卤素强,HBrO3氧化性最强。
第十七章 卤素
五、卤素的含氧酸及其盐
§17.2 单质及化合物
四类含氧酸:HXO、HXO2、HXO3、HXO4。 氧化态分别为+1、+3、+5、+7,都采取sp3杂化。 卤素原子和氧原子之间除有sp3杂化轨道参与成键外。 除氟外,还有氧原子中充满电子的2p轨道与卤素原 子空d 轨道形成d-pπ键。
第十七章卤素
1. 次卤酸及盐
(1)次卤酸的酸性及氧化性 次卤酸的酸性和氧化性
次卤酸 HClO HBrO
酸性( K a ) 电对
3.4×10-8 HClO/Cl2 2×10-9 HBrO/Br2
E/V
1.61 1.60
HIO 2.5×10-11 HIO/I2
卤素

卤素11-1 卤素的通性一、卤素的存在氟是最活泼的非金属元素,氟单质是目前已知最强的氧化剂,所以自然界中没有游离态的氟存在,只有氟的化合物。
萤石──氟化钙CaF 2───就是氟的天然化合物,因为在黑暗中摩擦时发出绿色荧光而得名。
氯在地壳中的质量分数为0.031% ,主要以氯化物的形式蕴藏在海水里,海水中含氯大约为 1.9% 。
在某些盐湖、盐井和盐床中也含有氯。
在自然界中,碘以化合物的形式存在,地壳中碘的质量百分数为3 ×10% ,主要以碘酸钠NaIO 3的形式存在于南美洲的智利硝石矿中。
在海水中碘的含量很少,但海洋中的某些生物如海藻、海带等具有选择性地吸收和聚集碘的能力,是碘的一个重要来源。
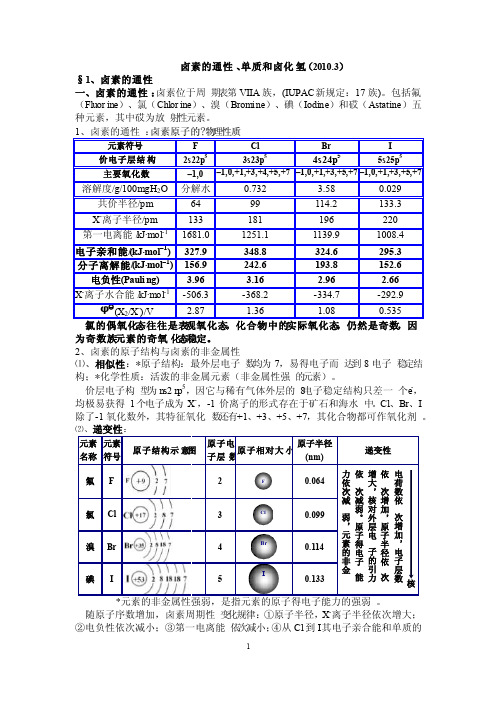
二、卤素原子的性质卤素原子的一些性质性质氟氯溴碘原子序数价电子构型常见氧化态共价半径/pmX - 离子半径/pm第一电离能/(kJ/mol) 电子亲合能/(kJ/mol) X - 水合能/(kJ/mol) X 2 的解离能/(kJ/mol) 电负性(Pauling 标度)92s 2 2p 5-1641331681327.9-507156.93.98173s 2 3p 5-1,1,3,5,7991811251348.8-368242.63.16354s 2 4p 5-1,1,3,5,7114.21961140324.6-335193.82.96535s 2 5p 5-1,1,3,5,7133.32201008295.3-293152.62.66三、卤素的电极电势φθ(V ):2.87 1.36 1.07 0.54F 2 ———F - Cl 2 ———Cl - Br 2 ———Br - I 2 ———I -11-2 卤素单质一、卤素单质的物理性质卤素单质的物理性质性质氟氯溴碘物态颜色液体密度(g/ml )熔点(K )沸点(K )汽化热/kJ/mol临界温度/K临界压力/MPa气体淡黄色1.513/85K53.3884.866.541445.57气体黄绿色1.655/203K172238.420.414177.7液体红棕色3.187/273K265.8331.829.5658810.33固体紫色( 气) 紫黑色( 固)3.960/393K386.5457.441.9578511.75二、卤素单质的化学性质1 、卤素与金属的反应卤素单质的氧化性是其最典型的化学性质.氟在低温或高温下都可以和所有的金属直接作用,生成高价氟化物。
第6章卤素
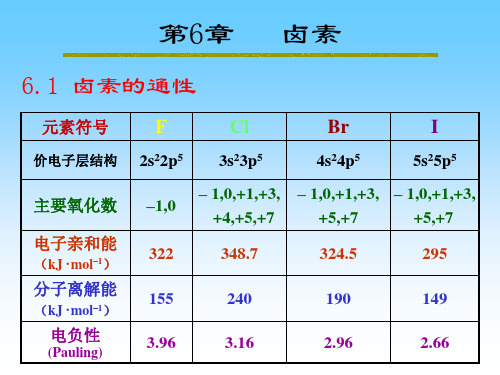
6.1 卤素的通性
元素符号
价电子层结构
卤素
Br
4s24p5
F
2s22p5
Cl
3s23p5 – 1,0,+1,+3, +4,+5,+7 348.7 240 3.16
I
5s25p5
主要氧化数 电子亲和能
(kJ · mol–1)
–1,0
322 155 3.96
– 1,0,+1,+3, – 1,0,+1,+3, +5,+7 +5,+7 324.5 190 2.96 295 149 2.66
4
K (Br2 ) 7.2109
K (I2 ) 2.01013
可见:氯水, 溴水, 碘水的主要成分是单质。 在碱存在下,促进X2在H2O中的溶解、歧化。
X XO H 2O 歧化反应 X 2 2OH _ 产物: 3X 6OH 5X XO 3 3H2 O 2
综 上 所 述
• 同一元素含氧酸酸性随氧化数升高而增强; • ---------------------稳定性---------------而增强; • ---------------------氧化性---------------而减弱。
6.5 拟卤素和拟卤化物
某些负一价的阴离子在形成化合物和共价化合物时,表现 出与卤素离子相似的性质。在自由态时,其性质与卤素很相似, 所以称之为拟卤素。 拟卤素主要包括: 氰 (CN)2 硫氰 (SCN)2 氧氰(OCN)2
2. 亚卤酸及其盐
已知的亚卤酸仅有亚氯酸,存在于水溶液中,酸性 比次氯酸强。
H2SO4+Ba(ClO2)2
卤素

氟 氯 石油产区的矿井水 干海藻 智利硝石 油井盐水 人工合成
卤素的电势图
卤素单质
卤素单质的物理性质 卤素单质的化学性质
卤素的制备和用途
卤素单质的物理性质
卤素分子内原子间以共价键相结合而形成双原子分子。 从氟到碘,随着分子间色散力的逐渐增加,卤素单质的密度、 熔点、沸点、临界温度和气化热的物理性质俊依次递增。
稀的 HF 是弱酸,而当其浓度大于 5.0 mol ·dm–3时,
酸性增强。因为,随着浓度的增大, HF 分子间的氢键增
强,形成 [HF]2 缔合分子,而 [HF]2 的酸性比 HF 强。
HF(aq)
2 HF
H+(aq) + F–(aq)
– H+ + HF2
K a
= 6.310–4
K = 3.310–3
1
金属卤化物的制备
卤化氢或氢卤酸与活泼金属、金属氧化物和氢氧化物
以及金属难溶盐作用, 可以得到相应的金属卤化物:
Zn + 2 HCl CuO + 2 HCl ZnCl2 + H2 (与活泼金属反应) CuCl2 + H2O (与金属氧化物反应)
NaOH + HCl NaCl + H2O (与氢氧化物反应) CaCO3 + 2 HCl CaCl2 + H2O + CO2
– – –
1
单质氟的制备
F2 是最强的氧化剂,所以通常不能采用氧化F 离子
-
的方法制备单质氟。
电解法制备单质氟 : 阳极反应:
2F – 2e 2
– HF2
–
–
F2
–
阴极反应:
+ 2e
卤素

2009/6/9
卤素
杨勤
溴酸和碘酸的酸性比氯酸要弱,溴酸的氧化性强 溴酸和碘酸 2BrO3-+2H++I2=2HIO3+Br2 2ClO3-+2H++I2=2HIO3+Cl2 2BrO3+2H++Cl2=2HClO3+Br2 溴酸制法: Br2+5Cl2+6H2O2HBrO3+10HCl 碘酸制法: I2+5Cl2+6H2O2HIO3+10HCl 3I2+10HNO3 6HIO3+10NO+2H2O 盐:卤酸盐中溴酸盐的氧化性最强。 I2+2ClO3- 2IO3-+Cl2
杨勤
2009/6/9
卤素
HF的制备
CaF2+H2SO4 (浓)= CaSO4+2HF(g) 因为氟与氢直接反应过于激烈,不易控制,并且
氟的制备又很困难,所以不用直接合成法制HF。
2009/6/9
卤素
杨勤
碘的制法
(1)海水提碘: Cl2+2I- = I2+2Cl注意氯气不能过量 5Cl2+I2+6H2O=2HIO3+10HCl (2)从碘酸钠中提碘: 2IO3-+5HSO3-=2SO42-+3HSO4-+H2O+I2 (3)实验室制碘:
2NaI+3H2SO4+MnO2
2NaHSO4 +MnSO4+2H2O+I2
2009/6/9
卤素
杨勤
溴的制备
(1)海水提溴:
通入氯气:
卤素
1/2X2 + e- ─→ X故卤素单质最突出的化学性质是氧化性。除I2外,均为强氧化剂。从标准 电极电势(X2/X-)可以看出,F2是卤素单质中最强的氧化剂。随着X原子半
径的增大,卤素的氧化能力依次减弱:
F2 > C12 > Br2 > I2
2 卤素单质
(1) 与金属作用
2.3 卤素单质化学性质
Cl2
Br2
不如氯
I2
高温
缓慢,可逆
2 卤素单质
(4) 与水的反应
2.3 卤素单质化学性质
卤素与水可发生两类反应。 第一类:卤素对水的氧化作用: 2X2 + 2H2O ─→ 4HX + O2↑ 第二类:卤素的水解,即卤素的歧化反应(自身氧化还原): X2 + H2O ─→ H+ + X- + HXO F2无此反应 卤素对水的氧化作用由两个电极反应组成:
ns 2np 5
-1, +1, +3, +5, +7 189.1 148.9
溶解度/g/100mgH2O
原子半径/pm X-离子半径/pm
分解水
71 136
0.732
99 181
3.58
114 195
0.029
133 216
第一电离能/kJ· -1 mol
第一电子亲合能/kJ· mol 电负性 (Pauling)
或还原碘酸盐
2NaIO3 + 5NaHSO3 = 2Na2SO4 + 3NaHSO4 + H2O + I2
4 卤化氢和氢卤酸
4.1 卤化氢的制备方法
(1)直接合成法
H2 + X2 = 2HX (2)复分解法 如 卤化物+高沸点酸 2MX + H2SO4 = M2SO4 + 2HX
无机化学考研辅导3

无机化学考研辅导(下)第五讲卤素一、卤素单质的通性1、分子结构和性质元素的价电子构型为ns2np5,易得一个电子形成全满结构,单质均为双原子分子。
最显著的性质是气态的F2、Cl2、Br2、I2的颜色变化,从近无色→紫色,分子最大吸收渐向长波方向移动。
说明双原子MO中最高充满的σ和π*至最低未满的空的σ*轨道之间能量差自上而下减小。
另外,卤素分子的离解能从F2到I2分别为159kj·mol-1,243kJ·mol-1,193kJ·mol-1和151kJ·mol-1。
.除F2外,随着离子半径的增加,键渐弱,因而离解能渐低。
2、反应活性(1)卤素标准电极电势:I2+2e-=2I- φ=0.52VBr2+2e-=2Br- φ=1.06VCl2+2e-=2Cl- φ=1.36VF2+2e-=2F- φ=2.87V氧化能力:F2>Cl2>Br2>I2(还原能力:I->Br->Cl->F-)(2)所以F2,Cl2可与所有金属作用,F2还能与稀有气体作用:形成XeF2,XeF4,XeOF4等化合物。
Br2,I2可与除贵金属外的所有金属作用。
(3)卤素与水作用发生下述两类反应1X2+H2O→2H++2X-+1/2O2F2极易发生此反应,日光下Cl2反应慢,Br2,I2无明显反应。
2X2+H2O→H++X-+HOX X2+2OH-→XO-+X-+H2O第 2类反应即为卤素特征的OX-Re反应即歧化反应。
在酸性条件下,卤素歧化反应不易发生,如Cl2的K=4.0×10-4;而在碱性条件下,歧化极易进行,且XO-还可继续歧化(3XO-→2X-+XO3-)。
Cl2在70摄氏度,Br2在室温,I2在0℃即可发生上述反应。
所以室温下将Cl2,Br2,I2分别加入碱中生成的是ClO-,BrO3-和IO3-。
3、单质制备(1)F21工业制备:电解KHF2与HF混合液阳极(石墨):2F-=F2↑+2e-阴极(电解槽):2HF2-+2e-=H2↑ +4F-电解总反应:2KHF2=2KF+H2↑+F2↑2实验室制法:BrF5(g)=BrF3(g)+F2(g)1986年:4KMnO4+4KF+20HF→4K2MnF6+3O2+10H2O2K2MnF6+4SbF5=4KSbF6+F2↑+2MnF3(2)Cl21工业制备:电解NaCl水溶液2实验室制法:MnO2+HCl(浓)= KMnO4+HCl(浓)=(3)Br21工业制法:海水制Br2。
卤素

常温 强光照射
Br2
常温 600C
I2
高温
爆炸、放出大量热
缓慢
爆炸
不如氯 明显
减 小
缓慢
10.2.1.3 与H2O反应
卤素与水可发生两类反应,分别是氧化作用和歧化作用:
(1)氧化作用 2X2 + 2H2O
4HX + O2↑
(2)歧化水解 X2 + H2O
H+ + X- + HXO
F2的氧化性强,只能与水发生第一类反应,且反应激烈:
主要氧化数
氟(F) 氯(Cl) 溴(Br) 碘(I)
9
17
35
53
2s22p5 3s23p5
4s24p5 5s25p5
64
99
114
133
4.0
3.0
2.8
2.5
1681 125非1 金属性1减140弱 1008
-1、0
-1、0
-1、0
-1、0 +1、+3 +5、+1、+3 +5、 +1、+3
+7
+7
力依次减弱:F2 > Cl2 > Br2 > I2
电极电势: F2/F-
Eθ (X2/X-) 2.87
Cl2/Cl1.36
Br2/Br- I2/I1.065 0.535
10.2.1.1 与金属、非金属反应
卤素
反应物质
所有金属
F2
除氮、氧外的非金属
Cl2 Br2 、I2
与上类似
活泼金属 其他金属
反应程度
10.3.2.2 还原性
卤素的通性6

04.04.2021
11
补:Na+、K+、Mg2+是产生咸味的主要阳离 子,阴离子则影响咸味强弱,CI为主。
NaCI纯咸味,KCI、MgCI2、MgSO4苦味 依次增强。
1.X2的物理性质 2.X2的化学性质 3.X2的制备和用途
浓溶液(5-15mol·dm-3)为
强F - 酸+ H F H F 2 -( 2 ) 破坏了(1)的平
衡
04.04.2021
38
氢卤酸(HF除外)酸性增强的解释 HCI HBr HI
X-半径,X-电子云密度,H-X引力,H-X解离能力,酸性。
(2)热稳定性 2HX→H2+X2 HF HCI HBr HI
04.04.2021
8
一、卤素的成键特征 二、卤素在自然界的分布 *三、卤素单质 *四、卤化氢和氢卤酸 五、卤化物和卤素互化物 六、卤素的氧化物 *七、卤素的含氧酸及其盐 八、拟卤素和拟卤化物
04.04.2021
9
1、X-X CI2 非极性共价键(共用电子对) 2、X(-1) NaX 离子键
HX 极性共价键 [CuX4]2- 配位键 3、F(0,-1);CI、Br、I(-1,0,+1,+3,+5,+7)
ψ(O2/H2O)=0.816V(PH=7) E=ψ(X2/X-)-0.816
F2 CI2 Br2 I2(不反应) E(V) 2.05 0.54 0.25 <0 (4HI+O2=2I2+2H2O)
04.04.2021
26
( B ) X 2 + 2 H 2 O H + + X - + H X O 歧化反应
2010.3卤素的通性,单质和卤化氢
显色的原因是分子中的 π*电子向 σ*轨道跃迁的 结果。 激发能:ΔE=Eσnp*-Eπnp*=hν(电子跃迁)
F 的反常特性:①电负性最大 ,F 的非金属性很强;②电子亲合能反而比氯还 小;原因:F 的半径最小,核外电子云的密度较大,当它接受一个外来的电子形 成负离子时,电子间斥力将增大,致使放出的 能量减少。 二、卤素的存在
F:卤素单质具有很高的化学活性,在自然界中均以化合物 形式存在,自然界中 不存在游离状态的氟。重要的矿物有萤石(CaF2)、冰晶石(Na3AlF6)、氟磷灰石 C a5F(PO4)3,在地壳中的质量百分含 量约 0.065%,占第十五位 。氟的天然同位素 只有氟19。
2
卤素 φ a ClO4- 1.19V ClO3- 1.21V HClO2 1.64V HClO 1.63V Cl2 1.36V Cl1.47V
BrO4-1.76V BrO3- 1.49V HBrO 1.59V Br2 1.08V Br1.51V
H5IO6 1.7V HIO3 1.14V HIO 1.45V I2 0.54V I1.20V
为奇数族元素的奇氧 化态稳定。
2、卤素的原子结构与卤素的非金属性 ⑴、相似性:*原子结构:最外层电子 数均为 7,易得电子而 达到 8 电子 稳定结 构;*化学性质:活泼的非金属元素(非金属性强 的元素)。
卤素

2011-12-12
2
P区元素的特点
(1)同族元素从上到下,其原子半径、 )同族元素从上到下,其原子半径、 金属性逐渐增强 区元素( (2) p区元素(零族除外) 原子价层 ) 区元素 零族除外) 电子构型: 电子构型:ns2 np1~5,具有较多的 氧化数( 除外 除外) 氧化数(F除外) (3)同一族元素自上而下低氧化态化合 ) 物的稳定性增强, 物的稳定性增强,高氧化数化合 物稳定性减弱。 物稳定性减弱。即“惰性电子对 效应” 效应”
卤素的原子半径随原子序数增加而依次增大
与同周期元素相比较,卤素的原子半径最小 卤素都有比较大的电负性 氟的电负性最大,因此氟具有最强的氧化性
2011-12-12 6
元素符号
价电子层结构
F
2s22p5 –1,0 322 155 3.96
Cl
3s23p5 – 1,0,+1,+3, +5,+7 348.7 240 3.16
2011-12-12 3
(4)同一族元素中,第一个元素原子半径 )同一族元素中, 最小、电负性最大, 最小、电负性最大,与同族其它元素 相比化学性质有较大差别 区元素电负性较s区大 (5)p区元素电负性较 区大,多以共价键 ) 区元素电负性较 区大, 结合
如非金属元素氧化物、氢化物( 如非金属元素氧化物、氢化物(除In、Tl外) 、 外
防止F2和H2相互混合爆炸,电解槽中需特制的合金隔膜 将两者严格分开。
2011-12-12
17
氯 工业 电解饱和NaCl水溶液,两极间以石棉作为隔膜
材料,溶液中阴极区为碱性 电解反应: 阳极(石墨) 2ClCl2 + 2eH2 + 2OH-
阴极(铁网) 2H2O + 2e电解反应方程式: 2NaCl +2H2O 实验室 MnO2 +4HCl(浓)
第一讲 卤素

浓盐酸 37%,密度1.19g· cm-3 工业盐酸 30%,呈黄色(含[FeCl4]-)
HCl 2) 还原性 KMnO4 浓 Mn2 Cl2
HCl MnO2 浓 Mn2 Cl2 HCl K2Cr2O7 浓 Cr 3 Cl2 HCl PbO2 浓 Pb2 Cl2 3) 配位性 Fe3 4Cl [FeCl4 ] Ag 2Cl [AgCl2 ]
3.卤化氢的性质递变规律
熔点、沸点 核间距 键能 极性 热稳定性 酸性
HF HCl HBr HI
HF HCl HBr HI
HF HCl HBr HI
HF HCl HBr HI HF HCl HBr HI HF HCl HBr HI
HF 1)分子间存在氢键,溶沸点、气化热反常
F H F 2)弱酸 H F H F H F
H
HF
H F
3)腐蚀性 SiO 2 4HF SiF4 2H2O
CaSiO 3 6HF CaF2 3H2O SiF4
HF腐蚀玻璃,通常用塑料容器储存。
HCl 1)强酸性
卤化物的键型及性质的递变规律: ◆同一周期:从左到右,阳离子电荷数增大,离 子半径减小,离子型向共价型过渡,熔沸点下降。
例如: NaCl b.p./℃ 1465 MgCl2 1412 AlCl3 SiCl4 181(升华) 57.6
◆同一金属不同卤素:AlX3 随着X-半径的增大,
极化率增大,共价成分增多。
例如: 离子键 AlF3 b.p./℃ 1272 熔沸点降低。 例如: m.p./℃ AlCl3 181 NaF 996 共 价 型 AlBr3 AlI3 253 382 NaCl 801 NaBr 755 NaI 660
卤族

HF + H2O
H 3O + + F -
K=6.6×10-4
与其它的弱酸不同的是,在很浓的HF溶液中电离 度反而增大,这是因为:
2HF + H2O
H3O+ + HF2-
K=5
在浓的溶液中HF2-比F-多得多
因为H2F2比HF的酸性强,所以浓溶液中HF的电离 度反而增大。
②与或硅酸盐反应 SiO2+4HF=SiF4↑+2H2O CaSiO3+6HF=CaF2+SiF4↑+3H2O
为什么用 二份的无水 HF与一份的KF 的混合物或 KHF/HF?
(铱合金做电解槽)
在1986年Karl Christe 首次用化学方法合成了F2:
(1)4KMnO4+ 4KF + 20HF == 4K2MnF6 +10H2O + 3O2 ↑ (2)SbCl5 + 5HF == SbF5 + 5HCl 423K MnF4 (3)2K2MnF6+4SbF5 ==== 4KSbF6+2MnF3+F2 ↑
2、氯、溴、碘的制备
①实验室制备:
△
NaX+3H2SO4+MnO2==2NaHSO4+MnSO4+2H2O+X2
实验室还用MnO2与浓HCl或KMnO4与浓HCl反 应制备Cl2气。
②工业制备:
在工业上制Cl2气,是采取
NaCl水溶液电解法和熔盐电
解法。注意对比两种制法所 得的阴极产物。见P529)
-271 ---
188.11
-92 0.014
206.43
-36 0.5
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
14
①物理性质变化规律解释 X2为非极性分子,分子间作用力┄┄ ∴熔沸点F2→I2 依次升高。
聚集态F2(g) →CI(g)→Br2(l)→I2(g)
Br2:非金属中的唯一液体 I2:固体易升华,紫黑→粉红
2018/9/17 15
② 物质的颜色与吸收光颜色的关系
绿 黄 青
橙 红
白光
青蓝 蓝
紫
物质的颜色通常是由 于物质对可见光中某种波 长的光具有选择性吸收作 用而产生的。如左图所示, 对角线上的两种颜色为互 补色。 若各种波长的光全被 吸收,则物质呈黑色; 若全被反射,物质呈 白色或无色; 若部分选择性吸收, 则物质将呈现吸收光的互 补色。
第十二章
卤素
§12-1 卤素的通性
§12-2 卤素单质及其化合物
§12-3 含氧酸的氧化还原性
2018/9/17
1
内容提要: 卤素及其重要化合物的制备、用途和性质的递变规律,卤素 的氧化还原性。 本章要求:
1.熟悉卤素及其重要化合物的基本化学性质、结构、制备和用途, 除了掌握共性外,还要抓住它们之间的差异性。 3.熟练运用元素电势图来判断卤素及其化合物各氧化态间的转化 关系。
*
np
) (
3
*
np
)
1
随卤素原子序数的增加,核对外层电子的 引力依次减弱,激发电子所需能量依次降低。
2018/9/17
19
F2:吸收可见光中能量较高,波长较 短的那部分光,显示波长较长的那部分光 的复合颜色─黄色。 I2:主要吸收可见光中能量较低,波 长较长的那部分光,显示波长较短的那部 分光的复合颜色─紫色。 上为气态物质颜色,当物质的聚集状 态由气态→液态→固态转化时颜色会逐渐 加深。
2018/9/17 20
③卤素单质的溶解性 F2:分解水 2F2 + 2H2O = 4H+ + 4F- + O2↑ CI2:水中溶解度较小,其水溶液为氯水,显 黄绿色,主要成分CI2。 * Br2:水中溶解度稍大,其水溶液为溴水。且 易溶于有机溶剂乙醇、乙醚、 氯仿、四氯化 碳、二硫化碳等中。溶液的颜色随溴浓度的 增加而加深,由黄色→橙色→棕色。
2018/9/17 3
卤素(X)
F
CI
Br
I
原子序数
9
17 3s23p5
35 4s24p5
53 5s25p5
价电子层结构 2s22p5
主要氧化数 共价、X-1半径 电子亲和能 第一电离能 电负性 -1;0 322 1681 3.98
-1;0;+1;+3;+5;+7 逐渐增大 348.7 324.5 1251 3.16 1140 2.96
(2) 为何不用液态HF?
2018/9/17 30
F2的用途:分离同位素U235F6 ,U238F6 制有机氟化物─制冷剂、杀虫剂等
(2)CI2的制备
工业制法
电解食盐水:2NaCI(饱和)+2H2O=2NaOH+H2↑ +CI2↑ (?极)
电解熔融盐:MgCI2(熔融态)= Mg+CI2↑(副产物)
2.熟悉卤素单质和次卤酸及其盐发生歧化反应的条件和递变规律。
2018/9/17
2
1A
0
Ⅱ A
ⅢA ⅣA ⅤA ⅥA ⅦA He
H
Li Be Ⅷ Na Mg ⅢB ⅣB ⅤB ⅥB ⅦB K Ca Sc Ti V Cr Mn Fe Co Rb Sr Y Zr Nb Mo Tc Ru Rh Cs Ba La-Lu Hf Ta W Re Os Ir Fr Ra Ac-Lr Rf Db Sg Bh Hs Mt 镧系 La Ce Pr Nd Pm Sm Eu 锕系 Ac Th Pa U Np Pu Am
2018/9/17
8
一、卤素的成键特征 二、卤素在自然界的分布 *三、卤素单质 *四、卤化氢和氢卤酸 五、卤化物和卤素互化物 六、卤素的氧化物 *七、卤素的含氧酸及其盐 八、拟卤素和拟卤化物
2018/9/17 9
1、X-X CI2 非极性共价键(共用电子对) 2、X(-1) NaX 离子键 HX 极性共价键 [CuX4]2- 配位键 3、F(0,-1);CI、Br、I(-1,0,+1,+3,+5,+7) 卤素含氧化合物 HCIO,HCIO3 ,HCIO4 卤素互化物 ICI ,IF5 ,IF7
2018/9/17 29
卤素的制备:X-+氧化剂→X2 ψθ(氧化剂)? ψθ(X2/X-) [2.87,1.36,1.07,0.54] (1) F2的制备─电解氧化法
373 K) 2KHF2(无水) 电解( 2KF H 2 F2
问题 (1-(g)
放出的能量
同族元素,E一般随半径增大而减小, F半径太小,核附近电子云密度较高,当 原子结合一个电子形成负离子时,因排斥 作用使放出的能量减小。
2018/9/17
7
3.CI、Br、I的第一电离能比H(E=1312kJ· mol-1) 低,为何有H+存在却没有X+生成? 解释:H+体积小,在水溶液中生成水合离 子时可以释放出较多的热量,因而H所需的电离 能可以从这些能量中得到补偿。而X+体积较大, 在生成水合离子时释放的热量较小。因此,相 比之下,卤素原子失去电子成为+1价的离子只 有碘的可能性大些。因电负性小,原子半径大。
26
(B)X2+2H2O
F2 CI2
H +X +HXO
Br2
+
-
歧化反应
I2
K
×
4.2×10-4
7.2×10-9 2.0×10-13
加酸抑制水解,加碱促进水解。 与碱反应: F 2:
2F2+2OH-(2%)=2F-+OF2+H2O
2F2+4OH-(浓)=4F-+O2+2H2O
2018/9/17 27
2018/9/17
21
* I2:水中溶解度最小,易溶于有机溶剂及 KI或其它碘化物的溶液中。 I2 + I- = I3- (三碘离子),溶液的性质 与I2溶液相同. 碘溶液的颜色随溶剂不同而不同 A.在水、醇、不饱和烃、酮、醚、酯等介 电常数较大的极性溶剂中,因形成溶剂化物而 呈棕色或棕红色。 B.在介电常数较小的非极性或极性较低的 溶剂如:CS2、CCI4等中,溶解的碘以分子状态 存在(不发生溶剂化作用),溶液显紫色(碘 蒸气的颜色)。
颜色、聚集状态 浅黄气体 黄绿气体 棕红液体 紫黑固体
逐渐升高 微溶于水 190 149
ψ°(X2/X-1)(v)
X2的氧化性 X-1的还原性 气味、毒性
2.87
1.36
1.07
0.54
逐渐减弱 逐渐增强 强刺激性气味,有毒,毒性依次减弱
2018/9/17 13
单 质 的 熔 沸 点
2018/9/17
2018/9/17 11
补:Na+、K+、Mg2+是产生咸味的主要阳离子, 阴离子则影响咸味强弱,CI为主。
NaCI纯咸味,KCI、MgCI2、MgSO4苦味依次 增强。
1.X2的物理性质 2.X2的化学性质 3.X2的制备和用途
2018/9/17 12
卤素单质的通性
卤素单质(X2) 熔、沸点 水中溶解性 X2离解能 分解水 155 240 F2 CI2 Br2 I2
* CI2
X2+2OH-(冷)=X-+XO-+H2O 3X2+6OH-(热)=5X-+XO3-+3H2O 3I2+6OH-=5I-+IO3-+3H2O
* Br2
* I2
(3)卤素间的置换反应 CI2+2Br-=2CI-+Br2
CI2+2I-=2CI-+I2
Br2+2I-=2Br-+I2
2018/9/17 28
H 3
H 4
H 5
F2
过程总热效应
-757.5
CI2
-608.2
Br2
-559.5
I2
-493.5
△Gmθ= △Hmθ-T△Smθ,△Gmθ主要由 △Hmθ决定,所以,△Hmθ的负值越大,反应自 发进行的趋势越大,体现在氧化能力上ψθ越 大。即F2的氧化能力最强。
2018/9/17
2018/9/17
295 1008 2.66
4
X-半径
共价半径
2018/9/17
5
解释:
1.半径与性质
共价半径:
同周期X最小,得电子能力最强,
同族半径依次增大,得电子能力减弱,氧 化性降低。
X-半径: 同族依次增大,失电子能力增强,还原性 增强。
2018/9/17 6
2. 电子亲合能?
EF<ECI ?
24
思考题: ψθ(F2/F-)值很大,水溶液中 能否用F2做氧化剂? (1)与金属、非金属反应 F2 反应活性
与H2反应条件 暗处 光照 600℃
CI2
Br2
I2 减弱
高温
F2可存储于Cu、Ni、Mg或其合金制成的容 器中(稳定氟化物),通常储存在塑料瓶中。 干燥的CI2可储存于铁罐中。
2018/9/17 25
2018/9/17 18
当可见光照射到物体上时,物体所显颜色 就是未被吸收光的复合色。 卤素分子轨道能级图
2 2 (ns )( *ns )( np ) 2 ( np )4 ( *np )4 (*np )
(ns )(
激发 2
*
ns
