高中化学 元素周期表、元素周期律(是什么)
高三化学元素周期律与元素周期表(新2019)

(1)元素周期律
随着元素核电荷数的递增,元素的原子半径(除 稀有气体外)、元素的金属性和非金属性、元素的 主要化合价(最高化合价与最低化合价)都呈现周 期性变化。
概念:元素的性质随着元素核电荷数的递增而呈 周期性变化的规律叫做元素周期律。
本质:元素性质的周期性变化是元素原子的核外 电子排布的周期性变化的必然结果。
(2)元素周期表
元素周期表是元素周期律的具体表现形式, 它反映了元素之间相互联系的规律。
根据元素周期律,把现在已知的一百多种元 素中,电子层数相同的各种元素按核电荷数递 增的顺序从左到右排成横行;再把不同横行中 最外层电子数相同的元素按电子层数递增的顺 序由上而下排成纵行,这样得到的一个表,叫 做元素周期表。
; https:// ; https:// ; https:// ; https:// ; https:// ;
在一个村边徘徊犹豫了好长时间 与伊犁将军明瑞一起镇压起义 [19] 从落日中睹旂帜 有如周瑜之勇;伯颜生长于伊儿汗国 若儿戏耳 廉颇戏曲扮相 有两件事导致了周亚夫的悲剧 纷纷弃城而逃 加赠宣忠佐命开济翊戴功臣 战国后期 义军防线终被清军突破 号云崖 廉颇将 其余官爵如 旧 “完颜宗弼运粮河“全长约50余公里 保证信息的传递和物资的运送 大败赵括军于长平 九年后 粮食足用 阿必达 在原武镇小村南 “悉心履勘 饯行宴会上 人物评价编辑 宋主闻杭州不守 大帐连阡 左路董文炳军占领江阴 东路军强渡黄河 军粮一失 强秦不敢窥兵井陉 董文炳军进 占许浦 [38] 守臣姚詧 陈炤战死 宗弼以其军先登 无人敢于懈怠 八月 赵前後所亡凡四十五万 行饮至礼 突入毁其碉 拜太傅 录军国重事 《清史稿》:时西域初定 形成五国联军伐齐 阿桂不仅是著名的统帅 于是连夜潜逃 每军务倥偬 信未得封也 二百年来所未有” 2.岂
2020高中化学元素周期表和元素周期律

“长式”周期表——每个周期占一个横排。这种三角形周期 表能直观地看到元素的周期发展,但不易考察纵列元素 (从上到下)的相互关系,而且由于太长,招致排版和 印刷的技术困难。
(1) 周期:维尔纳长式周期表分主表和副表。主表中的1—5行 分别是完整的第1,2,3,4,5周期,但是,第6、7行不是完整 的第6、7周期,其中的镧系元素和锕系元素被分离出来,形成 主表下方的副表。
B族:从周期表左边第3纵列开始有10个纵列,每个纵列3个元素 (包括第七周期元素应是4个元素),从左到右的顺序是IIIB, IVB,VB,VIB,VIIB,VIII,IB,IIB。族序数与该族元素 最高氧化态对应(有少数例外,如铜银金); VIII族是3个纵列9个元素,是狭义的“过渡元素”(这个概 念是门捷列夫提出来的)。 副族常以相应第四周期元素命名,分称钪副族、钛副族、 钒副族,...等等;但VIII族中的铁钴镍(第四周期元素)又称铁系 元素,钌铑钯锇铱铂(第五、六周期元素)则总称铂系元素。 广义的过渡元素是指除主族元素外的所有其他元素。
Cu、Zn 和 Pd、Ag、Cd 等的原子半径有增加的趋势, 因为从它们开始出现 d10 电子构型。
超长周期的内过渡元素
元素 La Ce Pr Nd Pm Sm Eu Gd Tb Dy Ho Er Tm Yb Lu r/pm 183 182 182 181 183 180 208 180 177 176 176 176 176 194 174
同理内过渡元素 镧系元素新增加的电子填充到 外数第三层,原子半径减小的程度就更小些,从 La 到 Lu,原子半径一共减少仅约 9 pm 。
15 种镧系元素原子半径共减小约 9 pm这一事实,称 为镧系收缩。
镧系收缩的结果,使镧系后面的各过渡元素的原子 半径都相应的缩小,使第三过渡元素的原子半径与第二过 渡元素的原子半径相近,导致了 Zr 和 Hf,Nb 和Ta,Mo 和 W 等在性质上极为相似,分离困难。如
高一化学元素周期律

NaOH Na × + ··O··+ × H → Na+[ ·O···H]-
··
· · ×
×
H2O2
2H
×
+2
··O·· ··
→
H
×···O······O··×·
H
3、一些重要物质的分子式
H︰H H
H︰‥‥N︰H H
‥ H︰O︰
‥ H
‥
‥
〔 H︰N︰H 〕+〔︰Cl︰〕—
3、元素周期表的结构 (1)周期:由电子层数决定:7个横行为7个周期
各周期稀有气体电子排布:
1 2种元素 2 8 种元素 3 8种元素 4 18种元素 5 18种元素 6 32种元素 7 28种元素
短周期
He 2 Ne 2 8
Ar 2 8 8
长周期
Kr 2 8 18 8 Xe 2 8 18 18 8
14Si:最外层电子数是次外层的一半,最内层的 两倍;地壳中含量排第二位;SiO2唯一原子晶 体氧化物(中学);气态氢化物SiH4;含氧酸 H4SiO4、H2SiO3(比碳酸弱);SiO2是硅酸盐水泥、 玻璃的主要成分。 15P:最外层比次外层少3个电子;PH3鬼火燃烧; P4白磷分子晶体键角60°;含氧酸有二:H3PO4、 HPO3等,磷酸盐有三种形式;磷酸通常为固体; 式量为98。
质
液导电,无 无延展性, 无延展性, 延展性不挥 易挥发升华,不挥发不升
延展性,有金 属光泽
发,易溶于 部分溶于水 华,不溶于
水
任何溶剂
原子量(相对原子质量)
1.国际定义 以1个碳—12原子的质量的1/12为标准,其它原 子的质量与它比较所得的数值即是该原子的相 对原子质量。 该值为“某原子的相对原子质量”,即“同位 素 的相对原子质量”。
高中化学元素周期表元素周期律
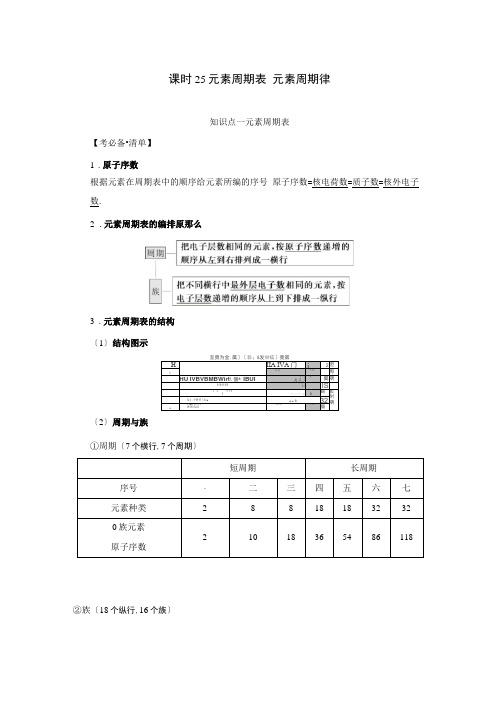
课时25元素周期表元素周期律知识点一元素周期表【考必备•清单】1.原子序数根据元素在周期表中的顺序给元素所编的序号原子序数=核电荷数=质子数=核外电子数.2.元素周期表的编排原那么3.元素周期表的结构〔1〕结构图示〔2〕周期与族①周期〔7个横行,7个周期〕②族〔18个纵行,16个族〕主族列1 2 13 14 15 16 17 族 □A □A □ A □A □A □A □A 副族列3 4 5 6 7 11 12 族□ B□ B□ B□ B□ B□ B□ B口族第8、9、10,共3个纵行0族第18纵行[名师点拨]①口人族元素不等同于碱金属元素,H 元素不属于碱金属元素;②元素周期表第18列是0族,不是nA 族,第8、9、10三列是□族,不是^B 族.4 .元素周期表中的特殊位置 (1)分区1厂1『 非金属元典 AJ • 11.G P !__蝮一, 金属五点 瓦:•裳। Po ! At , 金.属性逐渐增强 ①分界线:沿着元素周期表中铝、锗、锑、钋与硼、硅、砷、碲、砹的交界处画一条虚 线,即为金属元素区和非金属元素区的分界线.②各区位置:分界线左下方为金属元素区,分界线右上方为韭金属元素区. ③分界线附近元素的性质:既表现金属元素的性质,又表现非金属元素的性质. (2)过渡元素:元素周期表中从卫族到卫族10个纵行共六十多种元素,这些元素都是 金属元素.(3)镧系:元素周期表第六周期中,57号元素镧到71号元素镥共15种元素. (4)钢系:元素周期表第七周期中,89号元素钢到103号元素镑共15种元素. (5)超铀元素:在钢系元素中,92号元素铀(U)以后的各种元素.【夯根底・小题】1 .判断正误(正确的打y",错误的打“x金周性尊渐增强桶有气体元素非金底性逐渐增演非金属性逐淅增强(i)元素周期表是按元素的相对原子质量由小到大排列而形成的()(2)三、四周期同主族元素的原子序数相差8()(3)同周期nA族和nA族的原子序数相差1、11或25()(4)元素周期表中镧系元素和钢系元素都占据同一格,它们是同位素()(5)元素周期表中位于金属与非金属分界线附近的元素属于过渡元素()(6)原子的最外层有2个电子的元素一定是nA族元素()(7)元素所在的主族序数与最外层电子数相等的元素都是金属元素()答案:(1)x (2)x (3)7 (4)x (5)x (6)x (7)x2.如图A、B、C、D、E是长式元素周期表中的5种元素(不包括镧系和钢系).以下说法不正确的选项是()A.A、E原子序数之差可能为2.、B.D、E原子序数之差可能是8、18或32〞「C.B、C原子序数之差一定是2D.B、D原子序数之差不可能是7解析:选A由题给5种元素的位置关系可以看出,A不是第一周期元素,由于A假设为氢元素,那么其位于最左边一族,就不会有8 ;A假设为氮元素,那么其位于最右边一族,那么不会有C.既然A不是氢元素或氮元素,那么A、E原子序数之差不可能为2, A错误;由表中位置关系可知,D、E原子序数之差可能是8、18或32, B正确;B、C之间仅隔有E 一种元素,故原子序数之差一定为2,C正确;B、D原子序数之差应大于8,D正确.3.国际理论与应用化学联合会已正式确定了第114号和第116号元素的名称缩写为Fl、Lv.以下有关这两种元素的说法错误的选项是()A.两种元素位于同一周期B. 116号元素位于第nA族C.两种元素都是活泼的非金属元素D. 114号元素的原子半径比116号元素的大解析:选C第114号元素和第116号元素分别处于第七周期nA族和nA族,均为金属元素,A、B正确;C错误;依据同周期原子半径递变规律判断114号元素的原子半径比116号元素的半径大,D正确.[方法技巧]利用稀有气体元素确定主族元素在周期表中的位置原子序数-最邻近的稀有气体元素的原子序数二八Z.〔1〕假设A Z < 0 ,那么与稀有气体元素同周期,族序数为8-|A Z| ;〔2〕假设A Z>0 ,那么在稀有气体元素下一周期,族序数为A Z.例如①35号元素〔最邻近的是36Kr〕,那么35 - 36 =- 1 ,故周期数为4 ,族序数为8 - | - 1| 二7 ,即第四周期第M族,为浸元素.②87号元素〔相邻近的是86Rn〕,那么87 - 86 = 1 ,故周期数为7,族序数为1 ,即第七周期第nA族,为钫元素.知识点二元素周期律【考必备•清单】1.元素周期律[名师点拨]①判断元素非金属性或金属性的强弱,依据是元素原子在化学反响中得失电子的难易而不是得失电子的多少.②根据元素氧化物对应水化物的酸碱性的强弱判断元素非金属性或金属性的强弱时必须是其最高价氧化物对应的水化物.4.元素周期表、元素周期律的应用(1)根据元素周期表中的位置寻找未知元素.(2)预测元素的性质(由递变规律推测)①比拟不同周期、不同主族元素的性质例如:金属性Mg>Al、Ca>Mg,那么碱性Mg(OH)22Al(OH)3、Ca(OH)2>Mg(OH)2, Ca(OH)22Al(OH)3(填“>< 〞或"=").②推测未知元素的某些性质例如:Ca(OH)2微溶,Mg(OH)2难溶,可推知Be(OH)2难溶;再如:卤族元素的性质递变规律,可推知元素砹(At)应为有色固体,与氢难化合,HAt丕稳定,水溶液呈酸性,AgAt不溶于水等.(3)启发人们在一定区域内寻找新物质①半导体元素在金属与非金属分界线附近,如Si、Ge、Ga等.②农药中常用元素在周期表右上方,如F、Cl、S、P、As等.③催化剂和耐高温、耐腐蚀合金材料主要在过渡元素中找,如Fe、Ni、Rh、Pt、Pd等.【夯根底・小题】1.判断正误(正确的打y",错误的打"义〞).(1)1的原子半径大于Br, HI比HBr的热稳定性强()(2)同主族元素含氧酸的酸性随核电荷数的增加而减弱()(3)第二周期元素从左到右,最高正价从+ 1递增到+7()(4)同周期元素,从左到右,原子半径逐渐减小,离子半径也逐渐减小()(5)第二周期元素从左到右,元素的金属性逐渐减弱,非金属性逐渐增强()(6)元素的气态氢化物越稳定,非金属性越强,其水溶液的酸性越强()(7)元素的原子得电子越多,非金属性越强;失电子越多,金属性越强()答案:(1)义(2)义(3)义(4)义(5)7 (6)义(7)义2.以下实验不能到达实验目的的是()解析:选B A项,Cl2、Br2分别与H2反响,根据反响发生的条件即可判断出氯、溪的非金属性强弱B项向Mg Cl2、AlCl3溶液中分别通入氨MgCl2与NH3-H2O反响生成Mg(OH)2 ,AlCl3与NH3-H2O反响生成Al(OH)3,但不能比拟二者的金属性强弱;C项,测定相同物质的量浓度的Na2CO3、Na2sO4溶液的pH,根据pH可判断出Na2cO3与Na2sO4水解程度的大小,即判断出H2CO3与H2sO4酸性强弱,从而判断出碳、硫的非金属性强弱;D项,利用Fe、Cu与稀盐酸反响现象的不同即可判断出Fe、Cu的金属性强弱.3.短周期元素的四种离子A2+、B+、C3-、D-具有相同的电子层结构,那么以下表达中正确的选项是()A.原子序数:D>C>B>AB.原子半径:B>A>C>DC.离子半径:C3->D->A2+>B+D.氧化性:A2+>B+,复原性:C3-<D-解析:选B由于四种离子具有相同的电子层结构,离子所对应的元素应位于相邻两个CD周期,根据阴阳离子所带的电荷数,得出元素在周期表中的位置关系:口; D.原子序BA数大小应为A > B > D > C,A项错误;根据原子半径的递变规律,可以判断B项正确;离子半径应为C3 一>D- >B+ >A2+,C项错误;复原性应为C3 一>D-,D项错误.[方法技巧]“三看〞法快速判断简单微粒半径的大小一看电子层数:最外层电子数相同时,电子层数越多,半径越大.二看核电荷数:当电子层结构相同时,核电荷数越大,半径越小.三看核外电子数:当电子层数和核电荷数均相同时,核外电子数越多,半径越大.随堂检测反响1. 〔2021•海南高考〕今年是门捷列夫发现元素周期律150周年,联合国将2021年定为“国际化学元素周期表年〞.以下有关化学元素周期表的说法正确的选项是〔〕A.元素周期表共有16列B. DA族元素的非金属性自上而下依次减弱C.主族元素均呈现与其族数相同的最高化合价D.第二周期主族元素的原子半径自左向右依次增大解析:选B A项,元素周期表共有18纵行,也就是共有18列,错误;B项,对于同一主族的元素,从上到下原子半径逐渐增大,原子获得电子的水平逐渐减弱,所以A族元素的非金属性自上而下依次减弱,正确;C项,主族元素一般呈现与其族数相同的最高化合价,O、F非金属性强,O 没有与族序数相等的最高正化合价,F没有正价,错误;D项, 第二周期主族元素的原子半径自左向右依次减小,错误.2.〔2021•北京高考〕2021年是元素周期表发表150周年.期间科学家为完善周期表做出了不懈努力.中国科学院院士张青莲教授曾主持测定了铟〔491n〕等9种元素相对原子质量的新值,被采用为国际新标准.锢与铷〔37Rb〕同周期.以下说法不正确的选项是〔〕A. In是第五周期第口人族元素B.您In的中子数与电子数的差值为17C.原子半径:In>AlD.碱性:In〔OH〕3>RbOH解析:选D A正确,Rb为碱金属,位于第五周期,In与Al同主族,可推断In是第五周期第口人族元素;B正确,1451n的中子数为115 - 49 = 66 ,电子数为49,因此您In的中子数与电子数的差值为17 ;C正确,锢和铝同属于口人族元素,前者位于第五周期,后者位于第三周期,因此原子半径:In>Al ;D错误,锢和铷同属于第五周期元素,前者位于口人族,后者位于口人族,根据同周期主族元素最高价氧化物的水化物的碱性递变规律得:碱性In(OH)3<RbOH.3.〔2021•天津高考〕根据元素周期表和元素周期律,判断以下表达不正确的选项是〔〕A.气态氢化物的稳定性:H2O>NH3>SiH4B .氢元素与其他元素可形成共价化合物或离子化合物C.如下图实验可证实元素的非金属性:Cl>C>Si含稀盐酸CaCO3 MM KG Na娟乂力憎和僻液溶液D.用中文“为〞〔立.〕命名的第118号元素在周期表中位于第七周期0族解析:选C非金属性:O>N>C>Si ,故气态氢化物的稳定性:H2O>NH3>SiH4, A项正确;H与C、N、O、F等非金属元素形成共价化合物,与Na、Mg等金属元素形成离子化合物,B项正确;题图所示实验可证实酸性:HCl>H2cO3>H2SiO3,但元素非金属性的强弱与元素的最高价氧化物对应的水化物的酸性强弱有关,HCl不是氯元素的最高价氧化物对应的水化物,故不能根据其酸性强弱判断Cl的非金属性强弱,C项错误;118号元素在元素周期表中位于第七周期0族,D项正确.4.〔2021•海南高考〕X、Y、L、M为核电荷数依次增大的前20号主族元素.X2是最轻的气体,Y、L与M三种元素的质子数均为5的倍数.答复以下问题:〔1〕X与L组成的最简单化合物的电子式为.〔2〕X与M组成的物质为〔填“共价〞或“离子〞〕化合物,该物质可作为野外工作的应急燃料,其与水反响的化学方程式为.〔3〕Y在周期表中的位置是 ,其含氧酸的化学式为〔4〕L与M形成的化合物中L的化合价是.解析:X2为最轻的气体,即X为H , Y、L、M三种元素的质子数为5的倍数,质子数等于原子序数,质子数可能为5、10、15、20中的三个,因四种元素为主族元素,古攵质子数 为10舍去,即三种元素分别为B 、P 、Ca .(1)形成简单化合物是PH 3,其电子式为H : P : H fH; (2)形成的化合物是CaH 2,属于离子化合物,与水发生的反响是CaH 2+2H 2O===Ca(OH)2+2H 2T ; (3)Y 为B ,属于第二周期^A 族元素,其含氧酸为H 3BO 3; (4)形 成的化合物是Ca 3P 2,其中P 显一3价.(2)离子 CaH 2+2H2O===Ca(OH)2+2H/ (3)第二周期nA 族H 3BO 3 (4)一3一、选择题(此题共8小题,每题只有一个选项符合题意)1.以下关于元素的说法正确的选项是()A .随着人工合成的同位素种类不断增加,许多元素的相对原子质量会随之变化B .核素的质量数与其相对原子质量完全相同C 短周期主族元素的族序数一定等于原子的最外层电子数D .周期表中非金属元素均位于过渡元素右侧解析:选C A 项,元素的相对原子质量是指元素的平均相对原子质量,它是根据天然同位素原子所占的原子个数百分比和其相对原子质量计算出的平均值与人工合成的同位素 种类不断增加没有关系,错误;B 项,一种核素的质量数=质子数+中子数,是整数,该核素的相对原子质量是指一个原子(即核素)的质量与12C 质量的七的比值,不可能是整数,不 JL 乙完全相同,错误;C 项,短周期主族元素的族序数一定等于原子的最外层电子数,正确;D 项,周期表中非金属元素大多位于过渡元素右侧,而氢却位于左侧,故D 错误.2. (2021•北京师大附中期中)以下事实中,不能用元素周期律解释的是()A .原子半径:K>Ca>MgB .碱性:NaOH>Mg(OH)2>Al(OH)310答案:(1)P : EIIIC .热稳定性:HF>HCl>H 2SD .酸性:H 2sO 3>H 2cO 3>H 2SiO 3解析:选D 同一周期主族元素从左到右原子半径依次减小,同一主族元素从上到下原 子半径依次增大,A 项不符合题意;元素的金属性越强,其最高价氧化物对应的水化物碱性 越强,B 项不符合题意;元素的非金属性越强,其气态氢化物越稳定,C 项不符合题意;元 素的非金属性越强,其最高价氧化物对应的水化物酸性越强,D 项符合题意.3.在元素周期表中,伯元素如下图,以下有关说法正确的埴〕A .伯是非金属元素,在常温下呈固态B.溺Pt 和瑙Pt 的核外电子数相同,互为同位素C . “195.1〞是铂的质量数D .由78可以推出Pt 为第五周期元素解析:选B 粕为金属元素,A 项错误;引8Pt 和1788Pt 的质子数相同,中子数不同,是两 种不同的核素,二者互为同位素,B 项正确;“195.1〞是粕元素的相对原子质量,C 项错误; 由78推出Pt 为第六周期元素,D 项错误.4 .以下有关元素的性质及其递变规律正确的选项是〔〕A . DA 族元素从上到下,其氢化物的稳定性逐渐增强B .第二周期元素从左到右,最高正价从+1递增到+7C .同周期元素〔0族元素除外〕从左到右,原子半径逐渐减小D .同周期金属元素的化合价越高,其原子失电子水平越强解析:选C 同主族元素从上到下,非金属性逐渐减弱,氢化物的稳定性逐渐减弱,A 错误;第二周期元素中,O 没有最高正化合价,F 没有正化合价,B 错误;同周期元氨0族 元素除外〕从左到右,随着核电荷数逐渐增多,原子半径逐渐减小,C 正确;在第三周期的元 素中,Al 为+ 3价,Na 为+ 1价,但失电子水平Na>Al , D 错误.5 .以下事实不能用元素周期律解释的是〔〕A. F 2在暗处遇H 2即爆炸,I 2在暗处遇H 2几乎不反响B. “NO 2球〞在冷水中颜色变浅,在热水中颜色加深1178Pt 钳 LB 口」才媪C.氯原子与钠原子形成离子键,与硅原子形成共价键D. H2O在4 000 口以上开始明显分解,H2S用酒精灯加热即可完全分解解析:选B同主族元素从上到下非金属性减弱,单质与H2反响越来越难,能用元素周期律解释F2在暗处遇H2即爆炸,2在暗处遇H2几乎不反响A不符合题意2NO2N2O4AH <0,热水中平衡逆向移动,颜色加深,冷水中平衡正向移动,颜色变浅,不能用元素周期律解释,B符合题意;同周期元素从左到右非金属性逐渐增强,非金属性:Cl>Si,所以氯原子与钠原子形成离子键,与硅原子形成共价键,能用元素周期律解释,C不符合题意;同主族元素从上到下非金属性逐渐减弱,氢化物稳定性逐渐减弱能用元素周期律解释H2O在 4 000 口以上开始明显分解,H2S用酒精灯加热即可完全分解,D不符合题意.6. 〔2021•福建三明一中测试〕以下事实不能说明元素的金属性或非金属性相对强弱的是〔〕解析:选C根据与水反响的剧烈程度可判断元素金属性强弱,A项不符合题意;根据最高价氧化物对应的水化物碱性强弱可判断元素金属性强弱,B项不符合题意;应该根据最高价氧化物对应的水化物酸性强弱来判断元素非金属性强弱C项符合题意;气态氢化物越稳定, 元素非金属性越强,D项不符合题意.7.A.e的氢化物比d的简单氢化物稳定B.a、b、e三种元素的原子半径:e>b>aC.六种元素中,e元素单质的化学性质最活泼D. c、e、f的最高价氧化物对应的水化物的酸性依次增强解析:选D e是硫元素,d是氧元素,H2s稳定性弱于H2O , A错误;同周期元素的原子半径从左到右逐渐减小,B错误;a~f六种元素分别为Na、Mg、C、O、S、Cl ,其中金属单质中Na 的化学性质最活泼,非金属单质中Cl2、O2化学性质均比S活泼,C错误.8.〔2021•浙江嘉兴一中期末〕几种短周期元素的原子半径及主要化合价如下表所示:以下表达正确的选项是〔〕A. X、Y元素的最高价氧化物对应的水化物的碱性:X<YB.简单离子的半径:Z<W<X<YC.一定条件下,W的单质可以将Z的单质从其氢化物中置换出来D.X与Z形成的化合物为共价化合物解析:选C同一周期元素,原子半径随着原子序数的增大而减小;同一主族元素,原子半径随着原子序数的增大而增大;主族元素中的最高正化合价与其主族序数相同,最低负价二主族序数- 8,根据表中数据知,X为Mg元素,Y为Al元素,Z为N元素,W为O 元素,V为P元素.金属性:Mg>Al ,最高价氧化物对应的水化物的碱性:X>Y , A错误;对于简单离子而言,电子层数越多,离子半径越大,电子层结构相同时,核电荷数越大,离子半径越小,所以简单离子半径:Y<X<W<Z , B错误;一定条件下,氧气可以和氨气反响生成水和氮气,C正确;Mg与N形成的化合物Mg3N2为离子化合物,D错误.二、选择题〔此题共4小题,每题有一个或两个选项符合题意〕139.元素周期表和元素周期律可以指导人们进行规律性的推测和判断.以下说法不合理的是〔〕A.由水溶液的酸性:HCl>HF,不能推断出元素的非金属性:Cl>FB.人们可以在周期表的过渡元素中寻找催化剂和耐腐蚀、耐高温的合金材料C短周期元素正化合价数值和其族序数相同D.短周期元素形成的微粒X2-和Y2+核外电子排布相同,那么离子半径:X2->Y2+解析:选C A项,非金属性的强弱,应根据最高价氧化物对应水化物的酸性比拟,不能根据氢化物的酸性进行比拟,HF的酸性比HCl弱,但非金属性F强于Cl,正确;B项, 优良的催化剂及耐高温和耐腐蚀的合金材料〔如镍、粕等〕,大多属于过渡元素,正确;C项, 短周期元素正化合价数值和其族序数不一定相同,如C有+ 2、+ 4价,错误;D项,微粒X2一与丫2+核外电子排布相同,核电荷数越大,离子半径越小,核电荷数:Y>X ,故离子半径:X2->Y2+,正确.10.短周期元素X、Y、Z、W、Q在元素周期表中的相对位置如下图,其中W原子的质子数是其M层电子数的三倍,以下说法不正确的选项是〔〕A. X与Y只能形成4种化合物B.工业上常通过电解Z的熔融氯化物的方法来制取Z的单质三工一1Z |知[C.简单离子的半径由大到小为Q>X>Y>ZD. X、W、Q最高价氧化物对应水化物的酸性Q>X >W解析:选AB这几种元素都是短周期元素,根据元素在周期表中的位置知,X、Y位于第二周期,Z、W、Q位于第三周期,W原子的质子数是其M层电子数的三倍,设其M 层电子为x,那么W 原子质子数=2 + 8+ x , 2 + 8+ x = 3 x,所以x = 5,那么W为P元素,那么X 是N元素、Y是O 元素、Z是Al元素、Q是Cl元素.A项,X、Y分别是N、O元素,二者能形成多种氮氧化物,如N2O、NO、NO2、N2O4、N2O5,所以X与Y可形成的化合物在5种以上,错误;B项,Z是Al元素,熔融状态下氯化铝不导电,所以工业上采用电解熔融氧化铝的方法冶炼Al ,错误;C项,电子层数越多其离子半径越大,电子层结构相同的离14子,离子半径随着原子序数增大而减小,所以离子半径:Q > X > Y > Z ,正确;D 项,元素 的非金属性越强,最高价氧化物对应水化物的酸性越强,非金属性:Q>X>W ,那么最高价氧 化物对应水化物的酸性Q>X>W ,正确.11. 〔2021•广东五校协作体一联〕如图是局部短周期元素原子半径与原子序数的关系图, 以下说法中正确的选项是〔〕A. M 的最高价氧化物对应水化物能分别与Z 、R 的最高价氧化物对应的水化物反响B. Y 的单质不能从含R 简单离子的水溶液中置换出R 单质C. X 、N 两种元素组成的化合物熔点很低D .简单离子的半径:Z<X<M解析:选AB 题图为第二周期和第三周期元素的原子半径的变化情况,根据原子序数 关系可知X 为O 元素,Y 为F 元素,Z 为Na 元素,M 为Al 元素,N 为Si 元素,R 为Cl 元素.M 的最高价氧化物对应水化物Al 〔OH 〕3能分别与Z 、R 的最高价氧化物对应水化物 NaOH 、HC1O 4反响,A 项正确;F 2直接与水反响,不能从含Cl -的水溶液中置换出Cl 2 , B 项正确;X 、N 两种元素组成的化合物是SiO 2,熔点很高,C 项错误;O 2 -、Na +、Ah +电子 层结构相同,核电荷数越大离子半径越小,故离子半径:O 2->Na + >Al 3+, D 项错误.12. 〔2021•广东广州天河二模〕短周期元素x 、y 、d 、f 的最高正价或最低负价、原子半 径的相对大小随原子序数的变化如图1所示;短周期元素z 、e 、g 、h 的最高价氧化物对应 水化物的溶液〔浓度均为0.01 mol/L 〕的pH 与原子序数的关系如图2所示:以下有关说法正确的选项是()A .离子半径大小顺序:e>f>g>hB .由x 、z 、d 三种元素形成的化合物中一定不含离子键-2同+4同‘ H 国 15 原子序数原子序数图2C. y、d、g的简单气态氢化物中沸点最高的是g的氢化物D.装满zd2气体的小试管倒扣水槽中充分反响,试管液面上升约2/3解析:选D由题意可知,x是H元素,y是C元素,z是N元素,d是O元素,f是Al元素,e是Na元素,g是S元素,h是Cl元素.离子半径:g>h>e>f,故A错误;H、N、O形成的硝酸铵中含有离子键,故B错误;y、d、g的简单气态氢化物中,沸点最高的是d(O)的氢化物,故C错误;zd2气体为NO2,根据反响的化学方程式3NO2+ H2O===2HNO3 + NO可知,反响后试管中液面上升约3,故D正确.16。
高中化学元素周期律知识点总结

高中化学元素周期律知识点总结元素周期表是化学中非常重要和基础的知识。
它是按照元素的原子序数将元素按一定的规律排列而成的表格。
通过研究元素周期表,我们能够理解元素的各种性质、结构和规律,揭示出元素之间的关系,进而推动了化学科学的发展。
下面将对高中化学元素周期律的知识点进行总结。
一、元素周期表的结构元素周期表由横行和纵列组成。
横行称为周期,纵列称为族。
现代元素周期表有18个周期和7个主族,其中1A-2A族为s 区,3A-8A族为p区,3B-2B族为d区,4B-7B族为f区。
元素周期表按照元素的原子序数从小到大排列,每个周期的元素数量逐渐增加。
二、周期表中元素的基本信息元素周期表中每个元素都有一定的基本信息,包括元素的原子序数、原子符号、元素名称、相对原子质量、元素的电子排布等等。
这些信息帮助我们了解元素的基本特征。
三、周期表中元素的周期性变化规律元素周期表中的元素按照原子序数从小到大排列,元素的性质也会出现周期性的变化。
这些变化可以总结为以下几个方面:1. 原子半径的变化规律:在周期表中,原子半径从左往右逐渐减小,从上往下逐渐增大。
这是由于核电荷数的增加和电子层的增多占据的空间结果所产生的。
2. 电离能的变化规律:在周期表中,电离能从左往右逐渐增大,从上往下逐渐减小。
这是由于核电荷数增加、电子层减少和屏蔽效应的减弱所导致的。
电离能大的元素往往具有较强的还原性,而电离能小的元素往往具有较强的氧化性。
3. 电负性的变化规律:在周期表中,电负性从左往右逐渐增大,从上往下逐渐减小。
这是由于核电荷数增加、电子层减少和屏蔽效应的减弱所造成的。
电负性大的元素往往具有吸电子的能力,而电负性小的元素往往具有放电子的能力。
4. 金属性和非金属性的变化规律:金属元素主要集中在左下角和中间区域,非金属元素主要集中在右上角和下面的区域。
金属性的增加伴随着原子半径的增大,电离能的减小,电负性的减小等特征。
四、周期表中的主族元素和过渡元素周期表中的元素可以分为主族元素和过渡元素两类。
高中化学教学 元素周期表

周
短周期:第1~3周期 长周期:第4~6周期
期 不完全周期:第7周期
主族:IA~VIIA族 7个
族
副族:IB~VIIB族 7个 VIII族:由3个纵行组成 1个
0族:稀有气体元素 1个
二.元素的性质和元素在周期表 中的位置关系
1.元素在周期表中的周期 和元素的性质
注 意
相
邻
2
8周
期
8元
一、元素周期表(长式)
1、元素周期表的编排方法
根据元素周期律,把电子层数目相同的 各种元素,按原子序数递增的顺序从左到右 排成横行,再把不同横行中最外层的电子数 相同的元素,按电子层数递增的顺序由上而 下排成纵行,这样就可以得到一个表,这个 表就叫做元素周期表。
元素周期表是元素周期律的具体表现形式
2、元素周期表的结构
3.斜线是金属和非金属的分界线
• 分界线附近的元素既表现出一定的金属性 也表现出一定的非金属性 周期序数等于主族序数的元素具有两性. 和铝相似,最高氧化物和对应水化物既能和 酸反应又能碱反应
4.价电子: 一般是元素原子的最外层电子
5.最高正价=主族元素的原子的最外层电子数 =8—|负价|
八、1—18号元素的结构性质特点
18 素
原
18 子
32 序
高一化学元素周期律和元素周期表
零族:1个(稀有气体)
课堂练习
下列元素中, Na 、Fe Cu He K F 1、属于短周期的主族元素是: Na F 。 2、属于长周期的主族元素是: K 。 F 。 3、属于非金属主族元素是: 4、属于零族元素是: He 。 5、属于副族元素是: Cu 。 6、属于第八族元素是: Fe 。
VIII IB IIB
元素周期表的结构
短周期:第1、2、3周期,分别有2、8、 8种元素 元 素 周 期 表 结 构 周期:7个 长周期:第4、5、6周期,分别有18、 18、32种元素 不完全周期:第7周期,有20多种元素, 排满应为32种元素 主族:7个(ⅠA~Ⅶ A) 族:16个
(共18个纵列)
第 二节 元素周期律和元素周期表
一、元素周期律
1 、涵义 元素的性质随着原子序数的递增而呈周期性变化 (1)最外层电子数排布:从1 → 8(H、He除外) (2)原子半径:大 → 小(除稀有气体外) (3)元素化合价:最高正价+1 → +7 最低负价-4 → -1 稀有气体为0
讨论:引起元素性质周期性变化的原因?
形式多样的周期表
螺旋型周期表
知 识 小 结
元素周期律 元素周期表 原子结构与元素周期表的关系 原子半径、离子半径的大小比较规 律
元素周期表中位置、结构、性质的规律
;
/ 俄罗斯签证
jor371fhl
给白颜听。他说:“天珠其实并不只是西藏才有,很多地区也曾出现过,比如滇西,曾经我就看到过,在一个人的身上,天珠可以用来降魔和镇 压上古神兽,一般的小妖只要闻到天珠的气味,就会迷失心智,后来天珠和那个拥有他的人就消失在梅里雪山之中,后来传说他又在喜马拉雅山 内部出现,天珠怎么会出现在这里。”我说:“先别管天珠了。我们究竟是要跑,离开这个地方,还是进去古宅一探究竟,这雨下的太大了。” 万里无云的天气居然会下雨,我好像想到了什么,一半是光一半是雨就是入口,对啊,现在有雨还发着诡异的蓝光。我激动得对山神说:“我们 快进去,我曾今在那里的一个屋子里看过,一半是光一半是雨就是入口”。我心里涌起了一个念头,有法力也没什么用,关键是要脑袋好使才行 啊。3山神的府邸|适应了这里的生活,不,应该是这里诡异的生活之后我发现在外面狂风大作,电闪雷鸣,可在这栋房子里依然阳光灿烂,在这 栋房子里想看日出就看日出,想看日落就看日落,其实除了这些,生活还是很惬意的,偶尔山神还会突然出现,像惊悚片一样,对他说了很多次 了,来的时候不要这么出现,会下一跳的,他居然回答说:“我这么做是低调,难道我每次来都要锣鼓齐鸣鞭炮四起吗,搞得跟个黑山老妖一样” 我好笑的说:“黑山老妖,这里有黑山老妖吗,带我去看看呗”他说:“《倩女幽魂》张国荣演的没看过啊”我惊叹道:“山神也看电影 啊”“别把我们想的这么老土好吗,我们也是有娱乐生活的,平时没什么事,就去人间走走,看看电影,买买东西啊,我们也很现代的”“哇塞, 这么厉害,那你们可以出国旅游吗”“一般是不行的,山神在自己的管辖范围内”“那你为什么可以来这栋房子,你不是说这不是你的管辖范围 吗”“这就不懂了,以前的那个老朋友送了我一个玉佩,就可以来了”“你那老朋友到底是谁”我看着他,他眉头紧闭,不在说话,我也不便再 问,毕竟这是他的私事,问太多了反而不好,我和他还没熟悉到那个份上。我问他山神平时都住哪里,他说:“住在山的内部,凡人不可以进入 但是你想去,我还是可以带你进去,让你看看,也参观一下,别让山神的朋友像个傻子一样,别人问什么也不知道,丢我的脸啊”。我满脸期待: “什么时候”。“晚上红色月亮升起的时候,我来接你”“可这里和外面的天气好像不一样啊”“有时候不一样,可红色月亮,却是哪都一样的” 我问:“为什么红色月亮会是一样的呢”他说:“因为红色月亮有强大的法力,是我们,乃至所有上古神兽、妖精鬼怪无法抗衡的,除了红色月 亮,还有一半光一半雨,这种现象会让所有有法力的都消失,变得与普通人无异,不过这种现象要六百年左右才会发生一次,如果这种现象经常 出现的话,那神兽
高中化学元素周期表

高中化学元素周期表俄国化学家门捷列夫(Dmitri Mendeleev)于1869年总结发表此周期表(第一代化学元素周期表), [1] 此后不断有人提出各种类型周期表不下170余种,今天小编在这给大家整理了化学元素周期表,接下来随着小编一起来看看吧!化学元素周期表现代化学的元素周期律是1869年俄国科学家门捷列夫(Dmitri Mendeleev)首先创造的,他将当时已知的63种元素依相对原子质量大小并以表的形式排列,把有相似化学性质的元素放在同一列,制成元素周期表的雏形。
经过多年修订后才成为当代的周期表。
在周期表中,元素是以元素的原子序数排列,最小的排行最先。
表中一横行称为一个周期,一列称为一个族。
[2] 原子半径由左到右依次减小,上到下依次增大。
在化学教科书和字典中,都附有一张“元素周期表(英文:the periodic table of elements)”。
这张表揭示了物质世界的秘密,把一些看来似乎互不相关的元素统一起来,组成了一个完整的自然体系。
它的发明,是近代化学史上的一个创举,对于促进化学的发展,起了巨大的作用。
看到这张表,人们便会想到它的最早发明者——门捷列夫。
1869年,俄国化学家门捷列夫按照相对原子质量由小到大排列,将化学性质相似的元素放在同一纵行,编制出第一张元素周期表。
元素周期表揭示了化学元素之间的内在联系,使其构成了一个完整的体系,成为化学发展史上的重要里程碑之一。
随着科学的发展,元素周期表中未知元素留下的空位先后被填满。
当原子结构的奥秘被发现时,编排依据由相对原子质量改为原子的质子数﹙核外电子数或核电荷数﹚,形成现行的元素周期表。
按照元素在周期表中的顺序给元素编号,得到原子序数。
原子序数跟元素的原子结构有如下关系:质子数=原子序数=核外电子数=核电荷数利用周期表,门捷列夫成功的预测当时尚未发现的元素的特性(镓、钪、锗)。
1913年英国科学家莫色勒利用阴极射线撞击金属产生射线X,发现原子序数越大,X射线的频率就越高,因此他认为核的正电荷决定了元素的化学性质,并把元素依照核内正电荷(即质子数或原子序数)排列。
人教版高中化学必修二《元素周期律》ppt课件

通过对前面所学知识的归纳和比较, 过程与方法
掌握“位、构、性”的关系。 培养学生辩证唯物主义观点,培养学 情感、态度 生科学创造品质以及理论联系实际的 与价值观 能力。
自学导引
一、元素周期表的分区 元素周期表中以B、Al、Si、Ge、As、Sb、Te、Po、 At为分界线。 1.金属元素在分界线的________。 2.非金属元素在分界线的________。 3.稀有气体在________一列。
第一章
物质结构 元素周期律
第二节 元素周期律
第3课时 元素周期表和元素周期律的应用
自学导引 规律技巧 典例导析
随堂演练 课时作业
三维目标
1.掌握元素周期表和元素周期律的应用。 2.了解元素周期表中金属元素、非金属元 知识与技能 素的区分。 3.掌握元素的性质、原子结构、元素在周 期表中的位置之间的关系。
无论是同周期还是同主族元素中,a/b的值越小,元 素的金属性越强,其最高价氧化物对应水化物的碱性就越 强;反之,a/b的值越大,元素的非金属性越强,其最高 价氧化物对应水化物的酸性就越强。
(4)对角线规则:沿金属元素与非金属元素分界线方向 对角(左上角与右下角)的两主族元素的化学性质相似,这 一规律以第二、三周期元素间尤为明显,如铍与铝的化学 性质相似。
7.正负化合价的代数和为零,且气态氢化物中含氢 百分率最高的元素是C。
8.所形成气态氢化物最稳定的元素是F。 9.最高价氧化物对应的水化物酸性最强的是Cl。 10.所形成的化合物种类最多的是C。 11.原子序数、电子层数、未成对电子(单电子)数三 者均相等的是H。 12.只有负价无正价的是F。
13.单质和其最高价氧化物都是原子晶体的是Si。 14.气态氢化物在水中的溶解度最大的是N。 15.最轻的金属是锂[ρ(Li)=0.535g/cm3]。 16.同位素之一的原子核中只有质子而没有中子的元 素是H。 17.最高价氧化物及其水化物具有两性的元素是Al。 18.其单质可作半导体材料的是Si。 19.地壳中含量最高的元素是氧[ω(O)=48.60%]。
高三化学元素周期律与元素周期表

1、元素周期表的结构
短周期:3个(第1、2、3周期)
周期
7个
长周期:4个(第4、5、6、周期,
周期表 (七个横行) 其中第7周期为不完全周期)
主族7个:ⅠA-ⅦA
族
16个 (共18个纵行)
副族7个:IB-ⅦB 第Ⅷ族1个(3个纵行) 零族(1个)稀有气体元素
A. 原子序数=核电核数=质子数=核外电子数 B. 周期序数=原子核外电子层数 C. 主族序数=原子的最外层电子数=元素最高价数
⑤ (d)
元素性质的递变规律
周期 ⅠA ⅡA ⅢA ⅣA ⅤA ⅥA ⅦA
族
半径由大变小
1半
2径
3
由 小
4
变 大
5
6
7
非金属性逐渐增强
非
金
B
金
属
属
性
Al Si
性
逐
渐
Ge As
逐 渐
增 强
Sb Te
增 强
金属性逐渐增强
Po At
再见
网上订花 买花 订花 网上订花 买花 订花
A、非金属性强弱为:X>Y>Z
B、气态氢化物的稳定性由强到弱为X、Y、Z
C、原子半径大小是:X<Y<Z
D、对应阴离子的还原性按X、Y、Z顺序减弱
3.指出原子序数为5、17、20、35的元素的 位置在哪里?(用周期和族表示)
4.下列各组原子序数表示的两种元素,能形 成AB2型离子化合物的是( A )
7、 X、Y、Z为短周期三种元素,已知
X和Y同周期,Y和Z同主族,又知三种元 素原子最外层电子数总和为14,而质子数 总和为28,则三种元素为(D) (A)N、P、O (B)N、C、Si (C)B、Mg、Al (D)C、N、P
元素周期律

元素周期表
1.周期
元素周期表有7个横行,也就是7个周期。具有相 同的电子层数,而又按照原子序数递增的顺序排 列的一系列元素,称为一个周期。 周期的序数就是该周期原子具有的电子层数。 各周期里元素的数目不同,第一周期只有2个元 素,第二、第三周期各有8个元素。第四、五、 六、七周期元素都比8个元素多。第一、二、三 称为短周期,其余称长周期。
微粒半径大小比较的一般规律 1.先看电子层,电子层数越多,半径越大 2. 电子层数相同,看核电荷数,核电荷数越 大,半径越小。 3. 电子层数相同,核电荷数也相同,看最外 层电子数,电子数越多,半径越大。
四.元素主要化合价的周期变化
原子序数
元素名称
1
氢
2
氦
3
锂
4
铍
5
硼
6
碳
7
氮
第16号元素是硫也是非金属。它的最高价氧化物是 SO3,SO3对应的水化物是H2SO4。硫酸是一种强酸。在 加热时硫可以与氢气化合,生成气态氢化物硫化氢。
第17号元素氯也是非金属。它的最高价氧化物是Cl2O7, 对应的水化物是HClO4,它是已知酸中最强的酸。氯气与 氢气在光照或点燃时会发生爆炸而化合,生成气态氢化 物氯化氢。
一.核外电子 排布的周期性
部分元素原子 的电子层排布
通过上表可以发现,每隔一定数目的元素,会重复出 现原子最外层电子数从1个递增到8个的情况。也就是 说,随着原子序数的递增,元素原子的最外层电子呈 周期性的变化。
原子半径的周期性变化 同一周期内,从ⅠA到ⅦA(卤族)随着原子序数的递 增,原子半径由大变小。如Na原子的半径为: 1.86×10 -10米递减到0.99×10 -10米。 同一主族内,从上到下,随着元素电子层的增加,原 子半径增大。
高中化学一轮复习:元素周期律和元素周期表知识点总结
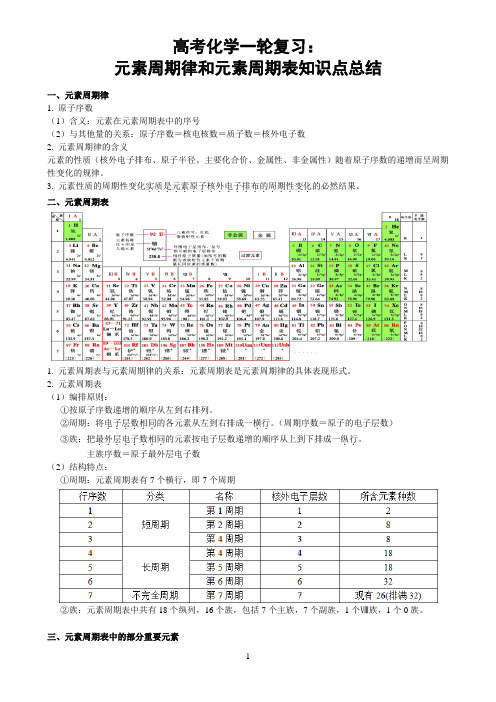
高考化学一轮复习:元素周期律和元素周期表知识点总结一、元素周期律1. 原子序数(1)含义:元素在元素周期表中的序号(2)与其他量的关系:原子序数=核电核数=质子数=核外电子数2. 元素周期律的含义元素的性质(核外电子排布、原子半径、主要化合价、金属性、非金属性)随着原子序数的递增而呈周期性变化的规律。
3. 元素性质的周期性变化实质是元素原子核外电子排布的周期性变化...................的必然结果。
二、元素周期表1. 元素周期表与元素周期律的关系:元素周期表是元素周期律的具体表现形式。
2. 元素周期表(1)编排原则:①按原子序数递增的顺序从左到右排列。
②周期:将电子层数相同..。
(周期序数=原子的电子层数)......的各元素从左到右排成一横行③族:把最外层电子数相同..。
........的元素按电子层数递增的顺序从上到下排成一纵行主族序数=原子最外层电子数(2)结构特点:①周期:元素周期表有7个横行,即7个周期②族:元素周期表中共有18个纵列,16个族,包括7个主族,7个副族,1个Ⅷ族,1个0族。
三、元素周期表中的部分重要元素四、焰色反应1、Na 黄Li 紫红K 浅紫(透过蓝色钴玻璃观察,因为钾里面常混有钠,黄色掩盖了浅紫色)2、Rb 紫Ca 砖红色Sr 洋红Rb 紫Cu 绿Ba 黄绿Co 淡蓝五、微粒半径的大小与比较(1)一看“电子层数”:当电子层数不同时,电子层数越多,半径越大。
如:同一主族元素,电子层数越多,半径越大如:r(Cl)>r(F)、r(O2-)>r(S2-)、r(Na)>r(Na+)。
(2)二看“核电荷数”:当电子层数相同时,核电荷数越大,半径越小。
如:同一周期元素,电子层数相同时核电荷数越大,半径越小。
如r(Na)>r(Cl)、r(O2-)>r(F-)>r(Na+)。
(3)三看“核外电子数”:当电子层数和核电荷数均相同时,核外电子数越多,半径越大。
如:r(Cl-)>r(Cl) 、r(Fe2+)>r(Fe3+)。
高中化学元素周期律知识点总结

高中化学元素周期律知识点总结一、元素周期律概述元素周期律是化学中描述元素性质随原子序数变化的基本规律。
这一规律由俄国化学家门捷列夫首次提出,并据此发明了元素周期表。
元素周期律主要包括两个方面的内容:一是元素的性质随着原子序数的增加呈现出周期性变化;二是元素的电子排布决定了其化学性质。
二、元素周期表的结构元素周期表是按照元素周期律排列元素的表格,它将所有已知的化学元素按照原子序数和电子排布规律进行分类。
周期表由若干行(周期)和列(族或组)组成,每一周期代表一个电子能级,每一族代表具有相似化学性质的元素。
1. 周期:周期表中的水平行称为周期,从上到下依次为1周期、2周期……7周期。
元素在周期表中的位置反映了其电子排布的能级。
2. 族或组:周期表中的垂直列称为族或组,从左到右依次为第1A族至第8A族(主族元素),以及第1B族至第2B族(过渡金属),还有第3B族至第12B族(后过渡金属),以及第8B族(镧系元素)和第9B族(锕系元素)。
三、元素周期律的具体表现1. 原子半径的周期性变化:同一周期内,从左到右原子半径逐渐减小;同一族内,从上到下原子半径逐渐增大。
2. 主要化合价的周期性变化:同一周期内,元素的最高正化合价从左到右逐渐增加;同一族内,元素的最高正化合价基本相同。
3. 电负性的周期性变化:同一周期内,电负性从左到右逐渐增加;同一族内,电负性从上到下逐渐减小。
4. 离子半径的周期性变化:同一周期内,阳离子半径小于阴离子半径;同一族内,阳离子半径小于上一族的阳离子半径,阴离子半径大于下一族的阴离子半径。
四、元素周期律的应用1. 预测元素性质:通过元素在周期表中的位置,可以预测其化学性质、反应性和化合物类型。
2. 指导化学实验:元素周期律有助于选择合适的试剂和条件进行化学反应,预测反应产物。
3. 材料科学:元素周期律在新材料的开发和性能预测中发挥重要作用,如半导体材料、超导材料等。
五、结语元素周期律是化学学科的基石之一,它不仅揭示了元素性质的内在联系,而且为化学研究和应用提供了重要的理论基础。
高中化学元素周期律知识点规律大全

高中化学元素周期律知识点规律大全1.元素周期律:元素周期律是按照原子核中质子数的大小和电子排布的规律,将所有元素按照一定的顺序排列成周期表。
2.元素周期表的结构:周期表由周期和组成两个维度组成。
周期是指原子核中质子数的递增顺序,组是指元素化学性质相似的元素在竖列方向上排列。
3.周期表分区:周期表分为s区(1-2组),p区(3-8组),d区(3-12组)和f区(内过渡金属区)。
4.元素周期表中的元素符号:元素周期表中的元素符号是代表元素的化学符号,比如氧元素的符号是O,碳元素的符号是C。
5.元素的周期和原子序数:元素周期表中的周期数表示元素的电子层数,原子序数表示元素的质子数或核电荷数。
6.主、副、次副周期:周期表中的s区是用户主周期,p区作为副周期,d区和f区则是次副周期。
7.元素周期表的横向周期规律:周期表横向周期数增加,元素的原子半径、电负性、电子亲和能等性质呈周期性变化。
8.元素周期表的纵向周期规律:周期表纵向组数增加元素以周期性地重复出现,一个新的主能级开始填入电子。
9.原子半径的周期性变化:原子半径在周期表中从左到右递减,从上到下递增。
10.电离能的周期性变化:第一电离能在周期表中从左到右增加,从上到下减小。
11.电子亲和能的周期性变化:电子亲和能在周期表中从左到右增加,从上到下减小。
12.电负性的周期性变化:电负性在周期表中从左到右增加,从上到下减小。
13.元素周期表的强氧化剂和强还原剂:在周期表中,元素越往上和越往右,越容易成为氧化剂;而越往下和越往左,越容易成为还原剂。
14.元素周期表的金属性和非金属性:在周期表中,金属性元素主要位于周期表左下角,非金属性元素主要位于周期表右上角。
15.主族元素和过渡元素:周期表中的s区和p区的元素称为主族元素,d区的元素称为过渡元素。
16.键合:通过元素周期表,我们可以预测元素之间的化学键合方式,如金属与非金属之间通常是离子键,非金属与非金属之间通常是共价键。
高一化学知识点-元素周期表

高一化学知识点:元素周期表高一化学知识点:元素周期表一、元素周期表原子序数=核电荷数=质子数=核外电子数1、元素周期表的编排原则:①按照原子序数递增的顺序从左到右排列;②将电子层数相同的元素排成一个横行——周期;③把最外层电子数相同的元素按电子层数递增的顺序从上到下排成纵行——族2、周期序数=电子层数;主族序数=最外层电子数3、元素金属性和非金属性判断依据:①元素金属性强弱的判断依据:单质跟水或酸起反应置换出氢的难易;元素最高价氧化物的水化物——氢氧化物的碱性强弱;置换反应。
②元素非金属性强弱的判断依据:单质与氢气生成气态氢化物的难易及气态氢化物的稳定性;最高价氧化物对应的水化物的酸性强弱;置换反应。
4、核素:具有一定数目的质子和一定数目的中子的一种原子。
①质量数二二质子数+中子数:A==Z+N②同位素:质子数相同而中子数不同的同一元素的不同原子,互称同位素。
(同一元素的各种同位素物理性质不同,化学性质相同)二、元素周期律1、影响原子半径大小的因素:①电子层数:电子层数越多,原子半径越大(最主要因素)②核电荷数:核电荷数增多,吸引力增大,使原子半径有减小的趋向(次要因素)③核外电子数:电子数增多,增加了相互排斥,使原子半径有增大的倾向2、元素的化合价与最外层电子数的关系:最高正价等于最外层电子数(氟氧元素无正价)负化合价数=8—最外层电子数(金属元素无负化合价)3、同主族、同周期元素的结构、性质递变规律:同主族:从上到下,随电子层数的递增,原子半径增大,核对外层电子吸引能力减弱,失电子能力增强,还原性(金属性)逐渐增强,其离子的氧化性减弱。
七大方法助你告别化学“差生”一.尽快去找化学老师,让他告诉你以前学过的关键知识点,在短期内掌握,目的是能够大致跟上现在的教学进度,以听懂老师讲授的新知识。
要想进步,必须弄清楚导致化学成绩差的根本原因是什么?是常用的几个公式、概念没记住,还是很重要的几个基本解题方法不能熟练应用,或者是以前的一些重点知识没有理解透彻等等。
高中化学05元素周期律、元素周期表

气态氢化物的稳定性、
最高价氧化物对应水化物的酸性强弱、
活泼的非金属单质能把较 不活泼的非金属离子氧化
二、原子结构与化学性质 的关系
原子的最外层电子数,因此最外层电子也称为价电子。有些元
(一)原子结构与元素化合价的关系:
素的化合价与它们原子的次外层或倒数第三层的 部分电子有关,这部分电子也叫价电子。
第三节 元素周期律
元素的性质随着原子序数的递增而呈周期性 的变化,这个规律叫做元素周期律。 1、随着原子序数的递增,元素原子的最 外层电子排布呈周期性的变化。 2、随着原子序数的递增,元素的原子半 径呈周期性的变化。 3、随着原子序数的递增,第一电离能呈周期 性的变化。 4、随着原子序数的递增,元素的主要化合价 呈周期性的变化。
钠与水的反应:常温下与冷水发生剧烈的反应,2Na +2H2O = 2NaOH + H2↑ 镁与水的反应: 常温下不反应,与沸水可发生 作用;与酸发生剧烈的反应。 Mg + 2H2O = Mg(OH)2 + H2 ↑ Mg + 2HCl = MgCl2 + H2↑ 铝与水的反应: 与水不发生反应,与酸的反应不如镁的剧烈。 2Al + 6HCl = 2AlCl3 + 3H2↑ 最高价氧化物对应水化物的酸性强弱: H4SiO4<H3PO4<H2SO4<HClO4 气态氢化物的稳定性:SiH4<PH3<H2S<HCl
结论: Na、Mg、Al、Si、P、S、Cl 金属性减弱、非金属性增强
四、同周期元素性质变化规律:
同周期元素从左到右非金属性不断增 强,金属性不断减弱。
Al2O3与Al(OH)3的性质:
Al2O3 + 6H+ = 2Al3+ + 3H2O Al2O3 + 2OH- = 2AlO2- + H2O
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
元素周期表、元素周期律(是什么)1.(2015·海南高考)下列离子中半径最大的是()A.Na+B.Mg2+C.O2-D.F-解析:选C选项中的离子都具有相同的电子层结构,对于电子层结构相同的离子来说,核电荷数越大,离子半径就越小。
2.“嫦娥一号”卫星在北京航天飞机控制中心科技人员的精确控制下,准确落于月球东经52.36°、南纬1.50°的预定撞击点。
“嫦娥一号”担负的四大科学目标之一是探测下列14种元素的含量和分布情况:K、Th(钍)、U(铀)、O、Si、Mg、Al、Ca、Fe、Ti(钛)、Na、Mn、Cr(铬)、Gd(钆),其中属于主族元素的有()A.4种B.5种C.6种D.7种解析:选D K、Na属于ⅠA族,Mg、Ca属于ⅡA族,Al属于ⅢA族,Si属于ⅣA 族,O属于ⅥA族,共7种,Th(钍)、U(铀)、Fe、Ti(钛)、Mn、Cr(铬)、Gd(钆)均为过渡元素。
3.已知a A n+、b B(n+1)+、c C n-、d D(n+1)-是具有相同电子层结构的离子,下列关于A、B、C、D四种元素的叙述正确的是()A.离子半径:A n+>B(n+1)+>C n->D(n+1)-B.原子序数:b>a>c>dC.原子半径:D>C>B>AD.四种元素一定均属于短周期元素解析:选B由于四种离子具有相同的电子层结构,可以推知四种元素在周期表中的位置关系如图。
A项,具有相同电子层结构的离子,核电荷数越大,离子半径越小,故离子半径:D(n+1)->C n->A n+>B(n+1)+;B项,原子序数:b>a>c>d;C项,原子半径:A>B>D>C;D项,四种元素也可以为长周期元素。
4.下列有关元素周期表的说法中,正确的是()A.能形成碱的金属元素都在第ⅠA族B.原子序数为14的元素位于元素周期表的第三周期第ⅥA族C.稀有气体元素原子的最外层电子数为2或8D.元素周期表有18个纵行,分列16个族,即7个主族、8个副族和1个0族解析:选C能形成碱的金属元素可能位于第ⅠA族,也可能位于其他族,如钙、钡等,A错误;原子序数为14的元素位于元素周期表的第三周期第ⅣA族,B错误;稀有气体元素中He原子的最外层电子数为2,其余原子最外层都有8个电子,C正确;元素周期表有18个纵行,分列16个族,即7个主族、7个副族、1个0族和1个第Ⅷ族,D错误。
5.(2018·天津高考)下列有关物质性质的比较,结论正确的是()A.溶解度:Na2CO3<NaHCO3B.热稳定性:HCl<PH3C.沸点:C2H5SH<C2H5OHD.碱性:LiOH<Be(OH)2解析:选C溶解度:Na2CO3>NaHCO3,A项错误;非金属性:Cl>P,故热稳定性:HCl>PH3,B项错误;C2H5OH分子间存在氢键,比同主族元素S形成的C2H5SH沸点高,C项正确;同周期元素的金属性:Li>Be,故碱性:LiOH>Be(OH)2,D项错误。
6.下列根据元素周期表和元素周期律得出的推断中正确的是()A.金属元素原子最外层电子数越少,该金属失电子能力越强B.若存在简单阴离子R2-,则R一定位于ⅥA族C.a A2+、b B+、c C3-三种离子具有相同的电子层结构,则原子序数c>a>bD.铅位于周期表中金属和非金属的交界处,可作半导体材料解析:选B A项,金属失电子能力的强弱与原子最外层电子数的多少没有关系;C项,原子序数a>b>c;D项,铅是金属,属于导体。
7.下列有关元素周期表结构的说法中正确的是()A.原子最外层电子数为2的元素一定处于周期表ⅡA族B.在元素周期表中金属和非金属分界线附近可以寻找合金材料C.某元素原子核外的电子数为63,则它是第六周期副族元素D.除短周期外,其他周期均有18种元素,副族元素没有非金属元素解析:选C A项,原子最外层电子数为2的元素不一定处于周期表ⅡA族,如He;B项,在元素周期表中金属与非金属分界线附近可寻找半导体材料;D项,第六周期有32种元素。
8.根据表中部分短周期元素的原子半径和主要化合价信息,判断以下叙述正确的是()A.氢化物的沸点:H2T<H2RB.L和Q形成的化合物中,两种微粒最外层均达到8电子稳定结构C.单质的还原性:L<MD.简单离子半径的大小顺序为r(L+)>r(T2-)>r(M3+)解析:选B根据表中原子半径和主要化合价的信息可以推知L为Na,M为Al,Q 为Cl,R为S,T为O。
A项,氢化物的沸点:H2O>H2S;B项,NaCl中两种微粒Na+和Cl-最外层均达到8电子稳定结构;C项,单质的还原性:Na>Al;D项,简单离子半径:r(O2-)>r(Na+)>r(Al3+)。
9.下列事实不能用元素周期律解释的是()A.F2在暗处遇H2爆炸,I2在暗处遇H2几乎不反应B.Br2和NaI溶液发生置换反应,和NaCl溶液不发生置换反应C.金属Na和熔融KCl反应置换出金属KD.常温下,NaCl溶液的pH=7,AlCl3溶液的pH<7解析:选C A项,非金属性F>I,故F2与H2化合较容易,可以利用元素周期律解释;B项,Br的非金属性强于I但弱于Cl,Br2和NaI溶液发生置换反应,和NaCl溶液不反应,可以利用元素周期律解释;C项,K金属性强于Na,金属Na和熔融KCl反应置换出金属K是因为钾的沸点较低,不可以利用元素周期律解释;D项,Na的金属性强于Al,NaCl 为强酸强碱盐,AlCl3为强酸弱碱盐,故常温下,NaCl溶液的pH=7,AlCl3溶液的pH<7,可以利用元素周期律解释。
10.同主族中常见的三种元素X、Y、Z,它们最高价氧化物对应水化物的酸性强弱的顺序为HXO4<HYO4<HZO4。
下列判断不正确的是()A.Y单质可以从海水中提取B.离子半径:X->Y-C.气态氢化物的稳定性:HX<HZD.单质的氧化性:Y>Z解析:选D从元素最高价氧化物对应水化物的化学式可知,三种元素的最高化合价均为+7价,故为第ⅦA族元素,由元素最高价氧化物对应水化物的酸性强弱可知,非金属性:X<Y<Z,由于氟元素无正价,则X、Y、Z分别为碘元素、溴元素、氯元素。
从海水中可提取单质Br2,A项正确;离子半径:I->Br-,B项正确;气态氢化物的稳定性:HI<HCl,C项正确;氧化性:Cl2>Br2,D项错误。
11.X、Y、Z、W为四种短周期主族元素,且原子序数依次增大。
已知X的最外层电子数是其电子层数的2倍,Y是地壳中含量最高的元素,Y原子的最外层电子数是W原子最外层电子数的2倍,Z原子最外层只有1个电子。
下列说法正确的是() A.原子半径:Z>XB.离子半径:W3+>Y2-C.非金属性:X>YD.最高价氧化物对应水化物的碱性:Z<W解析:选A由题述条件知,X是碳元素,Y是氧元素,Z是钠元素,W是铝元素。
原子半径:Na>C,A正确;根据核外电子排布相同的离子,核电荷数小的半径大,离子半径:O2->Al3+,B错误;非金属性:O>C,C错误;根据元素的金属性越强最高价氧化物对应水化物的碱性越强,碱性:NaOH>Al(OH)3,D错误。
12.如图是部分短周期元素原子半径与原子序数的关系图,下列说法正确的是()A.M、N的氧化物都能与Z、R的最高价氧化物对应的水化物反应B.Y的单质能从含R简单离子的水溶液中置换出R单质C.X、M两种元素组成的化合物熔点很高D.简单离子的半径:R>M>X解析:选C由题图可知,两条曲线分别为第二周期和第三周期元素的原子半径的变化情况,根据原子序数关系可知X为O元素,Y为F元素,Z为Na元素,M为Al元素,N为Si元素,R为Cl元素。
M、N的氧化物Al2O3、SiO2都能与Z的最高价氧化物对应的水化物NaOH反应,但SiO2不与R的最高价氧化物对应的水化物HClO4反应,A错误;F2非常活泼,与含氯离子的水溶液反应时直接与水反应,无法置换出Cl2,B错误;X、M 两种元素组成的化合物为Al2O3,Al2O3的熔点很高,C正确;O2-、Al3+电子层结构相同,核电荷数越大离子半径越小,Cl-比它们多一个电子层,半径最大,故离子半径:Cl->O2->Al3+,D错误。
13.(2019·长郡中学模拟)X、Y、Z、W、Q为短周期中的五种元素,其中Q在同周期中的原子半径最小。
下列说法正确的是()A.简单气态氢化物的热稳定性:Y>WB.简单离子的半径:Y>Z>W>QC.X、Q与氢元素所形成化合物的溶液能使石蕊试纸变蓝D.常温下,X的最高价氧化物对应水化物的浓溶液与Z的单质不反应解析:选A X、Y、Z、W、Q为短周期中的五种元素,其中Q在同周期中的原子半径最小,Q为氯元素,由元素在周期表中的位置关系可知X为N、Y为O、Z为Al、W为S。
元素非金属性越强,对应的简单氢化物越稳定,则简单氢化物的热稳定性:H2O>H2S,故A正确;电子层数越大,离子半径越大,电子层结构相同时,原子序数越小,离子半径越大,W、Q的简单离子比Y、Z的多一个电子层,则简单离子半径:W>Q>Y>Z,故B 错误;X、Q与氢元素可形成NH4Cl,在水溶液中NH+4水解使溶液显酸性,不能使石蕊试纸变蓝,故C错误;X的最高价氧化物对应水化物的浓溶液即为浓硝酸,常温下浓硝酸使Z的单质(Al)发生钝化生成致密的氧化铝薄膜,属于化学反应,故D错误。
14.(2017·天津高考)根据元素周期表和元素周期律,判断下列叙述不正确的是() A.气态氢化物的稳定性:H2O>NH3>SiH4B.氢元素与其他元素可形成共价化合物或离子化合物C.如图所示实验可证明元素的非金属性:Cl>C>SiD.用中文“”(ào)命名的第118号元素在周期表中位于第七周期0族解析:选C非金属性:O>N>C>Si,故气态氢化物的稳定性:H2O>NH3>SiH4,A项正确;H与C、N、O、F等非金属元素形成共价化合物,与Na、Mg等金属元素形成离子化合物,B项正确;题图所示实验可证明酸性:HCl>H2CO3>H2SiO3,但元素非金属性的强弱与元素的最高价氧化物对应的水化物的酸性强弱有关,HCl不是氯元素的最高价氧化物对应的水化物,故不能根据其酸性强弱判断Cl的非金属性强弱,C项错误;118号元素在元素周期表中位于第七周期0族,D项正确。
