日本东京大学Fukuyama组10年组会2012有机反应机理习题(适合研究生),八,题目
《有机化学》(第四版)第五章 芳烃(习题答案)
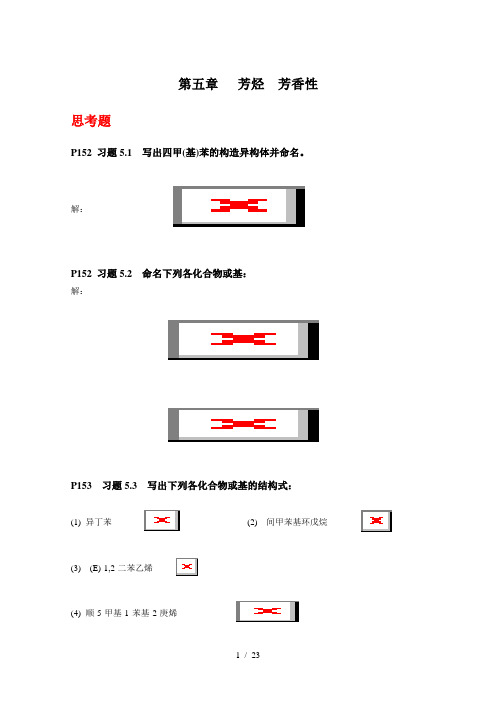
第五章芳烃芳香性思考题P152 习题5.1 写出四甲(基)苯的构造异构体并命名。
解:P152 习题5.2 命名下列各化合物或基:解:P153 习题5.3 写出下列各化合物或基的结构式:(1) 异丁苯(2) 间甲苯基环戊烷(3) (E)-1,2-二苯乙烯(4) 顺-5-甲基-1-苯基-2-庚烯1 / 23(5) 二苯甲基(6) 3-苯基-2-丙烯基P156 习题5.4 甲苯的沸点比苯高30.5℃,而熔点低~100℃,为什么?解:甲苯的相对分子质量大于苯,分子间色散力大于苯,因比甲苯的沸点也高于苯;但苯分子的对称性好,晶格能大于甲苯,因此苯的熔点高于苯。
P161 习题5.5 写出乙苯与下列试剂作用的反应式(括号内是催化剂):(1) Cl2(FeCl3) (2) 混酸(3) 正丁醇(BF3) (4) 丙烯(无水AlCl3) (5) 丙酸酐(CH3CH2CO)2O(无水AlCl3)(6) 丙酰氯CH3CH2COCl(无水AlCl3)解:(1)(2)(3)(4)(5)(6)P161 习题5.6 由苯和必要的原料合成下列化合物:(1)解:(2) 叔丁苯解:(3)解:(4)解:P164 习题5.7 试以苯和必要的原料合成正丙苯。
解:P164 习题5.8 在氯化铝的存在下,苯和新戊基氯作用,主要产物是2-甲基-2-苯基丁烷,而不是新戊基苯。
试解释之。
写出反应机理。
解:C+稳定性:>>3 / 23P164 习题5.8 写出下列反应的产物:P166 习题5.10 在日光或紫外光照射下,苯与氯加成生成六氯化苯,是一个自由基链反应。
写出反应机理。
解:P166 习题5.11 写出六氯化苯最稳定的构象式。
解:从理论上说,六氯化苯最稳定的构象式应该是;P168 习题5.12 写出下列反应的产物或反应物的构造式:(1)(2)(3)(4)(5)(6)(7)(8)P173 习题 5.13 苯甲醚在进行硝化反应时,为什么主要得到邻和对硝基苯甲醚?试从理论上解释之。
2014年(平成二十六年)日本东京大学二次试验试题(化学)

程(3)和(6)中的常数 α 和 β,皆保留两位有效数字。
QNaF (kJ•mol-1) -923
QNa (kJ•mol-1) 406
QF (kJ•mol-1) 524
rNa (nm) 0.12
rபைடு நூலகம் (nm) 0.12
13. 利用上题中求得的 α 和 β 值,试比较盐 A 和盐 B 的溶解度大小。另用约 50 字定量描述两种盐的 Q离子化
锰化合物中的锰元素亦具有多种化合价。酸化的高锰酸根[Mn(VII)]是双氧水分解为水和氧气的优良催 化剂。高锰酸钾具有强氧化性,其水溶液呈现特殊的紫红色,常在氧化还原滴定中使用。
基于上述信息,进行实验 1-3: 实验 1:向试管里加入 2.0 mL 的稀硫酸酸化的一定浓度的重铬酸钾溶液和 2.0 mL 2-丙醇。按照图 1-2 所示
第4页,共11页
刘田宇 译/整理
化学反应方程式。注意冰水浴中的试管下方收集有无色透明液体。 4. 实验 2 中若加入的高锰酸钾质量为 20 mg,与 1 mol 过氧化氢反应后测得的反应热应为多少 kJ?保留两 位有效数字。 5. 写出划线③处气体的化学式。另外,从以下(1)-(6)中选出能正确描述该气体特征的所有选项: (1) 水溶液呈弱酸性 (2) 水溶液呈弱碱性 (3) 向下排空法集气 (4) 向上排空法集气 (5) 黄绿色气体 (6) 褐色气体 6. 若不进行划线④处的煮沸过程而直接滴定,所测得的硫化铁的纯度可能超过 100%。试用 40~60 字阐述 原因。 7. 根据实验 3 的数据,求硫化亚铁样品的纯度(质量分数表示),保留两位有效数字。答题过程中需写出 划线⑤处的化学反应方程式。假定样品中的杂质不与高锰酸钾反应。
中科院应化所考博真题2012高等物理化学及答案

中国科学院长春应用化学研究所2012年攻读博士学位研究生入学试题高等物理化学一、选择题(包括8小题,每小题2分,共16分)1.298.15 K,已知气相反应2CO(g)﹢O2(g) → 2CO2(g)的r m ΔG﹦-514.2 kJ/mol,则发生1 mol 反应进度的Δr Am: (C)A. r m Δ A﹦-514.2 kJ/molB. r m Δ A﹦0C. r m Δ A>-514.2 kJ/molD. r m Δ A﹤-514.2 kJ/mol2.1mol 苯(l)在正常沸点完全变为蒸气时,一组不变的热力学函数是:(C)A. 温度、压力、定压热容B. 热力学能、温度、吉布斯函数C. 温度、总(系统和环境)熵、吉布斯函数D. 热力学能、焓、熵3.在一定压力下,纯A 的沸点、饱和蒸气压和化学势分别为b T∗,A p∗,A μ ∗,加入少量不挥发的溶质形成溶液后分别变成b T ,A p ,A μ ,因此有:(D)A. b T > b T∗,A p >A p∗,A μ > A μ∗B. b T < b T∗,A p <A p∗,A μ < A μ∗C. b T < b T∗,A p >A p ∗,A μ < A μ∗D. b T > b T∗,A p <A p ∗,A μ < A μ∗4.298 K,浓度均为0.01 mol·kg−1的下列电解质溶液,其γ±最大者是:(A)A.KC lB.CaC l2C l3D.ZnSO45.对于亲水性固体表面,其界面张力间的关系是:(B)A. s g σ < l s σB. s g σ > l s σC. s g σ﹦l s σD. g s σ< l g σ6.298 K 时有相同物质的量浓度的NaOH(l)和NaCl(2)溶液,两溶液中Na+的迁移数1 t 与2 t 之间的关系为:(C)A. 1 t ﹦2 tB. 1 t > 2 tC. 1 t < 2 tD.无法比较7.下面属于水包油型乳状液(O/W 型)基本性质之一的是:(A)A.有导电性B.易于分散在油中C.无导电性8.下列物质在水溶液中能发生正吸附的是:(D)A.烧碱B.蔗糖C.食盐D.肥皂二、填空题(包括10小题,每小题2分,共20分)1.下列四个过程:(a)物质的量为n的理想气体由始态(p1,V1,T)变化到末态(p2,V2,T)(b)实际气体的节流膨胀(c)物质的量分别为n B,n C的纯液体B,C在恒温恒压下形成理想状态混合物的混合过程(d)绝热,恒压,不做非体积功的化学反应过程。
有机化学第二版习题答案

第一章绪论1-1 扼要解释下列术语、(1)有机化合物(2) 键能、键的离解能(3) 键长(4) 极性键(5) σ键(6)π键(7) 活性中间体(8) 亲电试剂(9) 亲核试剂(10)Lewis碱(11)溶剂化作用(12) 诱导效应(13)动力学控制反应(14) 热力学控制反应答:(1)有机化合物-碳氢化合物及其衍生物(2) 键能:由原子形成共价键所放出的能量,或共价键断裂成两个原子所吸收的能量称为键能。
键的离解能:共价键断裂成两个原子所吸收的能量称为键能。
以双原子分子AB为例,将1mol气态的AB拆开成气态的A与B原子所需的能量,叫做A—B键的离解能。
应注意的就是,对于多原子分子,键能与键的离解能就是不同的。
分子中多个同类型的键的离解能之平均值为键能E(kJ、mol-1)。
(3) 键长:形成共价键的两个原子核之间距离称为键长。
(4) 极性键: 两个不同原子组成的共价键,由于两原子的电负性不同, 成键电子云非对称地分布在两原子核周围,在电负性大的原子一端电子云密度较大,具有部分负电荷性质,另一端电子云密度较小具有部分正电荷性质,这种键具有极性,称为极性共价键。
(5) σ键:原子轨道沿着轨道的对称轴的方向互相交叠时产生σ分子轨道, 所形成的键叫σ键。
(6) π键:由原子轨道侧面交叠时而产生π分子轨道,所形成的键叫π键。
(7) 活性中间体:通常就是指高活泼性的物质,在反应中只以一种”短寿命”的中间物种存在,很难分离出来,,如碳正离子, 碳负离子等。
(8) 亲电试剂:在反应过程中,如果试剂从有机化合物中与它反应的那个原子获得电子对并与之共有形成化学键,这种试剂叫亲电试剂。
(9) 亲核试剂:在反应过程中,如果试剂把电子对给予有机化合物与它反应的那个原子并与之共有形成化学键,这种试剂叫亲核试剂。
(10) Lewis碱:能提供电子对的物种称为Lewis碱。
(11)溶剂化作用:在溶液中,溶质被溶剂分子所包围的现象称为溶剂化作用。
有机化学反应机理大全(竞赛复习).
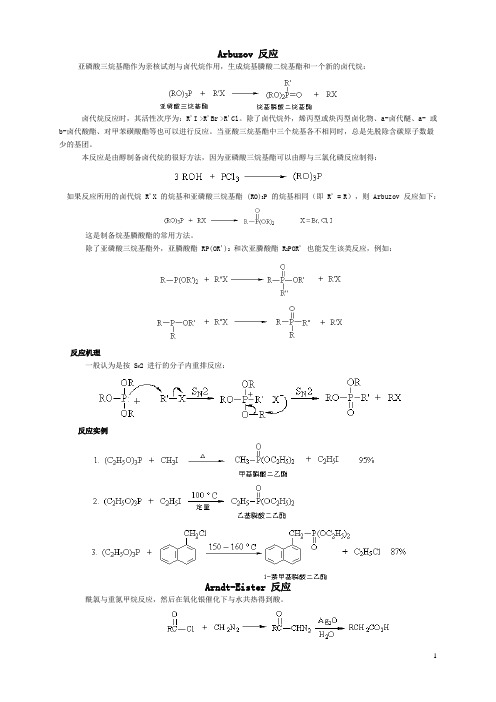
Arbuzov 反应亚磷酸三烷基酯作为亲核试剂与卤代烷作用,生成烷基膦酸二烷基酯和一个新的卤代烷:卤代烷反应时,其活性次序为:R'I >R'Br >R'Cl。
除了卤代烷外,烯丙型或炔丙型卤化物、a-卤代醚、a- 或b-卤代酸酯、对甲苯磺酸酯等也可以进行反应。
当亚酸三烷基酯中三个烷基各不相同时,总是先脱除含碳原子数最少的基团。
本反应是由醇制备卤代烷的很好方法,因为亚磷酸三烷基酯可以由醇与三氯化磷反应制得:如果反应所用的卤代烷 R'X 的烷基和亚磷酸三烷基酯 (RO)3P 的烷基相同(即 R' = R),则 Arbuzov 反应如下:这是制备烷基膦酸酯的常用方法。
除了亚磷酸三烷基酯外,亚膦酸酯 RP(OR')2和次亚膦酸酯 R2POR' 也能发生该类反应,例如:反应机理一般认为是按 S N2 进行的分子内重排反应:反应实例Arndt-Eister 反应酰氯与重氮甲烷反应,然后在氧化银催化下与水共热得到酸。
反应机理重氮甲烷与酰氯反应首先形成重氮酮(1),(1)在氧化银催化下与水共热,得到酰基卡宾(2),(2)发生重排得烯酮(3),(3)与水反应生成酸,若与醇或氨(胺)反应,则得酯或酰胺。
反应实例Baeyer----Villiger 反应反应机理过酸先与羰基进行亲核加成,然后酮羰基上的一个烃基带着一对电子迁移到-O-O-基团中与羰基碳原子直接相连的氧原子上,同时发生O-O键异裂。
因此,这是一个重排反应具有光学活性的3---苯基丁酮和过酸反应,重排产物手性碳原子的枸型保持不变,说明反应属于分子内重排:不对称的酮氧化时,在重排步骤中,两个基团均可迁移,但是还是有一定的选择性,按迁移能力其顺序为:醛氧化的机理与此相似,但迁移的是氢负离子,得到羧酸。
反应实例酮类化合物用过酸如过氧乙酸、过氧苯甲酸、间氯过氧苯甲酸或三氟过氧乙酸等氧化,可在羰基旁边插入一个氧原子生成相应的酯,其中三氟过氧乙酸是最好的氧化剂。
高2012级化学竞赛有机化学模拟训练题

高2012级化学竞赛有机化学模拟训练题1.在20%的NaOH溶液中,用丙酮在100℃条件下与反应得到的主要产物是(B)A.B.C.D.2.下面反应中,主要产物为.(CH3)3C-OCH3(甲基叔丁基醚)的是(A)A. (CH3)3C-ONa+CH3IB.C. (CH3)3CCl+KOCH3D.3.反应的主要产物是(B)A. B.C. D.4.反应(CH3)3C-OH的主要产物是(C)A. (CH3)3C-C-C(CH3)3B. (CH3)3CHC. (CH3)2C=CH2D.CH2=CH-CH=CH25.将下面标数字的方框中的主要产物填在答题纸上。
CH3+CH2C3CH3H+①CH COCl3②3③④+答案(4分)①②③④5.(6分)某芳香化合物A(C8H10)有①种合理的异构体,但在催化剂AlCl3存在下与CH3COCl CH CHCH3CH2+OH2H SO反应,只有一种产物B ,将B 用酸性KMnO 4氧化,得到C ,C 经分离纯化后,称取0.4203g ,加入50.00mL 、0.1500mol/L NaOH 溶液,溶解完全后,用0.1000mol/LHCl 溶液滴定过量的NaOH ,消耗15.00mL 。
则A 的结构式应是 ②,B 的结构式应为 ③ ,C 的分子量为 ④ ,其计算过程为 ⑤ ,所以,C 最合理的结构式应是 ⑥ 。
5.(6分)答案①4 ②③ ④210.15⑤n=30001(0.1500×50.0-0.1000×15.00)=0.002000(mol) M=002000.04203.0=210.15(g/mol)⑥ 6.(8分)化合物A 的元素分析结果为:含C 元素85.6%、H 元素14.40%。
将0.5000g 化合物A ,在0℃和0.1MPa 条件下催化加氢可以吸收100mL 氢,A 经O 3和Zn/H 2O 作用后只得到一种醛,试推测化合物A 的可能结构式(注意构型),并用系统命名法命名化合物A 。
【有机】Angew:东京工业大学...

【有机】Angew:东京工业大学...传递最新鲜的科研资讯点击上方蓝字CBG资讯加关注Actinorhodin(1)是由Brockmann等人于1947年从Streptomyces coelicolor A3(2)分离的红色素,属于吡喃并萘醌类抗生素(Figure 1)。
然而,1的NMR数据至今尚无任何报道。
Brockmann和Zeeck确定了1的结构,包括相对和绝对立体化学,Floss通过生物合成研究确定了二芳基键的位置。
1的结构与nanaomycin A的二聚体类似,其区别表现在:1)单体结构为对映体;2)1的C6和C6'位同时含有羟基。
相关单体的合成已有报道,但二聚体合成充满挑战性,只有Brückner课题组完成了kalafungin 相关二聚体的全合成。
近日,东京工业大学Keisuke Suzuki和Ken Ohmori等人完成了1的首次不对称全合成,并报道了其1H NMR数据。
该成果近期发表在Angew. Chem. Int. Ed.上(DOI: 10.1002/anie.201814172)。
(图片来源:Angew. Chem. Int. Ed.)1的全合成涉及三个问题(Figure 2a):1)二聚化的区域选择性;2)以有差别的方式引入多个含氧官能团;3)制备单体时的对映和非对映选择性。
然而,通过酸介导的平衡过程控制1,3-反式选择性尚不完美,需进行异构体分离(Figure 2b)。
(图片来源:Angew. Chem. Int. Ed.)Actinorhodin(1)的逆合成分析(Scheme 1):首先,二聚体1可以通过两个相同的单体A在C8-C8'位区域选择性氧化偶联得到,A则可以由萘二酚衍生物B衍生得到。
B中的侧链可以由半缩醛C作为前体,通过Lewis酸介导的活化、动力学控制下的π-亲核进攻来引入。
C可由醇D经不对称还原得到。
D中的手性中心可以通过酮E的对映选择性还原构建。
2020年(令和二年)日本东京大学二次试验试题(化学)

2020年(令和二年)日本东京大学二次试验试题(化学)2020年(令和二年)日本东京大学二次试验试题(化学)第一问本大题包含I、II两题。
一些必要的数值列举如下。
有机化合物的结构式例子:I、读下面的文章,回答一~六题。
某天然化合物A,分子量为286,仅由碳、氢、氧组成。
71.5 mg A完全燃烧后,生成143 mg二氧化碳和40.5 mg水。
A可水解为等物质的量的化合物B和化合物C。
B的水溶液与斐林试剂混合加热后有红色沉淀生成,而A的水溶液在同样条件下无沉淀生成。
C与氯化铁(III)水溶液混合后呈现出特殊的颜色,而A则不会。
纤维素和淀粉是由许多B缩合而成的多糖。
纤维素可被纤维素酶水解为纤维二糖。
淀粉可被淀粉酶水解为麦芽糖。
本题上方左侧的结构式例子表示的就是与这两种水解产物分子式相同的蔗糖结构式。
以上这些二糖都可被酶X或酶Y在水中分解为单糖。
酶X水解纤维二糖或酶Y水解麦芽糖都能生成B。
然而酶X无法水解麦芽糖,酶Y 无法水解纤维二糖。
蔗糖与酶X在水中不反应,但与酶Y反应生成等物质的量的B和化合物D。
A可被酶X水解生成B和C,但不与酶Y 反应。
C经酸化后可制得化合物E。
E存在分子内氢键,且与碳酸钠水溶液混合后产生二氧化碳。
E的无水酸酐与浓硫酸反应可制备一种作为解热镇痛剂的化合物F。
问题一、写出化合物A的分子式。
二、写出化合物B、D、F的名称。
三、化合物B能以链状或环状结构存在。
分别指出这两种结构中不对称碳原子的个数。
四、纤维二糖、麦芽糖、蔗糖三种二糖中,哪些可发生划线标注的反应生成红色沉淀?陈述理由。
五、写出化合物C的结构式。
六、写出化合物A的结构式。
II、阅读下面的文章,回答七~十一题。
纤维素是地球上含量最大的有机化合物,被认为是发展不依赖石油资源的新一代化学工业的重要物质。
纤维素在浓硫酸中加热后生成的产物中存在非主要产物化合物G。
G仅含C、H、O三种元素,可用于合成生物燃料、可生物降解高分子、医药品等。
高三有机推断试题训练
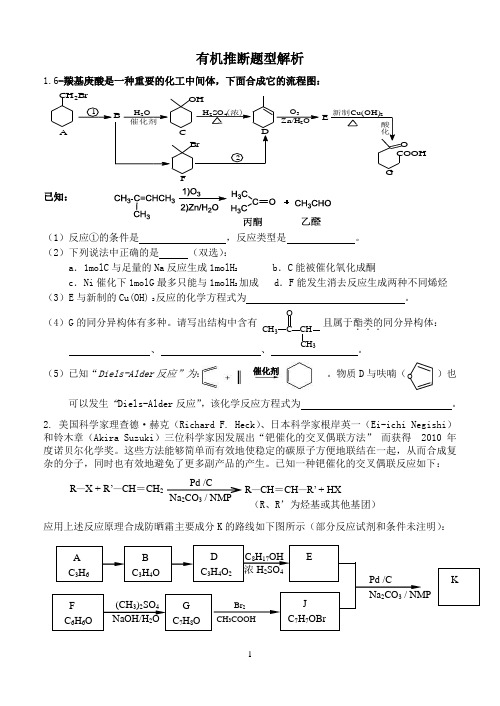
有机推断题型解析1.6-羰基庚酸是一种重要的化工中间体,下面合成它的流程图:已知:(1)反应①的条件是 ,反应类型是 。
(2)下列说法中正确的是 (双选):a .1molC 与足量的Na 反应生成1molH 2b .C 能被催化氧化成酮c .Ni 催化下1molG 最多只能与1molH 2加成d .F 能发生消去反应生成两种不同烯烃 (3)E 与新制的Cu(OH) 2反应的化学方程式为 。
(4)G 的同分异构体有多种。
请写出结构中含有 且属于酯类的...同分异构体:、 、 。
(5)已知“Diels-Alder 反应”为: 。
物质D 与呋喃( )也可以发生“Diels-Alder 反应”,该化学反应方程式为 。
2. 美国科学家理查德·赫克(Richard F. Heck )、日本科学家根岸英一(Ei-ichi Negishi )和铃木章(Akira Suzuki )三位科学家因发展出“钯催化的交叉偶联方法” 而获得 2010年度诺贝尔化学奖。
这些方法能够简单而有效地使稳定的碳原子方便地联结在一起,从而合成复杂的分子,同时也有效地避免了更多副产品的产生。
已知一种钯催化的交叉偶联反应如下:(R 、R’为烃基或其他基团)应用上述反应原理合成防晒霜主要成分K 的路线如下图所示(部分反应试剂和条件未注明):CH 2B rB1H 2O 2催化剂OHH 2SO 4(浓)O 3Zn/H 2OEOCOOH 酸化新制Cu(OH)2B rA C DFG催化剂 OC OCH3CH 3CHPd /CNa 2CO 3 / NMPKBr 2 CH 3COOHJ C 7H 7OBr(CH 3)2SO 4 NaOH/H 2O C 8H 17OH 浓H 2SO 4BC 3H 4OA C 3H 6 DC 3H 4O 2 EF C 6H 6OG C 7H 8OPd /CNa 2CO 3 / NMPR —X + R ’—CH =CH 2 R —CH =CH —R’ + HX已知:① B能发生银镜反应,1 mol B 最多与2 mol H2反应。
南开大学96-05年硕士生入学有机化学试题(共10年真题)

Cl
C(CH3)3
A 3.下列化合物碱性最强的是(
Cl B
)
N
N
H
H
A
B
4.下列化合物不具有芳香性的是(
N H C
)
O
O
..
N
O
CH3
A
B
C
5.下列化合物具有旋光性的是(
)
CO2H H OH
CH3
H OH CO2H
CH3 (2R,3S,4S)-2,4-二氯-3-戊醇
A
B
C
三,给下列化合物命名或根据名称写出结构(5 分)
CH3
CH3
C=CHCH2CH2CCH=CH2 OH
HBr
C Br
CH3 CH3
六,1,3-环己二酮在 NaOC2H5/HOC2H5 存在下与 1,5-二溴戊烷反应,首 先生成化合物 A,A 可继续反应生成 B。①写出 A 的结构②写出由 A 生 成 B 的历程。(5 分)
O
O
+
BrCH2CH2CH2CH2CH2Br OO
一,简要回答问题(16 分) 1.排列下列烯烃与 Br2 加成的反应活性顺序
CH3
A
B
C
2.排列下列含氮化合物碱性强弱顺序
NH2
N
H
A
B
(CH3CH2)2NH
N
H
C
D
3.排列下列负离子亲核性强弱顺序
CH=CHCH2O A
C CCH2O B
CH2CH2CH2O C
4.说明下列酮 A 比酮 B 偶极矩大的原因。
1.写出 A,B,C 的结构(4 分) 2. 写出由 B 生成 C 的历程(5 分) 十三,1. 从薰衣草油中提取得一种醇叫沉香醇,分子式为 C10H18O,它可与
东南大学高等有机(物理有机)考试必备
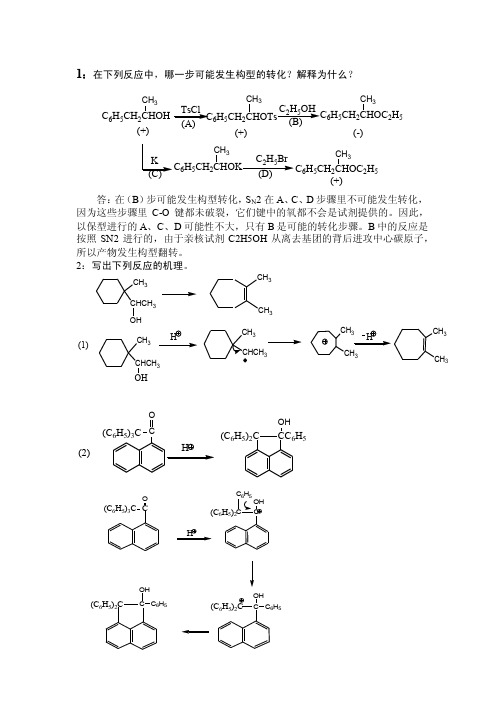
1:在下列反应中,哪一步可能发生构型的转化?解释为什么?答:在(B )步可能发生构型转化,S N 2在A 、C 、D 步骤里不可能发生转化,因为这些步骤里C-O 键都未破裂,它们键中的氧都不会是试剂提供的。
因此,以保型进行的A 、C 、D 可能性不大,只有B 是可能的转化步骤。
B 中的反应是按照SN2进行的,由于亲核试剂C2H5OH 从离去基团的背后进攻中心碳原子,所以产物发生构型翻转。
2:写出下列反应的机理。
CH 3CHCH 3OHCH 33CH 3CHCH 3OH33HCH 3CH 3HCH 33(1)O(C 6H 5)2C CC 6H 5OH(2)2)CC HOH CC 6H 5(C 6H 5)2C 6H 5OH(C 6H 5)2C(C 6H 5)2CC C 6H 5OH(C 6H 5)3C CO3:比较下列化合物酸碱性 (1)酸性强弱大顺序ROHOHRH2ORCOOHRH(A)(B)D)(E)(C)答:B>D>C>A>E(2)碱性强弱大顺序RMgXRONaNaOHRCOONaONaR(A)(B)D)(E)(C)答:B<D<C<A<E4.合成麝香是使香料增香和定香的要素,它是个苯环上有五个取代基的芳族化合物,其结构如下,试写出以基本有机化工产品为起始原料的合成路线。
NO 2OMeO 2N硝基是最具有吸电子性的基团,故应最先将其切断。
Me 或t -Bu 基可用傅—克反应加以引入。
OMe 基是强的邻、对位定位基,故只有t -Bu 切断是合理的切断。
起始原料(1)是易得的间单酚,可用任何甲基化试剂加以制得。
常用的是硫酸二甲酯。
OMeMe 2SO 43HNO 3TMOHOMe5:解释下列化合物是否具有旋光活性。
(3)无活性,内消旋酒石酸两个手性碳原子具有相反的构型6:(1)对甲氧基苯氯甲烷р-CH 3OC 6H 4CH 2Cl ,在67%含水丙酮中水解的速度为苄氯的10000倍,而间甲氧基苄氯甲烷水解的速度只有苄氯的2/3,为什么?答:(1)p-CH3O-显+E 效应,而m - CH 3-O-E 效应不能传递仅显示-I 效应,所以中间体碳正离子的安定性次序为:р-CH 3OC 6H 4CH 2C 6H 5CH 2m-CH 3OC 6H 4CH 2(2)CH 3CH 2OCH 2Cl 水解的速度比CH 3CH 2CH 2CH 2Cl 快一亿倍,而CH 3OCH 2CH 2Cl 水解的速度则为CH 3CH 2CH 2CH 2Cl 的0.9倍。
厦门大学有机化学考研真题及答案(2012年)

机密★启用前和使用过程中厦门大学2012年招收攻读硕士学位研究生入学考试试题科目代码:617科目名称:有机化学招生专业:化学系、材料科学与工程系、能源研究院各相关专业考生须知:答题必须使用黑(蓝)色墨水(圆珠)笔;不得直接在试题(草稿)纸上作答;凡未按上述规定作答均不予评阅、判分,责任考生自负。
一、解答下列问题。
(50分)1. (6分)下列烷烃分别在光照条件下与氯气反应都只生成一种一氯代产物,请写出这些烷烃及其一氯代产物的结构简式。
(1) C5H10 (2) C8H18 (3) C5H122. (4分)4,4-二甲基-5-羟基-2-戊酮的红外光谱在1600至1800cm-1区域无吸收峰,而在3000至3400cm-1区域出现一个宽吸收峰,13C NMR在150ppm处无吸收峰,在110ppm处有吸收峰,请给出合理的解释。
3. (3分)分别比较下列各组化合物中哪个酸性较强?4. (3分)写出实现下列转化所需要的试剂:5. (7分)化合物A分别与下列试剂反应,主要有机产物是什么?6. (4分)写出下列各步合成反应中化合物2—5的立体结构式。
7. (3分)写出下列化合物发生硝化反应所得主要产物的结构简式:8. (16分)用反应式表示如何由1-甲基-4-氯苯制备下列化合物:9. (4分)如何用简单的化学方法鉴别下列各组化合物?(1)4-氯苯酚和1-甲基-4-氯苯(2)苯氧基乙烯和乙氧基苯二、写出下列反应的主要有机产物,必要时写明产物的立体构型。
(12分)三、写出下列反应的机理,用弯箭头“”表示电子对的转移,用鱼钩箭头“”表示单电子的转移,并写出各步可能的中间体。
(10分)四、综合题(35分)1. (30分)文献报道的天然产物Patriscabrol(化合物19)和Isopatriscabrol(化合物20)的合成方法如下:(1)(2分)分别用中、英文系统命名法命名化合物1;(2)(14分)写出步骤(A)—(N)所需的试剂及必要的反应条件;(3)(14分)用反应机理解释由化合物10到11的转变过程。
F.A.Carey-最全最完备的高等有机化学习题 详细解答与分析 完美版

Chapter 1 Effect of Substituted in Organic molecule1. 试判断下列各对基团,那一个具有强的-I 效应(即强的吸电子诱导效应):(1) -COOH , -COO -(2) C HN OCH 3 , C H N N(CH 3)2CH 3+(3) C OCH 3 , C CH 2CH 3, (4) SO 2H ,SO 3H(5) OCH 3 , SCH 3 (6) C H C H CH 3 ,C C CH 3(7) N (CH 3)2 , P(CH 3)2 (8) Si(CH 3)3 ,Si(CH 3)2CH 3(9)N(CH 3)3+,NH 2 (10) CN ,CH 2NH 2 (11) SiCH 3 , Cl (12) C C CH 3 ,C H C H CH 3(13),(14)NO 2,NO 2(15) O 2SCH 3, O 2SBr2. 指出下列各对酸中哪一个酸性强(1) H 3NCH 2CH 2COOH , HOCH 2CH 2COOH (2) HC C COOH ,H 2C C H COOH(3) C 6H 5COCH 2COOH , C 6H 5CHOHCH 2COOH(4) C 4H 9CHCOOn,C C CH 3CH 3CH 3CH 3COOHOOC(5) COOH OH, COOH OH(6) BrCH 2CH 2COOH , CH 3CHBrCOOH(7)(H 3C)2CH 2CHCOOH,H 2CC HCH 2COOH(8) HC C COOH , SCOOH(9) CH 2(COOH)2 ,HOOCH CCOOCl(10) CH 3OCH 2CH 2COOH , CH 3SCH 2CH 2COOH (11) CH 3SCH 2COOH ,CH 3SO 2COOH(12)OHCCOOH,COOHCHO(13)OHC(CH 3)3(H 3C)3C,OH3)3CH 3(H 3C)3C(14) H 3COCOOH ,OCH 3COOH(15) C 6H 5CH 2SeH ,H 3CSeH3. 预料以下各对化合物,何者具有更强的酸性? (1) CH 3NO 2 ,(CH 3)2CHNO 2(2) CH 2(SO 2C 6H 5)2 ,CH 2(SOC 6H 5)2(3) H 3CCH(C 6H 5)2,(C 6H 5)2CHCH 2C 6H 5 (4) CH 3COCH 2COOCH 3 ,CH 3COCH 2CONH 2 (5) CH 3COCH 2COCH 2F ,CH 3COCHFCOCH 3(6)NOCH 3,NO H 3C(7)SO 2O 2S ,OO(8) NO 2CH 3CH 3H 3C ,NO 2CH 3H 3CCH 3(9)CH3,CH3(10) CH(C 6H 5)2,CH(C 6H 5)2(11) (CH)3Se , (CH 3)2O(12) ,4. 解释以下现象:(1). 杯烯 (Calcene) 的偶极距很大,μ= 5.6 D.(2). 吡咯 μ = 1.80 D ,吡啶 μ = 2.25 D ,且极性相反,如图:NN H5. 比较下列化合物的碱性的强弱:NN(CH 3)2N(C 2H 5)2NH 2N6. 9,10-二氢蒽-1-羧酸(A )和9,10-乙撑蒽-1-羧酸(B )的酸性取决于8-位上取代基X的性质。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
S. Umezawa et al., Bull. Chem. Soc. Jpn., 36, 1150 (1963)
Fukuyama Group - Group Meeting Problems 08/22/2012
1
Ph TsN
TsN3, CuI, TBAI, K2CO3 CH2Cl2, rt; neutral Al2O3 77% TsN
Cl
O
Me
tricyclic compound (except Ph) 4)
i-Pr2NEt CH2Cl2, rt 92%
O t-amyl O O Ph
Me Me O N N
OTBDPS
t-BuPh, 120 ºC 62%
H O
A. G. Myers et al., J. Am. Chem. Soc., 127, 5342 (2005)
2
O Me OBn H
Me
OTES
S (E/Z =4/1)
N
ZnCl2 CH2Cl2, 23 ºC 83% (dr > 19:1)
O3 CH2Cl2, –78 ºC; PPh3 89%
IR 1827, 1714 cm–1
TESOTf Et3SiH CH2Cl2 –78 to 0 ºC 66%
Me
H
O
4
Me AuCl3 (6 mol%) O O CH3CN, rt 90% OH Me O
A. S. K. Hashmi et al., Chem. Eur. J., 3703 (2008)
Fukuyama Group - Group Meeting Problems 08/08/2012
1
NO2 O2N Cl
O
Ph
Y.-Q. Tu et al., Chem. Sci., 3, 1975 (2012)
2
Me Me O H2N O NBoc OTBDPS 1) PhSH, Et3N THF, 70 ºC 95% 2) TMSOTf, 2,ቤተ መጻሕፍቲ ባይዱ-lutidine CH2Cl2, –78 to 0 ºC 98%
3)
H Me OH O OBn
3
Cl Cl OMe
D. Romo et al., J. Org. Chem., 72, 9053 (2007)
TMS
Br Ph
(1.2 eq.) n-BuLi (2.5 eq.) THF, –80 °C 81%
H2SO4 MeOH, 30 °C
O
TMS
Ph 83% M. Segi et al., Tetrahedron Lett., 51, 1294 (2010)
1) TFA CH2Cl2, rt 70 % 2) MsCl, Et3N CH2Cl2, 0 ºC; evap.; H2, Pd/C MeOH, rt, 20%
O HO H N O
A. Brandi et al., Org. Lett., 2, 2475 (2000)
4
EtO2C NO2 (2.0 eq) Ph N Ph BnNH2 reflux 86% O O BnHN O N NHBn
O P O O Cl
CuSO4·5H2O (15 mol%) 1,10-phenanthroline (30 mol%) K3PO4
Br Ph
O O P N O toluene, 135 °C 84% Ph
toluene, 60 °C 47%
Et3N, CH2Cl2 0 °C to rt 92% (2 steps)
3
HO O Br2 (theoretically 3 eq.) Sodium tetraborate THF-NaOH aq. 0 °C 13% O O O
O
T. Rosenau et al., Eur. J. Org. Chem., 2011, 3036 (2011)
4
Me Me2Si OH [Rh(OH)(cod)2] (2.5 mol%) Ligand (6 mol%) mesitylene, 100 °C 75%, 99%ee, dr=19:1 1) TsOH (5 mol%) CH2Cl2, 23 °C 2) toluene, 80 °C 71% (2 steps) Me H H SiMe2
K.A. DeKorver et al., Org. Lett., 14, 1768 (2012)
3
H EtO2C O N OH
CO2H 1) PMBO PPh3, DEAD THF, 0 ºC, 82%
2) o-dichlorobenzene 150 ºC, 73%
tricyclic compound (except for PMB group)
Fukuyama Group - Group Meeting Problems 08/01/2012
1
O Me CONHBn Me CO2Me hυ THF, rt; evap. conc. H2SO4 THF-MeOH rt 50% Me Me O O
O
O NHBn OMe
P. S. Baran et al., Angew. Chem. Int. Ed., 45, 249 (2006)
90 °C; Me2NH (2.2 eq), 0 °C to rt; N cyclopentadiene, NaOMe, 125 °C 51-59% K-P. Meinhardt et al., Org. Synth., 62, 134 (1984)
2
O N O
1) NH2NH2 CH2Cl2, rt 2)
F F F F O O O O PPh2 PPh2
Ligand
N. Cramer et al., Angew. Chem. Int. Ed., 49, 10163 (2010)
