乙二醇
乙二醇工艺的介绍

乙二醇工艺的介绍乙二醇,又称1,2-乙二醇或乙二醇,是一种常用的有机化学物质,属于二元醇类。
它的化学式为C2H6O2,结构式为HO-CH2-CH2-OH。
乙二醇具有无色、无臭、具有黏稠度的液体,具有许多广泛的应用领域,包括化学工业、医药、化妆品、塑料、涂料等。
乙二醇工艺是通过一系列的化学反应和物理处理来制备乙二醇的过程。
下面将介绍乙二醇工艺的主要步骤和关键反应。
1. 乙烯氧化:乙二醇的生产通常是从乙烯开始。
乙烯氧化是乙二醇工艺的第一步。
在工业规模上,乙烯被通过氧化反应转化为环氧乙烷。
这个反应通常在高温和高压下进行,使用催化剂例如银催化剂。
2. 环氧乙烷水解:环氧乙烷经过水解反应得到乙二醇。
水解反应通常在碱性条件下进行,可以使用氢氧化钠或氢氧化钾作为碱催化剂来加快反应速度。
水解反应使环氧乙烷断裂成为乙二醇和乙醇。
3. 精制处理:乙二醇在水中可溶,可以通过蒸馏和分离过程来从反应溶液中纯化。
蒸馏过程中,通过升温将乙二醇汽化,然后通过冷凝器冷凝成液体。
这个过程可以去除杂质,提高乙二醇的纯度。
4. 加氢:乙二醇工艺的最后一个步骤是加氢反应。
加氢反应将未反应的环氧乙烷和其他醇类成分转化为乙二醇。
这个反应使用催化剂,例如金属催化剂如铂、钯或铑。
乙二醇工艺还包括废水处理和能源回收等相关步骤。
废水处理是为了处理生产过程中产生的废水,以减少对环境的污染。
能源回收是通过余热回收和废水处理中的能量回收来提高工艺的能效。
乙二醇工艺的应用非常广泛。
在化工行业中,乙二醇主要用于生产聚酯类化合物,如聚酯纤维、聚酯薄膜和聚酯树脂。
在医药行业,乙二醇被用作药物溶剂和药物传递系统的原料。
在化妆品行业,乙二醇常用于护肤品和化妆品的制造过程中,用作稠化剂和溶剂等。
此外,乙二醇还用于制造颜料、香料、润滑剂和防冻剂等。
总之,乙二醇工艺是一个复杂的过程,包括乙烯氧化、环氧乙烷水解、精制处理和加氢等步骤。
乙二醇在化学工业、医药、化妆品等领域具有广泛的应用,成为重要的有机化学物质之一。
乙二醇

大都处于实验阶段,暂未有工业化进展
草酸酯法(氧化偶联法)
草酸酯法主要是指 CO 气体首先合成草酸二酯,再经催化加氢
我国聚酯产能经过前几年的过度发展,面临产能相对过剩的局 面,并受2008年金融危机的影响装置开工率逐年下降,一些小聚酯 企业逐步退出竞争。2010 年,随着世界经济的进一步复苏,但仍将 保持一定的发展速度,由此对乙二醇的需求将继续增加。另外,随 着我国汽车工业的发展和汽车保有量的增加,乙二醇在防冻液上的 需求量也将会有所增长。由此可以预见,2010 年我国乙二醇的需求 量将仍继续增长。 预计2014年我国对乙二醇的需求量将达 1100.0-1150.0万吨,而届时的生产能力将达到550.0万吨。
有效 甲醇原料 价格低廉, 资源丰富, 收率较高 反应条件 温和适用 范围广
缺点 费大量水
反应条件 苛刻,催化 剂不稳定
DMO 加氢 催化剂寿
命短
研究方向 开发催化剂,减少耗 水量,同时提高环氧 乙烷的转化率和乙二
醇的选择性 开发在较低压力和温 度下显示高活性且稳
定的催化剂 处于实验阶段
氢制 EG 取得了重要进展,加氢压力降为 3MPa。
此后,日本宇部暂停了在草酸酯加氢制乙二醇方面的研究,仅在气
下表为石油法与非石油法优缺点对比
相 法合 成草 酸酯 及碳 酸酯 方面 进行 了 产业 化的 继续 研发 工作 。 于
石油法 直接法 甲醇甲醛法 草酸酯法
优点 历史悠久,
工艺成熟
反应最为 直接,简单
乙二醇的化学结构简式

乙二醇的化学结构简式
乙二醇的结构简式为HOCH2—CH2OH。
一、乙二醇介绍:
乙二醇是一种无色无臭、有甜味的液体,化学式为(CH2OH)2,结构简式为HOCH2—CH2OH,是最简单的二元醇。
能与水、丙酮等互溶,但在醚类中溶解度较小。
乙二醇的熔点是-12摄氏度,沸点是197.3摄氏度。
乙二醇的密度是1.1132g/mL(20摄氏度)。
二、乙二醇储存温度:
乙二醇应该储存在干燥、通风、阴凉的地方,最好的储存温度范围为0-25摄氏度。
如果储存温度过高,乙二醇可能会分解,影响其品质和稳定性;而如果储存温度过低,乙二醇容易结晶,甚至可能形成固体。
因此,在储存乙二醇时,需要注意防止过高和过低的温度。
乙二醇的用途:
1、乙二醇是制造聚酯纤维和树脂的原料。
乙二醇可以制造聚脂钎维和树脂,聚酯纤维具有耐磨、耐皱、弹性好等特点,广泛用于服装家纺、工业等领域。
聚酯树脂具有硬度高、耐热、耐腐蚀等特点,广泛用于涂料、塑料、玻璃钢等领域。
2、乙二醇可以作为防冻剂和致冷剂。
乙二醇可以降低水溶液的冰点,因此可以用来防止汽车、飞机等发动机的冷却系统结冰。
也可以用来制造制冷剂,包括R134a,是一种环保型的氟利昂替代品,广泛用于空调、冰箱等领域。
3、乙二醇可以作为溶剂、增塑剂、吸湿剂、表面活性剂等。
乙二醇可以溶解许多有机物和无机盐,用来制造染料、油墨、化妆品等产品;乙二醇能增加塑料的柔软度和延展性,用来制造增塑剂。
乙二醇可以吸收水分,可以用来制造干燥剂和气体脱水剂;乙二醇的高聚物聚乙二醇是一种相转移催化剂,也是一种表面活性剂,可以改善油水界面的性质。
乙二醇摩尔质量

乙二醇摩尔质量乙二醇,也称为1,2-乙二醇,是一种有机化合物,化学式为C2H6O2,分子量为62.07 g/mol。
乙二醇是一种无色、无味、稠度较高的液体,常用于制造聚酯、溶剂、冷却剂等。
本文将从乙二醇的摩尔质量入手,探讨其在工业和化学中的应用。
一、乙二醇的摩尔质量乙二醇的摩尔质量为62.07 g/mol。
这意味着,每一个摩尔的乙二醇质量为62.07克。
摩尔质量是指一个分子中所有原子的相对原子质量之和,其单位为g/mol。
在化学反应中,摩尔质量是一个非常重要的概念,可以用来计算反应物和产物的质量比等。
二、乙二醇的应用1. 制造聚酯乙二醇是制造聚酯的重要原料。
聚酯是一种高分子化合物,由酸和醇通过酯化反应形成。
乙二醇可以和对苯二甲酸酯反应,生成聚对苯二甲酯(PET),这是一种在饮料瓶、食品包装、纤维等方面广泛使用的聚合物。
2. 溶剂乙二醇是一种常用的溶剂,可以溶解许多有机物和无机物。
由于其低毒性和低挥发性,乙二醇被广泛用于颜料、涂料、染料、树脂等领域。
此外,乙二醇还可以用作洗涤剂和防冻剂。
3. 冷却剂乙二醇是一种优秀的冷却剂,可以用于汽车发动机和空调系统中。
由于其低毒性和低挥发性,乙二醇比传统的冷却剂(如水)更加安全和可靠。
此外,乙二醇还具有较高的沸点和冰点,可以在极端温度下工作。
三、乙二醇的危害乙二醇在一定程度上对人体有害。
长期暴露于乙二醇蒸气中会导致头痛、眼痛、呕吐、呼吸困难等症状。
乙二醇还可以通过皮肤吸收和进食而进入人体。
进食乙二醇会导致肝、肾和神经系统受损。
因此,在使用乙二醇时应注意安全,避免接触和吸入其蒸气。
四、结语乙二醇是一种在工业和化学中广泛应用的化合物,其摩尔质量为62.07 g/mol。
乙二醇可以用于制造聚酯、溶剂、冷却剂等,在人类生活中发挥着重要的作用。
然而,乙二醇也具有一定的危害性,使用时应注意安全。
乙二醇物性数据

乙二醇物性数据乙二醇是一种常用的有机化合物,化学式为C2H6O2,也被称为1,2-乙二醇。
它是一种无色、无臭的液体,可溶于水和许多有机溶剂。
乙二醇具有许多重要的应用领域,包括化工、医药、塑料和纺织等。
以下是乙二醇的一些常见物性数据:1. 密度:乙二醇的密度为1.1134克/立方厘米。
这意味着在常温下,每立方厘米的乙二醇质量为1.1134克。
2. 沸点:乙二醇的沸点为197°C。
这是指在标准大气压下,乙二醇从液态转变为气态的温度。
3. 熔点:乙二醇的熔点为-13°C。
这是指在标准大气压下,乙二醇从固态转变为液态的温度。
4. 折射率:乙二醇的折射率为1.431。
折射率是光线在物质中传播时的弯曲程度的度量,它与物质的光密度有关。
5. 摩尔质量:乙二醇的摩尔质量为62.07克/摩尔。
摩尔质量是指一摩尔物质的质量,以克为单位。
6. 热导率:乙二醇的热导率为0.245瓦特/米·开尔文。
热导率是指物质传导热量的能力,它与物质的热性质有关。
7. 比热容:乙二醇的比热容为2.43焦耳/克·开尔文。
比热容是指单位质量物质在温度变化时吸收或释放的热量。
8. 溶解性:乙二醇是一种良好的溶剂,可溶于水和许多有机溶剂,如乙醚、苯和甲醇等。
9. 蒸汽压:乙二醇的蒸汽压随温度的升高而增加。
在20°C下,乙二醇的蒸汽压约为0.08毫巴。
10. 燃点:乙二醇的燃点为111°C。
这是指乙二醇与空气中的氧气形成可燃混合物时,开始燃烧的最低温度。
以上是乙二醇的一些常见物性数据。
这些数据对于研究乙二醇的性质、应用以及处理过程中的参数选择都非常重要。
请注意,这些数据是根据常规实验条件得出的,实际应用中可能会受到其他因素的影响。
因此,在具体应用中,建议参考相关的实验数据和文献资料,以获得更准确的物性数据。
乙二醇物性数据

乙二醇物性数据乙二醇(Ethylene Glycol)是一种无色、无味的有机化合物,化学式为C2H6O2。
它是一种重要的工业化学品,广泛应用于制造聚酯纤维、溶剂、冷却剂等领域。
在本文中,我们将详细介绍乙二醇的物性数据,包括密度、沸点、熔点、折射率等。
1. 密度:乙二醇的密度是指在特定条件下单位体积的质量。
乙二醇的密度随温度的变化而变化,以下是乙二醇在不同温度下的密度数据(单位:g/cm³):- 20℃:1.113- 25℃:1.113- 30℃:1.1122. 沸点:乙二醇的沸点是指在标准大气压下液体变为气体的温度。
以下是乙二醇的沸点数据(单位:℃):- 197.33. 熔点:乙二醇的熔点是指在标准大气压下固体变为液体的温度。
以下是乙二醇的熔点数据(单位:℃):- -13.24. 折射率:乙二醇的折射率是指光线通过乙二醇时的折射程度。
以下是乙二醇在不同波长下的折射率数据:- 589.3 nm:1.431- 546.1 nm:1.434- 435.8 nm:1.4395. 比热容:乙二醇的比热容是指单位质量的乙二醇在温度变化时吸收或释放的热量。
以下是乙二醇在不同温度下的比热容数据(单位:J/(g·℃)):- 20℃:2.43- 25℃:2.43- 30℃:2.436. 粘度:乙二醇的粘度是指液体内部分子间相互作用力的表现,也可理解为液体的黏稠程度。
以下是乙二醇在不同温度下的粘度数据(单位:mPa·s):- 20℃:16.9- 25℃:15.6- 30℃:14.37. 溶解性:乙二醇具有良好的溶解性,可溶于水和许多有机溶剂。
以下是乙二醇在不同温度下的溶解度数据(单位:g/100g溶剂):- 20℃:无限溶解- 25℃:无限溶解- 30℃:无限溶解以上是乙二醇的一些基本物性数据,这些数据可用于工业生产和科学研究中的相关计算和实验设计。
请注意,乙二醇的物性数据可能会因样品来源、纯度等因素而略有差异,因此在具体应用中应以实际测量值为准。
乙二醇
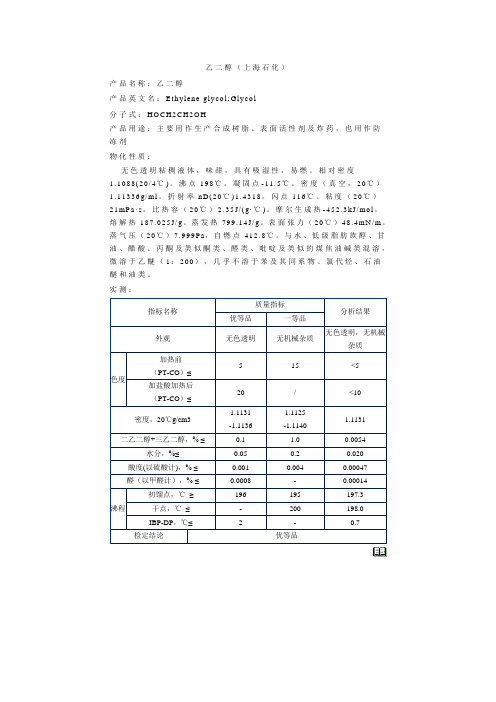
乙二醇(上海石化)
产品名称:乙二醇
产品英文名:E t h yl en e gl yc o l;Gl yc o l
分子式:H O C H2C H2O H
产品用途:主要用作生产合成树脂、表面活性剂及炸药,也用作防
冻剂
物化性质:
无色透明粘稠液体,味甜,具有吸湿性,易燃。
相对密度
1.1088(20/4℃)。
沸点198℃。
凝固点-11.5℃。
密度(真空,20℃)1.11336g/ml。
折射率n D(20℃)1.4318。
闪点116℃。
粘度(20℃)21mP a·s。
比热容(20℃)
2.35J/(g·℃)。
摩尔生成热-452.3kJ/mo l。
熔解热187.025J/g。
蒸发热799.14J/g。
表面张力(20℃)48.4mN/m。
蒸气压(20℃)7.999P a,自燃点412.8℃。
与水、低级脂肪族醇、甘油、醋酸、丙酮及类似酮类、醛类、吡啶及类似的煤焦油碱类混溶,微溶于乙醚(1:200),几乎不溶于苯及其同系物、氯代烃、石油
醚和油类。
实测:。
乙二醇爆炸下限

乙二醇爆炸下限1. 介绍乙二醇乙二醇(Ethylene Glycol)是一种常见的有机化合物,化学式为C2H6O2。
它是一种无色、无味、粘稠的液体,在室温下可以溶解在水中。
乙二醇具有广泛的应用领域,包括制造聚酯纤维、塑料、冷却剂和溶剂等。
2. 乙二醇的爆炸性质乙二醇在特定条件下可能发生爆炸。
为了安全使用乙二醇,我们需要了解其爆炸下限。
2.1 爆炸下限的定义爆炸下限(Lower Explosive Limit, LEL)指的是混合气体中可导致爆炸发生的最低浓度。
当气体浓度高于爆炸下限时,遇到火源或者电火花等能量源,就有可能引发爆炸。
2.2 确定乙二醇的爆炸下限确定乙二醇的爆炸下限需要进行实验或者参考相关文献数据。
根据已有数据,乙二醇的爆炸下限为3.2%(体积分数)。
3. 影响乙二醇爆炸下限的因素乙二醇的爆炸下限受到多种因素的影响,以下是一些常见的因素:3.1 温度温度对乙二醇的蒸气压和浓度有重要影响。
通常情况下,温度越高,乙二醇蒸气压越高,浓度也会增加,从而使得爆炸下限降低。
3.2 氧气浓度氧气是支持燃烧的必要条件之一。
当氧气浓度低于一定程度时,即使乙二醇浓度达到爆炸下限,也无法发生爆炸。
因此,在空气中使用乙二醇时需要注意空气中的氧含量。
3.3 其他物质的存在其他物质的存在也可能对乙二醇的爆炸性质产生影响。
例如,某些化学物质可以与乙二醇反应生成易燃或者易爆物质,增加了发生爆炸的风险。
4. 安全措施为了防止乙二醇发生爆炸,我们需要采取一系列的安全措施:4.1 控制温度尽量控制乙二醇的使用温度,避免过高的温度导致乙二醇蒸气压增加,从而使得爆炸下限降低。
4.2 确保充足通风使用乙二醇时,应确保有足够的通风,以保持空气中的氧含量。
这样可以防止氧气浓度过低导致无法发生爆炸。
4.3 防止与其他物质接触避免乙二醇与其他物质接触,特别是那些可能与乙二醇发生反应生成易燃或者易爆物质的物质。
4.4 使用适当的防护设备在处理乙二醇时,应佩戴适当的个人防护设备,包括手套、护目镜和防护服等。
乙二醇

乙二醇1.物化性质乙二醇 ethylene glycol,又名甘醇、1,2-亚乙基二醇,简称EG。
结构式HOCH2CH2OH,分子式C2H6O2,相对密度1.1132。
折射率1.4306(25℃)。
凝固点-12.6℃。
沸点197.2℃。
自燃温度400℃。
闪点110℃。
自燃点412℃,爆炸极限3.2%~15.3%。
很易吸湿。
能与水、乙醇和丙酮混溶。
能大大降低水的冰点。
微溶于乙醚。
乙二醇在常温下为无色、无臭、有甜味的粘稠液体。
无气味,有甜味,稳定无腐蚀性。
它可燃但不易燃。
它被《欧洲委员会危险品导则》分类为“有害物质”。
如果被误吞的话,二醇类化合物都是慢性毒物。
过度暴露在它的蒸汽中,能对眼、鼻和咽喉产生刺激作用。
2.技术进展工业上,现在唯一的大规模生产乙二醇的方法是环氧乙烷水解法。
早期的环氧乙烷是通过氯乙醇制取的,而现在这种方法已被直接氧化法取代,即在空气或氧气存在条件下,通过氧化银催化剂对乙烯进行氧化,然后环氧乙烷水解分馏制得乙二醇。
这一工艺的乙二醇选择性低,需要20倍于环氧乙烷摩尔数的水才能达到90%的乙二醇收率。
典型的水解工艺描述如下:将环氧乙烷和来自环氧乙烷装置的环氧乙烷水溶液送入氧化物——水混合器,使之与加入的补充水及循环水混合,使混合物中水和环氧乙烷的摩尔比达到22:1。
从混合器流出的混合物首先用第四效蒸发器——再沸器出来的冷凝液加热,然后通过与蒸汽的热交换使其温度达到150℃。
混合物进入乙二醇反应器,在150℃,1.38MPa压力条件下进行反应,生成乙二醇和少量的二甘醇、三甘醇和聚乙二醇残渣。
此工艺中乙二醇的选择性为88.4%,二甘醇为10.3%,三甘醇为0.5%。
为了克服上述工艺水与环氧乙烷摩尔比很高的缺点,许多石化公司力图开发出环氧乙烷催化水合制乙二醇的工艺。
UCC公司着重进行这方面的开发工作。
该公司开发了两种阴离子水合催化剂,主要是钼酸盐、钨酸盐、钒酸盐;另一种是三苯基膦络合催化剂。
乙二醇稀释方法

乙二醇稀释方法乙二醇是一种常见的有机化合物,具有多种用途,例如作为溶剂、防冻剂、湿润剂和制冷剂等。
在许多行业中都会用到乙二醇,而有时候我们需要对乙二醇进行稀释,以符合特定的要求。
乙二醇的稀释方法有很多种,可以根据具体的需求选择合适的方法。
下面将介绍一些常见的乙二醇稀释方法,希望能够对您有所帮助。
一、水稀释法水稀释法是乙二醇稀释的常见方法之一。
首先需要准备好一定比例的乙二醇和水,然后将它们按照一定的比例混合均匀即可。
在实际操作中,需要注意乙二醇和水的比例,一般来说,稀释的比例会根据具体的使用要求而有所不同。
在进行混合的过程中,需要充分搅拌确保混合均匀。
这种方法简单易行,成本较低,是一种常见的常规稀释方法。
二、酒精稀释法酒精稀释法是另一种常见的乙二醇稀释方法。
在这种方法中,我们将乙二醇和酒精按照一定的比例混合,然后进行充分搅拌混合。
酒精可以帮助乙二醇更好地溶解,并且在一些特定的应用中,酒精稀释法可以帮助提高乙二醇的挥发性能,使其更适合特定的使用环境。
需要注意的是,酒精稀释法需要选择合适的酒精品种,并且在混合的过程中需要小心操作,确保安全性。
三、稀释剂稀释法除了水和酒精,还可以选择其他稀释剂来进行乙二醇的稀释。
丙二醇和丁二醇都可以作为乙二醇的稀释剂。
这些稀释剂在一些特定的应用中,可能会比水和酒精更加适合,因此在选择稀释剂时需要根据具体的使用要求来进行选择。
这种方法适用于对乙二醇的特性要求较高的情况,但需要注意稀释剂的选择和混合比例的控制。
四、物理稀释法物理稀释法是通过物理手段来进行乙二醇的稀释。
可以通过加热的方式来使乙二醇变为液态,然后再加入适量的稀释剂进行混合。
这种方法适用于一些特殊的情况,可以帮助实现特定的稀释要求,但在操作过程中需要注意加热温度和混合均匀度的控制,确保稀释效果和安全性。
五、化学稀释法化学稀释法是通过化学反应来实现乙二醇的稀释。
可以选择在乙二醇中加入适当的化学物质,使其与乙二醇发生反应,从而实现稀释的目的。
乙二醇是什么东西 主要用途

乙二醇是什么东西主要用途乙二醇(又称为1,2-乙二醇、乙二醇、1,2-双羟基乙烷、MEG或MECH等)是一种无色、无臭、粘稠液体,化学式为C2H6O2。
它由两个羟基(醇基,-OH)与一个乙烷分子结合而成。
乙二醇在室温下可以溶解于水,并具有较好的稳定性。
乙二醇具有许多重要的用途,主要体现在以下几个方面:1. 化工原料:乙二醇是一种重要的化工原料,广泛应用于生产聚酯、溶剂、冷却剂、防冻剂、涂料、油墨等。
其中,乙二醇是用于生产聚酯纤维的重要原料,如聚酯纤维(PET),广泛应用于制造纺织品、塑料瓶等。
此外,在油漆和涂料中,乙二醇可以作为稀释剂、湿润剂,提高涂料的流动性和涂料的附着性。
2. 化妆品和个人护理产品:乙二醇也被广泛应用于化妆品和个人护理产品中。
在护肤品中,乙二醇被用作湿润剂、溶剂和柔软剂,有助于提高产品的质地和吸收性。
在化妆品中,乙二醇可用作固定剂、稳定剂和乳化剂,改善产品的稳定性和延长其保质期。
3. 药物和医疗用途:乙二醇在医药领域也具有重要的应用,例如,它是制备某些药物的溶剂,可用于制备注射剂、口服药和外用药。
此外,乙二醇还用于制备软膏、凝胶和乳剂。
4. 冷却剂和防冻剂:由于乙二醇具有低冰点和高沸点的特性,它被广泛应用于冷却系统和防冻系统中,如汽车冷却系统和空调系统。
乙二醇可以防止水在低温下冻结,并提高液体的沸点,从而保护引擎和冷却系统不受损坏。
5. 化学反应及催化剂:乙二醇还可以作为多种化学反应的溶剂或催化剂,例如用于制备酯类或醚类化合物,还可参与其他有机合成反应的中间体反应。
总结来说,乙二醇在工业和日常生活中具有广泛的应用。
无论是作为化工原料、化妆品、药物、冷却剂还是催化剂,乙二醇都发挥着不可或缺的作用。
然而,需要注意的是,乙二醇在高剂量下有毒性,因此在使用时需要小心,并遵循相应的安全操作规程。
乙二醇

乙二醇
乙二醇,又名甘醇,英文名称为Ethylene glycol;gylcol;ethanediol。
有甜味的无色粘稠液体,无气味,无机械杂质,允许有轻微乳光,无色或微黄色。
一、制备或来源
由环氧乙烷水合、氯乙醇水解、二氯乙烷水解;或由乙烯在催化剂存在下氧化成乙二醇二乙酸酯后水解而得。
三、用途
主要用作聚脂纤维(涤纶)的原料,并用于其他聚脂树脂、不饱和聚脂树脂和1730聚脂漆。
由乙二醇和聚乙二醇能衍生出多种类型的表面活性剂。
其二硝基化合物二硝基乙二醇是炸药。
乙二醇可降低水溶液冰点,故常用作防冻剂。
四、毒性及防护
对低级脊椎动物无严重毒性,但对人类则不同。
由于乙二醇沸点高,蒸气压低,一般不存在吸入中毒现象。
对未破损皮肤的渗入量小。
对眼可引起刺激。
但大量饮用会刺激中枢神经,引起呕吐、疲倦、昏睡、呼吸困难、震颤、肾脏充血和出血、脂肪肝、尿闭、支气管炎、肺炎等,严重时甚至导致死亡。
乙二醇的特性

环境标准
车间空气中有害物质的最高容许浓度 5 毫克/立方米 水体中有害有机物的最大允许浓度 1.0mg/L 嗅觉阈浓度 90mg/m3 乙二醇的物化性质: 乙二醇的物理性质“ 别名 甘醇 分子式 C2H6O2;HOCH2CH20H 分子量 62.07 熔点 -13.2℃ 沸点:197.5℃ 密度 相对密度(水=1)1.11;相对密度(空气=1)2.14 外观与性状 无色、无臭、有甜味、粘稠液体 蒸汽压 6.21kPa/20℃ 闪点:110℃ 溶解性 与水混溶,可混溶于乙醇、醚等 稳定性 稳定 乙二醇的化学性质: 化 学 性 质 与 乙 醇 相 似 ,主 要 能 与 无 机 或 有 机 酸 反 应 生 成 酯 ,一 般 先 只 有 一 个 羟 基 发 生 反 应 , 经升高温度、增加酸用量等,可使两个羟基都形成酯。如与混有硫酸的硝酸反应,则形成二硝 酸酯。酰氯或酸酐容易使两个羟基形成酯。 乙二醇在催化剂(二氧化锰、氧化铝、氧化锌或硫 酸)作用下加热,可发生分子内或分子间失水。 乙二醇能与碱金属或碱土金属作用形成醇盐。 通 常 将 金 属 溶 于 二 醇 中 ,只 得 一 元 醇 盐 ;如 将 此 醇 盐( 例 如 乙 二 醇 一 钠 )在 氢 气 流 中 加 热 到 180~ 200°C,可形成乙二醇二钠和乙二醇。此外用乙二醇与 2 摩尔甲醇钠一起加热,可得乙二醇二 钠。乙二醇二钠与卤代烷反应,生成乙二醇单醚或双醚。乙二醇二钠与 1,2-二溴乙烷反应, 生成二氧六环。 此外,乙二醇也容易被氧化,随所用氧化剂或反应条件的不同,可生成各种产 物,如乙醇醛 HOCH2CHO、乙二醛 OHCCHO、乙醇酸 HOCH2COOH、草酸 HOOCCOOH 及二氧化碳和水。 a 二醇与其他二醇不同,经高碘酸氧化可发生碳链断裂。 制法 工业上由环氧乙烷用稀盐酸水解 制得。实验室中可用水解二卤代烷或卤代乙醇的方法制备。 应用 乙二醇常可代替甘油使用。 在制革和制药工业中,分别用作水合剂和溶剂。乙二醇的衍生物二硝酸酯是炸药。乙二醇的单 甲醚或单乙醚是很好的溶剂,如甲溶纤剂 HOCH2CH2OCH3 可溶解纤维、树脂、油漆和其他许多 有 机 物 。乙 二 醇 的 溶 解 能 力 很 强 ,但 它 容 易 代 谢 氧 化 ,生 成 有 毒 的 草 酸 ,因 而 不 能 广 泛 用 作 溶 剂。乙二醇是一个抗冻剂,60%的乙二醇水溶液在-40°C 时结冰。" 乙二醇的主要用途: 用于制造树脂、增塑剂,合成纤维、化妆品和炸药,并用作溶剂、 配制发动机的抗冻剂 也可用于玻璃纸、纤维、皮革、粘合剂的湿润剂。
乙二醇

性质物理性质:CAS号107-21-1 中文名称乙二醇乙二醇的球棍模型EINECS 登录号203-473-3 英文名称Ethylene Glycol,Mono ethylene glycol,MEG,EG. 英文别名: glycol, 1,2-ethanediol. 别名甘醇分子式:C2H6O2;结构简式:HO-CH2CH2-OH 分子量:62.07 冰点:-13.2℃沸点:197.85℃密度:相对密度(水=1)1.1155(20℃);相对密度(空气=1)2.14 外观与性状:无色、无臭、有甜味、粘稠液体蒸汽压:6.21kPa/20℃闪点:111.1℃粘度:25.66mPa.s(16℃)溶解性:与水/乙醇/丙酮/醋酸甘油吡啶等混溶,微溶于醚等,不溶于石油烃及油类,能够溶解氯化锌/氯化钠/碳酸钾/氯化钾/碘化钾/氢氧化钾等无机物。
表面张力:46.49 mN/m (20℃) 稳定性:稳定燃点:418℃编辑本段化学性质由于分子量低,性质活泼,可起酯化/醚化/醇化/氧化/缩醛/脱水等反应。
与乙醇相似,主要能与无机或有机酸反应生成酯,一般先只有一个羟基发生反应,经升高温度、增加酸用量等,可使两个羟基都形成酯。
如与混有硫酸的硝酸反应,则形成二硝酸酯。
酰氯或酸酐容易使两个羟基形成酯。
乙二醇在催化剂(二氧化锰、氧化铝、氧化锌或硫酸)作用下加热,可发生分子内或分子间失水。
乙二醇能与碱金属或碱土金属作用形成醇盐。
通常将金属溶于二醇中,只得一元醇盐;如将此醇盐(例如乙二醇一钠)在氢气流中加热到180~200C,可形成乙二醇二钠和乙二醇。
此外用乙二醇与2摩尔甲醇钠一起加热,可得乙二醇二钠。
乙二醇二钠与卤代烷反应,生成乙二醇单醚或双醚。
乙二醇二钠与1,2-二溴乙烷反应,生成二氧六环。
此外,乙二醇也容易被氧化,随所用氧化剂或反应条件的不同,可生成各种产物,如乙醇醛HOCH2CHO、乙二醛OHCCHO、乙醇酸HOCH2COOH、草酸HOOCCOOH 及二氧化碳和水。
乙二醇 分析方法

乙二醇分析方法
乙二醇是一种常用的有机化合物,常用于工业化学和制药工业中。
乙二醇的分析方法通常包括以下几种:
1. 气相色谱法(GC):乙二醇可以通过气相色谱法分离和定量分析。
该方法可以在分析前对样品进行蒸馏或提取来提高分析的准确性和灵敏度。
2. 液相色谱法(HPLC):HPLC在乙二醇的分析中也是常用的方法之一。
它采用液相柱进行分离和定量,可以选择不同的检测器进行分析,如紫外检测器或荧光检测器。
3. 红外光谱法(IR):利用乙二醇分子特征的红外吸收峰可以进行定性和定量分析。
通过红外光谱仪测定样品的红外吸收谱图,可以确定乙二醇的存在和浓度。
4. 近红外光谱法(NIR):近红外光谱法是一种快速、非破坏性的分析方法,可以用于乙二醇的定性和定量分析。
该方法通过测量样品在近红外光谱范围内的吸收、散射和透射等光学性质,建立相关模型进行分析。
5. 傅里叶变换红外光谱法(FT-IR):FT-IR是一种高分辨率和高灵敏度的分析方法,可以用于乙二醇的结构表征和定量分析。
通过测量样品在不同波数下的红外吸收峰,可以确定乙二醇的存在和含量。
这些方法在乙二醇的分析中都具有一定的优势,选择适合的分析方法需要根据具体的分析要求和实际情况进行评估和选择。
乙二醇的性质与用途

乙二醇的性质与用途乙二醇的填充模型乙二醇(ethylene glycol)又名“甘醇”、“1,2-亚乙基二醇”,简称EG。
化学式为(HOCH2)₂,是最简单的二元醇。
乙二醇是无色无臭、有甜味液体,对动物有毒性,人类致死剂量约为1.6 g/kg。
乙二醇能与水、丙酮互溶,但在醚类中溶解度较小。
用作溶剂、防冻剂以及合成涤纶的原料。
乙二醇的高聚物聚乙二醇(PEG)是一种相转移催化剂,也用于细胞融合;其硝酸酯是一种炸药。
性质参数CAS号107-21-1中文名称乙二醇乙二醇的球棍模型EINECS 登录号203-473-3英文名称Ethylene glycol,Mono ethylene glycol,MEG,EG.英文别名: glycol, 1,2-ethanediol.别名甘醇分子式C2H6O2;结构式:HOCH2CH2OH分子量62.07熔点-13.2℃沸点:197.85℃密度相对密度(水=1)1.1155(20℃);相对密度(空气=1)2.14外观与性状无色、无臭、有甜味、粘稠液体蒸汽压 6.21kPa/20℃闪点:111.1℃粘度:25.66mPa.s(16℃)溶解性与水/乙醇/丙酮/醋酸甘油吡啶等混溶,、微溶于醚等,不溶于石油烃及油类.能够理解氯化锌/氯化钠/碳酸钾/氯化钾/碘化钾/氢氧化钾等无机物.表面张力:46.49 mN/m (20℃)稳定性稳定燃点:118℃化学性质:由于分子量低,性质活泼,可起酯化/醚化/醇化/氧化/缩醛/脱水等反应,主要用途主要用于制聚酯涤纶,聚酯树脂、吸湿剂,增塑剂,表面活性剂,合成纤维、化妆品和炸药,并用作染料/油墨等的溶剂、配制发动机的抗冻剂,气体脱水剂.健康危害毒性:大鼠经口LD50=5.8ml/kg,小鼠经口LD50=1.31-13.8ml/kg.侵入途径:吸入、食入、经皮吸收。
健康危害:国内未见相品急慢性中毒报道。
国外的急性中毒多系因误报。
吸入中毒表现为反复发作性昏厥,并可有眼球震颤,淋巴细胞增多。
乙二醇代谢

乙二醇代谢
乙二醇是一种简单的二醇,其化学式为C2H6O2。
在生物体内,乙二醇可以通过多种代谢途径进行转化,下面详细介绍这些代谢过程。
首先,乙二醇可以在醇脱氢酶的作用下被氧化成乙二醛。
这个反应需要消耗NADH或NADPH作为还原剂,同时会产生H2O和CO2。
乙二醛也可以通过进一步的氧化反应被分解成乙酰CoA,这是脂肪酸和胆固醇合成的原料。
其次,乙二醇也可以被氧化成乙酸。
这个反应需要依赖于乙二醇氧化酶的催化作用,同时需要O2作为氧化剂。
乙酸是生物体内重要的代谢中间产物,可以参与到许多生化反应中,如脂肪酸的合成和氧化、胆固醇的合成等。
此外,乙二醇也可以通过糖酵解途径被转化为葡萄糖。
这个过程需要依赖于丙酮酸激酶的催化作用,同时需要消耗ATP。
生成的葡萄糖可以进一步参与到糖代谢中,如糖酵解、糖异生等。
最后,乙二醇也可以通过一些非氧化代谢途径进行转化。
例如,它可以被转化为甘油,这是生物体内的一种重要的中性脂质前体。
此外,乙二醇也可以参与到一些其他的生化反应中,如磷脂的合成、蛋白质的翻译后修饰等。
总之,乙二醇在生物体内的代谢过程涉及到多种代谢途径,这些代谢途径对于生物体的正常生长和发育具有重要意义。
了解乙二醇的代谢过程有助于深入理解生物体的代谢机制,并为相关生物工程和药物研发提供理论支持。
乙二醇

乙二醇一、乙二醇简介乙二醇(ethylene glycol)又名“甘醇”、“1,2-亚乙基二醇”,简称EG。
化学式为(HOCH2)₂,是最简单的二元醇。
乙二醇是无色无臭、有甜味液体,对动物有毒性,人类致死剂量约为1.6 g/kg。
乙二醇能与水、丙酮互溶,但在醚类中溶解度较小。
用作溶剂、防冻剂以及合成涤纶的原料。
乙二醇的高聚物聚乙二醇(PEG)是一种相转移催化剂,也用于细胞融合;其硝酸酯是一种炸药。
二、物理性质冰点: -12.6℃沸点:197.3℃密度:相对密度(水=1)1.1155(20℃);相对密度(空气=1)2.14 外观与性状:无色、有甜味、粘稠液体蒸汽压:0.06mmHg(0.06毫米汞柱)/20℃闪点:111.1℃粘度:25.66mPa.s(16℃)[1]溶解性:与水/乙醇/丙酮/醋酸甘油吡啶等混溶,微溶于乙醚,不溶于石油烃及油类,能够溶解氯化锌/氯化钠/碳酸钾/氯化钾/碘化钾/氢氧化钾等无机物。
表面张力:46.49 mN/m (20℃)燃点:418℃燃烧热:1180.26KJ/mol在25摄氏度下,相对介电常数为37浓度较高时易吸潮三、化学性质由于分子量低,性质活泼,可起酯化/醚化/醇化/氧化/缩醛/脱水等反应。
乙二醇的结构与乙醇相似,主要能与无机或有机酸反应生成酯,一般先只有一个羟基发生反应,经升高温度、增加酸用量等,可使两个羟基都形成酯。
如与混有硫酸的硝酸反应,则形成二硝酸酯。
酰氯或酸酐容易使两个羟基形成酯。
乙二醇在催化剂(二氧化锰、氧化铝、氧化锌或硫酸)作用下加热,可发生分子内或分子间失水。
乙二醇能与碱金属或碱土金属作用形成醇盐。
通常将金属溶于二醇中,只得一元醇盐;如将此醇盐(例如乙二醇一钠)在氢气流中加热到180~200°C,可形成乙二醇二钠和乙二醇。
此外用乙二醇与 2摩尔甲醇钠一起加热,可得乙二醇二钠。
乙二醇二钠与卤代烷反应,生成乙二醇单醚或双醚。
乙二醇二钠与1,2-二溴乙烷反应,生成二氧六环。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
Chapter 2 生产工艺概述 煤化路线
c.合成气间接合成路线 • 甲醇甲醛合成法 (2)二甲醚(DME)氧化偶联法 有研究者采用甲醇制备二甲醚,然后二甲醚偶联生成二甲氧基乙烷,然后在酸催化剂 作用下生成乙二醇。氧化偶联的催化剂采用将氧化镁浸渍金属硝酸盐后与硅胶进行高 温焙烧。反应条件为:200 ℃、1621.28 kPa、进料量3.8 g/(mol· h)、n(DME)n(02)=5.0 下,DME的转化率为10.8%,二甲氧基乙烷的选择性为34.5%,反应的副产物主要是甲 醇,而甲醇又可转化为二甲醚进行循环使用,产物EG的最终选择性可达88%。但此工 艺热力学上难度较大,需做进一步的研究。
pter 1 摘要
Chapter 1 摘要
目前乙二醇的工业生产方法主要是由乙烯氧化生成环氧乙烷、环氧乙烷水合 生成乙二醇,该工艺路线完全依赖于不可再生的石油资源。环氧乙烷来自石 油乙烯,乙二醇装置要依托乙烯工厂建设,由此决定国内乙二醇生产能力主 要集中在大型石化企业
成本高
流程长
能耗高 设备多
Chapter 2 生产工艺概述 石油路线工艺
b.催化水合法
Chapter 2 生产工艺概述 石油路线工艺
a.催化水合法 国内的大连理工大学非均相催化剂方面研发的磷铝酸钾/γ-Al2O3催化剂,在反应温度 140℃,反应压力1.0MPa,水比5:1下EO的转化率为80%,EG的选择性70%;在均相 催化剂中,KI/K3PMO1-7H2O复合物催化剂,在反应温度100--150℃,反应压力 0.8~2.1 MPa,水比4~8:1下EO转化率为95-99.9%,EG选择性96%。上海石油化工研 究院研发的固体酸非均相催化剂,在反应温度150℃,反应压力1.5 MPa,水比8:1下 EO转化率为100%,EG选择性90%。催化水合法优点比较明显,但也存在不少缺点, 主要体现在目前研发的催化水合法催化剂稳定性较差,使用寿命短,催化剂制备复杂 、催化剂回收困难等问题。因此也限制此工艺的发展。
Chapter 2 生产工艺概述 煤化路线
c.合成气间接合成路线 • 甲醇甲醛合成法 (3)羟基乙酸法 羟基乙酸法使用甲醛、CO和水在高温、高压、酸催化剂作用下,缩合成羟基乙醇,羟 基乙酸与甲醇酯化反应生成羟基乙酸甲酯,羟基乙酸甲酯在200.225℃、2.4 MPa条件下 ,以亚铬酸铜为催化剂加氢反应得到乙二醇。 HCHO+CO+H2O——HOCH2COOH HOCH2COOH+CH3OH——HOCH2COOCH3+H2O HOCH2COOCH3+2H2——HOCH3CH2OH+CH3OH 此法的主要的缺点在于偶联反应中采用的催化剂为硫酸或氢氟酸,对设备的腐蚀特别 严重。后来有研究者对此方法进行改进,将反应的前两步骤进行合并,甲醛、一氧化 碳、水和甲醛发生酯化反应,酯化产物再通过加氢过程生成乙二醇,采用铜或银为催 化剂活性组分,在浓H2S04或BH3等强酸条件下发生反应。虽然反应条件缓和了不少, 但仍难以工业化。
Chapter 2 生产工艺概述 煤化路线
b.CO合成气一步合成法 合成气一步合成乙二醇是美国DoPont公司最先提出的,是原子利用率最高的合成法, 其反应式如下: 2CO+3H2—HOCH2CH2OH 从原子反应和经济角度来看,该方法具有很大的优越性,但反应热力学上很难进行, 对反应过程吉布斯自由能计算,该反应为自由能增加的反应,反应自由能6.60×104J /mol这就要求苛刻的反应条件下才能进行反应。DoPont公司早期的钴催化剂,即使在 高温、高压的反应条件下,EG的收率也很低;后来美国UCC公司开发了铹催化剂【1明 由合成气制乙二醇,但反应条件依然苛刻,需要反应压力340MPa,同时催化剂稳定性 差、活性很低,不能满足工业化的要求。
• 碳酸二甲酯(DMC)和乙二醇(EG)联产法 C2H4O+CO2—C3H4O3 C3H4O3+2CH3OH—HOCH2CH2OH+(CH3O)2CO
Chapter 2 生产工艺概述 石油路线工艺
c.碳酸乙烯酯法
• 碳酸乙烯酯水解法 碳酸乙烯酯水解法制乙二醇的工艺由美国哈尔康、道化学和日本触媒公司在上世纪研 发出来,虽然基本原理相同,但各公司的工艺技术各有特点。哈尔康公司的技术特点 在于加成反应和水解反应使用的是同一种催化剂,这就解决了均相催化剂难回收的问 题,但其水解反应需要高压条件才能反应,使得反应器材质和投资问题一直是限制该 工艺大规模化障碍。而日本触媒公司的技术是在较低的反应条件下得到较高的收率
Chapter 2 生产工艺概述 石油路线工艺
c.碳酸乙烯酯法 • 碳酸二甲酯(DMC)和乙二醇(EG)联产法 此方法需要两步完成,首先第一步环氧乙烷和二氧化碳反应生成碳酸乙烯酯,然后碳 酸乙烯酯与甲醇再反应,生成碳酸二甲酯和乙二醇。这种联产技术的优势比较明显, 可以使乙烯制环氧乙烷时副产的二氧化碳充分再利用,降低碳酸二甲酯和乙二醇的成 本。对于这项技术研究国外的单位有陶氏化工和德士古等公司。陶氏技术特点在于及 时移走反应产物碳酸二甲酯和甲醇,减少他们形成共沸物,提高反应的平衡转化率, 提高乙二醇的收率。德士古公司在催化剂的研发取得突破,研发出一种离子交换树脂 ,使得碳酸二甲酯和乙二醇的选择性有了很大的提高,推动此项技术的工业化。国内 的中科院兰州化物所也对此工艺路线进行研究,取得不错的成绩,现已进行了实验中 试,这将使国内乙二醇生产具有竞争力。碳酸乙烯酯法制乙二醇工艺的技术难点一直 是均相催化剂的回收再利用问题,所以今后的研究重点还是在开发出性能优良的非均 相催化剂上。
Chapter 2 生产工艺概述 煤化路线
c.合成气间接合成路线 • 甲醇甲醛合成法 (1)甲醇自由基聚合法 甲醇的聚合法从反应机理来看属于自由基反应机理,甲醇在引发剂的作用下生成 · CH20H自由基,然后两个· CH2OH自由基发生终止反应生成HOCH2CH2OH。其反应 反应方程式如下: CH3OH--· CH2OH+· H 2· CH2OH—HOCH2CH2OH 以Hg为催化剂,在紫外线照射下,激发态的Hg与甲醇反应,生成· CH2OH,进而自由基 发生中止反应生成乙二醇,其收率达97%。根据目前的研究报道该方法优点在于原料 甲醇价格低廉,来源丰富,乙二醇的收率高。但反应条件仍然比较苛刻,需要过氧化 物、锗、γ射线和铑作为催化剂,这对工业化应用提出不小的要求。
Chapter 2 生产工艺概述 煤化路线
c.合成气间接合成路线 • 合成气氧化偶联法 合成气氧化偶联法又称草酸酯法,是一条最有前途的工艺路线,由美国UCC公司1966 提出,1978年日本宇部兴产对该技术进行了改进。其工艺路线分两步:第一步,CO的 偶联反应生成草酸酯;第二步,草酸酯加氢得到乙二醇。 第一步的合成气偶联制草酸酯,利 第一步: 用合成气与亚硝酸酯反应生成草酸 酯和一氧化氮,然后一氧化氮与醇 偶联反应: 2CO+2RONO--(COOR)2+2NO 类发生反应生成亚硝酸酯,此过程 再生反应: 2NO+2ROH+1/2 O2--2RONO+H2O (2—9) 不消耗醇类和亚硝酸。第二步是草 总反应为: 2CO+2ROH+1/2 O2--(COOR)2+H2O (2-10) 酸酯加氢得到乙二醇,此步骤是该 第二步:加氢反应: 技术路线的关键,催化剂量产和寿 命的问题一直是限制该工艺工业化 (COOR)2+4H2--(CH2OH)2+2ROH
Chapter 2 生产工艺概述 煤化路线
随着石油资源的日益减少,人们认识到石油资源的有限性,结合我国富煤、富气、少 油的现实,发展以天然气、煤替代石油制备乙二醇的技术受到广泛重视。 a.C1-乙烯合成法 C1-乙烯合成法是以碳一化学合成法合成乙烯,然后沿用传统的乙烯氧化制环氧乙烷、 环氧乙烷水解制取乙二醇。根据C1合成乙烯的经历的步骤不同可以分为一步法、二步 法、和三步法。一步法即直接利用天然气中的甲烷为原料,采用催化剂偶联或等离子 体技术一步合成乙烯;二步法是天然气经过合成气合成乙烯;三步法的路线有三条: • 天然气经合成气生成甲醇然后制得乙烯; • 天然气经合成气生成二甲醚制乙烯; • 天然气经合成气生成乙醇再反应生成乙烯 其中以合成气制甲醇,甲醇反应生成乙烯的工艺技术较成熟,已具备大规模工业化条 件。
摘要
原料来源广泛和低廉
工艺流程简单
具有工业应用前景
能耗小、反应条件温和
乙二醇的选择性相对较高
可以避免传统方法对环境的污染
Chapter 2 生产工艺概述
乙二醇(EG),又称“甘醇”,1,2.亚乙基二醇,化学分子式HOCH2CH2OH, 是最简单的二元醇,常温下为无色、有甜味的液体。分子量为62.07,相对密 度1.1155(20℃下相对水的密度为1),黏度为25.66 mPa· s,沸点197.2℃,熔 点.11.5℃,凝固点一12.6℃。乙二醇物理性质稳定,不易腐蚀,易溶于水 、乙醇、丙酮、醋酸的极性、弱极性溶液,微溶于于醚类溶剂,能溶于氯化锌 、氯化钠、碳酸钾、氢氧化钾等无机溶剂,不溶于石油烃类。 乙二醇的生产路线大致可以分为石油路线和非石油路线
乙二醇生产工艺
指导老师:骆培成 组员:李月月 19111201 王广宏 19111202 韩建伟 19111203 LOGO 王肖磊 19111204
Chapter 1 摘要
乙二醇(EG)是一种重要的化工原料,主要用于生产聚酯(PET)、醇酸树脂、表 面活性剂、涂料以及防冻剂等。2009年,全世界乙二醇的总消费量达到1797 .2万吨,生产量为1725.0万吨;我国乙二醇的消费量约为777.14万吨,预 计2014年消费量将达到1100.0万吨,而生产量仅为243.8万吨。产能严重不 足,需要大量进口,乙二醇的市场前景十分广阔。
Chapter 1
摘要
上世纪70年代世界石油危机的冲击,使人们认识到石油资源的有限性,因此开发利用 我国丰富的煤和天然气资源,发展碳一化工具有重要的战略意义和经济意义。绿色路 线合成乙二醇(即碳一合成路线)得到了广泛的研究。
