各种酸在水中的解离常数
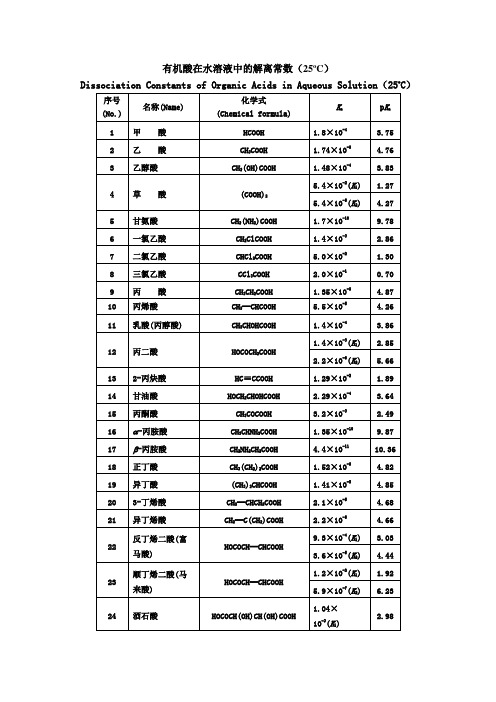
有机酸在水溶液中的解离常数
55
乙二胺四乙酸(EDTA)
CH2—N(CH2COOH)2
∣
CH2—N(CH2COOH)2
1.0×10-2(K1)
2.0
2.14×10-3(K2)
2.67
6.92×10-7(K3)
6.16
5.5×10-11(K4)
10.26
0.29
43
葡萄糖酸
CH2OH(CHOH)4COOH
1.4×10-4
3.86
44
苯甲酸
C6H5COOH
6.3×10-5
4.20
45
水杨酸
C6H4(OH)COOH
1.05×10-3(K1)
2.98
4.17×10-13(K2)
12.38
46
邻硝基苯甲酸
(o)NO2C
有机酸在水溶液中的解离常数(25oC)
Dissociation Constants of Organic Acids in Aqueous Solution(25oC)
序号(No.)
名称(Name)
化学式
(Chemical formula)
Ka
pKa
1
甲 酸
HCOOH
1.8×10-4
3.75
2
乙 酸
CH3COOH
1.74×10-5
4.76
3
乙醇酸
CH2(OH)COOH
1.48×10-4
3.83
4
草 酸
(COOH)2
5.4×10-2(K1)
1.27
5.4×10-5(K2)
4.27
5
甘氨酸
CH2(NH2)COOH
1.7×10-10
醋酸标准解离常数和解离度的测定

醋酸标准解离常数和解离度的测定
首先,我们来了解一下醋酸的解离反应。
醋酸在水中的解离反应可以表示为CH3COOH ⇌ CH3COO+ H+。
在这个平衡反应中,醋酸分子会与水分子发生反应,生成乙酸离子和氢离子。
解离常数Ka是描述醋酸在水中解离程度的参数,其定义为乙酸离子和氢离子浓度的乘积除以醋酸浓度,即Ka=[CH3COO-
][H+]/[CH3COOH]。
Ka数值越大,表示醋酸在水中的解离程度越高。
测定醋酸的解离常数和解离度可以采用多种方法。
其中一种常用的方法是电导法。
在电导法测定中,首先需要准备不同浓度的醋酸溶液,然后通过电导仪测定这些溶液的电导率。
根据醋酸解离产生的离子对电导率的贡献,可以计算出醋酸的解离度和解离常数。
另一种常用的方法是pH法。
在pH法测定中,首先需要准备不同浓度的醋酸溶液,然后用pH计测定这些溶液的pH值。
通过计算醋酸溶液的pH值和解离常数的关系,可以得到醋酸的解离度和解离常数。
除了电导法和pH法,还可以利用核磁共振、红外光谱等方法来测定醋酸的解离常数和解离度。
这些方法各有优缺点,可以根据实际情况选择合适的方法进行测定。
总之,醋酸的解离常数和解离度是描述其在溶液中解离程度的重要参数,对于理解醋酸的化学性质和在实际应用中的作用具有重要意义。
通过合适的测定方法,可以准确地测定醋酸的解离常数和解离度,为相关研究和应用提供重要参考。
各种酸在水中的电离常数

K1 K2
25
正戊酸
CH3(CH2)3COOH
26
异戊酸
(CH3)2CHCH2COOH
27
2—戊烯酸
CH3CH2CH=CHCOOH
28
3—戊烯酸
CH3CH=CH2CHCOOH
29
4—戊烯酸
CH2=CHCH2CH2COOH
30
戊二酸
HOOC(CH2)3COOH
K1 K2
K1
31
谷氨酸
HOOCCH2CH2CH(NH2)COOH K2
水杨酸
C6H4(OH)COOH
K1 K2
46 邻硝基苯甲酸
(o)NO2C6H4COOH
47 间硝基苯甲酸
(m)NO2C6H4COOH
48 对硝基苯甲酸
(p)NO2C6H4COOH
49
邻苯二甲酸
(o)C6H4(COOH)2
K1 K2
50
间苯二甲酸
(m)C6H4(COOH)2
K1 K2
51
对苯二甲酸
(p)C6H4(COOH)2
H2CO3
K1 K2
HClOபைடு நூலகம்
HF
H2GeO3
K1 K2
HIO4
HNO2
H3PO2
H3PO3
K1 K2
K1
H3PO4
K2
K3
K1
H4P2O7
K2 K3
K4
H2S
K1 K2
H2SO3
K1 K2
H2SO4
K1 K2
H2S2O3
K1 K2
21
氢硒酸
22
亚硒酸
23
硒酸
24
常见酸碱的电离常数(解离常数)
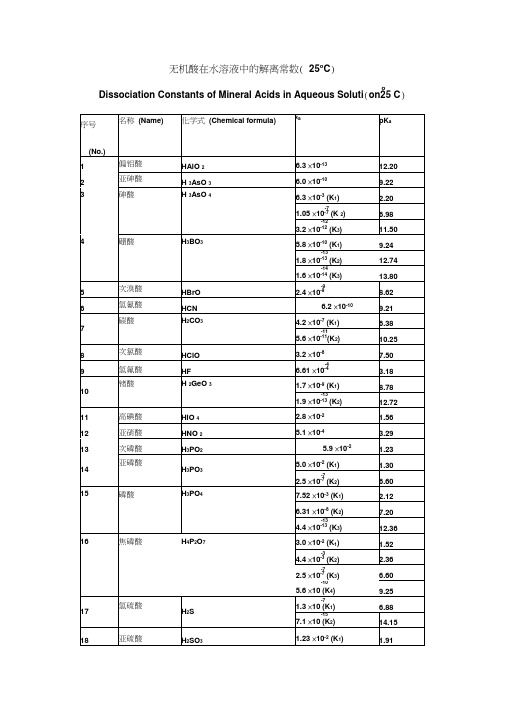
pKb
1
氢氧化铝
Al(OH)3
-9
1.38×10-9(K3)
8.86
2
氢氧化银
AgOH
-4
1.10×10-4
3.96
3
氢氧化钙
Ca(OH)2
-3
3.72×10-3
2.43
-2
3.98×10-2
1.40
4
氨水
NH3+H2O
-5
1.78×10-5
4.75
5
肼(联氨)
N2H4+H2O
-7
9.55×10-7(K1)
18
己胺
H(CH2)6NH2
-4
4.37×10-4
3.36
19
辛胺
H(CH2)8NH2
-4
4.47×10-4
3.35
20
苯胺
C6H5NH2
-10
3.98×10
9.40
21
苄胺
C7H9N
-5
2.24×10
4.65
22
环己胺
C6H11NH2
-4
4.37×10-4
3.36
23
吡啶
C5H5N
-9
1.48×10-9
5
乙二胺
H2N(CH2)2NH2
-5
8.51×10-5(K1)
4.07
-8
7.08×10-8(K2)
7.15
6
二甲胺
(CH3)2NH
-4
5.89×10-4
3.23
7
三甲胺
(CH3)3N
-5
6.31×10-5
4.20
各种酸在水中的解离常数

各种酸在水中的解离常数序号 (No.) 名称(Name) 化学式(Chemical formula) Ka pKa1 偏铝酸HAlO2 6.3×10-13 12.202 亚砷酸H3AsO3 6.0×10-10 9.223 砷酸H3AsO4 6.3×10-3 (K1) 2.201.05×10-7 (K 2) 6.983.2×10-12 (K3) 11.504 硼酸H3BO3 5.8×10-10 (K1) 9.241.8×10-13 (K2) 12.741.6×10-14 (K3) 13.805 次溴酸HBrO 2.4×10-9 8.626 氢氰酸HCN 6.2×10-10 9.217 碳酸H2CO3 4.2×10-7 (K1) 6.385.6×10-11(K2) 10.258 次氯酸HClO 3.2×10-8 7.509 氢氟酸HF 6.61×10-4 3.1810 锗酸H2GeO3 1.7×10-9 (K1) 8.781.9×10-13 (K2) 12.7211 高碘酸HIO4 2.8×10-2 1.5612 亚硝酸HNO2 5.1×10-4 3.2913 次磷酸H3PO2 5.9×10-2 1.2314 亚磷酸H3PO3 5.0×10-2 (K1) 1.302.5×10-7 (K2) 6.6015 磷酸H3PO4 7.52×10-3 (K1) 2.126.31×10-8 (K2)7.204.4×10-13 (K3) 12.3616 焦磷酸H4P2O7 3.0×10-2 (K1) 1.524.4×10-3 (K2) 2.362.5×10-7 (K3) 6.605.6×10-10 (K4) 9.2517 氢硫酸H2S 1.3×10-7 (K1) 6.887.1×10-15 (K2) 14.1518 亚硫酸H2SO3 1.23×10-2 (K1) 1.916.6×10-8 (K2)7.1819 硫酸H2SO4 1.0×103 (K1) -3.01.02×10-2 (K2) 1.9920 硫代硫酸H2S2O3 2.52×10-1 (K1) 0.601.9×10-2 (K2) 1.7221 氢硒酸H2Se 1.3×10-4 (K1) 3.891.0×10-11(K2) 11.022 亚硒酸H2SeO3 2.7×10-3 (K1) 2.572.5×10-7 (K2) 6.6023 硒酸H2SeO4 1×103 (K1) -3.01.2×10-2 (K2) 1.9224 硅酸H2SiO3 1.7×10-10 (K1) 9.771.6×10-12 (K2) 11.8025 亚碲酸H2TeO3 2.7×10-3 (K1) 2.571.8×10-8 (K2) 7.74序号(No.) 名称(Name) 化学式(Chemical formula) Ka pKa1 甲酸HCOOH 1.8×10-4 3.752 乙酸CH3COOH 1.74×10-5 4.763 乙醇酸CH2(OH)COOH 1.48×10-4 3.834 草酸(COOH)2 5.4×10-2(K1) 1.275.4×10-5(K2) 4.275 甘氨酸CH2(NH2)COOH 1.7×10-10 9.786 一氯乙酸CH2ClCOOH 1.4×10-3 2.867 二氯乙酸CHCl2COOH 5.0×10-2 1.308 三氯乙酸CCl3COOH 2.0×10-1 0.709 丙酸CH3CH2COOH 1.35×10-5 4.8710 丙烯酸CH2═CHCOOH 5.5×10-5 4.2611 乳酸(丙醇酸) CH3CHOHCOOH 1.4×10-4 3.8612 丙二酸HOCOCH2COOH 1.4×10-3(K1) 2.852.2×10-6(K2) 5.6613 2-丙炔酸HC≡CCOOH 1.29×10-2 1.8914 甘油酸HOCH2CHOHCOOH 2.29×10-4 3.6415 丙酮酸CH3COCOOH 3.2×10-3 2.4916 a-丙胺酸CH3CHNH2COOH 1.35×10-10 9.8717 b-丙胺酸CH2NH2CH2COOH 4.4×10-11 10.3618 正丁酸CH3(CH2)2COOH 1.52×10-5 4.8219 异丁酸(CH3)2CHCOOH 1.41×10-5 4.8520 3-丁烯酸CH2═CHCH2COOH 2.1×10-5 4.6821 异丁烯酸CH2═C(CH2)COOH 2.2×10-5 4.6622 反丁烯二酸(富马酸) HOCOCH═CHCOOH9.3×10-4(K1) 3.03 3.6×10-5(K2) 4.4423 顺丁烯二酸(马来酸) HOCOCH═CHCOOH 1.2×10-2(K1) 1.92 5.9×10-7(K2) 6.2324 酒石酸HOCOCH(OH)CH(OH)COOH 1.04×10-3(K1) 2.98 4.55×10-5(K2) 4.3425 正戊酸CH3(CH2)3COOH 1.4×10-5 4.8626 异戊酸(CH3)2CHCH2COOH 1.67×10-5 4.7827 2-戊烯酸CH3CH2CH═CHCOOH 2.0×10-5 4.7028 3-戊烯酸CH3CH═CHCH2COOH 3.0×10-5 4.5229 4-戊烯酸CH2═CHCH2CH2COOH 2.10×10-5 4.67730 戊二酸HOCO(CH2)3COOH 1.7×10-4(K1) 3.778.3×10-7(K2) 6.0831 谷氨酸HOCOCH2CH2CH(NH2)COOH 7.4×10-3(K1) 2.13 4.9×10-5(K2) 4.3132 正己酸CH3(CH2)4COOH 1.39×10-5 4.8633 异己酸(CH3)2CH(CH2)3—COOH 1.43×10-5 4.8534 (E)-2-己烯酸H(CH2)3CH═CHCOOH 1.8×10-5 4.7435 (E)-3-己烯酸CH3CH2CH═CHCH2COOH 1.9×10-5 4.7236 己二酸HOCOCH2CH2CH2CH2COOH 3.8×10-5(K1) 4.423.9×10-6(K2) 5.4137 柠檬酸HOCOCH2C(OH)(COOH)CH2COOH 7.4×10-4(K1) 3.131.7×10-5(K2) 4.764.0×10-7(K3) 6.4038 苯酚C6H5OH 1.1×10-10 9.9639 邻苯二酚(o)C6H4(OH)2 3.6×10-10 9.451.6×10-13 12.840 间苯二酚(m)C6H4(OH)2 3.6×10-10(K1) 9.308.71×10-12(K2) 11.0641 对苯二酚(p)C6H4(OH)2 1.1×10-10 9.9642 2,4,6-三硝基苯酚2,4,6-(NO2)3C6H2OH 5.1×10-1 0.2943 葡萄糖酸CH2OH(CHOH)4COOH 1.4×10-4 3.8644 苯甲酸C6H5COOH 6.3×10-5 4.2045 水杨酸C6H4(OH)COOH 1.05×10-3(K1) 2.984.17×10-13(K2) 12.3846 邻硝基苯甲酸(o)NO2C6H4COOH 6.6×10-3 2.1847 间硝基苯甲酸(m)NO2C6H4COOH 3.5×10-4 3.4648 对硝基苯甲酸(p)NO2C6H4COOH 3.6×10-4 3.4449 邻苯二甲酸(o)C6H4(COOH)2 1.1×10-3(K1) 2.964.0×10-6(K2)5.4050 间苯二甲酸(m)C6H4(COOH)2 2.4×10-4(K1) 3.622.5×10-5(K2) 4.6051 对苯二甲酸(p)C6H4(COOH)2 2.9×10-4(K1) 3.543.5×10-5(K2)4.4652 1,3,5-苯三甲酸C6H3(COOH)3 7.6×10-3(K1) 2.127.9×10-5(K2) 4.106.6×10-6(K3) 5.1853 苯基六羧酸C6(COOH)6 2.1×10-1(K1) 0.686.2×10-3(K2) 2.213.0×10-4(K3) 3.528.1×10-6(K4) 5.094.8×10-7(K5) 6.323.2×10-8(K6) 7.4954 癸二酸HOOC(CH2)8COOH 2.6×10-5(K1) 4.592.6×10-6(K2) 5.5955 乙二胺四乙酸(EDTA) CH2—N(CH2COOH)2 ∣ CH2—N(CH2COOH)2 1.0×10-2(K1) 2.02.14×10-3(K2) 2.675.5×10-11(K4) 10.26。
常见酸的电离平衡常数表(3篇)

第1篇一、引言酸是化学中一类重要的物质,它们在水溶液中能够释放出氢离子(H+)。
酸的电离平衡常数(Ka)是衡量酸强弱的一个重要指标,它反映了酸在水溶液中电离的程度。
本文将列举一些常见酸的电离平衡常数,以便于读者查阅和参考。
二、强酸的电离平衡常数1. 盐酸(HCl)Ka = 1.3×10^62. 硫酸(H2SO4)Ka1 = 1.99×10^3Ka2 = 2.0×10^-23. 硝酸(HNO3)Ka = 4.0×10^34. 氢溴酸(HBr)Ka = 1.0×10^95. 氢碘酸(HI)Ka = 1.0×10^10三、中等强度的酸的电离平衡常数1. 乙酸(CH3COOH)Ka = 1.8×10^-52. 乳酸(C3H6O3)Ka = 4.3×10^-53. 丙酸(C2H5COOH)Ka = 1.4×10^-54. 苹果酸(C4H6O5)Ka = 1.7×10^-45. 乳酸(C3H6O3)Ka = 4.3×10^-5四、弱酸的电离平衡常数1. 氢氟酸(HF)Ka = 6.6×10^-42. 氢氰酸(HCN)Ka = 4.9×10^-103. 氢亚硫酸(H2SO3)Ka1 = 1.6×10^-2Ka2 = 1.3×10^-74. 氢亚磷酸(H3PO3)Ka1 = 7.5×10^-3Ka2 = 6.2×10^-8Ka3 = 4.6×10^-135. 氢硫酸(H2S)Ka1 = 1.0×10^-7Ka2 = 1.3×10^-13五、非常弱的酸的电离平衡常数1. 氨水(NH3)Ka = 1.8×10^-52. 氢硫化氢(H2S)Ka = 1.0×10^-73. 氢亚硫酸(H2SO3)Ka = 1.6×10^-24. 氢亚磷酸(H3PO3)Ka = 7.5×10^-35. 氢氰酸(HCN)Ka = 4.9×10^-10六、总结本文列举了常见酸的电离平衡常数,包括强酸、中等强度酸、弱酸和非常弱的酸。
化学物质的酸碱解离常数

化学物质的酸碱解离常数酸碱解离常数是描述酸碱的强弱程度的物理量,它可以用来判断溶液中酸碱反应的方向和平衡位置。
在化学反应中,酸和碱能够解离产生氢离子(H+)和氢氧根离子(OH-),解离常数就是用来表示酸和碱在水中解离的程度。
一、酸碱解离常数的定义酸碱解离常数(Ka 和 Kb)分别是酸和碱在水中解离的程度指标。
酸的解离常数(Ka)可以通过下列反应的平衡常数来计算:HA ⇌ H+ + A-其中,HA是酸分子,H+是所释放出的氢离子,A-是带一个负电荷的阴离子。
酸的解离常数可以表示为:Ka = [H+][A-]/[HA]类似地,碱的解离常数(Kb)可以通过下列反应的平衡常数来计算:B + H2O ⇌ BH+ + OH-其中,B是碱分子,BH+是带一个正电荷的阳离子,OH-是所释放出的氢氧根离子。
碱的解离常数可以表示为:Kb = [BH+][OH-]/[B]二、酸碱解离常数的意义酸碱解离常数能够提供酸碱的强弱信息,数值越大,表示酸碱越强。
通过解离常数可以判断溶液中酸碱反应的方向和平衡位置,具体来说:1. 如果Ka 值很大,说明酸在水中几乎完全解离,属于强酸;反之,如果Ka 值很小,说明酸在水中解离很少,属于弱酸。
2. 如果Kb 值很大,说明碱在水中几乎完全解离,属于强碱;反之,如果Kb 值很小,说明碱在水中解离很少,属于弱碱。
3. 对于强酸和强碱,它们在溶液中的解离是完全的,其解离常数接近于无穷大。
而对于弱酸和弱碱,它们在溶液中的解离是部分的,其解离常数通常在10的负几次方到10的正几次方之间。
三、影响酸碱解离常数的因素酸碱解离常数受到溶液温度、离子浓度和溶剂极性等因素的影响。
1. 温度:通常情况下,酸碱解离常数随着温度升高而增大。
这是因为在高温下,反应速率加快,使得更多的酸和碱分子解离,从而提高了解离常数。
2. 离子浓度:酸碱解离常数与溶液中酸和碱的浓度相关。
当酸或碱的浓度增加时,解离常数也随之增大。
酸碱的电离常数(解离常数)
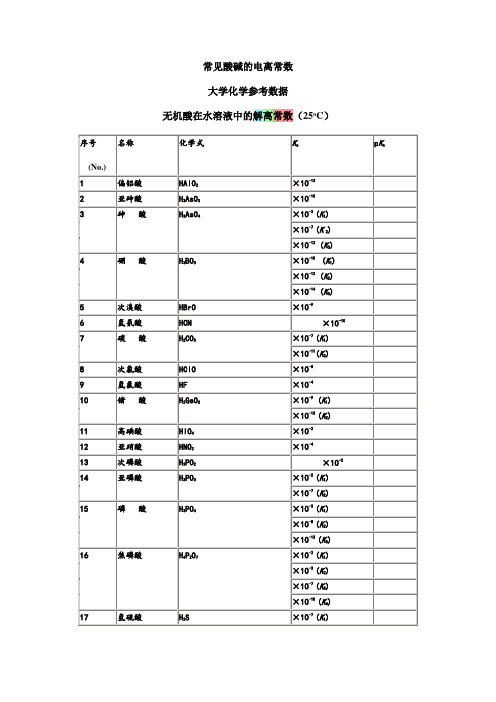
×10-2
14
亚磷酸
H3PO3
×10-2(K1)
×10-7(K2)
15
磷 酸
H3PO4
×10-3(K1)
×10-8(K2)
×10-13(K3)
Hale Waihona Puke 16焦磷酸H4P2O7
×10-2(K1)
×10-3(K2)
×10-7(K3)
×10-10(K4)
17
氢硫酸
H2S
×10-7(K1)
×10-15(K2)
×10-4(K1)
×10-7(K2)
31
谷氨酸
HOCOCH2CH2CH(NH2)COOH
×10-3(K1)
×10-5(K2)
×10-10(K3)
32
正己酸
CH3(CH2)4COOH
×10-5
33
异己酸
(CH3)2CH(CH2)3—COOH
×10-5
34
(E)-2-己烯酸
H(CH2)3CH═CHCOOH
序号(No.)
名称(Name)
化学式
(Chemical formula)
Ka
pKa
1
甲 酸
HCOOH
×10-4
2
乙 酸
CH3COOH
×10-5
3
乙醇酸
CH2(OH)COOH
×10-4
4
草 酸
(COOH)2
×10-2(K1)
×10-5(K2)
5
甘氨酸
CH2(NH2)COOH
×10-10
6
一氯乙酸
CH2ClCOOH
C6(COOH)6
×10-1(K1)
化学物质的酸碱解离常数计算

化学物质的酸碱解离常数计算在化学领域中,酸碱解离常数是描述酸和碱在水溶液中解离程度的重要参数。
通过计算酸碱解离常数,我们可以了解化学物质的酸碱性质以及酸碱反应的强弱程度。
本文将介绍如何计算化学物质的酸碱解离常数以及具体的计算方法。
1. 酸碱解离常数的概念酸碱解离常数(Ka或Kb)是描述酸和碱在水溶液中解离程度的指标。
在水中,酸和碱都会发生解离反应,生成氢离子(H+)或羟离子(OH-)。
酸在水溶液中的解离反应可表示为HA ⇌ H+ + A-,碱的解离反应可表示为B + H2O ⇌ BH+ + OH-。
酸碱解离常数通过反应物的浓度比值来确定。
2. 酸碱解离常数的计算方法酸碱解离常数的计算方法主要有两种:指数法和数值法。
2.1 指数法对于酸解离反应HA ⇌ H+ + A-,酸碱解离常数Ka可以表示为:Ka = [H+][A-]/[HA],其中[H+]代表氢离子的浓度,[A-]代表阴离子的浓度,[HA]代表酸的浓度。
通过测定反应物和生成物的浓度,我们可以直接计算出酸碱解离常数Ka的值。
2.2 数值法对于无法直接测定酸碱解离反应物和生成物浓度的情况,我们可以通过计算pH值来间接计算酸碱解离常数。
pH值是酸碱性的度量指标,它表示水溶液中氢离子的浓度。
pH值的计算公式为:pH = -log[H+],其中[H+]代表氢离子的浓度。
根据pH值,我们可以反推出酸碱解离常数Ka的值。
3. 示例以强酸盐酸(HCl)为例,我们来计算其酸碱解离常数。
3.1 指数法假设盐酸溶液中盐酸的浓度为0.1 mol/L,根据酸碱解离常数的计算公式Ka = [H+][Cl-]/[HCl],我们可以得到:Ka = ([H+][Cl-])/([HCl]) = ([H+]^2)/([HCl])。
3.2 数值法通过测定盐酸溶液的pH值,我们可以间接计算出酸碱解离常数Ka的值。
假设盐酸溶液的pH值为-1,根据pH值的计算公式,我们可以得到[H+] = 0.1 mol/L。
常见酸碱的电离常数(解离常数)

常见酸碱的电离常数(解离常数)电离常数(ionization constant,又称解离常数)是生物化学中一个重要的概念,它表示了一种物质在溶液中的解离度和电荷的大小。
一般情况下,电离常数越大,表明溶液中放电离子越多,pH值越低。
以下是常见酸碱的电离常数信息:1. 氢氧化钠(NaOH):电离常数为1.40×10^-22. 氢氧化钙(Ca(OH)2):电离常数为2.12×10^-53. 氢氧化镁(Mg(OH)2):电离常数为1.06×10^-114. 氢氧化氢(H2O):电离常数为1.00×10^-145. 氢氧化氯(HCl):电离常数为1.00×10^-16. 氢氧化碳酸钙(CaCO3):电离常数为4.51×10^-97. 氢氧化锌(Zn(OH)2):电离常数为2.08×10^-168. 氢氧化硫酸(H2SO4):电离常数为1.20×10^-29. 氢氧化硅酸钙(SiO2.CaO):电离常数为1.14×10^-510. 氢氧化银氨(AgNH3):电离常数为4.90×10^-1011. 氫氧化銻(Sb(OH)3):电离常数为4.25×10^-512. 氢氧化镍(Ni(OH)2):电离常数为7.75×10^-1613. 氢氧化锂(LiOH):电离常数为2.50×10^-114. 氢氧化铁(Fe(OH)2):电离常数为5.26×10^-1615. 氢氧化锆(Zr(OH)4):电离常数为2.66×10^-616. 氢氧化碳酸铝(Al2(CO3)3):电离常数为1.25×10^-917. 氢氧化氯化钠(NaClO):电离常数为3.31×10^-118. 氢氧化氯化铵( NH4ClO):电离常数为4.92×10^-219. 氢氧化高氯酸钠(NaClO3):电离常数为2.05×10^-220. 氢氧化氯化钙(Ca(ClO)2):电离常数为8.37×10^-6。
盐酸的解离常数

盐酸的解离常数盐酸是一种无机酸,其化学式为HCl。
在水溶液中,盐酸会发生完全的解离,生成氢离子(H+)和氯离子(Cl-)。
解离常数是描述酸在水中解离程度的一个指标,用K值表示。
对于盐酸来说,其解离常数可以通过测定酸溶液的离子浓度来确定。
其实验测定方法有很多,比较常用的是电导法和pH法。
电导法是通过测量酸溶液的电导率来确定溶液中的离子浓度,从而计算出解离常数。
在电导法中,首先需要将电导池浸入待测的酸溶液中,然后接通电源,测量通过溶液的电流以及电源与电导池间的电压差。
根据欧姆定律可以计算出溶液的电导率。
然后,通过测定不同浓度的酸溶液的电导率,绘制出电导率-浓度曲线,在低浓度区间内可以得到一个线性关系。
根据电导率与电解质浓度之间的线性关系,可以计算出离子的浓度,从而计算出解离常数。
pH法是通过测量酸溶液的pH值来确定溶液中的氢离子浓度,从而计算出解离常数。
在pH法中,首先需要用电极将酸溶液的pH值进行测量,通常使用玻璃电极和参比电极。
然后,根据酸碱滴定原理,可以通过滴定的方法来测定酸溶液的酸度,进而计算出氢离子的浓度。
再根据HCl的化学反应方程式,可以计算出氯离子的浓度。
根据氢离子和氯离子的浓度,可以计算出酸的解离常数。
盐酸在水中的离解方程式为:HCl →H+ + Cl-根据此离解方程式以及解离常数定义式:K = [H+][Cl-]/[HCl]由于盐酸是强酸,所以它的解离常数非常大,大约为1x10^6。
这意味着在水中,盐酸的解离程度非常高,几乎完全解离为氢离子和氯离子。
在普通实验室中,可以用酸碱滴定的方法来测定盐酸的解离常数。
首先需要制备一种已知浓度的碱溶液(如氢氧化钠溶液),然后用滴定管将碱溶液滴入装有盐酸的烧杯中,同时使用指示剂(如酚酞指示剂),观察溶液颜色的变化。
当溶液中多余的盐酸被滴定溶液中的碱完全中和时,指示剂颜色变化的位置就是酸和碱滴定反应的终点。
根据在滴定过程中所加入的碱溶液的体积和浓度,以及已知的盐酸的浓度,可以计算出解离常数。
酸解离常数

25
正戊酸
CH3(CH2)3COOH
1.4×10-5
4.86
26
异戊酸
(CH3)2CHCH2COOH
1.67×10-5
4.78
27
2-戊烯酸
CH3CH2CH═CHCOOH
2.0×10-5
4.70
28
3-戊烯酸
CH3CH═CHCH2COOH
3.0×10-5
4.52
29
4-戊烯酸
CH2═CHCH2CH2COOH
5.0×10-2
1.30
8
三氯乙酸
CCl3COOH
2.0×10-1
0.70
9
丙酸
CH3CH2COOH
1.35×10-5
4.87
10
丙烯酸
CH2═CHCOOH
5.5×10-5
4.26
11
乳酸(丙醇酸)
CH3CHOHCOOH
1.4×10-4
3.86
12
丙二酸
HOCOCH2COOH
1.4×10-3(K1)
2.85
2.2×10-6(K2)
5.66
13
2-丙炔酸
HC≡CCOOH
1.29×10-2
1.89
14
甘油酸
HOCH2CHOHCOOH
2.29×10-4
3.64
15
丙酮酸
CH3COCOOH
3.2×10-3
2.49
16
-丙胺酸
CH3CHNH2COOH
1.35×10-10
9.87
17
-丙胺酸
CH2NH2CH2COOH
1.74×10-5
4.76
各种物质的解离常数
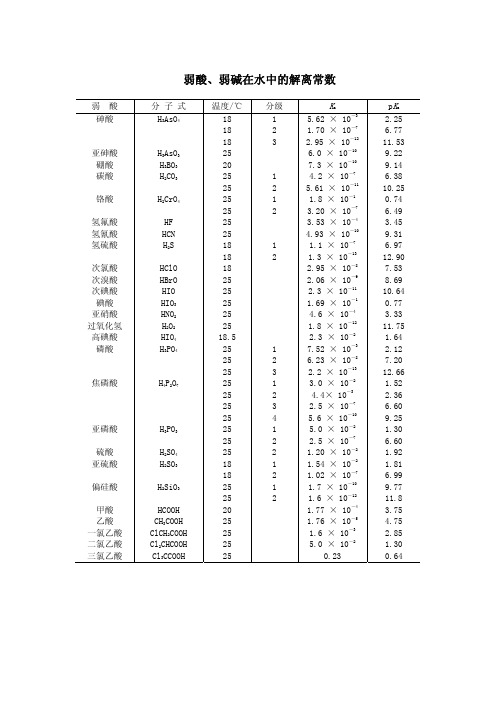
0.23
pKa
2.25 6.77 11.53 9.22 9.14 6.38 10.25 0.74 6.49 3.45 9.31 6.97 12.90 7.53 8.69 10.64 0.77 3.33 11.75 1.64 2.12 7.20 12.66 1.52 2.36 6.60 9.25 1.30 6.60 1.92 1.81 6.99 9.77 11.8 3.75 4.75 2.85 1.30 0.64
1.7 × 10-9
3.74 × 10-3 4.0 × 10-2
续表 pKa 3.86 4.21 1.23 4.19 2.35 9.60 3.04 4.37 2.95 4.41 3.13 4.76 6.40 9.95 0.9 1.6 2.0 2.67 6.16 10.26
pKb 4.75 7.97 5.52 14.12 8.85
N
Ca(OH)2
温度/℃ 25 25 25 25 25
25 25 25 25 25 25 25 25
25
25 30
分级
1 2 1 2 1 2 1 2 1 2 3
1 2 3 4 5 6
分级
1 2
1 2
1 2
Ka 1.4 × 10-4 6.2 × 10-5 5.90 × 10-2 6.40 × 10-5 4.5 × 10-3 2.5 × 10-10 9.1 × 10-4 4.3 × 10-5 1.1 × 10-3 3.9 × 10-5 7.4 × 10-4 1.7 × 10-5 4.0 × 10-7 1.1 × 10-10
各种酸的pKa及pH值-pb的pka

各种酸的pKa及pH值-pb的pka 各种酸的 pKa 及 pH 值 pb 的 pka在化学的世界里,酸的性质和强度是通过一些特定的参数来描述的,其中 pKa 和 pH 值就是两个非常重要的概念。
对于各种酸来说,它们的 pKa 值和在溶液中的 pH 值有着密切的关系,这不仅对于理解化学反应的机制至关重要,也在许多实际应用中有着广泛的用途。
首先,我们来了解一下什么是 pKa。
pKa 是酸解离常数(Ka)的负对数。
简单来说,它反映了酸在溶液中解离出氢离子(H⁺)的难易程度。
pKa 值越小,酸的酸性越强,越容易解离出氢离子;反之,pKa 值越大,酸的酸性越弱,解离出氢离子的难度就越大。
不同的酸具有不同的 pKa 值。
例如,盐酸(HCl)是一种强酸,其pKa 值约为-7。
这意味着盐酸在溶液中几乎完全解离,释放出大量的氢离子。
而乙酸(CH₃COOH)则是一种弱酸,其 pKa 值约为 476。
相比之下,乙酸在溶液中的解离程度就较小。
接下来,我们再看看 pH 值。
pH 值是用来衡量溶液酸碱度的指标,它的定义是溶液中氢离子浓度的负对数。
pH 值的范围通常在 0 到 14之间,其中 pH 值小于 7 表示溶液呈酸性,pH 值等于 7 表示溶液呈中性,pH 值大于 7 表示溶液呈碱性。
对于强酸来说,其溶液的 pH 值可以通过简单的计算得出。
假设我们有一定浓度的盐酸溶液,比如 01mol/L,由于盐酸完全解离,氢离子浓度也是 01mol/L,那么 pH 值就等于 log₁₀(01) = 1。
然而,对于弱酸来说,计算溶液的 pH 值就稍微复杂一些。
以乙酸为例,其解离平衡可以表示为:CH₃COOH ⇌ CH₃COO⁻+ H⁺。
在一定的温度下,根据乙酸的浓度和其 Ka 值,可以通过一系列的化学平衡计算来确定溶液中氢离子的浓度,进而得出 pH 值。
那么,pKa 和 pH 值之间有什么关系呢?在弱酸的溶液中,如果已知酸的 pKa 值和初始浓度,可以通过近似计算或者更精确的公式来估算溶液的 pH 值。
醋酸标准解离常数

醋酸标准解离常数
醋酸(乙酸)的标准解离常数(Ka)表示了醋酸在水中解离生成乙酸根离子(CH3COO^-)和氢离子(H+)的平衡程度。
它的数值越大,说明醋酸在水中的解离越完全,反应越偏向生成乙酸根离子。
醋酸的标准解离常数通常用数值表达,其值约为1.8×10^-5。
这意味着在标准状态下,溶液中的醋酸只有很小一部分会解离成乙酸根离子和氢离子,大部分仍然以醋酸分子的形式存在。
需要注意的是,醋酸的解离常数会受到温度、浓度等因素的影响。
在不同条件下,醋酸的解离程度和解离常数的数值都可能发生变化。
常见解离常数

常常常常常常
解离常数是衡量两个物质之间相对稳定性的参数。
它是指在相同温度下,一个物质与另一个物质解离的速率比值。
解离常数越大,表示解离的速率越快,该物质与另一个物质的相对稳定性越小。
解离常数的单位通常为L/mol*s。
常见的解离常数包括:
•氧气在水中的解离常数:k=2.3×10^-3 L/mol*s
•氧气在甲醇中的解离常数:k=3.9×10^-3 L/mol*s
•氧气在乙醇中的解离常数:k=7.4×10^-3 L/mol*s
•二氧化碳在水中的解离常数:k=0.06 L/mol*s
•二氧化碳在乙醇中的解离常数:k=6.5×10^-3 L/mol*s
•硫酸在水中的解离常数:k=1.3×10^-2 L/mol*s
•硫酸在乙醇中的解离常数:k=7.0×10^-3 L/mol*s
解离常数的测定通常使用解离平衡法,即在一定温度下,在一定的时间内两种物质的解离速率相等,这时物质之间的平衡关系就建立了。
通过测量物质在平衡时的浓度,可以计算出解离常数。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
各种酸在水中的解离常数
序号 (No.) 名称(Name) 化学式(Chemical formula) Ka pKa
1 偏铝酸HAlO
2 ×10-13
2 亚砷酸H3AsO
3 ×10-10
3 砷酸H3AsO
4 ×10-3 (K1)
×10-7 (K 2)
×10-12 (K3)
4 硼酸H3BO3 ×10-10 (K1)
×10-13 (K2)
×10-14 (K3)
5 次溴酸HBrO ×10-9
6 氢氰酸HCN ×10-10
7 碳酸H2CO3 ×10-7 (K1)
×10-11(K2)
8 次氯酸HClO ×10-8
9 氢氟酸HF ×10-4
10 锗酸H2GeO3 ×10-9 (K1)
×10-13 (K2)
11 高碘酸HIO4 ×10-2
12 亚硝酸HNO2 ×10-4
13 次磷酸H3PO2 ×10-2
14 亚磷酸H3PO3 ×10-2 (K1)
×10-7 (K2)
15 磷酸H3PO4 ×10-3 (K1)
×10-8 (K2)
×10-13 (K3)
16 焦磷酸H4P2O7 ×10-2 (K1)
×10-3 (K2)
×10-7 (K3)
×10-10 (K4)
17 氢硫酸H2S ×10-7 (K1)
×10-15 (K2)
18 亚硫酸H2SO3 ×10-2 (K1)
×10-8 (K2)
19 硫酸H2SO4 ×103 (K1)
×10-2 (K2)
20 硫代硫酸H2S2O3 ×10-1 (K1)
×10-2 (K2)
21 氢硒酸H2Se ×10-4 (K1)
×10-11(K2)
22 亚硒酸H2SeO3 ×10-3 (K1)
×10-7 (K2)
23 硒酸H2SeO4 1×103 (K1)
×10-2 (K2)
24 硅酸H2SiO3 ×10-10 (K1)
×10-12 (K2)
25 亚碲酸H2TeO3 ×10-3 (K1)
×10-8 (K2)
序号(No.) 名称(Name) 化学式(Chemical formula) Ka pKa
1 甲酸HCOOH ×10-4
2 乙酸CH3COOH ×10-5
3 乙醇酸CH2(OH)COOH ×10-4
4 草酸(COOH)2 ×10-2(K1)
×10-5(K2)
5 甘氨
酸CH2(NH2)COOH ×10-10
6 一氯乙酸CH2ClCOOH ×10-3
7 二氯乙酸CHCl2COOH ×10-2
8 三氯乙酸CCl3COOH ×10-1
9 丙酸CH3CH2COOH ×10-5
10 丙烯
酸CH2═CHCOOH ×10-5
11 乳酸(丙醇
酸) CH3CHOHCOOH ×10-4
12 丙二
酸HOCOCH2COOH ×10-3(K1)
×10-6(K2)
13 2-丙炔酸HC≡CCOOH×10-2
14 甘油
酸HOCH2CHOHCOOH ×10-4
15 丙酮酸CH3COCOOH ×10-3
16 a-丙胺
酸CH3CHNH2COOH ×10-10
17 b-丙胺
酸CH2NH2CH2COOH ×10-11
18 正丁
酸CH3(CH2)2COOH ×10-5
19 异丁
酸(CH3)2CHCOOH ×10-5
20 3-丁烯
酸CH2═CHCH2COOH ×10-5
21 异丁烯
酸CH2═C(CH2)COOH ×10-5
22 反丁烯二酸(富马
酸) HOCOCH═CHCOOH ×10-4(K1)
×10-5(K2)
23 顺丁烯二酸(马来
酸) HOCOCH═CHCOOH ×10-2(K1)
×10-7(K2)
24 酒石
酸HOCOCH(OH)CH(OH)COOH ×10-3(K1)
×10-5(K2)
25 正戊
酸CH3(CH2)3COOH ×10-5
26 异戊
酸(CH3)2CHCH2COOH ×10-5
27 2-戊烯
酸CH3CH2CH═CHCOOH ×10-5
28 3-戊烯
酸CH3CH═CHCH2COOH ×10-5
29 4-戊烯
酸CH2═CHCH2CH2COOH ×10-5
30 戊二
酸HOCO(CH2)3COOH ×10-4(K1)
×10-7(K2)
31 谷氨
酸HOCOCH2CH2CH(NH2)COOH ×10-3(K1)
×10-5(K2)
×10-10 (K3)
32 正己
酸CH3(CH2)4COOH ×10-5
33 异己
酸(CH3)2CH(CH2)3—COOH ×10-5
34 (E)-2-己烯
酸H(CH2)3CH═CHCOOH ×10-5
35 (E)-3-己烯
酸CH3CH2CH═CHCH2COOH ×10-5
36 己二
酸HOCOCH2CH2CH2CH2COOH ×10-5(K1)
×10-6(K2)
37 柠檬
酸HOCOCH2C(OH)(COOH)CH2COOH ×10-4(K1)
×10-5(K2)
×10-7(K3)
38 苯酚C6H5OH ×10-10
39 邻苯二
酚(o)C6H4(OH)2 ×10-10
×10-13
40 间苯二
酚(m)C6H4(OH)2 ×10-10(K1)
×10-12(K2)
41 对苯二
酚(p)C6H4(OH)2 ×10-10
42 2,4,6-三硝基苯
酚2,4,6-(NO2)3C6H2OH ×10-1
43 葡萄糖
酸CH2OH(CHOH)4COOH ×10-4
44 苯甲酸C6H5COOH ×10-5
45 水杨
酸C6H4(OH)COOH ×10-3(K1)
×10-13(K2)
46 邻硝基苯甲
酸(o)NO2C6H4COOH ×10-3
47 间硝基苯甲
酸(m)NO2C6H4COOH ×10-4
48 对硝基苯甲
酸(p)NO2C6H4COOH ×10-4
49 邻苯二甲
酸(o)C6H4(COOH)2 ×10-3(K1)
×10-6(K2)
50 间苯二甲
酸(m)C6H4(COOH)2 ×10-4(K1)
×10-5(K2)
51 对苯二甲
酸(p)C6H4(COOH)2 ×10-4(K1)
×10-5(K2)
52 1,3,5-苯三甲
酸C6H3(COOH)3 ×10-3(K1)
×10-5(K2)
×10-6(K3)
53 苯基六羧
酸C6(COOH)6 ×10-1(K1)
×10-3(K2)
×10-4(K3)
×10-6(K4)
×10-7(K5)
×10-8(K6)
54 癸二
酸HOOC(CH2)8COOH ×10-5(K1)
×10-6(K2)
55 乙二胺四乙酸
(EDTA) CH2—N(CH2COOH)2 ∣ CH2—N(CH2COOH)2 ×10-2(K1)
×10-3(K2)
×10-7(K3)
×10-11(K4)。
