酸碱的电离常数(解离常数)
常见酸碱的电离常数(解离常数)
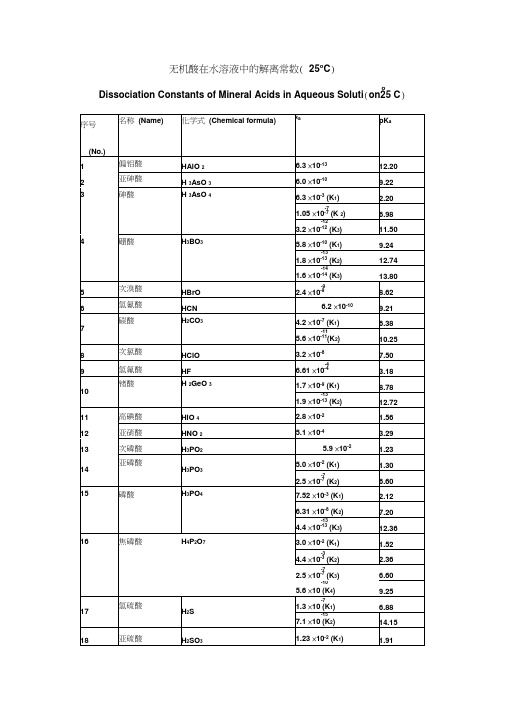
pKb
1
氢氧化铝
Al(OH)3
-9
1.38×10-9(K3)
8.86
2
氢氧化银
AgOH
-4
1.10×10-4
3.96
3
氢氧化钙
Ca(OH)2
-3
3.72×10-3
2.43
-2
3.98×10-2
1.40
4
氨水
NH3+H2O
-5
1.78×10-5
4.75
5
肼(联氨)
N2H4+H2O
-7
9.55×10-7(K1)
18
己胺
H(CH2)6NH2
-4
4.37×10-4
3.36
19
辛胺
H(CH2)8NH2
-4
4.47×10-4
3.35
20
苯胺
C6H5NH2
-10
3.98×10
9.40
21
苄胺
C7H9N
-5
2.24×10
4.65
22
环己胺
C6H11NH2
-4
4.37×10-4
3.36
23
吡啶
C5H5N
-9
1.48×10-9
5
乙二胺
H2N(CH2)2NH2
-5
8.51×10-5(K1)
4.07
-8
7.08×10-8(K2)
7.15
6
二甲胺
(CH3)2NH
-4
5.89×10-4
3.23
7
三甲胺
(CH3)3N
-5
6.31×10-5
4.20
解离平衡常数

解离平衡常数解离平衡常数(dissociation constant)是指一种物质在溶液中的解离程度,它表示溶液中物质的离解状态所占的比例。
解离平衡常数可以用来衡量一种物质在溶液中的溶解度,也可以用来衡量一种化合物的稳定性。
常见的解离平衡常数包括酸碱平衡常数(pH值)、离子解离常数(离子解离度)和离子解离平衡常数(离子解离程度)等。
解离平衡常数的大小可以通过实验测定,也可以用理论方法计算。
解离平衡常数在化学、生物学、药学等领域都有广泛的应用。
酸碱平衡常数(pH值)是衡量溶液中酸性或碱性程度的常数,它的大小可以反映溶液中的氢离子浓度。
pH值是以负数为单位表示的,常用pH计测定。
当pH值在7左右时溶液是中性的,pH值小于7时溶液是酸性的,pH值大于7时溶液是碱性的。
pH值对于生命的重要性是不言而喻的,它会影响生物体内的代谢过程,并且对人体的健康也有很大的影响。
离子解离常数(离子解离度)是衡量溶液中某种离子的解离程度的常数。
离子解离度的大小可以反映溶液中离子的溶解度,也可以反映溶液的电离度。
离子解离度是以正数为单位表示的,它的大小可以通过实验测定,也可以用理论方法计算。
离子解离度在化学、生物学、药学等领域都有广泛的应用。
离子解离平衡常数(离子解离程度)是衡量溶液中某种化合物的离解程度的常数。
离子解离程度的大小可以反映溶液中化合物的稳定性,也可以反映溶液的pH值。
离子解离程度是以正数为单位表示的,它的大小可以通过实验测定,也可以用理论方法计算。
离子解离程度在化学、生物学、药学等领域都有广泛的应用。
总之,解离平衡常数是衡量溶液中物质的解离程度的常数,它可以用来衡量物质的溶解度、电离度和稳定性。
解离平衡常数在化学、生物学、药学等领域都有广泛的应用。
常见酸碱的电离常数
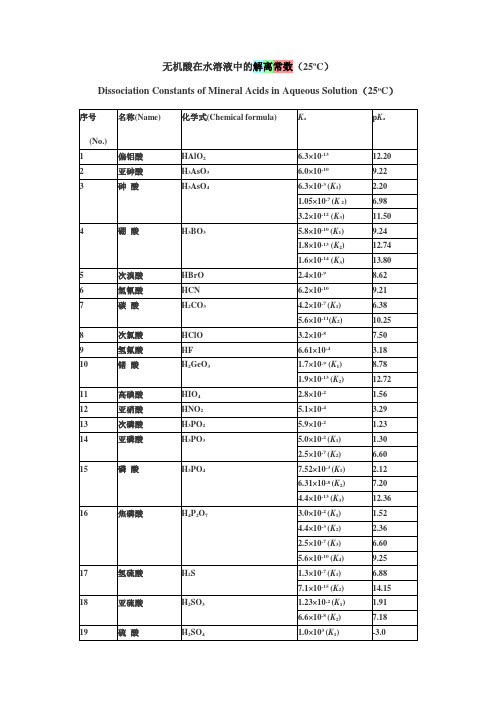
Dissociation Constants of Mineral Acids in Aqueous Solution(25oC)
序号
(No.)
名称(Name)
化学式(Chemical formula)
Ka
pKa
1
偏铝酸
HAlO2
6.3×10-13
12.20
2
亚砷酸
序号(No.)
名称(Name)
化学式(Chemical formula)
Kb
pKb
1
甲胺
CH3NH2
4.17×10-4
3.38
2
尿素(脲)
CO(NH2)2
1.5×10-14
13.82
3
乙胺
CH3CH2NH2
4.27×10-4
3.37
4
乙醇胺
H2N(CH2)2OH
3.16×10-5
4.50
5
乙二胺
H2N(CH2)2NH2
3.35
20
苯胺
C6H5NH2
3.98×10-10
9.40
21
苄胺
C7H9N
2.24×10-5
4.65
22
环己胺
C6H11NH2
4.37×10-4
3.36
23
吡啶
C5H5N
1.48×10-9
8.83
24
六亚甲基四胺
(CH2)6N4
1.35×10-9
8.87
25
2-氯酚
C6H5ClO
3.55×10-6
4.76
4.0×10-7(K3)
6.40
酸碱的电离常数(解离常数)

14
甘油酸
HOCH2CHOHCOOH
×10-4
15
丙酮酸
CH3COCOOH
×10-3
16
-丙胺酸
CH3CHNH2COOH
×10-10
17
-丙胺酸
CH2NH2CH2COOH
×10-11
18
正丁酸
CH3(CH2)2COOH
×10-5
19
异丁酸
(CH3)2CHCOOH
×10-5
20
3-丁烯酸
CH2═CHCH2COOH
8-HO—C9H6N
×10-5
35
二苯胺
(C6H5)2NH
×10-14
36
联苯胺
H2NC6H4C6H4NH2
×10-10(K1)
×10-11(K2)
有机酸在水溶液中的解离常数(25oC)
Dissociation Constants of Organic Acids in Aqueous Solution(25oC)
×10-4(K1)
×10-7(K2)
31
谷氨酸
HOCOCH2CH2CH(NH2)COOH
×10-3(K1)
×10-5(K2)
×10-10(K3)
32
正己酸
CH3(CH2)4COOH
×10-5
33
异己酸
(CH3)2CH(CH2)3—COOH
×10-5
34
(E)-2-己烯酸
H(CH2)3CH═CHCOOH
×10-5
21
异丁烯酸
CH2═C(CH2)COOH
×10-5
22
反丁烯二酸(富马酸)
HOCOCH═CHCOOH
碱解离常数kb公式

碱解离常数kb公式
碱的解离常数通常用Kb表示,计算公式为Kb = [BH+][OH-]/[B]。
其中,[BH+]、[OH-]和[B]分别表示碱的氢离子浓度、氢氧根离子浓度和碱的浓度。
Kb越大,pKb越小,碱性越强。
对于一对共轭酸碱对而言,通过公式推导可知pKa+pKb=pKw=14(25℃)。
例如当NH3做碱时pKb为4.75,生成共轭酸NH4+,NH4+的pKa为9.25,两者之和为14。
但人们有时依然习惯用pKa表示碱性的强弱,此处的pKa并不代表碱的pKa,而是指其共轭酸的pKa,共轭酸的pKa越大,则碱的pKb 越小,碱的碱性越强。
当然对于有些分子即可做酸,也可做碱,例如苯胺做酸时会电离产生H+,其pKa=28,此时的pKa指其作为酸的pKa。
当苯胺做碱时,其pKa=4.6,此时的Pka实际指的是其共轭酸的pKa。
以上信息仅供参考,如需了解关于化学公式的更多信息,建议查阅化学书籍或咨询化学专家。
醋酸的解离度和解离常数

醋酸的解离度和解离常数
醋酸是一元弱酸,在水溶液中存在以下电离平衡:HAC==H++AC-,在一定的温度下,这个过程很快达到了平衡,平衡常数的表达式为:K=[H+][AC-]/[HAC],此时,电离度α%=[H+]/c,式中[H+]、[AC-]、[HAC]分别为H+、AC-、HAC的平衡浓度。
设醋酸的初始浓度为C,如果忽略水电离所提供的[H+]量,则达到平衡时:
[H+ ]=[AC-] [HAC]=C-[H+]
K=[H+]2 /(C-[H+])
当α<5%时,K=[H+]2/C
因此,配制一系列已知浓度的醋酸溶液,测定其PH值,可求得一系列Ki值,其平均值为该温度下的Ki值。
意义
解离常数(pKa)是有机化合物非常重要的性质,决定化合物在介质中的存在形态,进而决定其溶解度、亲脂性、生物富集性以及毒性。
对于药物分子,pKa还会影响其药代动力学和生物化学性质。
精确预测有机化合物的pKa值在环境化学、生物化学、药物化学以及药物开发等领域都有重要意义。
采用电位滴定法测定物质解离常数时要注意数据处理的技巧,因为选择适当的数据处理方法能给实验数据的处理带来很大的方便,节省大量时间,同时能够提高数据的准确度。
电离度的概念以及公式

电离度的概念以及公式
电离度的概念是指一定温度下,弱电解质在溶液里达到电离平衡时,溶液中已电离的弱电解质分子数占弱电解质分子总数(包括已电离的和未电离的)的百分数。
电离度是表示弱电解质在水中电离程度的物理量,通常用电离度和电离常数来表示。
对于一元弱酸或一元弱碱,其电离度可以用以下公式计算:
对于一元弱酸:电离度α= [H+] / Ka
其中[H+]为溶液中的氢离子浓度,Ka为该物质的酸解离常数。
对于一元弱碱:电离度α= [OH-] / Kb
其中[OH-]为溶液中的氢氧根离子浓度,Kb为该物质的碱解离常数。
需要注意的是,对于多种离子同时存在的体系,如混合酸、混合盐等,电离度的计算较为复杂,需要考虑各种离子之间的相互作用。
常见酸碱的电离常数

6.0×10-10
9.22
3
砷酸
H3AsO4
6.3×10-3(K1)
2.20
1.05×10-7(K2)
6.98
3.2×10-12(K3)
11.50
4
硼酸
H3BO3
5.8×10-10(K1)
9.24
1.8×10-13(K2)
12.74
1.6×10-14(K3)
13.80
5
次溴酸
HBrO
2.4×10-9
4.19
35
二苯胺
(C6H5)2NH
7.94×10-14
13.1
36
联苯胺
H2NC6H4C6H4NH2
5.01×10-10(K1)
9.30
4.27×10-11(K2)
10.37
有机酸在水溶液中的解离常数(25oC)
Dissociation Constants of Organic Acids in Aqueous Solution(25oC)
2.0×10-5
4.70
28
3-戊烯酸
CH3CH═CHCH2COOH
3.0×10-5
4.52
29
4-戊烯酸
CH2═CHCH2CH2COOH
2.10×10-5
4.677
30
戊二酸
HOCO(CH2)3COOH
1.7×10-4(K1)
3.77
8.3×10-7(K2)
6.08
31
谷氨酸
HOCOCH2CH2CH(NH2)COOH
4.74
35
(E)-3-己烯酸
CH3CH2CH═CHCH2COOH
酸碱的电离常数(解离常数)
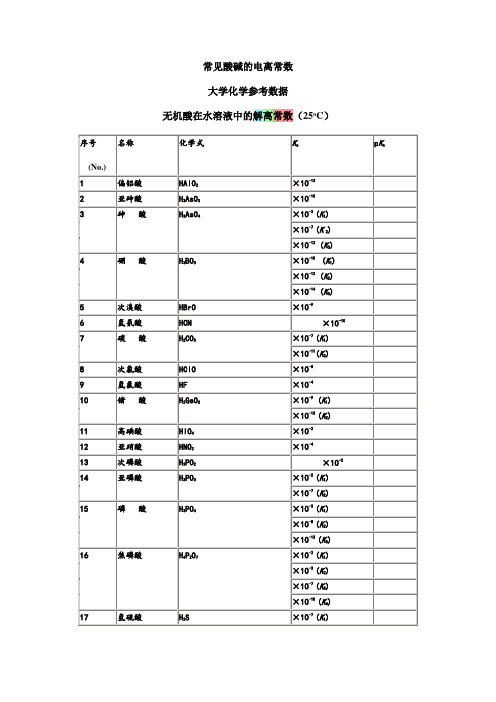
×10-2
14
亚磷酸
H3PO3
×10-2(K1)
×10-7(K2)
15
磷 酸
H3PO4
×10-3(K1)
×10-8(K2)
×10-13(K3)
Hale Waihona Puke 16焦磷酸H4P2O7
×10-2(K1)
×10-3(K2)
×10-7(K3)
×10-10(K4)
17
氢硫酸
H2S
×10-7(K1)
×10-15(K2)
×10-4(K1)
×10-7(K2)
31
谷氨酸
HOCOCH2CH2CH(NH2)COOH
×10-3(K1)
×10-5(K2)
×10-10(K3)
32
正己酸
CH3(CH2)4COOH
×10-5
33
异己酸
(CH3)2CH(CH2)3—COOH
×10-5
34
(E)-2-己烯酸
H(CH2)3CH═CHCOOH
序号(No.)
名称(Name)
化学式
(Chemical formula)
Ka
pKa
1
甲 酸
HCOOH
×10-4
2
乙 酸
CH3COOH
×10-5
3
乙醇酸
CH2(OH)COOH
×10-4
4
草 酸
(COOH)2
×10-2(K1)
×10-5(K2)
5
甘氨酸
CH2(NH2)COOH
×10-10
6
一氯乙酸
CH2ClCOOH
C6(COOH)6
×10-1(K1)
常见酸碱的电离常数(解离常数)

常见酸碱的电离常数(解离常数)电离常数(ionization constant,又称解离常数)是生物化学中一个重要的概念,它表示了一种物质在溶液中的解离度和电荷的大小。
一般情况下,电离常数越大,表明溶液中放电离子越多,pH值越低。
以下是常见酸碱的电离常数信息:1. 氢氧化钠(NaOH):电离常数为1.40×10^-22. 氢氧化钙(Ca(OH)2):电离常数为2.12×10^-53. 氢氧化镁(Mg(OH)2):电离常数为1.06×10^-114. 氢氧化氢(H2O):电离常数为1.00×10^-145. 氢氧化氯(HCl):电离常数为1.00×10^-16. 氢氧化碳酸钙(CaCO3):电离常数为4.51×10^-97. 氢氧化锌(Zn(OH)2):电离常数为2.08×10^-168. 氢氧化硫酸(H2SO4):电离常数为1.20×10^-29. 氢氧化硅酸钙(SiO2.CaO):电离常数为1.14×10^-510. 氢氧化银氨(AgNH3):电离常数为4.90×10^-1011. 氫氧化銻(Sb(OH)3):电离常数为4.25×10^-512. 氢氧化镍(Ni(OH)2):电离常数为7.75×10^-1613. 氢氧化锂(LiOH):电离常数为2.50×10^-114. 氢氧化铁(Fe(OH)2):电离常数为5.26×10^-1615. 氢氧化锆(Zr(OH)4):电离常数为2.66×10^-616. 氢氧化碳酸铝(Al2(CO3)3):电离常数为1.25×10^-917. 氢氧化氯化钠(NaClO):电离常数为3.31×10^-118. 氢氧化氯化铵( NH4ClO):电离常数为4.92×10^-219. 氢氧化高氯酸钠(NaClO3):电离常数为2.05×10^-220. 氢氧化氯化钙(Ca(ClO)2):电离常数为8.37×10^-6。
电离常数与解离常数的区别

电离常数与解离常数的区别全文共四篇示例,供读者参考第一篇示例:电离常数与解离常数是化学中常用的两个概念,它们在不同的实验条件下可以描述物质在溶液中的解离程度和相互作用强度。
虽然两者听起来很相似,但其实有着明显的区别。
在下文中,我们将从定义、计算方法、应用等方面来详细解释电离常数与解离常数的区别。
首先,我们先来了解一下电离常数和解离常数的定义。
电离常数是指在某一特定实验条件下,物质在水溶液中发生电离反应的程度的量化指标。
在溶液中,大部分物质会发生电离反应,将其分解为离子形式。
电离常数可以用来描述这个电离反应的强度和速率。
通常用Kw表示水的电离常数,其值为1.0×10^-14。
解离常数则是在给定条件下,某种物质在溶液中的解离程度的量化指标。
解离是指溶质分子在水中发生化学反应,将其分解为离子形式。
解离常数可以用来描述这种溶质在水中溶解的强度和程度。
解离常数通常用Kd或者Ksp表示,取决于具体的实验条件。
接下来,我们来看一下电离常数和解离常数的计算方法。
电离常数通常通过测定水溶液中离子的浓度来计算。
在水中,水分子会自发发生电离反应,产生氢离子和氢氧根离子。
电离常数的值可以通过氢离子和氢氧根离子的浓度来推导得出。
如果溶液中含有其他电离物质,电离常数的计算方法需要进行修正。
解离常数的计算方法与电离常数略有不同。
通常解离常数需要通过实验测定溶质在水中的溶解度来得到。
解离常数取决于溶质本身的性质和实验条件,一般来说,解离常数与溶解度之间存在一定的数学关系。
在实际应用中,电离常数和解离常数有着不同的作用。
电离常数通常用于描述酸碱溶液中离子的浓度和强度,可以帮助我们了解溶液的PH值和酸碱性质。
在化学反应中,电离常数也可以用来预测反应的平衡位置和速率。
解离常数则在溶解度平衡反应中发挥着重要作用。
解离常数可以帮助我们了解溶质在溶液中的溶解度和溶解度平衡的特性。
解离常数对于一些盐类和金属离子的溶解度平衡反应尤为重要。
常见酸碱的电离常数(解离常数)

无机碱在水溶液中的解离常数(25oC)
Dissociation Constants of Mineral Bases in Aqueous Solution(25oC)
序号(No.)
名称(Name)
化学式
(Chemical formula)
Kb
pKb
1
氢氧化铝
Al(OH)3
1.38×10-9(K3)
12.36
16
焦磷酸
H4P2O7
3.0×10-2(K1)
1.52
4.4×10-3(K2)
2.36
2.5×10-7(K3)
6.60
5.6×10-10(K4)
9.25
17
氢硫酸
H2S
1.3×10-7(K1)
6.88
7.1×10-15(K2)
14.15
18
亚硫酸
H2SO3
1.23×10-2(K1)
1.91
3.35
20
苯胺
C6H5NH2
3.98×10-10
9.40
21
苄胺
C7H9N
2.24×10-5
4.65
22
环己胺
C6H11NH2
4.37×10-4
3.36
23
吡啶
C5H5N
1.48×10-9
8.83
24
六亚甲基四胺
(CH2)6N4
1.35×10-9
8.87
25
2-氯酚
C6H5ClO
3.55×10-6
8.51×10-5(K1)
4.07
7.08×10-8(K2)
7.15
6
二甲胺
常见弱电解质电离平衡常数表
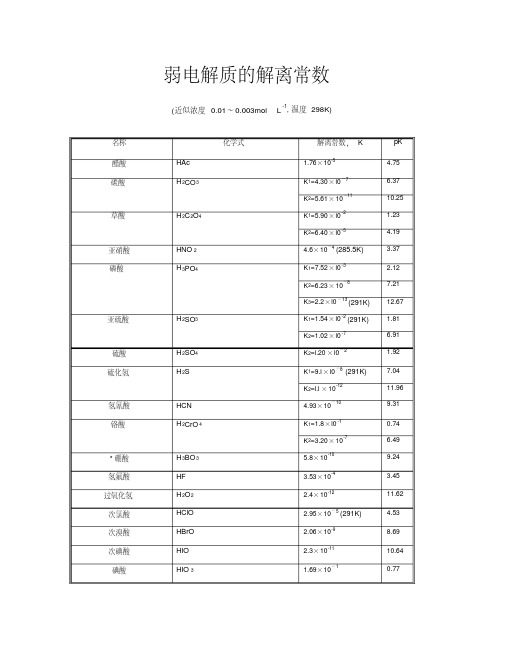
氨基乙酸 * 邻苯二甲酸
(CH 2)6N4 CO(NH 2)2 (CH 2)6N4H + HCOOH ClCH 2COOH NH 2CH2COOH C6H 4(COOH) 2
柠檬酸
(HOOCCH 2)2C(OH)COOH
K1=5.62×l0 -3 (291K) K2=l.70× l0- 7 K3=3.95 × 10-12 6× 10 -10 5.56× 10 -10 1.79× 10 - 5 8.91× 10 - 7 9.12× 10 -9 9.6× 10 -4 6.31× 10 -1 1.78× 10 - 6 2.51× 10 - 9 5.01× 10 -9 1.99× 10 -10 7.94× 10 -7 5.01× 10 - 11 K1=8.5×l0 -5 K2=7.l ×l0 -8 1.35× 10 -9 1.3× 10 -14 7.1× 10 -6 1.77×10-4 (293K) 1.40× 10 -3 1.67× 10 -10 K1=1.12 × 10-3 K2=3.91 × 10-6 K1=7.l ×10-4 K2=1.68×10-5 (293K) K3=4.1× 10 -7
氢氧化铝
氢氧化锌 氢氧化镉 * 乙二胺
HAsO 2 NH 4+ NH 3· H2O N 2H 4 NH 2OH Pb(OH) 2 LiOH Be(OH) 2 BeOH + A1(OH) 3 Al(OH) 2+ Zn(OH) 2 Cd(OH) 2 H 2NC 2H 4NH 2
* 六亚甲基四胺 * 尿素
2.98 4.34 5.1 9.0 9.89 0 9.22 9.25 4.75 6.05 8.04 3.02 0.2 5.75 8.6 8.3 9.7 6.1 10.3 4.07 7.15 8.87 13.89 5.15 3.75 2.85 9.78 2.95 5.41 3.14 4.77 6.39
hclo电离常数

hclo电离常数HClO的电离常数HClO是一种重要的无机化合物,也是含氯酸的一种。
它在化学和环境领域中具有广泛的应用,具有强氧化性和消毒性。
理解HClO的电离常数对于深入研究其在化学反应和环境中的行为至关重要。
本文将讨论HClO的电离过程以及其在不同条件下的电离常数。
HClO的电离过程是指将HClO分解为H+和ClO-的过程。
电离常数(Ka)是描述该电离过程中酸性强弱的指标,定义为酸解离常数[H+][ClO-]/[HClO]。
HClO的电离过程可以用如下方程式表示:HClO ⇌ H+ + ClO-在水溶液中,HClO的电离过程会受到溶液酸度的影响。
根据Le Chatelier原理,较酸性的溶液中HClO的电离程度会增加,而较碱性的溶液中电离程度会降低。
因此,溶液的酸度是影响HClO电离常数的一个重要因素。
在常温常压下,HClO的电离常数约为1.0×10^-8。
这意味着在纯水中,只有约0.00001%的HClO会电离为H+和ClO-。
然而,在酸性溶液中,HClO的电离程度会增加,从而使电离常数升高。
当溶液中存在其他阴离子时,HClO的电离程度也会受到影响。
这是由于其他阴离子与H+竞争水溶液中的ClO-,抑制了HClO的电离。
因此,在含有其他阴离子的溶液中,HClO的电离常数会相应降低。
除了溶液酸度和溶液成分的影响之外,温度也是影响HClO电离常数的因素之一。
一般来说,随着温度的升高,HClO的电离常数会增加。
这是因为温度升高会使化学反应速率增加,从而促使HClO更容易电离。
总结起来,HClO的电离常数受到溶液酸度、溶液成分和温度的综合影响。
这些因素决定了HClO在不同条件下的电离程度和酸性强弱。
了解HClO的电离常数有助于我们更好地理解其在化学反应和环境中的行为,为相关领域的研究和应用提供基础。
尽管HClO的电离常数相对较小,但HClO的化学性质和应用价值不可忽视。
它广泛用于消毒剂的制备、水处理和污染控制等领域,对人类生活和环境保护起着重要作用。
乙酰胺的电离常数

乙酰胺的电离常数
乙酰胺(Acetamide)是一种有机化合物,它在水溶液中可以发生电离过程。
电离常数是衡量溶液中化合物电离能力的一个指标,通常用酸解离常数(Ka)和碱解离常数(Kb)来表示。
对于乙酰胺的电离,我们可以关注它在水溶液中的酸性和碱性性质。
1. 酸性:乙酰胺具有酰胺中的氮原子,该氮原子可以接受一个质子(H+),从而形成酸性离子。
乙酰胺的酸解离常数(Ka)表示乙酰胺作为酸时的解离情况。
乙酰胺的酸解离常数相对较小,大约在10的负9次方左右。
2. 碱性:在某些情况下,乙酰胺也可以作为碱接受质子,形成带正电荷的离子。
乙酰胺的碱解离常数(Kb)表示乙酰胺作为碱时的解离情况。
然而,乙酰胺作为碱的性质相对较弱,碱解离常数较小。
需要注意的是,乙酰胺的电离程度相对较低,电离常数值较小,这意味着在水溶液中乙酰胺倾向于存在以分子的形式而不是离子形式存在。
乙酰胺的电离常数具体数值可以通过实验测定或计算方法得到。
在实际应用中,可以通过测定乙酰胺在水溶液中的酸碱性质,如测定其溶液的pH值以及酸碱度相关的化学反应等来推断乙酰胺的电离常数。
化学数据库和文献中也常有已知乙酰胺电离常数的参考数值供查询。
酸碱中的电离度和浓度关系

酸碱中的电离度和浓度关系酸碱是化学中重要的概念,它们在日常生活和工业生产中扮演着重要的角色。
酸碱溶液中的电离度和浓度关系是理解酸碱性质和进行化学计算的基础。
本文将介绍酸碱中电离度和浓度的关系,并探讨其在化学实验和应用中的重要性。
1. 电离度和浓度的基本概念在酸碱溶液中,酸和碱分子会发生电离现象,形成离子。
反应的平衡常数K可以体现电离的程度,用水解反应为例:酸HA + H2O ⇌ H3O+ + A-碱BOH + H2O ⇌ B+ + OH-在反应中,HA、BOH是完全离解的强酸和强碱,而A-、B+、H3O+、OH-是溶液中的离子,它们的浓度可以用c表示。
2. 酸碱的电离度电离度α表示酸、碱分子中发生电离的比例,α在0到1之间取值。
强酸、强碱的电离度接近于1,表示几乎所有酸碱分子都发生了电离;而弱酸、弱碱的电离度较小,只有一部分分子会电离。
电离度与浓度之间的关系可以用电离度公式表示:α = (c - c')/c其中,c是起始浓度,c'是平衡时的浓度。
3. 酸碱的浓度浓度是指单位体积内溶液中溶质的质量或物质的量。
在酸碱溶液中,可以使用物质的量浓度或摩尔浓度(mol/L)来表示溶液中酸碱的浓度。
浓度可以通过实验测定或通过化学计算来确定。
在酸碱反应中,根据化学计算的结果,可以确定酸碱的浓度,并进一步计算出电离度。
4. 电离度和浓度的关系酸碱溶液中的电离度和浓度存在一定的关系。
在相同的温度下,对于给定的酸或碱,浓度越大,电离度也越大。
这是因为溶液中更多的酸碱分子发生了电离。
例如,对于弱酸HA,其电离度α与浓度c的关系可以用近似公式表示:α ≈ √(kc)其中,k是酸的酸解离常数,它是准确测定的。
通过测定酸的pH值或其他方法得到的浓度c,可以利用这一公式计算电离度。
5. 电离度和浓度关系的实际应用电离度和浓度关系在化学实验和工业生产中有着广泛的应用。
例如,在酸碱滴定中,根据溶液的电离度和浓度关系,可以确定滴定终点和计算物质的量。
化学中ka是什么意思

化学中的ka指的是酸度系数。
Ka和Kb分别是酸式电离和碱式电离的电离平衡常数,等于电离产生的各离子的浓度乘积除以未电离的分子态的浓度。
1、Ka:表示弱酸的电离常数,条件是在室温下(25°C)。
2、Kb:弱碱的电离常数。
电离平衡常数只与温度有关,温度升高,K值增大。
电离常数反映了弱电解质的电离程度的大小,K值越大,电离程度越大,酸(或碱)性越强。
3、pKa:酸式解离常数Ka的负对数,pKa越小,酸性越强;反之,酸性越弱。
4、pKb:弱碱的电离常数Kb的负对数,表示碱性强度。
酸度系数:代号Ka值,在化学及生物化学中,是指一个特定的平衡常数,以代表一种酸离解氢离子的能力。
该平衡状况是指由一种酸(HA)中,将氢离子(即一粒质子)转移至水(H2O)。
水的浓度([H2O])是不会在系数中显示的。
离解的化学反应为:HA+H2O≒A- +H3O+
由于HA与A的电离作用就等同于水的自我离子化,酸度系数与碱度系数的积就相等于水的离解常数(Kw),在25℃下即1.0 ×10-14。
由于Ka与Kb的积是一常数,较强的酸即代表较弱的共轭碱;较弱的酸,则代表较强的共轭碱。
电离常数大于水解常数

电离常数大于水解常数电离常数和水解常数是化学中的两个非常重要的概念。
电离常数是指电解质在水溶液中完全离解的程度,水解常数则是指酸、碱和盐在水溶液中水解程度的大小。
在这两个概念中,电离常数的大小往往被认为是更加重要的指标。
因为在大多数情况下,电离常数大于水解常数,这也是绝大多数物种发生电离反应的原因。
电离常数是指一个解离产物离解的程度。
在化学反应中,一些物质会自动解离为溶解物,这些解离离子的浓度,也就是电离程度,可以用电离常数来表示。
电离常数是指在给定温度下,当给出一个1摩尔的溶液时,会产生多少量的离子。
换句话说,电离常数用于衡量反应物分解产生离子的数量。
这个概念主要适用于电解质和酸和碱。
水解常数则是指化学反应中水解程度。
当涉及到盐或酸或碱时,它们通常会与水反应,制成氢氧根离子或氢离子,这个过程被称为水解。
这个过程完成后,然后会形成等量的氢离子或氢氧根离子,从而创造出酸或碱的质子或氢氧根离子。
这里所发生的反应的程度可以使用水解常数来表示。
接下来我们要讨论的是电离常数大于水解常数的情况。
除非反应物非常弱,否则电离常数通常比水解常数大得多。
这是因为电离常数无需代表水解反应的氢氧离子,而水解反应需要氢氧离子以及离子的形成。
换句话说,电离常数反映了分子直接转换成离子的速率,而水解常数则反映了副反应的速率,例如在水中形成溶液的氢氧离子。
电离常数的高值通常反映出分子分解的强度,也就是说,在溶液中溶解的化合物,如果分子分解得快,就会直接导致电离常数高。
相比之下,水解反应的速度要慢得多,因为它需要较长的时间形成氢氧离子。
这意味着水解常数往往较低。
因此,大多数情况下,电离常数大于水解常数。
水解常数和电离常数的大小是由参与反应的离子浓度、溶液温度和pH值等因素决定的。
然而,大多数情况下,电离常数比水解常数大,即使在高浓度的特定解离产物的情况下也是如此。
在现实生活中,电离常数和水解常数被广泛应用于一系列化学反应和实验。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
9.96
42
2,4,6-三硝基苯酚
2,4,6-(NO2)3C6H2OH
5.1×10-1
0.29
43
葡萄糖酸
CH2OH(CHOH)4COOH
1.4×10-4
3.86
44
苯甲酸
C6H5COOH
6.3×10-5
4.20
45
水杨酸
C6H4(OH)COOH
1.05×10-3(K1)
2.98
4.17×10-13(K2)
常见酸碱的电离常数
大学化学参考数据
无机酸在水溶液中的解离常数(25oC)
序号
(No.)
名称
化学式
Ka
pKa
1
偏铝酸
HAlO2
6.3×10-13
12.20
2
亚砷酸
H3AsO3
6.0×10-10
9.22
3
砷酸
H3AsO4
6.3×10-3(K1)
2.20
1.05×10-7(K2)
6.98
3.2×10-12(K3)
1.92
24
硅酸
H2SiO3
1.7×10-10(K1)
9.77
1.6×10-12(K2)
11.80
25
亚碲酸
H2TeO3
2.7×10-3(K1)
2.57
1.8×10-8(K2)
7.74
无机碱在水溶液中的解离常数(25oC)
序号
名称
化学式
Kb
pKb
1
氢氧化铝
Al(OH)3
1.38×10-9(K3)
8.86
15
丙酮酸
CH3COCOOH
3.2×10-3
2.49
16
-丙胺酸
CH3CHNH2COOH
1.35×10-10
9.87
17
-丙胺酸
CH2NH2CH2COOH
4.4×10-11
10.36
18
正丁酸
CH3(CH2)2COOH
1.52×10-5
4.82
19
异丁酸
(CH3)2CHCOOH
1.41×10-5
4.85
5.5×10-5
4.26
11
乳酸(丙醇酸)
CH3CHOHCOOH
1.4×10-4
3.86
12
丙二酸
HOCOCH2COOH
1.4×10-3(K1)
2.85
2.2×10-6(K2)
5.66
13
2-丙炔酸
HC≡CCOOH
1.29×10-2
1.89
14
甘油酸
HOCH2CHOHCOOH
2.29×10-4
3.64
3.36
11
1,3-丙二胺
NH2(CH2)3NH2
2.95×10-4(K1)
3.53
3.09×10-6(K2)
5.51
12
1,2-丙二胺
CH3CH(NH2)CH2NH2
5.25×10-5(K1)
4.28
4.05×10-8(K2)
7.393
13
三丙胺
(CH3CH2CH2)3N
4.57×10-4
3.34
2.6×10-5(K1)
4.59
2.6×10-6(K2)
5.59
55
乙二胺四乙酸(EDTA)
CH2—N(CH2COOH)2
∣
CH2—N(CH2COOH)2
1.0×10-2(K1)
2.0
2.14×10-3(K2)
2.67
6.92×10-7(K3)
6.16
5.5×10-11(K4)
10.26
序号(No.)
名称(Name)
化学式(Chemical formula)
Kb
pKb
1
甲胺
CH3NH2
4.17×10-4
3.38
2
尿素(脲)
CO(NH2)2
1.5×10-14
13.82
3
乙胺
CH3CH2NH2
4.27×10-4
3.37
4
乙醇胺
H2N(CH2)2OH
3.16×10-5
4.50
5
乙二胺
H2N(CH2)2NH2
4.10
6.6×10-6(K3)
5.18
53
苯基六羧酸
C6(COOH)6
2.1×10-1(K1)
0.68
6.2×10-3(K2)
2.21
3.0×10-4(K3)
3.52
8.1×10-6(K4)
5.09
4.8×10-7(K5)
6.32
3.2×10-8(K6)
7.49
54
癸二酸
HOOC(CH2)8COOH
8.51×10-5(K1)
4.07
7.08×10-8(K2)
7.15
6
二甲胺
(CH3)2NH
5.89×10-4
3.23
7
三甲胺
(CH3)3N
6.31×10-5
4.20
8
三乙胺
(C2H5)3N
5.25×10-4
3.28
9
丙胺
C3H7NH2
3.70×10-4
3.432
10
异丙胺
i-C3H7NH2
4.37×10-4
20
3-丁烯酸
CH2═CHCH2COOH
2.1×10-5
4.68
21
异丁烯酸
CH2═C(CH2)COOH
2.2×10-5
4.66
22
反丁烯二酸(富马酸)
HOCOCH═CHCOOH
9.3×10-4(K1)
3.03
3.6×10-5(K2)
4.44
23
顺丁烯二酸(马来酸)
HOCOCH═CHCOOH
1.2×10-2(K1)
4.76
4.0×10-7(K3)
6.40
38
苯酚
C6H5OH
1.1×10-10
9.96
39
邻苯二酚
(o)C6H4(OH)2
3.6×10-10
9.45
1.6×10-13
12.8
40
间苯二酚
(m)C6H4(OH)2
3.6×10-10(K1)
9.30
8.71×10-12(K2)
11.06
41
对苯二酚
(p)C6H4(OH)2
4.27
5
甘氨酸
CH2(NH2)COOH
1.7×10-10
9.78
6
一氯乙酸
CH2ClCOOH
1.4×10-3
2.86
7
二氯乙酸
CHCl2COOH
5.0×10-2
1.30
8
三氯乙酸
CCl3COOH
2.0×10-1
0.70
9
丙酸
CH3CH2COOH
1.35×10-5
4.87
10
丙烯酸
CH2═CHCOOH
序号(No.)
名称(Name)
化学式
(Chemical formula)
Ka
pKa
1
甲酸
HCOOH
1.8×10-4
3.75
2
乙酸
CH3COOH
1.74×10-5
4.76
3
乙醇酸
CH2(OH)COOH
1.48×10-4
3.83
4
草酸
(COOH)2
5.4×10-2(K1)
1.27
5.4×10-5(K2)
5.40
50
间苯二甲酸
(m)C6H4(COOH)2
2.4×10-4(K1)
3.62
2.5×10-5(K2)
4.60
51
对苯二甲酸
(p)C6H4(COOH)2
2.9×10-4(K1)
3.54
3.5×10-5(K2)
4.46
52
1,3,5-苯三甲酸
C6H3(COOH)3
7.6×10-3(K1)
2.12
7.9×10-5(K2)
11.50
4
硼酸
H3BO3
5.8×10-10(K1)
9.24
1.8×10-13(K2)
12.74
1.6×10-14(K3)
13.80
5
次溴酸
HBrO
2.4×10-9
8.62
6
氢氰酸
HCN
6.2×10-10
9.21
7
碳酸
H2CO3
4.2×10-7(K1)
6.38
5.6×10-11(K2)
10.25
8
次氯酸
2
氢氧化银
AgOH
1.10×10-4
3.96
3
氢氧化钙
Ca(OH)2
3.72×10-3
2.43
3.98×10-2
1.40
4
氨水
NH3+H2O
1.78×10-5
4.75
5
肼(联氨)
N2H4+H2O
9.55×10-7(K1)
6.02
1.26×10-15(K2)
14.9
6
羟氨
NH2OH+H2O
9.12×10-9
2.0×10-5
4.70
28
3-戊烯酸
CH3CH═CHCH2COOH
3.0×10-5
4.52
