人教版高中化学选修41.2燃烧热 能源练习题word版试题含解析
人教版高中化学选修四1-2燃烧热能源(含答案详解).docx

高中化学学习材料唐玲出品课时作业(三) 燃烧热 能源1.下列说法正确的是( )A .在101 kPa 时,1 mol 物质完全燃烧时所放出的热量,叫该物质的燃烧热B .弱酸和碱发生中和反应生成1 mol 水,这时的反应热叫中和热C .燃烧热或中和热是反应热的种类之一D .101 kPa 时,纯物质完全燃烧生成稳定的氧化物时所放出的热量,叫该物质的燃烧热【解析】 本题旨在考查学生对燃烧热、中和热定义的理解,特别是两个概念中应注意的问题。
A 项中没有确定“物质完全燃烧生成稳定的氧化物”这一条件,所以A 项错误。
B 项在稀溶液中酸与碱发生中和反应生成1 mol H 2O 时所释放的热量称为中和热,B 项错误。
D 项中未限定物质的量是1 mol ,所以D 项错误。
【答案】 C2.下列各组物质的燃烧热相等的是( )A .碳和二氧化碳B .1 mol 碳和3 mol 碳C .3 mol 乙炔和1 mol 苯D .淀粉和纤维素【解析】 燃烧热是指1 mol 纯物质完全燃烧生成稳定的氧化物时所放出的热量,故B 正确。
D 中淀粉和纤维素都可以表示为(C 6H 10O 5)n ,但n 不同,燃烧热不同。
【答案】 B3.(2012·辽宁实验中学高二月考)25 ℃、101 kPa 下,碳、氢气、甲烷和葡萄糖的燃烧热依次是393.5 kJ/mol 、285.8 kJ/mol 、890.3 kJ/mol 、2 800 kJ/mol ,则下列热化学方程式正确的是( )A .C(s)+12O 2(g)===CO(g)ΔH =-393.5 kJ/mol B .2H 2(g)+O 2(g)===2H 2O(l)ΔH =+571.6 kJ/molC .CH 4(g)+2O 2(g)===CO 2(g)+2H 2O(g)ΔH =-890.3 kJ/molD .C 6H 12O 6(s)+6O 2(g)===6CO 2(g)+6H 2O(l)ΔH =-2 800 kJ/mol【解析】 A 中碳未完全燃烧;B 中应为放热反应ΔH =-571.6 kJ/mol ;C 中H 2O 应为液态。
高中化学专题1.2燃烧热、能源练习(含解析)新人教版选修4

1。
2 中和热、燃烧热、能源1.下列叙述正确的是A.电能是二次能源B.水力是二次能源C.天然气是二次能源D.水煤气是一次能源【答案】A【解析】电能是二次能源,A项正确;水力是一次能源,B项错误;天然气是一次能源,C项错误;水煤气是二次能源,D项错误.16.“海上风电,如东是真正的全国领先”。
下列有关说法正确的是①风能其实是太阳能的一种转换形式②风能和水能、太阳能等都是可再生能源③风力发电由风能转换为机械能,再转化为电能④在未来多能源时期,氢能、生物质能等的核心仍是化学反应A.①②③④ B.②③④ C.①②③ D.①②④【答案】A【解析】①风能是太阳能的一种转换形式,正确;②风能和水能、太阳能等都是可再生能源,正确;③风力发电由风能转换为机械能,再转化为电能,正确;④在未来多能源时期,氢能、生物质能等的核心仍是化学反应,正确;故选项A符合题意。
2.含20.0gNaOH的稀溶液与稀盐酸反应,放出28。
7kJ的热量,表示该反应中和热的热化学方程式正确的是()A.NaOH(aq)+HCl(aq)===NaCl(aq)+H2O(l) ΔH=28.7 kJ·mol-1B.NaOH(aq)+HCl(aq)===NaCl(aq)+H2O(l)ΔH=-28.7 kJ·mol-1C.NaOH(aq)+HCl(aq)===NaCl(aq)+H2O(l)ΔH=57.4 kJ·mol-1D.NaOH(aq)+HCl(aq)===NaCl(aq)+H2O(l)ΔH=-57。
4 kJ·mol-1【答案】D【解析】根据上述分析可知,A。
反应放热,焓变的符号应为“—"、数值与化学计量数不对应,A项错误;B. 焓变的数值与化学计量数不对应,B项错误;C。
反应放热焓变的符号应为“-”,C项错误;D. NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l);ΔH=-57。
4 kJ/mol,D项正确.3.已知中和热的数值是57。
2019学年高二人教版化学选修4练习:1.2燃烧热能源(Word版含答案)

第二节燃烧热能源A组1 •燃烧热与反应热的关系是()A. 燃烧热是反应热的一种类型B. 当一个反应是燃烧反应时,该燃烧反应的反应热就是燃烧热C. 燃烧热不属于反应热,反应热是在25 C、101 kPa下测定的,而燃烧反应的温度要高D•反应热有正负之分,燃烧反应的焓变全部是正值解析:可燃物是1 mol时的反应热才是燃烧热。
答案:A2. 下列说法准确的是()A. CO是不稳定的氧化物,它能继续和氧气反应生成稳定的CQ,故CO燃烧一定是吸热反应B. 在101 kPa时,1 mol碳燃烧所放出的热量为碳的燃烧热C. 物质燃烧都需要氧气D. 物质燃烧放出热量的多少与产物相关解析:A中CO是强还原剂(高温时),点燃时易和氧气反应,生成稳定的二氧化碳,故CO燃烧是放热反应;B中碳燃烧有完全燃烧与不完全燃烧,1 mol碳完全燃烧生成CQ时所放出的热量叫燃烧热;任何发光放热的剧烈的化学反应都叫燃烧,如H2在C2中燃烧。
答案:D3. 现有以下几种措施:①对燃烧煤时产生的尾气实行除硫处理;②少用原煤作燃料;③燃煤时鼓入足量空气:④开发清洁能源。
其中能减少酸雨产生的措施是()A. ①②③B.②③④C①②④ D.①③④解析:煤及其他化石燃料中含S元素,它们燃烧产生的SQ的大量排放是形成酸雨的主要原因。
对燃煤产生的尾气实行除硫,少用、不用原煤作燃料,开发清洁能源都能够减少SQ的排放,减少酸雨的产生。
燃煤时鼓入足量空气只能提升煤的燃烧效率,不能减少SQ的排放。
答案:C4. 下列关于燃烧热的说法准确的是()A. 燃烧反应放出的热量就是该反应的燃烧热B. 1 mol可燃物质发生氧化反应所放出的热量就是燃烧热C. 1 mol可燃物质完全燃烧生成稳定的化合物时所放出的热量就是燃烧热D. 在25 C、101 kPa时,1 mol纯物质完全燃烧生成稳定的氧化物时所放出的热量是燃烧热解析:燃烧热是有严格定义的,有量的要求,有燃烧产物和状态的要求,有反应条件的要求。
人教版高中化学选修四配套练习:1.2燃烧热 能源 Word版含解析

(本栏目内容,在学生用书中以独立形式分册装订!)一、选择题1.下列分别是利用不同能源发电的实例图形,其中不属于新能源开发利用的是()答案: C2.下列图示关系不正确的是()解析:燃烧热和中和热均属于反应热,两者是并列关系,A项正确;一次能源和二次能源是并列关系,而非交叉关系,B项错误;氧化还原反应既有放热反应又有吸热反应,非氧化还原反应也是既有放热反应又有吸热反应,C项正确;根据能源的分类及关系可知D 项正确。
答案: B3.下列性质中,能说明乙醇宜作燃料的是()①燃烧时发生氧化反应②充分燃烧的产物不污染环境③乙醇是一种可再生能源④燃烧时放出大量的热A.①②③B.①②④C.①③④D.②③④解析:在选择燃料时,应从物质的燃烧热(燃烧热值高),燃料的储量(储量大,可再生),对生态环境的影响(无影响或尽可能小)等各方面综合考虑,乙醇燃烧热值高,充分燃烧生成物为CO2和H2O,对环境无污染,且可以由绿色植物光合作用的产物淀粉发酵制取,是一种可再生能源,而燃烧时发生氧化反应是所有可燃物燃烧时的共性,故①错误。
答案: D4.下列说法正确的是( )A .CO 是不稳定的氧化物,它能继续和氧气反应生成稳定的CO 2,故反应一定是吸热反应B .在101kPa 时,1mol 碳燃烧所放出的热量为碳的燃烧热C .物质燃烧都需要氧气D .物质燃烧放出热量的多少与外界条件有关解析: A 中CO 是强还原剂(高温时),点燃时易和氧气反应,生成稳定的二氧化碳,故CO 燃烧是放热反应;B 中碳燃烧有完全燃烧与不完全燃烧,1mol 碳完全燃烧生成CO 2时所放出的热量叫燃烧热;任何发光放热的剧烈的化学反应都叫燃烧,如H 2在Cl 2中燃烧。
答案: D5.已知下列热化学方程式: 12CH 4(g)+O 2(g)===12CO 2(g)+H 2O(l) ΔH =-445.15kJ/molCH 4(g)+32O 2(g)===CO(g)+2H 2O(l)ΔH =-607.3kJ/molCH 4(g)+2O 2(g)===CO 2(g)+2H 2O(l) ΔH =-890.3kJ/molCH 4(g)+2O 2(g)===CO 2(g)+2H 2O(g) ΔH =-802.3kJ/mol 则CH 4的燃烧热为( ) A .445.15kJ/mol B .607.3 kJ/mol C .890.3kJ/molD .802.3 kJ/mol解析: 1mol 甲烷完全燃烧生成CO 2(g)和H 2O(l)时的ΔH =-890.3kJ/mol ,故甲烷的燃烧热为890.3 kJ/mol 。
化学人教版选修4:第一章第二节燃烧热能源 Word版含解析

高考化学选修四自我小测夯基达标1.下列说法正确的是()A.CO是不稳定的氧化物,它能继续和氧气反应生成稳定的CO2,故反应一定是吸热反应B.在11 kPa时,1 mol 碳燃烧所放出的热量为碳的燃烧热C.物质燃烧都需要氧气D.物质燃烧放出热量的多少与外界条件有关2.现有以下几种措施:①对燃烧煤时产生的尾气进行除硫处理;②少用原煤做燃料;③燃煤时鼓入足量空气;④开发清洁能源。
其中能减少酸雨产生的措施是()A.①②③B.C.①②④D.①③④3.下列热化学方程式中,ΔH能正确表示物质的燃烧热的是()4.下列说法中正确的是()A.物质燃烧放出的热量是燃烧热B.1 mol C 燃烧生成CO时放出的热量就是C的燃烧热C.1 mol H2燃烧生成水放出的热量是H2的燃烧热D.相同条件下,1 mol H2O(l)完全分解吸收的热量与H2、O2化合生成1 mol H2O(l)放出的热量数值相等5.我国首条纤维乙醇生产线——河南天冠集团吨级纤维乙醇项目,在镇平开发区开工奠基。
这一项目打破了过去单纯以粮食类原料生产乙醇的历史,使利用秸秆类纤维质原料生产乙醇成为现实。
下列有关说法中不正确的是()A.用这种纤维乙醇部分替代成品油,有助于缓解日益增长的成品油需求B.这一项目不仅使秸秆类废物得到科学利用,而且能为国家节约大量粮食C.乙醇能部分替代汽油作车用燃料是因为乙醇与汽油组成元素相同,化学成分相似D.掺入1%燃料乙醇的乙醇汽油可以使汽车尾气中一氧化碳排放量下降6.已知反应:①25 ℃、11 kPa 时,2C(s)+O2(g)====2CO(g)ΔH=-221 kJ·mol-1②稀溶液中,H+(aq)+OH-(aq)====H2O(l)ΔH=-57. kJ·mol-1又已知弱电解质电离吸热。
下列结论正确的是…()A.C的燃烧热大于1.5 kJ·mol-1B.①的反应热为221 kJ·mol-1C.稀硫酸与稀NaOH溶液反应的中和热ΔH=为57. kJ·mol-1D.稀醋酸与稀NaOH溶液反应生成1 mol 水,放出57. kJ热量7.天然气、石油、煤等在地球上的蕴藏量是有限的,因此下列说法正确的是()①可利用电解水的方法得到氢气作能源②可用酒精作燃料③砍伐树木作燃料④应开发太阳能、核能等新的能源A.①B.②和C.②和③D.④8.下列叙述中正确的是()A.在稀溶液中1 mol 酸和1 mol 碱完全反应所放出的热量,叫做中和热B.在11 kPa时1 mol 物质燃烧时所放出的热量叫做该物质的燃烧热C.热化学方程式中,各物质前的化学计量数不表示分子个数D.如果反应物所具有的总能量小于生成物所具有的总能量,则发生的反应是放热反应9.已知:2H2(g)+O2(g)====2H2O(g)ΔH=-484 kJ·mol-12H2(g)+O2(g)====2H2O(l)ΔH=-572 kJ·mol-1在11 kPa、25 ℃时,一定量的氢气、氧气混合气体点燃爆炸后再恢复至原来状况时,气体体积比原来减少了3.36 L(折合成标准状况下的体积),则反应时放出的热量是()A.28.6 kJB.57.2 kJC.24.2 kJD.72.6 kJ10.能源可划分为一级能源和二级能源。
人教版高中化学选修4-1.2《燃烧热_能源》综合练习2
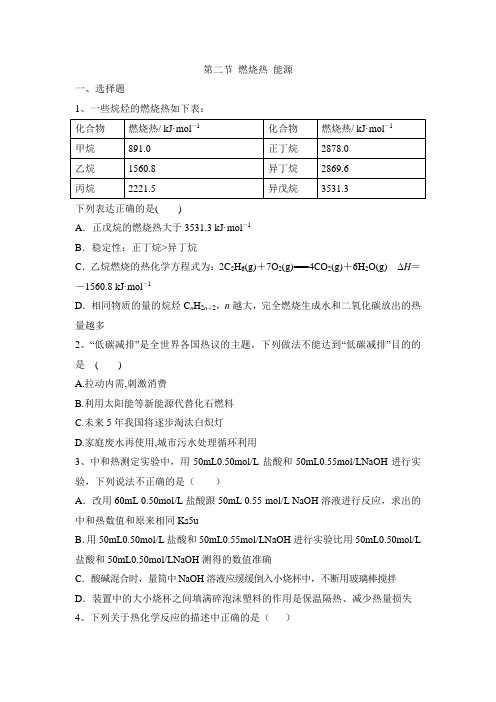
第二节燃烧热能源一、选择题1、一些烷烃的燃烧热如下表:下列表达正确的是()A.正戊烷的燃烧热大于3531.3 kJ·mol-1B.稳定性:正丁烷>异丁烷C.乙烷燃烧的热化学方程式为:2C2H6(g)+7O2(g)===4CO2(g)+6H2O(g)ΔH=-1560.8 kJ·mol-1D.相同物质的量的烷烃C n H2n+2,n越大,完全燃烧生成水和二氧化碳放出的热量越多2、“低碳减排”是全世界各国热议的主题。
下列做法不能达到“低碳减排”目的的是()A.拉动内需,刺激消费B.利用太阳能等新能源代替化石燃料C.未来5年我国将逐步淘汰白炽灯D.家庭废水再使用,城市污水处理循环利用3、中和热测定实验中,用50mL0.50mol/L盐酸和50mL0.55mol/LNaOH进行实验,下列说法不正确的是()A.改用60mL 0.50mol/L盐酸跟50mL 0.55 mol/L NaOH溶液进行反应,求出的中和热数值和原来相同Ks5uB.用50mL0.50mol/L盐酸和50mL0.55mol/LNaOH进行实验比用50mL0.50mol/L 盐酸和50mL0.50mol/LNaOH测得的数值准确C.酸碱混合时,量筒中NaOH溶液应缓缓倒入小烧杯中,不断用玻璃棒搅拌D.装置中的大小烧杯之间填满碎泡沫塑料的作用是保温隔热、减少热量损失4、下列关于热化学反应的描述中正确的是()A.HCl和NaOH反应的中和热ΔH=-57.3 kJ·mol-1,则H2SO4和Ca(OH)2反应的中和热ΔH=2×(-57.3) kJ·mol-1B.CO(g)的燃烧热是283.0 kJ/mol,则2CO2(g) =2CO(g)+O2(g)反应的ΔH=+566.0 kJ·mol-1C.需要加热才能发生的反应一定是吸热反应D.Ba(OH)2·8H2O与NH4Cl反应的焓变小于0,所以在常温下能自发进行5、已知:①H2O(g)====H2O(l) ΔH=- Q 1 kJ·mol-1②C2H5OH(g)====C2H5OH(l) ΔH=- Q 2 kJ·mol-1③C2H5OH(g)+3O2(g)====2CO2(g)+3H2O(g) ΔH=-Q3 kJ·mol-1下列判断正确的是( )A.酒精的燃烧热为Q3 kJB.若使23 g液态酒精完全燃烧,最后恢复到室温,释放出的热量为(1.5Q1-0.5Q2+0.5Q3) kJC.H2O(g)→H2O(l)释放出了热量,所以该过程为化学变化D.由反应③可知1 mol C2H5OH(g)的能量高于2CO2(g)和3H2O(g)的总能量6、下列关于热化学反应的描述中正确的是( )A.HCl和NaOH反应的中和热ΔH=-57.3 kJ·mol-1。
2019-2020学年高中化学人教版选修四同步练习:第1章第2节燃烧热、能源(2) Word版含答案.doc

第一章第二节燃烧热能源(2)1、下列分别是利用不同能源发电的实例图形,其中不属于新能源开发利用的是( )A. B.C. D.2、下列说法错误的是( )A.煤、石油、沼气均属于一级能源B.核能、水能均是可再生能源C.太阳能属于新能源D.常规天然气、页岩气均属于清洁能源3、下列图示关系不正确的是( )A. B.C. D.4、下列有关燃料的说法错误的是( )A.燃料燃烧产物CO2是温室气体之一B.化石燃料完全燃烧不会造成大气污染C.以液化石油气代替燃油可减少大气污染D.燃料不完全燃烧排放的CO是大气污染物之一5、下列关于燃烧热的说法正确的是( )A.燃烧反应放出的热量就是该反应的燃烧热B.1mol 可燃物质发生氧化反应所放出的热量就是燃烧热C.1mol 可燃物完全燃烧生成稳定的化合物时所放出的热量就是燃烧热D.在25℃、101kPa 时,1mol 纯物质完全燃烧生成稳定的氧化物时所放出的热量是燃烧热6、己知丙烷的燃烧热-12215kJ mol H ∆=-⋅,若一定量的丙烷完全燃烧后生成1.8g 水,则放出的热量约为( )A.55kJB.220kJC.550kJD.1108kJ7、下列各组物质的燃烧热相等的是( )A.C 2H 4和C 3H 6B.1mol C 和3mol CC.白磷和红磷D.淀粉和纤维素8、在25℃,101kPa 时,强酸与强碱的稀溶液发生中和反应的中和热为57.3kJ/mol ,辛烷的燃烧热(H ∆)为-5518kJ/mol 。
下列热化学方程式书写正确的是( )A.()()()()()()+2-2+-4422H aq +SO aq +Ba aq +2OH aq BaSO s +2H O l 57.3kJ/mol H =∆=-B.()()()()2424211KOH aq +H SO aq K SO aq +H O l 57.3kJ/mol 22H =∆=- C.()()()()81822225C H l +O g 8CO g +9H O g 5518kJ/mol 2H =∆=- D.()()()()8182222C H g +25O g =16CO g +18H O l 5518kJ/mol H ∆=-9、已知反应:①25 ℃、101kPa 时,2C(s)+O 2(g)2CO(g) ΔH =‒221kJ·mol ‒1,②稀溶液中,H +(aq)+OH ‒(aq) H 2O(l) ΔH =‒57.3kJ·mol ‒1。
2019-2020学年化学人教版选修4同步检测:1.2燃烧热能源Word版含解析

第二节焚烧热能源记一记1.25 ℃、 101 kPa 时, 1 mol 纯物质完整焚烧生成稳固的氧化物所放出的热量叫做该物质的焚烧热,单位是 kJ·mol-1。
2.稳固氧化物的含义:①生成的氧化物不可以再焚烧,②该氧化物在25 ℃、 101 kPa 时为稳固齐集状态。
如C→CO2(g)、 H→ H2 O(l) 、 S→ SO2 (g)。
3.太阳能、风能、地热能、核能、氢能、生物质能属于新能源。
探一探1.(1)可燃物的物质的量发生变化,其焚烧热度吗?(2)如何配平焚烧热的热化学方程式?[提示 ](1)焚烧热指 1 mol 可燃物焚烧放出的热量,与可燃物的物质的量没关。
(2)先定可燃物的化学计量数为1,再依据元素守恒和得失电子守恒配平其余物质的化学计量数。
2.如何使燃料充足焚烧?[提示 ]① 要有足够的空气;② 燃料与空气有足够大的接触面积。
3.焚烧热和中和热有何同样点和不一样之处?[提示 ]焚烧热与中和热的比较焚烧热中和热相能量放热反响变化同H 及点H <0,单位均为 kJ ·mol -1其单位不反响物不必定为 1 mol1 mol同的量生成物生成水的量为 1 mol 点不确立的量焚烧热为 中和热为表示 57. 3 kJ mol · -1或a kJ ·mol -1或方法H =- 57.3 kJ mol ·-1H =- a kJ mol · -14.如何计算可燃物的焚烧热?Q[提示 ]H =-kJ/mol 。
n 可燃物判一判判断正误 (正确的打“√”,错误的打“×”)(1)1 mol 碳在常温常压下焚烧所放出的热量为碳的焚烧热。
(× )(2)焚烧热和中和热都是发生化学反响时放出的热量,故它们对应的H<0 。
(√ )(3)1 mol H 2 完整焚烧生成 1 mol 气态水所放出的热量称为氢气的焚烧热。
(× )(4) 化石燃料主要包含石油、煤和天然气,它们储藏无穷,能够重生。
化学人教版选修4同步练习:第一章 第2节 燃烧热 能源 Word版含解析

1.对于燃烧热,下列叙述正确的是()A.在25 ℃、101 kPa时,纯物质完全燃烧生成稳定的氧化物时所放出的热量,叫做该物质的燃烧热B.反应热有正负之分,燃烧热ΔH全部是正值C.在25 ℃、101 kPa时,1 mol纯物质完全燃烧生成稳定的氧化物时所放出的热量即为该物质的燃烧热D.化学方程式前的化学计量数扩大,燃烧热亦扩大答案 C解析A项,未限定纯物质的物质的量是1 mol;B项,燃烧反应是放热反应,ΔH<0;C项,燃烧热指1 mol纯物质在25 ℃、101 kPa时完全燃烧生成稳定的氧化物时放出的热量;D项,燃烧热特指1 mol纯物质完全燃烧生成稳定氧化物时放出的热量,其数值不随化学计量数改变而改变。
2.下列说法中正确的是()A.物质燃烧放出的热量是燃烧热B.1 mol C燃烧生成CO时放出的热量就是C的燃烧热C.1 mol H2燃烧生成水时放出的热量是H2的燃烧热D.相同条件下,1 mol H 2O(l)完全分解吸收的热量与H2、O2化合生成1 mol H2O(l)放出的热量值相等答案 D解析A项中,燃烧热是指在25 ℃、101 kPa下,1 mol纯物质完全燃烧生成稳定的氧化物时放出的热量,错误;B项中碳燃烧生成的稳定化合物应为CO2,错误;C项中H2燃烧时的条件及生成水的状态不确定,故1 mol H2燃烧生成水放出的热量不一定是H2的燃烧热,错误;D项中,根据能量守恒定律可知,正确。
(1)正确理解燃烧热①一个条件:25 ℃、1.01×105 Pa。
②一个标准:1 mol纯物质。
③两个要求:“完全燃烧”“稳定的氧化物”;C→CO2(g)、H→H2O(l)、S→SO2(g)等。
④两种表示:“某物质燃烧热是a kJ·mol-1”或“某物质燃烧热是ΔH=-a kJ·mol-1”。
(2)燃烧热的计算:由燃烧热定义可知:25 ℃、101 kPa时,可燃物完全燃烧产生的热量=可燃物的物质的量×其燃烧热,即Q放=n(可燃物)×|ΔH|;或变换一下求物质的燃烧热:ΔH=-Q放n(可燃物)。
人教版高中化学选修四1.2燃烧热能源练习.docx

高中化学学习材料鼎尚图文收集整理课时作业(三)[学业水平层次(A )]1.当前世界范围内都在积极发展新能源和可再生能源,走可持续发展道路。
下列有关做法跟此无关的是( )A .将氢气、酒精设计成燃料电池,是因为燃料电池具有较高的能量利用率,同时氢气、酒精等燃料可再生B .大力开发丰富的煤炭资源,并将煤进行气化处理,提高煤的综合利用率,可减少对石油的依赖C .开发和利用太阳能、生物质能、风能等,如在我国西部和沿海地区兴建太阳能、风力发电站等D .合理开发利用海底可燃冰有助于缓解化石能源紧缺【解析】 煤、石油均属于化石燃料,它们不属于新能源和可再生能源,故B 错误。
【答案】 B2.以下几个热化学方程式,能表示燃烧热的热化学方程式是( )A .C(s)+12O 2(g)===CO(g)ΔH =110.5 kJ/mol B .C(s)+O 2(g)===CO 2(g) ΔH =-393.5 kJ/molC .2H 2(g)+O 2(g)===2H 2O(l)ΔH =-571.6 kJ/mol D .H 2(g)+12O 2(g)===H 2O(g) ΔH =-241.8 kJ/mol【解析】 A 项,C(s)燃烧未生成稳定氧化物CO 2(g),故其反应热不能叫燃烧热;B 项,符合燃烧热的定义;C 项,H 2虽然转变成了稳定的氧化物H 2O(l),但由于其反应热表示的是2 mol H 2完全燃烧时的热量变化,故不能叫燃烧热;D 项,参加燃烧的H 2虽然是1 mol ,但其生成H 2O(g),而不是H 2O(l),故它的反应热也不为H 2的燃烧热。
【答案】 B3.下列表述中正确的是 ( )A .现在人们使用的能源正向多元化发展,许多新能源不断被开发利用,其中氢能和太阳能均属于清洁能源B .已知反应CH 4(g)+2O 2(g)===CO 2(g)+2H 2O(g) ΔH =-802.3 kJ/mol ,说明甲烷的燃烧热为802.3 kJ/molC .反应热的大小与反应物和生成物的键能无关D .1 mol NaOH 分别和1 mol CH 3COOH 、1 mol HNO 3反应,放出的热量相等【解析】 1 mol 甲烷完全燃烧生成CO 2(g)和H 2O(l)时放出的热量才是燃烧热,B 错误;反应热ΔH =反应物键能总和-生成物键能总和,C 错误;醋酸是弱酸,电离时要吸收热量,故NaOH 与CH 3COOH 反应时放出的热量少,D 错误。
人教版高中化学选修四1-2《燃烧热能源》课时练.docx

高中化学学习材料鼎尚图文收集整理1-2《燃烧热能源》课时练双基练习1.下列说法正确的是()A.CO是不稳定的氧化物,它能继续和氧气反应生成稳定的CO2,故反应一定是吸热反应B.在101 kPa时,1 mol碳燃烧所放出的热量为碳的燃烧热C.物质燃烧都需要氧气D.物质燃烧放出热量的多少与外界条件有关解析:CO燃烧是放热反应;B中碳燃烧有完全燃烧与不完全燃烧,1 mol碳完全燃烧生成CO2时所放出的热量叫燃烧热;任何发光放热的剧烈的化学反应都叫燃烧,如H2在Cl2中燃烧。
答案:D2.未来新能源的特点是资源丰富,在使用时对环境无污染或很少污染,且有些可以再生。
下列各项中属最有希望的新能源的是()①天然气②煤③核能④水电⑤太阳能⑥燃料电池⑦风能⑧氢能A.①②③④B.⑤⑥⑦⑧C.③④⑤⑥ D.除①②外解析:最有希望的新能源有太阳能、燃料电池、风能、氢能等。
答案:B3.已知下列热化学方程式:2H2(g)+O2(g)===2H2O(g)ΔH=-483.6 kJ/molH2(g)+12O2(g)===H2O(g)ΔH=-241.8 kJ/mol2H2(g)+O2(g)===2H2O(l)ΔH=-571.6 kJ/mol则氢气的燃烧热ΔH是()A.-483.6 kJ/mol B.-241.8 kJ/molC.-571.6 kJ/mol D.-285.8 kJ/mol解析:本题通过方程式考查燃烧热的含义,即101 kPa时,1 mol 纯物质完全燃烧生成稳定的氧化物时所放出的热量为燃烧热。
H2生成稳定的化合物为液态水,所以由第三个方程式求出燃烧热ΔH=1 2×(-571.6 kJ/mol)=-285.8 kJ/mol。
答案:D4.(2011·济源高二检测)下列各组物质的燃烧热相等的是() A.碳和二氧化碳B.1 mol 碳和3 mol碳C.3 mol C2H2和1 mol C6H6D.淀粉和纤维素解析:燃烧热是物质的性质,与量的多少无关。
高二化学人教版选修4练习:第1章第2节燃烧热能源Word版含解析

第二节燃烧热能源课后篇巩固提升基础巩固1 •下列分别是利用不同能源发电的实例图像,其中不属于新能源开发利用的是火力发电利用的是化石能源,化石能源不属于新能源。
C2•下列说法中不正确的是 ( )A. 化石燃料在任何条件下都能充分燃烧B. 化石燃料在燃烧过程中会产生污染环境的 CO 、SO 2等有害气体C. 直接燃烧煤不如将煤进行深加工后再燃烧的效果好D. 将固体煤变为气体再燃烧,燃烧效率将提高燃料只有在与足量的空气或氧气充分接触的条件下才能充分燃烧。
A 3•能源分类相关图”如图,下列选项中的能源全部符合图中阴影部分的是(A. 煤炭、石油、潮汐能B. 水能、生物质能、天然气C. 太阳能、风能、生物质能D. 地热能、海洋能、核能解析|煤炭、石油、天然气均不是新能源;核能、地热能不是来自太阳的能量 答案|C4•下列对燃烧热的说法正确的是( )aB;太阳能、风能、生物质C 丸力黑电D 地轨能嵐电A. 1 mol纯物质完全燃烧时所放出的热量叫做该物质的燃烧热B. 放热反应的热化学方程式中,A H就是该反应物的燃烧热9.( ),1 mol S(s) 2 mol S(s) 1 mol Ba(OH) 2 D.101 kPa ,1 mol(—890 3) kJ=2 953 kJ I B 7.(H 2)(CO)(C 8H 18)H 2(g)+-O 2(g)^H 2O(l) H=-285.8 kJ mol CO(g)+ -O 2(g)^CO 2(g)H=-283.0 kJ molC 8H 18(I)+ —O 2(g)——8CO 2(g)+9H 2O(l)_1 H=-5 518 kJ mol 1CH 4(g)+2O 2(g)一CO 2(g)+2H 2O(l) H=-890.3 kJ mol -1H 2 CO C 8H 18 CH 4 , ( )A.H 2(g) 1B.CO(g) 1 gC.C 8H 18(I)D.CH 4(g)51 B8.( ) ■A. 4NH 3(g)+5O 2(g) -- 4NO(g)+6H 2O(g) H=-a kJ molB. C 6H 12O 6(s)+6O 2(g) -- 6CO 2(g)+6H 2O(l) H=-b kJ mol -1-1C. 2CO(g)+O 2(g)——2CO 2(g) H=-c kJ molD. 2CH 3CH 2OH(l)+O 2(g)^2CH 3CHO(l)+2H 2O(l) H=-d kJ mol -1解 一 1101 kPa ,1 mol, NH 31;C CO1;DCO 2 B C. D. 101 kPa;B;C51 mol; A ,101 kPa;D5.A. 101 kPaB. 1 molC. C O5B;CO5,DCA6.,CO CH 42CO(g)+O 2(g) -12CO 2(g) H =-566 kJ molCH 4(g)+2O 2(g) CO 2(g)+2H 2O(l) H =-890kJ mol -11 mol CO 3 mol CH 4A.2 912 kJB.2 953 kJC.3 236 kJD.3 867 kJ1 mol COkJ,3 mol CH 4(CH 4)CO 2,CO,A;101 kPa55,1 mol2 mol H 2O(l)5( )3 890 kJ,1 molBaSO 4⑴热稳定性:正丁烷 _____ (填>”或<”)异丁烷。
人教版高中化学选修四第二节 燃烧热 能源同步练习 .docx

高中化学学习材料鼎尚图文收集整理第二节 燃烧热 能源同步练习1. 下列关于燃烧热的说法正确的是( )A .1mol 纯物质完全燃烧时所放出的热量,叫该物质的燃烧热B .放热反应热化学方程式中△H 就是该反应物的燃烧热C .物质的燃烧热可利用仪器由实验测得D .物质燃烧必然伴随发光发热现象且肯定是氧化还原反应2. 在汽油中添加适量酒精作为汽车燃烧的技术正在逐步向全国推广。
已知C 8H 18和C 2H 5OH 燃烧的热化学方程式分别为:2C 8H 18(1) + 25O 2=== 16CO 2(g) + H 2O(1) △H= -10900kJ·mol -1, C 2H 5OH(1) + 3O 2(g) === 2CO 2(g) + 3 H 2O(1) △H=-1367 kJ·mol -1。
假定汽油的成分为C 8H 18,则用添加酒精的汽油作汽车燃料时,不能达到的目的是( )A. 节省化石燃料B. 减少有害气体的排放C. 有利于转化过剩的粮食D. 提高每千克燃料燃烧放出的热量3. 下列热化学方程式中△H 的绝对值表示可燃物燃烧热的是( ) A. CO(g)+ 21O 2(g) === CO 2(g) △H=-283.0 kJ•mol -1B. CH 4(g)+ 2O 2(g) === CO 2(g)+2H 2O(g) △H=-802.3 kJ•mol -1C. 2H 2(g)+ O 2(g) === 2H 2O(l) △H=-571.6kJ•mol -1D. C(s)+21O 2(g) === CO(g) △H=-110.5kJ•mol -14. 25℃、101 kPa 下,碳、氢气、甲烷和葡萄糖的燃烧热依次是393.5 kJ•mol -1、285.8 kJ•mol -1、890.3 kJ•mol -1、2 800 kJ•mol -1,则下列热化学方程式正确的是( )A. C(s)+21O 2(g) ===CO(g) △H =-393.5 kJ•mol -1B. 2H 2(g)+O 2(g) ===2H 2O(g) △H =+571.6 kJ•mol -1C. CH 4(g)+2O 2(g) === CO 2(g)+2H 2O(g) △H =-890.3 kJ•mol -1D. 21C 6H 12O 6(s )+3O 2(g) ===3CO 2(g) +3H 2O(l) △H =-1 400 kJ•mol -15. 100gC 不完全燃烧所得产物中,CO 所占体积为31,CO 2为32,且:C (s )+21O 2(g) === CO (g ) ΔH =-110.35 kJ•mol -1CO (g )+21O 2(g) === CO 2(g ) ΔH =-282.57 kJ•mol -1与这些碳完全燃烧相比,损失的热量为 ( )A .39.292kJB .3274.3kJC .784.92kJD .2489.44kJ6. 航天飞机常用肼(N 2H 4)和过氧化氢(H 2O 2)作动力源。
人教版化学选修四测试1-2燃烧热 能源bWord版含解析
04课后测评提实能①2CO 2――→光能2CO +O 2;②2H 2O ――→光能2H 2+O 2;③2N 2+6H 2O ――→光能4NH 3+3O 2;④CO 2+2H 2O――→光能CH 4+2O 2,要实现上述构思和方案的关键是( )A .如何使物质吸收光能转变为其他物质B .寻找催化剂C .利用光能D .利用绿色植物解析:通过题中反应不难看出,若要使燃料循环使用,则必须首先研究如何使物质吸收光能转变为其他物质,否则就无法实现燃料的循环使用。
答案:A 2.[2015·兰州一中期中]据新浪网报道,欧洲一集团公司拟在太空建立巨大的激光装置,把太阳光变成激光用于分解海水制氢。
有下列几种说法:①水分解反应是放热反应;②若用生成的氢气与空气中多余的二氧化碳反应生成甲醇储存起来,可改善生存条件;③使用氢气作燃料有助于控制温室效应;④氢气是一级能源。
其中叙述正确的是( )A .①②B .③④C.②③D.①②③④解析:①水分解反应为吸热反应,①错误;④氢气不属于一级能源,④错误。
答案:C3.[2014·南京师范大学附中模拟]下列热化学方程式中ΔH的绝对值能表示可燃物的燃烧热的是( )A.SO2(g)+12O2(g)=====催化剂△SO3(g)ΔH=-98.3 kJ·mol-1B.CH4(g)+2O2(g)===CO2(g)+2H2O(g)ΔH=-802.3 kJ·mol-1 C.2H2(g)+O2(g)===2H2O(l)ΔH=-571.6 kJ·mol-1D.CO(g)+12O2(g)===CO2(g)ΔH=-283 kJ·mol-1解析:A项中反应指的是SO2的催化氧化反应,而不是SO2的燃烧反应,错误。
B项中产物是气态水而非液态水,错误。
C项中可燃物H2的物质的量不是1 mol而是2 mol,错误。
答案:D4.[2015·太原五中期中]下列热化学方程式书写正确的是(ΔH的绝对值均正确)( ) A.C2H5OH(l)+3O2(g)===2CO2(g)+3H2O(g)ΔH=-1367.0 kJ·mol-1(燃烧热)B.NaOH(aq)+HCl(aq)===NaCl(aq)+H2O(l)ΔH=+57.3 kJ·mol-1(中和热)C.2NO2===O2+2NO ΔH=+116.2 kJ·mol-1(反应热)D.S(s)+O2(g)===SO2(g) ΔH=-296.8 kJ·mol-1(反应热)解析:燃烧热必须是可燃物生成稳定的化合物对应的热效应,而气态水不是稳定的化合物,故A错误;中和反应是放热反应,ΔH<0,故B错误;书写热化学方程式时必须标明物质的状态,C错误。
人教版高中化学选修四1.2燃烧热、能源练习新.docx

高中化学学习材料唐玲出品第一章《化学反应与能量》第二节《燃烧热能源》周考卷三——燃烧热、能源一、选择题(每小题4分,每小题有1-2个正确选项)1.2007年3月,温家宝指出“优化结构、提高效益和降低消耗、保护环境”,这是我国国民经济和社会发展的基础性要求。
你认为下列行为不符合这个要求的是( ) A.大力发展农村沼气,将废弃的秸秆转化为清洁高效的能源B.加快太阳能、风能、生物质能、海洋能等清洁能源的开发利用C.研制开发以水代替有机溶剂的化工涂料D.将煤转化成气体燃料可以有效地减少“温室效应”的气体产生答案:D2.甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应原理是①CH3OH(g)+H2O(g)===CO2(g)+3H2(g);ΔH=+49.0kJ·mol-1②CH3OH(g)+1/2O2(g)===CO2(g)+2H2(g);ΔH=-192.9kJ·mol-1下列说法正确的是( )A.CH3OH的燃烧热为192.9kJ·mol-1B.反应①中的能量变化如下图所示C .CH 3OH 转变成H 2的过程一定要吸收能量D .根据②推知反应:CH 3OH(l)+1/2O 2(g)===CO 2(g)+2H 2(g)的ΔH >-192.9kJ ·mol -1解析:本题考查了化学反应中的能量变化、燃烧热的概念及热化学方程式的计算。
燃烧热指1mol 可燃物完全燃烧生成稳定的氧化物所放出的热量,CH 3OH 燃烧生成稳定的氧化物是CO 2(g)、H 2O(l),方程式①不表示燃烧热的热化学方程式,A 不正确。
反应①是吸热反应,说明生成物的总能量大于反应物的总能量,B 不正确。
由反应①②可知CH 3OH 转化成H 2可能是吸热反应,也可能是放热反应。
D 项中CH 3OH(l)到CH 3OH(g)需要吸收热量,所以CH 3OH(l)燃烧放出的热量少,则ΔH >-192.9kJ ·mol -1(比较ΔH 要带正负号)。
人教版高中化学选修四课时训练3燃烧热能源Word版含解析

人教版高中化学选修四课时训练3燃烧热能源Word版含解析一、燃烧热的概念1.下列关于燃烧热的说法中正确的是( )A.1 mol物质燃烧所放出的热量B.常温下,可燃物燃烧放出的热量C.在1.01×105 P a时,1 mol纯物质完全燃烧生成稳定的氧化物时所放出的热量D.燃烧热随化学方程式前的化学计量数的改变而改变解析:该题考查对燃烧热概念的理解。
燃烧热是指在1.01×105 P a时,1 mol 纯物质完全燃烧生成稳定氧化物时放出的热量。
答案:C2.下列表示可燃物燃烧热的热化学方程式是( )A.CO(g)+O2(g)CO2(g)ΔH=-283.0 kJ·mol-1B.CH4(g)+2O2(g)CO2(g)+2H2O(g)ΔH=-802.3 kJ·mol-1C.2H2(g)+O2(g)2H2O(l)ΔH=-571.6 kJ·mol-1D.C(s)+O2(g)CO(g)ΔH=-110.5 kJ·mol-1解析:B项中水为气态;C项中H2为2 mol;D项中生成的CO为不稳定氧化物,故只有A项正确。
答案:A3.下列说法正确的是( )A.在101 kPa时,1 mol S(s)和2 mol S(s)的燃烧热相等B.1 mol浓硫酸与1 mol Ba(OH)2完全中和所放出的热量为中和热C.CO是不稳定的氧化物,它能继续与氧气反应生成稳定的CO2,所以CO的燃烧反应一定是吸热反应D.101 kPa时,1 mol碳燃烧所放出的热量为碳的燃烧热解析:由燃烧热的定义可知,燃烧热与物质的量无关,故A项正确;中和热是指在稀溶液里酸与碱发生中和反应生成1 mol水时的反应热,而这里是浓硫酸,而且生成2 mol H2O(l)和BaSO4沉淀,故B项错误;CO的燃烧反应是放热反应,故C项错误;101 kPa时,1 mol碳完全燃烧生成二氧化碳气体所放出的热量才是碳的燃烧热,故D项错误。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
1-2《燃烧热能源》课时练双基练习1.下列说法正确的是()A.CO是不稳定的氧化物,它能继续和氧气反应生成稳定的CO2,故反应一定是吸热反应B.在101 kPa时,1 mol碳燃烧所放出的热量为碳的燃烧热C.物质燃烧都需要氧气D.物质燃烧放出热量的多少与外界条件有关解析:CO燃烧是放热反应;B中碳燃烧有完全燃烧与不完全燃烧,1 mol碳完全燃烧生成CO2时所放出的热量叫燃烧热;任何发光放热的剧烈的化学反应都叫燃烧,如H2在Cl2中燃烧。
答案:D2.未来新能源的特点是资源丰富,在使用时对环境无污染或很少污染,且有些可以再生。
下列各项中属最有希望的新能源的是()①天然气②煤③核能④水电⑤太阳能⑥燃料电池⑦风能⑧氢能A.①②③④B.⑤⑥⑦⑧C.③④⑤⑥D.除①②外解析:最有希望的新能源有太阳能、燃料电池、风能、氢能等。
答案:B3.已知下列热化学方程式:2H2(g)+O2(g)===2H2O(g)ΔH=-483.6 kJ/molH2(g)+12O2(g)===H2O(g)ΔH=-241.8 kJ/mol2H2(g)+O2(g)===2H2O(l)ΔH=-571.6 kJ/mol 则氢气的燃烧热ΔH是()A.-483.6 kJ/mol B.-241.8 kJ/molC.-571.6 kJ/mol D.-285.8 kJ/mol解析:本题通过方程式考查燃烧热的含义,即101 kPa时,1 mol 纯物质完全燃烧生成稳定的氧化物时所放出的热量为燃烧热。
H2生成稳定的化合物为液态水,所以由第三个方程式求出燃烧热ΔH=1 2×(-571.6 kJ/mol)=-285.8 kJ/mol。
答案:D4.(济源高二检测)下列各组物质的燃烧热相等的是()A.碳和二氧化碳B.1 mol 碳和3 mol碳C.3 mol C2H2和1 mol C6H6D.淀粉和纤维素解析:燃烧热是物质的性质,与量的多少无关。
答案:B5.25℃、1.01×105 Pa时,下列哪个反应放出的热量能表示乙炔的燃烧热(单位:kJ/mol)()A.2C2H2(g)+5O2(g)===4CO2(g)+2H2O(g)B.C2H2(g)+52O2(g)===2CO2(g)+H2O(l)C.C2H2(g)+32O2(g)===2CO(g)+H2O(g)D.C2H2(g)+32O2(g)===2CO(g)+H2O(l)解析:燃烧热是指在25℃、101 kPa时完全燃烧1 mol纯物质生成稳定的化合物时所放出的热量。
答案:B6.氢能是一种既高效又干净的新能源,发展前景良好,用氢作能源的燃料电池汽车备受青睐。
我国拥有完全自主知识产权的氢燃料电池轿车“超越三号”,已达到世界先进水平,并加快向产业化的目标迈进。
氢能具有的优点包括()A.①②B.①③C.③④D.②④答案:A7.下列有关能量转换的说法正确的是()A.煤燃烧是化学能转化为热能的过程C.动物体内葡萄糖被氧化成CO2是热能转变成化学能的过程D.植物通过光合作用将CO2转化为葡萄糖是太阳能转变成热能的过程解析:本题考查了自然界中能量的转化方式。
煤燃烧不仅转化为热能,A错;动物体内葡萄糖的氧化是化学能转化为其他形式的能量,C错;光合作用是太阳能转化为化学能的过程,D错。
答案:B8.在相同温度和压强下,将32 g硫分别在纯氧中和空气中完全燃烧,令前者放出的热量为ΔH1,后者放出的热量为ΔH2,则关于ΔH1和ΔH2的数值大小,正确判断是()A.ΔH1=ΔH2B.ΔH1>ΔH2C.ΔH1<ΔH2D.无法判断解析:由题意知反应物与生成物之间的能量差是定值,燃烧时有发光发热的现象,硫在纯氧中燃烧有明亮的蓝紫色火焰,在空气中燃烧有淡蓝色火焰。
显然,无论是在什么条件下燃烧,都有一部分化学能转化成了光能,而且转化成光能越多,转化成热能就越少。
答案:C9.一定条件下,充分燃烧一定量的丁烷放出热量为Q kJ(Q>0),经测定完全吸收生成的二氧化碳需消耗5 mol/L的KOH溶液100mL,恰好生成正盐,则此条件下反应:C4H10(g)+13/2O2(g)===4CO2(g)+5H2O(g)的ΔH为()A.+8Q kJ/mol B.+16Q kJ/molC.-8Q kJ/mol D.-16Q kJ/mol解析:由题意可得如下关系:C4H10——4CO2——8KOH1 mol8 moln mol 0.5 mol解得:n=116mol,当1 mol C4H10燃烧时放出的热量应为16Q,ΔH为负值。
答案:D10.能源是经济发展重要的物质基础。
目前我国使用的主要能源煤、石油、天然气都属于不可再生资源,因此,开发利用新能源就显得格外重要,利用新能源发电的形式很多(见下图),其中A表示潮汐能发电,B表示地热能发电,C表示__________能发电,D表示__________能发电。
A. B.C . D.解析:从图中可以看出C 利用的是风能,而D 利用的是太阳能。
答案:风 太阳能力提升11.能源是人类生存和发展的重要支撑因素。
常规能源(煤、石油、天然气等)日益减少、促使人们去研究能源的利用率和新能源(如太阳能、氢能、核能等)的开发。
某些科学家对以下三个化学反应很感兴趣:①3FeCl 2+4H 2O=====500℃Fe 3O 4+6HCl +H 2②2Fe 3O 4+3Cl 2+12HCl===6FeCl 3+6H 2O +O 2③6FeCl 3=====300℃6FeCl 2+3Cl 2↑ 科学家想利用上述反应来制取一种很有意义的物质是__________。
该物质作为燃料的主要优点有__________________ ______________________________________________。
(至少填三点)解析:将①×2+②+③可得:2H 2O===2H 2↑+O 2↑,相当于用H 2O 制H 2。
12.化学反应过程中发生物质变化的同时,常常伴有能量的变化。
这种能量的变化常以热量的形式表现出来,叫做反应热。
由于反应的情况不同,反应热可以分为许多种,如燃烧热和中和热等。
(1)下列ΔH表示物质燃烧热的是__________;表示物质中和热的是__________(填“ΔH1”、“ΔH2”、“ΔH3”等)。
A.2H2(g)+O2(g)===2H2O(l)ΔH1B.C(s)+1/2O2(g)===CO(g)ΔH2C.CH4(g)+2O2(g)===CO2(g)+2H2O(g)ΔH3D.C(s)+O2(g)===CO2(g)ΔH4E.C6H12O6+6O2(g)===6CO2(g)+6H2O(l)ΔH5F.NaOH(aq)+HCl(aq)===NaCl(aq)+H2O(l)ΔH6G.2NaOH(aq)+H2SO4(aq)===Na2SO4(aq)+2H2O(l)ΔH7H.CH3COOH(aq)+NaOH(aq)===CH3COONa(aq)+H2O(l)ΔH8(2)根据2.00 g C2H2气体完全燃烧生成液态水和CO2气体,放出99.6 kJ的热量,写出该反应的热化学方程式:___________________。
解析:解答本题首先要明确燃烧热和中和热的概念,然后据此进行分析、判断和计算。
(1)根据燃烧热的含义可知ΔH4、ΔH5为燃烧热。
根据中和热的含义可知ΔH6为中和热。
(2)2.00 g C2H2完全燃烧放出热量为99.6 kJ可得1 mol C2H2气体完全燃烧放出热量为99.6 kJ÷(2.00 g/26 g)=1 294.8 kJ。
故C2H2气体燃烧的热化学方程式为:C2H2(g)+52O2(g)===2CO2(g)+H2O(l)ΔH=-1 294.8 kJ/mol答案:(1)ΔH4、ΔH5ΔH6(2)C2H2(g)+52O2(g)===2CO2(g)+H2O(l)ΔH=-1 294.8 kJ/mol13.某学校化学科研小组使用一些废旧物品组装了一个简易装置,用来测定乙醇的燃烧热,过程如下:①用一只空墨水瓶,盖上钻一小孔,插入一段玻璃管,灯芯通过玻璃管伸入墨水瓶中;②取小食品罐头盒,去了盖子,开口的两侧各钻一小孔,准备系线绳用,罐头盒外面缠上石棉绳;③用绝热板(或用硬纸板代替)做成一个圆筒,圆筒下剪开一排小孔,便于进入空气。
圆筒正好套在罐头盒和自制酒精灯外边。
如图所示;④准确量取200毫升水,倒入罐头盒中,__________;⑤在自制酒精灯中注入容积的12的无水乙醇,并使灯芯浸入无水乙醇中,__________;X k b 1 . c o m⑥点燃灯芯,使火焰接触罐头盒底进行加热,并用环形玻璃搅拌棒在罐头盒里上下轻轻地搅动;⑦当水温上升到40℃~50℃时,熄灭灯焰。
记录下最高温度t2;⑧再次称量自制酒精灯的质量m2;⑨更换水,添加无水乙醇,重复以上实验。
(1)请结合实验信息,补充④、⑤中实验操作。
④__________________________________________________。
⑤__________________________________________________。
(2)该小组同学通过实验并查阅资料得到了如表实验数据:请根据Q=21m1-m2,利用测得的数据计算乙醇的燃烧热并填入表中。
(3)结合计算结果分析误差产生的原因(两条即可):①____________________________________________________。
②____________________________________________________。
(4)实验中当水温上升到40℃~50℃时,即熄灭灯焰,记录最高温度,温度太高或太低时,会对结果产生什么影响?解释原因。
解析:解答本题的关键是准确测量出水温的变化及酒精质量的变化,然后由Q=mc(t2-t1)Mm1-m2计算放出的热量。
答案:(1)测得其温度为t1称得其质量为m1(2)1 285.4 1 093.9(3)圆筒中空气流通带走热量圆筒绝热性能差(4)温度过低,圆筒中空气流通带走的热量占较大的百分比;温度过高,内外温差大,散失的热量会更多,都会使误差增大。
