有机化学复习-羧酸及其衍生物
有机化学--羧酸及其衍生物

POCl3
HCl↑
O R C OH
SOCl2
O R C Cl
SO2↑
低、高沸点 ↑ HCl 的酰氯制备 都适合
② 酸酐的生成
羧酸在脱水剂如五氧化二磷的存在下,加热。两分子羧 酸失去一分子水而形成酸酐。
R-C OH R-C OH O R-C O R-C + H2O
P2O5
△
(产率较低)
O
分子量较大的羧酸在乙酐(作脱水剂)存在下,失水生 成酸酐。反应平衡中发生了酸和酸酐的交换。 O O CH3-C 2R-C-OH + O CH3-C O
任何使酸根负离子稳定的因素都将增加其酸性,羧酸根负离 子愈稳定,愈容易生成,酸性就愈强。
(1)电子效应的影响
诱导效应:X—COOH
-I使酸性增强, +I使酸性减弱
X= F Cl Br I CHO 3.53 NO2 1.68
+N(CH ) 3 3
pKa 2.66 2.86 2.90 3.18
1.83
O CH3CH2 C
丙酰基
O C
苯甲酰基
CH3 CH3 CH3CH-CHCH2COOH CH3CH-CHCH21 COOH 4 3 2 CH2CH3 CH
5 6 3
CH3-C =CH-COOH CH3 3-甲基-2-丁烯酸
γ β α
4
3
2
1
3,4-二甲基戊酸 CH2-COOH CH2-COOH 丁二酸
羧酸铵盐 腈的水解为其逆反应:
酰胺
腈
O C OH + HNH-
O C NHN-苯基苯甲酰胺
+ H2 O
扑热息痛
3、羧基的还原 (LiAlH4)
有机化学:12 羧酸及羧酸衍生物

C
+
O C O
H
(二)羧基上羟基的取代反应
O 酰卤 O 酸酐 O O 酯 O 酰胺 R C X R C O C R R C O R R C NH2(R)
1.成酯反应
O R C OH + H OR' H
+
O R C OR' + H2O
称酯化反应 反应特点:用酸做催化剂,反应可逆,速率慢
1.成酯反应
(1)诱导效应
HCOOH > CH3COOH > CH3CH2COOH
pKa 3.77 4.76 4.88
(一)酸性
如:卤素的位置——越靠近羧基影响越大
CH3CH2CHCOOH Cl
CH3CHCH2COOH CH2CH2CH2COOH Cl Cl
pKa
2.86
4.41
4.70
卤素的数目——越多,酸性越强
RCH2COOH + RCHCOX
X RCHCOOH
X X 该反应称为赫尔-佛尔哈德-泽林斯基(Hell-VolhardZelinsky)反应。 α-位如果还有H,可以进一步发生卤代反应,直至 所有α-H全部反应完。
问:
COOH CH3COOH 1 COOH 2 H2C COOH COOH 3
CH3COOH+SOCl2
pKa
4.20
3.83
4.09
4.10
2.电子效应的影响
邻位取代:
C和 I 都发挥作用,还有空间效应,情况复杂。
除氨基外,-X、-CH3、-OH、NO2酸性都比间 位或对位取代的强。邻位有取代时,羧基与 苯环不共平面,苯环电子云向羧基偏移少。
有机化学-羧酸及其衍生物

O CH3OC
O
H+
COCH3 + 2HOCH2CH2OH -2CH3OH
酯交换
O
O
O HOCH2CH2 OC
O
CH3OC
COCH3
COCH2CH2OH
HOCH2CH2OH
酯交换
O
O
C
C OCH2CH2O n n=80100
( 涤纶 )
16
4、酰胺的反应
酰胺的反应活性更小,需在酸或碱催化下长时间
加热回流才能水解
O
或 其它试剂
R CH
醛
水解反应 醇解反应 胺解反应
还原反应
11
1、酰氯的取代反应
H—OH O
R—C—Cl + H—OR'
H—NH2
O
R—C—OH O
HCl 水解
R—C—OR' + HCl 醇解
O
R—C—NH2 NH4Cl 氨解
(酰氯活性大是个优良的酰基化试剂)
O CH3CCl + CH3CH2CH2OH
RCH2
O CX
O
O
RCH2 C O C R
O RCH2 C OR'CH C
H
有弱酸性
可加成至 饱和
L
可被亲核 试剂取代
L: 离去基团 (Leaving group)
9
一、羧酸衍生物的取代反应
这类反应是羧酸衍生物与羧酸、以及羧酸衍生物 之间的相互转化。
O RCL
HOH
R C OH
RCOOH
OO
O
RC O C R HOR'
R C OR' RCOOH
有机化学第十三章 羧酸及其衍生物
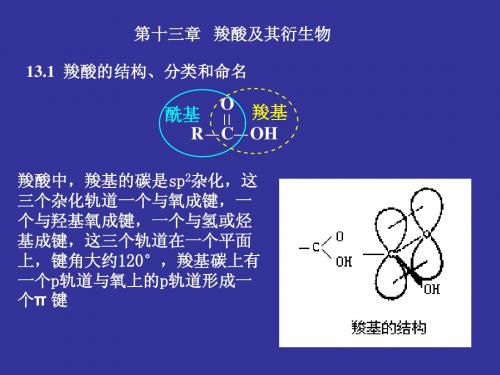
2) 与羰基相连的基团(Y) 空间体积; 3) 与羰基相连的基团(Y)
离去能力; 4) 反应物稳定化程度。
离去基团的离去能力: X- > RCOO- > RO > H2N
O R C Y
OR C Y+
羧酸衍生物亲核取代反应活性顺序:
O O O O > RCNH2 ~ ~ RCN
RCX > RCOCR >
RCH2Cl3 + H2O RCH2CN + H2O RCH2COOR' + H2O ......
RCH2COOH
13.3 羧酸的物理性质(P309) 13.4 羧酸的化学性质(P311) 1、酸性和成盐
sp
2
自学
R C
O OH R C
O
O OH
O C O
R C O-
两个碳氧键键长不同
四电子三中心的分子轨道 两个碳氧键键长等同。
O HO HC HOH2C OH
O
CH3
OH
Erythromycin A (红霉素) A
Vitamin C
• 酰胺
CH3 O O HCN-CH3 CH3
N,3-二甲基戊酰胺 N,N-二甲基甲酰胺
COOH
CH3CH2CHCH2CNHCH3
NHCOCH3
4-乙酰氨基-1萘羧酸
氮原子上有取代基, 在取代基名称前加N标出。
O NH R O R-C-NH N O S CH3 CH3 COOH
R=C6H5CH2(penicillin G)
γ -内酰胺
青霉素 ( penicillin )
物理性质(自学)
13.9 羧酸衍生物的物理性质
有机化学第10章羧酸及其衍生物
. 6H O 2
Ⅱ羧酸衍生物
羧酸分子中的羧基被不同基团取代的产物—羧酸的衍生物。 一、命名
酰氯和酰胺的命名相同,以它所含酰基命名
O O C CH 3 C Cl Cl CH3 C NH2 C NH2 O O
O H C N
CH3
O C H 3 C N H C H 2C H 3
CH3
N,N‘—二甲基甲酰胺(DMF)
O H2 R
'
+
-H R
+
O R C OR
'
H
(4)酰胺的形成
先得到铵盐,将铵盐加热,首先失去一分子水,生成酰胺,继续加热失水成腈。
O R C OH O O ONH
4
+
NH3
R
C
-H 2 O
R
C
NH2
-H 2 O
R
C
N
正好是腈水解的逆反应。 芳香、二元羧酸同样具有上述反应,可生成单酰氯、单酯也可生成二酰氯二酯。
2-丁烯酸
二元羧酸、 选取含有两个羧基的最长碳链,叫某二酸。
COOH H 3 CH 2 C H C HOOCCH COOH
2 CH 2 CH 2 CH 2 COOH
乙基丙二酸
HOOCCH=CHCOOH
已二酸
丁烯二酸 芳香酸:把芳环作为取代基
COOH COOH CH=CH-COOH HOOCH
2C
邻苯二甲酸
三、化学性质 1、酸性 RCOOH可看作 HOH中的H被酰基
R O C
取代的产物。
由于羰基的π 键与羟基氧原子上未共用电子对形成P-π 共轭体系,—OH氧上电子密度因向羰基转移而有所降低,使得—OH中氢氧间电 子密度降低,键强度减弱,以致—OH中的氢以质子形成离解,所以酸性比弱酸 和水强得多。但与强酸相比,羧酸只属于弱酸。
有机化学复习考试题及答案第十三章羧酸及其衍生物
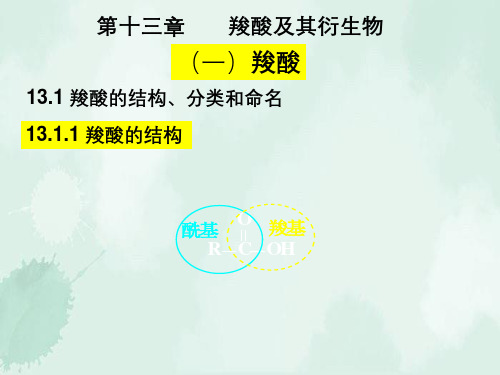
13.5.3 丙烯酸 • 丙烯酸的制备
丙烯气相氧化
CH2=CH—CH3
O2,MoO3
280~360℃, 0.2~0.3MPa
CH2=CH—COOH
• 丙烯酸具有羧酸和烯烃双重性质。双键易发生氧化和 聚合反应。控制聚合反应程度,可得不同用途的聚合 物。工业上用作分散剂、涂料、粘合剂。
13.6 二元羧酸(自学 )
(2) 羧酸的命名 •俗名——根据天然来源
•系统命名法
(1)选择含有羧基的最长碳链为主链(母体);
(2)碳链编号时,从羧基的碳原子开始;
(3)酸前要冠以官能团位置的数字(编号最小);
(4)其它同烷烃的命名规则
俗名
系统名
O CCC C C C
OH
6 5432 1
例如:
CH2=CH-COOH C H3C -H = C HC -O O H
苯甲酸(安息香酸)
C H3
对甲苯甲酸
• 多元芳香族羧酸的命名 • 用“羧酸”或“甲酸”作字尾,其它作为取代基
COOH
COOH
COOH
COOH
对苯二羧酸
环己烷羧酸
(对苯二甲酸,1,4-苯二甲酸)(环己烷甲酸)
-萘羧酸 -萘甲酸;1- 萘甲酸
13.2 羧酸的制法 13.2.1 从伯醇或醛制备羧酸
• 不饱和醇或醛须用弱氧化剂制备
6MPa, 150~250℃
3. 烯烃制备羧酸——双键断裂
RCH=CHR’ + 4[O] K2Cr2O7+H2SO4 R’COOH
4. 环状烯烃制备——二元羧酸
RCOOH +
+ 4[O]
5. 丙烯酸的制备
CH2CH2COOH CH2CH2COOH
有机化学羧酸及其衍生物
Organic Chemistry
Ⅰ羧酸
一、羧酸、羧基的结构 1)羧酸:
H
C O
OH
R
C O
OH
Ar C O
OH
Organic Chemistry
Chapter 9 羧酸及其衍生物
2)羧基的结构:
C O
R
Organic Chemistry
OH
O
..
R C O H
形式上看,羧基由羰基和羟基组成。羟基氧原子的未共用电子对所 占据的 p轨道和羰基的 π键形成 p-π共轭。羟基氧上电子云密度有所 降低,羰基碳上电子云密度有所升高。因此,羧酸中羰基对亲核试 剂的活性降低,不利于HCN等亲核试剂反应。 Organic Chemistry
对于含不饱和键的不饱和羧酸则取包括羧基和不饱和键的最长碳链为主链称某烯酸并注明不饱和键的位置命名含脂碳环羧酸和芳香羧酸时则把脂碳环和芳环当作取代基choh3乙基己酸3丙基4戊烯酸coohchcoohchcoohcoohcooh乙基丙二酸邻苯二甲酸环戊基甲酸四物理性质羧酸的沸点比相近分子质量的其它有机物要高
3—丙基—4—戊烯酸
COOH
COOH
乙基丙二酸
环戊基甲酸
邻苯二甲酸
Organic Chemistry
Chapter 9 羧酸及其衍生物
四、物理性质
羧酸的沸点比相近分子质量的其它有机物要高: 乙 丙 酸(60):117.9℃ 醛(58): 48.8℃ 8 ℃
Organic Chemistry
正丙醇(60): 97.4℃ 甲乙醚(60):
味道 沸点
酰氯和酸酐都对粘膜有刺激性,酯有香味。 酰氯、酸酐和酯由于不能形成氢键,熔沸点与分子量相近
2024届高考化学一轮复习教案(人教版)第十一单元 有机化学 第5讲

第5讲羧酸羧酸衍生物复习目标1.掌握羧酸、羧酸衍生物的典型代表物的结构、性质与相互转化。
2.掌握羧酸及其衍生物与其他有机物的相互转化。
3.了解有机分子中官能团之间的相互影响。
一、羧酸1.概念:由01烃基(或氢原子)与02羧基相连构成的有机化合物,官能团为03—COOH ,饱和一元羧酸的通式为04C n H 2n O 2(n≥1)。
2.分类羧,酸HCOOH )、乙酸、硬脂酸HOOC—COOH )3.羧酸的化学性质羧酸的化学性质主要取决于羧基,反应时的主要断键位置如图:(1)酸的通性(以乙酸为例):乙酸是一种弱酸,其酸性比碳酸01强,在水溶液里的电离方程式为02CH 3COOH CH 3COO -+H +。
可以与Na 、NaOH 、Na 2CO 3、NaHCO 3等反应。
(2)酯化反应:酸脱03羟基,醇脱04氢。
如CH 3COOH +C 2H 185OH浓H 2SO 4△05CH 3CO 18OCH 2CH 3+H 2O 。
4.几种重要的羧酸(1)甲酸:俗名蚁酸,是最简单的饱和一元羧酸。
结构:既有01羧基,又有02醛基,具有羧酸与醛的性质。
△(NH4)2CO3+2Ag↓+2NH3+H2O。
银镜反应:HCOOH+2[Ag(NH3)2]OH――→(2)乙酸:CH3COOH,有强烈刺激性气味的无色液体,低于16.6℃凝结成固体,又称03冰醋酸,04易溶于水和乙醇。
(3)乙二酸:,俗名05草酸,属于还原性酸,可用来洗去钢笔水的墨迹。
(4)苯甲酸:,属于芳香酸,可作防腐剂。
二、羧酸衍生物1.酯(1)结构:羧酸酯的官能团为01(酯基),可表示为,饱和一元羧酸与饱和一元醇所生成酯的通式为02C n H2n O2(n≥2)。
(2)物理性质(3)化学性质酯的水解反应原理06。
07。
无机酸只起08催化作用,碱除起09催化作用外,还能中和水解生成的酸,使水解程度增大。
2.油脂(1)油脂的组成油脂的主要成分是一分子01甘油与三分子02高级脂肪酸脱水形成的酯。
大学有机化学下学期复习题

N-亚硝基化物 油层 丙醇 水相
①HCl ②NaOH
乙醚提取蒸馏
41
(4)
酰化N-甲基苯胺
乙酰氯
水相(NaOH中和)
HCl
油相
乙醚提取
洗涤蒸馏
42
9.完成下列转换
Cl Cl
(1)
NH2 NO2
CH3
NH2 NO2
(2)
NO2
CH3
43
Cl
Cl
(1)
NH2 NO2
Cl
(CH3CO)2O
Cl
Cl HNO3
10%NaOH 水溶液
水层
辛酸盐
加盐酸 调PH至酸性
辛酸
己醛 有机层 和1-溴丁烷 饱和亚硫酸氢钠
有机层 1-溴丁烷
水层
白色固体
水层
白色固体
加盐酸 调PH至酸性
己醛
6
4、将下列化合物按指定性质的活泼程度从小到大排列成序
(1)将下列化合物按醇解反应速率快慢排序: A. 苯甲酰氯 B.丙烯酰氯 C. 乙酰氯
CH3
KMnO4 H+ COOH
CN
CONH2 1) SOCl2 2 ) NH3
CN P2O5
CN HNO3 H2SO4 NO2
Fe HCl
CN
NH2
CN NaNO2 HCl CN CuCN
48
(5)
Cl
CH2CH3
Cl
NH2
(6)
NHCH3 CH3
49
Cl
CH2CH3
Cl
NH2
(5)
KMnO4
36
6. 在一组分子量相近的伯、仲和叔胺中,为何通 常伯胺的沸点最高?
有机化学-- 羧酸及其衍生物

碱性水解
O
OH-
RC
OR'
O R C OR' OH
O R C + -OR'
OH
O
RC OH
H+
O
R C + HOR'
O-
同位素跟踪结果表明: 碱性水解时,发生酰氧键断裂。
O
O
C2H5C18OC2H5 + H2O NaOH CH3CONa + C2H518OH
碱性水解的讨论
1. 碱性水解速率与 [-OH]成正比。
OO C RO R
酸酐 carboxylic acid anhydride
RCN
腈 nitrile
➢羧酸及其衍生物的命名和物理性质 ➢羧酸及其衍生物的制备 ➢羧酸衍生物的水解、醇解和氨解 ➢羧酸及其衍生物的还原反应 ➢羧酸及其衍生物-碳的反应
羧酸及其衍生物的命名
HCO2H CH3CO2H CH3(CH2)16CO2H
(4) 在RCOOR'中, R对速率的影响是: 一级 > 二级 > 三级 R'对速率的影响是: 三级 > 一级 > 二级
CH3COOR'在盐酸中,于25OC时水解的相对速率v的 实验数据如下:
R': CH3 C2H5 CH(CH3)2 C(CH3)3
v: 1 0.97
0.53 1.15(历程不同)
2.98
CO2H OR
水杨酸: R = H O
阿司匹林: R = -CCH3
羧酸及其衍生物的制备
1. 羧酸的制备
(1)醇和醛的氧化
RCH2 OH
or O
RC H
KMnO4 or
有机化学(第二版)第十二章 羧酸及其衍生物

CH2=CHOCOC2H5
丙二酸二乙酯
醋酸乙烯酯
12.9 羧酸衍生物的化学性质 12.
一、羧酸衍生物的亲核取代反应 • 加成-消除历程:
O 1) R C L O
+
Nu
R C Nu L 亲 亲亲 亲
O 2) R C Nu L:-X,-OCOR,-OR,-NH 2 L R
O C OH HO
O C
O C OH
pKa
4.76
3.75
1.23
2、α-H卤代
• 赫尔-乌尔哈-泽林斯基反应
Br2/P
Br CH2COOH CH2COOH Cl
CH3COOH
Cl2/S
CN
NaCN
CN
H+/H 2 O
RCHCOOH X
① OH
+
-
RCHCOONa OH RCHCOONa RCHCOONa NH 2
②羧酸氯化水解
RCH2COOH Cl2 P RCHCOOH Cl OH .H2O RCHCOOH OH
2、β-羟基酸
• ① 通过次卤酸(p.55)
OH
HOCl
OH Cl
NaCN
OH
R
R
R
CN
1) NaOH
2) H
+
R
COOH
② Reformasky反应
Zn+BrCH2COOC2H5 RCHCH2COOC2H5 OZnBr 无 RCHO ZnBrCH2COOC2H5 .H2O RCHCH2COOH OH
.H2O H
+
三、化学性质
1、酸性
有机化学II-13羧酸及其衍生物
羧酸和芳香族羧酸都是固体。
水溶性:
C1~C4羧酸可以和水混溶。芳香族羧酸分子量大,
难溶于水。 4-11碳部分溶解;羧酸盐水中溶 解性好
(长链羧酸盐为好的表面活性剂)。
实 例
O O H H
COOH OH
COOH
O
OH
邻位
诱导吸电子作用大、 共轭给电子作用大、 氢键效应吸电子作用大。 pka 2.98 苯甲酸的pka 4.20
间位
诱导吸电子作用中、 共轭给电子作用小。
对位
诱导吸电子作用小、
共轭给电子作用大。
pka 4.08
pka 4.57
二元酸: 有两个解离常数 举例:
十八酸 硬脂酸
CH2 COOH CH2 COOH
乙二酸(草酸) 丙二酸(胡萝卜酸) 丁二酸(琥珀酸)
HOOC
COOH
顺丁烯二酸 (马来酸)
反丁烯二酸 (富马酸)
苯甲酸(安息香酸)
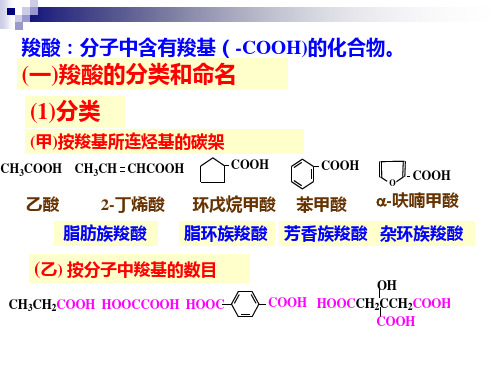
(乙)系统命名法
(A)脂肪族羧酸
母体: 选含羧基的最长连续碳链,不饱和羧酸选含羧 基和不饱和键在内的最长连续碳链为主链.
内酐
COOH 230oC COOH
CO O + H2O CO
二元酸酐
邻苯二甲酸酐
混合酸酐
O
O
CH3CH2 C Cl + Na OCCH3
△
O O CH3CH2C OCCH3
3. 酯的生成
RCOOH + R'OH H+
RCOOR' + H2O
有机化学第15章 羧酸及其衍生物

CO2H
Br2 P
Br CO2H
反应选择性地发生在羧酸的α-C上,如果卤素过量,还可 以进一步产生二卤化物和三卤化物,例如:
CH3COOH Cl2,P ClCH2COOH Cl2,P Cl2CHCOOH Cl2,P Cl3COOH
16
α-卤代酸还可以发生消除反应生成α,β-不饱和羧酸。
RCH2CHCOOH X KOH 醇 RCH CHCOOK H+ RCH CHCOOH
④ 二元酸的有两个离解常数K1和K2, K1 、K2其大小与两个羧 基的相对距离有关,离解是分步进行的,第一步电离受到另 一个羧基-I效应的影响,两个羧基相距越近影响越大,因此, 二元羧酸的pKa1 一般小于一元羧酸的pKa2,例如:
草酸 < 丙二酸 < 丁二酸 < 乙酸 pKa1 值 1.27 2.85 4.21 4.75
4
(2)伯醇和醛的氧化
H R C O H H O H R C O O O R C OH
CH2OH KMnO4/H2SO4
CHO KMnO4/H2SO4
COOH
CH3CH2CH2CH2OH
KMnO4/H2SO4
CH3CH2CH2CHO
KMnO4/H2SO4 CH3CH2CH2COOH
O CH3CH2CH2CH
(CH3)3CBr
(CH3)3CCH2CH2OH
K2Cr2O7,H+ H2O
(CH3)3CCH2CO2H
此法可用于制备比原料 多一个或两个碳的羧酸
RCH=CH2 + CO + H2O Ni(CO)4 R CH CH2 C O H2O R CH COOH CH3
8
有机化学基础知识点整理羧酸的衍生物与反应

有机化学基础知识点整理羧酸的衍生物与反应羧酸的衍生物与反应羧酸是有机化学中常见的一类化合物,具有羧基(-COOH)的结构特征。
羧酸的衍生物是指通过对羧酸进行化学反应或者取代得到的相关化合物。
羧酸的反应涉及到许多重要的有机合成反应和应用,对于有机化学的学习非常重要。
本文将对羧酸的衍生物以及与之相关的反应进行整理和概述。
一、酯的合成酯是羧酸醇酯化反应的产物,也是羧酸衍生物中使用最广泛的一种化合物。
酯的合成通常通过将羧酸与醇在酸性条件下进行酯化反应而得到。
此反应是通过羧基中的羟基与醇发生酯化反应而形成的,其反应方程式如下所示:羧酸 + 醇→ 酯 + 水酯化反应可以在各种温度下进行,常见的催化剂有硫酸、盐酸等。
酯化反应是有机合成中的重要步骤,能够制备出许多重要的化合物,如乙酸乙酯、苯甲酸甲酯等。
二、酰氯的合成酰氯是羧酸与氯化物反应生成的一种衍生物。
酰氯是有机合成中常用的试剂,可以作为中间体参与进一步的化学反应。
羧酸与氯化物反应生成酰氯的反应方程式如下所示:羧酸 + 氯化物→ 酰氯 + 酸常见的氯化物有氯化亚砜、氯化磷等。
酰氯在合成中起到重要的作用,可以进一步发生亲核取代反应、缩合反应等。
三、酰亚胺的合成酰亚胺是羧酸与胺反应生成的衍生物,分子中含有酰基与氨基。
酰亚胺具有一定的稳定性和活性,可以作为有机化合物的合成中间体。
酰亚胺的反应方程式如下所示:羧酸 + 胺→ 酰亚胺 + 水酰亚胺的合成可以通过将羧酸与胺在酸性条件下反应而得到。
酰亚胺在有机合成中应用广泛,可以进行类似于酯的各种反应。
四、酰胺的合成酰胺是羧酸与氨反应生成的一种衍生物,分子中含有酰基与氨基。
常见的酰胺有酰胺与酰胺。
酰胺的合成通常通过将羧酸与氨在酸性或碱性条件下反应而得到。
酰胺的反应方程式如下所示:羧酸 + 氨→ 酰胺 + 水酰胺是许多药物和生物活性分子的结构基础,也是有机化学中重要的中间体。
综上所述,羧酸的衍生物包括酯、酰氯、酰亚胺和酰胺等,它们在有机合成和应用领域中具有广泛的应用。
有机化学羧酸及其衍生物

O
CH2C
CH3CH2CH
O
CH2C
O
Ⅱ 羧酸的衍生物
★ 酰氯、酸酐、酯和酰胺都是羧酸中的羟基被不同 基团取代的产物,统称为羧酸衍生物。
10.6 命名:
① 酰氯和酰胺以其所含的酰基来命名; ② 酸酐根据其来源的酸命名; ③ 酯按其来源的酸和醇,叫某酸某酯。
O
酰氯
H3CC Cl
O
OH
R COH LiAlH4 RCH2
4)烃基上的反应: ① α—卤代作用:脂肪羧酸中的α—H比其它C原子
上的H活泼,可被卤素取代:
C3 C HOO 2o H 日 红 r 光 磷 + C 一 l2 C C C 氯 O H l 日 乙 C O 2 l光 C H 酸 二 2 C l H 氯 C 日 C 乙 2O l光 C 三 酸 O 3 C l H 氯 CO 乙
O CH 3COC2H5
NaO2HC 5
O
-CH 2CO OC2H5CH 3 COC2H5
(Ⅰ)
OO CH 3CCH 2COC2H5+-OC2H5
乙 乙酰酸 乙酸乙乙酰 酯 乙酯
O- O
[CH 3CCH 2 COC2H5] OC2H5 (Ⅱ)
5)酰胺的酸碱性:氨是碱性的,但酰胺是中性 物质。这是由于氮上未共用电子对与碳—氧 双键共轭而氮原子上电子密度降低所致。O .. R C NH 2
O
RC O
HCOOH
CH3CO2H
CH3CH2CH2CO2H
CH3CH2CHCO2H Cl
CH3CHCH2CO2H Cl
ClCH2CH2CH2CO2H
pKa 3.75
4.75
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
O
OOHH
OHOH
3)Reformatsky反应
-卤代酸酯在锌粉作用下和醛、酮反应,所得加成产物 经水解得-羟基酸。
O
O
O
R CH
Zn C OEt
R
CH C
R'' OEt
C R'
Br
ZnBr
OZnBr
O
H2O
R'' C CH C OEt
R' R
OH R'' C CH
R' R
O C OEt
H2O, H+
4.3.成酰胺反应
O R C OH
O NH3
-H2O
R C ONH4 100oC
O R C NH2
R'NH2 R
O C
-H2O
ONH3R 180~190oC R
O C NHR
4.4 生成酯(酯化反应)
O
R C OH + R′OH
H+
R
1)酯化反应特点 ➢反应很慢 (H+ 催化,加热)
O
C OR′ + H2O
➢叔醇酯化按此机理成酯(R+ 稳定,较易生成)
5 脱羧反应
1)羧酸-碳上有强吸电子基时,受热易发生脱羧
△ Y CH2COOH
Y CH3 + CO2
O
2)Hunsdiecker 反应
Y : COOH ,R C , CN, NO2 , X, Ar, C C
OO
AAggNNOO33
OO
RR CC OOHH
产物单一 有合成意义
(3)Dieckmann 缩合(分子内酯缩合)
羧酸及其衍生物
1. 物理性质
一.羧酸
1. 物态 2. 沸点高——氢键 3. 熔点高——氢键 4. 高级脂肪酸具有润滑性
2. 光谱性质
• IR:—OH 3000 ~ 2500 cm-1(宽) 注意与醇羟基比较
C=O 1725 ~ 1700 cm-1 (与醛酮相近)
• HNMR:O—H δ 10~12 α—H δ 2.2~2.5
或
Nu
Nu
O
H
OH 亲核加成
OH
RCL
RCL
RC L
消除
OH HNu
R C Nu
H
Nu
O
H
+
R C Nu
LH
OH R C LH
Nu
3) 羧酸衍生物的水解
O RC X
H2O
HX
易
O
O
H2O
R C O CR
H or OH
O R C OR'
H2O H or OH
O R C NH2(R)
H2O H or OH
OH R'' C CH
R' R
O C OH
(4) 性质
1)受热脱水反应
-羟基酸
R R CCHOCCHOOOHOHOHH++HHHHOOOOOOCCCCHH
ΔΔ RR
RR OO
OO OO
+ +2H22HO2O OO RR 分子间脱水酯化成交酯
-羟基酸 RCRHCCHHC2HC2OCOOHOH ΔΔ RRCCHH CCHHCCOOOOHH ++HH2O2O
RR CC OOAAgg
KKOOHH
Br2
R Br + CO2
3)自由基脱羧反应
4)柯尔柏反应
电解
自由基反应引发剂
阳极
阴极
6 -氢的卤代
OO
XX2,2P, P
RRHHCC CC OOHH
HH
XX==BBr,rC, Cl l
O RHC C OH
X
O
Cl2
H3C C OH hv
7 还原反应
O Cl-H2C C OH
己二酸、 庚二酸受 热脱水和 脱羧
其它二酸 受热发生分子间脱水成高聚物(聚酐)
(3) 酯化反应
COOH CH2OH
+
H
COOH CH2OH
OO + 2 H2O
环
OO
酯
n HOOC
H
COOH + n HOH2C CH2OH
O
O
HO C
10 羟基酸
C OCH2CH2O H + (2n-1)H2O
聚酯
n
Na C2H5OH
Na, N2 乙醚 or 甲苯
RCH2OH + R'OH
伯醇
O RC
OH CR H
-羟基酮
acyloin 缩合(酮醇缩合)
➢ acyloin 缩合在合成上的应用举例
CO2R (CH2)n
CO2R
Na 二甲苯
H2O
(CH2)n
CO CHOH
4. 羧酸衍生物的-位的反应
1)酸酐-位的反应——Perkin反应
羰基:可加成至饱和
O
L:可被亲核试剂取代
RCH C L
H
离去基团 (Leaving group)
-H:有弱酸性
1. 酰基上的亲核取代
1)通式
O
Nu
R CL
or HNu
O R C Nu + L or HL
2) 酰基上的亲核取代的机理 (加成—消除)
O
亲核加成
O
消除
O
RCL
RC L
R C Nu + L
O
H2, Pd-BaSO4, 硫-喹啉
O
R C Cl Rosenmund 还原
R CH
(ii) 酯还原至醇(工业化)
使Pd催化剂活性减 弱(催化剂中毒)
O
H2, CuO CuCrO4
R C OR'
RCH2OH + R'OH 油脂氢化得高级脂肪醇
3)酯的金属钠还原
O R C OR'
O 2 R C OR'
OHOH
分子内脱水成不饱和酸
-羟基酸
ΔΔ
RCHRCHC2CHH2C2CHO2COOHOH
RR
OO ++HH2O2O
OHOH
OO
分子内脱水酯化成-丁内酯
-羟基酸
O
RCHCH2CH2CH2COOH
O + H2O
OH
R 分子内脱水酯化成 -戊内酯
2)氧化反应 RRCCHCOOH [ O ] RCCOOH
➢反应可逆 (加大某反应物用量或除去水使酯产率提高)
2) 酯化反应机理
(i) 酰基上的亲核取代(酰氧断裂) ➢ H+先与羰基氧结合—亲核加成—消除(酰氧断裂)
➢ 伯醇、仲醇酯化按此机理成酯
➢ 烃基R和R’的体积越大,酯化反应速度越慢 (ii) 烷基碳正离子中间体(烷氧断裂)
➢ H+先与醇羟基氧结合—碳正离子(烷氧断裂)
O R C OH
HO
O C
R递
or
+
减
O
HOR'
R CO
较易 催化
NH3(R)
催化 加热
4)羧酸衍生物的醇解反应
O
R'OH
O
R
C Cl Et3N or Py
R
C
OR' + HCl (碱吸收)
Et3NHCl or N HCl
OO
R'OH
R COCR
O
O
R C OR' + R C OH
O
H or R"O
(1) 制法
1)卤代酸水解
RRCCHH2C2COOOOHH BBrr22,, P
2)氰醇水解
RRCCHHCCOOOOHH1H)H2O2O, O, HO-H-RCRHCCHOCOOHOH
BBrr
2) H+ OHOH
R C HH HHCCNN RR CCHH CCNNH2HO2O, H,+H+ R R CHCHCOCOOHOH
(卤原子)
O
O
R C O C R (酰氧基)
O R C OR'
(烷氧基)
O R C NH2(R)
(氨基)
酰卤
酸酐 酯 酰胺
酰基-负性基
羧酸衍生物
4.1.成酰卤反应
O
R C OH + PCl3
(相 对 分子质量 小)
O
R C Cl + H3PO3
(蒸 出)
O
R C OH + PCl5
(相 对 分子质量 大)
CCHH33CCCCHH33 ++ CCOO22
OO CCHH33CCCCHHCCOOOOHH
ΔΔ
C6H5
OO CCHH33CCCCHH22CC66HH55 ++ CCOO22
二.羧酸衍生物的化学性质
性质分析
O
RCH2 C X
O
O
RCH2 C O C R
O RCH2 C OR'
O RCH2 C NH2(R)
RCH2COONa
Ph CHO + (RCH2CO)2O
Ph CH
COOH C
R
CH3COONa
Ph CHO + (CH3CO)2O
2)酯的-位的反应HCOOHCC NhomakorabeaPh
H
(1)Claisen 缩合(两个相同酯之间的缩合)
O
O
OO
