1.3 原子内电子的排布
原子核外电子排布教案

原子核外电子排布教案第一章:引言1.1 学习目标:了解原子核外电子排布的概念及其重要性。
掌握电子的基本性质和电子云的概念。
1.2 教学内容:介绍原子的基本结构,包括原子核和核外电子。
解释电子的基本性质,如负电荷、量子化等。
引入电子云的概念,解释其表示电子分布的方式。
1.3 教学活动:通过图片和示例介绍原子的基本结构。
利用动画演示电子的基本性质。
引导学生思考为什么电子不能随意分布在原子核周围。
1.4 作业与评估:设计一些简答题,让学生回答关于电子基本性质的问题。
让学生绘制简单的电子云示意图。
第二章:电子分层排布2.1 学习目标:掌握电子在原子核外的分层排布规律。
了解不同层上的电子数量限制。
2.2 教学内容:介绍电子的分层排布规律,包括K层、L层、M层等。
解释每个层上的电子数量限制,如K层最多容纳2个电子。
2.3 教学活动:通过示例和图解展示电子的分层排布。
引导学生理解电子在不同层上的排布规律。
2.4 作业与评估:设计一些填空题,让学生填写不同层上的电子数量限制。
让学生根据给定的原子核,绘制其电子的分层排布图。
第三章:电子亚层排布3.1 学习目标:掌握电子在同一层内的亚层排布规律。
了解不同亚层的名称和特点。
3.2 教学内容:介绍电子在同一层内的亚层排布规律,包括s亚层、p亚层、d亚层等。
解释不同亚层的名称和特点,如s亚层具有较低的能量。
3.3 教学活动:通过示例和图解展示电子在同一层内的亚层排布。
引导学生理解不同亚层的排布规律和特点。
3.4 作业与评估:设计一些选择题,让学生区分不同亚层的名称和特点。
让学生根据给定的原子核,绘制其电子的亚层排布图。
第四章:电子自旋排布4.1 学习目标:掌握电子自旋排布的规则。
了解电子自旋量子数和自旋状态。
4.2 教学内容:介绍电子自旋排布的规则,如泡利不相容原理、洪特规则等。
解释电子自旋量子数和自旋状态的概念。
4.3 教学活动:通过示例和图解展示电子自旋排布的规则。
价电子排布式(原子序数顺序)
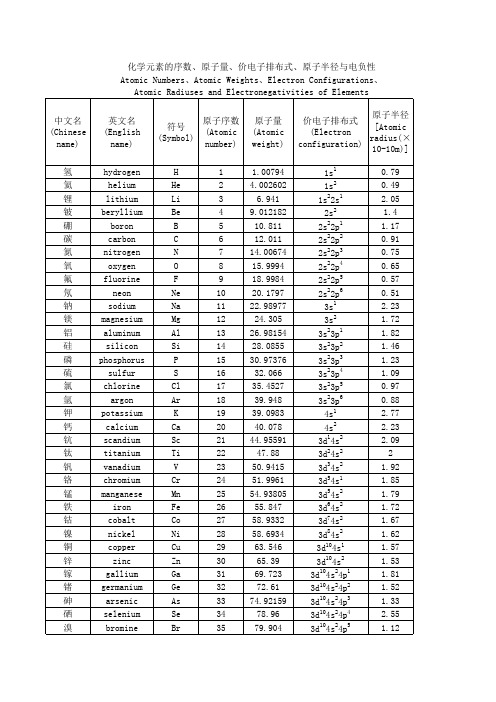
3d104s24p6 5s1 5s2 1 2 4d 5s 2 2 4d 5s 4d45s1 4d55s1 4d55s2 4d75s1 4d85s1 10 4d 4d105s1 4d105s2 4d105s25p1 4d105s25p2 4d105s25p3 4d105s25p4 4d105s25p5 2 6 5s 5p 6s1 6s2 1 2 5d 6s 4f15d16s2 4f36s2 4 2 4f 6s 4f56s2 4f66s2 7 2 4f 6s 4f75d16s2 4f96s2 10 2 4f 5s 4f116s2 12 2 4f 6s 13 2 4f 6s 4f146s2 4f145d16s2 4f145d26s2 4f145d36s2 4 2 5d 6s 14 5 2 5f 5d 6s 4f145d66s2 14 7 2 4f 5d 6s 14 9 1 4f 5d 6s
氪 铷 锶 钇 锆 铌 钼 锝 钌 铑 钯 银 镉 铟 锡 锑 碲 碘 氙 铯 钡 镧 铈 镨 钕 钷 钐 铕 钆 铽 镝 钬 铒 铥 镱 镥 铪 钽 钨 铼 锇 铱 铂
krypton rubidium strontium yttrium zirconium niobium molybdenum technetium ruthenium rhodium palladium silver cadmium indium tin antimony tellurium iodine xenon cesium barium lanthanum cerium praseodymium neodymium promethium samarium europium gadolinium terbium dysprosium holmium erbium thulium ytterbium lutetium hafnium tantalum tungsten rhenium osmium iridium platinum
化学前36号元素电子排布式和简式

化学前36号元素电子排布式和简式化学前36号元素电子排布式和简式是一种通过绘制电子排布式图或简式来表示元素在原子中的电子排布情况的方法。
排布式图可以准确地描述原子内电子在不同能量等级上的排布情况,而简式可以提供一个有限的、容易理解的定性描述。
化学前36号元素电子排布式及简式如下:氢(H):排布式:1s1,简式:1氦(He):排布式:1s2,简式:2锂(Li):排布式:1s22s1,简式:2.1硼(B):排布式:1s22s22p1,简式:2.3碳(C):排布式:1s22s22p2,简式:2.4氮(N):排布式:1s22s22p3,简式:2.5氧(O):排布式:1s22s22p4,简式:2.6氟(F):排布式:1s22s22p5,简式:2.7氖(Ne):排布式:1s22s22p6,简式:2.8钠(Na):排布式:1s22s22p63s1,简式:2.8.1镁(Mg):排布式:1s22s22p63s2,简式:2.8.2铝(Al):排布式:1s22s22p63s23p1,简式:2.8.3磷(P):排布式:1s22s22p63s23p3,简式:2.8.5硫(S):排布式:1s22s22p63s23p4,简式:2.8.6氯(Cl):排布式:1s22s22p63s23p5,简式:2.8.7 氩(Ar):排布式:1s22s22p63s23p6,简式:2.8.8 钾(K):排布式:1s22s22p63s23p64s1,简式:2.8.8.1钙(Ca):排布式:1s22s22p63s23p64s2,简式:2.8.8.2钡(Ba):排布式:1s22s22p63s23p64s23d1,简式:2.8.8.2.1铁(Fe):排布式:1s22s22p63s23p64s23d6,简式:2.8.8.2.6锌(Zn):排布式:1s22s22p63s23p64s23d10,简式:2.8.8.2.10铜(Cu):排布式:1s22s22p63s23p64s13d10,简式:2.8.8.3.10氯(Br):排布式:1s22s22p63s23p65s1,简式:2.8.8.4氪(Kr):排布式:1s22s22p63s23p65s24d5,简式:2.8.8.4.52.8.9.2钯(Pd):排布式:1s22s22p63s23p64d10,简式:2.8.10铑(Rh):排布式:1s22s22p63s23p64d86s1,简式:2.8.10.1铱(Ir):排布式:1s22s22p63s23p64d106s2,简式:2.8.10.2铂(Pt):排布式:1s22s22p63s23p64d106s26f1,简式:2.8.10.2.6金(Au):排布式:1s22s22p63s23p64d105f14,简式:2.8.10.2.5锡(Sn):排布式:1s22s22p63s23p64d105f46s2,简式:2.8.10.2.5.6锑(Sb):排布式:1s22s22p63s23p64d105f26d1,简式:2.8.10.2.5.2碲(Te):排布式:1s22s22p63s23p64d105f26d2,简式:2.8.10.2.5.2碘(I):排布式:1s22s22p63s23p64d105f46d17s1,简式:2.8.10.2.5.6.7砹(At):排布式:1s22s22p63s23p64d105f76d17s2,简式:2.8.10.2.5.7.7氙(Xe):排布式:1s22s22p63s23p64d105f76d17s2,简式:2.8.10.2.5.7.7 氖(Rn):排布式:1s22s22p63s23p64d105f86d18s2,简式:2.8.10.2.5.8.8 钍(Tl):排布式:1s22s22p63s23p64d105f146d2,简式:2.8.10.2.5.14.2铯(Cs):排布式:1s22s22p63s23p65s24d105f146d17s1,简式:2.8.10.3.14.6.7铵(Fr):排布式:1s22s22p63s23p64f145d106s27p1,简式:2.8.11.1.5.6.7 钇(Y):排布式:1s22s22p63s23p64d104f14,简式:2.8.12铒(Er):排布式:1s22s22p63s23p64d104f145d1,简式:2.8.12.1铥(Dy):排布式:1s22s22p63s23p64d104f145d16s2,简式:2.8.12.1.5.6 镤(Pu):排布式:1s22s22p63s23p64d104f145d106s4,简式:2.8.12.1.5.10.4以上就是化学前36号元素的电子排布式和简式。
元素周期表价层电子排布式

元素周期表价层电子排布式元素周期表是化学中用来组织化学元素的工具,根据元素的原子序数按照规律排列。
每个元素都有自己的电子排布式,即电子在原子内的分布情况。
电子排布式分为两部分:价层电子和内层电子。
价层电子指的是原子的层次,从外向内编号为1、2、3……层。
每一层由一个以上的电子组成,并且由于电子间的相互作用,同一层的电子会形成一个电子云。
内层电子指的是原子的轨道,从内向外编号为1、2、3……轨道。
每个轨道都有自己的能量级,并且可以容纳一定数量的电子。
在元素周期表中,通常会根据价层电子的数量将元素分为几大族,如金属族、半金属族、非金属族等。
而内层电子的数量则决定了元素的化学性质。
例如,同一族的元素通常会有相似的化学性质。
此外,元素周期表还可以帮助我们理解元素的化合反应规律。
例如,对于非金属元素来说,通常会接受电子而成为负离子;而对于金属元素来说,通常会损失电子而成为正离子。
总之,元素周期表是一种重要的化学工具,能够帮助我们理解元素的电子排布式和化学性质,以及元素之间的化合反应规律。
教案《原子核外电子的排布》

教案《原子核外电子的排布》第一章:引言1.1 教学目标让学生了解原子核外电子排布的概念和重要性。
让学生掌握原子核外电子排布的基本原理。
1.2 教学内容原子核外电子的定义和特点。
原子核外电子排布的意义和应用。
1.3 教学方法讲授法:讲解原子核外电子的定义和特点。
提问法:引导学生思考原子核外电子排布的意义和应用。
第二章:电子云和原子轨道2.1 教学目标让学生了解电子云的概念和特性。
让学生掌握原子轨道的定义和分类。
2.2 教学内容电子云的定义和特性。
原子轨道的定义和分类。
2.3 教学方法讲授法:讲解电子云的概念和特性。
提问法:引导学生思考原子轨道的定义和分类。
第三章:泡利不相容原理3.1 教学目标让学生了解泡利不相容原理的内容和意义。
让学生掌握泡利不相容原理在电子排布中的应用。
3.2 教学内容泡利不相容原理的内容和意义。
泡利不相容原理在电子排布中的应用。
3.3 教学方法讲授法:讲解泡利不相容原理的内容和意义。
举例法:通过具体例子引导学生掌握泡利不相容原理在电子排布中的应用。
第四章:能量最低原理4.1 教学目标让学生了解能量最低原理的概念和意义。
让学生掌握能量最低原理在电子排布中的应用。
4.2 教学内容能量最低原理的概念和意义。
能量最低原理在电子排布中的应用。
4.3 教学方法讲授法:讲解能量最低原理的概念和意义。
举例法:通过具体例子引导学生掌握能量最低原理在电子排布中的应用。
第五章:洪特规则5.1 教学目标让学生了解洪特规则的内容和意义。
让学生掌握洪特规则在电子排布中的应用。
5.2 教学内容洪特规则的内容和意义。
洪特规则在电子排布中的应用。
5.3 教学方法讲授法:讲解洪特规则的内容和意义。
举例法:通过具体例子引导学生掌握洪特规则在电子排布中的应用。
第六章:电子排布的表示方法6.1 教学目标让学生了解电子排布的表示方法。
让学生掌握电子排布图和电子排布式的书写。
6.2 教学内容电子排布图的定义和表示方法。
电子排布式的定义和表示方法。
高中化学原子核外电子排布

高中化学原子核外电子排布原子的组成由原子核和电子构成。
原子核位于原子的中心,由质子和中子组成。
而原子核外围则存在着一定数量的电子。
这些外电子的排布方式对于原子的性质和化学反应具有重要影响。
本文将介绍高中化学中原子核外电子的排布规律及其相关知识。
1. 电子排布的原则每个原子的电子排布遵循一定的规律和原则。
其中最为重要的是以下三个原则:1.1. 伯利兹定则伯利兹定则(Bau rule)表明,电子从低能量轨道开始填充。
这意味着在填满外电子壳层时,首先填充内层能量较低的轨道,然后逐渐填满能量较高的轨道。
简单来说,电子排布的顺序是由内向外进行。
1.2. 阿尔尼奥定则阿尔尼奥定则(Aufbau rule)指出,电子填充各能级轨道时,要优先填充能量最低的轨道。
在每个能级轨道中,需要先填满低能量的子能级,然后再填充高能量的子能级。
这样可以保证整个原子结构的稳定性。
1.3. 保里排除原理保里排除原理(Pauli exclusion principle)规定,每个轨道最多只能容纳两个电子,并且这两个电子的自旋要相反。
也就是说,同一个轨道上的两个电子必须具有相反的自旋角动量。
2. 原子核外电子层和子层原子核外的电子都存在于各种能级的轨道中。
高中化学通常会涉及到以下几个电子层和子层:2.1. 电子层电子层是指位于原子核外部的能级,用字母表示(K、L、M、N、O、P、Q)。
K层最接近原子核,能量最低,因此分布的电子最少。
随着电子层数的增加,能量逐渐升高,电子数也逐渐增多。
2.2. 子层子层是电子层内部的能级,用字母和数字表示(s、p、d、f、g、h)。
s子层能量最低,容纳电子数最少;p子层次之;d子层再次增加;f子层电子数最多。
3. 原子核外电子排布的案例分析以下是几种常见原子核外电子排布的案例分析:3.1. 氢原子(H)氢原子只有一个质子和一个电子,根据伯利兹定则和阿尔尼奥定则,电子会填充能量最低的1s轨道。
3.2. 氦原子(He)氦原子有两个质子和两个中子,根据伯利兹定则和阿尔尼奥定则,前两个电子会填充1s轨道。
前三十六号元素价层电子排布式

前三十六号元素价层电子排布式1.氢(H)的电子配置为1s^1,其中的1表示电子所在的能级(层),s表示轨道类型,上标1表示轨道中只有一个电子。
2.氦(He)属于2族元素,它的电子配置为1s^23.锂(Li)属于3族元素,它的电子配置为1s^22s^14.铍(Be)属于4族元素,它的电子配置为1s^22s^25.硼(B)属于5族元素,它的电子配置为1s^22s^22p^16.碳(C)属于6族元素,它的电子配置为1s^22s^22p^27.氮(N)属于7族元素,它的电子配置为1s^22s^22p^38.氧(O)属于8族元素,它的电子配置为1s^22s^22p^49.氟(F)属于9族元素,它的电子配置为1s^22s^22p^510.氖(Ne)属于10族元素,它的电子配置为1s^22s^22p^6从11到18号元素,它们的电子配置均符合2s层和2p层的填充顺序:11.钠(Na)属于11族元素,它的电子配置为1s^22s^22p^63s^112.镁(Mg)属于12族元素,它的电子配置为1s^22s^22p^63s^213.铝(Al)属于13族元素,它的电子配置为1s^22s^22p^63s^23p^114.硅(Si)属于14族元素,它的电子配置为1s^22s^22p^63s^23p^215.磷(P)属于15族元素,它的电子配置为1s^22s^22p^63s^23p^316.硫(S)属于16族元素,它的电子配置为1s^22s^22p^63s^23p^417.氯(Cl)属于17族元素,它的电子配置为1s^22s^22p^63s^23p^518.氩(Ar)属于18族元素,它的电子配置为1s^22s^22p^63s^23p^6从19到36号元素,它们的电子配置符合3s层、3p层和3d层的填充顺序:19.钾(K)属于19族元素,它的电子配置为1s^22s^22p^63s^23p^64s^120.钙(Ca)属于20族元素,它的电子配置为1s^22s^22p^63s^23p^64s^221.钪(Sc)属于21族元素,它的电子配置为1s^22s^22p^63s^23p^64s^23d^122.钛(Ti)属于22族元素,它的电子配置为1s^22s^22p^63s^23p^64s^23d^223.钒(V)属于23族元素,它的电子配置为1s^22s^22p^63s^23p^64s^23d^324.铬(Cr)属于24族元素,它的电子配置为1s^22s^22p^63s^23p^64s^13d^51s^22s^22p^63s^23p^64s^23d^526.铁(Fe)属于26族元素,它的电子配置为1s^22s^22p^63s^23p^64s^23d^627.钴(Co)属于27族元素,它的电子配置为1s^22s^22p^63s^23p^64s^23d^728.镍(Ni)属于28族元素,它的电子配置为1s^22s^22p^63s^23p^64s^23d^829.铜(Cu)属于29族元素,它的电子配置为1s^22s^22p^63s^23p^64s^13d^10。
原子结构知识:原子的电子布居规则

原子结构知识:原子的电子布居规则原子结构知识:原子的电子布居规则原子是由原子核和围绕在核周围的电子组成的基本结构单元。
原子内的电子数量和排列方式决定了化学元素的属性。
在原子结构的研究中,原子的电子布居规则是非常重要的一个概念。
本文将为大家介绍原子的电子布居规则及其一些重要原理。
1.布居规则的历史背景早在19世纪初期,化学家们就已经开始了原子结构的研究。
当时,最先提出原子结构模型的是英国化学家道尔顿,他认为原子是一个不可分割的小球体。
随后,汤姆逊发现了电子,这个小球体模型受到了挑战,化学家们认识到原子并不是一个不可分割的实体。
于是乎,另一位英国化学家里瑟福又提出了原子为一个带正电荷的核和围绕核运动的电子的模型。
随着原子结构的研究的深入,化学家们发现原子内的电子并不是随意排布的,而是有一定的规律。
这些规律便被整理成原子的电子布居规则。
2.电子布居规则的基本原理电子在原子内的位置是由其能量级别决定的,即越靠近原子核的能级越低,越远离核的能级越高。
根据这个原理,我们可以得出以下电子布居规则:2.1.泡利不相容原理泡利不相容原理是最基本的电子布居规则之一。
其表述为:在同一原子内,不能有两个电子的四个量子数都相同。
这意味着每个电子在原子内必须有其独特的位置。
2.2.奥卡规则奥卡规则是指电子在原子内的填充应遵循最低能量原理,即先填充最低能量的轨道。
2.3.求和原理每个能级的电子数量等于其对应的主量子数的平方。
例如,第一能级能够容纳的电子数是2,第二能级能够容纳的电子数就是4,第三能级能够容纳的电子数是9,以此类推。
2.4.光谱线的解释原子内的电子被束缚在离核的轨道中,并在其他轨道之间跃迁。
当电子受到能量激励时,它会跃迁到更高能级的轨道上。
当电子跃迁回原来的能级时,它会释放出一个能量与频率相对应的光子。
因此,光谱线可以用来解释原子内电子的跃迁和能级结构。
3.电子布居规则的应用电子布居规则可以应用于各种化学和物理领域,如量子力学、原子能和亚原子化学等。
核外电子排布与元素周期表

P S 110 104
K 227
Rb 248 Cs 265
Ca Sc Ti V Cr Mn Fe Co Ni Cu Zn Ga Ge As 197 161 145 132 125 124 124 125 125 128 133 122 122 121
Se 117
Br 114Байду номын сангаас
Kr 198
Xe 217
Sr Y Zr Nb Mo Tc Ru Rh Pd Ag Cd In Sn Sb Te I 215 181 160 143 136 136 133 135 138 144 149 163 141 141 137 133 Ba La Hf Ta W Re Os Ir Pt Au Hg Tl Pb Bi Po 217 188 159 143 137 137 134 136 136 144 160 170 175 155 153
Au
Hg Tl
[Xe]4f145d106s1
[Xe]4f145d106s2 [Xe]4f145d106s26p1
82
83 84
Pb
Bi Po
[Xe]4f145d106s26p2
[Xe]4f145d106s26p3 [Xe]4f145d106s26p4
85
86
At
Rn
[Xe]4f145d106s26p5
(四)
31
32 33 34 35 36
Ga
Ce As Se Br Kr
[Ar]3d104s24p1
[Ar]3d104s24p2 [Ar]3d104s24p3 [Ar]3d104s24p4 [Ar]3dl04s24p5 [Ar]3d104s24p6
37 38 39 40
电子在原子轨道中的排布

原子内正电荷均匀分布
负电荷包罗于正电荷
5
卢瑟福的“天体行星模型”
❖ 1911年,英国物理学家卢瑟福(E.Rutherford) 借助一个放射源,用α粒子轰击金箔的散射实验, 发现了原子核,从而提出了最早的原子结构模型, 即“天体行星模型”。在这个模型中,把微观的原 子看成是“太阳系”,带正电的原子核好比“太 阳”,把电子描述为在绕核的固定轨道上运动,就 象行星绕着太阳运动一样。
❖ 3、只有当电子在不同的轨道间跃迁时(受到激发), 才会吸收或放出能量。
❖ 4、跃迁时放出或吸收的能量,正好等于两个轨道的能 级差。
❖ 5、放出或吸收的能量,若以光辐射的形式转移,则光 的频率ν=(E2-E1)/h。
25
Paschen 线系, infrared红外; Balmer Series, visible可见; Lyman 线系, ultraviolet紫外
E hv 结合相对论中的质能关系定律:E mc2
可以得到光子的波长和动量之间的关系 P mc E hv h c c
28
❖ 在式子
E hv E mc2 P mc E hv h
c c
❖ E和P是表示粒子特性的物理量,λ和ν是表示波动性的物理 量,这两种性质通过普朗克常数定量的联系起来,很好的揭 示了光的本质。
红外光
可见光 紫外光
氢原子光谱
26
波尔模型的成功与局限性
成功地解释了原子的稳定性,氢原子光谱(线光谱)的不 连续性,预测了氢光谱的新线系及理得堡常数,明确的指 出原子轨道能级的量子化特征等。 局限:未脱离经典力学的框架;电子运动并没有确定的轨 道,不能解释多电子原子的光谱,不能解释氢光谱的精细 结构,没有认识到电子运动的另一个重要特征—波粒二象 性,而把核外电子的运动看做是宏观物体在固定的轨道上 运动来处理,不能全面反映微观粒子的运动规律。
鲁教版高中化学必修二1.3元素周期表的应用一课一练(含答案)

1.3元素周期表的应用一、选择题(本题共23道小题,每小题2分,共46分)1.不能作为判断硫、氯两种元素非金属性强弱的依据是A. 单质氧化性的强弱B. 单质沸点的高低C. 单质与氢气化合的难易D. 最高价氧化物对应的水化物酸性的强弱2.下列元素中原子半径最小的是A. CB. NC. OD. F3.下表所示为部分短周期元素的原子半径及主要化合价,以下叙述错误的是A. A、B的单质与稀盐酸反应速率A>BB. D、E形成单质的氧化性D2>E2C. A单质着火时,可以用干粉灭火D. 最高价氧化物对应的水化物的酸性 H2CO4<HEO44.下列各组性质比较中,错误的是A. 热稳定性: SiH4< PH3 < NH3B. 沸点: H2O > H2Se > H2SC. 离子的还原性: Cl- < Br- < I-D. 最高化合价: N < O < F5.X、Y、Z为短周期非金属元素,其相关性质如下:下列叙述正确的是()A. 非金属性:Z<X<YB. 气态氢化物稳定性:Z>Y>XC. 最高价氧化物对应水化物的酸性:X>Z>YD. Y、Z的氢化物能反应形成离子化合物6.下列物质的性质比较,正确的是()A. 气态氢化物稳定性:HF>HCl>H2SB. 碱性:NaOH>KOH>RbOHC. 还原性强弱: F- > Cl- > Br- > I-D. 酸性:H2SO4>HClO4>HBrO47.已知X、Y、Z、T、W是短周期中原子序数依次增大的5种主族元素,其中X、T同主族,X与Y形成的简单气态化合物能使湿润的红色石蕊试纸变蓝,Z原子的最外层电子数是电子层数的3倍,W是一种重要的半导体材料。
下列说法正确的是A. 原子半径: X<Y<Z<TB. Y元素的含氧酸都属于强酸C. Z、T和W三种元素形成的化合物的水溶液呈碱性D. 元素Z、T组成的化合物中阴阳离子个数之比为2∶18.短周期元素W、X、Y、Z 的原子序数依次增大,四种元素的原子最外层电子数总和为17。
《材料科学基础》第一章 原子结构与结合健

《材料科学基础》教学大纲四年制本科材料科学与工程专业用80 学时 4 学分一、课程性质和任务《材料科学基础》是材料科学方法与工程专业一级学科公共主干课,是介于一般基础课与专业课之间的专业基础课。
本课程将系统全面介绍材料科学的基础理论知识,诸如固体材料的结合键,材料的结构与性能,材料中的扩散,材料的相变,材料的塑性变形与强化,以及材料科学研究方法等,将金属材料、无机非金属材料、聚合物材料紧密地结合在一起,使学生更好地把握材料的属性,熟悉材料的共性,为后继课程的学习、进一步深造和从事科技工作奠定基础。
二、课程学习的目标和基本要求:1.对能力培养的要求通过学习,要求学生掌握材料组织结构—成分—工艺—性能相互关系的基本规律和基本理论,深入理解材料组织结构—成分—工艺—性能相互关系,培养学生应用所学的知识,分析、解决材料研究、开发和使用中实际问题的能力。
初步掌握材料科学研究的思路和方法,为后续课程的学习和进一步深造奠定理论基础。
2 .课程的重点和难点本课程重点是料组织结构—成分—工艺—性能相互关系的基本规律和基本理论,如材料结构与缺陷,材料凝固与相图,塑性变形与强韧化等,并能应用所学的理论分析和解决实际问题。
难点是材料结构,位错理论,合金凝固,二元相图,三元相图,材料强韧化,晶体塑性变形等,3 .先修课程及基本要求无机化学、物理化学、材料力学三、课程内容及学时分配•教学基本内容第一章材料的结构( 22 学时)1.1 晶体学基础1.2 常见的晶体结构1.3 固溶体的晶体结构1.4 金属间化合物的晶体结构1.5 硅酸盐结构1.6 非晶态固体结构1.7固体的电子能带结构理论1.8 团簇与纳米材料结构1.9 准晶结构本章重点:•结晶学基础知识 (晶体的概念与性质、晶体宏观对称要素、晶体定向、•单位平行六面体的划分、配位数与配位多面体的概念、鲍林规则 )。
•常见材料的结构理论与模型(常见无机化合物的晶体结构、硅酸盐晶体结构分类及特征、固溶体晶体结构类型及影响因素、缺陷化学反应表示法、金属间化合物的结构类型及影响因素,玻璃的结构)。
元素周期表中元素的电子排布规律

元素周期表中元素的电子排布规律元素周期表是化学中最基础且最重要的工具之一,它按照元素的原子序数、原子结构和化学性质的规律排列了所有已知元素。
元素的电子排布规律是元素周期表的核心内容之一,其中包含了电子分布的规则和原则。
本文将详细介绍元素电子排布的规律,以及这些规律背后的科学原理。
一、原子结构和电子排布简介在了解元素的电子排布规律之前,我们首先需要了解元素的原子结构。
一个原子由质子(位于原子核中,带正电荷)、中子(位于原子核中,无电荷)和电子(位于原子外层,带负电荷)组成。
原子的质子数和电子数相等,而中子数量可以变化。
电子排布指的是电子在原子中的分布方式,可以分为核心电子和价电子。
核心电子指的是位于原子核内的电子,它们的能量较低,不参与化学反应。
价电子指的是位于原子外层的电子,它们的能量较高,决定了元素的化学性质。
二、奥布规则奥布规则是描述电子排布的基本原则之一。
根据奥布规则,电子在原子中的排布方式遵循“低能量优先,同能量填满,电子自旋相反”的原则。
具体来说,奥布规则可以总结为以下三条:1. 质子数增加时,电子会按照能量顺序填充最低能量的轨道,也就是说,电子首先填充1s轨道,然后依次填充2s、2p、3s、3p等轨道。
2. 同一轨道的电子填充时,会尽量让每个轨道填充一个电子,直到轨道的容纳电子的数量达到最大值为止。
这种填充方式称为洪特定则。
3. 每个电子都具有自旋,自旋的方向有两种可能,分别表示为上自旋和下自旋。
按照奥布规则,每个轨道填充一个电子时,上自旋和下自旋的电子数量应该尽量相等。
奥布规则的应用使得元素的电子排布变得有序和可预测,为化学研究和元素性质的理解提供了重要的基础。
三、朗道规则朗道规则是描述电子排布的另一个重要原则。
根据朗道规则,电子在填充轨道时,会尽量使轨道的总角动量(包括轨道角动量和自旋角动量)取最小能量。
朗道规则可以概括为以下三个原则:1. 在一个主量子数n相同的壳层中,总角动量为零的子壳层会比总角动量不为零的子壳层更稳定。
无机化学 原子结构与元素周期系 基态原子电子排布 元素性质周期性

3.939 × 10-18 J 8.716 × 10-18 J
Z* = Z - σ
l相同、n不同的轨道中, n值越大,电子出现概率 18 2 2 . 179 10 ( Z ) 最大的区域离核越远,所 E J 2 n 受屏蔽越强,能量越高。
2019/2/15 4
屏蔽参数σ 的大小可由 Slater 规则决定: 将原子中的电子分成如下几组: (1s)(2s,2p)(3s,3p)(3d)(4s,4p)(4d)(4f)(5s,5p)… ◆ 位于被屏蔽电子右边的各组, = 0
2、同一电子层的不同亚层( n相同 l 不同)
ns< np< nd<nf
3、能级交错
例: 4s< 3d
3
屏蔽效应和钻穿效应
(1) 屏蔽效应(Shielding effect)
屏蔽效应:由核外 电子云抵消一些核 电荷的作用。
有效核电荷Z*与屏蔽常数σ
ee+2
He
e+2
2-σ e-
He+
假想 He
He 移走一个 e 需 He+移走一个 e 需
2s 电子云径向分布曲线除
主峰外 , 还有一个距核更近的 小峰. 这暗示, 部分电子云钻 至离核更近的空间, 从而部分 回避了其他电子的屏蔽.
(2)钻穿效应 指外部电子进入原子内部空间,受到核的较强的吸引 作用。
◆ 轨道的钻穿能力通常有如下顺序: n s > n p > n d
> n f,导致能级按 E(ns) < E(np) < E(nd)< E(nf ) 顺序分裂。
— —— —— —— —— —
2 p p p x 2 y 2 z
↓ ↑↓ ↑ ↑↑↑
原子核电子的排布

2s 2 2 p6
1s 2
1s
n=1
态
l=0
1.3.3 跃迁选择定则
不是原子中任何两个能级之间都能够发生 跃迁。只有符合光谱选择定则的跃迁才是 允许的; 不符合光谱选择定则的跃迁叫禁戒跃迁(有 些禁戒的跃迁还是可能发生的,只是它的 跃迁几率比容许跃迁的跃迁几率要小得多) 。
跃迁选择定则 跃迁选择定则
2
E2 − E1 ν= h
E1 吸收跃迁: 粒子吸收一光子ε ②吸收跃迁: 粒子吸收一光子 =hv=E2-E1 而由低能级跃迁 至高能级. 至高能级 E2
E1
非辐射跃迁
无辐射跃迁: 既不发射又不吸收光子的跃 迁(通过与其它粒子或气体容器壁的碰撞、 或其它能量交换过程)
1927年索尔维会议 埃 年索尔维会议
电子填充各壳层的次序是: 电子填充各壳层的次序是: 1s,2s,2p,3s,3p,4s,3d,4p,5s, 4d,5p,6s…
洪特规则
电子在原子核外排布时,将尽可能分占不 同的轨道,且自旋平行。(量子力学证明, 电子这样排布可能使能量最低,所以洪特 规则也可以包括在能量最低原理中) 对于同一个电子亚层,当电子排布处于 全满(s2、p6、d10、f14) 半满(s1、p3、d5、f7) 全空(s0、p0、d0、f0)时比较稳定。
原子中电子壳层结构
1. 原子的电子壳层结构: 原子的电子壳层结构: 原子核外电子的运动状态由四个量子数描述: 原子核外电子的运动状态由四个量子数描述:
n l ml ms
1916年,Kossel提出了电子壳层分布模型:n相同的电 年 提出了电子壳层分布模型: 相同的电 提出了电子壳层分布模型 子处于同一壳层, 大则距离原子核越远 能量越高; 大则距离原子核越远, 子处于同一壳层,n大则距离原子核越远,能量越高; 同一壳层内, 不同分为不同支壳层 越大 不同分为不同支壳层, 越大, 同一壳层内,l不同分为不同支壳层,l越大,相应支壳 层能量越高。 层能量越高。 主量子数n 主量子数 = 1, 2, 3, 4, 5, 6 壳层符号 K L M N O P
化学第六版电子课件第一章原子和分子
小结:同周期中,随着原子序数的增加,元素的金
属性逐渐减弱,元素的非金属性逐渐增强。
第一章 原子和分子
2.同主族元素金属性和非金属性的递变(表1—6)
表 1—6
同一主族元素(ⅠA、Ⅶ A)性质的递变规律
性质变 元素 核电 电子 原子半径 元素 核电 电子 原子 性质变
化
荷数 层数 (nm)
荷数 层数 半径
(4)由于稀有气体原子电子层排布的结构相对稳定,
稀有气体的化学性质稳定。
依据上述规律,可以将核电荷数为 1 ~ 20 的元素的
原子核外电子分层排布的情况列出来(表 1—4)
第一章 原子和分子
2.原子核外电子的分层排布
表 1—4核电荷数为 1 ~ 20 的元素原子的核外电子排布
第一章 原子和分子
2.原子核外电子的分层排布
这 15 种元素的性质非常相似,称为镧系元素。
第七周期中从 89 号元素锕 Ac 到 103 号元素铹 Lr
,这 15 种元素的性质也非常相似,称为锕系元素。
注:镧系元素为主要的稀土元素,我国的稀土存储量和种类在世界上都处于
领先位置。
锕系元素中铀后面的元素都是人工合成的元素,叫做超铀元素。锕系元素都
向外,依次排布在能量逐步升高的电子层里,这个规律叫
做能量最低原理。
第一章 原子和分子
2.原子核外电子的分层排布
我们以稀有气体元素原子电子层排布的情况来说明核外
电子的分层排布规律(表 1—3):
表 1—3稀有气体元素原子的电子层排布
从上述表格可以看出什么规律吗?
第一章 原子和分子
2.原子核外电子的分层排布
单位正电荷
1.673×10-27
1.007
3.2.1 原子的构成 原子核外电子的排布 课件(共26张PPT)

课时1 原子的构成 原子核外电子的排布
与原子相比,原子核的体积更小
原子 因此,原子核外有很大的空间,电子就在这个空间里不停运动着
课时1 原子的构成 原子核外电子的排布 Ⅱ 原子核外电子的排布 不是真实存在的,只是为了研究方便假设的
核外电子的运动区域由内到外依次为第一至七层
核外电子分层排布示意图
电子层:1 2 3 4 5 6 7
+13 2 8 3
钠Na
镁Mg
铝Al
原子最外层电子一般都少于4个,在化学反应中易失去电子
课时1 原子的构成 原子核外电子的排布 非金属原子的结构示意图
+7 2 5
+8 2 6
+16 2 8 6
+17 2 8 7
氮N
氧O
硫S
氯Cl
原子最外层电子一般都多于4个,在化学反应中易得到电子
课时1 原子的构成 原子核外电子的排布
课时1 原子的构成 原子核外电子的排布 稀有气体原子的结构示意图
+2 2
+10 2 8
+18 2 8 8
氦He
氖Ne
氩Ar
原子最外层一般都有8个电子(氦为2个电子),这样的结构被认为是 一种相对稳定的结构
课时1 原子的构成 原子核外电子的排布 金属原子的结构示意图
+11 2 8 1
+12 2 8 2
19世纪末,英国物理学家汤姆孙发现了电子。在此 基础上,他提出了一种原子模型,认为正电荷均匀 分布在整个原子内,带负电荷的电子镶嵌其中
实心球模型
我国古代哲学家提出了“端”的观点, 古希腊哲学家也提出了意义相近的 “原子”的概念。1808年,道尔顿提 出了原子论。上述“端”和“原子” 可被认为是原子的“实心球模型”
高二化学知识点总结选择性必修一

高二化学知识点总结选择性必修一高二化学知识点总结化学是一门研究物质组成、性质和变化的科学。
在高二学年,化学课程的知识点开始逐渐扩展,其中选择性必修一的内容为我们提供了基本的化学原理和概念。
本文将对这些知识点进行总结和梳理,以帮助同学们更好地复习和掌握。
1. 原子结构与元素周期表1.1 原子结构的组成原子由质子、中子和电子构成。
质子和中子位于原子核中,而电子则围绕原子核的轨道上运动。
质子和中子的质量相近,而电子质量较小。
1.2 元素的原子序数和原子量元素的原子序数指的是元素原子核中质子的数量,以及元素周期表中元素的顺序。
原子量则是指元素一个原子质量的相对数,通常以u(原子质量单位)表示。
1.3 元素的电子层次和电子排布原子内的电子排布遵循一定的规则。
电子填充遵循“能量最低和能量最近原则”。
根据不同的能级和轨道,可以分为s、p、d、f等不同类型的电子轨道。
1.4 元素周期表元素周期表按照原子序数的增加,将元素分类排列。
周期表的横行称为周期,竖列称为族。
元素周期表不仅提供了元素的基本信息,也有助于预测元素的性质。
2. 化学键与化学方程式2.1 原子结合与化学键原子通过化学键结合形成分子或离子。
常见的化学键有共价键、离子键和金属键等。
共价键是通过电子的共享而形成的,离子键是通过电子的转移而形成的。
2.2 化学方程式的描述和平衡化学方程式用化学符号和配比表示化学反应过程。
化学反应可以分为反应物和生成物。
平衡状态下反应物和生成物的物质的量保持不变。
3. 配位化学与离子反应3.1 配位化合物和配位键配位化合物是指中心金属离子和周围配位体形成的结构。
配位键是指配位体中的配位原子与中心金属离子之间的键。
3.2 配位化合物的命名和常见配体根据国际纯粹与应用化学联合会的规定,配位化合物和配体的命名遵循一定的规则。
常见的配体有氨、水、氯等。
3.3 离子反应和电离方程式离子反应是指反应物中的离子参与的化学反应。
电离方程式以离子形式表示反应过程,可以方便地描述溶液中的离子反应。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
①发射跃迁: 粒子发射一光子ε= hv=E2-E1而由高能级跃迁 至低能级; E
2
E2 E1 h
E1 ②吸收跃迁: 粒子吸收一光子ε=hv=E2-E1 而由低能级跃迁 至高能级. E2
E1
非辐射跃迁
无辐射跃迁 : 既不发射又不吸收光子的跃 迁(通过与其它粒子或气体容器壁的碰撞、 或其它能量交换过程)
• 能级也与副量子数l 有关,有时n较小的壳层未满, n 较大的壳层上却有电子填入。 • 填充顺序的经验公式 能级高低由半经验公式决定 n+0.7 l 例:4s 和3d状态 4s n+0.7l=4+0.7*0=4 3d n+0.7l=3+0.7*2=4.4 • 先填4s态
泡利不相容原理
电子排布数量
泡利不相容原理:不能有两个全同费密子处于同 一个单粒子态----决定了电子数量 在原子中,每个确定的电子能态上最多只能容纳一 个电子,而每个电子能状态要四个量子数描述(n、l 、ml、ms ) n 1 2n 2 2 2l 1 壳层n上的电子数
l0
每一支壳层l上电子数
原子中电子壳层结构
原子的电子壳层结构: 原子核外电子的运动状态由四个量子数描述:
n l ml ms
1916年,Kossel提出了电子壳层分布模型:n相同的电 子处于同一壳层,n大则距离原子核越远,能量越高; 同一壳层内,l不同分为不同支壳层,l越大,相应支壳 层能量越高。
主量子数n = 1, 2, 3, 4, 5, 6 壳层符号 K L M N O P s p d f g h
量子数
磁量子数ml 描述原子轨道或电子云在空间的伸展方向。某种 形状的原子轨道,可以在空间取不同方向的伸展 方向,从而得到几个空间取向不同的原子轨道。 m取值受角量子数取值限制,对于给定的l值,m= -l,...,-2,-1,0,+1,+2…+l,共2l+1个值。 自旋磁量子数ms 描述轨道电子特征的量子数,ms=+或-1/2
1.3.2 电子组态
电子组态:原子内电子壳层(以nl形式)排 布的表示。又称电子构型。原子中的电子 排布组成一定的壳层.例如 ,硅原子的电子 组态是 1s2 2s2 2p6 3s2 3p2,表示其14个 电子中2个排布在1s态,2个排布在2s态,6 个排布在2p态,2个排布在3s态和最后 2 个电子排布在3p态。电子组态清楚地显示 出核外电子的排布状况。 指电子在核外运动的波函数满足定态薛定 谔方程,即呈不随时间变化的稳定的状态 。它通常以电子组态表示。
1927年索尔维会议 埃
小 布 拉 格
伦 法 斯 特
薛 定 格
康 泡 普 利 顿
德 布 洛 意
玻 尔
普 朗 克
居 里 夫 人
洛 仑 兹
爱 因 斯 坦
郎 之 万
J J1 J 2
j j1 j2 , j1 j2 1,..., j1 j2
例* 利用j-j耦合,求3p4d态的原子态。 解: l 1 s1 1 j1 1 , 3 1 2 2 2
l2 2
1 s2 2
3 5 j2 , 2 2
一般j-j耦合的原子态表示为: ( j1 , j2 ) j
同一个原子中没有也不可能有运动状态完全相同 的两个电子存在。如果两个电子处于同一轨道, 这两个电子的自旋方向必定相反。 s亚层只有1个轨道,可以容纳两个自旋相反的电 子;p亚层有3个轨道,总共可以容纳6个电子;d 亚层有5个轨道,总共可以容纳10个电子,f亚层 有7个轨道,总共可以容纳14个电子。 第一电子层(K层)中只有1s亚层,最多容纳两个电 子;第二电子层(L层)中包括2s和2p两个亚层,总 共可以容纳8个电子;第3电子层(M层)中包括3s、 3p、3d三个亚层,总共可以容纳18个电子……第n 层总共可以容纳2n^2个电子。
1.3.3 跃迁选择定则
不是原子中任何两个能级之间都能够发生 跃迁。只有符合光谱选择定则的跃迁才是 允许的; 不符合光谱选择定则的跃迁叫禁戒跃迁(有 些禁戒的跃迁还是可能发生的,只是它的
跃迁几率比容许跃迁的跃迁几率要小得多)
。
跃迁选择定则 选择定则
举例:某碱金属原子从3d态跃迁到3p态,可能发 生的所有跃迁。 3p: n=3, s=1/2, l=1, j=1/2, j=3/2
电子组态
核外电子数 N
32 18 8 2
4s 2 4 p6 4d 10 4 f 14 n 4
M
l0 l 1 l2 l3 4s 2 4 p6
电
4d 10 4 f 14 子
3s 2 2s 2
1s
2
3 p6 2 p6
3d 10
L K
n 3 l 1 3 p6
l2
l0
3s 2
3d 10 组
原子态能量高低的判断---洪特规则的另一种表述 洪特规则的另一种表述 对于一个给定的电子组态形式的一组原子态,当 某原子态具有的S最大时,它处的能级位置低; 对于同一个S,又以L值大的最低 洪特规则的补充规则:对于同科电子,当同科电 子数小于或等于闭壳层占有数一半时,具有最小J 值的能级处于最低,这称为正常次序;当同科电 子数大于闭壳层占有数一半时,则具有最大J值的 能级最低,这称为倒转次序,(只对L~S耦合)
常用单位换算 普朗克常数 h 6.626 1027 尔格秒 19 e 1.602 10 电子电荷 库仑 电子质量 me 9.109 1028 克 24 m 1.6725 10 质子质量 p 克=1836me 24 m 1.6747 10 中子质量 n 克 -9 a=5.2917 10 cm 0.53A 波尔半径 7 10 1焦耳= 尔格 19 1.602189 10 J 1电子伏特= 27 1.66 10 kg 1u=
能量最低原理
“电子优先占据最低能态”
n 3 Ze S
n=1 n=2 n=3
l
2 1 0 3d 3p 3s
P
D
2
1 0
2p 2s
1
0
1s
能量最低原理
一般情况: l相同时,n愈大,能量越高
E1s E2 s E3s
n相同时,l 愈大,能量越高,
E3s E3 p E3d
但有交叉,如3d﹥4s 电子填入壳层次序的经验规律:(极个别例外) n+l相同时,先填n小的; n+l不相同时,若n相同 ,则先填 l 小的,若n不同,则先填n大的壳层
2(2l+1)
s, p, d , f 2,6, 10, 14
洪特规则
电子在原子核外排布时,将尽可能分占不 同的轨道,且自旋平行。(量子力学证明, 电子这样排布可能使能量最低,所以洪特 规则也可以包括在能量最低原理中) 对于同一个电子亚层,当电子排布处于
全满(s2、p6、d10、f14)
半满(s1、p3、d5、f7) 全空(s0、p0、d0、f0)时比较稳定。
1 3 ( , ) 2,1 2 2
1 5 ( , )3, 2 2 2
3 3 ( , )3, 2,1,0 2 2
3 5 ( , ) 4,3, 2,1 2 2
有12个态与前面一样 j-j耦合的跃迁选择定则
J 0, 1
辐射跃迁
1.跃迁: 粒子由一个能级过渡到另一能级的过程 2.辐射跃迁: 粒子发射或吸收光子的跃迁(满足跃迁选择定则)
n2 l0 l 1
2s 2 2 p6
1s 2
n1
态
l0
1.3.3原子态
由电子组态到原子态: 如何将原子的状态与电子 的组态联系起来?这要考虑电子之间的相互作用 ,原子状态不是单个电子状态 的简单叠加,因它 们之间存在相互作用。通常以角动量的耦合来体 现 Байду номын сангаас即 L S J J
原子态表示符号 2s1 LJ L S 耦合才能这样表达 能量最低的原子态称基态,能量较高的称激发态 。如何判断原子态能量的高低—洪特规则等
L—S耦合
当两个电子自旋之间作用很强,两个电子的轨 道运动之间作用也很强,那么两个自旋运动就要合 成一个总的自旋运动,即s1+s2=S。 两个轨道角动量也要合成一个轨道总角动量, 即l1+l2=L, 轨道总角动量和自旋总角动量再合成总角动量 ,即L+S=J,此耦合过程称为L-S耦合。
l1 1
l2 2 l 3,2,1
j (0,2) 21D2
j (0,1) 11P 1
j (0,3) 31F3
j (1,1) 2,1,0 P2,1,0
3
j (1,2) 3,2,1 D3, 2,1
3
j (1,3) 4,3,23F4,3, 2
(s1l1 )(s2l2 ) ( j1 j2 ) J
j-j耦合
J1 L1 S1
J 2 L2 S2
j1 l1 s1 , l1 s1 1,..., l1 s1
j2 l2 s2 , l2 s2 1,..., l2 s2
副量子数l = 0, 1, 2, 3, 4, 5,….n-1 支壳层符号
1.3.1 电子排布原理
处于稳定状态的原子,核外电子将尽可能 地按 能量最低原理 泡利不相容原理 洪特规则
能量最低原理
在不违背不相容原理的情况下,电子在原子 核外排布时,要尽可能使电子的能量最低 。 离核较近的电子具有较低的能量,随着电 子层数的增加,电子的能量越来越大;同 一层中,各亚层的能量是按s、p、d、f的 次序增高的。
S 0
l 1 J 0, 1
3d:
n=3, s=1/2, l=2,
j=5/2, j=3/2
