拉替拉韦钾片药物详细说明解析
100个还未被仿制的进口独家产品

100个还未被仿制的进口独家产品
2015-03-06医药代表
本期精选了100个还没有仿制品的进口独家产品,并通过咸达数据(V3.0)确认了国内申请仿制最快的企业和进度,个个高大上。
亲爱的民族制药企业,你们如果永远都在研究各部委的政策,钻研招标的空子,忽略药物的本质,中国制药和中国足球还有什么区别!
可喜的是,总有一些企业,能给人些许安慰。
手机药筛利用咸达数据3.0
黄金版,检索出部分产品国内最快仿制进度情况,发现我们me(山) too(寨)的节奏还是挺快的,中国制药还有希望。
这些进度最快的,最有希望将来成为首仿,如果您关心医药股的话,这些家的审评进度您可盯紧了哦!假如您错过了甲磺酸阿帕替尼上市之前买入恒瑞医药、错过了复格列汀批临床前入手复星医药,难道您还要错过下面的品种吗?。
拉替拉韦钾干混悬剂说明书

核准日期:拉替拉韦钾干混悬剂说明书请仔细阅读说明书并在医师指导下使用[药品名称]通用名称:拉替拉韦钾干混悬剂 商品名称:艾生特 (ISENTRESS )英文名称:Raltegravir Potassium for Oral Suspension 汉语拼音:Latilawei jia Ganhunxuanji [成份]本品主要成份为拉替拉韦钾。
化学名称:N -[(4-氟苯基)甲基]-1,6-二氢-5-羟基-1-甲基-2-[1-甲基-1-[[(5-甲基-1,3,4-噁二唑-2-基)羰基] 氨基]乙烷基]-6-氧代-4-嘧啶甲酰胺一钾盐。
化学结构式:NNH N O H NOOH 3C CH 3H 3CO NNOH 3CFK分子式:C 20H 20FKN 6O 5 分子量:482.51 [性状]本品为白色或类白色颗粒状粉末,偶见黄色至米色至棕褐色颗粒。
[适应症]本品适用于与其它抗反转录病毒药物联合使用,用于治疗大于4周龄且体重3~20公斤婴幼儿中的人免疫缺陷病毒(HIV-1)感染。
[规格]100mg(按拉替拉韦计)。
[用法用量]大于4周龄且体重在3~20公斤的婴幼儿,根据体重给药的剂量详见表1。
表1:艾生特对于体重在3~20公斤的儿科患者的建议给药剂量*[不良反应]成人曾接受过治疗的患者出现的不良事件对于曾接受过治疗的患者,本品的安全性评价是基于来自随机临床试验中安全性数据的汇总分析,临床试验P018和P019 报告了462 名患者服用本品推荐剂量400 mg,每日两次合并优化背景疗法(OBT)治疗,与对照组237 名接受安慰剂合并OBT联合治疗的患者进行比较。
在双盲治疗期内,服用本品400 mg,每日二次组的总随访期为1051病人年,而服用安慰剂组为322病人年。
在临床试验P018和P019的汇总显示:服用本品400 mg,每日两次+ OBT组患者(平均随访118.7周)和服用安慰剂+ OBT对照组(平均随访71.0周)患者,不考虑不良事件严重程度或因果关系,最常出现的(任一组中>10%)临床不良事件及其发生率分别为:腹泻26.6%和24.9%、恶心13.6%和16.0%、头痛12.1%和13.5%、鼻咽炎14.3% 和8.9%、疲劳12.1%和5.9%、上呼吸道感染15.8%和10.1%、支气管炎12.1%和6.8%、发热9.7%和13.9%、呕吐8.9% 和11.0%。
盐酸拉维达韦片说明书
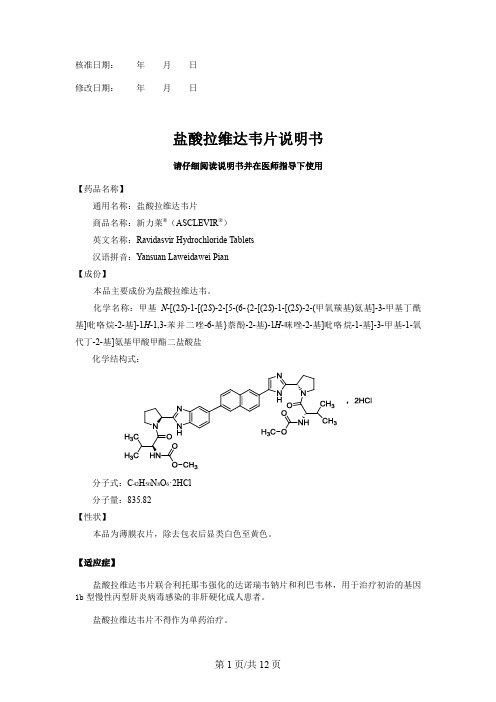
核准日期:年月日修改日期:年月日盐酸拉维达韦片说明书请仔细阅读说明书并在医师指导下使用【药品名称】通用名称:盐酸拉维达韦片商品名称:新力莱®(ASCLEVIR®)英文名称:Ravidasvir Hydrochloride Tablets汉语拼音:Yansuan Laweidawei Pian【成份】本品主要成份为盐酸拉维达韦。
化学名称:甲基N-[(2S)-1-[(2S)-2-[5-(6-{2-[(2S)-1-[(2S)-2-(甲氧羰基)氨基]-3-甲基丁酰基]吡咯烷-2-基]-1H-1,3-苯并二唑-6-基}萘酚-2-基)-1H-咪唑-2-基]吡咯烷-1-基]-3-甲基-1-氧代丁-2-基]氨基甲酸甲酯二盐酸盐化学结构式:分子式:C42H50N8O6·2HCl分子量:835.82【性状】本品为薄膜衣片,除去包衣后显类白色至黄色。
【适应症】盐酸拉维达韦片联合利托那韦强化的达诺瑞韦钠片和利巴韦林,用于治疗初治的基因1b型慢性丙型肝炎病毒感染的非肝硬化成人患者。
盐酸拉维达韦片不得作为单药治疗。
【规格】0.2g(以C42H50N8O6计)【用法用量】推荐剂量本品口服,可空腹或与食物同服。
本品用法用量:每次200mg,每日1次,连续12周。
服用本品时须同时应用达诺瑞韦钠片、利托那韦和利巴韦林。
推荐达诺瑞韦钠片用法用量:口服,每次100mg,每日2次;连续12周(详见达诺瑞韦钠片说明书)。
推荐利托那韦(RTV)用法用量:口服,每次100mg,每日2次,连续12周(详见利托那韦片说明书)。
推荐利巴韦林用法用量:利巴韦林的剂量根据体重确定。
如体重<75kg,每次500mg,每日2次;如体重≥75kg,每次600mg,每日2次;连续12周(详见利巴韦林制剂说明书)。
剂量调整、暂停给药和停止治疗不建议调整盐酸拉维达韦片的剂量,并应避免暂停给药。
但如果因不良反应需要暂停给药联合治疗方案中的任何一种药物,则不得单独应用盐酸拉维达韦片治疗。
FDA批准的44个抗艾滋病药物

Elvitegravir+cobicistat, emtricitabine+tenofovir disoproxil fumarate
复方制剂
28
齐多夫定+拉米夫定
zidovudine+lamivudine
复方制剂
29
阿巴卡韦+拉米夫定
Abacavir+lamivudine
raltegravir
整合酶抑制类
42
德罗格韦
dolutegravir
整合酶抑制类
43
依特格韦
Elvitegravir
整合酶抑制剂
44
可比西他
Cobicistat
抗艾滋病药物增强剂
核苷逆转录酶抑制类
6
硫酸阿巴卡韦
AbacavirSulfate
核苷逆转录酶抑制类
7
恩曲他滨
emtricitabine
核苷逆转录酶抑制类
8
扎西他滨
Hivid
核苷逆转录酶抑制类
9
利匹韦林片
rilpivirine
非核苷逆转录酶抑制类
10
依曲韦林
etravirine
非核苷逆转录酶抑制类
11
地拉韦啶
delavirdine
复方制剂
30
齐多夫定+拉米夫定+
阿巴卡韦
Abacavir+zidovudine+lamivudine
复方制剂
31
齐多夫定+拉米夫定+奈韦拉平
zidovudine+lamivudine+nevirapine
哌拉西林钠舒巴坦钠联合阿奇霉素治疗细菌性肺炎的效果及安全性分析

者的一般资料相比,P>0.05。
本次研究经该医院医学伦理学委员会批准。
1.2 方法为参照组患者使用富马酸替诺福韦二吡呋酯片、依非韦伦片及拉米夫定片进行治疗,方法是:让患者每天口服1次富马酸替诺福韦二吡呋酯片〔进口药品注册证号:H20130589,生产厂家:Aspen Port Elizabeth(Pty.)Ltd.〕,每次服400 mg。
让患者每天口服1次依非韦伦片(进口药品注册证号:H20130135,生产厂家:Merck Sharp &Dohme Australia Pty.Ltd),每次服600 mg。
让患者每天口服1次拉米夫定片(批准文号:国药准字H20030581,生产厂家:葛兰素史克制药有限公司),每次服100 mg。
连续治疗1个月。
为研究组患者使用富马酸替诺福韦二吡呋酯片、拉替拉韦钾片及拉米夫定片进行治疗,方法是:让患者每天口服1次拉替拉韦钾片〔进口药品注册证号:H20171172,生产厂家:MSD Pharma(Singapore)Pte.Ltd.〕,每次服600 mg。
富马酸替诺福韦二吡呋酯片及拉米夫定片的使用方法与参照组患者相同。
连续治疗1个月。
1.3 观察指标治疗前后分别检测两组患者的血清CD4+细胞计数及HIV荷载量。
治疗期间观察两组患者发生不良反应的情况。
1.4 统计学处理将本次研究中的数据均采用SPSS 20.0统计软件进行处理,计量资料用均数±标准差(s±)表示,采用t检验,计数资料用百分比(%)表示,采用χ²检验。
以P<0.05为差异具有统计学意义。
2 结果2.1 治疗前后两组患者的血清CD4+细胞计数及HIV荷载量治疗前,两组患者的血清CD4+细胞计数及HIV荷载量相比,P>0.05。
治疗后,研究组患者的血清CD4+细胞计数高于参照组患者,其HIV荷载量低于对照组患者,P<0.05。
详见表1。
表1 治疗前后两组患者的血清CD4+细胞计数及HIV荷载量(sx±)组别例数时间血清CD4+细胞计数(106/L)HIV荷载量(103/L)研究组28治疗前136.25±7.253.28±0.42治疗后226.37±8.80*1.01±0.26*参照组28治疗前132.07±9.053.41±0.49治疗后178.69±10.332.27±0.36注:*与参照组治疗后相比,P<0.052.2 治疗期间两组患者发生不良反应的情况治疗期间,研究组患者中无患者发生明显的不良反应;参照组患者中有1例患者发生恶心,其不良反应的发生率为3.57%。
HIV职业暴露告知书及预防药物使用说明

HIV职业暴露告知书及预防药物使用说明同志,根据你的述诉,经专家组分析讨论后认为,你已发生了HIV 职业暴露,根据国家有关规定,是否服用预防药物需由你本人自己决定,但在作决定前,你应了解以下事项:HIV职业暴露是指卫生保健人员在职业工作中与HIV感染者的血液、组织、体液或HIV污染的医疗器械及设备等接触而具有感染HIV的危险。
确定具有传染性的暴露源包括血液、体液、**和阴道分泌物。
脑脊液、关节液、胸腔积液、腹水、心包积液、羊水也具有传染性,但其引起感染的危险程度尚不明确。
粪便、鼻分泌物、唾液、痰液、汗液、泪液、尿液及呕吐物通常认为不具有传染性。
其中:HIV职业暴露危险评估中(一)风险增高的因素包括:(1)污染物(例如针头)有可见的血液;(2)针头直接刺入静脉或动脉;(3)空心针;(4)损伤较深;(5)暴露源为晚期HIV感染者;(6)高病毒载量(暴露源检测不到病毒载量,发生职业暴露的风险很低但并不是完全不可能,需要提供PEP)。
(二)不需要暴露后预防(PEP)的情况:(1)被暴露者本身为HIV感染者。
(2)暴露源为HIV阴性者。
(3)暴露的体液没有感染HIV风险:眼泪、没有血迹的唾液、尿液、汗液而根据第四版艾滋病抗病毒药物治疗手册,推荐职业暴露PEP方案为:替诺福韦(1次1片,每天1次)+拉米夫定(1次1片,每天1次)+克力芝(1次2片,每天2次),连服28天。
或恩曲他滨替诺福韦(1次1片,每天1次)+拉替拉韦钾(1次1片,每天2次),连服28天。
如决定用药,用药时间越早越好,应在发生暴露后尽快(2小时内)开始预防性治疗,最好不要超过72小时。
如果在此时间内无法获得药物,即使超过72小时后也要将药物提供给暴露者。
用药必须服满28天才有效。
服用注意事项:1、服药严格按照时间规定。
2、每日饮水量不得少于1500ML。
3、服药前后2小时内不要进食,以免影响药物的吸收。
4、应于暴露后基线、6周、12周、6个月时进行HIV检测(如果使用4代P 24抗原和(或)抗体检测方法,暴露后基线、6周、12周、4月进行HIV检测)。
Tivicay (通用名:dolutegravir
• 结构式如下:
不良反应
最常见不良反应中度至严重强度和发生率≥2% (在任何一个成年试验接受 TIVICAY)是失眠和头痛。
类似产品:
• raltegravir(拉替拉韦) • 默沙东的拉替拉韦(商品名为艾特生)是目前在 中国唯一上市销售的整合酶抑制剂。
在临床试验中,Tivicay 疗效优于强生(JNJ)的蛋 白酶抑制剂Prezista (darunavir ,地瑞那韦),同 时与当前的标准护理药物整合酶抑制剂Isentress (raltegravir,拉替拉韦)疗效相当。
HIV-1整合酶
• HIV-1整合酶是逆转录病毒复制的必需酶.当艾滋病病 毒感染人体时,通常会利用整合酶当工具,将病毒的遗 传信息“复制粘贴”到宿主细胞的DNA中,并将病毒 DNA与人体DNA整合。而且在人类细胞中没有类似物, 因此成为治疗艾滋病的富有吸引力和合理的靶标。 • 很多HIV-1整合酶抑制剂被鉴定出来,其中一些化合 物可以选择性的抑制HIV-1整合酶和阻断病毒复制的活 性。 • 整合酶在包括艾滋病病毒等逆转录酶病毒中可以找到, 并且充当了艾滋病病毒在人体内复制时的“帮凶”。这 项重大突破有助于科学家解决困扰了艾滋病研究领域长 达20年的一个难题,从而找到更好的治疗艾滋病的方法。
作用效果
• 最强整合酶抑制剂Tivicay日本上市 它低剂量 50mg横扫全部hiv病毒,不管有没有治疗经历, 耐不耐药,全部消灭,并且不再出现耐药病毒。 这个药据现行资料来看是副作用最小的艾滋病药 物了50mg剂量就能维持24小时,而且只有个别 副作用是失眠。
上市
• 葛兰素史克旗下 ViiV 保健公司的多替拉韦钠片 (dolutegravir)也于 2015 年 1 月 29 日获批临床, 目前办理状态为「在审批」。这也是进入 2015 年以来 GSK 在中国市场连续获批临床的第四个药 物。 • 这款药物分别于 2013 年 8 月和 2014 年 1 月在美 国和欧洲获批上市,商品名为 Tivicay。
比克替拉韦 作用原理

比克替拉韦作用原理比克替拉韦(Bictegravir)是一种高效的抗逆转录病毒药物,作为一种整合酶抑制剂,具有独特的作用原理。
它被广泛用于治疗人免疫缺陷病毒(HIV)感染,可以有效地抑制病毒复制,并减少病毒在人体内的数量。
下面将详细介绍比克替拉韦的作用原理。
比克替拉韦的作用原理主要集中在抑制HIV病毒的整合酶活性。
整合酶是HIV病毒中的一种重要酶类,它能够将病毒的RNA基因组整合到宿主细胞的DNA中,使病毒能够在细胞内复制和繁殖。
比克替拉韦能够与整合酶结合,阻断其活性,从而阻止病毒的整合过程。
具体来说,比克替拉韦能够与整合酶结合,并通过与病毒DNA结合,形成稳定的药物-酶-底物复合物。
这种复合物的形成阻碍了整合酶在DNA链上的催化活性,使得病毒无法将其基因组整合到宿主细胞的DNA中。
此外,比克替拉韦还能阻断整合酶与DNA底物结合的过程,从而进一步抑制病毒的整合。
通过这种作用机制,比克替拉韦能够有效地抑制HIV病毒的复制和繁殖,减少病毒在人体内的数量。
与其他抗逆转录病毒药物相比,比克替拉韦具有较高的选择性和亲和力,能够更有效地抑制整合酶的活性,从而提供更持久的抗病毒效果。
比克替拉韦还具有良好的耐药性,能够有效地抑制多种耐药HIV株的复制。
这一特点使得比克替拉韦成为一种理想的治疗选择,尤其适用于那些已经对其他抗逆转录病毒药物产生耐药性的患者。
总结起来,比克替拉韦作为一种整合酶抑制剂,通过与病毒整合酶的结合,阻断病毒DNA整合的过程,从而抑制HIV病毒的复制和繁殖。
它具有高度的选择性和亲和力,能够有效地抑制耐药HIV株的复制。
比克替拉韦的独特作用机制为HIV感染的治疗提供了新的选择,有望在临床上发挥重要作用。
多替拉韦钠片-详细说明书与重点

多替拉韦钠片【成分】多替拉韦钠。
辅料:D-甘露醇,微晶纤维素,聚同羧甲淀粉钠,硬指富马酸钠等。
【性状】本品为黄色双面凸起的圆形片,一面刻有“SV572”,另一面刻有“50”字样。
【适应症】本品联合其它抗逆转录病毒药物,用于治疗人类免疫缺陷病毒(HIV)感染的成人和年满12 岁的儿童患者。
【规格】50 mg(以多替拉韦计)【用法用量】本品应该由具有治疗HIV 感染经验的医生进行处方。
成人:感染HIV-1 且未被确诊或临床疑似对整合酶类抑制剂耐药的患者,本品的推荐剂量为50 mg,口服,每日一次。
当与某些药物(例如依非韦伦、奈韦拉平替拉那韦/利托那韦或利福平)联用时,本品应按每日两次给药(见【药物相互作用】)。
感染HIV-1 且被确诊或临床疑似对整合酶类抑制剂耐药的患者:本品的推荐剂量为50 mg,每日两次。
应根据整合酶耐药类型以决定此类患者的用法(见【药理毒理】一药效学)。
在该人群中,应避免本品与某些药物(例如依非韦伦、奈韦拉平、替拉那韦/利托那韦或利福平)联合用药(见【注意事项】、【药物相互作用】)。
漏服药物:如果患者漏服,必须尽快服用本品,前提是下一次服药时间在4 小时之后。
如果下一次服药时间在4 小时内,患者不得服用漏服剂量,按照常规给药方案服药即可。
12 岁和12 岁以上的青少年::对整合酶类药物不耐药的青少年HIV-1 患者中(12 至17 岁,体重不低于40 kg),本品的推荐剂量为50 mg,每日一次。
老年人:65 岁及65 岁以上的患者中本品的用药数据有限。
尚无证据证实老年患者所需剂量与年轻成人患者不同(见【药代动力学】)。
肾损害:轻度、中度或重度(肌酐清除率(CrCl<30 mL/分,没有接受透析)肾损害的患者不需要调整剂量。
尚无关于接受透析受试者的数据,但预计在此人群中药代动力学无差异(见【药代动力学】)肝损害:在轻度或中度肝损害(Child-PughA 或B 级)的患者中不需要调整剂量.尚无关于重度肝损害患者(Child-PughC 级)的数据;因此在这些患者中必须慎用本品(见【药代动力学)。
拉替拉韦方案

概述拉替拉韦方案是一种针对新冠病毒感染而研发的药物治疗方案。
该方案主要通过使用拉替拉韦(Remdesivir)这一药物来治疗新冠病毒感染,并取得一定的临床疗效。
本文将对拉替拉韦方案的成分、治疗原理、临床应用以及注意事项进行介绍。
成分拉替拉韦是一种核苷类似物,由美国Gilead Sciences公司研发。
其结构类似于RNA的组成单元腺苷(Adenosine),可以使病毒的RNA复制受到干扰,从而抑制病毒在宿主细胞内的复制和传播。
治疗原理拉替拉韦主要通过以下方式发挥其治疗作用:1.抑制病毒复制:拉替拉韦与新冠病毒的RNA相互作用,阻止病毒的复制和传播,从而减轻感染程度。
2.减少炎症反应:新冠病毒感染会引发免疫系统的炎症反应,严重时可能导致器官损伤。
拉替拉韦可以通过抑制某些免疫细胞的激活,减少炎症反应。
临床应用拉替拉韦方案在新冠病毒感染的临床治疗中得到了广泛应用。
在临床试验中,研究人员发现使用拉替拉韦可以显著减少新冠病毒的复制和传播,缩短病程,减轻病情。
根据目前的临床指南,拉替拉韦方案主要应用于以下患者群体:•重症患者:对于需要住院治疗的重症患者,使用拉替拉韦可以减轻病情,降低死亡率。
•高风险人群:对于有基础疾病或老年人等高风险人群,拉替拉韦方案可以提供额外的治疗保障,减少并发症发生的可能性。
•早期感染者:拉替拉韦方案也可以应用于早期感染者,以抑制病毒的复制,避免疾病进一步恶化。
注意事项在使用拉替拉韦方案时,需要注意以下几点:1.使用拉替拉韦需要在专业医生指导下进行,严格按照剂量和用药时间进行使用。
2.拉替拉韦可能会影响肝功能,对于有肝病史的患者需谨慎使用。
3.孕妇、哺乳期妇女以及儿童患者的使用安全性尚未完全确定,需遵循医嘱。
4.长期使用拉替拉韦可能出现耐药性,需在医生监护下定期评估治疗效果。
结论拉替拉韦方案是一种用于治疗新冠病毒感染的药物方案,通过抑制病毒复制和炎症反应来减轻病情。
在临床应用中,拉替拉韦方案显示出一定的疗效,并被广泛应用于重症患者、高风险人群和早期感染者中。
拉替拉韦钾片药物详细说明

药品名称:通用名称:拉替拉韦钾片英文名称:ISENTRESS (Raltegravir Potassium Tablets)商品名称:艾生特成份:拉替拉韦钾适应症:本品适用于与其他抗反转录病毒药物联合使用,用于曾接受过治疗的HIV-1感染的成年患者,这些患者有病毒复制的证据并且对多种抗反转录病毒药物耐药。
本品适应症的确立是基于对两个临床对照研究24周时的血浆HIV-1 RNA水平进行的分析。
这些研究是在接受过三种抗反转录病毒抑制剂治疗(非核苷类反转录酶抑制剂、核苷类反转录酶抑制剂、蛋白酶抑制剂)并有疾病临床进展的成年患者中进行的。
本品与其他活性药物联合使用时产生治疗应答的可能性更大。
(见临床试验)在未经治疗的成年患者或儿童患者中尚无本品的安全性和有效性数据。
尚没有本品影响HIV-1感染的临床进展的研究结果。
规格:每片含拉替拉韦钾434.4mg,相当于拉替拉韦400mg(游离酚)用法用量:用于治疗HIV-1感染者时,口服本品400 mg,每日两次,餐前或餐后服用均可。
本品应与其他抗反转录病毒药物联合使用。
不良反应:同心堂心脑血管专科医院()此药物的容易出现的不良反应有:曾接受过治疗的患者出现的不良事件对于曾接受过治疗的患者,本品的安全性评价是基于来自随机临床试验中安全性数据的汇总分析,临床试验P005、P018和P019报告了507名患者服用本品推荐剂量400 mg,每日两次合并优化背景疗法(OBT)治疗,与对照组282名接受安慰剂合并OBT联合治疗的患者进行比较。
在双盲治疗期内,服用本品400mg,每日二次组的总随访期为702.8病人年,而服用安慰剂组为257.1病人年。
在临床试验P005、P018和P019的汇总显示:服用本品400 mg,每日两次+ OBT组患者(平均随访72.3周)和服用安慰剂+OBT对照组(平均随访47.6周)患者,不考虑不良事件严重程度或因果关系,最常出现的(任一组中>10%)的不良事件及其发生率分别为:腹泻20.3%和21.3%、恶心12.2%和15.6%、头痛10.8%和12.8%、疲劳10.5%和5.7%、上呼吸道感染10.3%和7.8%、发热7.7%和11.7%。
拉替拉韦钾片

拉替拉韦钾片关于《拉替拉韦钾片》,是我们特意为大家整理的,希望对大家有所帮助。
艾滋病这类病症坚信大伙儿一定都了解,归属于感染性很强,而且伤害非常大的症状。
尽管治疗艾滋病的方式有很多,但现阶段都还没除根的方式。
但是,艾滋病也不是不可以医治,一些药品针对病况的控制還是有很非常好的实际效果的,最典型性的便是拉替拉韦钾片。
下边我们就讨论一下拉替拉韦钾片的具体情况吧。
适用范围本产品适用与其他抗反转录病毒药品协同应用,用以医治人类免疫缺陷病毒I型(HIV-1)感染。
本产品适用范围的建立是根据对三个双盲临床医学对比科学研究48周时的血液HIV-1 RNA水准开展的剖析。
这种科学研究中的2个是在接纳过三种抗反转录病毒缓聚剂医治(非核苷类反转录酶缓聚剂、核苷类反转录酶缓聚剂、胰蛋白酶缓聚剂)并有病症临床医学进度的成年人病人中开展的,另一个是在以往未医治的病人中开展的。
本产品与别的特异性药品协同应用时造成医治回复的可能性更大。
(见临床研究)在少年儿童病人中未有本产品的安全系数和实效性数据信息。
[1]使用方法使用量用以医治HIV-1感染者时,内服本产品400mg,每天2次,餐前或饭后服食均可。
本产品应与别的抗反转录病毒药品协同应用。
常见问题比较严重皮肤和过敏症状在本产品与别的药品(与这种副作用相关)随着应用的患者中汇报了中重度、潜在性威协性命和至死性皮肤反映,包含Stevens-Johnson综合症与立毒副作用外皮坏死融解。
也汇报了以皮疹和全身病症为特点的过敏症状及其极少数人体器官功能问题,包含肝衰竭。
一旦产生比较严重皮肤反映或过敏症状临床症状或病症(包含但不限于比较严重皮疹或随着发热的皮疹、全身不适感、疲惫、肌肉或关节疼、起疱、口腔损害、结膜炎、面部水肿、肝炎、嗜酸粒细胞增加和血管神经性水肿),应该马上停止使用本产品和别的异常药品。
应检测病人的临床医学情况,包含肝转氨酶,并开展适度的医治。
在产生比较严重皮疹后如延迟时间停止使用本产品或别的异常药品可能造成威协性命的反映。
默沙东

2005年5月,默沙东与中国卫生部签署了全面预防和治疗艾滋病的合作项目,以支持中国政府通过国际合作,更好地开展艾滋病防治工作。
这一项目首先在四川凉山彝族自治州的3个县启动,并在2009年扩展至四川省的其他20个地州,共计62个项目点。
该合作为期5年、投入资金达3000万美元,是中国迄今为止最大的政府与国外私营企业合作的艾滋病综合防治项目,也是中国政府探索政府与非政府机构、公共和私有企业之间的合作方式,共同抗击艾滋病的重要举措。
产品说明书
安特尔®
[十一酸睾酮胶丸]
产品说明书
保法止®
[非那雄胺1mg]
产品说明书
女性健康
妈富隆®
[去氧孕烯炔雌醇片]
产品说明书
美欣乐®
[去氧孕烯炔雌醇片]
产品说明书
利维爱®
[替勃龙片]
产品说明书
欧维婷®
[雌三醇乳膏]
产品说明书
我们坚信患者为先;
我们的事业是保护人类健康,提高生活质量;
我们汇集优秀人才,并相信承诺予人,发展之本。
这是默沙东作为世界制药企业领先者的承诺和使命。
默沙东(在美国名为默克公司),作为全球500强企业多次获得赞誉,包括16次获得美国《财富》杂志“美国十大最受推崇公司”称号。自1992年进入中国以来,我们致力于通过专业的学术交流,为医生提供具有价值的产品和治疗领域信息,从而使默沙东的药品更好地造福于患者。
抗击艾滋病
为提高中国应对艾滋病的能力,默沙东与中国卫生部在四川省凉山彝族自治洲启动合作项目,共同探索建立一个综合的、可评估的和可推广的艾滋病防治模式。
默沙东支持地震灾区重建。
2008年汶川地震后,默沙东(含原先灵葆雅)先后捐赠总价值逾2800万元人民币的现金和5辆配备先进的救护车、价值30万美金的远程医疗系统等。我们正承诺将通过与相关机构的合作持续援助灾区的重建工作。
多替拉韦利匹韦林片说明书

核准日期:XXXX年XX月XX日多替拉韦利匹韦林片说明书请仔细阅读说明书并在医师指导下使用【药品名称】通用名称:多替拉韦利匹韦林片英文名称:Dolutegravir Sodium and Rilpivirine Hydrochloride Tablets汉语拼音:Duotilawei Lipiweilin Pian【成份】本品为复方制剂,其组分为:每片含多替拉韦钠(以多替拉韦计)50mg和盐酸利匹韦林(以利匹韦林计)25mg。
辅料:交联羧甲基纤维素钠,D-甘露醇,乳糖,硬脂酸镁,微晶纤维素,聚山梨酯20,聚维酮K29/32和K30,硅化微晶纤维素,羧甲淀粉钠,硬脂富马酸钠,薄膜包衣包含部分水解聚乙烯醇、二氧化钛、聚乙二醇/PEG、滑石粉、氧化铁黄、氧化铁红。
【性状】本品为粉红色双面凸起的椭圆形薄膜衣片,一面凹刻“SV J3T”字样,除去包衣后显白色或类白色。
【适应症】作为完整治疗方案用于治疗接受稳定的抗逆转录病毒治疗方案达到病毒学抑制(HIV-1 RNA < 50拷贝/mL)至少六个月,无病毒学失败史,且对非核苷类逆转录酶抑制剂或整合酶抑制剂没有已知或疑似耐药性的成人人类免疫缺陷病毒1型(HIV-1)感染患者。
【规格】每片含多替拉韦钠(按多替拉韦计)50mg和盐酸利匹韦林(按利匹韦林计)25mg。
【用法用量】本品应该由治疗HIV感染经验丰富的医生进行处方。
剂量本品的推荐剂量为一片,每日一次。
本品须随餐服用(见【药代动力学】)。
如果需要停用一种活性物质或调整其剂量,可以使用多替拉韦或利匹韦林的单方制剂(见【药物相互作用】)。
在这种情况下,医生应参阅这些药品的产品特征概要。
漏服如果患者漏服一剂本品,则应尽快随餐服用,前提是下一次服药时间在12小时之后。
如果下一次服药时间在12小时内,患者不得服用漏服剂量,只需按常规给药方案服药即可。
如果患者在服用本品后4小时内呕吐,则应随餐服用另一片本品。
如果患者在服用本品超4小时后呕吐,则在下一次常规服药之前,无需额外服用一剂本品。
拉替拉韦钾片治疗艾滋病的临床疗效观察

拉替拉韦钾片治疗艾滋病的临床疗效观察梁津;阮克琛;梁成员;黎海舰;罗禄文【摘要】目的观察拉替拉韦钾片治疗艾滋病的临床疗效及安全性.方法将120例艾滋病患者随机分为两组,治疗组给予拉替拉韦钾片+富马酸替诺福韦二吡呋酯片+拉米夫定片治疗,对照组给予依非韦伦片+富马酸替诺福韦二吡呋酯片+拉米夫定片治疗,观察两组治疗前后CD4+细胞计数、病毒载荷量的变化及不良反应.结果两组患者的CD4+细胞计数均高于治疗前,而病毒载荷量则均低于治疗前,差异有统计学意义(P<0.01);治疗组的CD4+细胞计数高于对照组,病毒载荷量则均低于对照组,差异有统计学意义(P<0.01);两组均无明显不良反应.结论拉替拉韦钾片治疗艾滋病免疫学和病毒学疗效显著,临床应用价值高.【期刊名称】《右江医学》【年(卷),期】2017(045)003【总页数】3页(P334-336)【关键词】拉替拉韦钾片;艾滋病;CD4+细胞;病毒载荷量【作者】梁津;阮克琛;梁成员;黎海舰;罗禄文【作者单位】右江民族医学院附属西南医院暨百色市人民医院感染性疾病科,百色533000;右江民族医学院附属西南医院暨百色市人民医院感染性疾病科,百色533000;右江民族医学院附属西南医院暨百色市人民医院感染性疾病科,百色533000;右江民族医学院附属西南医院暨百色市人民医院感染性疾病科,百色533000;右江民族医学院附属西南医院暨百色市人民医院感染性疾病科,百色533000【正文语种】中文【中图分类】R512.91艾滋病(Acquired immunodeficiency syndrome,AIDS)是由人类免疫缺陷病毒感染,导致CD4淋巴细胞的产生减少继发免疫缺陷引起的一种慢性致死性累及全身多器官系统的传染病。
目前治疗艾滋病的有效手段是高效抗逆转录病毒联合疗法,即通过联合应用三种或三种以上的抗病毒药物治疗艾滋病,其作用机制以HIV逆转录酶、蛋白酶为治疗靶点,而由于HIV病毒易发生突变,容易使抗HIV药物出现耐药性。
默沙东产品销售收入分析

默沙东产品销售收入分析2017年~2022年上半年默沙东销售收入地域分布◼由于默沙东在2021年6月完成Organon & Co. 公司的剥离,包含对女性健康、生物仿制药以及一些品牌的剥离,默沙东公司年报上仅就2021年、2020年和2019年的财务数据做了调整,刨除剥离业务的财务数据,而2018年和2017年公司年报的财务数据仍包含Organon 的财务数据。
这里我们对默沙东2018年和2017年的财务数据自行做了调整,扣除了女性健康和一些品牌的销售收入数据。
而对于默沙东销售收入的地域分布,仅通过默沙东公司披露的年报,无法了解2018年和2017年剥离Organon 后的销售收入的地域分布情况,因此,在分析收入地域分布时,这里的2018年和2017年的销售收入数据包含了Organon 的收入。
这里仅对销售收入各地域的相对占比进行分析。
如果想准确获得2018年和2017年默沙东刨除Organon 后的销售收入数据,需要再进一步查找Organon 在2018年和2017年的销售收入进行扣除。
◼从下图中默沙东各地域销售收入的占比可见,默沙东的销售收入主要来自于美国。
其次来自于欧洲、中东和非洲地区。
2017年至2022年上半年默沙东来自美国的收入占其全部收入的43%至48%,默沙东来自欧洲、中东和非洲地区的收入占其全部销售收入的26%~29%。
占比变动较为稳定。
◼值得关注的是,默沙东在中国的销售收入占比在逐年攀升。
从2017年默沙东在中国的销售收入占其全部销售收入的4%,升至2021年的9%。
◼默沙东在其他地区的销售收入占比在逐步下降。
2017年默沙东在日本的销售收入占比为8%,在2021年销售收入占比减少至6%。
在亚洲其他地区2017年的销售收入占比为7%,2021年销售收入占比降至5%。
在拉丁美洲2017年销售收入占比为6%,2021年降至不到5%。
默沙东销售收入地域分布百万美元201720182019202020212022H1美国17,424 18,346 18,420 19,588 22,425 13,577 欧洲中东和非洲11,478 12,213 10,496 11,547 13,341 7,942 中国1,586 2,184 2,180 2,751 4,378 2,515 日本3,122 3,212 2,609 2,602 2,726 2,103 亚洲其他地区2,751 2,909 2,126 2,113 2,407 1,938 拉丁美洲2,339 2,415 2,015 1,890 2,206 1,249 其他1,422 1,015 1,275 1,027 1,221 1,170 合计40,12242,29439,12141,51848,70430,494占比美国43.43%43.38%47.08%47.18%46.04%44.52%欧洲中东和非洲28.61%28.88%26.83%27.81%27.39%26.04%中国 3.95% 5.16% 5.57% 6.63%8.99%8.25%日本7.78%7.59% 6.67% 6.27% 5.60% 6.90%亚洲其他地区 6.86% 6.88% 5.43% 5.09% 4.94% 6.36%拉丁美洲 5.83% 5.71% 5.15% 4.55% 4.53% 4.10%其他3.54%2.40%3.26%2.47%2.51%3.84%0%10%20%30%40%50%60%70%80%90%100%201720182019202020212022H1默沙东销售收入地域分布美国欧洲中东和非洲中国日本亚洲其他地区拉丁美洲其他默沙东各部门销售收入◼默沙东包含制药部门和动物健康。
已上市HIV整合酶抑制剂及其合成介绍

已上市HIV整合酶抑制剂及其合成介绍徐靖坤;王瑞;陈小峰;田磊【摘要】整合酶是艾滋病毒(HIV)复制过程中的四个关键酶之一.目前已作为药物上市的艾滋病毒整合酶抑制剂一共有四种,分别是拉替拉韦、多替拉韦、埃替格韦和bictegravir,分别介绍了这四种整合酶抑制剂的情况及其化工企业可行的制备方法.【期刊名称】《安徽化工》【年(卷),期】2019(045)001【总页数】6页(P1-5,9)【关键词】艾滋病毒;整合酶抑制剂;制备方法【作者】徐靖坤;王瑞;陈小峰;田磊【作者单位】安徽贝克联合制药有限公司,安徽阜阳236626;安徽贝克联合制药有限公司,安徽阜阳236626;安徽贝克联合制药有限公司,安徽阜阳236626;安徽贝克联合制药有限公司,安徽阜阳236626【正文语种】中文【中图分类】TQ464.81981年,美国纽约和旧金山的医生同时发现一种奇怪病症,患者被诱发出现一些常见于有免疫缺陷人群的感染和癌症。
因此该病症被称为获得性免疫缺陷综合症(Acquired Immune Deficiency Syndrome),简称艾滋病(AIDS)[1]。
1984年,美国和法国科学家找到了致病的人体免疫缺损病毒(HumanImmunodeficiency Virus,简称HIV,亦称艾滋病毒)[2]。
AIDS传播速度快,死亡率高,如何阻止艾滋病毒入侵免疫细胞,恢复艾滋病患者的健康,一直是医药工业界的重要课题[3]。
自首个治疗HIV药物齐多夫定(Zidovudine)上市以来,目前用于临床的HIV药物主要以核苷/非核苷类逆转录酶抑制剂、蛋白酶抑制剂、融合酶抑制剂为主。
而整合酶是HIV复制过程中的四个关键酶之一 [4]。
HIV-1整合酶是由病毒的3’端pol基因编码的含288个氨基酸残基的蛋白质组成,折叠成3个结构域,即N端(N-terminal)结构域、核心(core)区域和 C端(C-terminal)结构域[5]。
药品注册审批年度报告

年药品注册审批年度报告国家食品药品监督管理局年月目录. 年药品注册管理工作情况. 年批准药品生产上市情况年批准药品临床研究情况. 年重要治疗领域的药品批准情况. 年药品注册申请受理情况. 结语药品注册,是国家食品药品监督管理局依照《药品管理法》的规定,根据药品注册申请人的申请,对拟上市销售药品的安全性、有效性、质量可控性等进行审查,并决定是否同意其申请的审批过程。
其根本目的是通过科学评价保证上市药品安全有效,保障和促进公众健康。
在药品研制、生产、流通、使用的全过程监管中,药品注册管理是从源头上对药品安全性和有效性实施监管的重要手段。
. 年药品注册管理的重要举措年,药品注册管理工作深入贯彻落实科学发展观,大力实践科学监管理念,以风险效益评估和风险管理为核心,坚持“规范审批、公开透明、鼓励创新”的原则,完善药品注册法规,健全药品审评审批机制,提高审评审批效率,较好地履行了《药品管理法》赋予的职责。
完善药品注册法规体系一是加快制定《药品注册管理办法》配套文件。
颁布了《新药注册特殊审批管理规定》对于符合特殊审批条件的注册申请,实行“早期介入、优先审评、多渠道沟通交流、动态补充资料”,充分体现了鼓励创新和加强风险控制管理的导向,促进我国创新药的研究与开发。
出台了《药品技术转让注册管理规定》,促进产品结构调整和生产资源的合理分配,实现优势产品重组和重点发展。
出台了《药物临床试验机构资格认定复核检查标准》,开展临床试验复核检查,加强对临床研究机构的监管。
完成《药品标准管理办法》、《药用原辅材料备案管理规定》、《天然药物注册管理补充规定》、《报告和管理规定》和《伦理委员会技术指导原则》的初步起草工作,进一步加快药品注册管理法规体系的完善。
二是健全药物研究技术指导原则体系。
采取先翻译后转化的办法,借鉴和引入国际公认并遵循的药物研发指南,有计划、分步骤地推进我国指导原则体系建立。
制定了复方抗生素研究技术要求、银杏叶和丹参类中药注射剂安全性及上市后风险评估技术要求、《药物致癌试验必要性的技术指导原则》等,着力解决药品安全问题。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
药品名称:通用名称:拉替拉韦钾片英文名称:ISENTRESS (Raltegravir Potassium Tablets)商品名称:艾生特成份:拉替拉韦钾适应症:本品适用于与其他抗反转录病毒药物联合使用,用于曾接受过治疗的HIV-1感染的成年患者,这些患者有病毒复制的证据并且对多种抗反转录病毒药物耐药。
本品适应症的确立是基于对两个临床对照研究24周时的血浆HIV-1 RNA水平进行的分析。
这些研究是在接受过三种抗反转录病毒抑制剂治疗(非核苷类反转录酶抑制剂、核苷类反转录酶抑制剂、蛋白酶抑制剂)并有疾病临床进展的成年患者中进行的。
本品与其他活性药物联合使用时产生治疗应答的可能性更大。
(见临床试验)在未经治疗的成年患者或儿童患者中尚无本品的安全性和有效性数据。
尚没有本品影响HIV-1感染的临床进展的研究结果。
规格:每片含拉替拉韦钾434.4mg,相当于拉替拉韦400mg(游离酚)用法用量:用于治疗HIV-1感染者时,口服本品400 mg,每日两次,餐前或餐后服用均可。
本品应与其他抗反转录病毒药物联合使用。
不良反应:同心堂心脑血管专科医院()此药物的容易出现的不良反应有:曾接受过治疗的患者出现的不良事件对于曾接受过治疗的患者,本品的安全性评价是基于来自随机临床试验中安全性数据的汇总分析,临床试验P005、P018和P019报告了507名患者服用本品推荐剂量400 mg,每日两次合并优化背景疗法(OBT)治疗,与对照组282名接受安慰剂合并OBT联合治疗的患者进行比较。
在双盲治疗期内,服用本品400mg,每日二次组的总随访期为702.8病人年,而服用安慰剂组为257.1病人年。
在临床试验P005、P018和P019的汇总显示:服用本品400 mg,每日两次+ OBT组患者(平均随访72.3周)和服用安慰剂+OBT对照组(平均随访47.6周)患者,不考虑不良事件严重程度或因果关系,最常出现的(任一组中>10%)的不良事件及其发生率分别为:腹泻20.3%和21.3%、恶心12.2%和15.6%、头痛10.8%和12.8%、疲劳10.5%和5.7%、上呼吸道感染10.3%和7.8%、发热7.7%和11.7%。
该汇总分析显示,本品+OBT治疗组因不良事件中止治疗的患者比例为2.6%,安慰剂+OBT组为3.2%。
与药物相关的不良事件下表所示的临床不良事件是研究者认为严重程度呈中至重度,且与联合治疗方案中的某种药物相关(单独与本品或安慰剂相关;与本品/安慰剂合用OBT相关;或者单独与使用OBT相关):表1列出了本品+OBT治疗组≥2%的成人患者出现的与药物相关的中至重度临床不良事件。
本品+OBT治疗组曾接受过治疗的的患者(n=507),按照系统器官分类,发生率不到2%的与药物相关的中至重度临床不良事件如下:[常见(>1/100,<1/10),罕见(>1/1,000,<1/100)]血液与淋巴系统疾病罕见:贫血、巨幼红细胞性贫血,中性粒细胞减少症心脏疾病罕见:心肌梗塞、心悸、室性早搏听觉和迷路障碍罕见:眩晕眼部疾病罕见:视觉障碍胃肠道疾病常见:腹痛罕见:腹胀、上腹痛、便秘、胃肠道疼痛、腹部不适、消化不良、胃肠胀气、胃炎、舌炎、胃食管返流病,口干燥全身性不适和给药部位异常常见:衰弱、疲乏罕见:发热、胸部不适、寒战、自觉发热、激惹,药物不耐受,面部浮肿,脂肪坏死肝胆疾病罕见:肝炎、肝脏肿大、高胆红素血症免疫系统疾病罕见:药物过敏、超敏反应感染和寄生虫感染罕见:蜂窝组织炎、单纯疱疹,生殖器疱疹伤害,中毒和程序并发症(Procedural Complication)罕见:药物毒性,压缩性骨折系统检查结果异常罕见:体重减轻、体重增加代谢和营养障碍罕见:糖尿病、中心性肥胖、脂代谢紊乱、高乳酸血症、高脂血症、高甘油三酯血症、食欲增加、食欲减退、脂肪增多症肌肉骨骼与结缔组织疾病罕见:肌肉痛、肢体痛、背痛、肌肉痉挛、骨骼肌疼痛、肌炎、肌萎缩(muscleatrophy)、肌萎缩(amyotrophy)、骨质疏松症神经系统疾病常见:头晕罕见:外周神经疾病、痛觉超敏、神经病变、感觉异常、多神经病、嗜睡、紧张性头痛、震颤、外周感觉神经病变精神疾病罕见:抑郁、失眠、梦异常、焦虑肾脏和泌尿系统疾病罕见:中毒性肾病、肾病综合征、肾炎、间质肾炎、肾石病、夜尿症、尿频、肾衰、急性肾衰、慢性肾衰、肾脏损害、肾小管坏死生殖系统和乳腺疾病罕见:勃起功能障碍、男子女性型乳房呼吸、胸腔和纵隔疾病罕见:鼻衄皮肤和皮下组织疾病罕见:皮疹、多汗症、痤疮性皮炎、红斑、脂肪萎缩、皮下脂肪萎缩、脂肪肥大、盗汗、斑疹、斑丘疹、瘙痒疹、皮肤干燥症、痒疹、面容消瘦严重事件临床试验P005、P018和P019报告了下列与药物相关的严重不良事件:超敏反应、贫血、中性粒细胞减少症、心肌梗塞、胃炎、肝炎、药物过敏、中毒性肾病和肾衰、生殖器疱疹、意外用药过量、急性肾衰、慢性肾衰和肾小管坏死。
选择的不良事件在曾接受过本品加OBT治疗和安慰剂加OBT治疗的患者中观察到癌症事件,其中数例为原有癌症复发。
癌症的具体类型和发生率符合重度免疫缺陷人群的特征(许多患者的CD4+计数低于50个/mm3,且大多数曾被诊断为AIDS)。
在这些研究中服用本品和服用对照药物而发生癌症的风险是类似的。
在使用本品治疗的患者(见表2)中观察到2-4级肌酸激酶实验室值异常。
已报告有肌病和横纹肌溶解的发生;然而尚不清楚这些事件与使用本品是否相关。
对于肌病或横纹肌溶解风险增加的患者,如同时服用了已知能导致这些疾病的其他药物的患者,需谨慎使用本品。
混合存在状况的病人混合感染乙肝和/或丙肝病毒的患者在Ⅲ期试验中,允许纳入伴有慢性(非急性)活动性乙肝和/或丙肝混合感染的患者(N=113/699或16.2%),只要其基线肝功能指标没有超过正常值上限的5倍。
尽管在两个组的乙肝和/或丙肝混合感染患者亚组中,AST和ALT的异常率稍高,但总的来说,本品的安全性在乙肝和/或丙肝混合感染患者与非乙肝和/或丙肝混合感染患者中基本一致。
上市后经验不考虑因果关系在上市后经验中已报告下列其他不良经验:皮肤和皮下组织疾病Stevens-Johnson综合征实验室检查结果实验室异常在临床试验P005、P018和P019的本品400 mg,每日两次治疗组中,出现与基线相比加重的2至4级实验室异常的曾接受过治疗的患者比例参见表2。
禁忌:本品禁用于对本品任何成份过敏的患者。
注意事项:同心堂乳腺专科医院()提醒广大患者应该注意的事项:免疫重建综合征在治疗初期,抗反转录病毒治疗疗效较好的患者可能对潜伏的或残余的机会性感染产生炎症反应(如非结核分枝杆菌、巨细胞病毒、卡氏肺孢子虫肺炎、结核,或带状疱疹水痘病毒的再激活),这可能需要开展进一步的评价和治疗。
药物相互作用本品与尿苷二磷酸葡糖苷酸转移酶(UGT)1A1的强诱导剂(例如:利福平)合用时,由于这些药物会降低拉替拉韦的血浆浓度,需注意。
(见药物相互作用)孕妇及哺乳期妇女用药:在家兔(剂量达1000 mg/kg/天)和大鼠(剂量达600 mg/kg/天)中开展了发育毒性试验。
这些试验采用的最大剂量在这些动物中所产生的全身暴露量大约是人临床推荐剂量暴露量的3到4倍。
在家兔中没...儿童用药:尚未确立本品用于16岁以下儿童的安全性和有效性。
老年用药:本品临床试验尚未纳入足够样本量的65岁及65岁以上的老年患者,因此目前还不能确定老年患者对本品的反应是否与青年患者不同。
其他已报告的临床使用经验尚未发现老年患者与青年患者之间的有效性差异。
通常对于老年...药物相互作用:拉替拉韦并非细胞色素P450 (CYP)酶的底物,在体外不会对CYPIA2、CYP286、CYP2C8、CYP2C9、CYP2C19、CYP2D6或CYP3A产生任何抑制作用(ICso>100μM)。
此外,体外拉替拉韦也不会诱导CYP3A4。
与咪达唑仑的药物间相互作用试验显示,拉替拉韦对CYP3A4的敏感底物咪达唑仑不会产生任何有意义的药代动力学影响,这证实了拉替拉韦不太可能会影响体内经CYP3A4代谢的药物的药代动力学特征。
同样,拉替拉韦并非所测试的UDP-葡萄糖醛酸转移酶(UGTs)UGT1A1、UGT287的抑制剂(IC50>50 μM),拉替拉韦也不会抑制由P-糖蛋白介导的转运过程。
基于上述数据,本品可能不会影响作为上述酶类或P-糖蛋白底物的药物(如蛋白酶抑制剂、NNRTIs、美沙酮、阿片类镇痛药、他汀类药物、唑类抗真菌药物、质子泵抑制剂和抗勃起功能障碍药物)的药代动力学特征。
基于体内、体外试验,拉替拉韦主要经UGTIA1介导的葡萄糖醛酸化途径代谢清除。
与UGTIA1强诱导剂,如利福平(许多药物代谢酶的诱导剂)联用时,本品的血药浓度会下降。
当本品和利福平或其他UGTIA1强诱导剂合用时需谨慎(见注意事项)。
尚不知药物代谢酶的其他强诱导剂,例如苯妥英和苯巴比妥对UGTIA1的影响。
而本品的推荐剂量可与其他诱导作用较弱的药物(如依非韦伦[efavirvenz]、奈韦拉平[nevirapine])、利福布汀、皮质类固醇激素、连翘、吡格列酮)联用。
与已知的UGTIA1强抑制剂(如阿扎那韦[atazanavir])联用时,本品的血药浓度会上升。
但上升幅度不大,且临床试验显示与上述抑制剂的联合治疗耐受性良好,故无需调整剂量。
基于在高pH值时本品会增加溶解度,与已知的增加胃pH值的药物(如奥美拉唑)合用时,本品的血浆浓度可能会增加。
在方案018和019研究中观察到,同时服用本品和质子泵抑制剂或H2阻滞剂的病人,相对于没有同时服用质子泵抑制剂或H2阻滞剂的病人的安全性情况是相似的。
基于这些数据,质子泵抑制剂和H2阻滞剂与本品合用不需要调整剂量。
拉替拉韦对其他药物药代动力学的影响在药物间相互作用试验中,拉替拉韦对下列药物的药代动力学没有产生任何有临床意义的影响:激素类避孕药、泰诺福韦(tenofovir)咪达唑仑和拉米夫定(lamivudine)。
在多剂量给药的药物相互作用试验中,当与本品合用和不与本品合用时比较,乙炔基雌二醇和NorelgestrominAUC分别是98%和114%。
在多次给药的药物间相互作用试验中,与拉替拉韦联用时泰诺福韦(tenofovir)的AUC和谷浓度分别是泰诺福韦(tenofovir)单药治疗时的90%和87%。
在其他药物间相互作用试验中,与拉替拉韦联用时咪达唑仑的AUC是咪达唑仑单药治疗时的92%。
在一项Ⅱ期试验中,无论与拉替拉韦或依非韦伦(efavirvenz)联用,拉米夫定(lamivudine)的药代动力学特征均相似。
其他药物对拉替拉韦药代动力学的影响在药物间相互作用试验中,阿扎那韦(atazanavir)、依非韦伦(efavirvenz)、利托那韦(ritonavir)、泰诺福韦(tenofovir)和替拉那韦(tipranavir)/利托那韦(ritonavir)对拉替拉韦的药代动力学没有产生任何有临床意义的影响。
