无菌粉针剂生产工艺特点
年产2000万支无菌分装的粉针剂生产车间工艺设计

一、引言无菌分装的粉针剂是一种常见的药物剂型,具有方便、安全等优点,广泛应用于医疗领域。
为了确保产品的质量和安全性,需要设计一个合理的生产车间工艺。
本文将详细介绍年产2000万支无菌分装的粉针剂生产车间工艺设计。
二、工艺流程设计1.原料筛选:选择高质量的原料,确保产品的质量。
应根据药物性质和制剂要求进行原料筛选。
2.制剂液体制备:根据药物的特性,选择适当的制剂液体制备方法。
常见的制剂液体制备方法有搅拌法、溶解法、混合法等。
3.粉剂制备:根据药物的特性和制剂要求,选择适当的粉剂制备方法。
常见的粉剂制备方法有搅拌法、研磨法、混合法等。
4.灭菌处理:无菌分装的粉针剂需要进行灭菌处理,以确保产品的无菌性。
常用的灭菌方法有高温高压灭菌法、过滤灭菌法等。
5.包装:对已经灭菌的产品进行包装,以保护产品不受外界环境的污染。
常用的包装方式有瓶装、袋装、管装等。
6.检验:对生产的产品进行质量检验,包括外观检查、物理性质测试、化学成分分析、微生物检验等。
7.产品储存:存放已经通过检验的产品,确保产品的质量和安全性。
三、工艺参数设计1.生产能力:根据年产量为2000万支无菌分装的粉针剂,确定每天的生产量和生产时间安排。
合理安排生产能力,确保按时完成生产任务。
2.温度控制:根据药物的要求,确定生产车间的温度范围。
应确保温度稳定,不受外界环境影响。
3.湿度控制:根据无菌要求,确定生产车间的湿度范围。
应确保湿度适宜,不影响产品的质量和无菌性。
4.空气洁净度:根据无菌要求,确定生产车间的空气洁净度等级。
应确保空气中的微生物和颗粒物的浓度符合要求。
5.灭菌参数:根据灭菌方法的要求,确定灭菌的温度、压力和时间。
应确保灭菌处理能够完全灭菌,确保产品的无菌性。
四、设备选择和布局设计1.根据工艺流程和工艺参数,选择合适的设备,包括制剂液体制备设备、粉剂制备设备、灭菌设备、包装设备等。
2.设计合理的设备布局,确保设备之间的流程顺畅,减少操作员的移动和产品的污染。
执业西药师《药剂学》经典知识:注射用无菌粉末

执业西药师《药剂学》经典知识:注射用无菌粉末注射用无菌粉末是注射剂的一种,指药物制成的供临用前用适宜的无菌溶液配制成澄清溶液或均匀混悬液的无菌粉末或无菌块状物。
以下是店铺带来的详细内容,欢迎参考查看。
一、概念专供注射用的无菌粉末,简称粉针。
使用前用无菌注射用水溶解。
二、适用范围在水中不稳定的药物、不能在溶液中加热灭菌的药物,均须制成粉针。
如抗生素类药物、酶制剂、血浆等生物制剂。
必须在无菌条件下进行。
三、分类1.注射用无菌分装产品制备本类粉针的关键是原料药物的精制,通过精制得到无菌粉末,在无菌条件下分装即得。
在水中特别不稳定的药物适合制成此类粉针。
2.注射用冷冻干燥产品简称冻干制品。
将药物的除菌水溶液经无菌分装,并在无菌条件下冷冻干燥、封口而制得的产品。
具有产品质地疏松、溶解迅速、含水量低、剂量准确等优点。
特别适合对温度敏感的药物。
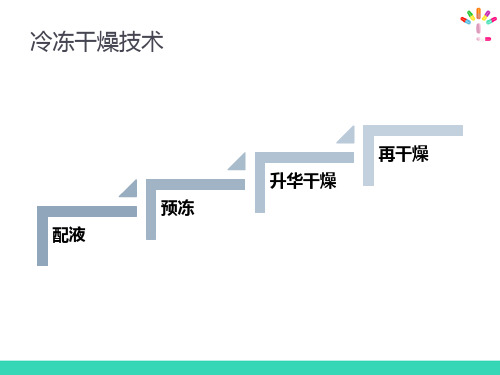
冷冻干燥的工艺过程:测定产品的低共熔点一预冻一升华干燥一再干燥渗透压的调节与体液渗透压相等的溶液为等渗溶液,如0.9%NaCl溶液。
人体可耐受的渗透压,肌肉注射为0.45%~2.7%的NaCl溶液的渗透压,相当于0.5~3个等渗浓度的溶液。
常用的调整方法如下:1.冰点降低法计算将药液调整为等渗溶液需加入等渗调节剂的量,可用下式计算:0.52=a + b WW:配成等渗溶液中需加等渗调节剂的量(%,g/ml)。
a:未经调整的药物溶液(1%)冰点下降摄氏度数(℃)。
b:1%等渗调节剂溶液的.冰点下降摄氏度数(℃),若用氯化钠为等渗调节剂,则b=0.58。
2.氯化钠等渗当量法与1g药物呈等渗效应的氯化钠的量称氯化钠等渗当量,用E表示,可按下式计算:0.9%V=E W + XX:药物溶液中需加等渗调节剂的量,g; V:欲配制药物溶液的体积,ml; E:1g药物的氯化钠等渗当量(可由表查得或测定); W:溶液中药物的量,g。
等渗溶液与等张溶液1.等渗溶液与血浆渗透压相等的溶液。
无菌液体制剂—粉针剂(药物制剂技术)
注射用冷冻干燥制品
是指将药物制成无菌水溶液,无菌分装后,再通 过冷冻干燥法制成无菌粉末的工艺技术。
适用于:在水中稳定,但加热即失效的药物 例如:酶制剂、血浆、蛋白质等生物制品;难以
干燥的药物。
(二)冷冻干燥技术
优点: 1. 不耐热的药物可避免因高热而分解变质; 2. 所得产品质地疏松,加水后迅速溶解; 3. 含水量低,在1%-3%之间; 4. 产生污染的机会相对少; 5. 剂量准确,外观优良。 缺点: 溶剂的选择受限,需要特殊设备,成本较高。
注射用无菌分装制品 注射用冷冻干燥制品 冻干粉针
脑蛋白水解物
重组人促甲状腺素α粉针
双黄连粉针剂
注射用头孢呋辛钠
二、注射用无菌分装制品
将原料用溶剂结晶法或喷雾干燥法精制成无菌粉 末,再无菌分装于容器中制得成品的工艺技术。
药物 无菌 粉末
分装
加塞
压盖
质检
包装
(一)原辅料的质量要求:质量要求高 产品的无菌水平依赖于原辅料的无菌水平。 ① 粉末无异物; ② 细度和结晶适宜; ③ 无菌、无热原。
冷冻干燥设备
(一)冷冻干燥的原理
压力
610.5 Pa 固
液 气
0.01℃
三相平衡点 温度
(二)冻干粉针的制备
1. 药液配制、过滤及灌装 溶解:含有部分有机溶剂的水性溶液 过滤:0.22μm级微孔滤膜 灌注:液面深度为1-2cm 冷冻
(二)冻干粉针的制备
2. 冷冻干燥
首先应检测产品的最低共熔点。 最低共熔点:在水溶液冷却过程中,冰和溶质同时析出
(二)冷冻干燥技术 – (3)再干燥
预冻 压力
升华 再干燥
液 固
气 缓慢恢复室温
常压 负压
论无菌粉针剂生产的工程控制措施

论无菌粉针剂生产的工程控制措施作者:姜雯高莹莹来源:《科学与财富》2016年第01期摘要:无菌粉针剂生产过程很严格,在生产中,必须按照严格的程序的执行。
而且为了保证产品的无菌特性,不能只依赖产品的检验。
在确保生产出来的无菌产品都能符合标准的时候,就要在对生产设施进行有效的控制,本篇文章以无菌粉针剂的生产为视角,探讨了在生产中的工程措施,从而可以保证生产出来的产品是符合合格的标准。
关键词:无菌粉针剂;生产;工程措施无菌药品就是没有任何细菌的药品,而现在生产的过程中就要保证与细菌隔离,满足产品能够用在预定的用途上。
在保证无菌药品生产的时候,就要使生产中的污染源远离药品的生产设施,污染源有微生物污染或者是其他种类的微粒污染。
在工程操作中,最关键的操作就是无菌性指标操作,这与药品的质量有关。
除此之外,还有其他的工艺,例如无菌原料的转移或者是在无菌原料上添加其他的原料、灭菌后产品的运输后者是无菌产品的分装等。
下面仔细的分析以上几个环节。
一、无菌粉针剂生产工艺特点1、需要无菌分装的注射剂为不耐热性,不能采用成品无菌粉针剂生产工艺特点灭菌工艺的产品,其工艺进城需无菌操作,并防止异物的混入。
2、无菌分装的注射剂吸湿性强,再生产过程中应特别注意,无菌室的相对湿度,胶塞和瓶子的水份,工具的干燥和成品包装的严密性。
3、为保护产品的无菌性质,需严格检测洁净室的空气洁净度。
4、为防止污染,青霉素类的无菌分装注射剂生产中,其退出,车间的物料如工作服,废瓶,胶塞,空的容器等进行碱溶液处理。
二、无菌原料的转移和加料我国在包装无菌原料的时候,一般都是用两种方式,一种是用包装袋,这个包装袋有2层或者是3层LDPE袋组成。
而第二的包装方式是用瓶后者是桶装。
而且无菌包原料都是从最普通的地区运送到到有级别的A区灌装线,而且无菌原料要与分装机加料口快速的连接,并且连接的过程也要保证无菌,怎样能够做到无菌又快速的连接是一个有待解决的问题,现在有几种解决的方法。
无菌分装粉针工艺课件

设备监控
密切关注分装设备的运行 状态,及时发现并处理设 备故障,确保生产顺利进 行。
后处理阶段
产品检验
对分装完成的产品进行全面检验 ,包括外观、装量、微生物限度 等方面的检测,确保产品质量合
格。
包装与储存
采用符合要求的包装材料进行包 装,确保产品在储存和运输过程 中的稳定性。按照规定的储存条 件进行存放,避免产品受潮、霉
设备检查
检查分装设备是否完好, 确保设备在无菌状态下进 行操作。
原料准备
核对原料的品质和数量, 确保原料符合生产要求, 并将原料进行必要的预处 理。
分装操作阶段
无菌操作
操作人员必须穿戴符合要 求的无菌服,且操作过程 中需严格遵守无菌操作规 程,避免微生物污染。
精确分装
按照规定的分装量进行精 确分装,确保每份产品的 装量准确无误。
02
在故障处理完成后,对设备进行 全面检查,确保正常运行。
CHAPTER 05
案例分析与实践操作
成功案例分析
案例一
某大型制药企业采用先进的无菌分装粉针工艺,成功提高生产效率和产品质量。该企业引进了一套高度自动化的 无菌分装设备,通过优化生产流程和严格的质量控制,实现了生产效率的显著提升和产品质量的持续改进。
变等问题。
清场与设备维护
操作结束后,对操作室进行清场 ,确保场地整洁无污染。对分装 设备进行必要的维护和保养,延
长设备使用寿命。
CHAPTER 04
常见问题与解决方案
无菌环境破坏及预防
环境破坏原因:无菌环境破坏可能由人 员操作不规范、设备缺陷、原材料带菌 等原因引起。
加强生产现场的监控,及时发现并处理 问题。
针剂应选择适当的溶剂和pH值,以 保证药物在生理条件下的稳定性和活 性。
无菌粉针剂生产工艺特点

无菌粉针剂生产工艺特点:1.需要无菌分装的注射剂为不耐热性,不能采用成品灭菌工艺的产品,其工艺进城需无菌操作,并防止异物的混入。
2.无菌分装的注射剂吸湿性强,再生产过程中应特别注意,无菌室的相对湿度,胶塞和瓶子的水份,工具的干燥和成品包装的严密性。
3.为保护产品的无菌性质,需严格检测洁净室的空气洁净度。
4.为防止污染,青霉素类的无菌分装注射剂生产中,其退出,车间的物料如工作服,废瓶,胶塞,空的容器等进行碱溶液处理。
注射剂装量差异检查法:1.取供试品5瓶(支)除去标签,铝盖,容器的外壁用乙醇擦掉,干燥。
开启时注意避免玻璃等异物落入容器中。
2.分别迅速精密称定每一容器的重量,求出每瓶(支)的装量与平均装量3.每瓶(支)装量与平均装量相比较,应符合规定。
4.如有1瓶(支)不符合规定,应另取10瓶(支)复试,应符合规定。
可见异物检查法:1.定义:可见异物是指存在于注射剂、滴眼剂中,在规定条件下目视可以观察到的不溶性物质,其粒径通常大于50um。
2.《中国药典》规定:可见异物检查法有两种:灯检法和光散射法,一般常用灯检法或采用光散射法,但灯检法不适用(如用有色透明容器包装或液体色泽较深的品种)应选用光散射法。
制药用水的分类和各自主要用途:制药用水的分类和各自主要用途:分类:制药用水因其适应的范围不同分为:饮用水,纯化水,注射用水,灭菌注射用水。
用途:饮用水:可作为药材浸制时的漂洗,制药工具的粗洗用水,除另有规定外,也可以作为药材的提取溶剂。
纯化水:为饮用水经蒸馏法、离子交换法、反渗透法或其他适宜的方法制备,制药用水可作为配制普通药物制剂用的溶剂或实验用水。
中药注射剂、滴眼剂等灭菌制剂所用药材的提取溶剂,以及口服、外用制剂配制用溶剂或稀释剂,非灭菌制备用器具的清洁用水。
注射用水:为纯化水经蒸馏所得到的水,可作为配制注射剂的溶剂或稀释剂及注射用容器的精洗,滴眼剂配制的溶剂。
灭菌注射用水:按照注射剂生产工艺制备所得,可用于注射用无菌粉末的注射剂的稀释剂。
注射用无菌粉末名词解释

注射用无菌粉末名词解释
注射用无菌粉末是一种用于注射的单剂粉末,用于静脉或其他路径输注药物,主要用于较大版本非水溶性药物。
注射用无菌粉末主要组成是药物粉末和辅料,它可以保证药物的有效性,质量和安全性,而且容易使用。
注射用无菌粉末的科学制备可以分为两个主要步骤:粉末混合和压片。
首先,在无菌条件下将药物和辅料混合,以保证药物均匀地均匀地分散在粉末中,以保证其正确的组成。
然后,将此混合物压制成粉末片,使之能被注射。
三种压片技术可以使用:气流压片,螺旋压片和滚摩压片。
注射用无菌粉末具有许多优点,例如可提高药物稀释剂的稳定性,可以提供更高浓度的药物分散,以及它的简单使用。
这些优点使其成为处方药中非水溶性药物的首选。
此外,它也可以提高药物溶解度,改善溶解性和在长期保存过程中不易变质。
除了上述优点外,注射用无菌粉末还具有一些缺点,例如压片技术所消耗的时间久、成本高以及辅料的添加使存在一定的风险。
因此,在制备过程中需要严格控制药物和辅料的比例,并且严格控制无菌条件,以确保药物的安全性和有效性。
注射用无菌粉末的质量控制也是至关重要的,质量控制可以确保药物的有效性和安全性。
首先,要确定其化学和微生物质量标准,即必须合格的实验数据,值才能被认定为有效。
此外,还需要进行其他质量控制检测,比如外观检查、气味检查、强度检查、重量检查以及
表观检查等。
总之,注射用无菌粉末是一种用于非水溶性药物的处方药,其科学制备可以分为两个主要步骤,可以提高药物稀释剂的稳定性,有助于改善溶解性和抗变质性。
质量控制也是至关重要的,需要严格控制药物和辅料的比例,并且严格控制无菌条件,以确保药物的安全性和有效性。
ZLF0104无菌粉针剂分装机

二次蒸汽 蒸汽
配液系统、化工容器等设备的厂商,该公司拥有BR1(一、二类)压力容器设 计、制造和安装许可证。
该公司近期研制的WLG系列卧式离心薄膜真空蒸发器可广泛用于天
然色素、酵类、抗生素等物料的浓缩,其属高效、低温、高倍浓缩与无污染的
蒸发设备。
冷凝液
特点:(1)蒸发温度低(一般小于60 ℃),特殊设计蒸发温度可低于30 ℃,
产品推介◆Chanpin Tuijie
ZLF0104 无菌粉针剂分装机
南京博健科技有限公司是专门从事西林瓶等包材的冻干粉针剂等无菌药品生产专业 设备的制造商。该公司生产的ZLF0104无菌粉针剂直线式分装机可用于分装各类不同特性 的药粉。
工 艺 特 点 :(1)采 用 直 线 式 布 局 设 计 , 能 保 证 在 封 闭 动 态 A 级 层 流 下 用 隔 离 手 套 进 行 生产等全过程操作;(2)透明保护罩内配以垂直A级层流自循环净化系统,能保证罩内洁 净复合工艺要求;(3)高位密闭式无污染补料的结构设计,确保在洁净保护下的外加原料 和外加胶塞。
无刮板,因而避免因刮板磨损而造成的污染;(8)通过观察窗可随时观察内部运行情况,操作直观;(9)运转稳定,振
动小;(10)清洗与消毒方便。
常 熟 市 春 来 机 械 有 限 公 司(原 常 熟 市 制 药 化 工 机 械 有 限 公 司)
地址:江苏省常熟市南三环路斜桥 邮编:215556 联系人:王坤金(13913622222) 电话:0512-52451184/52451186 传真:0512-52451999 网址:
地址:江苏省南京市雨花经济开发区龙腾南路 邮编:210039 联系人:卢存富(13913852900) 电话:025-52412284 传真:025-52419949 网址:
注射用无菌粉末

图3-7 甘氨酸水溶液DSC
❖其低共熔温度为-3.5℃,故其 升华干燥理论上允许的最高温 度是共熔温度。
❖但实际产品温度应控制比这个 温度低几度,以保证在冻干过 程中不致于产生熔化现象。
2 冷冻干燥工艺过程
❖(1) 预冻:预冻温度应低于产品共熔点10~ 20℃。
❖ 预冻方法有速冻法和慢冻法, ❖速冻法就是在产品进箱之前,先把冻干箱温度
❖再干燥温度,根据制品性质确定, 如0℃、25℃等。制品在保温干 燥一段时间后,整个冻干过程即 告结束
(三) 冷冻干燥过程中常出现的异常现象及处 理方法
❖ 1.含水量偏高 ❖ 装入容器液层过厚,超过10~15mm; ❖干燥过程中热量供给不足,使蒸发量减少;真
空度不够,冷凝器温度偏高等,均可造成含水 量偏高,
❖1. 物料热稳定性的测定
❖测定物料稳定性的目的,是确 定产品最后能否进行灭菌处理。
❖2. 临界相对湿度的测定
❖测定方法在散剂一章中已讨论,
❖生产上分装室的相对湿度必须控 制在分装产品的临界相对湿度以 下,以免吸潮变质。
❖3. 粉末晶形检查
❖粉末晶形与制备工艺有密切关系, 如喷雾干燥法制得的多为球形,机 械分装易于控制。
❖ 一次升华法:此种升华法适用于共熔点10℃ ~ -20℃ 的 制 品 , 装 量 厚 度 在 10 ~ 15mm的情况。
❖具体方法如下:先将处理好的制品溶液在干燥 箱内预冻至低共熔点以下10~20℃,同时将 冷凝器温度下降至-45℃以下,启动真空泵, 通过搁置板下的加热系统缓缓加温,温度逐渐 升高至约-20℃,药液中的水分就可升华,最 后可基本除尽,然后转入再干燥阶段。
❖ 注射用无菌粉末的生产必须在 无菌室内进行,特别是一些关键 工序,更应严格要求,可采用层 流洁净装置,保证无菌无尘。
4-3-1 无菌分装粉针工艺

4.3.1 工艺流程及区域划分
粉针剂属于无菌分装注射剂,所需无菌分装的药品 多数不耐热,不能采用灌装后灭菌,故生产过程必须是 无菌操作。 粉针剂的生产工序包括:洗瓶及干燥灭菌、胶塞处 理及灭菌、铝盖洗涤及灭菌、分装轧盖、包装。
无菌分装注射剂工艺流程示意图及环境区域划分见 下图。
点击进入下一节
冻干原料 擦洗消毒
分装原料 擦洗消毒
玻 璃 瓶
洗 瓶
胶
塞
酸碱处理 饮用水洗
配
料 干燥灭菌 检 查 冷 却
纯水洗 注射用水 硅 化
局部100级
无菌过滤
干燥灭菌 灌 冻 装 干 加 轧 装 箱 入 库 塞
工艺过程简述
(1)瓶塞的处理 玻璃瓶经过清洗或超声波清洗、纯水冲洗,最后一次用孔 径0.22μ m微孔滤膜滤过的注射用水冲洗。在4h内灭菌和干燥, 使玻璃瓶达到洁净、无菌、干燥、无热原。 常见的干热灭菌条件是电烘箱于180℃加热1.5h;隧道式 干热灭菌器于320℃加热5min以上。 胶塞用稀盐酸煮洗、饮用水及纯化水冲洗,最后用注射用 水漂洗。洗净的胶塞进行硅化,硅油应经180℃加热1.5h去除 热原,处理后的胶塞在8h内灭菌。胶塞可采用纯蒸汽灭菌,在 121℃灭菌40min,并在120℃烘干。 灭菌后的瓶子和胶塞应在100级层流下存放或存放在专用 容器中。
(2)粉剂的充填及盖胶塞 采用容积定量或螺杆计量,通过装粉机构定量地 将粉剂分装在玻璃瓶内,并在同一洁净等级环境下 将经过清洗、灭菌、干燥的洁净胶塞盖在瓶口上。 此过程是在专用的分装机上完成。 (3)轧封铝盖 在玻璃瓶装粉盖胶塞后,将铝盖严密地包封在 瓶口上,保证瓶内的密封,防止药品受潮、变质。
(4)半成品检查 其方式是目测,主要检查玻璃瓶有无破损、 裂纹,胶塞是否盖好,铝盖是否包封完好,瓶 内药粉剂量是否准确,瓶内有无异物等。 (5)封蜡 正常粉针剂生产没有这个工序,天然橡胶 塞密封性较差,加上受其他包装材料如玻璃瓶 质量的影响,在轧封铝盖目检后增加一道在铝 盖包边处进行封蜡这一工序。
注射用无菌分装制品及冷冻干燥制品的相关讲解

注射用无菌粉末俗称粉针,是指药物制成的供临用前用适宜的无菌溶剂配制成澄清溶液或均匀混悬液的无菌粉末或无菌块状物。
可用适宜的注射用溶剂配制后注射,也可以用静脉输液配制后静脉滴注。
凡是在水溶液中不稳定的药物,如某些抗生素(青霉素类、头抱菌素类)、一些酶制剂(胰蛋白、辅酶A)及血浆等生物制剂,不能制成水溶性注射剂,更不能在溶液中加热灭菌,均须制成注射用无菌粉末。
近年也将中药注射剂研制成粉针以提高其稳定性,如双黄连粉针、茵桅黄粉针等。
根据生产工艺的不同,注射用无菌粉末可分为两大类:注射用无菌分装制品和注射用冷冻干燥制品。
注射用无菌分装制品注射用无菌分装制品系将采用灭菌溶剂结晶法、喷雾干燥法制得的无菌原料药在无菌条件下直接分装于洁净灭菌的小瓶或安甑中,密封而成。
常用于抗生素药品,如注射用青霉素钠、注射用头抱吠辛钠等。
(一)制备流程注射用无菌分装制品制备流程,如下图。
再确定。
干燥灭菌「|「麻I- - I~■■~I节呼菌| ∣x¾∣υ贴签1I I冷⅜P I 1口I ,r I_I1 r√T_I(二)基本工艺1、原材料及容器准备无菌原料可在无菌条件下采用结晶法或喷雾干燥法制备,必要时在无菌条件下进行粉碎、过筛等操作,制得符合分装要求的注射用无菌粉末。
安甑或玻璃瓶与胶塞的处理按注射剂的要求均需进行灭菌处理。
安甑或玻璃瓶可于180。
C干热灭菌1.5小时或于250。
C干热灭菌45分钟,胶塞洗净后要用硅油进行处理,再用125。
C干热灭菌2.5小时或于121。
C湿热,灭菌30分钟灭菌好的空瓶应在净化空气下存放,时间不应超过24小时,具体存放时间应经过验证后2、无菌粉末的分装分装必须在A级洁净环境中按无菌操作法进行,分装时多以容积进行定量,可用人工法或机械分装法。
手工分装常采用刮板式分装器,机械分装设备有螺旋式自动分装机、直管式自动分装机和真空吸粉自动分装机等。
分装机宜有局部层流装置。
分装后的小瓶应立即加塞并用铝盖密封。
注射剂无菌保证工艺介绍

注射剂无菌保证工艺介绍注射剂无菌保证工艺是指为实现规定的无菌保证水平所采取的经过充分验证后的灭菌(无菌)生产工艺。
在工业上,无菌保证工艺可分为两类:最终灭菌工艺(terminal sterilization process)和无菌生产工艺(aseptic processing)。
最终灭菌工艺:在控制微生物污染量的基础上将完成最终密封的产品进行适当灭菌的工艺。
一般来说,本方法成本低,无菌保证水平(SAL,Sterility Assurance Level)≤10-6。
无菌生产工艺:在无菌系统环境下通过无菌操作生产无菌产品的方法,以防止污染为目的,消除可能导致污染的各种可能性来保证无菌水平。
目前WHO和欧盟执行的标准是95%可信限度下微生物残存概率不超过0.1%,大概相当于3000瓶产品中不得有1瓶染菌的水平。
本方法对环境系统的要求高,产品存在微生物污染的概率远远高于终端灭菌无菌药品。
1基本原则1.1注射剂剂型选择的原则在遵循剂型选择一般原则的基础上,从无菌保证水平的角度考虑,注射剂剂型选择的一般原则如下:A.首先要考虑被选剂型可采用的灭菌工艺的无菌保证水平的高低。
原则上首选剂型应能采用最终灭菌工艺(F0≥8),以保证SAL≤10-6。
B.对有充分的依据证明不适宜采用终端灭菌工艺(F0≥8)且临床必须注射给药的品种,可考虑选择采用无菌生产工艺的剂型。
通常无菌生产工艺仅限于粉针剂或部分小容量注射剂。
C.注射剂中大容量注射剂、小容量注射剂和粉针剂之间的互改,如无充分的依据,所改剂型的无菌保证水平不得低于原剂型。
1.2无菌工艺的选择原则无菌保证工艺选择原则是:应优先选择无菌保证水平高的最终灭菌工艺,只有在充分的工艺研究证明产品无法耐受各种最终灭菌工艺的前提下,才选择非最终灭菌工艺。
欧洲药品评价局(EMEA)在其规范性文件“选择灭菌方法决策树”(Decision Trees For The Selection of Sterilization Methods (CPMP/QWP/054/98))中将水溶性药品无菌保证工艺分为:①灭菌条件为121℃,15min的湿热灭菌工艺,②灭菌F0值≥8min,SAL≤10-6的湿热灭菌工艺,③采用微生物截留过滤器的除菌过滤工艺,④需要采用无菌原料和预先灭菌的包装材料进行无菌配臵和灌装的工艺;将非水溶性产品,包括非水溶性液体、半固体和干粉的无菌保证工艺分为:①灭菌条件为160℃,120min的干热灭菌工艺,②其他时间和温度组合,SAL≤10-6的干热灭菌工艺,③非干热灭菌方法,如离子辐射吸收剂量≥25KGy的灭菌工艺,④经验证的更低剂量的辐射灭菌工艺,⑤采用微生物截留过滤器的除菌过滤工艺,⑥需要采用无菌原料和预先灭菌的包装材料进行无菌配臵和灌装的工艺。
药剂学课件-注射用无菌粉末

将药物溶液在低温下冻结,然后在真空条件下进行干燥,得到疏松、多孔的结构,易于溶解和吸收。
灭菌与无菌保证
辐射灭菌
利用放射性元素产生的射线进行灭菌,具有操作简便、灭菌效果好、对物品无损害等优 点。
环氧乙烷气体灭菌
将无菌粉末置于密封容器中,通入环氧乙烷气体进行灭菌,具有穿透能力强、灭菌效果 可靠等优点。
VS
新型载体材料的应用
新型载体材料如聚合物纳米颗粒、脂质体 等在无菌粉末制备中得到广泛应用,有助 于提高药物的溶解度、稳定性及靶向性。
临床需求与市场前景
适应症的拓展
随着医学的进步,注射用无菌粉末的应用范 围不断扩大,涉及抗肿瘤、抗病毒、抗炎等 多个治疗领域,市场需求持续增长。
国际化市场拓展
国内制药企业正积极开拓国际市场,注射用 无菌粉末的出口量逐年增加,国际竞争力不 断提升。
注射用无菌粉末应针对明 确的适应症进行治疗,并 通过临床试验验证其疗效 。
治疗效果
注射用无菌粉末应具有显 著的治疗效果,并能改善 患者的生活质量。
药物经济学
注射用无菌粉末应具备合 理的药物经济学价值,降 低医疗成本。
不良反应与处理措施
不良反应监测
医疗机构和患者应密切关注注射 用无菌粉末可能引起的不良反应 ,如过敏反应、呼吸系统反应等
储存要求高
注射用无菌粉末需要严格 的无菌环境下储存,对储 存条件要求较高。
适用范围与临床应用
适用范围
注射用无菌粉末适用于需要注射给药的药品,尤其适用于需要长期给药或需要精 确控制剂量的药物。
临床应用
注射用无菌粉末在临床中广泛应用于抗肿瘤药物、抗生素、麻醉药等需要注射给 药的药品。
与其他剂型的比较
剂量准确
年生产2000万支无菌分装的粉针剂生产车间工艺设计方案

年产2000万支无菌分装的粉针剂生产车间工艺设计方案1、概述1.1粉针剂简介粉针剂是将药物与试剂混合后,经消毒干燥形成的粉状物品。
便于运输保存。
粉针剂应用时以葡萄糖溶液稀释注射,注射剂根据用量不同可稀释可直接注射。
粉针,作为一种剂型,应该称为“注射用XXX”,根据制备原理分为无菌粉和冻干粉。
如:青霉素、头抱等,这一类粉针常为无菌分装;而其他类的抗生素,如喹诺酮类的注射用加替沙星,则是冻干粉。
这两者在外形上也有区别,无菌分装的为粉末状,而冻干粉常为块状。
两者均要求无菌车间制备。
凡对热敏感或在水溶液中不稳定的药物,如某些抗菌素(青霉素G钾、霉素、多粘菌素),医药用的酶制剂(胰蛋白酶、辅酶A等),它们既不能制成一般的水溶性注射液,更不能在水溶液中加热灭菌,只能采用无菌操作法制成粉针剂,在临用前以适宜的注射用溶媒溶解后供临床应用。
这类药物一般可采用无菌操作法,将供注射用的灭菌粉状药物装入安瓿或其他适宜容器中,临用时用适当的溶媒溶解或混悬。
如青霉素、链霉素、苯巴比妥钠等均可制成“粉针”。
近年来国内外已研制成功一批中药粉针剂,如从天花粉中提取精制的结晶毒蛋白、人参提取物、葛根汤提取精制物等制备成注射用粉针剂。
还有一些药物,如酶制剂(胰蛋白酶、a一糜蛋白酶、波罗蛋白酶、辅酶A 等),为了保持稳定亦常在无菌操作下冷冻干燥后制成注射用粉针剂;有的生物制品亦采用冻干法制成粉针剂,如胎盘白蛋白注射用粉针剂等。
1.2粉针剂的生产方法粉针剂的生产有两种方法:一种是无菌分装的粉针剂工艺生产;另一种是利用冷冻干燥法进行粉针剂药品的生产。
青霉素、头抱等,这一类粉针常为无菌分装;而其他类的抗生素,如喹诺酮类的注射用加替沙星,则是冷冻干燥。
这两者在外形上也有区别,无菌分装的为粉末状,而冷冻干燥粉常为块状。
冻干粉针是药物的一种制剂形式,是将药用成分(原料)及辅助成分(辅料),用溶媒(例如水)溶解后,配制成一定浓度的溶液,分装于安瓿或西林瓶等容器中,在无菌密闭环境中,低温下冻结,再通过降低环境气压,缓慢升高制品温度的方法使制品中的溶媒(例如水)升华,留下固体形态的疏松块状或粉末状药物而成的制剂。
无菌粉针剂生产工艺特点

无菌粉针剂生产工艺特点首先,无菌粉针剂的生产需要严格的无菌操作。
无菌操作是确保产品无菌性的重要环节。
生产过程中需要使用无菌室进行操作,操作人员需要穿戴无菌衣、戴无菌手套,并采取正确的无菌操作技术,以确保在整个生产过程中没有外界微生物污染的产生。
此外,无菌粉针剂的原料和包装材料也必须经过无菌处理,从而保证最终产品的无菌性。
其次,无菌粉针剂的生产需要进行适当的灭菌处理。
在制备无菌粉末时,原料通常需要经过高温灭菌处理,以杀灭可能存在的微生物。
此外,制剂中所加入的辅料也需要经过适当的灭菌处理,以保证最终产品的无菌性。
灭菌处理通常使用高温高压灭菌法或者选择性灭菌法,目的是杀灭可能存在的细菌、真菌和病毒等微生物,从而确保产品的无菌性。
再次,无菌粉针剂的生产还需要进行适当的清洁处理。
清洁处理是为了消除可能存在的杂质和有机物等污染物,以保证产品质量。
在生产过程中,通常需要对使用的仪器设备和容器进行清洗和消毒处理。
清洗通常使用水和洗涤剂进行,消毒则可以使用酒精、紫外线辐射等方法进行。
清洁处理能够有效地去除污染物,从而确保产品的纯净度和无菌性。
最后,无菌粉针剂的生产需要进行适当的质量控制。
在生产过程中,需要对原料、辅料、中间产品和最终产品进行严格的质量控制。
原料和辅料的质量需要通过合格供应商的选择和供货商的评估来保证;中间产品的质量需要通过严格的生产操作和工艺流程控制来保证;最终产品的质量需要通过各项质量指标的检测和验证来保证。
通过质量控制,可以确保产品的品质稳定性和无菌性。
总之,无菌粉针剂的生产工艺具有无菌操作、灭菌处理、清洁处理和质量控制等特点。
通过严格的无菌操作、适当的灭菌处理、适当的清洁处理和严格的质量控制,可以保证产品的无菌性和质量稳定性,从而满足临床使用的要求。
为了确保无菌粉针剂的安全性和有效性,生产企业需要严格遵守相关法律法规和规范要求,并进行相应的质量控制和管理。
注射用无菌粉药剂

• 3.灭菌及异物检查 • 对于耐热的品种,如青霉素,一般可按前述条件
•
进行补充灭菌;对于不耐热品种,必须严格无菌 操作。 异物检查一般在传送带上目检。
T.G.C.M.灭菌
X光异物检查装置
(二)无菌分装工艺中存在的问题及解决办法
原辅料 配滤 滤滴眼液
印字包装
主药不耐热的品种全部无菌操作法制备,眼部 手术或眼外伤的制剂应制成单剂量包装,保证 完全无菌。洗眼液用输液瓶包装
制备工艺
容器及包装材料的要求和处理:中性瓶储
存药液稳定。玻璃瓶质量要求与输液瓶相同, 遇光不稳定,可选用茶色瓶,塑料瓶应选用 无毒的。
以上工艺流程中 药物,附加剂 用适量的溶媒溶解,无菌灌装 进 行质量检查
眼膏剂
眼膏剂
概 念
眼膏剂是指药物与适宜的基质制 成的供眼用的膏状灭菌制剂
眼膏基质:必须纯净,常用的有油脂性,乳剂型及凝胶型。
特点
眼膏剂在结膜蘘内保留时间较 长,属于长效制剂。常用于眼 科术后用药,适用于不宜使用 滴眼液的小儿。缺点是有油腻 感并使视物模糊
滴眼剂
滴眼剂的质量要求
• 无菌:用于眼外伤或术后的眼用制剂要求
绝对无菌,并不得加入抑菌剂。一般滴眼 剂要求无致病菌,要加抑菌剂 • 可见异物:玻璃等可见异物可能对眼睛造 成刺激或伤害,可见异物的检查法应符合 规定。 • 金属性异物:金属性异物可能对眼睛造成 刺激或严重损伤,眼用半固体制剂不得有 金属性异物
影响吸收的主要因 素 ●角膜的渗透性:油水分配系数
●角膜前影响因素:鼻泪导管排出,溢出
●渗透促进剂的影响
●给药方法:滴入,注射给药
粉针剂的无菌生产工艺

柜式电热烘箱 1. 电机;2. 风机;3. 保温层;4. 风量调 节板;5. 托架;6. 进风口;7. 挡风板; 8. 电烙丝;9. 进风口;10. 进风调节板; 11. 温度计
隧道式灭菌干燥机
•隧道式灭菌干燥机的特点:
从玻璃瓶输入→预热→加热→灭 菌干燥→冷却→至小瓶输出。
是连续进行的,自动化程度高。
•
柜式电热烘箱
• 柜式电热烘箱一般应用在小量粉 •
•
针剂生产的玻璃瓶灭菌干燥,也 可用于铝盖或胶塞的灭菌干燥。 典型结构 : 主要由不锈钢板制 成的保温箱体、电加热丝、托架、 风机、可调挡风板等组成。 工作流程 : 洗瓶→进入方盘→再到烘箱→启 动风机→升温→温度升至180度保持 1.5h→完成灭菌干燥. 停止加热→风机继续运转→冷却 瓶→当箱内温度降至比室温高 15~20度时→烘箱停止工作→出瓶 →转入下道工序.
CHXP 300超声波洗瓶机
•送瓶机构:由电机、减速器、
输瓶网带、过桥、 喷淋头组 成,是玻璃瓶排列并输送到清 洗装置的传递机构。 •清洗装置:由超声波换能器、 送瓶螺杆、提升装置构成。 •冲洗机构:由带机械手的转 盘、冲洗摆动圆盘、喷针装置 组成。 •出瓶机构:由出瓶拨盘、导 轨、传动装置构成。 •主传动系统:由主电机、减 CHXP 300超声波洗洗瓶机 速器、传动轴、凸轮、链轮系 1. 送瓶机构;2. 冲洗机构;3. 出瓶机构;4. 床身; 组成。 5. 主传 动系统;6. 清洗装置;7. 电气控制系统;
(二)洗 瓶
1.超声波洗瓶
先用超声波预洗,再用过滤的蒸馏水洗干净。 按清洗玻璃瓶传动装置传送方式分类 分为水平传动型(如图)和行列式传动型(如图)。
2.刷洗
毛刷洗瓶机通过设备上设置的毛刷,去除瓶壁上的杂 物,实现清洗目的。 先用毛刷刷洗,再用过滤的蒸馏水冲洗干净。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
无菌粉针剂生产工艺特点:1.需要无菌分装的注射剂为不耐热性,不能采用成品灭菌工艺的产品,其工艺进城需无菌操作,并防止异物的混入。
2.无菌分装的注射剂吸湿性强,再生产过程中应特别注意,无菌室的相对湿度,胶塞和瓶子的水份,工具的干燥和成品包装的严密性。
3.为保护产品的无菌性质,需严格检测洁净室的空气洁净度。
4.为防止污染,青霉素类的无菌分装注射剂生产中,其退出,车间的物料如工作服,废瓶,胶塞,空的容器等进行碱溶液处理。
注射剂装量差异检查法:1.取供试品5瓶(支)除去标签,铝盖,容器的外壁用乙醇擦掉,干燥。
开启时注意避免玻璃等异物落入容器中。
2.分别迅速精密称定每一容器的重量,求出每瓶(支)的装量与平均装量3.每瓶(支)装量与平均装量相比较,应符合规定。
4.如有1瓶(支)不符合规定,应另取10瓶(支)复试,应符合规定。
可见异物检查法:1.定义:可见异物是指存在于注射剂、滴眼剂中,在规定条件下目视可以观察到的不溶性物质,其粒径通常大于50um。
2.《中国药典》规定:可见异物检查法有两种:灯检法和光散射法,一般常用灯检法或采用光散射法,但灯检法不适用(如用有色透明容器包装或液体色泽较深的品种)应选用光散射法。
制药用水的分类和各自主要用途:制药用水的分类和各自主要用途:分类:制药用水因其适应的范围不同分为:饮用水,纯化水,注射用水,灭菌注射用水。
用途:饮用水:可作为药材浸制时的漂洗,制药工具的粗洗用水,除另有规定外,也可以作为药材的提取溶剂。
纯化水:为饮用水经蒸馏法、离子交换法、反渗透法或其他适宜的方法制备,制药用水可作为配制普通药物制剂用的溶剂或实验用水。
中药注射剂、滴眼剂等灭菌制剂所用药材的提取溶剂,以及口服、外用制剂配制用溶剂或稀释剂,非灭菌制备用器具的清洁用水。
注射用水:为纯化水经蒸馏所得到的水,可作为配制注射剂的溶剂或稀释剂及注射用容器的精洗,滴眼剂配制的溶剂。
灭菌注射用水:按照注射剂生产工艺制备所得,可用于注射用无菌粉末的注射剂的稀释剂。
简述灭菌法的定义以及常用的灭菌方法:定义:灭菌法系指用适当的物理化学手段将物品中活的微生物杀灭或除去的方法。
(适用于制剂、原料、辅料及医疗器械等物品的灭菌)常用的灭菌方法:辐射灭菌法、干热浴法、间歇式灭菌法、热压灭菌法、真空压力蒸汽灭菌法、环氧乙烷灭菌法、甲醛低温蒸气熏蒸法
简述湿热灭菌法:1.定义:是指将物品置于灭菌柜内利用高压饱和蒸汽流过热水喷淋的手段使微生物菌体中的蛋白质、核酸发生变性而杀灭微生物的方法。
2.条件:121℃,30分钟,121℃15分钟,116℃,40分钟3.装载方式:湿热灭菌时,被灭菌的物品应有适当的装载方式,不能排列过密,以保证灭菌的有效性和均一性,并通过装载验证。
4.湿热灭菌法应确立灭菌柜在不同装载时可能存在的冷点,用生物指示剂进一步确认灭菌效果时,应将其置于冷点处。
常用的指示剂:嗜热脂肪芽胞杆菌孢子。
简述注射剂的定义和特点:定义:是指将药物制成供注入体内的灭菌溶液、乳状液和混悬液以及供临用前配成溶液或混悬液的无菌粉末。
特点:1.药效迅速作用可靠2.适用于不宜口服的药物3.适用于不能口服给药的病人4.可以产生逐步定位作用5.使用不便且注射疼痛6.制备工艺复杂,对生产环境要求高。
