FITC免疫荧光检测试剂盒小鼠FITCImmunofluorescence
小鼠cfos试剂盒使用方法
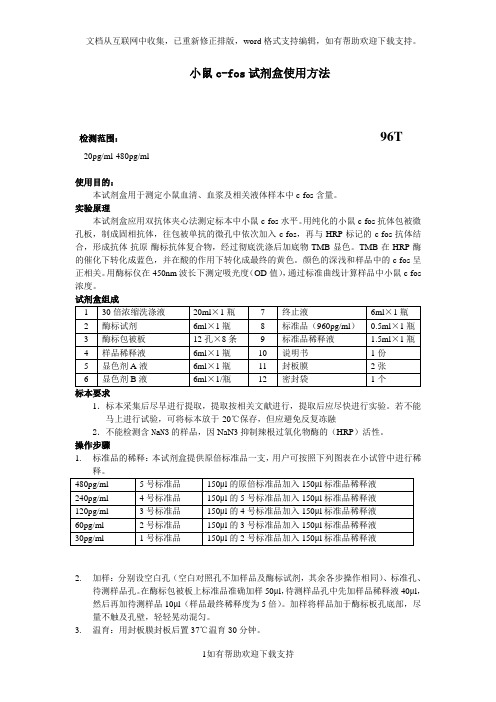
小鼠c-fos试剂盒使用方法检测范围:96T20pg/ml-480pg/ml使用目的:本试剂盒用于测定小鼠血清、血浆及相关液体样本中c-fos含量。
实验原理本试剂盒应用双抗体夹心法测定标本中小鼠c-fos水平。
用纯化的小鼠c-fos抗体包被微孔板,制成固相抗体,往包被单抗的微孔中依次加入c-fos,再与HRP标记的c-fos抗体结合,形成抗体-抗原-酶标抗体复合物,经过彻底洗涤后加底物TMB显色。
TMB在HRP酶的催化下转化成蓝色,并在酸的作用下转化成最终的黄色。
颜色的深浅和样品中的c-fos呈正相关。
用酶标仪在450nm波长下测定吸光度(OD值),通过标准曲线计算样品中小鼠c-fos 浓度。
试剂盒组成标本要求1.标本采集后尽早进行提取,提取按相关文献进行,提取后应尽快进行实验。
若不能马上进行试验,可将标本放于-20℃保存,但应避免反复冻融2.不能检测含NaN3的样品,因NaN3抑制辣根过氧化物酶的(HRP)活性。
操作步骤1.标准品的稀释:本试剂盒提供原倍标准品一支,用户可按照下列图表在小试管中进行稀2.加样:分别设空白孔(空白对照孔不加样品及酶标试剂,其余各步操作相同)、标准孔、待测样品孔。
在酶标包被板上标准品准确加样50μl,待测样品孔中先加样品稀释液40μl,然后再加待测样品10μl(样品最终稀释度为5倍)。
加样将样品加于酶标板孔底部,尽量不触及孔壁,轻轻晃动混匀。
3.温育:用封板膜封板后置37℃温育30分钟。
4.配液:将30倍浓缩洗涤液用蒸馏水30倍稀释后备用5.洗涤:小心揭掉封板膜,弃去液体,甩干,每孔加满洗涤液,静置30秒后弃去,如此重复5次,拍干。
6.加酶:每孔加入酶标试剂50μl,空白孔除外。
7.温育:操作同3。
8.洗涤:操作同5。
9.显色:每孔先加入显色剂A50μl,再加入显色剂B50μl,轻轻震荡混匀,37℃避光显色15分钟.10.终止:每孔加终止液50μl,终止反应(此时蓝色立转黄色)。
Annexin-V-FITC细胞凋亡检测试剂盒

2. Yang L, Zhou X, Yang J, Yin X, Han L, Zhao D. Aspirin inhibits cytotoxicity of prion peptide PrP106-126 to neuronal cells associated with microglia activation in vitro. J Neuroimmunol. 2008 Aug 13;199(1-2):10-7.
分钟,收集细胞,用50-100μl Annexin V-FITC结合液轻轻重悬细胞,涂片后,荧光显微镜下观察。 2. 对于贴壁细胞:
A. 把细胞培养液吸出至一合适离心管内,PBS洗涤贴壁细胞一次,加入适量胰酶细胞消化液(可含有EDTA)消化细胞。 室温孵育至轻轻吹打可以使贴壁细胞吹打下来时,吸除胰酶细胞消化液。需避免胰酶的过度消化。
使用说明:
1. 对于悬浮细胞: A. 在进行完细胞凋亡刺激后,1000g (约1000-2000rpm)离心5分钟,弃上清,收集细胞,用PBS轻轻重悬细胞并计数。 注意:PBS重悬不能省略,PBS重悬的过程同时也起到了洗涤细胞的作用,可以保证后续Annexin V-FITC的结合。
B. 取5-10万重悬的细胞,1000g离心5分钟,弃上清,加入195μl Annexin V-FITC结合液轻轻重悬细胞。 C. 加入5μl Annexin V-FITC,轻轻混匀。 D. 室温(20-25℃)避光孵育10分钟。可以使用铝箔进行避光。 E. 1000g离心5分钟,弃上清,加入190μl Annexin V-FITC结合液轻轻重悬细胞。 F. 加入10μl碘化丙啶染色液,轻轻混匀,冰浴避光放置。 G. 随即进行流式细胞仪检测,Annexin V-FITC为绿色荧光,PI为红色荧光。如果用于荧光显微镜下检测,1000g离心5
免疫荧光
FITC-细胞桨;DAPI-细胞核
SYBR Green I 溶液染色: 病毒(小点)、细菌(大亮 点)、硅藻(细长的细胞) SYBR Green I 凝胶染色
染色体原位杂交检测
免疫荧光染色,多色叠加
实验内容
小鼠B细胞膜表面Ig(mIgG)测定——直接免疫荧光染色法
细胞膜或细胞内的抗原分子与相应的荧光素直 接标记的mAb结合后,形成带有荧光色素的抗原抗 体复合物。 经激发光激发后发出与荧光素相对应的特定波 长的荧光,其荧光强度与被测抗原分子表达密度成 正比例关系,由此可检测细胞与标记抗体对应抗原 的表达量和阳性细胞百分比。 活细胞表面保留有较完整的抗原或受体,根据 所测定的荧光强度和阳性细胞百分率即可知相应抗 原的密度和分布的比例。
3、用眼科剪将脾脏一端剪一小口后,将含5ml Hank’s液的注射器 从另一端刺入脾脏,缓缓注入Hank’s液,即可见脾细胞流入平皿, 在注射Hank’s液同时不断转动针头方向,直至脾脏变苍白为止。
4、将脾细胞悬液吸入试管,静置10分钟,以去除较大块未冲散 的脾组织块,然后将沉淀以上部分移入干净试管。
荧光
指一个分子或原子吸收了外界给予的能量后, 即刻引起发光;停止能量供给,发光亦瞬即停 止。
受到短波激发光照射,发射出波长较长的荧光。 若激发光停止照射,荧光立即熄灭。 荧光的衰减:取决于激发光强度和照射时间。
荧光发生机理
量子理论:光波短,光子能量强;光波长,光子能量小 某些物质接收紫外线和较短波照射------能量增高,处于 不稳定状态-----以光的形式向外释放多余的能量。
在碱性条件下,FITC的异硫氰酸基在水溶液中与 免疫球蛋白的自由氨基经碳酰胺化而形成硫碳氨基键, 成为标记荧光免疫球蛋白,即荧光抗体。 一个Ig分子上最多能标记15~20个FITC分子。
免疫荧光

LOGO
实验展示
不同的亚细胞定位
绿色:细胞骨架
红色:细胞核
LOGO
实验展示
GFP Anti-NOB1 DAPI
1
B
Anti-NOB1
DAPI
2
3
LOGO
注意事项
注意事项: •细胞密度要合适,状态较好; •PBS洗时动作要轻缓,避免冲下细胞; •操作时避免弄混盖玻片的正反面; •从孵育二抗开始要避光; •完成后最好及时镜检,照相;分别用不同波长激发荧光,在Photoshop软件 下合成一张图; •镜检时盖玻片应朝向物镜。
LOGO
免疫荧光
LOGO
1 2 3 4
免疫荧光原理 实验方法 实验展示
注意事项
LOGO
免疫荧光ห้องสมุดไป่ตู้理
免疫荧光技术(Immunofluorescence technique )又称荧光抗体技术,是标记免疫技 术中发展最早的一种。它是在免疫学、生物化学和显微镜技术的基础上建立起来的一 项技术。利用抗原抗体反应进行组织或细胞内抗原物质的定位。先将已知的抗原或抗 体标记上荧光素制成荧光标记物,再用这种荧光抗体(或抗原)作为分子探针检查细 胞或组织内的相应抗原(或抗体)。在细胞或组织中形成的抗原抗体复合物上含有荧 光素,利用荧光显微镜观察标本,荧光素受激发光的照射而发出明亮的荧光,可以看 见荧光所在的细胞或组织,从而确定抗原或抗体的性质、定位,以及利用定量技术测 定含量。
LOGO
免疫荧光原理
LOGO
免疫荧光原理
常见荧光素 1)FITC:黄色结晶粉末,吸收光:490~495nm,发射光:520~530nm,明亮 的黄绿色荧光。 2)RB200:橘红色粉末,吸收光570nm,发射光595~600nm,橘红色荧光。 3)TRITC:紫红色粉末,吸收550nm,发射光620nm,橙红色荧光。 4)镧系:Eu、Tb 5)PE:吸收光490~560nm,发射光595nm,红色荧光。 6)其它:酶作用后产生荧光物质。
免疫荧光

酶底物产物激发光发射光 Β-G MUG MU 360 450 AP MUP MU 360 450 HRP HPA二聚体 317 414 ⑷合适荧光素的选择 1)具有与蛋白质形成共价键的化学基团。 荧光素-N=C +NH-蛋白质荧光素-N-C-N-蛋白质 ‖ ︱ ︱‖ ︱ S H H SH 2)荧光效率高,标记后下降不明显。 3)荧光色泽与背景色泽对比鲜明。
实验步骤
直接法测抗 原
间接法测抗 体
⑴基本原理 将荧光素标记在相应的抗体上,直接与相应抗原反应。其优点是方法简便、特异性高,非特异性荧光染色少。 缺点是敏感性偏低;而且每检查一种抗原就需要制备一种荧光抗体。此法常用于细菌、病毒等微生物的快速检查 和肾炎活检、皮肤活检的免疫病理检查。 ⑵试剂与仪器 磷酸盐缓冲盐水(PBS):0.01mol/L,pH7.4 荧光标记的抗体溶液:以0.01mol/L,pH7.4的PBS进行稀释 缓冲甘油:分析纯无荧光的甘油9份+ pH9.2 0.2M碳酸盐缓冲液1份配制 搪瓷桶三只(内有0.01mol/L,pH7.4的PBS 1500ml) 有盖搪瓷盒一只(内铺一层浸湿的纱布垫) 荧光显微镜 玻片架
1)荧光色素
许多物质都可产生荧光现象,但并非都可用作荧光色素。只有那些能产生明显的荧光并能作为染料使用的有 机化合物才能称为免疫荧光色素或荧光染料。常用的荧光色素有:
⑴异硫氰酸荧光素(fluoresceinisothiocyanate,FITC)为黄色或橙黄色结晶粉末,易溶于水或酒精等溶 剂。分子量为389.4,最大吸收光波长为490--495nm,最大发射光波长520--530nm,呈现明亮的黄绿色荧光,结 构式如下:
标记的抗抗体是抗球蛋白抗体,同于血清球蛋白有种的特异性,如免疫抗鸡血清球蛋白只对鸡的球蛋白发生 反应,因此,制备标记抗体适用于任何抗原的诊断。
免疫荧光技术

葡聚糖凝胶G25或G50,用pH=7.4的0.01%PBS溶胀 后装柱,加入标记后的抗体溶液,然后用上述 PBS洗脱,取洗脱液加入20%三氯醋酸使蛋白沉淀 后,上清液中的荧光素应低于0.01ug/ml。
⑵ 除去标记不适当的抗体:
采用DEAE纤维素离子柱。将DEAE纤维素用pH=7.6的 0.01mol/L磷酸盐缓冲液平衡装柱,加入标记抗体溶液, 进行分步洗脱。 未结合荧光素的抗体,所帶负电少,最先洗出。 中间洗脱出来的是荧光标记合适的抗体部分。 过量结合荧光素的抗体,所帶负电多,最后洗出。 但经此法纯化,标记抗体损失达50%。
⑶ 除去非特异反应物质:
将荧光抗体用同一正常组织或同种动物其它组织 的组织粉预先吸收。 按每ml标记抗体加100mg组织粉比例混合, 4℃ 磁力搅拌1h,静置1h,1800r/min于4℃条件下离 心20min取上清液,再用每ml标记抗体加组织粉 比例重复一次。
(三)荧光抗体的鉴定
荧光素与蛋白结合率:
P:总蛋白质的量。F:荧光色素量。(物质的量)
*
*
固定标本染色以F/P=1.5左右为宜 活细胞染色以F/P=2.4左右为宜.
F/P值高则抗体分子结合的荧光素多。
F/P=
IgG (mg/ml)
荧光色素(μg/L ) 160 000x10 3 荧光色素 ( μg/L ) x 0.4 x 6
IgG (mg/ml) 390x10
病毒
无水乙醇,丙酮、CCl4
(3)固定后处理
抗原固定后必须立即以冷PH7.4 PBS冲洗,顺序经过三缸 浸泡,每缸3min,末次再以蒸馏水浸泡1min以脱盐。 标本固定干燥后最好立即进行荧光染色及镜检,如必须 保存则应保持干燥,置于4℃以下保存,一般细菌涂片或 组织切片经过固定后可保存一个月以上,但病毒和某些 组织 抗原标本则需-20℃以下保存。
人CD45分子检测试剂盒(流式细胞仪法-FITC)

当某一细胞通过流式细胞仪被检测到具有此 525nm 特异光信号,就可以确
定该细胞表面表达 CD45 分子。对某一细胞群体进行该项检测,可以确定
本试剂用于体外流式细胞仪半定量检测经 EDTA、枸橼酸钠或肝素钠 抗凝的骨髓细胞表面 CD45 分子的表达。
CD45 的荧光强度结合测向角可以用于流式细胞仪检测时设门,准确找 到白血病细胞群,然后进行细胞免疫分型表达分析。
用 CD45 与侧向角(side scatter,SSC),对数取样后可将骨髓细胞清晰地 分出淋巴细胞,单核细胞,成熟粒细胞,幼稚细胞和红细胞群,其理论依 据是 CD45 是所有白细胞的抗原。其表达量在淋巴细胞最高,单核细胞, 成熟粒细胞,早期造血细胞(blasts)依次减弱。红细胞(中,晚幼红细胞, 成熟红细胞)不表达 CD45[1-3]。SSC 反映细胞的颗粒性,成熟粒细胞 SSC 最高,依次为单核细胞,淋巴细胞,早期造血细胞,红细胞。以 CD45/SSC 双参数,对数取样时即可把各细胞群区分出来。若同时加上一个,二个甚 或三个荧光标记的单抗,则很容易识别非正常细胞群所表达的抗原。这样 可以排除正常细胞的干扰。在幼稚细胞百分率低的情况下或检测残存白血 病时尤为必要 。
异硫氰酸(FITC)标记小鼠抗人 CD45 单克隆抗体试剂是一种流式细胞 仪用试剂,主要用于白血病分型诊断时,应用流式细胞术 CD45/SSC 设门进 行急性白血病免疫分型[4]。
通过使用本品检测 CD45+细胞,只作为辅助判断白血病的免疫分型, 其百分率高低与白血病的具体类型、发病、疾病进程和预后并无直接关系, 需要临床医师根据病人的临床表现及其他检查结果综合做出判断。 【检验原理】
fitc的激发波长和发射波长

fitc的激发波长和发射波长
FITC指Fluorescein isothiocyanate,是一种有机化学物质,它具有荧光特性,可以用微量添加到物质中,从而使其具有调节特性。
FITC的激发波长是495 nm,发射波长是520 nm。
FITC的主要用途有:
一、用于染色细胞。
FITC可以充当FLUOR和CFAs的凝胶电泳染色剂,有助于更好地解释实验结果,而不会影响实验的灵敏度。
另外,FITC还可以通过免疫细胞染色法来识别特定的细胞,使其与研究相关的特定信号互相关联。
二、用于组织及细胞构建。
FITC可以把特定的核酸和蛋白质附着在特定的细胞表面,以便标记指定的细胞,例如脂肪细胞、神经元和血管细胞等。
三、用于真核生物中的遗传测定。
FITC可以运用在荧光原位杂交技术(FISH)中,将特定的核酸链结合在特定的序列上,以帮助实验者测定基因的表达和遗传变异情况。
四、用于EMT鉴定。
FITC可以配合其他技术,如荧光技术、传递电子显微镜和免疫细胞化学分析,用于鉴定多种疾病的机制,例如肝癌、肠癌和胰腺癌等。
FITC有着许多广泛的用途,激发波长495nm,发射波长为520nm,并且可以将特定的核酸和蛋白质附着在特定的细胞表面,以帮助实验者做出合理的判断,获得准确的实验结果。
免疫荧光法检测干细胞标志物

免疫荧光法检测干细胞标志物英文回答:Immunofluorescence is a widely used technique to detect and visualize specific proteins or molecules in biological samples. It utilizes the specific binding of antibodies to their target molecules, followed by the detection of these antibodies using fluorescent markers.In the context of stem cell research, immunofluorescence can be used to detect and identify specific markers that are characteristic of stem cells. Stem cells are undifferentiated cells with the ability to differentiate into various cell types. They express certain proteins or molecules that are unique to stem cells, and these markers can be detected using immunofluorescence.For example, one commonly used stem cell marker is Oct-4. Oct-4 is a transcription factor that plays a crucialrole in maintaining pluripotency in embryonic stem cells.To detect Oct-4 using immunofluorescence, researchers would first incubate the stem cells with a primary antibody that specifically binds to Oct-4. This primary antibody is typically derived from a different species than the sample (e.g., mouse anti-Oct-4 antibody for human stem cells). After washing away any unbound antibodies, a secondary antibody conjugated to a fluorescent dye (e.g., FITC or Alexa Fluor) is added. This secondary antibody recognizes and binds to the primary antibody, allowing for the visualization of Oct-4 under a fluorescence microscope. The presence of Oct-4 in the stem cells can be identified by the green fluorescence emitted by the FITC or Alexa Fluor dye.In addition to Oct-4, there are many other markers that can be detected using immunofluorescence to identify and characterize stem cells. These include Nanog, Sox2, SSEA-4, and CD133, among others. Each of these markers has its own specific antibody that can be used in immunofluorescence experiments.Immunofluorescence is a powerful tool in stem cellresearch as it allows for the visualization and identification of stem cells based on their unique markers. It provides valuable information about the presence, location, and abundance of stem cells in a sample. This information is crucial for understanding stem cell biology and for the development of stem cell-based therapies.中文回答:免疫荧光法是一种广泛应用于生物样本中特定蛋白质或分子检测和可视化的技术。
FITC

FluoroTag™FITC Conjugation KitProduct Number FITC1Storage Temperature 2−8 °CTECHNICAL BULLETINProduct DescriptionThe FluoroTag FITC Conjugation Kit is suitable for the conjugation of polyclonal and monoclonal antibodies with fluorescein isothiocyanate (FITC) for use in immunohistochemistry and immunofluorescence studies utilizing flow cytometry. It may also be used for conjugation of FITC to peptide hormones, cytokines, growth factors, and other proteins. The kit contains sufficient reagents for at least 5 conjugations. Fluorescein isothiocyanate (FITC), Isomer I is among the most widely used fluorescent labeling reagents due to the fluorophore’s high quantum efficiency and conjugate stability. FITC has an absorption maximum at 495 nm and emission maximum at 525 nm. FITC reacts with free amino groups of proteins to form stable conjugates (see Figure 1). FITC-protein conjugates, in particular FITC labeled antibodies, are used as specific probes in immunocytochemistry and flow cytometry applications.1,2Biologically active FITC-conjugates of peptide hormones and growth factors have been successfully prepared which identify receptors on target cells.3,4FITC has also been used as a site-specific probe for several other proteins.5,6,7The use of optimal labeling conditions is recommended. Overlabeling of proteins generally results in altered specificity, aggregation and/or precipitation of the protein. Fluorescent labeling of antibodies with high fluorophore to antibody ratios (molar F/P >6) usually results in increased non-specific binding (fluorescent background) and decreased quantum yield due to the fluorophore self-quenching effect.The FluoroTag Kit includes detailed procedures for both small and large scale conjugation of FITC to antibody. Small scale FITC conjugations are performed using three different molar ratios of FITC to antibody. Based on the molar ratio that gives the most satisfactory result, the large scale procedure can then be performed to optimally label the protein. The labeled protein is purified from the unconjugated fluorescein by a quick Sephadex®G-25M column. The F/P molar ratio of the purified protein is then determined by measuring the absorbance at 280 nm and at 495 nm.Reagents and Materials Provided• Fluorescein isothiocyanate, Isomer I (FITC), F7250.Five amber vials each containing 2.0 mg oflyophilized fluorescein isothiocyanate.• 0.1M Sodium Carbonate-Bicarbonate Buffer, pH9.0, C0688. Five capsules containing powder.• Phosphate Buffered Saline (PBS), P3813. Five packages containing powder.• Gel filtration columns. Two columns prepacked with Sephadex G-25M. These serve to separateunreacted FITC from the conjugate and for bufferexchange. The columns are preswollen in watercontaining 0.15% Kathon®CG/ICP II aspreservative. The gel filtration columns are supplied for two different reaction scales:Small Scale (Column A), B7533:One columnprepacked with Sephadex G-25M. The bed volume of the column is 3.5 ml and the bed height is2.6cm. The maximal sample volume is 0.3 ml.Large Scale (Column B), B4783:One columnprepacked with Sephadex G-25M. The bed volume of the column is 9.1 ml and the bed height is 5cm.The maximal sample volume is 1.5 ml.Reagents and Equipment Required but Not Provided• Standard glass vials (1.5−2 ml capacity) equipped with stirring bars.• Two dilution vials are needed for each conjugation.• Vortex mixer.• Standard glass tubes (12 X75 mm or 13 X100 mm) to collect fractions from Sephadex G-25M columns.• Aluminum foil -To protect reaction and FITC labeled protein from intense light.• Quartz cuvette -1 cm path length• UV/Visible spectrophotometer.2Precautions and DisclaimerThis product is for R&D use only, not for drug, household, or other uses. Please consult the Material Safety Data Sheet for information regarding hazards and safe handling practices.Preparation Instructions0.1 M Sodium Carbonate-Bicarbonate Buffer, pH 9.0,C0688-Add contents of one capsule to 50 ml of deionized water to make 0.1M sodium carbonate-bicarbonate buffer, pH9.0. This is used to dissolve FITC and to buffer the conjugation reaction. Phosphate Buffered Saline (PBS), P3813-Mix contents of one package with 800 ml of deionized water. Adjust volume to 1 liter to make 10 mM sodium phosphate buffer, 27 mM KCl, 138 mM NaCl, pH 7.4. This serves as an equilibration buffer for the Sephadex G-25 columns, for the elution of the labeled protein from the column, and for the final dilution of the labeled protein.Storage/StabilityStore at 2−8 °C.ProcedureThe protocol outlined describes the labeling of 1 mg of IgG at 5 mg/ml with FITC (Small Scale Conjugation Procedure). The procedure can be scaled up to 5 mg of IgG maintaining the same concentration and molar ratio of the reagents (Large Scale Conjugation Procedure). It is important to consider that the number and surface availability of amine groups (primarily -amine groups of lysine residues) vary greatly among proteins and even among different IgGs. This may result in a large variability of the level of labeling. Testing different FITC to antibody molar ratios to determine the optimal levels of labeling of the antibody is recommended.Small Scale Conjugation Procedure(1.0 mg IgG)This procedure describes the conjugation of FITC to1mg of IgG, using one of the following molar ratios in the reaction mixture: 5:1, 10:1 and 20:1 of FITC(MW389) to IgG (MW 150,000). The labeling is performed in a final reaction volume of 0.25 ml. In general, these reaction molar ratios result in fluorescein-antibody conjugates with F/P ratios of 1−2, 2−4 and 3−6, respectively. This procedure can be modified if a protein of a different molecular weight (or a different amount of IgG) is used in the labeling reaction. (See Table 2 reaction mixture ratios for whole IgG, IgM, or antibody fragments.)1.Dissolve the contents of one sodium carbonate-bicarbonate capsule (C0688) in 50 ml of deionized water. The pH of this buffer should be 9.0 ±0.1(See Application Notes 1&2).2.Prepare at least 0.25 ml of antibody solution at5.0mg/ml in 0.1 M carbonate-bicarbonate buffer,pH 9.0 (See Application Notes 3, 4 & 5). The A280of an IgG solution at 1.0 mg/ml is 1.4 (1.0 cm path length).3.Add 0.2 ml (1.0 mg) of the antibody solution intoeach reaction vial labeled “5:1”, “10:1”, or “20:1”. 4.Reconstitute one vial of FITC (F7250) in 2 ml of0.1M carbonate-bicarbonate buffer and vortex untilall FITC has dissolved. Label vial “20:1 FITC”. The solution should be freshly prepared before eachconjugation and used within 5 minutes (SeeApplication Note 6). The "20:1 FITC" solution isfurther used to prepare the "5:1" and "10:1"solutions.5.Prepare the required dilution of FITC in 0.1Mcarbonate-bicarbonate buffer as directed inTable1.Table 1.Dilution of FITC in 0.1M Carbonate-Bicarbonate Buffer6.Add 50 µl of the appropriate FITC dilution dropwisewhile stirring to the correspondingly labeledreaction vial.pletely cover the reaction vial with aluminumfoil to protect from light.8.Incubate all reaction vials for 2 hours at roomtemperature with gentle stirring.Isolation of labeled protein1.Empty contents of PBS package (P3813) into asuitable container. Add 800 ml of distilled ordeionized water and mix. Adjust to final volume of 1,000 ml.bel Sephadex G-25M, column A (B7533), “5:1”,“10:1”, or “20:1”. Support column over a suitable(100ml) beaker.3.Remove cap from the top of the column, cut openlower tip of column and let excess of liquid flowthrough. The column will not run dry.34.Equilibrate the column with 12 ml of PBS solution(6 X2 ml). If the column is not immediately used,close with top and bottom caps and store at 2−8 °C.5.Apply reaction mixture to top of column gel bed andcollect the flow through (Fraction 1)6.Elute the column with 2.5 ml of PBS, collecting0.25ml fractions (10 X0.25 ml). Monitor theabsorbance of each fraction at 280 nm. Two bands will be visible during elution. The conjugate ispresent in the first band (fractions 6−8)(See Application Note 7).7.Pool the main fractions. Do not collect fractions withA280<0.2.8.Wash the column with 35 ml (10 X column volumes)of PBS to remove unbound fluorophore. This issufficient to regenerate the column.9.For prolonged storage, wash the column with 10mlof PBS containing 0.05% sodium azide and storecapped at 2−8 °C, with 1 ml buffer above the gel. 10.Determine the fluorescein/protein ratio (F/P) of theconjugate using a spectrophotometer as described in Determination of Fluorescein/Protein Molar Ratio (F/P).11.For storage of the conjugate after determination ofthe F/P molar ratio, add 1% (w/v) BSA and 0.1%(w/v) sodium azide to the conjugate. Store at2−8°C, protected from light.Large Scale Conjugation Procedure(5.0 mg IgG)This procedure describes the scale-up of the conjugation reaction of FITC to 5 mg of IgG, using the molar ratio, which gives the most satisfactory results as obtained from the “Small Scale Conjugation Procedure.” The labeling is performed maintaining the same concentrations and ratios of reagents used previously. The reaction is performed in a final reaction volume of 1.25 ml.1.Add 1.0 ml (5.0 mg) of the antibody solution to areaction vial labeled “5:1”, “10:1”, or “20:1”.2.Reconstitute one vial of FITC (F7250) in 2 ml of0.1 M carbonate-bicarbonate buffer and vortex untilall FITC has dissolved.3.Prepare 10:1 or 5:1 dilution of FITC in 0.1Mcarbonate-bicarbonate buffer as directed inTable1, if necessary.4.Add 250 µl of the appropriate FITC dilutiondropwise while stirring to the reaction vial.pletely cover the reaction vial with aluminumfoil to protect from light.6.Incubate reaction vial for 2hours at roomtemperature with gentle stirring.Isolation of labeled proteinbel Sephadex G-25M, column B (B4783), “5:1”,“10:1”, or “20:1”. Support the column over asuitable (100 ml) beaker.2.Remove cap from the top of the column, cut openlower tip of column and let excess of liquid flowthrough. The column will not run dry.3.Equilibrate the column with 30 ml of PBS solution(6 X5 ml). If the column is not immediately used,close with top and bottom caps and store at 2−8 °C.4.Apply reaction mixture to top of the column gel bedand collect flow through (Fraction 1).5.Elute column with 10 ml of PBS, collecting 1.0 mlfractions (10 X1 ml). Monitor the absorbance ofeach fraction at 280 nm. Two bands will be visible during elution. The conjugate is present in the first band (fractions 3−5). (See Application Note 7.)6.Pool the main fractions. Do not collect fractionswith A280<0.4.7.Wash the column with 50 ml of PBS solution toremove unbound fluorophore. This is sufficient toregenerate the column.8.Preserve the column as instructed in step 9 of thesmall scale “Isolation of Labeled Protein” section. Determination of Fluorescein/Protein Molar Ratio (F/P) The F/P molar ratio is defined as the ratio of moles of FITC to moles of protein in the conjugate.To determine this ratio, it is necessary to first determine the absorbance of the conjugate sample at 280 nm and then at 495 nm.1.Place the conjugate sample in a quartz cuvette.For the large scale conjugation, dilute 0.1 ml of the FITC conjugate in 0.9 ml of PBS containing sodium azide. Read the absorbance of the conjugatesample at 280 nm and 495 nm. The absorbancereading of the conjugate sample should be between0.2 and 1.4 at 280 nm. If the absorbance reading isoutside this range, adjust the sample dilutionaccordingly.2.From the absorbance readings (A280and A495) ofthe conjugate sample, calculate the F/P of thefluorescein-IgG conjugate according to the84The protein concentration of the fluorescein-IgGFITC, use the general formula below, substituting the appropriate values for the particular protein:MW is the molecular weight of the protein.389 is the molecular weight of FITC.195 is the absorption E 0.1% of bound FITC at 490 nm at pH 13.0.(0.35 x A 495) is the correction factor due to the absorbance of 280(For E 0.1%and C values, see Table 2)FITC at 280 nm.8E 0.1%is the absorption at 280 nm of a protein at 1.0mg/ml.280280Application Notes1.Do not store sodium carbonate-bicarbonate buffermore than 1 week at 2−8 °C. The pH of the buffer may change upon storage. It is advised that fresh buffer be made just before use.2.The conjugation of FITC to proteins is affected bythe reaction conditions (concentration, temperature, pH).3.When conjugating antibodies with FITC, the startingmaterial should be free of contaminating serum proteins. Affinity isolated antibodies, IgG fractions, or Protein A purified immunoglobulin are generally acceptable.4.Protein solutions should not be prepared in bufferscontaining amines such as Tris, glycine or sodium azide since they inhibit the labeling reaction. If the buffer contains amines or sodium azide, dialyze protein solution (1 ml) against PBS, pH 7.4(1,000ml), overnight at 2−8 °C. Avoid dialysis at high pH values (>8.0−8.5) as this may be harmful to some proteins.5.If the antibody is in PBS pH 7.4 (without azide), add1 M carbonate-bicarbonate buffer (1 capsule (C0688) in 5 ml deionized water) to a final concentration of 0.1 M (e.g., 0.1 ml of 1 Mcarbonate-bicarbonate buffer to 0.9 ml IgG solution at 5.0 mg/ml).6.FITC is not stable in aqueous solutions. Do notstore FITC stock solutions.7.The second band containing unbound fluorophoreis retained on the column and will elute only with subsequent PBS washes.References1.Staines, W., et al., Three-colorimmunofluorescence histochemistry allowing triple labeling within a single section. J. Histochem. Cytochem., 36, 145 (1988).2.Carter, N., in Flow Cytometry: A PracticalApproach, M.G. Ormerod, Ed., IRL Press (1990).3.Carraway, K., et al., Location of the epidermalgrowth factor binding site on the EGF receptor. A resonance energy transfer study. Biochemistry , 29, 8741 (1990).4.Schwartz, J., and Vale, W., Fluorescent andcytotoxic analogs of corticotropin-releasing factor: probes for studying target cells in heterogeneous populations. Methods in Enzymol ., 168, 29 (1989).5.Adams, S., et al., Fluorescence ratio imaging ofcyclic AMP in single cells. Nature , 349, 694 (1991).6.Abbott, A., et al., Immunochemical andspectroscopic characterization of two fluorescein 5'-isothiocyanate labeling sites on Na+, K(+)-ATPase. Biochemistry , 30, 1692 (1991).7.Pavalko, F., and Burridge, K., Disruption of theactin cytoskeleton after microinjection of proteolytic fragments of alpha-actinin. J. Cell Biol.,114, 481 (1991).8.The, T., and Feltkamp, T., Conjugation offluorescein isothiocyanate to antibodies. I. Experiments on the conditions of conjugation. Immunol.,18, 865 (1970).Sephadex is a registered trademark of Pharmacia, Inc. Kathon is a registered trademark of the Rohm & Haas Company.LPG,KTA 12/05-15 Table 2.Reaction Mixture Ratios for Whole IgG, IgM or Antibody Fragments** This corresponds to volume in microliters of the appropriate FITC concentration (5:1, 10:1, or 20:1).***For IgM, a lower molar ratio is recommended as high levels of FITC may result in overlabeling of the antibody and self-quenching of the fluorophore.****For F(ab′) 2 use a 2-fold more concentrated FITC solution than used for IgG.*****For Fab′and Fc use a 4-fold more concentrated FITC solution than used for IgG.6Figure 1.The FITC Labeling ReactionFITC conjugation occurs through the free amino groups of proteins or peptides, forming a stable thiourea bond.Sigma brand products are sold through Sigma-Aldrich, Inc.Sigma-Aldrich, Inc. warrants that its products conform to the information contained in this and other Sigma-Aldrich publications.Purchaser must determine the suitability of the product(s) for their particular use. Additional terms and conditions may apply.Please see reverse side of the invoice or packing slip.。
第七章免疫组织化学技术【实用资料】

(immunofluorescence cytochemistry)
免疫组化
原位杂交技术
膀胱癌和癌旁组织上用ADAM12 T3 反义探针检测到阳性杂交信号(C,D), 而正义探针在癌旁的正常组织中只见 到很弱或阴性信号(E,F)。D和F分别是 C和D的黑视野图像。
定量免疫 组化技术
免疫组织化学技术基本流程
(protein A immunocytochemistry) (7)生物素-亲合素系统介导的免疫组织化学方法
(biotin-avidin system cytochemistry)
3.按应用方式不同分类
(1)免疫电镜组化技术 (immunoelectromicroscopy cytochemistry)
固定剂选择
• 血涂片:丙酮,福尔马林(胞质蛋白,BCR) • 细胞涂片:95%乙醇、carbowax. • 冰冻切片:乙醇、丙酮、多聚甲醛 • 石蜡切片:福尔马林(需抗原修复)、氯化汞(胞浆蛋白)
PLP/PLDP(糖类、脂类)、乙醇、丙酮
固定方法
• 浸泡法 • 蒸汽法 • 注射、灌注法 • 微波固定
• 注意事项: • 自然冷却、避免蒸干、条件统一,结构改
变,适当加入螯合剂
免疫组织化学技术基本流程
一、样品的制备 二、抗原抗体反应 三、化学呈色反应 四、免疫组织化学结果及其分析
染色策略
ABC PROCEDURE UTILIZING CATALYZED SIGNAL AMPLIFICATION (CSA)
组织细胞的固定
(Fixation)
➢ 要求:
➢ 完整性、天然性、抗原性、便于后期操作
➢ 策略:
➢ 快速脱水、阻断酶活、保持抗原性
免疫荧光技术(immunofluorescencetechnique)又称荧光抗体技术

免疫荧光技术免疫荧光技术(immunofluorescence technique )又称荧光抗体技术。
始创于40年代初,1942年coons等多次报道用异氰酸荧光素标记抗体。
它是在免疫学、生物化学和显微镜技术的基础上建立起来的一项技术。
免疫荧光技术包括荧光抗体技术和荧光抗原技术,因为荧光色素不但能与抗体球蛋白结合,用于检测或定位各种抗原,也可以与其他蛋白质结合,用于检测或定位抗体,但是在实际工作中荧光抗原技术很少应用,所以人们习惯称为荧光抗体技术,或称为免疫荧光技术。
该技术的主要特点是:特异性强、敏感性高、速度快。
主要缺点是:非特异性染色问题尚未完全解决,结果判定的客观性不足,技术程序也还比较复杂。
一、实验的基本原理免疫学的基本反应是抗原-抗体反应。
由于抗原抗体反应具有高度的特异性,所以当抗原抗体发生反应时,只要知道其中的一个因素,就可以查出另一个因素。
免疫荧光技术就是将不影响抗原抗体活性的荧光色素标记在抗体(或抗原)上,与其相应的抗原(或抗体)结合后,在荧光显微镜下呈现一种特异性荧光反应。
二、实验方法1、直接法这是荧光抗体技术最简单和基本的方法。
滴加荧光抗体于待检标本片上,经反应和洗涤后在荧光显微镜下观察。
标本中如有相应抗原存在,即与荧光抗体特异结合,在镜下可见有荧光的抗原抗体复合物。
此法的优点是简单、特异。
但其缺点是检查每种抗原均需制备相应的特异性荧光抗体,且敏感性低于间接法。
图一、直接免疫荧光法原理示意图2、间接法根据抗球蛋白试验的原理,用荧光素标记抗球蛋白抗体(简称标记抗抗体)的方法。
检测过程分为两步:第一次,将待测抗体(第一抗体)加在含有已知抗原的标本片上作用一定时间,洗去未结合的抗体。
第二,滴加标记抗抗体。
如果第一步中的抗原抗体已发生结合,此时加入的标记抗抗体就和已固定在抗原上的抗体(一抗)分子结合,形成抗原-抗体-标记抗抗体复合物,并显示特异荧光。
此法的优点是敏感性高于直接法,而且无需制备一种荧光素标记的抗球蛋白抗体,就可用于检测同种动物的多种抗原抗体系统。
fitc荧光染料结构

fitc荧光染料结构荧光染料是一类具有特殊发光性能的有机化合物,其分子结构中通常包含着芳香环及有机功能团。
荧光染料的结构对其发光性能有着重要的影响。
其中,fitc(fluorescein isothiocyanate)是一种常用的荧光染料,其分子结构如下:fitc荧光染料的分子式为C21H11NO5S,其分子量为389.38 g/mol。
它主要由苯环、噻吩环及吡啶环组成,具有较高的荧光量子产率和较长的荧光寿命。
在其结构中,苯环起到了增加共轭体系的作用,使得fitc具有较宽的吸收光谱和发射光谱范围。
在fitc的结构中,噻吩环则起到了增加共振效应的作用,进一步提高了其荧光强度。
而吡啶环则是通过与其他官能团的共轭作用,使fitc能够与生物分子发生特异性的化学反应,从而实现对目标物质的荧光标记。
fitc荧光染料是一种可溶于水的荧光染料,在生物医学研究和生物分析领域有着广泛的应用。
其荧光性能稳定,荧光强度高,且对环境的敏感性较低。
因此,fitc荧光染料常被用于生物分子的检测、细胞标记、免疫分析等实验中。
在生物实验中,常常将fitc荧光染料与目标生物分子(如抗体、核酸等)结合,通过特异性化学反应使其发生共价结合。
这样,目标生物分子就能够被fitc荧光染料标记,并通过荧光显微镜等设备进行观察和分析。
此外,fitc荧光染料还可以利用其荧光性质进行生物分子的定量测定,实现对生物样品中目标物质含量的检测。
除了在生物医学研究领域的应用外,fitc荧光染料还可以用于材料科学领域的研究。
由于其良好的溶解性和较高的荧光强度,fitc荧光染料被广泛应用于荧光传感器、光电器件等领域。
通过对其分子结构的调整和改变,可以制备出具有不同荧光特性的fitc衍生物,进一步拓展其在材料科学领域的应用。
总结起来,fitc荧光染料是一种重要的荧光标记工具,其分子结构的设计与调整对其荧光性能有着重要的影响。
通过合理设计fitc的结构,可以实现对荧光强度、波长范围等性能的调控,进而满足不同领域的应用需求。
fitc和pi试剂盒原理

fitc和pi试剂盒原理一、引言FITC(Fluorescein Isothiocyanate)和PI(Propidium Iodide)试剂盒是生物医学研究中常用的荧光染料试剂盒,用于细胞活力和细胞凋亡的检测。
本文将介绍FITC和PI试剂盒的原理及其在实验中的应用。
二、FITC试剂盒原理FITC试剂盒是一种用于细胞活力检测的荧光染料试剂盒。
FITC是一种绿色荧光染料,具有良好的水溶性和细胞渗透性。
FITC试剂盒通过测量细胞内的活性蛋白酶活性来评估细胞的活力水平。
FITC试剂盒的原理是利用FITC染料与活性蛋白酶底物(如Calcein-AM)结合后的荧光信号来反映细胞的活力。
在活力高的细胞中,FITC染料会与底物结合,产生强烈的荧光信号;而在活力低的细胞中,底物无法被FITC染料结合,因此荧光信号较弱。
通过测量荧光信号的强度,可以判断细胞的活力水平。
三、PI试剂盒原理PI试剂盒是一种用于细胞凋亡检测的荧光染料试剂盒。
PI是一种红色荧光染料,可与细胞核酸结合。
在正常的细胞中,细胞膜完整,PI无法进入细胞核,因此没有荧光信号;而在凋亡细胞中,细胞膜破损,PI可以进入细胞核,与核酸结合产生红色荧光。
PI试剂盒的原理是通过测量细胞核的红色荧光信号来判断细胞的凋亡水平。
在正常的细胞中,凋亡水平较低,红色荧光信号较弱;而在凋亡细胞中,凋亡水平较高,红色荧光信号较强。
通过测量荧光信号的强度,可以评估细胞的凋亡情况。
四、FITC和PI试剂盒的应用FITC和PI试剂盒广泛应用于生物医学研究中的细胞生物学、免疫学和药物研发等领域。
1. 细胞活力检测FITC试剂盒可以用于评估细胞的活力水平。
通过测量FITC荧光信号的强度,可以判断细胞的活力水平。
该方法可用于筛选具有促进细胞活力的化合物,或评估细胞对外界刺激的响应能力。
2. 细胞凋亡检测PI试剂盒可以用于检测细胞的凋亡水平。
通过测量PI荧光信号的强度,可以评估细胞的凋亡情况。
免疫荧光技术

一般常用DAPI复染。
7、封片: 为了长期保存,我们一般用缓冲甘油等封片,此外还有专门的抗荧光萃灭封片液; 避免产生气泡。
5、二抗孵育条件:
二抗一般室温或37度30min-1h,具体时间需要摸索;
而浓度一般有工作液,若是浓缩液还要摸索浓度; 切记要避光反应;
但在免疫荧光中我们一般先把二抗浓度和孵育时间先定下,然后去摸索一抗浓度和 孵育时间;
四乙基罗丹明 (rhodamine, RB200) RB200为橘红色粉末,不溶于水,易溶于酒精和丙酮,性质稳定,可 长期保存。最大吸收光波长为 570nm,最大发射光波长为595~600nm,呈现橘红色荧光。
四甲基异硫氰酸罗丹明 (tetramethyl rhodamine isothiocynate, TRITC) TRITC为罗丹明的衍生物,呈紫红色粉 末,较稳定。最大吸收光波长为 550nm,最大发射光波长为620nm,呈现橙红色荧光,与 FITC的翠绿色荧光对比鲜明,可配合用于双重标记或对比染色。因其荧光淬灭慢,也可用 于单独标记染色。
【固定液的选择】
2、冰冻切片制备:
建议用新鲜组织,否则组织细胞内部结构破坏,易使抗原弥散。 选用干净锋利的刀片、组织一定要冷冻适度等,防止裂片和脱片严重。
3、血清封闭: 为防止内源性非特异性蛋白抗原的结合,需要在一抗孵育前先用血清(与二抗来源一致) 封闭,减弱背景着色。 封闭是血清与非特异性位点结合,以消除非特异性染色,提高目的蛋白的准确性和降低 背景。 血清封闭的时间是可以调整的,一般30min。
激光共聚焦扫描显微镜既可以用于观察细胞形态,也可以用于细胞内生化成分的
定量分析、光密度统计以及细胞形态的测量, 配合焦点稳定系统可以实现长时间
活细胞动态观察。
免疫标记:四大免疫标记原理介绍

免疫标记:四大免疫标记原理介绍!为提高抗原和抗体检测的敏感性,将已知抗体或抗原标记上易显示的物质,通过检测标记物,反映有无抗原抗体反应,从而间接测出微量的抗原或抗体。
常用的标记物有酶、荧光素、放射性同位素、胶体金及电子致密物质等。
这种抗原或抗体标记上显示物所进行的特异性反应称为免疫标记技术(immunolabelling technique)。
免疫标记不仅大大提高了试验敏感性,若与光镜或电镜技术相结合,能对组织或细胞内的待测物质作精确定位,从而为基础与临床医学研究及诊断提供方便。
免疫标记技术大致分为两大类:一类属于免疫组织化学技术(immunohistochemical technique),用于组织切片或其他标本中抗原的定位。
另一类称为免疫测定(immunoassay),用于液体标本中抗原或抗体的测定。
一,免疫酶技术(immunoenzymatic technique)最早应用的免疫酶技术是免疫酶组织化学染色,即用标记的抗体与标本中的抗原发生特异性结合,当加入酶的底物时,在酶的作用下经一系列生化反应产生有色物质,借助光镜作出定位判断。
目前,应用最广泛的是酶联免疫吸附试验(enzyme linked immunosorbent assay,ELISA)。
该法特异性强,敏感性高,既可检测抗体,又能测定可溶性抗原。
主要方法及操作要领见图18.5,除了图示的两种方法外,还有抗原竞争法,现较少应用。
ELISA常采用的酶为辣根过氧化物酶(hosradish peroxidase,HRP),其底物是二氨基苯胺(DAB),底物被分解则呈棕褐色,可目测或借助酶标仪比色。
ELISA为非均相免疫测定,另外还有均相法,在此不作介绍。
由于酶免疫测定无需特殊仪器和试剂,且操作简便,利于普及。
因此,在免疫标记技术中,该法应用最为广泛,并在原有方法基础上加以改良,使得众多新的,更敏感的方法应运而生。
①生物素-亲和素放大系统(biotin-avidin system,BAS),建立于70年代后期,通过将酶标记在生物素或亲和素上,借助生物素与亲和素的高度亲力和生物素能与抗体结合的特点应用于ELISA,显著提高了检测的敏感性。
Annexin V-FITC PI荧光双染细胞凋亡检测试剂盒说明书
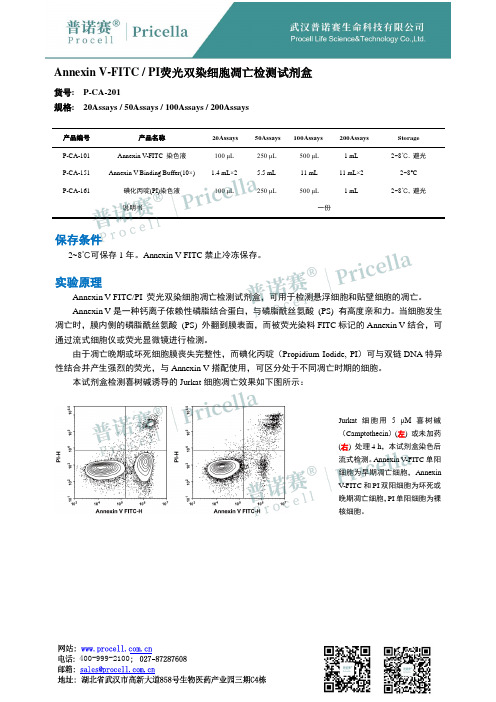
Annexin V-FITC / PI荧光双染细胞凋亡检测试剂盒货号: P-CA-201规格: 20Assays / 50Assays / 100Assays / 200Assays产品编号产品名称20Assays 50Assays 100Assays 200Assays Storage P-CA-101 Annexin V-FITC 染色液100 μL250 μL500 μL 1 mL 2~8℃. 避光P-CA-151 Annexin V Binding Buffer(10×) 1.4 mL×2 5.5 mL 11 mL 11 mL×2 2~8°C 碘化丙啶(PI)染色液P-CA-161 100 μL250 μL500 μL 1 mL 2~8℃, 避光说明书一份保存条件2~8℃可保存1年。
Annexin V-FITC禁止冷冻保存。
实验原理Annexin V-FITC/PI 荧光双染细胞凋亡检测试剂盒,可用于检测悬浮细胞和贴壁细胞的凋亡。
Annexin V是一种钙离子依赖性磷脂结合蛋白,与磷脂酰丝氨酸(PS) 有高度亲和力。
当细胞发生凋亡时,膜内侧的磷脂酰丝氨酸(PS) 外翻到膜表面,而被荧光染料FITC标记的Annexin V结合,可通过流式细胞仪或荧光显微镜进行检测。
由于凋亡晚期或坏死细胞膜丧失完整性,而碘化丙啶(Propidium Iodide, PI)可与双链DNA特异性结合并产生强烈的荧光,与Annexin V搭配使用,可区分处于不同凋亡时期的细胞。
本试剂盒检测喜树碱诱导的Jurkat细胞凋亡效果如下图所示:Jurkat细胞用 5 μM喜树碱(Camptothecin)(左) 或未加药(右) 处理4 h,本试剂盒染色后流式检测。
Annexin V-FITC单阳细胞为早期凋亡细胞,AnnexinV-FITC和PI双阳细胞为坏死或晚期凋亡细胞,PI单阳细胞为裸核细胞。
免疫荧光实验技术

595~600nm(橙 FITC的衬比染色或双
红色)
标记FAT
四甲基异硫氰酸罗 丹明 (TRITC) 藻红蛋白(PE)
Eu3+螯合物
550nm 490-560nm 340nm
620nm(橙红色) FITC的衬比染色或双 标记FAT
575nm(红色) 双标记FAT、流式细 胞术
613nm
时间分辨荧光免疫测 定
免疫荧光技术实验 封闭,抗体孵育
封闭:目的是为了减少抗体的非特异性结合,最常 用的封闭剂为 BSA, (PBS pH 7.5),其他可选择的封 闭剂还有 1% 凝胶 gelatin, 1% bovine 或与二抗种 属相同的血清(3-10%)等。室温和4℃均可以。
抗体孵育:直接免疫荧光法中的一抗和间接免疫荧 光法中的二抗都是荧光抗体,因此在这些抗体孵育 的时候必须注意避光。此外,为保证结合质量和防 止干燥,抗体孵育应尽量在湿盒中进行。
免疫荧光技术简介:荧光
发射光谱是指固定激发波长,在不同波长下记录的样品发射荧光的强 度。
激发光谱是指固定检测发射波长,用不同波长的激发光激发样品记录 的相应的荧光发射强度。
荧光寿命:荧光物质被激发后所产生的荧光衰减到一定程度时所用的 时间。
荧光淬灭:荧光物质在某些理化因素作用下,发射荧光减弱甚至消退 称为荧光淬灭。如紫外线照射、高温(≥20℃)、苯胺、酚、硝基苯、 I-等 。
荧光显微镜
Chance Favors Only the Prepared Mind.
免疫荧光技术简介:抗体
抗体(Antibody):抗体指机体的免疫系统在抗原刺 激下,由B淋巴细胞或记忆细胞增殖分化成的浆细胞 所产生的、可与相应抗原发生特异性结合的免疫球 蛋白。主要分布在血清中,也分布于组织液及外分 泌液中。
FITC

FITC异硫氰酸荧光素(fluorescein isothiocyanate, FITC) FITC纯品为黄色或橙黄色结晶粉末,易溶于水和酒精溶剂。
有两种异构体,其中异构体Ⅰ型在效率、稳定性与蛋白质结合力等方面都更优良。
FITC分子量为389.4,最大吸收光波长为490~495nm,最大发射光波长为520~530nm,呈现明亮的黄绿色荧光。
FITC在冷暗干燥处可保存多年,是目前应用最广泛的荧光素。
其主要优点是人眼对黄绿色较为敏感,通常切片标本中的绿色荧光少于红色。
当FITC在碱性溶液中与抗体蛋白反应时,主要是蛋白质上赖氨酸的R氨基与荧光素的硫碳胺键(thiocarbmide)结合,形成FITC-蛋白质结合物,即荧光抗体或荧光结合物。
一个IgG 分子中有86个赖氨酸残基,一般最多能结合15~20个,一个IgG分子可结合2~8个分子的FITC,其反应式如下FITC-N=C=S + N-H2-蛋白质→FITC-NS-C-N-H2-蛋白质在荧光灯源紫外线或兰紫光激发下产生黄绿色荧光,通过在荧光显微镜下观察或流式细胞仪分析可对相应抗原进行定性、定位或定量的检测。
Fluorescein isothiocyanate (FITC) is a derivative of fluorescein used in wide-ranging applications including flow cytometry. FITC is the original fluorescein molecule functionalized with an isothiocyanate reactive group (-N=C=S), replacing a hydrogen atom on the bottom ring of the structure. This derivative is reactive towards nucleophiles including amine and sulfhydryl groups on proteins.A succinimidyl-ester functional group attached to the fluorescein core, creating NHS-fluorescein, forms another common amine reactive derivative that has much greater specificity toward primary amines in the presence of other nucleophiles.FITC has excitation and emission spectrum peak wavelengths of approximately 495 nm/521 nm. Like most fluorochromes, it is prone to photobleaching. Because of the problem with photobleaching, derivatives of fluorescein such as Alexa 488 and DyLight 488 have been tailored for various chemical and biological applications where greater photostability, higher fluorescence intensity, or different attachment groups are needed.操作步骤将纯化的IgG抗体对PH9~9.5碳酸盐缓冲液透析过夜,透析后抗体液移入小烧杯中↓称取适量IFTC,加入二甲亚砜(DMSO)(FITC~1mg/1ml DMSO)使终浓度为1mgFITC/1mlDMSOFITC/IgG比例:如IgG浓度为1mg/ml,FITC/IgG比例约为50μgFITC/mgIgG;如IgG为5~10mg/ml,则比例为25μgFITC/ml IgG在10ml小烧杯中先放入抗体↓按上述比例将FITC-DMSO溶液逐滴加入透析后的抗体溶液中↓将标记物用PBS加至2.5ml,磁力搅拌器室温下避光搅拌2h↓用PD10柱(Sephadex G25柱)除去游离荧光素,先用25ml PBS淋洗G25柱↓收集PBS洗脱第一个荧光素结合蛋白峰,测定F/P比值。
fitc的激发波长和发射波长

fitc的激发波长和发射波长
FluoresceinIsothiocyanate,简称FITC,是一种应用于免疫检测的有机染料。
它常被用来标记荧光免疫检测试剂,是一种全色谱增强剂和荧光检测增敏剂。
FITC,以其独特的荧光特性而闻名。
它在一定的激发波长和发射波长下发出荧光来。
FITC的激发波长在498-533nm之间,它的发射波长在500-546nm 之间,波长宽度约为20-30nm。
FITC因其特殊的光谱特性,而被广泛应用于免疫检测技术,特别是荧光免疫检测技术。
FITC作为指示剂,它能够产生很强的荧光信号来检测抗原,而不受其他物质的干扰。
FITC的激发波长在498至533nm之间,具体分别为498、500、502、504、512、522、533nm,其中498nm是最常用的。
FITC发射波长一般在500至546nm之间,具体分别为500、502、512、522、530、546nm,其中522nm最常用。
FITC的激发波长决定了它的荧光强度,发射波长却决定了它的灵敏度。
FITC在免疫检测技术中,可用于检测抗原和抗体。
与其他荧光探针比较,FITC具有更耐热和耐腐蚀的特点。
同时,FITC还具有良好的黏附性能,可附着在一些微小的实体物质上,例如金纳米粒子或者纳米纤维。
因此,FITC还可以用于构建一些纳米荧光探针。
FITC的激发波长和发射波长特性,在免疫检测技术中发挥着重要作用。
这种染料几乎在所有免疫检测实验中都有着广泛的应用。
同时,FITC也被用于构建一些纳米荧光探针,用于跟踪一些细胞位移。
因此,FITC的激发波长和发射波长是非常重要的。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
FITC 免疫荧光检测试剂盒(小鼠)
FITC Immunofluorescence Detection Kit (Mouse)
产品编号:E670005
包装规格:100 Tests/300 Tests 产品简介
免疫荧光检测试剂盒系列用于细胞或组织切片的免疫荧光染色。
在有适当的一抗检测特定的目标蛋白时,就可以使用免疫荧光检测试剂盒检测到红色、绿色或蓝色等荧光。
本试剂盒含有FITC 标记的驴抗小鼠IgG (H+L) 抗体,可以用于检测小鼠来源的相应一抗,在荧光显微镜或激光共聚焦显微镜下可以观察到鲜艳的绿色。
FITC 是一种常用的绿色荧光探针。
FITC 的吸收(激发)和发射峰分别为492 nm 和520 nm 。
产品特点
1. 本试剂盒含有抗荧光淬灭封片液,可以使荧光更加持久。
2. 操作简便,灵敏度高。
保存条件
驴抗小鼠FITC 标记二抗和抗荧光淬灭封片液-20°C 避光保存,其它试剂2-8°C 保存,保质期12个月。
试剂盒组成 组分
100 Tests 300 Tests 试剂 A 封闭液 (Blocking Solution)
10 mL 30 mL 试剂 B 驴抗小鼠FITC 标记二抗 (FITC Conjugated Donkey Anti-Mouse IgG)
100 μL 300 μL 试剂 C 免疫荧光染色二抗稀释液 (Secondary Antibody Dilution Buffer For IF Staining) 30 mL 90 mL 试剂 D 抗荧光淬灭封片液 (Anti-Fade Mounting Medium)
3 mL
10 mL 操作步骤
A. 免疫荧光染色的准备工作
荧光标记二抗的稀释:将荧光标记的二抗按照1:50-200的比例用本试剂盒提供的免疫荧光染色二抗稀释液进行稀释。
根据荧光的强弱,其稀释比例可以适当地提高或降低。
B. 贴壁细胞
1. 细胞爬片,PBST 洗3次,每次5 min 。
2. 加入1 mL 预冷的固定液,室温固定10 min 或更长时间。
3. PBST 洗3次,每次5 min 。
4. 0.1-0.5%Triton X-100室温通透10-15 min 。
5. PBST 洗3次,每次5 min 。
6. 封闭液室温封闭30-45 min 。
7. 一抗室温孵育60 min ,为增强与一抗的结合,建议4°C 孵育过夜,次日室温孵育60 min 。
8. PBST 洗4次,每次5 min 。
s a
n g
o n
b
i o t
e c
h
9. 加入50 μL 稀释的荧光标记的二抗,避光孵育45-60 min 。
10. PBST 洗3次,每次5 min ,期间适当注意避光操作。
11. 如有需要可进行DAPI 或Hoechst 复染细胞核。
12. 抗荧光淬灭封片液封片,指甲油密封盖玻片。
13. 荧光显微镜下可以观察到绿色的荧光。
C. 悬浮细胞
1. 离心收集细胞样品于1.5 mL 离心管中,去掉上清后轻轻弹散细胞。
2. 加入0.5 mL 固定液,混悬细胞,固定10 min 或更长时间。
3. 离心去除固定液,PBST 洗3次,每次5 min 。
4. 0.1-0.5%Triton X-100室温通透10-15 min 。
5. PBST 洗3次,每次5 min 。
6. 最后一次离心后吸除大部分液体并保留50 μL 液体,再缓缓悬起细胞,滴加至防脱载玻片上,尽量使细胞分布均匀。
7. 稍晾干,使细胞贴在载玻片上不易随液体流动。
8. 封闭液室温封闭30-45 min 。
9. 一抗室温孵育60 min ,为增强与一抗的结合,建议4°C 孵育过夜,次日室温孵育60 min 。
10. PBST 洗4次,每次5 min 。
11. 加入50 μL 稀释的荧光标记的二抗,避光孵育45-60 min 。
12. PBST 洗3次,每次5 min ,期间适当注意避光操作。
13. 如有需要可进行DAPI 或Hoechst 复染细胞核。
14. 抗荧光淬灭封片液封片,指甲油密封盖玻片。
15. 荧光显微镜下可以观察到绿色的荧光。
D. 冰冻切片
1. 用固定液固定10 min 或更长时间。
2. PBST 洗3次,每次5 min 。
3. 封闭液室温封闭30-45 min 。
4. 一抗室温孵育60 min ,为增强与一抗的结合,可以4°C 孵育过夜,次日室温孵育60 min 。
5. PBST 洗4次,每次5 min 。
6. 加入50 μL 稀释的荧光标记的二抗,避光孵育45-60 min 。
7. PBST 洗3次,每次5 min ,期间适当注意避光操作。
8. 如有需要可进行DAPI 或Hoechst 复染细胞核。
9. 抗荧光淬灭封片液封片,指甲油密封盖玻片。
10. 荧光显微镜下可以观察到绿色的荧光。
E. 石蜡切片
1. 切片常规脱蜡至水。
2. 根据每一种抗体的要求,对组织进行相应的抗原修复,也可选用本公司生产的抗原修复液。
3. PBST 洗3次,每次5 min 。
4. 封闭液室温封闭30-45 min 。
5. 一抗室温孵育60 min ,为增强与一抗的结合,可以4°C 孵育过夜,次日室温孵育60 min 。
6. PBST 洗4次,每次5 min 。
7. 加入50 μL 稀释的荧光标记的二抗,避光孵育45-60 min 。
8. PBST 洗3次,每次5 min ,期间适当注意避光操作。
9. 如有需要可进行DAPI 或Hoechst 复染细胞核。
10. 抗荧光淬灭封片液封片,指甲油密封盖玻片。
s a
n g
o n
b
i o t
e c
h
11. 荧光显微镜下可以观察到绿色的荧光。
注意事项
1. 荧光物质均易发生淬灭,染色后需尽快进行荧光显微镜下的观察。
如果不能及时观察可以4°C 避光保存,但随着存放时
间的延长可能会导致观察效果越来越差。
2. 如果观察时发现荧光过弱,可以适当提高一抗的浓度或适当提高荧光标记抗体的浓度。
3. 为了您的安全和健康,请穿实验服并戴一次性手套操作。
s a
n g
o n
b
i o t
e c
h。
