国家食品药品监督管理局令第22号-医疗器械生产企业质量体系考核办法
医疗器械生产企业质量体系考核办法局令第号

医疗器械生产企业质量体系考核办法局令第号为了加强对医疗器械生产企业质量体系的管理与监督,提高医疗器械的质量安全水平,根据《医疗器械监督管理条例》的相关规定,制定本办法。
第一条适用范围本办法适用于所有从事医疗器械生产经营活动的企业、机构、个人。
第二条考核内容医疗器械生产企业质量体系的考核内容包括但不限于以下几个方面:1. 质量管理体系建立与实施情况1.1 编制和完善操作规程,确保质量管理体系的正常运行;1.2 设立质量管理部门,明确责任和职责;1.3 建立质量控制点和质量风险管理机制。
2. 生产设备与条件2.1 确保生产设备的正常运行,定期进行维护和检修;2.2 生产车间符合相关的卫生、安全和环境要求;2.3 引进先进的生产设备和工艺,提高生产效率和产品质量。
3. 原材料采购与管理3.1 原材料的采购应符合国家相关法律法规和标准要求;3.2 建立原材料供应商评估机制,确保原材料的质量符合要求;3.3 建立原材料入库管理制度,确保原材料的追溯能力和安全性。
4. 产品质量控制4.1 按照国家规定的标准进行产品质量检验和控制;4.2 建立严格的产品质量记录和档案管理制度;4.3 提高产品检验的效率和准确性,确保产品的合格率。
5. 售后服务与用户反馈5.1 建立健全的售后服务体系,及时处理用户的投诉和问题;5.2 定期进行用户满意度调查,改进产品和服务质量。
第三条考核方法考核方法主要包括下列几种形式,可根据具体情况选择使用:1. 检查抽查企业的相关文件和记录,检查各项质量管理制度和操作规程的执行情况。
2. 现场调查对企业的生产车间、实验室等场所进行实地考察,了解设施设备的使用和维护情况。
3. 抽样检验从企业的产品批次中随机抽取样品进行质量检验,评估产品的合格率和质量稳定性。
4. 用户满意度调查通过问卷调查等形式,了解用户对企业产品和服务的满意度,及时改进不足之处。
第四条考核结果与评定根据考核内容和方法,综合评定医疗器械生产企业质量体系的合格程度,可分为优秀、合格、基本合格和不合格四个等级。
上海医疗器械生产企业二类医疗器械生产申请须知

上海医疗器械生产企业二类医疗器械生产申请须知一、申办项目:II类医疗器械产品注册(非医疗器械体外诊断试剂类产品,首次申报)。
二、办理法律依据:1、国务院第276号令《医疗器械监督管理条例》。
2、国家食品药品监督管理局第16号令《医疗器械注册管理办法》。
3、国家食品药品监督管理局第10号令《医疗器械说明书、标签和包装标识管理规定》。
4、国家食品药品监督管理局第5号令《医疗器械临床试验规定》。
5、国家药品监督管理局第15号令《医疗器械分类规则》。
6、国家药品监督管理局第22号令《医疗器械生产企业质量体系考核办法》。
7、国家药品监督管理局“关于印发《医疗器械分类目录》的通知”(国药监械[2002]302号)。
三、申请对象:本市医疗器械生产企业。
>>医疗器械是指:单独或者组合使用于人体的仪器、设备、器具、材料或者其他物品,包括所需要的软件;其用于人体体表及体内的作用不是用药理学、免疫学或者代谢的手段获得,但是可能有这些手段参与并起一定的辅助作用。
>>二类医疗器械使用旨在达到下列预期目的:1、对疾病的预防、诊断、治疗、监护、缓解;2、对损伤或者残疾的诊断、治疗、监护、缓解、补偿;3、对解剖或者生理过程的研究、替代、调节;4、妊娠控制。
四、申请者所需条件:1、申报注册的产品已经列入《医疗器械分类目录》(或者符合上述医疗器械定义及《医疗器械分类规则》)。
2、申请者应取得医疗器械生产企业资格证明:营业执照及医疗器械生产企业许可证或登记表,并且所申请产品应当在生产企业许可证或登记表核定的生产范围之内。
3、办理医疗器械注册申请事务的人员应当受生产企业委托,并具有相应的专业知识,熟悉医疗器械注册管理的法律、法规、规章和技术要求。
五、申办程序:1、请登陆上海市食品药品监督管理局行政许可申请平台。
2、向上海市食品药品监督管理局受理中心提交所有准备齐全的II类医疗器械准产注册申报资料,内容包括:(1)、申请表。
医疗器械质量管理体系考核自查表

医疗器械质量管理体系考核自查表
为了帮助我市医疗器械生产企业切实开展质量管理体系的内部审核工作,促进企业质量管理的水平不断提高,依据《医疗器械生产企业质量体系考核办法》(局令第22号)及质量管理体系的相关标准制定了本自查表,以供相关生产企业参考使用。
注:
1.本申请表仅供企业申请质量管理体系考核前自查使用,且申报体系考核时无需提交,但可作为现场考核的参考资料。
2.企业应根据申请考核产品的特点和体系运行的情况,切实开展自查工作,并落实改正自查中发现的问题。
3.本自查表中的“检查项目”对应22号令中自查表的项目;“建议自查项目及内容”为建议的自查项目、内容及具体要求,但是并不局限于此。
4.“▲”、“■”对应《医疗器械生产企业质量体系考核办法》(局令第22号)中的重点考核项目。
企业基本情况
医疗器械生产企业质量管理体系考核自查表。
医疗器械基础知识培训

《医疗器械标准管理办 法》(2017年2月21 日国家食品药品监督管 理总局令第33号,自 2017年7月1日起施行)
三、医疗器械的分类
国家对医疗器械按照风险程度实行分类管理。 第一类是风险程度低,实行常规管理可以保证其安全、有效的医疗器械。 例如:手术器械的大部分、听诊器、医用X线胶片、医用X线防护装置、全
查看企业生产资料时,看程序文件、作业指导书是否受控、有效、齐全,是 否能指导企业产品的生产,表达是否清晰、完整,企业是否按程序文件或工 艺文件控制产品的生产过程,是否进行修订及完善;看原始生产记录是否真 实、齐全、规范,并通过生产记录看企业是否按照工艺流程进行生产并记录; 必要时可对应产品的批次进行抽查;
202X
医疗器械基础 知识培训
单击此处添加副标题
一、医疗器械的定义
医疗器械是指单独或者组合使用于人体的仪器、设备、器具、材料或者其他物品,包括所需要 的软件;其用于人体体表及体内的作用不是用物理学、免疫学或者代谢的手段获得,但是可能 有这些手段参与并起一定的辅助作用;其使用指在达到下列预期目的:
1. 对疾病的预防、诊断、治疗、监护、缓解; 2. 对损伤或者残疾的诊断、治疗、监护、缓解、补偿; 3. 生理结构或者生理过程的检验、替代、调节或者支持; 4. 妊娠控制。 5. 通过对来自人体的样本进行检查,为医疗或者诊断目的提供信息。
02
03 经 营 第 一 类 医 疗 器 械 , 不
需要许可和备案。
经营第二类医疗器械,实 行备案管理。由经营企业 向所在地设区的市级人名 政府食品药品监督管理部 门备案,填写第二类医疗 器械经营备案变,并提交 其符合上述规定条件的证 明资料,取得医疗器械经 营备案凭证。
七、经营医疗器械产品需具备的资质
医疗器械法规及标准清单2023.11.29
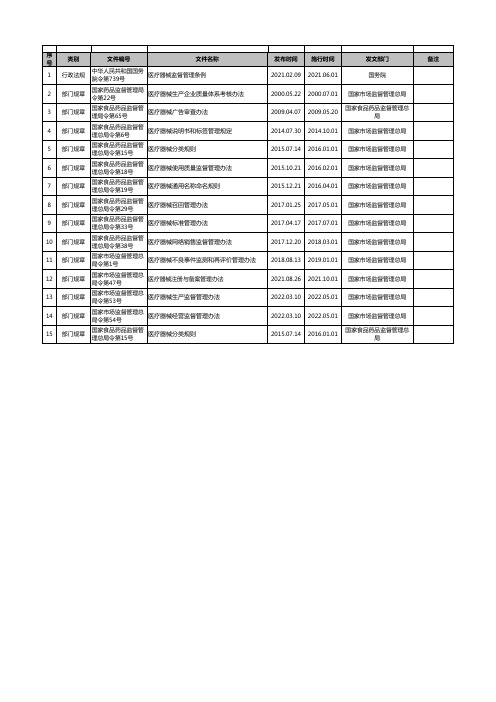
14
部门规章
国家市场监督管理总 局令第54号
医疗器械经营监督管理办法
15
部门规章
国家食品药品监督管 理总局令第15号
医疗器械分类规则
发布时间 施行时间 2021.02.09 2021.06.01
发文部门 国务院
2000.05.22 2000.07.01 国家市场监督管理总局
2009.04.07
2009.05.20
2022.03.10 2022.05.01 国家市场监督管理总局
2015.07.14
2016.01.01
国家食品药品监督管理总 局
备注
医疗器械标准管理办法
10
部门规章
国家食品药品监督管 理总局令第38号
医疗器械网络销售监督管理办法
11
部门规章
国家市场监督管理总 局令第1号
医疗器械不良事件监测和再评价管理办法
12
部门规章
国家市场监督管理总 局令第47号
医疗器械注册与备案管理办法
13
部门规章
国家市场监督管理总 局令第53号
医疗器械生产监督管理办法
序 号
类别
文件编号
文件名称
1
行政法规
中华人民共和国国务 院令第739号
医疗器械监督管理条例
2
部门规章
国家药品监督管理局 令第22号
医疗器械生产企业质量体系考核办法
3
部门规章
国家食品药品监督管 理局令第65号
医疗器械广告审查办法
4
部门规章
国家食品药品监督管 理总局令第6号
医疗器械说明书和标签管理规定
5
国家食品药品监督管理总 局
2014.07.30 2014.10.01 国家市场监督管理总局
医疗器械生产企业质量体系考核培训教材PPT课件

11
考核结论判定为“通过考核”的, 对质量体系的评价和存在不合格项要如 实陈述,对不合格项给出整改期限。考 核结论为“整改后复核”的,以“考核 报告”的签署日起,企业必须在半年内 完成整改并申请复核。
质量体系考核报告有效期四年。
12
几点说明:
1、企业资格认定与质量体系考核 企业资格认定与质量体系考核的区别 (见下表)
17
二、质量管理体系文件的内容
18
质量管理体系文件一般包括:
A)形成文件的质量方针和质量目标 B)质量手册
C)标准所要求的形成文件的程序。GB/T 19001标准要求至少应包括6个程序文件:而作 为医疗器械专用要求YY/T 0287-2003标准要
涉及21个程序文件。
19
控制程序文件
❖ 1、文件控制 ❖ 2、记录控制 ❖ 3、管理评审控制 ❖ 4、人力资源控制 ❖ 5、基础设施控制 ❖ 6、工作环境控制 ❖ 7、与顾客有关的控制 ❖ 8、设计与开发控制
7
(六)办理程序:
企业:1、填写自查表 2、提出申请
省局对自查表审核
省局现场考核
通过考核
整改后复核
半年内完成整改并 申请复核
出具质量 体系考核报告
8
企业申请人应按《医疗器械生产企业质量 体系考核办法》的要求及参照GB/T19001和 YY/T0287标准建立起质量管理体系并有效地 运行。在申请考核前应按《质量体系考核企业 自查表》进行认真自查,填写自查表和自查小 结,自查合格后方能提出质量体系考核申请。 国家已经实施生产实施细则的产品,应在申请 考核前按相应实施细则要求进行自查。
13
企业资格认定
质量体系考核
依
据
医疗器械生产监督管理办法
上海市医疗器械生产企业质量体系考核申请须知

上海市医疗器械生产企业质量体系考核申请须知一、办事项目:医疗器械生产企业质量体系考核。
二、办事依据:(一)国务院第`276号令《医疗器械监督管理条例》第十九条、第二十一条。
(二)国家药品监督管理局第22号令《医疗器械生产企业质量体系考核办法》。
(三)国家食品药品监督管理局第16号令《医疗器械注册管理办法》。
三、申请范围:本市辖区内申请第二、三类医疗器械注册和重新注册的企业。
四、办理程序:申请医疗器械质量体系考核(包括实施生产实施细则的)按以下程序办理:(一)、申请1、申请人应按《医疗器械生产企业质量体系考核办法》的要求及参照GB/T19001和YY/T0287标准建立起质量保证体系并有效地运行。
在申请考核前应按《质量体系考核企业自查表》进行认真自查,填写自查表和自查小结,自查合格后方能提出质量体系考核申请。
国家已经实施生产实施细则的产品,应在申请考核前按相应实施细则要求进行自查。
申请时应提交以下资料:1)《医疗器械生产企业质量体系考核申请书》(附质量体系考核企业自查表)(二类产品一式二份,三类产品一式三份);注:多个产品同时申报质量体系考核需提交申请书的份数为:申报产品数加2份。
2)适用的产品标准及说明(各一份);3)(重新注册)产品注册证书复印件(各一份)。
2、凡符合《医疗器械生产企业质量体系考核办法》第二条规定要求豁免现场考核的企业,除提交上述资料外还应提出书面申请,填写《关于豁免质量体系现场考核的申请报告》,并提交有关证明材料(质量体系认证证书或质量体系考核报告)。
(二)、受理和审查1、市食品药品监管局收到申请后,经形式审查,对申请材料不齐全或者不符合形式审查要求的,在5个工作日内发给申请人《补正材料通知书》。
2、申请材料齐全,符合形式审查要求的,或者申请人按照要求提交全部补正申请材料的,予以受理。
3、市食品药品监管局自受理之日起30个工作日内,按照有关规定对申报资料进行审查,在资料审查后组织现场考核或确认豁免现场考核。
【中心】医疗器械相关法规汇总

【关键字】中心一、主要注册法规《医疗器械标准管理办法》(试行)(局令第31号)2002年1月4日发布,2002年5月1日实施.cn/WS01/CL0270/24469.html《境内第三类和进口医疗器械注册文件受理标准》(国药监械[2002]18号)2002年1月22日发布并实施.cn/WS01/CL0270/9381.html关于执行《医疗器械标准管理办法》有关事项的通知(国药监械[2002]223号)2002年7月2日发布并实施.cn/WS01/CL0270/9382.html《关于发布医疗器械注册产品标准编写规范的通知》(国药监械[2002]407号)2002年11月7日发布并实施.cn/WS01/CL0270/9811.html《医疗器械临床试验规定》(国家食品药品监督管理局第5号令)2004年1月17日发布,2004年4月1日实施.cn/WS01/CL0270/24475.html《关于医疗器械产品注册后说明书更改备案有关事项的公告》(国食药监械[2004]55号)2004年3月11日发布并实施.cn/WS01/CL0270/10263.html国家食品药品监督管理局第10号令《医疗器械说明书、标签和包装标识管理规定》2004年7月8日发布并实施.cn/WS01/CL0270/24517.html《医疗器械注册管理办法》(国家食品药品监督管理局第16号令)2004年8月9日发布并实施.cn/WS01/CL0270/25844.html关于向生产企业提供境内第三类、境外医疗器械注册产品标准副本有关操作程序的通知(食药监械函[2005]42号)2005年7月5日发布并实施.cn/WS01/CL0055/10432.html关于《医疗器械注册管理办法》重新注册有关问题的解释意见(国食药监械[2006]284号)2006年6月26日发布并实施.cn/WS01/CL0270/10568.html《医疗器械产品注册技术咨询管理规范》2007年3月26日发布并实施.cn/CL0098/153.html《医疗器械注册证书纠错-技术审评环节管理规范》2007年3月26日发布并实施.cn/CL0098/27.html《医疗器械说明书备案审查规范》2007年4月30日发布并实施.cn/CL0098/151.html《关于印发医疗器械生物学评价和审查指南的通知》(国食药监械[2007]345号)2007年6月15日发布并实施.cn/WS01/CL0270/10708.html《关于医疗器械注册证书变更申请有关事项的通知》(国食药监械[2007]778号)2007年12月25日发布并实施.cn/WS01/CL0270/27326.html关于执行GB 9706.1-2007《医用电气设备第一部分:安全通用要求》有关事项的通知(国食药监械[2008]314号)2008年6月26日发布,2008年7月1日实施.cn/WS01/CL0270/30867.html关于印发进一步加强和规范医疗器械注册管理暂行规定的通知(国食药监械[2008]409号)2008年7月23日发布并实施.cn/WS01/CL0270/31612.html《关于清理医疗器械注册管理文件有关问题的通知》(国食药监械[2008]518号)2008年9月16日发布并实施.cn/WS01/CL0270/32830.html《关于境外医疗器械标签和包装标识有关问题的通知》(国食药监械[2008]634号)2008年11月3日发布并实施.cn/WS01/CL0270/33922.html《执行《关于进一步加强和规范医疗器械注册管理的暂行规定》中涉及重新注册产品注册申报资料的说明》2009年2月23日发布并实施.cn/CL0111/698.html《医疗器械技术审评中心关于无源植入性医疗器械产品注册申报若干技术问题的说明》2009年7月30日发布并实施.cn/CL0013/846.html《医疗器械技术审评中心主审集体负责制实施办法》2009年11月19日发布并实施.cn/CL0098/970.html《医疗器械技术审评中心内部联合审评管理规范》2009年11月19日发布并实施.cn/CL0098/972.html《医疗器械技术审评中心专家咨询管理规范》2009年11月19日发布并实施.cn/CL0098/974.html《医疗器械技术审评补充资料管理规范》2009年11月19日发布并实施.cn/CL0098/975.html《对医疗器械注册申请提出退审意见的管理规范》2009年11月19日发布并实施.cn/CL0098/976.html《关于医疗器械注册有关事宜的公告》(国家食品药品监督管理局公告2009年第82号)2009年12月26日发布并实施.cn/CL0013/1001.html《关于印发无源植入性和动物源性医疗器械注册申报资料指导原则的通知》(食药监办械函[2009]519号)2009年12月30日发布并实施.cn/WS01/CL0055/44961.html《关于2006年医疗器械注册证书延期事宜的通知》(食药监办械[2010]32号)2010年4月12日发布并实施.cn/WS01/CL0055/48114.html《关于医疗器械到期重新注册和变更重新注册后提交原医疗器械注册证书原件的公告》(第59号)2010年5月5日发布并实施.cn/WS01/CL0068/48517.html关于启用“医疗器械(体外诊断试剂)注册电子申报软件2010“的公告(第64号)2010年7月15日发布(2010年8月16日实施).cn/WS01/CL0068/51244.html《关于印发医疗器械注册复审程序(试行)的通知》(食药监办械[2010]92号)发布并实施《关于印发医疗器械检测机构开展医疗器械产品标准预评价工作规定(试行)的通知》(食药监办械[2010]133号)发布并实施二、针对特定产品的注册文件《关于禁止从发生疯牛病的国家或地区进口和销售含有牛羊组织细胞的医疗器械产品的公告》(国药监械[2002]112号)发布并实施《关于含有牛、羊源性材料医疗器械注册有关事宜的公告》(国食药监械[2006]407号)发布并实施关于印发《一次性使用麻醉穿刺包生产实施细则》的通知(国药监械[2002]472号)发布,实施关于印发《外科植入物生产实施细则》的通知(国药监械[2002]473号)发布,实施《关于硅橡胶充填式人工乳房产品注册有关问题的通知》(国食药监械[2007]203号)发布并实施《关于印发X射线诊断设备等6个医疗器械产品注册技术审查指导原则的通知》(食药监办械函[2009]95号)发布并实施《关于印发B型超声诊断设备(第二类)和多参数患者监护设备(第二类)医疗器械产品注册技术审查指导原则的通知》(食药监办械函[2009]231号)发布并实施《关于规范口腔义齿生产监督管理的通知》(国药监械[2002]323号)发布并实施《关于印发定制式义齿注册暂行规定的通知》(国食药监械[2003]365号)发布并实施《关于加强定制式义齿生产监管的通知》(国食药监械[2009]336号)发布并实施《关于药械组合产品注册有关事宜的通告》(国食药监械[2009]第16号)发布并实施关于印发医疗器械生产质量管理规范无菌医疗器械实施细则和检查评定标准(试行)的通知(国食药监械[2009]835号)发布,实施关于印发医疗器械生产质量管理规范植入性医疗器械实施细则和检查评定标准(试行)的通知(国食药监械[2009]836号)发布,实施关于加强定制式义齿注册产品标准管理的通知(食药监办械[2010]28号)发布并实施关于公布《角膜接触镜类产品注册申报资料基本要求》的通知发布并实施关于公布《介入类医疗器械产品化学性能要求的说明》的通知发布,实施关于发布植入式心脏起搏器等三个医疗器械产品注册技术审查指导原则的通知(植入式心脏起搏器、医用X射线诊断设备(第三类)、影像型超声诊断设备(第三类)(食药监办械函[2010]279号)发布并实施关于发布自测用血糖监测系统注册申报资料指导原则的通知(食药监办械函[2010]438号)发布并实施关于定制式义齿执行国家标准和行业标准有关问题的通知(食药监办械函[2010]432号)发布并实施三、针对特定产品的其它文件《关于规范磁疗和含药医疗器械产品监督管理的通知》(国药监械[2002]286号)发布并实施关于器官保存液有关问题的复函(国药监械函[2002]83号)发布并实施《关于用医用脱脂棉医用脱脂纱布加工的后续产品类别判定的批复》(国药监械[2002]379号)发布并实施《关于设备吊臂等不作为医疗器械管理的通知》(国药监械[2002]406号)发布并实施关于转发《一次性使用塑料血袋》等4项国家标准第1号修改单的通知(国药监械[2003]102号)发布,实施关于发布YY 0330-2001《医用脱脂棉》等2项医疗器械行业标准第1号修改单的通知(国药监械[2003]101号)发布,实施《关于印发高强超声聚焦治疗机有关技术要求的通知》(国食药监械[2003]222号)发布并实施关于发布YY 1116-2002《可吸收性外科缝线》行业标准第1号修改单的通知(国食药监械[2003]356号)发布并实施关于发布医疗器械行业标准YY 1036-2004《压陷式眼压计》勘误单的通知发布,实施关于医用透明质酸钠产品管理类别的公告(国家食品药品监督管理局公告第81号)发布并实施四、其它国家法规(非注册直接参照法规,但与注册相关)《医疗器械监督管理条例》(国务院第276号令)发布,实施《医疗器械生产监督管理办法》(局令第12号)发布并实施关于执行《医疗器械生产监督管理办法》有关问题的通知(国食药监械[2004]498号)发布并实施《医疗器械生产企业质量体系考核办法》(国家药品监督管理局第22号令)发布,实施《关于医疗器械生产企业跨省兼并有关问题的批复》(国食药监械函[2009]68号)发布并实施《医疗器械分类规则》(国家药品监督管理局第15号令)发布,实施国家药品监督管理局《医疗器械分类目录》(国药监械[2002]302号)发布并实施《关于修改医疗器械注册证编号的通知》(国食药监械[2003]98号)发布,实施家食品药品监督管理局药物临床试验机构资格认定公告第1号第2号第3号第4号第5号第6号第7号第8号第9号第10号第11号第12号第13号第14号第15号第16号第17号第18号第19号第20号第21号第22号第23号第24号此文档是由网络收集并进行重新排版整理.word可编辑版本!。
医疗器械生产企业质量管理体系考核程序

医疗器械生产企业质量管理体系考核程序发布时间:2011—09-29项目名称:医疗器械生产企业质量管理体系考核程序编号:京药监备—26(械)办理机关:北京市药品监督管理局[委托北京市药品监督管理局医疗器械技术审评中心(以下简称市器审中心)]依据:1. 《医疗器械监督管理条例》(中华人民共和国国务院令第276号)2。
《医疗器械生产监督管理办法》(国家药品监督管理局令第12号第三十六条)3. 《医疗器械注册管理办法》(国家食品药品监督管理局令第16号附件三第十条、附件五第八条)4。
《医疗器械生产企业质量体系考核办法》(国家药品监督管理局令第22号)收费标准:不收费期限:自接收材料之日起55个工作日(不含送达期限)适用范围:医疗器械生产企业质量管理体系考核程序由市药监局办理。
(本程序不适用于体外诊断试剂产品、无菌医疗器械产品和植入性医疗器械产品)办理程序:申请医疗器械质量体系检查的基本条件:1. 企业应按照国家局医疗器械生产质量管理规范的要求建立质量管理体系,并运行至少3个月以上;2。
通过试运行,已完成生产设备、生产工艺、洁净车间等相关验证、确认工作;3. 已完成产品设计验证,并取得由法定检测机构出具的医疗器械产品注册检验报告;4. 已经完成产品的设计确认,如需要进行临床试验应已经完成临床试验;5. 已对照有关要求完成自查、整改.一、申请与接收企业登陆北京市药品监督管理局企业服务平台进行网上填报,并依据受理范围的规定提交以下申请材料:1。
《医疗器械生产企业质量体系考核申请书》(一式两份)(填表说明)申请企业填交的《医疗器械生产企业质量体系考核申请书》(以下简称《申请书》)所填写项目应齐全、准确,填写内容应符合以下要求:(1)申请考核企业应按照要求如实填写,并对所填写内容的真实性负责。
除法定代表人需亲笔签名外,所有内容应当打印。
(2)申请企业应当在封面加盖公章。
(3)质量管理体系考核所覆盖的产品应逐一注明,申请多种产品可附表并加盖公章。
医疗器械监管知识介绍

二、医疗器械监管法律法规体系
法规 《条例》
部门规章
规范性文件
法规:《医疗器械监督管理条例》(2014年3月7日国务 院令第650号公布,自2014年6月1日起施行 ) 部门规章: (一)注册: 1、《医疗器械注册管理办法》(国家食品药品监督管 理总局局令第4号,自2014年10月1日施行) 2、《体外诊断试剂注册管理办法》(国家食品药品监 督管理总局局令第5号,自2014年10月1日施行) 3、《医疗器械新产品审批规定(试行)》(2000年4月10 日国家药品监督管理局令第17号发布,自2000年4月20日起 施行) (二)生产: 1、《医疗器械生产监督管理办法》(国家食品药品监督管 理总局局令第7号,自2014年10月1日施行)
《医疗器械监督管理条例》于2000年颁布施行, 十多年来,随着我国医疗器械产业发展变化,其不适 合行业发展新变化的情况突出,业界要求修订的呼声强 烈。 2006年,原国家食品药品监管局启动修订工作,先 后组织开展数十项课题研究,广泛听取各方意见,认真研 究、修改。 2008年3月向国务院法制办上报送审稿。随后,积 极配合国务院法制办,反复研究、协调、论证、修改,形 成了《医疗器械监督管理条例(修订草案)》。
第二阶段:文化大革命后期至改革开放初期 行业特点: 保持计划经济体制,工业生产有一定规模。 (都为国有企业),医疗器械品种和数量增多,质量 问题凸显; 管理方式: 行政管理为主,提出消灭无标产品原则,制定了大 量医疗器械国家、行业标准和企业标准,开展行业质量 大检查(执行标准情况),开展优质产品评比(依据标 准):一等品、二等品、质量金奖、银奖等。同样没有处 罚、吊证等市场监管措施。政企不分,责任界限不分。
医疗器械监管知识介绍
前言
医疗器械作为食品药品监管部门“四品一械” 监管职能的重要组成部分,同人们的生活联系日 益密切,小到家庭使用的温度计、避孕套 ,大到 医院使用的CT机、手术床等大型设备都属于医疗 器械的范围。随着经济社会的发展人们对医疗器 械需求在增加、要求在提高,这对我们的监管也 提出了更高的要求,因此作为食品药品监管系统 的干部了解、掌握一定的器械知识是非常必要的。
国内医疗器械法律法规

第二部分:医疗器械基础知识
法规文件
医疗器械分类规则
医疗器械分类目录
医疗器械分类规则
第五条 医疗器械分类判定的依据 (一)医疗器械结构特征 医疗器械的结构特征分为:有源医疗器械和无源医疗器 械。 (二)医疗器械使用形式 根据不同的预期目的,将医疗器械归入一定的使用形式。 其中: 1.无源器械的使用形式有:药液输送保存器械;改变血 液、体液器械;医用敷料;外科器械;重复使用外科器械; 一次性无菌器械;植入器械;避孕和计划生育器械;消毒清 洁器械;护理器械、体外诊断试剂、其他无源接触或无源辅 助器械等。
2.有源器械的使用形式有:能量治疗器械;诊断监护器械; 输送体液器械;电离辐射器械;实验室仪器设备、医疗消毒 设备;其他有源器械或有源辅助设备等。
医疗器械分类规则
(三)医疗器械使用状态 根据使用中对人体产生损伤的可能性、对医疗效果的影 响,医疗器械使用状况可分为接触或进入人体器械和非接触 人体器械,具体可分为: 1.接触或进入人体器械 (1)使用时限分为:暂时使用;短期使用;长期使用。 (2)接触人体的部位分为:皮肤或腔道;创伤或体内组 织;血液循环系统或中枢神经系统。 (3)有源器械失控后造成的损伤程度分为:轻微损伤; 损伤;严重损伤。 2.非接触人体器械 对医疗效果的影响,其程度分为:基本不影响;有间接 影响;有重要影响。
医疗器械广告审查发布标准
(四)在向个人推荐使用的医疗器械广告中,利用消费者缺乏 医疗器械专业、技术知识和经验的弱点,使用超出产品注册 证明文件以外的专业化术语或不科学的用语描述该产品的特 征或作用机理; (五)含有无法证实其科学性的所谓“研究发现”、“实验或 数据证明”等方面的内容; (六)违反科学规律,明示或暗示包治百病、适应所有症状的; (七)含有“安全”、“无毒副作用”、“无效退款”、“无 依赖”、“保险公司承保”等承诺性用语,含有“唯一”、 “精确”、“最新技术”、“最先进科学”、“国家级产 品”、“填补国内空白”等绝对化或排他性的用语; (八)声称或暗示该医疗器械为正常生活或治疗病症所必须等 内容的; (九)含有明示或暗示该医疗器械能应付现代紧张生活或升学、 考试的需要,能帮助改善或提高成绩,能使精力旺盛、增强 竞争力、能增高、能益智等内容。
医疗器械生产质量管理规范培训

第二章 机构与人员
第九条
企业应当配备与生产产品相 适应的专业技术人员、管理 人员和操作人员,具有相应 的质量检验机构或者专职检 验人员。
1.5.1应当配备与生产产品相适应 的专业技术人员、管理人员和操作 人员。 *1.5.2应当具有相应的质量检验机 构或专职检验人员。
医疗器械生产质量管理规范
• 强调了独立机构的设立与专职人员的设置。 • 知识点: • 专职检验人员一般应有任命书,并不得兼职生产、采购等
岗位。
• 案例:生产互检或义齿检头道工序
第二章 机构与人员
第十条
从事影响产品质量工作的人
理的实践经验,有能力对生
产管理和质量管理中的实际
问题作出正确的判断和处理。
医疗器械生产质量管理规范
• 关注生产、技术、质量管理部门。 • 关注知识背景与实际经验——能力。 • 生产、技术和质量管理部门负责人的任职条件,应明确相
关人员的专业知识水平、工作技能、工作经历等要求。 • 知识点: • 人力资源的管理一般应明确人员的任职资格、考核、评价
医疗器械生产质量管理规范
• 1、管代任命书应由最高管理者任命。 • 2、管代职责和权限。 • 知识点: • 一般应指定管理层中的一员为管理者代表。最高管理者与
管代可为同一人。
• 案例:主、副管代
第二章 机构与人员
第八条
技术、生产和质量管理部门 的负责人应当熟悉医疗器械 相关法律法规,具有质量管
1.4.1技术、生产、质量管理部门 负责人应当熟悉医疗器械法律法规, 具有质量管理的实践经验,应当有 能力对生产管理和质量管理中实际 问题作出正确判断和处理。
医疗器械生产质量管理规范培训
上海市医疗器械生产企业管理者代表登记报备申请须知

上海市医疗器械生产企业管理者代表登记报备申请须知保护视力色:【字体:大中小】一、办事依据:(一)《医疗器械生产企业质量体系考核办法》(国家食品药品监督管理局第22号局长令);(二)《医疗器械生产质量管理规范(试行)》(国食药监械〔2009〕833号)(三)《上海市医疗器械生产企业管理者代表管理暂行办法》(沪食药监法〔2013〕111号)。
二.办理程序:(一)本市第二、三类医疗器械生产企业应当按照《上海市医疗器械生产企业管理者代表管理暂行办法》的要求,确定管理者代表人选。
管理者代表经企业负责人任命后15个工作日内(新开办企业在取得许可证后的30个工作日内),应将登记信息上报行政许可申请信息平台(),其中管理者代表身份证/护照、学历/职称证书、内审员/外审员培训合格证明、管理者代表授权书的扫描件应一并上传至平台(不需要递交纸质申请)。
(二)企业生产地址所在区(县)食品药品监督管理分局根据《上海市医疗器械生产企业管理者代表管理暂行办法》的要求,在10个工作日内对管理者代表报备信息进行网上预审。
1、未通过网上预审的,分局应告知理由,企业补正后需重新递交网上申请;2、通过网上预审后,企业应生成、打印《上海市医疗器械生产企业管理者代表登记表》(一式两份,正反打印或骑缝盖章,一份交所在地分局,一份企业留存),经法定代表人签字后提交至生产地址所在区(县)分局报备(不需要递交管理者代表资质证明材料的复印件)。
(三)区(县)分局收到企业递交的《上海市医疗器械生产企业管理者代表登记表》后,应审核书面登记表和网上报备信息的一致性。
如登记报备材料符合要求,应当场打印登记报备告知书(一式两份,一份交企业,一份分局留存),盖章后交给企业。
三、办理机构:企业生产地址所在区(县)食品药品监督管理分局。
四、受理部门:企业生产地址所在区(县)食品药品监督管理分局。
五、收费标准:本项目不收费。
六、下载表格:(一)《医疗器械生产企业管理者代表授权书》;(二)《上海市医疗器械生产企业管理者代表登记表》;(三)《上海市医疗器械生产企业管理者代表登记报备指南》。
医疗器械生产企业质量体系考核办法局令第号

医疗器械生产企业质量体系考核办法局令第号医疗器械是现代医疗领域的重要组成部分,对于保障医疗安全和提高医疗质量起着至关重要的作用。
医疗器械生产企业的质量体系是保障医疗器械质量安全的重要环节。
为了规范医疗器械生产企业的质量体系建设和监管,亟需制定医疗器械生产企业质量体系考核办法。
现根据有关法律法规,我局制定了《医疗器械生产企业质量体系考核办法》,特制订如下:第一章总则第一条根据《医疗器械监督管理办法》等相关法律法规的规定,为了加强对医疗器械生产企业质量体系建设的监督和管理,提高医疗器械质量安全水平,特制定本办法。
第二条本办法适用于境内所有从事医疗器械生产的企业。
第三条医疗器械生产企业质量体系考核是指对医疗器械生产企业质量体系运行状态进行评估和监测的过程,旨在确保企业质量体系符合相关法规要求,并不断进行持续改进。
第四条质量体系考核结果将作为医疗器械生产企业申请注册和备案的重要依据,对未通过考核的企业将暂停或撤销生产许可证,严肃追究相关法律责任。
第二章考核内容和方法第五条考核内容包括以下几方面:质量管理体系、设备管理体系、人员培训和资质管理、产品质量控制体系、不合格品管理体系、质量记录和档案管理体系等。
第六条考核方法主要包括定期抽查、现场检查和会议审查等方式。
具体考核方法由监管部门根据实际情况灵活选择,并提前通知企业,企业应积极配合。
第七条考核组由监管部门组织,考核组成员需具备相关知识和经验,对企业的质量体系建设具有专业能力。
第八条考核结果采用等级制度评定,根据企业质量体系建设情况,分为优秀、良好、合格和不合格四个等级。
考核结果将直接影响企业的生产许可证申请和备案申请。
第三章考核程序和要求第九条考核是定期进行的,具体考核频率由监管部门根据医疗器械的风险等级和企业的生产规模进行确定。
一般情况下,低风险的企业每3年进行一次考核,中风险的企业每2年进行一次考核,高风险的企业每年进行一次考核。
第十条考核前,企业应对自身的质量体系进行全面自查,确保符合相关要求。
医疗器械质量管理体系简介

一、医疗器械的概述(一)医疗器械的定义制造商的预期用途是为下列一个或多个特定目的用于人类的,不论单独使用或组合使用的仪器、设备、器具、机器、用具、植入物、体外试剂或校准物、软件、材料或者其他相似或相关物品。
这些目的是:Ø 疾病的诊断、预防、监护、治疗或者缓解;Ø 损伤的诊断、监护、治疗、缓解或者补偿;Ø 解剖或生理过程的研究、替代、调节或者支持;Ø 支持或维持生命;Ø 妊娠控制;Ø 医疗器械的消毒;Ø 通过对取自人体的样本进行体外检查的方式来提供医疗信息;其作用于人体体表或体内的主要设计作用不是用药理学、免疫学或代谢的手段获得,但可能有这些手段参与并起一定辅助作用。
(二)医疗器械的分类1)有源医疗器械:任何依靠电能或其他能源而不是直接由人体或重力产生的能源来发挥其功能的医疗器械。
(能源的种类:电能、核能、射线能、超声波能、电磁波能、热能等)2)植入性医疗器械:任何通过外科手段来达到下列目的的医疗器械:全部或部分插入人体或自然腔口中;或为替代上表皮或眼表面用的并且使其在体内至少留30天,且只能通过内科或外科手段取出。
3)有源植入医疗器械:任何通过外科或内科手段,拟部分或全部插入人体,或通过医疗手段介入自然腔口且拟留在体内的有源医疗器械。
4)无菌医疗器械:旨在满足无菌要求的医疗器械类别。
(三)医疗器械的分类管理我国对医疗器械实行分类管理是根据产品的风险程度,分为Ⅰ类、Ⅱ、类Ⅲ类产品,对不同类别产品采取不同的监督管理办法,不能混淆。
第一类是指:通过常规管理足以保证其安全性、有效性的医疗器械;第二类是指:对其安全性、有效性应当加以控制的医疗器械;第三类是指:植入人体;用于支持、维持生命;对人体具有潜在危险,其安全性、有效性必须严格控制的医疗器械。
注:管理类别查询《医疗器械分类目录》及国家药品食品管理局随时公布的产品分类界定通知。
二、医疗器械质量管理体系用于法规的要求认证用标准:YY/T 0287-2003 idt ISO 13485:2003《医疗器械质量管理体系用于法规的要求》GB/T 19001-2000 idt ISO 9001:2000 (企业申请时)其他相关法律法规及标准。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
医疗器械生产企业质量体系考核办法(局令第22号)《医疗器械生产企业质量体系考核办法》于2000年4月29日经国家药品监督管理局局务会审议通过,现予发布,自2000年7月1日起施行。
二○○○年五月二十二日医疗器械生产企业质量体系考核办法第一条为加强医疗器械管理,强化企业质量控制,保证病患者的人身安全,根据《医疗器械监督管理条例》,制定本办法。
第二条本办法适用于申请第二类、第三类医疗器械准产注册企业的审查及对企业的定期审查。
下列情况可视同已通过企业质量体系考核:(一)企业获得国务院药品监督管理部门认可的质量认证机构颁发的GB/T19001和YY/T0287(或GB/T19002和YY/T0288)标准的质量体系认证证书,证书在有效期内的。
(二)已实施工业产品生产许可证的产品,其证书在有效期内的。
(三)已实施产品安全认证,企业持有的产品安全认证证书在有效期内的。
第三条申请第二、三类医疗器械生产企业质量体系考核,均由所在地省、自治区、直辖市药品监督管理部门受理并组织考核。
国家规定的部分三类医疗器械,由所在地省、自治区、直辖市药品监督管理部门受理后,报国家药品监督管理局,由国家药品监督管理局组织考核。
部分三类医疗器械目录由国家药品监督管理局确定并公布。
质量体系的考核,可委托下一级药品监督管理部门或具有相应资格的第三方机构进行。
质量体系考核结果由委托方负责。
第四条企业在申请产品准产注册前,应填写《医疗器械生产企业质量体系考核申请书》(见附件1),向省级以上药品监督管理部门提出企业质量体系考核申请。
国家规定的部分三类医疗器械的质量体系考核,企业提出质量体系考核申请的同时,向国家药品监督管理局提交被考核产品的《质量保证手册》和《程序文件》。
其它产品的质量体系考核,企业提出质量体系考核申请前,应按《质量体系考核企业自查表》(见附件1的附表)进行自查,填写自查表。
自查表填写内容应如实、准确,以备现场考核时查验。
第五条对二类医疗器械,省、自治区、直辖市药品监督管理部门应对企业填写的《质量体系考核企业自查表》和提供的相关资料进行审核,经审核后签署意见,必要时可对申请企业进行现场查验。
对三类医疗器械,按本办法第三条执行后,质量体系考核申请和考核报告(见附件1、2)应在国家药品监督管理局备案正本(原件)一份。
第六条考核人员至少应有一人经贯彻GB/T19001和YY/T0287标准的培训,并取得内审员或外审员的资格;考核人员至少由二人组成;确定的考核人员与被考核的企业应无经济利益联系。
第七条质量体系现场考核,参照质量体系认证审核的方法;依据附件1自查表确定的内容进行考核,重点考核项目及判定规则为:┌────┬──────────┬───────────────┐│产品类别│重点考核项目│考核结论│├────┼──────────┼───────────────┤││四.1、2│1.重点考核项目全部合格,其它││├──────────┤考核项目不符合项不超过五项, ││三│五.1、3│判定为通过考核。
││├──────────┤2.重点考核项目有不合格,其它│││六.1、2、3│考核项目不符合项超过五项,││├──────────┤判定为整改后复核。
│││七.1、2、3、9、10│││├──────────┤││类│八.1、2、6、7、8│││├──────────┤│││九.2、3、4、5││├────┼──────────┼───────────────┤││四.1│1.重点考核项目全部合格,其它││├──────────┤考核项目不符合项不超过五项,││二│五、1、3│判定为通过考核。
││├──────────┤2.重点考核项目有不合格,其它│││六.1│考核项目不符合项超过五项,││├──────────┤判定为整改后复核。
│││七.1、2│││├──────────┤││类│八.1、6、8│││├──────────┤│││九.2、3、4││└────┴──────────┴───────────────┘考核结论判定为“通过考核”的,对质量体系的评价和存在不合格项要如实陈述,对不合格项给出整改期限。
不能如期完成整改的应作为“整改后复核”处理。
第八条考核结论为“整改后复核”的,以“考核报告”的签署日起,企业必须在半年内完成整改并申请复核,逾期将取消申请准产注册资格。
第九条企业产品质量体系考核以“考核报告”通过的签署日为准,其有效期为四年;在有效期内企业申请同类产品准产注册,不再进行考核(药品监督管理部门另有规定的除外)。
企业应定期进行质量体系自查,自查结果应按《质量体系考核企业自查表》的规定进行记录、归档。
省、自治区、直辖市药品监督管理部门定期对企业进行体系审查。
第十条企业通过质量体系考核后,不按规定进行自查、不按质量体系要求组织生产的,经核实,由所在地省、自治区、直辖市药品监督管理部门予以警告,并限期整改。
第十一条本办法由国家药品监督管理局负责解释。
第十二条本办法自2000年7月1日起施行。
(附件1)“医疗器械生产企业质量体系考核申请书”(附)“质量体系考核企业自查表”(附件2)“医疗器械生产企业质量体系考核报告”[ 附件1]医疗器械生产企业质量体系考核申请书本企业根据《医疗器械监督管理条例》中医疗器械注册管理办法要求,准备办理:产品准产注册;现已按《医疗器械生产企业质量体系考核办法》做了准备,进行了质量体系自查,并保证填报内容真实,现申请质量体系考核。
附《质量体系考核企业自查表》一份。
(企业名称,法人代表签字) ______.______.______.____年__月__日(企业盖章)质量体系考核企业自查表一、企业基本情况二、按照GB/T19000系列标准建立健全企业质量体系计划1.是否准备按GB/T19001(或GB/T19002);YY/T0287(或YY/T0288)标准建立健全本企业质量体系?是□否□2.企业打算在____年申请质量体系认证。
或尚无计划。
3.企业有______人接受了GB/T19000系列标准及YY/T0288标准的培训。
取得内审员证书的有______ 人。
4.企业通过质量体系认证的困难是:费用问题□;无人指导□;管理水平低□;认识不够□;迫切性不大□三、本次申请注册产品名称和报告适用范围申请注册产品名称:___________________________。
本报告覆盖产品范围及名称:_______________________ 。
四、企业质量管理职责1.与质量有关的管理、执行、验证工作人员是否规定了质量职责并形成文件。
有□无□2.企业的管理者代表是________ 。
或未指定□3.能否提供企业质量体系组织结构图。
能□否□4.企业是否收集并保存与生产、经营有关的法律、法规、行政规章,各级质量标准。
是□否□5.企业法人代表或管理者代表是否经过了GB/T19000及YY/T0287标准的培训。
是□否□五、设计控制1.企业是否建立并保持设计控制和验证的形成文件的程序或相应要求。
是□否□2.在设计过程中是否进行了风险分析是□否□3.是否建立并保存了该产品的全部技术规范和应用的技术文件(包括产品技术文件清单)是□否□4.是否保存了试产注册后该产品设计修改的记录。
是□否□六、采购控制1.是否建立并保持控制采购过程的形成文件的程序。
是□否□2. 是否建立了申请准产注册产品主要采购内容清单,并确定了合格分承包方。
是□否□3.该产品的采购资料是否清楚、明确、齐全。
是□否□七、过程控制1.是否确定了申请准产注册产品的关键过程和特殊过程(工序)并制定了相应的控制文件或作业指导书。
是□否□2.无菌医疗器械是否按照《无菌医疗器械生产管理规范》组织生产。
是□否□3.该产品所需的设备、工装、检验仪表是否具备,并能满足产品制造过程的要求。
是□否□4.参加该产品的施工制造人员是否具备相应资格或经过针对性的培训。
是□否□5.是否确定了该产品过程检验的内容、规程和记录。
是□否□6. 是否对该产品要求的作业环境,产品清洁作出规定。
是□否□7. 是否建立了用于该产品安装、查验的技术资料和接受准则。
是□否□8. 是否规定了过程控制中应形成的记录。
是□否□9. 是否对该产品的可追溯性范围和程度进行了确定。
(材料、元件、过程和去向)。
是□否□10、现场能否看到产品标识(包括最终产品的标签)及检验试验状态的标识。
是□否□八、产品检验和试验1. 是否设有专职的检验试验机构,并规定了其职责和权限。
对有源医疗器械和植入性医疗器械是否记录了检验人员身份。
是□否□2. 是否建立了进行检验和试验,形成文件的程序。
是□否□3. 是否进行进货检验和验证。
是□否□列出进货检验和验证规程、名称_________________________________________________________________________________。
4. 是否进行过程检验。
是□否□列出过程检验的检验规程、名称___________________________________________________________________________________。
5. 最终产品的检验试验是否覆盖了该产品的技术标准全部出厂检验项目。
是□否□6. 上述检验试验记录及最近一次型式试验报告是否保存。
是□否□7. 企业有无相应的测试设备。
是□否□8. 企业是否建立并实施了对检验、测量和试验设备进行控制、校准和维护的规定文件。
是□否□九、其它方面1. 企业是否定期对产品质量及质量管理工作进行审核,评审和评价。
是□否□2. 是否保留了前款评价活动的记录。
是□否□3. 是否对不合格品如何评价处理作出规定。
是□否□4. 是否按一定程序处理顾客投诉并保留记录。
是□否□5. 有无实施纠正和预防措施的规定文件。
是□否□十、省级主管部门对企业自查结果的审核意见:年月日(主管部门盖章)[ 附件2 ]医疗器械生产企业质量体系考核报告一、考核组成员二、被考核方主要现场人员三、考核日期:__________________四、考核结论和建议1)对企业质量体系的基本评价。
2)对主要不合格内容的陈述。
3)考核结论(建议通过考核,建议整改后复核)。
4)考核组长签字日期五、企业法人代表意见企业法人代表签字 ________日期________。
