北大中级无机化学有机金属化学共48页文档
2024版年度《北京大学有机化学》ppt课件

2024/2/2
31
THANKS
感谢观看
2024/2/2
32
14
酚
酚的分类与命名
根据羟基所连苯环的不同,酚可 分为一元酚和多元酚等。
2024/2/2
酚的物理性质
多数酚为无色或淡黄色晶体,具有 特殊气味,微溶于水,易溶于有机 溶剂。
酚的化学性质
酚分子中的羟基和苯环相互影响, 使得酚具有一些特殊的化学性质, 如酸性、氧化反应等。
15
醚
醚的分类与命名
根据醚键两端所连基团的不同,醚可分为单醚、混醚等。
实例与应用
乙炔是常见的炔烃之一,广泛应用于 焊接、切割、照明等领域。
10
芳香烃
定义与通式
结构特点
芳香烃是由苯环或稠环结构组成的烃类化合 物。
芳香烃分子中含有苯环或稠环结构,具有特 殊的稳定性和芳香性。
性质与反应
实例与应用
芳香烃的化学性质较为特殊,可以发生取代、 加成、氧化等多种反应,但反应条件较为苛 刻。
机溶剂。
卤代烃的化学性质
03
卤代烃中的卤素原子较为活泼,可发生取代反应、消除反应等。
13
醇
醇的分类与命名
根据羟基所连碳原子的不 同,醇可分为伯醇、仲醇、 叔醇等。
2024/2/2
醇的物理性质
多数醇为无色液体,具有 特殊气味,可溶于水,也 可溶于有机溶剂。
醇的化学性质
醇分子中的羟基具有亲核 性,可发生氧化反应、酯 化反应等。
遵守实验室规章制度,尊重实验数据,不抄袭、不造假,保持诚信 和实事求是的科学精神。
29
实验操作规范与安全注意事项
1
实验前准备
熟悉实验步骤和操作规程,检查实验仪器和试剂 是否齐全、完好,做好个人防护措施。
中级无机化学

CCl4难水解,是因C的价轨道已用于成键且又没有孤电子对之故。 NF3的分子结构与NCl3同,其中N原子也是采用sp3杂化轨道成键,其上有一对孤 对电子。然而, 1 由于F原子的电负性较大,使得NF3的碱性(给电子性)比NCl3小,因而亲电水解 很难发生; 2 由于N是第二周期元素,只有4条价轨道(没有d轨道),不可能有空轨道接受水 的亲核进攻; 3 N-F键的键能比N-Cl键的键能大,不容易断裂。 这些原因决定了NF3不会发生水解作用。
第一章 原子、分子及元素周期性
第一节 原子结构理论概述 第二节 原子参数及元素周期性 第三节 共价键理论概述 第四节 键参数与分子构型 第五节 分子对称性与点群 第六节 单质的性质及其周期性递变规律 第七节 主族元素化合物的周期性性质 以上七节主要自学,要求掌握: 1 用徐光宪的改进的Slater规则计算电子的屏蔽常数 2 了解电负性的几种标度,理解环境对电负性的影响和基 团电负性的概念 3 键参数 价层电子对互斥理论 分子对称性知识 4 单质及其化合物的一些性质的周期性变化规律 同时,还要特别注意 5 掌握周期反常现象的几种表现形式及合理解释
习题:1,2,3,4,6,7,8,10,11,12,13,15,17
原子所带电荷
电负性与电荷的关系可用式 χ = a + b 表示。 式中为分子中原子所带的部分电荷。a、b为两个 参数。其意义是: a表示中性原子的电负性(中性原 子=0), b为电荷参数,表示电负性随电荷而改变 的变化率。大的、易极化的原子有较小的b值; 小 的、难以极化的原子b值较大。
分子
是
是 D∞h i i? 否 C∞v
直线型 ?
是
否 两个或多个 Cn(n≥3) ?
否 Cn ? 否 ζ?
T,Th,Td,O,Oh 是
2024版北京大学有机化学ppt课件[1]
![2024版北京大学有机化学ppt课件[1]](https://img.taocdn.com/s3/m/ea51b34b0640be1e650e52ea551810a6f524c8cb.png)
含氧官能团的保护与脱保护
阐述在有机合成中如何对含氧官能团 进行保护和脱保护,以实现复杂有机 分子的合成。
14
04
含氮有机化合物
2024/1/2915源自胺类化合物结构和性质胺类化合物的结构特点
包括伯胺、仲胺和叔胺的结构特征, 以及它们与氨分子的结构差异。
胺类化合物的物理性质
胺类化合物的化学性质
阐述胺类化合物的碱性、亲核性、氧 化还原性以及它们的特征反应,如酰 化反应、烷基化反应等。
炔烃 含有碳碳三键的链状烃类化合物。具有不饱和性,可发生 加成、聚合等反应。性质较为活泼,可与多种物质发生反 应。
8
芳香烃及其衍生物
芳香烃
含有苯环的烃类化合物,如苯、甲苯、二甲苯等。具有特殊的芳香气味和稳定 的化学性质。
芳香烃衍生物
以芳香烃为母体,通过取代反应引入其他官能团的化合物,如硝基苯、苯酚、 苯胺等。具有多样化的化学性质和广泛的应用领域。
2024/1/29
13
含氧官能团转化反应及合成策略
醇与醛、酮的转化 讲解醇氧化成醛或酮的反应条件及机 理,以及醛或酮还原成醇的方法。
酚与醚的转化
阐述酚羟基化合成醚的反应条件及机 理,以及醚裂解生成酚的方法。
2024/1/29
羧酸及其衍生物的转化
介绍羧酸及其衍生物之间的转化反应, 如酯化反应、酰胺化反应等,并讲解 其合成策略。
6
02
烃类化合物
2024/1/29
7
烷烃、烯烃、炔烃等结构和性质
2024/1/29
烷烃 由碳和氢元素组成,分子中只含有单键的链状烃类化合物。 根据碳原子数不同,可分为甲烷、乙烷、丙烷等。具有饱 和性、稳定性,不易发生化学反应。
烯烃 含有碳碳双键的链状烃类化合物。根据双键位置不同,可 分为α-烯烃、β-烯烃等。具有不饱和性,可发生加成、氧 化等反应。
北京大学无机化学PPT课件

第12页/共32页
二 金属原子簇
1. HNCC(High Nuclear Carbonyl Cluster )
Wade 规 则 : M(CO)3 与 BH ( 或 CH ) 的 等 瓣 关 系 , (2n+2)、 (2n+4)、(2n+6)骨架电子数规则,
CO2和SiO2; “ PO33 – ”和SO32 – 是否为等电子体?
H
H
H
H
CH4
H
H H NH3
H H
OH2
H FH
第1页/共32页
2. 等瓣(等叶片)相似
R. Hoffmann, (Nobel Lecture, 1982) “Building Bridges between Inorganic and Organic Chemistry”
一.等瓣(isolobal) 相似
1. 等电子(isoelectronic)原理: 电子数相等 N2, CO, CN –, NO+ (10e) CH4, NH3, OH2, FH (8e) NO3 –, CO32 –, BO33 – (24e) ClO3 –, SO32 – (26e) SiO44– , PO43–, SO42–, ClO4– (32e)
(n为金属原子数)
14n+2 14n+4 14n+6 14n+8
第16页/共32页
高价过渡金属卤化物(硫化物)原子簇
M6X8
或 [ M6(3-X)8 ]
Mo6Cl84+ Mo6S84–
Mo(II) 簇电子数: 4×6 = 24e
Mo—Mo间的电子数: 24/12(棱)=2 Mo—Mo 单键(2e) ~ 2.60Å
北京大学中级无机化学答案

无机化学习题参考答案(II) 1.4.解:(1)H2O22C(2)S2O32-3vC(3)N2O (N-N-O方式)vC∞(4)Hg2Cl2hD∞(5)H2C=C=CH22dD(6)UOF4C5v(7)BF4-dT(8)SClF54vC(9)反-Pt(NH3)2Cl22hD(10)PtCl3(C2H4)-2vC1.B(CH3)3和BCl3相比,哪一个的Lewis 酸性强,为什么?一般来说,CH3为推电子基团,Cl 为吸电子基团,因此的Lewis 酸性强。
(BCl3易水解;B(CH3)3不溶于水,在空气中易燃)2.BH3和BF3都可和(CH3)2NPF2生成加合物,在一种加合物中,B原子和N相连,另一种则和P相连,绘出两种结构式,并说明形成两种结构的原因。
(该题可参考史启桢等翻译的"无机化学",作者Shriver等,由高教社出版, 其中关于热力学酸度参数的部分,p.190-191; 或者该书的英文原版第5章的相关内容)3. 无水AlCl3可作为傅-克烷基化反应的催化剂, 而吸水后则失效, 原因何在?配位饱和(6配位),失去Lewis酸性4. 吸水后失效的AlCl3有什么方法可以脱水?因为Al3+是典型的硬酸,与氧的亲合力很强,因此实验室不能在HCl,NH4Cl,SOCl2等气氛下加热脱水。
(只能加强热生成 Al2O3后,用高温下用加C和Cl2用还原氯化法制备,这就不是脱水方法了)。
第二章2.1 解:Ni2+ d8组态Pt2+ d8组态第四周期(分裂能小)第六周期(分裂能大)trans cis 四面体构型平面四方形构型(两种构型)只有一种结构(P代表PPh3)2.2 解(1)MA2B4(2)MA3B3trans cis fac(面式) mer(经式)D 4h C 2v C 3v C 2vμ=0 μ≠0 μ≠0 μ≠0μfac >μmer2.3 Co(en)2Cl 2+D 2hC 2 光活异构体 C 2Co(en)2(NH 3)Cl 2+trans cis Co(en)(NH 3)2Cl 2+trans(1) trans(2) cis 2.4 Co(en)33+Ru(bipy)32+手性分子D 3D 3PtCl(dien)+dien HNCH 2CH 2CH 2NH 2NH 2CH 2基本上为平面分子,无手性2.5 (1) 分别用BaCl 2溶液滴入,有白色沉液出现的为[Co(NH 3)5Br]SO 4,或分别加入AgNO 3溶液,产生浅黄色沉淀的为[Co(NH 3)5SO 4]Br 。
北京大学无机化学课件

第一章 酸碱化学
1. 元素在周期表中的酸碱性 2. 酸碱质子理论和酸碱概念的相对性 3. Lewis酸碱 4. 软硬酸碱
1.元素在周期表中的酸碱性
元素周期表中酸性和碱性元素的分布区域
第一过渡系金属的氧化态和酸性的关系
2. 酸碱概念的相对性
醋酸为碱: CH3COOH +H2SO4 CH3COOH2+ HSO4 醋酸为酸: CH3COOH + H2O H3O + CH3COO
EDTA
配位数(coordination number,CN )和配位点
Ag(NH3)2+ CN=2, Cu(CN)2- CN=?
Zn(EDTA)2- CN=6,
配位数 化学计量比 配位数 配体数
二.常见的配体
1. 单齿配体(monodentate ligands)
F、Cl、Br、I、
NH3 、NR3 、PR3、PPh3、P(OR)3,
多齿配体
-OOC -OOC
NCH2CH2N
COOCOO-
六齿配体 EDTA
L
N
N
Co
O
O
四齿配体
二水杨醛缩乙二 胺合钴Co(Salen)
EDTA配合物的结构
三.配合物的几何构形
❖配位数2 (D∞h ) ❖配位数3 (D3h)
❖配位数4 (D4h和Td 点群) ❖ 配位数5 (D3h和T4v 点群) ❖ 配位数6 (Oh, D4h , D3h , D3d , D2h点群) ❖ 配位数8 (D4d四方反棱柱 , D2d 12面体 )
K2Pt(CN)4.0.3Br.3H2O 配合物(分子导线)
2. 基础研究: 量子化学为基础, 波谱学方法 新型无机化合物的合成, 反应机理, 结构表征
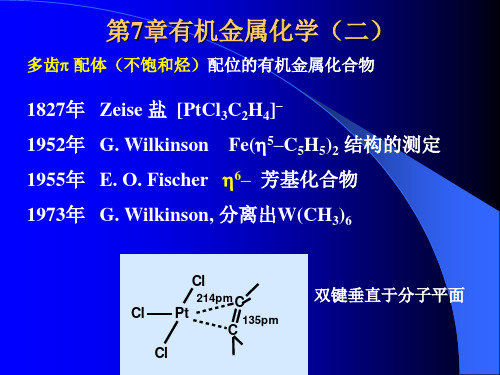
北大中级无机化学有机金属化学(2)
H H H CH 4
H H H N H3 OH2 H H FH H
H
2. 等瓣相似
R. Hoffmann, (Nobel Lecture, 1982) ―Building Bridges between Inorganic and Organic Chemistry‖
练习
写出下列化合物 的结构、总价电子计数和金属原子 的氧化态 1. (5–C5H5)Mn(CO)3 2. (5–C5H5)Mo(CO)2 (3–C3H5) 3. (5–C5H5)2Ta (CH2)(CH3)
Fe(5–C5H5)2
Fluxional ferrocene 转动势垒低,~ 3.8kJ.mol–1
固态:交错型 D5d
气相:重叠型 D5h 室温时不规则,低温为D5
合成方法: C5H6 C5H5–
1) C5H6(二聚体) + Na (THF) C5H5– + Na+ + H2
FeCl2+ NaC5H5(THF, 苯) Fe(5–C5H5)2
Alkylidyne ( CR )次烷基配合物 Carbyne配合物
3电子给体
OM e (O C ) 5 M o= C Ph OC
+
Br CO Mo OC C O C Ph
+
B B r3
CO
+
B B r2 (O M e )
卡宾化合物
卡拜化合物
Carbene 和 Carbyne的配合物
讨论:
1. 烯丙基配合物[PdC3H5Cl]2的结构和总价电子计数,
R2 C M CR
东北大学中级无机化学复习资料

第一章酸碱理论与非水溶液化学>>学习单元1 酸碱概念1、NH4+的共轭碱是(B)。
(A) OH-(B) NH3(C)NH2-(D) NH2-提示:由质子理论定义: NH4+(酸) H++NH3(碱),故选B。
2、在反应BF3 + NH3 F3BNH3中,BF3为(D)。
(A) Arrhenius碱(B) Br nsted酸(C) Lewis碱(D) Lewis酸提示:B具有缺电子性,可以接受孤对电子,故为Lewis酸。
3、根据酸碱的溶剂理论,在液态 SO2体系中的碱是( B )。
(A) SOCl2(B) Na2SO3(C) Na2SO4(D) PCl3 提示:2SO2 SO2+ SO32-,能生成溶剂阴离子的是Na2SO3,故选B。
为什么Fe3+与F-形成的配合物的稳定性大于Fe3+与Cl-形成的配合物的稳定性?酸碱定义:电负性较小的路易斯碱称为软碱;与软碱形成稳定配合物的路易斯酸为软酸。
电负性较大的路易斯碱称为硬碱硬”对应的是小的、高氧化态的粒子,这些粒子都很难被极化。
相反,“软”是指大的,低氧化态的粒子,很容易被极化。
软-软和硬-硬之间的酸碱反应最为稳定。
这个理论在有机化学和无;与硬碱形成稳定配合物的路易斯酸为硬酸。
硬”对应的是小的、高氧化态的粒子,这些粒子硬”对应的是小的、高氧化态的粒子,这些粒子都很难被极化。
相反,“软”是指大的,低氧化态的粒子,很容易被极化。
软-软和硬-硬之间的酸碱反应最为稳定。
这个理论在有机化学和无都很难被极化。
相反,“软”是指大的,低氧化态的粒子,很容易被极化。
软-软和硬-硬之间的酸碱反应最为稳定。
这个理论在有机化学和无机化学均有应用。
酸碱反应实质:硬酸倾向于与硬碱反应(硬亲硬),软酸倾向于软碱反应(软亲软)。
Fe3++6F–=[FeF6]3-(硬-硬)Hg2++4I-=[HgI4]2-(软-软)Fe4++4:Cl–=[FeCl4]–(硬-软),故[FeCl4]–不稳定第一章酸碱理论与非水溶液化学>>学习单元2 酸碱强度一、填空题1、判断相对Lewis碱性(1)(H3Si)2O和(H3C)2O;(2)(H3Si)3N和(H3C)3N ;其中较强的是(1)__(H3C)2O __,(2)__(H3C)3N___。
13-中级无机化学

4-1、 有机金属化合物
4-2、金属羰基和酸配体化合物 4-3、配位催化反应
4-3、配位催化反应
一、过渡金属有机化合物的基本反应
二. 配位催化反应
一、过渡金属有机化合物的基本反应
配体的解离和取代 氧化加成 还原消除 插入和迁移 对配体的亲核反应
1、氧化加成反应(oxidation addition)
均相催化(homogeneous or uniform catalysis)
catalyst starting precursor products A B
催化循环
C
催化反应与非催化反应 的能量关系图
16e
H转移 ,16e
烯烃加成 ,18e
用Co(CO)3H作催化剂由丙烯醇制备丙醛的催化循环 HOCH2CH=CH2 CH3CH2CHO
配体L的大小决定配位数和反应活性
NiL4 NiL3 + L 当L= PPh3时, 溶液中的NiL4全部解离为NiL3
由甲醇(碘甲烷)合成乙酸的催化循环(Monsanto反应) CH3I +CO CH3COI
CH3COI +H2O CH3COOH+HI
乙烯氧化为乙醛的催化循环(Wacker过程)
C2H2+O2+H2O CH3CHO
催化剂
上世纪50年代 德国的Ziegler 发现了乙烯聚合反应的催 化剂TiCl4-AlEt3,催化过程中给出TiCl3 意大利的Natta 完成了丙稀的立体选择性 (stereospecific)聚合
还原消除
Wilkinson’s catalyst : RhCl(PPh3)3
加成
氧化加成
北京大学有机化学课件(2024)

六元杂环化合物
吡啶和嘧啶
含有氮的六元杂环化合物,具有芳香性和弱碱性,是许多药物和生 物活性分子的核心结构。
哒嗪和嘌呤
含有两个氮原子的六元杂环化合物,具有重要的生物功能,如DNA 和RNA的组成成分。
氧杂蒽类化合物
如喹啉、异喹啉等,具有多种生物活性,如抗菌、抗炎等。
2024/1/29
25
生物碱简介
醇、酚、醚具有亲核取代 反应、氧化反应和还原反 应等化学性质。其中,亲 核取代反应是它们最重要 的反应之一,可以生成酯 、卤代烃等化合物。
2024/1/29
14
醛、酮、醌
01
02
03
04
05
醛的分类和命名
酮的分类和命名
醌的分类和命名
醛、酮、醌的物 理性质
醛、酮、醌的化 学性质
醛是羰基与一个烃基和一 个氢原子相连的化合物。 根据羰基所连碳原子的类 型,醛可分为甲醛、伯醛 和仲醛。醛的命名以羰基 为定位基,遵循系统命名 法。
33
分类
按碳骨架分类为开链化合物、碳环化合物和杂环化合物;按 官能团分类为烃类、醇类、酚类、醚类、醛类、酮类、羧酸 类、酯类等。
5
有机化学研究意义
揭示生命现象本质
推动材料科学发展
有机化合物是生命体的基础物质,研究有 机化学有助于揭示生命现象的本质。
有机高分子材料在现代社会中应用广泛, 研究有机化学可以为材料科学的发展提供 理论支持。
促进医药事业发展
探索新能源和环保技术
许多药物都是有机化合物或其衍生物,研 究有机化学可以为药物设计和合成提供思 路和方法。
有机化合物在新能源和环保技术中具有潜在 应用价值,研究有机化学可以为相关领域的 发展提供技术支持。
中级无机化学课件

《中级无机化学》教学大纲英文名称:Intermediate Inorganic Chemistry课程编号:310401课程类型:学科方向课学时:48 学分:3适应对象:化学系高年级本科生先修课程:要求系统学习过大学基础化学课程体系,如化学原理,元素化学,有机化学,仪器分析等,并对生物化学的基础知识有所了解。
建议教材及参考书:1. 《中级无机化学》,项斯芬,姚光庆编著,北京大学出版社,20032. 《中级无机化学》,朱文祥,刘鲁美主编,北京师范大学出版社,19933. 《无机化学新兴领域导论》,项斯芬编著,北京大学出版社,19884. 《中级无机化学》电子教案及讲义稿一、课程的性质、目的和任务中级无机化学面对的是学完了无机化学、分析化学、有机化学和物理化学等基础课的高年级学生,是无机化学的继续与提高,是化学、化工类专业本科生必备的重要专业基础课。
通过本课程的教学,使学生更加全面、更加深入地掌握无机化学原理,了解无机化学的一些新领域、新成就和新知识,提高学生运用现代理论解决实际问题的能力,为更好地学习专业课打下坚实的基础。
二、课程的教学内容及要求绪论(2学时)0.1 无机化学各新兴领域的发展历史,研究意义,学科特点等0.2 课程概述,各组成部分,课程要求,考核方式基本要求:了解无机化学的发展历史;了解无机化学发展的现状和未来发展的可能方向;了解现代无机化学发展的特点。
第1章分子对称性和群论初步(8学时)1.1 对称操作和对称元素1.2 对称性在化学中的应用1.3 群的定义1.4 化学中重要的点群1.5 群的表示1.6 特征标表1.7 群论在杂化轨道理论的应用1.8 群论在振动光谱的应用知识点:对称操作;对称元素;群的定义;群的四个基本特征;重要的分子点群;群的表示;特征标表;群论在杂化轨道理论和振动光谱的应用基本要求:掌握对称操作、对称元素和相应的矩阵表示;掌握群的定义和四个基本特征;掌握重要的分子点群;了解群论在杂化轨道理论和振动光谱的应用重点:对称操作;重要的分子点群第二章配位化学基础和配合物立体化学(4学时)2.1 配位化学基础2.2 配合物的几何构型2.3 配合物的异构现象2.4 配合物的制备方法知识点:配位化合物组成和定义;配合物的几何构型;配合物的异构现象;配合物的制备方法基本要求:复习配位化合物组成和定义;熟悉不同配位数的配位化合物的几何构型;掌握配合物的异构现象;了解配合物的制备方法重点:配合物的几何构型;配合物的异构现象(几何、旋光、键合)第三章配合物的电子结构(6学时)3.1 价键理论3.2 晶体场理论3.3 配位场理论3.4 配合物的电子光谱知识点:价键理论;晶体场理论;分裂能;光谱化学序;配位场理论;三种理论的优缺点;配合物的电子光谱基本要求:复习价键理论和晶体场理论;了解光谱化学序;重点掌握配位场理论和三种理论的优缺点;熟悉分裂能的概念;了解配合物的电子光谱重点:配位场理论;反馈π键;三种理论的优缺点第四章配合物的反应机理和动力学(8学时)4.1 配体取代反应4.2 电子转移反应知识点:八面体和正方形配合物的配体取代反应;配体取代反应的机理(离解机理,缔合机理,交换机理);过渡态理论;配合物的活性与惰性;外界机理;内界机理;双电子转移反应;配体的反位效应基本要求:了解配体取代反应的机理;能熟练判断配合物的活性与惰性;了解八面体配合物、平面正方形配合物的配体取代反应机理;熟悉配体的反位效应概念及其应用重点:配合物的活性与惰性;反位效应第五章有机金属化学(4学时)5.1 概述5.2 金属羰基化合物5.3 金属不饱和烃化合物5.4 金属环多烯化合物5.5 金属卡宾卡拜化合物(自学)知识点:羰基化合物和类羰基化合物;茂夹心型配合物;二苯铬;环辛四烯夹心型化合物;金属卡宾卡拜化合物基本要求:初步掌握过渡金属茂夹心型配合物,二苯铬,环辛四烯夹心型化合物的结构、成键特征;会利用EAN规则来推断羰基簇合物的结构重点:羰基化合物和二茂铁类化合物的化学键和结构特性,以及在催化领域的应用第六章原子簇化学(6学时)6.1 原子簇定义、类型与结构特征6.2金属-金属多重键簇6.3金属簇合物的结构规则6.4 金属簇的反应性能与应用知识点:金属簇的结构特征;金属-金属多重键的形成;金属簇的结构预测的相关理论;金属簇合物在功能材料和生物无机中的应用;过渡金属的羰基簇合物,过渡金属的卤素簇合物基本要求:熟悉金属-金属键多重键重点:金属-金属多重键;EAN规则第七章无机固体化学(4学时)7.1 固体中的化学键(自学)7.2 固体中的缺陷7.3 固溶体7.4无机固体的制备知识点:无限排列固体中的化学键;能带;固体中的缺陷;扩散;非化学整比性;固溶体特征分类;无机固体的制备方法基本要求:复习能带与固体的分类;掌握固体中缺陷的种类和固溶体的特征;会利用固溶体相关知识来指导无机材料的合成重点:点缺陷;固溶体;高温固相反应法第八章生物无机化学(4学时)8.1 概述,生命元素与生物配体8.2 金属蛋白与金属酶8.3 生物膜,离子载体,金属与核酸的作用知识点:宏量与痕量生命元素;生物配体;蛋白质的结构;载氧金属蛋白;金属酶;生物膜;离子载体;金属与核酸的作用基本要求:了解生物体内宏量与痕量生命元素的分布;了解蛋白质的结构;掌握载氧金属蛋白和金属酶;了解生物膜、固氮酶离子载体、金属与核酸的作用重点:载氧金属蛋白与金属酶三、课程教学基本要求1.课堂讲授教学过程以课堂讲授为主,采用板书和幻灯相结合的教学方法,使学生理解本课程的基本内容,尽可能结合学生专业的实例,引导学生运用所学知识解决实际问题。
北京大学中级无机化学答案

无机化学习题参考答案(II)第一章1.4.解:(1)H 2O 22C(2)S 2O 32- 3v C (3)N 2O (N -N -O 方式) v C ∞(4)Hg 2Cl 2h D ∞(5)H 2C=C=CH 2 2d D (6)UOF 4 C 5v (7)BF 4-d T (8)SClF 54v C(9)反-Pt(NH 3)2Cl 22h D(10)PtCl 3(C 2H 4)- 2v C1.B(CH 3)3和BCl 3相比,哪一个的Lewis 酸性强,为什么?一般来说,CH 3为推电子基团,Cl 为吸电子基团,因此的Lewis 酸性强。
(BCl 3易水解;B(CH 3)3不溶于水,在空气中易燃)2.BH 3和BF 3都可和(CH 3)2NPF 2生成加合物,在一种加合物中,B 原子和N 相连,另一种则和P 相连,绘出两种结构式,并说明形成两种结构的原因。
PFFH 3CH 3PF F H 3CH 3B BH 3F 3(该题可参考史启桢等翻译的"无机化学",作者Shriver 等,由高教社出版, 其中关于热力学酸度参数的部分,p.190-191; 或者该书的英文原版第5章的相关内容)3. 无水AlCl 3可作为傅-克烷基化反应的催化剂, 而吸水后则失效, 原因何在? 配位饱和(6配位),失去Lewis 酸性4. 吸水后失效 的AlCl 3有什么方法可以脱水?因为Al 3+是典型的硬酸,与氧的亲合力很强,因此实验室不能在HCl ,NH 4Cl ,SOCl 2等气氛下加热脱水。
(只能加强热生成 Al 2O 3后,用高温下用加C 和Cl 2用还原氯化法制备,这就不是脱水方法了)。
第二章2.1 解:Ni 2+ d 8组态Pt 2+ d 8组态 第四周期(分裂能小)第六周期(分裂能大)P Ni ClP ClClCl P Ptrans cis四面体构型 平面四方形构型(两种构型) 只有一种结构 (P 代表PPh 3)2.2 解 (1)MA 2B 4(2)MA 3B 3M A BB M AA BM AAB M A A Btrans cis fac(面式) mer(经式) D 4h C 2v C 3v C 2v μ=0 μ≠0 μ≠0 μ≠0μfac >μmer2.3 Co(en)2Cl 2+D 2hC 2 光活异构体 C 2Co(en)2(NH 3)Cl 2+33Htrans cisCo(en)(NH3)2Cl2+3Cl333NHNH33trans(1) trans(2)cis2.4 Co(en)33+Ru(bipy)32+手性分子D3D3PtCl(dien)+dienHNCH2CH2CH2NH2NH2CH2基本上为平面分子,无手性2.5 (1) 分别用BaCl2溶液滴入,有白色沉液出现的为[Co(NH3)5Br]SO4,或分别加入AgNO3溶液,产生浅黄色沉淀的为[Co(NH3)5SO4]Br。
2020高中化学竞赛 中等无机化学北大版 引言和基本概念共36张

CCME学生献给北大化学百年的礼物
元素的世界之元素家族 这是一个独特的家族 每个成员都性格各异 虽无长幼尊卑
但却如禁卫军般排列有序
元素的世界之元素档案 掀开尘封的档案
探究元素的奥秘
抓住每一丝线索
追寻隐匿的踪迹
周期表中的化合物类型和 Lewis 酸碱
Cl-, F-, OH-
CO, CH2CH2
原子簇合物在周期表中的分布 (1)
SCN –,
Bases: H–, R –, CN –, I–, CO , SCN –, R 3P, C 6H6, R 2S,
9
10 11 12 13
Cu
Pd Ag Cd
Ir Pt Au Hg Tl
元素周期表中的软酸三角形
硬酸 :碱金属,碱土金属,轻和高价的金属离子
软酸 :重过渡金属离子,低价或零价金属
,HSAB )
硬,软和交界酸和碱结合
的稳定常数
亲石元素:Ca CO 3, Li2CO 3, Ca F 2, TiO2, Zr O2,
亲硫元素 : As2S3 , Hg S, Cu 2S, Cd, Zn, Co, Fe,
Sb, Bi
Hard acids prefer to bind to hard bases, soft acids prefer to bind to soft bases.
transactinide( 锕后元素)的合成
113 和115新元素的报道 (2003-2004 年 ) : 俄国和美国核科学家在回旋加速器中用钙的同位素 48 20 Ca 轰击 24395 Am观察到 4个115号元素, 几十毫秒 后放出? 粒子,得到 113号, 113在1秒后再衰变为其他元素 112号的半衰期为 20微秒,即 0.00002秒 99年劳伦斯实验室关于 118元素的报道,实验不能重复,没有被
《中级无机化学》课件

欢迎大家来到《中级无机化学》的PPT课件!在这里,我们将深入探讨无机化 学的重要概念和原则,帮助您建立牢固的化学基础。
课程概述
本课程将介绍无机化学领域的关键概念,包括元素周期表、化学键、离子和 配合物等。您将了解无机化学在现实世界中的应用和重要性。
课程大纲
1 模块一Байду номын сангаас
元素周期表
2
生全面理解。
通过实验操作,培养学生的实践能力和探索
精神。
3
案例研究
分析和解决真实世界中的无机化学问题,提 高学生的问题解决能力。
教学资源
教材
精心挑选的无机化学教材,包含丰 富的理论知识和实践案例。
实验设备
先进的实验室设备,提供良好的实 验环境。
软件工具
专业化学软件,用于模拟和分析无 机化学反应和结构。
结语
通过这门课程,您将对无机化学有更深入的了解,并掌握在实际应用中运用 所学知识的能力。愿您在这个学习之旅中获得丰富的化学知识!
3 模块三
离子和配合物
2 模块二
化学键和分子结构
4 模块四
反应性和化学平衡
课程目标
深入理解
掌握无机化学基本概念的原理和应用。
实践操作
通过实验和案例研究,加深对无机化学的理解。
团队合作
与同学们合作解决复杂的无机化学问题,培养团队合作能力。
教学方法
1
理论讲解
通过讲解完整的无机化学知识体系,帮助学
实验探索
