转基因动物生物反应器的基因构建与表达
09转基因动物与生物反应器-HXY78页PPT

转基因动物技术路线
外源目的基因的制备 外源目的基因有效导入生殖细胞或胚胎干细胞
选择获得携有目的基因的细胞 选择合适的体外培养系统和宿主动物
转基因细胞胚胎发育及鉴定 筛选所得的转基因动物品系
哺乳动物生殖生理
哺乳动物受精和妊娠,整乳动物的制备方法
显微注射法 逆转录病毒载体感染 胚胎干细胞介导法 精子载体介导法 YAC介导的基因转移
1 显微注射法
雄性原核
显
受精卵
微
注
射
显微注射
法
操
作
胚胎移植
流
程
后定检测
显微注射法的优点
a、转移率较高、整合效率达30%; b、外源基因长度可达50Kb; c、方法简单,导入过程直观;
缺点
a、设备昂贵、操作复杂; b、随机整合、首尾相连的多拷贝; c、常造成插入位点附近宿主DNA大片
段缺失、重组等突变,出现动物严重 生理缺陷; d、外源基因能否稳定整合要到子一代 中筛选得到。
1987年美国科学家戈登(Gordon)等 人首次在小鼠的奶中生产出一种医用蛋 白──tPA(组织型纤溶酶原激活物), 展示了用动物乳腺生产高附加值产品的 可能性。利用动物乳腺生产高价值产品 的方式称为乳腺生物反应器。
微生物反应器 植物反应器 动物反应器
(一) 优点 1可以利用发酵工程 技术大规模生产。 2 胞外活性物质制备 容易。 (二)不足 1哺乳动物或人类的 基因往往不能表达。 有些表达了,却没有 活性,需要进一步修 饰。 2真核生物蛋白质翻 译后加工的精确性有 限。 3需要大型发酵设备 和车间。 4细菌发酵常形成不 溶聚合物,使下游加 工成本增加。
疾病模型
基因转移方法
转导的基因
动物乳腺生物反应器
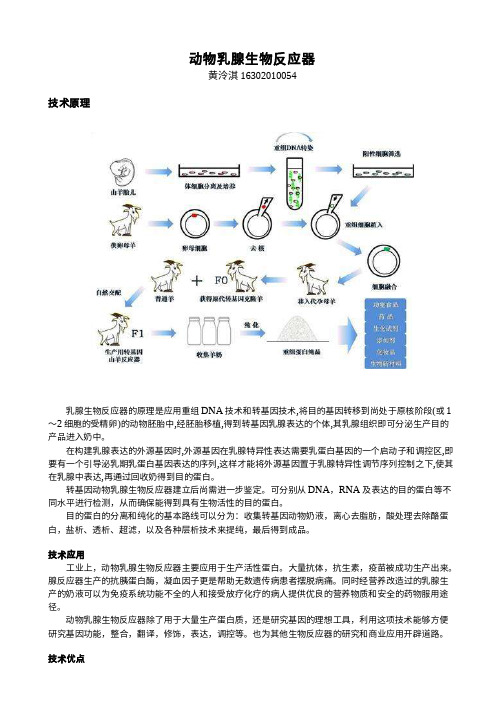
动物乳腺生物反应器黄泠淇 16302010054技术原理乳腺生物反应器的原理是应用重组DNA技术和转基因技术,将目的基因转移到尚处于原核阶段(或1~2细胞的受精卵)的动物胚胎中,经胚胎移植,得到转基因乳腺表达的个体,其乳腺组织即可分泌生产目的产品进入奶中。
在构建乳腺表达的外源基因时,外源基因在乳腺特异性表达需要乳蛋白基因的一个启动子和调控区,即要有一个引导泌乳期乳蛋白基因表达的序列,这样才能将外源基因置于乳腺特异性调节序列控制之下,使其在乳腺中表达,再通过回收奶得到目的蛋白。
转基因动物乳腺生物反应器建立后尚需进一步鉴定。
可分别从DNA,RNA及表达的目的蛋白等不同水平进行检测,从而确保能得到具有生物活性的目的蛋白。
目的蛋白的分离和纯化的基本路线可以分为:收集转基因动物奶液,离心去脂肪,酸处理去除酪蛋白,盐析、透析、超滤,以及各种层析技术来提纯,最后得到成品。
技术应用工业上,动物乳腺生物反应器主要应用于生产活性蛋白。
大量抗体,抗生素,疫苗被成功生产出来。
腺反应器生产的抗胰蛋白酶,凝血因子更是帮助无数遗传病患者摆脱病痛。
同时经营养改造过的乳腺生产的奶液可以为免疫系统功能不全的人和接受放疗化疗的病人提供优良的营养物质和安全的药物服用途径。
动物乳腺生物反应器除了用于大量生产蛋白质,还是研究基因的理想工具,利用这项技术能够方便研究基因功能,整合,翻译,修饰,表达,调控等。
也为其他生物反应器的研究和商业应用开辟道路。
技术优点1.动物乳腺的表达可进行翻译后修饰,如信号肽切除,蛋白的糖基化,羟基化及羧基化等,相比原核生物生产的外源蛋白,这种方法生产的蛋白具有生物活性和稳定性。
2.这种蛋白表达体系简单,一旦建立转基因动物乳腺生物反应器,只要简单地饲养好动物,利用动物乳腺的高表达能力,即可源源不断地得到贵重的药物蛋白。
3.转基因动物乳腺反应器的生产过程是一个畜牧业过程,饲养费用低廉,对环境没有污染,有广阔的发展前景。
生物乳腺反应器的原理及进展

动物乳腺生物反应器的原理及进展摘要:动物乳腺生物反应器技术是转基因技术的应用,于上世纪80年代提出,其目的是利用动物乳腺产生目的蛋白。
利用该技术生产的蛋白具有低成本,高活性,易提取纯化的优点。
虽然该技术尚处于发展时期,但具有广阔的应用前景和巨大地商业潜力,是许多公司大力发展的对象。
关键词:动物乳腺生物反应器、原理、进展、优点动物乳腺生物反应器(mammary gland reactor)是指利用动物乳腺特异性启动子调控元件指导外源基因在乳腺中特异性表达,并能从转基因动物乳汁中获取重组蛋白的一种生物反应器。
1生物反应器(bioreactor) 经历了3 个发展阶段:细菌基因工程、细胞基因工程、转基因动物生物反应器。
细菌基因工程产物往往不具备生物活性,必须经过糖基化、羟基化等一系列修饰加工后, 才能成为有效的药物,而细胞基因工程又因为哺乳动物细胞的培养条件要求相当苛刻,成本太高,限制了规模生产。
动物生物反应器具有产品质量高,容易提纯的特点,弥补了其它各类基因表达系统的缺陷。
它是在转基因技术体系基础上发展起来的。
7自从上世纪80年代出现以来,已经取得了许多突破,现己成为生物技术研究的热点。
并向商业化阶段转变,显示了广阔的应用前景。
并且利用转基因动物乳腺生物反应器生产饮用奶,以期望获得既能满足蛋白质需要,又能增加抵抗力的品质全面的奶,为人类服务。
21、动物乳腺生物反应器的原理乳腺生物反应器的原理是应用重组DNA 技术和转基因技术,将目的基因转移到尚处于原核阶段的动物胚胎中,经胚胎移植得到转基因乳腺表达的个体。
1 外源基因在乳腺特异性表达需要乳蛋白基因的一个启动子和调控区,即需要一个引导泌乳期乳蛋白基因表达的序列,这样才能将外源基因置于乳腺特异性调节序列控制之下,使其在乳腺中表达再通过回收奶获得具有生物活性的目的蛋白。
它是一个专门化的分泌腺体,可以生产出具完全生物活性的药用重组蛋白质,其纯化简单,生产投资及成本相对较少,而且对环境不具污染性,也被称为“分子农场”。
转基因动植物生物反应器 综述

转基因动植物生物反应器生物技术1002摘要:生物反应器,指以活细胞或酶为生物催化剂进行细胞增殖或生化反应提供适宜环境的设备,它是生物反应过程中的关键设备。
随着转基因技术问世,生物反应器不再局限于传统“冷冰冰”的设备,而是富有生命特性的动植物。
动植物生物反应器指的是通过基因工程途径以常见的农作物或者活体动物,高效表达某种器官或组织,进行工业化生产功能蛋白等生物制剂。
本文为大家阐述了转基因动植物反应器的优缺点,研究进展及其应用。
关键词:转基因动物反应器,转基因植物反应器,优缺点,研究进展,应用一、转基因动植物生物反应器的优缺点1.1转基因动物生物反应器的优点1易养殖,实现大规模制备。
2通过乳腺和血液制备活性物质简单易行。
3可以通过动物细胞培养实现大量制备。
4产量高,转基因动物在每升乳汁中可得几十克产物,而转基因植物,微生物在每升培养液中只能获得几毫克。
5成本低,用细菌、酵母菌或动物细胞生产基因工程药物,反应条件要求严格,而转基因动物只需要正常饲养。
6用于转基因动物制药的受体牛、羊、猪等哺乳动物,与人类亲缘关系比细菌、酵母菌要近的多,所以其产品具有与人体自身产生的蛋白相同的生物学活性川。
7用转基因动物培植活体器官和组织,用于更替人体患病的器官和组织。
1.2转基因动物生物反应器的缺点1细胞培养需要昂贵的培养基和设备。
2转基因动物制备成本昂贵。
3转基因动物易产生一些伦理问题。
4目前转基因动物的研究存在理论基础薄弱、技术不完善等问题"使得转入的基因在受体动物基因组中存在着随机整合、调节失控、遗传不稳定、表达率不高等问题。
为确保转入的基因能得到高效表达并完全整合,关键是基因构建和位点整合。
5转基因表达产物的分离与纯化也存在问题,可能会出现要纯化的产物含量低的现象,还要确保去除引起人类变态反应的非人类蛋白。
6转基因表达产物的结构和生物活性是否与人体蛋白相似#转基因产品必须与人体产生的蛋白高度相似,以免人体对它产生免疫反应。
生物反应器及其应用——转基因动物生物反应器

2 动物生物 反应器的类型
21 动 物血液生物 反应 器 .
近 年 来 , 物 血 液 生物 反 应 器 取得 了很 大进 展 。 动 血 液 生 物 反 应 器 比较 适 合 生 产 人 血 红 蛋 白、 体 和 抗 纯 的特 点 , 补 了其 它 各 类 基 因 表 达 系 统 的 缺 陷 。 弥 生产 非 生物 学 活 性 状 态 的融 合 蛋 白, 有 活性 的 蛋 而
维普资讯
・讲
座 ・
生 物 反 应 器 及 其 应 用
— —
转 基 因动 物 生 物 反 应 器
袁 明霞 , 孙德 君 , 万秋 杨
( 黑龙 江 省 生 物 制 品 一 厂 , 龙 江 哈 尔 滨 1 0 6 ) 黑 5 0 9
【 中图分 类号 1 8 48 s 1. 【 文献 标识 码 】 B 【 文章 编号 ] 6 2— 2 7 (0 70 17 0 82 0)6— 、 养 盐 、 他 命 和 氧 ( 好 氧 有 机 物 ) 营 维 对 来 畜 研 究 最 为 活 跃 的领 域 就 是 利 用 它 们 生产 新 的 动 支 持 这个 自然 过 程 , 细胞 能进行 生 长和 新 陈 代谢 。 物 产 品 。通 常 把 目的基 因在 血 液 循 环 系 统 或 乳 腺 使
《转基因生物反应器》课件

生物工程领域的应用
转基因生物反应器将在生物 工程领域发挥重要作用,为 创新研究和产品开发提供支 持。
转基因生物反应器的安 全问题
在推广应用转基因生物反应 器时,需要充分考虑安全问 题,做好风险评估和管理。
结束语
1 转基因生物反应器的前景展望
转基因生物反应器将在医药、化工、能源等领域发展壮大,推动社会进步和创新发展。
《转基因生物反应器》 PPT课件
欢迎来到《转基因生物反应器》PPT课件!本课程将深入探讨转基因生物反应 器的概念、优点、工作原理和未来发展,带您领略转基因技术的魅力。
什么是转基因?
转基因是指通过基因工程技术将外源基因导入到目标生物体中,使其获得新 的遗传特征。转基因技术的发展历程将带您了解其演变和突破。
2 转基因技术的社会意义
转基因技术的发展和应用将为人类带来更多健康、环保和可持续发展的选择。
转基因生物反应器是什么?
定义
转基因生物反应器是指 利用转基因技术构建的 生物反应器,用于合成 特定化合物或产生特定 功能的生物制品。
优点
转基因生物反应器具有 高效、可控性强、产量 高等优点,被广泛用于 生物制药、生物能源等 领域。
应用领域
转基因生物反应器可应 用于合成药物、酶工程、 生物能源产业等领域, 为生物工程领域带来了 革命性的进展。
转基因生物反应器的工作原理
1
基因表达调控机理
转基因生物反应器中的基因表达通
反应器中的代谢路径
ห้องสมุดไป่ตู้
2
过调控机制实现,控制基因的表达 水平和时机。
在转基因生物反应器中,代谢途径
的调控将影响产物的合成和积累。
转基因生物反应器的未来发展
转基因技术的优化
动物乳腺生物反应器的研究概况

动物乳腺生物反应器的研究概况摘要:转基因动物乳腺生物反应器是利用动物乳腺特异性启动子调控元件指导外源基因在乳腺中特异性表达,并从转基因动物乳汁中获取重组蛋白。
近年来,生物学和分子生物学研究领域的成就促进了该技术的蓬勃发展。
本文简要概述了转基因动物乳腺生物反应器的基本概念、原理、特点及应用,并重点阐述了其研究现状及前景,从而探讨其存在的问题。
关键词:转基因动物;乳腺生物反应器;进展Abstract:Mammary gland bioreactor of transgenic animals is a useful biological technology, which expresses foreign genes under the direction of special promoters of the mammary gland as regulating components in the mammary gland and produces functional pharmaceutical proteins in milk.In recent years,achievements of biology and molecular biology accelerate the development of this technology. This paper briefly reviews the basic concepts, principle, chara- cteristics and applications of the mammary gland bior- eactor of transgenic animals,especially summarizing its current research status and bright future,meanwhile discusses the problems existed.Key words:transgenic animals;mammary gland bioreactor;progress前言21世纪是生命科学突飞猛进的时代,生命科学在人类生活中占有极为重要的位置。
第9章 转基因技术

重组目的基因的结构示意图
限制性核酸内切酶
20
21
DNA连接酶
22
转入受体进行表达
23
二、中游部分
1、外源基因的导入 2、外源DNA整合、转录及表达的检测
24
1、外源基因的导入
1)受精卵原核显微注射法 2)逆转录病毒感染法 3)胚胎干细胞法 4)精子载体法 5)细胞核移植法 6)脂质体介导法 8)基因打靶 9)原始生殖细胞技术
效率高
感染率高、细胞损伤小,胚胎存活率高。
宿主范围广泛,外源DNA在整合位点附近较少发生缺失 和重排
呈单位点、单拷贝整合,并且不受胚胎发育阶段的限制。
43
缺点:
逆转录病毒载体容量有限,只能转移≤10kb的DNA,转 入的基因一般没有其邻近的调控序列。
载体病毒基因有潜在的致病性,携带外源基因的病毒 载体在导入受体细胞过程中有可能激活受体细胞DNA序 列上的原癌基因或其它有害基因,威胁受体动物的健 康安全。
基因,从而在生物活体内研究此基因的功能。
48
第二节
原理 同源重组(homologous recombination)
发生在同源序列间的重组,通过链的断裂 和再连接,在两个DNA分子同源序列间进行单链 或双链片段的交换。 细胞水平实现基因的定位修饰
49
50
51
优点:
可对阳性细胞选择,实现外源DNA的定点整合,避免 了随即整合的缺点。
,是一项旨在培育肉多低脂且环境友好型家禽的研究组成部
分。无毛鸡能够减少养殖户用在防止鸡遭受高温侵袭的通风
设施上的投入
9
约翰斯-霍普金斯大学的科学家注视着两只小老鼠,左边的 是一只普通老鼠,右边的是一只转基因老鼠,肌肉发达程 度是普通老鼠的2到3倍。在对一种新发现的基因进行研究 时,科学家培育了转基因鼠。这只转基因鼠有助于科学家 寻找伴随癌症或者艾滋病出现的肌肉萎缩症的治疗手段。
8 转基因生物反应器

动物乳腺生物反应器利用哺乳动物乳腺特异性表达 的启动子元件构建转基因动物, 指导外源基因在乳 腺中表达, 并从转基因动物的乳液中获取重组蛋白。
乳汁中分泌人凝血因子IX的转基因山羊
动物乳腺生物反应器的应用
高乳汁营养价值 生产药用蛋白
患有庞普病的婴儿体内一种可促进糖原质代谢的酶有缺陷。 荷兰研究人员培育出一种转基因兔,兔奶中表达这种酶,因此 饮用这种奶可以治疗这种疾病。
两大缺陷:
Байду номын сангаас
一是细菌等微生物本身是低等生物,构建 好的哺乳动物或人类的基因导入后不能很 好表达。 二是即使表达了,产物往往没有活性,必 须经过糖基化、羧基化等一系列修饰加工 才能成为有效的药物。
转基因生物反应器
生物反应器(bioreactor)
生物反应器:一般是指用于完成生物催化反应的装置, 分为细胞反应器和酶反应器。
传统生物反应器 生物反应器 转基因生物反应器
细胞反应器 酶反应器 动物生物反应器 植物生物反应器 微生物生物反应器
微生物反应器
(一) 优点 1可以利用发酵工程 技术大规模生产。 2 胞外活性物质制备 容易。 (二)不足 1哺乳动物或人类的 基因往往不能表达。 有些表达了,却没有 活性,需要进一步修 饰。 2真核生物蛋白质翻 译后加工的精确性有 限。 3需要大型发酵设备 和车间。 4细菌发酵常形成不 溶聚合物,使下游加 工成本增加。
1 转基因动物反应器
概念1:转基因动物反应器是指从转基因动物体液或血液 中收获目标产物的生命系统。其原理是将编码活性蛋白的 基因导入动物的受精卵或早期胚胎内,以制备转基因动物, 并使外源基因在动物体内(乳汁、血液)进行高效表达, 然后提取目的产物。 概念2:一般把目的基因片段在器官或组织中表达的转基 因动物叫动物生物反应器。
转基因技术——动植物转基因方法

转基因 技术
【DAWN_ZX】
转基因技术的步骤
转基因 技术
STEP4:目的基因的检测和表达
1.检测转基因生物的染色体DNA上是否插入了目 的基因。 方法:采用DNA分子杂交技术。 2.检测目的基因是否转录出了mRNA。 方法:采用用标记的目的基因作探针与 mRNA 杂交。 3.最后检测目的基因是否翻译成蛋白质。 方法:从转基因生物中提取蛋白质,用相应的 抗体进行抗原-抗体杂交。 4. 进行个体生物学水平的鉴定。
转基因 技术
【DAWN_ZX】
动物转基因方法
原核显微注射法
胚胎干细胞介导法 逆转录病毒载体法 精子介导的基因转移 核移植转基因法 体细胞核移植法 线粒体介导法
转基因 技术
【DAWN_ZX】
动物转基因方法
原核显微注射法(最常用) •方法:将外源基因注射到受精卵细胞的原核内,
外源基因与胚胎基因组融合后体外培养, 移植到 受体母畜子宫内发育,这样分娩的动物体内的每一 个细胞都含有新的DNA片段。 •缺点:效率低、位置效应(外源基因插入位点随 机性)造成表达结果有不确定性、动物利用率低。 反刍动物繁殖周期长,有较强的时间限制、需要大 量的供体和受体动物。
转基因 技术
【DAWN_ZX】
植物转基因方法 基因枪介导转换法
•方法:利用火药爆炸或高压气体加速将包裹
了带目的基因的DNA溶液的高速微弹直接送入 完整的植物组织和细胞中,然后通过细胞和组 织培养技术,再生出植株,选出其中转基因阳 性植株即为转基因植株。 •优点:不受受体植物范围的限制,而且其载 体质粒的构建也相对简单,是目前转基因研究 中应用较为广泛的一种方法。
转基因技术的步骤 STEP2:基因表达载体的构建
目的:使目的基因在受体细胞中稳定存在,并且 可以遗传至下一代,使目的基因能够表达和发挥 作用。 组成:目的基因+启动子+终止子+标记基因 标记基因的作用:是为了鉴定受体细胞中是否含 有目的基因,从而将含有目的基因的细胞筛选出 来。常用抗生素基因。
生物学转基因动物与动物生物反应器
基 因 打 靶 流 程 图
• 基因打靶的产生和发展建立在胚胎干细胞技术和 同源重组技术成就的基础之上,并促进了相关技 术的进一步发展。
• 基因打靶的研究进展迅速,给现代生物学和医学 研究带来了革命性的变化,并直接引发了现代生 物学和医学研究各个领域中许多突破性的进展, 成为后基因组时代研究基因功能最直接和最有效 的方法之一。
缺点:
转入的外源基因的大小受到限制, 一般在10kb 以下。
获得纯合体的转基因动物的机会少。 病毒载体构建复杂。 可能出现病毒自身基因的复制表达问题等。
3 胚胎干细胞(ES细胞)法
将外源基因导入体外培养的ES细胞。 可以通过逆转录病毒感染、脂质体介导、电穿
孔、磷酸钙共沉淀等方法将外源基因导入ES细 胞。 将携带有外源基因的ES细胞注入到动物的早期 胚胎内,可产生嵌合体及转基因动物。
转基因动物的应用
(1)基因表达与调控的研究 将转基因导入动物受体细胞内,研究该基因在体
内的表达调控特征及其相应的生物学效应,这是转 基因动物的一种应用途径。 当转基因动物的外源目的基因插入某一内源基因 后, 可能会破坏该内源基因的功能,造成某一基因 功能的缺失。通过这种基因剔除的方法可阐明某 一特定基因在发育过程中的功能。
得纯系转基因动物。
Injection of ES cells into
blastocysts
优点:
外源基因整合情况的可控性高。 可预先在细胞水平检测外源基因的拷贝数、定
位、表达的水平及插入的稳定性。
外源基因导入ES细胞的方法Fra bibliotek样,细胞鉴定及
筛选方便。 该方法遗传修饰能力强且十分精确,基因
目前, 已经培育出了动脉粥样硬化、镰刀形红细胞 贫血症、痴呆症、自身免疫病、淋巴系统病、真 皮炎及前列腺癌等多种疾病的模型动物,为这类疾 病的研究提供了方便。
转基因动植物生物反应器研究进展及应用现状

转基因动植物生物反应器研究进展及应用现状廖莎;李国玲;吴珍芳;李紫聪【期刊名称】《广东农业科学》【年(卷),期】2018(45)11【摘要】转基因动植物作为生物反应器,有完善的真核表达系统,可以为多种外源蛋白提供正确的翻译后修饰,表达具有生物活性的外源蛋白,可以应用于人或动物的疾病治疗及预防,因其具有成本低、产出高、产品珍贵且需求高的特点而具有广阔的商业前景.目前,转基因动植物生物反应器研究领域已经取得多项成果与突破,以此生产的蛋白制品也有部分被权威机构批准上市应用,还有许多未上市的研究成果已经进入临床试验阶段,为产业化发展做准备.动植物生物反应器已成为重组药用蛋白生产的新趋势.综述了转基因植物和转基因动物作为生物反应器生产重组蛋白的研究进展及应用现状,介绍了生物反应器类型、生产的蛋白种类、已获批应用的动植物生物反应器,讨论了利用动植物生物反应器生产外源蛋白的意义及存在的问题,对其研究及应用前景进行展望.【总页数】11页(P126-136)【作者】廖莎;李国玲;吴珍芳;李紫聪【作者单位】华南农业大学动物科学学院/国家生猪种业工程技术研究中心,广东广州 510642;华南农业大学动物科学学院/国家生猪种业工程技术研究中心,广东广州 510642;华南农业大学动物科学学院/国家生猪种业工程技术研究中心,广东广州 510642;华南农业大学动物科学学院/国家生猪种业工程技术研究中心,广东广州 510642【正文语种】中文【中图分类】S-1;Q-1【相关文献】1.piggyBac转座子介导的转基因家蚕丝腺生物反应器研究进展 [J], 钟伯雄;危浩;庄兰芳2.转基因家蚕生物反应器研究进展 [J], 周文林;叶爱红;曹锦如3.tPA特性及其利用转基因乳腺生物反应器生产研究进展 [J], 张会亮;王建英;何成强;李国荣4.抗菌肽在转基因动植物中的研究进展 [J], 张鑫;苗向阳;尹逊河;马艳芳;曲朝杰;张秋婷5.转基因动物生物反应器研究进展 [J], 李紫聪;黄晓灵;刘德武;吴珍芳因版权原因,仅展示原文概要,查看原文内容请购买。
细胞工程-7.转基因动物与生物反应器

从分子水平和乳腺分泌物两个方面进行鉴定。
整理:灵魂的心碎 更多内容请联系 linghundexinsui@
■ 目的基因的选择
选择目的基因的基本要求是,正常情况下浓度低、翻译后修饰复杂、其它表达体系难以表达或表达量低、应用前景广阔的蛋白基因。
■ 体外重组
选择好目的基因和启动子调控元件后进行体外重组,构建融合基因。
■ 基因转导
将构建好的重组基因用基因转导方法转移到受精卵。
■ 胚胎移植
利用胚胎移植技术将制备的转基因受精卵植入待孕母体子宫内,生产转基因动物,得到转基因乳腺表达个体。通过采集转基因动物的乳汁,来获得目的基因表达产物。
━转基因技术:通过人工方式将外源基因整合到生物体基因组内,并使该转基因生物能够稳定地将此基因遗传给后代的技术。
━转基因动物:在基因组内稳定地整合外源基因,并且可以稳定地遗传给后代的基因工程动物。
━转基因动物细胞反应器制备流程
■ 外源目的基因的制备
■ 外源目的基因有效导入生殖细胞或胚胎干细胞
■ 选择获得携有目的基因的细胞
■ 选择合适的体外培养系统和宿主动物
■ 转基因细胞胚
■ 胎发育及鉴定
■ 筛选所得的转基因动物品系。
━生物反应器的类型
■ 动物血液生物反应器
■ 动物乳腺生物反应器
■ 动物膀胱生物反应器
动物乳腺生物反应器的制备
■ 表达载体的构建
目前用于表达载体的启动子调控元件选用动物乳蛋白基因启动子元件,主要有四类乳腺定位表达调控元件。
第9章 转基因动物与生物反应器

优点:
鸡输卵管是一个自我封闭的系统,肝脏 合成蛋黄中的蛋白质和脂肪,并由血液 直接输入输卵管,避免大量表达的外源 性蛋白质对鸡健康造成的危害。
产量可观,且成本低廉。
产品的活性接近天然产品
本章结束
在显微镜下准确地插入受体细胞核中,并将 DNA注射进去。
3、裸DNA直接转移法:效率低。
显微操作系统
二、化学方法
1、DEAE-葡聚糖介导法:效率低
(乙二胺乙基葡聚糖)
DNA上的磷酸带负电
DEAE带正电
→ DNA大颗粒→ 细胞胞饮
2、磷酸钙-DNA共沉淀法:效率低(P254)
表面活性剂
3.脂质体介导法(P255)
转基因动物乳腺生物反应器的优越性: 产品质量稳定,活性高; 可持续大量地表达; 成本低,经济效益显著; 无污染; 药物分离纯化工艺简便,可获得纯度
高达99%的产品; 研制开发周期短。
转基因动物乳腺生物反应器存在的问题:
转基因在受体动物基因组中随机整合, 有些存在调节失控、遗传不稳定、表达 率不高等问题
第9章 转基因动物 第9章与生转物基反因应动器物
与生物反应器
9.1 转基因技术
通过人工操作的方式将外源基因整合到 生物体基因组内,使该转基因生物能稳定 地将此基因遗传给后代的实验技术。
细胞转染外源基因分三步:
(1)选择合适的受体细胞; (2)有效的转染方法; (3)转化后的筛选。
细胞转染外源基因的方法:
9.2.1 转基因动物的制备
一、步骤: •外源目的基因的制备; •目的基因有效导入生殖细胞或胚胎干细胞; •选择获得携有目的基因的细胞; •选择合适的体外培养系统和宿主动物; •转基因细胞胚胎发育及鉴定; •筛选所得的转基因动物品系。
动物生物反应器

(2)目的基因的选择 选择目的基因的基本要求是,正常情况下浓度低、翻 译后修饰复杂、其它表达体系难以表达或表达量低、应用 前景广阔的蛋白基因。
(3)体外重组及检测
选择好目的基因和启动子调控元件后进行体外重组,构 建融合基因。并将构建的表达载体转染至动物乳腺细胞中表 达,提取细胞分泌蛋白,检测目的基因表达情况。
乳腺动物反应器建立的关键在于: 乳腺组织特异性表达载体构建的合理性和有效 性,这包括外源基因在活体动物组织中分泌表达,
表达是否具有组织特异性,表达水平及其蛋白是
否具有全部的生物学活性。
为解决这些问题,国外采用的的方法:
• 采用BLG、WAP、酪蛋白启动子及部分内含子等乳腺定位
表达调控元件进行乳腺特异性表达的调控。
转基因动物乳腺生物反应器是目前国际上唯一证明可以达到商
业化生产水平的生物反应器。
• 动物就像一个活的发酵罐,其温度、气体、水分
和PH值均由动物自身调控,所以常被喻为药物工 厂、生物反应器、基因农场或分子农场。 • 动物生物反应器优点: ① 表达产物能充分被修饰且具有稳定的生物活性。 ② 产品成本低。可无限繁殖,且饲养成本低,可 大规模生产。 ③ 产品质量高,易提纯。由动物生物反应器生产 的药品为纯的生物制品,避免了化学试剂及生物 毒素的污染,安全可靠。 ④ 生物反应器目的基因对动物内部组织器官的干 扰和影响不大,一旦获得有高效表达的祖代个体, 其遗传性即可保证维持生产的低成本。
蛋白质或多肽等药物己取得了一定进展。外源基因编码产物 可直接从血清中分离出来,血细胞组分可通过裂解细胞获得。
动物膀胱生物反应器
外源基因在膀胱中表达的转基因动物生物反应器 , 叫动物膀胱生物反应器。膀胱尿乳头顶端表面可表达一
组尿血小板溶素的膜蛋白,这种蛋白在膀胱中表达具有专一性, 而且它的基因是高度保守的,将外源基因插入5′端调控序列中, 就可以指导外源基因在尿中表达。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
转基因动物生物反应器的基因构建与表达摘要近年来,生物学和分子生物学研究领域的成就促进了转基因动物生物反应器的蓬勃发展。
用转基因动物生物反应器生产药用蛋白是生物技术领域里的又一次革命,它以一个全新生产珍贵药用蛋白的模式区别于传统药物的生产。
本文着重介绍转基因动物生物反应器的基因构建以及转基因动物组织特异性表达的最新进展。
以合理的费用获取大量在人体内原本稀少的血浆蛋白在不久前还只是幻想。
然而,近年来生物学和分子生物学取得的显著进展终于使这种幻想成为现实。
其中,将外源DVA用显微技术注入生殖细胞的原核,将重组DVA转入小鼠胚胎细胞和将DVA整合入宿主染色体和种系传递等重要发现,使用转基因(Tg)动物生产药用蛋白成为可能。
此外,生物学技术的发展,如对卵细胞的获得、操作以及再植入和重组DNA等技术进步都为转基因动物生物反应器的成功提供了保证。
转基因动物生物反应器生产药用蛋白一般有两种技术路线。
第一种是将目的基因在同源组织中表达蛋白质;第二种是将目的基因构建成杂合基因,转入动物胚胎,通过转基因动物的分泌器官收集并提纯药用蛋白。
转基因动物分泌的蛋白经过后加工酷如人体天然蛋白的结构,也有完全相似的生物活性。
同源组织中表达蛋白质目前,在同源组织中表达蛋白质最典型的例子是在动物的红细胞中表达人的血红蛋白。
在人的血红蛋白基因编码序列里启动子有2个CACCC盒,而对应的猪的启动子里只有一个,另一个靠近它的是CGCCC盒。
Sharma等[1]将猪的β-启动子与人的β编码基因融合,并将人的β-基因座调控区(β-LCR)和α、ε基因与融合基因的β基因连接在一起构成载体,转入猪胚胎细胞,从转基因猪分泌乳汁中得到的重组人血红蛋白含量高达32g/L。
在转基因动物的分泌器官中生产蛋白转基因动物表达重组蛋白多以乳腺、唾液腺和膀胱为靶位。
在这些表达器官中,通过构建合适的载体,选择适当的启动子和调控序列可产生比正常水平高得多的重组蛋白。
不过,生产系统应尽可能与循环系统隔离,以减少表达产物对宿主动物的影响。
乳腺生物反应器将所需目的基因构建入载体,加上适当的调控序列,转入动物胚胎细胞,使转基因动物分泌的乳汁中含有所需要药用蛋白。
从融合基因转入胚胎细胞到收集蛋白质有一个过程,包括胚胎植入、分娩和转基因动物的生长。
转基因动物从出生到第一次泌乳,猪、羊、牛各需12、14、16个月;并且只有雌性动物泌乳且不连续,一般可持续2、6、10个月。
牛、羊等大型家畜能对药用蛋白进行正确的后加工,使之具有较高的生物活性,同时产奶量大,易于大规模生产,因而成为乳腺生物反应器理想的动物类型。
抗凝血酶Ⅲ第一个进入临床试验的转基因蛋白产物是抗凝血酶Ⅲ,将半乳糖β-酪蛋白的启动子和含抗凝血酶Ⅲ基因序列相连,转入绵羊胚胎细胞,在转基因绵羊的乳液中得到有生物活性的蛋白产量可达7g/L[2]。
目前该蛋白正用于冠状动脉旁路手术患者的二期临床验证。
β-乳球蛋白在实验过程中人们发现牛的β-乳球蛋白(BLG)基因非常稳定,并能在乳腺中特异性表达。
Hyttinen等[3]将含有5'端2.8kb 和3'端1.9kb的牛BLG基因片段构建成载体,转入小鼠胚胎细胞,可在转基因小鼠的乳腺中特异表达高水平的BLG,此外,还发现CpG 位点的甲基化程度与BLG的表达量有关,甲基化少的转基因小鼠乳液中BLG分泌量较大,可达1~2mg/ml,而其他转基因小鼠分泌量小于0.1mg/ml。
红细胞生成素(EPO)目前国内外均采用CHO细胞表达生产人EPO,成本比较昂贵,而用转基因动物生产的EPO,可能是一条理想的途径。
将EPO dNA分别以HindⅢ和BamHI酶切,1%琼脂糖凝胶电泳回收5.4kb的HinⅢ/BamHI片段,插入pGEM-7zf(+)载体,再将867bp的BLG启动子插入EPO基因之前EcoR、ClaI位点,构建表达载体pGEM-3zf(+)β-LG-EPO。
通过显微注射方法得到转基因小鼠乳汗中的EPO含量可达0.5μg/ml[4]。
α1-抗胰蛋白酶这也是一个利用B LG基因构建的重组蛋白。
将BLG5'末端4.0kb序列与人的α1-抗胰蛋白酶(α1AT)基因的6.5kb片段(去掉第一个内含子)融合,再连接羊的BLG启动子,以pPOLY Ⅲ-Ⅰ为载体,转入羊的胚胎细胞,可在转基因羊分泌的乳液中得到含量高达60.0mg/ml的重组蛋白α1AT[5]。
转基因在两年前进入了临床验证。
因子ⅨSchnieke等[6]将羊的BLG基因5'末端和人的因子ⅨcDNA 与含有BLG复制单元和3'末端的片段融合,将构建的杂合基因转入羊的胚胎细胞,从分泌的乳汁中得到125μg/ml的重组蛋白。
黄淑帧教授等[7]构建了一个含有小鼠MAR元件、牛β-酪蛋白基因调控序列和hFⅨ微基因的hFⅨ乳腺组织特异性表达载体pMCⅨm,其中hF Ⅸ微基因包括全长hF ⅨcDNA ,800bp经过改造的内含子1序列和hFⅨ蛋白的信号肽序列。
将线形化的表达载体pMC Ⅸm导入羊的受精卵。
转基因羊分泌的乳汁中hFⅨ蛋白的含量约为95ng/ml。
在另一实验中,Yull等[8]将BLG5'末端序列,fⅨ编码序列和缺失隐性3'端连接点的f Ⅸ3'末端不翻译区域的一个小片段融合,构成杂合基因,去掉SphI和SmaI位点,克隆入移去了pBJ41的SphI/EcoRV。
转入小鼠胚胎细胞,得到的重组蛋白产量达0.06mg/ml。
经过进一步研究,发现是转基因动物乳腺中对DNA的错误剪切使分泌量降低,从而增高重组蛋白产率。
在乳腺组织中表达有完全活性的因子Ⅸ是比较成功的,尤其是乳腺组织对因子ⅨN端附近的一段含12个葡萄糖残基的序列进行γ-羧化以保持其活性,而在以前的天然蛋白中没有发现γ-羧化作用。
因子Ⅷ人FⅧcDNA长约7.2kb,是目前为止表达的最长cDNA。
将它插入小鼠的乳清酸性蛋白(WAP)基因中启动子(2.5kb)的下游,使之在乳腺中靶向分泌FⅧ重组蛋白。
在WAP/FⅧcDNA构建的转基因小鼠中rFⅧ表达最低,而在转基因猪中可达1.0~2.7μg/ml[9]。
单克降抗体Castilla等[10]将编码了重组单克降抗体(rMab)6A.C3的免疫球蛋白基因cDNA插入小鼠WAP dNA基因组的第一个外显子,使rMab 6A.C3的表达可以由WAP基因调控序列来控制,将构建的杂合基因注入小鼠胚胎细胞原核,使小鼠乳腺分泌有活性的单克降抗体,这种转基因表达产物将广泛应用于预防新生儿肠道感染。
C蛋白同样在WAP基因的第一个外显子位点,Drews等[11]将人C蛋白cDNA插入,转入小鼠胚胎细胞,可得到产量达1.6mg/ml的重组蛋白。
而将上述杂合基因转入猪的胚胎细胞,可使猪分泌出380μg/ml μg/ml·hr的外源蛋白,活性与人血浆中C蛋白的活性相同。
由于C 蛋白的抗凝活性依赖于轻链膜结合区域正确的γ-羧化,因此,转基因猪能分泌有活性的C蛋白表明猪的乳腺细胞可对C蛋白前体高速率地进行γ-羧化,以使成熟C蛋白有完整的活性。
膀胱生物反应器膀胱反应器有着和乳腺反应器一样的优点:收集产物蛋白比较容易,不必对动物造成伤害。
此外,该系统可从动物一出生就收集产物,不论动物的性别和是否正处于生殖期。
膀胱生物反应器最显著的优势在于从尿中提取蛋白质比在乳汁中提取简便、高效。
膀胱生物反应器多用Uroplakin启动子启动人生长激素(hGH)的表达,产生hGH特异性的高丰度RNA,这些RNA与蛋白分泌量高度相关。
Uroplakin基因在多种哺乳动物体内有很高的保守性,如鼠、兔、牛、羊和人等。
生长激素Kerr等[12]将pUPII-LacI用质粒的Kpn i进行消化,用T4DNA多聚酶切去3'端,然后用BamHI消化,分离出3.6kb的5'端小鼠UPII基因片段,此片段含有膀胱反应器特异性表达所需的大部分序列。
将此片段与位于无启动子的pOGH质粒纯化SaI和BamHI 位点间的hGH结构基因的5'端连接,得到pUPII-hGH质粒,能表达该质粒的组织分布有限。
将得到的pUPII- hGH质粒用HindIII和EcoRI消化,得出一段5.7kb的UPII-hGH融合基因可用于显微注射,在膀胱上皮细胞中合成hGH,收集转基因动物尿液,从中提取重组蛋白。
但在这一途径中转基因动物会因hGH的作用逐渐肥胖,并导致雌性动物不育症。
乳腺生物反应器也能表达hGH。
用同源重组方法将hGH基因导入210kb的人α-乳球蛋白位置依赖性YAC载体,将重组的YAC dNA显微注入大鼠胚胎,转基因大鼠的乳汁中含有高水平的hGH,含量可达0.25~8.9mg/ml[13]。
翻译与修饰转基因动物分泌的蛋白,特别是糖链成分的结构与人体蛋白有差异。
因此研究分泌蛋白的修饰就显得很重要。
在乳腺生物反应器中,蛋白质翻译前修饰的主要方式是在多个位点对乳腺中的蛋白前体进行信号肽剪切和对糖链进行修饰。
例如,从山羊乳液中得到的长效组织型纤溶酶原激活剂与人体内和相比较,含有少量的异种(外源)低聚糖,同时,唾液酸、N-乙酰葡萄糖胺和半乳糖含量明显减少,关且出现缺少蛋白质C127的N-乙酰半乳糖胺。
此外,从猪乳液中得到的C 蛋白中是没有的;从羊乳液中得到的重组α1-抗胰蛋白酶多聚肽也反映了唾液酸酸化程度的差异;在山羊乳腺中观察到了重组抗凝血酶Ⅲ上低聚甘露糖与特异天冬酰胺的位点特异性聚合等等。
研究小鼠乳液中的重组γ-干扰素可对翻译前修饰有更好的理解,γ-干扰素有大量的位点特异性变化,在N端连接位点进行复杂的唾液酸酸化和连接核心岩藻多聚糖,其次是低聚甘露糖。
与从小鼠细胞中取得的蛋白质相比,分泌的重组蛋白没有GalNAc、NeuGC和Gal∞l 、3Gal-βl、4GlcNAc 残基。
这些蛋白特异性的糖基化类型可与细胞上的受体结合并清除病人体内的重组蛋白,因此可能会影响疗效,最终的结果尚有待验证。
同源组织表达蛋白质的优点是可对表达产物进行调控并校正珠蛋白链的翻译过程,避免无效的翻译前修饰,使产物蛋白尽可能与人体天然蛋白相似,降低人体内的排斥反应,提高药物蛋白疗效。
目前,蛋白分离技术飞速发展,大大提高了蛋白质分离的可行性和分离效率。
第二种技术路线中目前以乳腺生物反应器较为多见,因为乳汁易得到,且乳汁中的特异蛋白含量较大,对蛋白水解酶的降解作用也比较稳定。
乳汁是一种混合物,含3%~6%的总蛋白,3%~5%的脂类,对蛋白提纯技术要求比较高。
另一方面,药用蛋白是在动物乳腺中产生。
因此只有含转基因型人雌性动物在泌乳期才能生产药用蛋白,可用的动物数目有限,且生产期较短。
膀胱生物反应器的优点在于含有转基因型的两性动物都可用,产后收集时间长,提取产物蛋白浓度双乳液中的含量低得多,尽管收集的尿液多且时间长,生产单位数量的药用蛋白在乳腺和膀胱生物反应器中的成本是差不多的问题与展望在转基因动物生物反应器的应用中,有些问题尚待解决。
