lncRNA研究策略之:RNA Pull Down实验技术
lncRNA功能验证方法大全

lncRNA功能验证方法大全长链非编码RNA(long non-coding RNAs,lncRNAs)是一类长度超过200nt、不编码蛋白的RNA,在表观遗传及转录后水平调控基因表达,与人类疾病的发生、发展和防治有密切联系。
研究lncRNA 想发高分文章,运用RNA-seq技术筛选特异性lncRNA只是第一步,后期实验验证才是直接影响文章水平的关键。
小编为大家总结了lncRNA验证涉及实验概念,赶紧先睹为快~SEE MORE →1cDNA末端快速扩增(Rapid amplification of cDNA ends, RACE)目的:确定lncRNA 5’和3’末端序列,进而获得lncRNA的全长信息。
原理:在cDNA合成或第二链cDNA合成的过程中末端序列外侧引入接头序列,通过接头引物和基因特异性引物进行PCR扩增,PCR 产物经克隆测序获得末端序列信息。
2RNA免疫沉淀(RNA-Immunoprecipitation, RIP)目的:IP是研究RNA蛋白相互作用的重要手段,利用RIP可以研究在体内蛋白是否与lncRNA发生相互作用。
原理:利用目的蛋白的抗体免疫沉淀蛋白RNA复合物,从沉淀的RNA蛋白复合物中纯化RNA,进行定量PCR分析。
3荧光素酶报告基因目的:检测转录因子与目的基因启动子区DNA相互作用的一种方法。
原理:荧光素酶可以催化荧光素(luciferin)氧化成oxyluciferin,在luciferin氧化的过程中,会发出生物荧光(bioluminescence)。
然后可以通过荧光测定仪测定luciferin氧化过程中释放的生物荧光,进而检测转录因子与目的基因启动子区DNA是否发生相互作用。
4 RNA pulldown目的:RNA pull-down实验主要用来鉴定与目的lncRNA结合的蛋白配体。
原理:蛋白与生物素标记的RNA孵育结合,富集的蛋白通过SDS-PAGE分离,最后选择特异性蛋白条带进行质谱鉴定。
RNApulldown实验技术服务

RNApulldown实验技术服务
RNA pull down 是一种研究RNA与蛋白结合互作的实验技术方法,生物体内许多功能的核心是RNA与蛋白的结合来进行调控,如:蛋白的合成,mRNA的组装,细胞发育调控等。
基本原理是:通过体外转录获取标记的RNA作为探针,与细胞细胞裂解液孵育,免疫共沉淀的方法获取RNA结合捕获的蛋白,后续可通过WB检测验证结合蛋白,或通过质谱(MS)的方法得到结合蛋白的信息
技术原理:
技术服务流程:
1.克隆载体的构建
2.体外转录形成标记的RNA探针
3.探针与裂解液孵育结合,形成磁珠-RNA-蛋白复合物
4.纯化获取蛋白产物
5.WB检测或MS分析
优势:
1.生物信息学预测,分析RNA motif与蛋白的结合,可通过截断与截短的方式研究结合的序列信息,为客户提供深度分析和研究方案
2.设置完整组别,包括Input组,正义链组,反义链组,阴性组,
实验更加严谨可靠
3.提供可直接用于文章的标准结果图,以及实验原图结果
4.提供完善的实验报告,更利于文章的撰写和申请
适用研究:
各种通路,代谢路径,分子机制,细胞调控,药物诱导等方向的调控研究,寻找或验证RNA结合的蛋白,如:结合蛋白为某些转录因子,代谢过程中的核心酶,通路中的调控蛋白等。
RNA研究相关的实验原理及操作介绍

RNA研究相关的实验原理及操作介绍1. ChIRP-Seq(Chromatin Isolation by RNA Purification)ChIRP-Seq:培养的细胞在活细胞中交联,它们的染色质被提取并均匀化。
利用磁性链霉亲和素珠,将感兴趣的RNA与目标RNA杂交并分离得到生物素化互补寡核苷酸。
将纯化的染色质洗脱成蛋白质、RNA或DNA,然后进行下游检测以进行鉴定和定量,ChIRP-Seq能在全基因组水平上对lncRNA与染色质之间所有潜在的相互作用位点进行标记。
原理:戊二醛固定细胞后,利用声波降解法进行细胞裂解和染色质断裂,在裂解物中加入带生物素标记的oligo探针与lncRNA杂交,利用链霉素亲和磁珠分离纯化(与生物素亲和)。
最后加RNaseA,从复合物中将lncRNA结合的蛋白和DNA片段洗脱下来,用于后续分析。
实验操作视频链接:/video/3912/chromatin-isolation-by-rna-purification-chirp实验操作protocol:二、RNA原位杂交(RNA in situ hybridization)RNA原位杂交(RNA in situ hybridization):在细胞或组织结构保持不变的条件下,用标记的已知的RNA核苷酸片段,按核酸杂交中碱基配对原则,与待测细胞或组织中相应的基因片段相杂交,经显色反应后在光学显微镜或电子显微镜下观察其细胞内相应的mRNA/lncRNA等分子,可检测该lncRNA是否位于核内或在细胞内的分布情况。
原理:将特定标记的已知序列核酸做为探针与细胞或组织切片中的核酸进行杂交,从而对特定核酸进行精确定量定位的过程。
原位杂交可以在细胞标本或组织标本上进行。
根据RNA序列设计cDNA探针,可结合RNA和DNA。
三、荧光原位杂交 (fluorescence in situ hybridization, FISH)FISH:对于RNA分布定位,一般会使用荧光原位杂交技术(fluorescence in situ hybridization,FISH)。
研究lncRNA的常见技术及原理LncRNA专题

研究lncRNA的常见技术及原理LncRNA专题本期专题将围绕lncRNA的常见技术与原理,主要介绍RT-PCR/qPCR/RT-qPCR/QD-FISH原位杂交技术/cDNA 末端快速扩增/RNA pull down/RIP技术/ChIRP等技术及原理,还介绍了相关研究思路。
快来和小编一起开启学习模式吧~1常见技术及原理1.RT-PCRRT-PCR(reverse transcription-polymerase chain reaction, RT-PCR),由一条RNA单链转录为互补DNA(cDNA)称作“逆转录”,由依赖RNA的DNA聚合酶(逆转录酶)来完成。
随后,DNA 的另一条链通过脱氧核苷酸引物和依赖DNA的DNA聚合酶完成,随每个循环倍增,即通常的PCR。
原先的RNA模板被RNA酶H降解,留下互补DNA。
RT-PCR的指数扩增是一种很灵敏的技术,可以检测很低拷贝数的RNA。
RT-PCR广泛应用于遗传病的诊断,并且可以用于定量监测某种RNA的含量。
RT-PCR的关键步骤是在RNA的反转录,要求RNA模版为完整的且不含DNA、蛋白质等杂质。
常用的反转录酶有两种,即鸟类成髓细胞性白细胞病毒(avian myeloblastosis virus,AMV)反转录酶和莫罗尼鼠类白血病病毒(moloney murine leukemia virus,MMLV)反转录酶。
2.qPCRReal-time-PCR和qPCR(Quantitative Real-time-PCR)是一码事,都是实时定量PCR,指的是PCR过程中每个循环都有数据的实时记录,因此可以对起始模板数量进行精确的分析。
3.RT-qPCRRT-qPCR(Real-time Quantitative PCR),实时荧光定量PCR 就是在PCR反应体系中加入荧光基团,利用荧光信号积累实时监测整个PCR扩增反应中每个循环扩增产物量的变化,最后通过Ct值和标准曲线的分析对起始模版进行定量分析的方法。
移花接木,lncRNA结合蛋白的套路解析

移花接⽊,lncRNA结合蛋⽩的套路解析⽤腻了ceRNA,不妨试试lncRNA结合蛋⽩的套路。
lncRNA之所以在科研界炙⼿可热,是因为它有通天彻地之能,DNA、RNA、蛋⽩质均与它有着千丝万缕的关系,可介导胞内各种各样的⽣物学效应。
lncRNA如此全能,甚⾄可媲美蛋⽩质,因⽽要研究lncRNA,⼀招移花接⽊,灵活套⽤蛋⽩研究思路,⾃然可以⼀步登天。
lncRNA调控的12种途径众所周知,lncRNA对基因的调控可发⽣在基因⽔平、转录、转录后、翻译、翻译后这5个环节。
⽽细分下来,这5个环节共包含了12种能够影响基因表达调控与功能的途径:基因⽔平1)lncRNA参与调节DNA甲基化,甲基化需要蛋⽩酶催化,lncRNA可以起到穿针引线的作⽤。
转录⽔平2)&3):lncRNA对转录因⼦以及其他转录调节蛋⽩的作⽤主要有两种:招募(recruitment)和抑制(inhibitor),需要依据具体情况来分析促进或抑制转录过程。
4)lncRNA转录后直接结合附近的DNA序列,抑制转录。
该过程的特殊之处在于不依赖于蛋⽩,是核酸之间直接结合。
5)lncRNA可影响转录复合物以及RNA聚合酶的催化活性,进⽽影响转录过程。
6)lncRNA影响染⾊质结构的组蛋⽩修饰包括甲基化、⼄酰化,进⽽调节转录过程。
转录后⽔平7)lncRNA可结合mRNA影响可变剪切,即影响mRNA的前体加⼯成熟的过程。
8)mRNA加⼯成熟后需要转运到细胞质进⾏蛋⽩翻译,⽽mRNA的定位也会受到lncRNA影响。
9)mRNA的稳定性同样受到lncRNA调节。
既可结合mRNA的3’UTR诱导mRNA降解(类似miRNA),也可结合蛋⽩,再靶向结合mRNA的序列,促进mRNA的稳定性。
翻译⽔平10)lncRNA可以结合mRNA的5’UTR⾮翻译区,促进翻译过程;也可以结合特定的蛋⽩靶向mRNA,抑制翻译。
翻译后⽔平11)lncRNA可调控蛋⽩翻译后修饰,⽐如可影响JAK-STAT信号通路的明星分⼦STAT3的磷酸化⽔平。
一文参透:lncrna研究思路、模式和数据库应用知识讲解

一文参透:l n c r n a研究思路、模式和数据库应用一文参透:lncRNA研究思路、模式和数据库应用...作者:解螺旋.老谈导语当很多小伙伴还徘徊在miRNA时,lncRNA已经横空出世,还没得来得及反应过来lncRNA到底是怎么回事时,circRNA又开始崭露头角了。
科研就是这样,你落后一步,便步步落后,跟娶媳妇生孩子是一样一样的。
说回正题,应部分解螺旋粉丝的要求,今天老谈帮大家整体梳理了曾经红极一时、目前热度不减的IncRNA的研究思路和模式以及相关工具,希望能对那些想在IncRNA研究上有所作为的小伙伴能助上一臂之力。
lncRNA研究思路IncRNA参与了X染色体沉默、基因组印记以及染色质修饰、转录激活、转录干扰、核内运输等多种重要的调控过程。
很多人看到lncRNA的热度还没有过去,经常会问老谈如果没有相关的工作基础,如何开始lncRNA的研究?今天我们就褪去虚伪外衣,研究的大方向是这样子的:1. 寻找到lncRNA分子2. lncRNA分子表型研究3. lncRNA 通过何种机制调节表型?老谈将这些研究方向及实验手段按层次的方式绘成流程图,如下所示:首先,是样本的准备与收集。
高质量的样本是实验结果具有可靠性的前提。
其次,是lncRNA检测。
可以先通过芯片的方式高通量筛选到目的基因,然后通过q-PCR或Northern blot的方法验证所得到的芯片结果。
再次,其研究方向根据研究目的而定。
如果是研究生物标志物,那么可以通过收集更多的临床样本,研究lncRNA对疾病的指示作用。
如果是研究其功能,则是研究其细胞表型、分子表型及机制。
小伙伴们是不是觉得这和miRNA的总体研究思路相似呢?这时可以根据各自的实验平台条件选择相应的研究。
值得注意的是,lncRNA的功能研究并不像miRNA一样通过3’UTR影响翻译套路,总的来说lncRNA机制研究套路还不成熟。
对于很多科研工作者而言,lncRNA分子的获得及其细胞表型的获得并非难事,关键在于如何进行下一步研究,这时候就要涉及到对功能研究的定位。
LncRNA的研究策略

lncRNA研究策略转载请注明来自丁香园发布日期:2012-09-21 14:47 文章来源:丁香园分享到:收藏夹新浪微博腾讯微博开心网豆瓣社区人人网关键词:RNA miRNA 技术专题锐博生物丁香通丁香园点击次数:34471、差异表达筛选通过lncRNA芯片或RNA-seq测序等方法对多对疾病模型和对照样本组织进行lncRNA 表达谱分析。
2、生物信息分析通过生物信息学的方法筛选出具有表达差异的lncRNA,构建共表达网络,预测lncRNA 的靶基因。
3、细胞分子水平研究(1)功能获得性研究:构建lncRNA过表达载体(2)功能缺失性研究:可通过siRNA、shRNA、反义核酸等方法沉默lncRNA,干预lncRNA后检测其对疾病相关基因表达的影响和对细胞表型如增值、凋亡、侵袭、转移等的影响(3)可通过RNA pull down、RNA-RIP、ChIRP-seq等方法检测与lncRNA结合的DNA、RNA、蛋白质。
4、动物实验(1)构建移植瘤或原位瘤模型,转移模型(2)导入siRNA或者lncRNA表达质粒(3)检测肿瘤生长曲线(4)通过免疫组化、RT-PCR、Western Blot等方法检测相关指标变化。
小知识RNA-RIP技术(RNA Binding Protein Immunoprecipitation)是一种高通量检测细胞内RNA与蛋白结合情况的技术,运用针对目标蛋白的抗体把相应的RNA-蛋白复合物沉淀下来,然后经过分离纯化就可以对结合在复合物上的RNA进行分析。
RIP技术下游结合microarray技术被称为RIP-Chip,帮助我们更高通量地了解癌症以及其它疾病整体水平的RNA变化。
CHIRP-Seq( Chromatin Isolation by RNA Purification )是一种检测与RNA绑定的DNA和蛋白的高通量测序方法。
方法是通过设计生物素或链霉亲和素探针,把目标RNA拉下来以后,与其共同作用的DNA染色体片段就会附在到磁珠上,最后把染色体片段做高通量测序,这样会得到该RNA能够结合到在基因组的哪些区域;如果结合物是蛋白质,可以通过将蛋白质打断成短肽再通过质谱进行鉴定,从而或者与RNA结合的蛋白质。
pulldown实验原理及步骤

pulldown实验原理及步骤一、实验原理pulldown实验是一种常用的实验方法,用于研究蛋白质与DNA的相互作用。
该实验利用特定的蛋白质结合域与DNA结合,通过蛋白质与DNA的特异性相互作用,从而实现对蛋白质-DNA复合物的富集和纯化。
pulldown实验的原理基于亲和层析技术,该技术利用靶蛋白与固定在固相介质上的配体之间的特异性结合,将靶蛋白从混合物中富集出来。
在pulldown实验中,DNA序列通常是作为配体固定在固相介质上,而蛋白质则是靶蛋白。
通过将混合物与固相介质接触,靶蛋白与固相上的DNA结合,而其他非特异性结合的蛋白质则被洗脱掉。
最终,只有与DNA特异性结合的蛋白质被富集下来。
二、实验步骤1. 准备工作a. 合成或克隆目标DNA序列,并将其连接到适当的表达载体上。
b. 在表达载体中插入靶蛋白的编码序列。
c. 通过细菌转化等方法将表达载体导入宿主细胞中。
d. 在宿主细胞中诱导靶蛋白的表达。
2. 细胞裂解a. 收集表达靶蛋白的细胞。
b. 使用裂解缓冲液等方法将细胞裂解,释放细胞内的蛋白质。
c. 使用超声波、高压破碎等方法加强细胞裂解效果。
3. 富集DNA-DNA结合复合物a. 准备含有DNA的固相介质,如磁珠、琼脂糖或硅胶。
b. 将裂解液与固相介质接触,使DNA结合到固相上。
c. 使用洗涤缓冲液洗脱非特异性结合的蛋白质。
4. 分离DNA-DNA结合复合物a. 对固相介质进行洗涤,去除残留的非特异性结合的蛋白质和其他杂质。
b. 使用洗脱缓冲液将特异性结合的蛋白质从固相上洗脱下来。
c. 收集洗脱液中的蛋白质,即为富集得到的DNA-DNA结合复合物。
5. 分析DNA-DNA结合复合物a. 使用SDS-PAGE或Western blot等方法检测富集得到的蛋白质。
b. 使用DNA测序等方法分析富集得到的DNA序列。
通过以上步骤,pulldown实验可以实现对蛋白质-DNA复合物的富集和纯化,从而进一步研究蛋白质与DNA的相互作用。
rnapulldown实验原理

rnapulldown实验原理RNA拉down实验是一种用于检测RNA-蛋白相互作用的技术,可以用来测定RNA和特定蛋白之间的相互作用,从而探究RNA在细胞环境中的功能。
本文将介绍RNA拉down实验的背景、原理、流程以及其优势和缺点。
一、背景RNA拉down实验是一种发展自蛋白免疫沉淀实验(immunoprecipitation,IP)的新技术,简称“RNA-PD”。
它是基于蛋白质-RNA互作的一种检测方法,主要用于鉴定哪些RNA被某种蛋白结合,从而发现RNA的功能性相互作用,从而可以让我们更深入的了解RNA的功能。
二、原理RNA拉down实验将靶蛋白与可结合的核酸探针或核酸抗体结合,然后将全细胞中的RNA转换成具有抗体修饰的纳米级磁珠,最终通过磁分离,将蛋白质免疫沉淀珠从细胞中提取出来。
有了这一细胞抽取的纳米级磁珠,研究人员便可以检测出它们中结合蛋白的RNA序列,并将这些 RNA列及其表达水平与对照组、全细胞中的 RNA析进行比较,从而发现蛋白与RNA的相互作用。
三、流程RNA拉down实验的流程包括以下几个步骤:(1)细胞膜去除:首先,细胞膜应该去除,以便将蛋白质依赖性及质粒依赖性的RNA分离出来。
(2)细胞抽取:其次,细胞抽取,这一部分采用磁珠沉淀技术,通过使用带有抗体的纳米级磁珠,将细胞中特定的RNA聚集起来,其中的RNA聚集物可以进行更详细的分析。
(3)RNA水解:之后,RNA水解,利用水解酶将RNA水解,并加入 RNase inhibitor 以避免非特定性水解。
(4)检测:最后,利用实时定量PCR或者高通量测序技术检测细胞中RNA的表达水平,获得RNA的特定性绑定蛋白的结果。
四、优势RNA拉down实验是一种高灵敏度和特异性的技术,有很多优势: 1.以分离出具有特定RNA结合蛋白的细胞,以检测特定RNA-蛋白相互作用,进而揭示RNA的功能性。
2.能在低浓度的情况下,可以高效的从大量的细胞样本中检测出特定RNA-蛋白的相互作用,同时也避免了重复实验。
RNA pull-down实验

RNA pull-down实验定义:使用体外转录法标记生物素RNA探针,然后与胞浆蛋白提取液孵育,形成RNA-蛋白质复合物。
该复合物可与链霉亲和素标记的磁珠结合,从而与孵育液中的其他成分分离。
复合物洗脱后,通过western blot实验检测特定的RNA结合蛋白是否与RNA相互作用。
RNA Pull Down实验流程。
注释:① 目标RNA生物素标记;② 磁珠富集RNA;③ RNA结合蛋白孵育;④ RNA结合蛋白洗脱;⑤ WB或者MS检测常见问题:问题1:RNA 降解可能原因:1)无核酸酶的环境被破坏;2)体外转录的RNA探针降解解决办法:1)清洗和使用新开的离心管和试剂等2)RNA探针合成后,电泳检测其长度和浓度问题2:RNA结合蛋白的亲和力不够:可能原因:1)结合缓冲环境没有优化2)裂解不完全3)磁珠用量不足4)RNA探针用量不足解决办法:1)优化孵育时间、温度、盐浓度等条件2)增加裂解液和蛋白上样量的比例3)增加裂解液4)增加磁珠用量5)增加探针用量6)确定生物素和链霉亲和素效率问题3:RNA结合蛋白没有结合可能原因:1)靶蛋白量不足2)缓冲体系不对3)RNA探针和蛋白的亲和力本来就低解决办法:1)增加上样蛋白量2)应用低盐体系3)加入交联试剂问题4:结合的非特异性高可能原因:1)缓冲环境没有优化2)缓冲环境严谨性低3)样品没有裂解完全和裂解体系没有优化解决方法:1)优化孵育时间温度盐浓度等条件2)使用严谨性高的缓冲体系3)调低RNA探针和样品的比例4)提高裂解液的量问题5:WB信噪比高可能原因:1)阳性信号率低2)一抗效率低3)蛋白没有充分溶解解决方法:1)增加二抗的量2)用敏感度的化学发光液3)用细胞裂解液预孵一抗4)增加样品的量5)确定有没有其他可能的结合情况6)增加裂解液用量。
lncRNA研究策略之RNAPullDown实验技术

【实验技巧】 lncRNA研究策略之:RNA Pull Down实验技术lncRNA研究策略之:RNA Pull Down实验技术RNA pull-down是检测 RNA结合蛋白与其靶RNA 之间相互作用的主要实验手段之一。
RNA pull-down 使用体外转录法标记生物素RNA探针,尔后与胞浆蛋白提取液孵育,形成RNA- 蛋白质复合物。
该复合物可与链亲和素标记的磁珠结合,从而与孵育液中的其他成分分别。
复合物洗脱后,经过Western Blot实验检测特定的 RNA 结合蛋白可否与RNA 相互作用。
1) lncRNA 精选:经过 lncRNA 芯片或 RNA测序等方法对多对疾病模型和比较样本组织进行lncRNA表达谱解析;经过生物信息学的方法精选出拥有表达差其他lncRNA ,成立共表达网络,展望lncRNA的靶基因;经过 PCR 或 Northern Blot技术对候选lncRNA 考据,确定其表达差异。
2) lncRNA 确定:经过 5' RACE获得 lncRNA 5'全长, 3' RACE获得 lncRNA3'全长,最后拿到完满的lncRNA 序列。
3) 表达解析:细胞水平表达:在细胞水平进行检测表达差异。
组织分布:检测不同样组织、不同样阶段表达特点。
表达水平动力学变化:比较不同样办理条件下,如药物办理、引诱办理下,表达水平差异。
4)功能研究:功能获得性研究:成立 lncRNA 过表达载体 :原那么上是将全长 lncRNA定向克隆到表达载体上实现 lncRNA 的过表达。
可是有些lncRNA 很大或全长还没有分别,这时将视lncRNA 在基因组上的定位采用不同样的研究策略。
功能缺失性研究:可经过 siRNA 、shRNA 、反义核酸等方法默然lncRNA ,干预 lncRNA后检测其对疾病相关基因表达的影响和对细胞表型如增值、凋亡、侵袭、转移等的影响;采用 RNA pull down、 RNA-RIP(RNA Binding Protein Immunoprecipitation)、ChIRP-seq(Chromatin Isolation by RNA Purification)等方法检测与 lncRNA 结合的 DNA 、RNA 、蛋白质。
超详细!手把手教你做RNApull-down

超详细!⼿把⼿教你做RNApull-down随着⾼通量测序技术的发展,越来越多的长链⾮编码RNA(long non-coding RNA,lncRNA)被注释出来,其⼴泛的⽣物学功能也成为近年来的研究热点。
RNA与蛋⽩质的相互作⽤是发挥功能的主要作⽤机制之⼀,⽽作为检测RNA与其结合蛋⽩相互作⽤的⼀种重要的⼿段—RNA pull-down,具有不可或缺的意义。
简⽽⾔之,RNA pull-down实验就是先将RNA进⾏标记(如⽣物素探针标记),再与细胞裂解液共同孵育,从⽽形成RNA-蛋⽩质复合物,之后再分离复合物得到蛋⽩质,通过western blot 或 mass Spectrometry检测蛋⽩质的技术。
⽬前RNA pull-down技术已成为研究miRNA、lncRNA与相互作⽤蛋⽩的主要技术⼿段之⼀。
那么,如此⾼⼤上的实验,我们到底该怎么下⼿呢?莫⽅,且听本迪⼀⼀道来~⾸先,你需要合成体外转录RNA。
由于后续实验需要将RNA做探针标记,所以需要提前准备好体外转录的RNA⽚段,就好⽐是先把“靶⼦”准备好,才能抓住射过来的箭嘛!那我们常规的做法是:外包给公司合成…(毕竟这个难度系数有点⾼),可以向Takara公司提供RNA过表达的质粒,质粒浓度会有⼀定要求,⼀般要超过200ng/µl,总量超过5µg,第⼀次合成的RNA⼀般20 µg,⾜够做两次RNA pull down了。
其次,需要订购⼀个试剂盒。
Pierce™ RNA 3' End Desthiobiotinylation Kit(Thermo 20163).这个试剂盒是利⽤T4 RNA连接酶将单个脱硫⽣物素化的胞苷⼆磷酸连接到单链RNA的3’端。
3’端的末端标记不⼲扰RNA结构,因此,该⽣物素标记不会影响RNA与蛋⽩的互相作⽤。
每⼀次反应需要50pmol RNA。
孵育时间的延长,以及在标记反应中加⼊DMSO,可优化RNA的标记效率。
想做LncRNA与蛋白互作?RNAPULLDOWN技术了解一下

想做LncRNA与蛋⽩互作?RNAPULLDOWN技术了解⼀下转载请注明:解螺旋·临床医⽣科研成长平台LncRNA是⼀类⼤于200nt的⾮编码RNA分⼦,在个体发育和疾病进程中都发挥了重要的作⽤。
近年来,LncRNA的研究重点已经从早期的⼤规模鉴定,转移到了对具体的某个LncRNA的功能和机制的探索。
LncRNA主要通过与其他分⼦相互作⽤发挥功能,包括RNA,DNA和蛋⽩。
其中,LncRNA与蛋⽩的互作是近⼏年的研究热点,⼩⼜今天给⼤家介绍的就是研究RNA与蛋⽩互作的⽅法——RNA pull down。
进⼊正题之前,先通过⼀篇Nature Communications的⽂章“The LINC01138 drivesmalignancies via activating arginine methyltransferase 5 in hepatocellularcarcinoma”回顾⼀下LncRNA在疾病体系中的研究套路:1选中⼀个LncRNA通过⾼通量的⽅法(包括⾃⼰测序以及挖别⼈的数据)筛选到⼀批LncRNA,然后选⼀个最特别的(包括变化最明显,表达量最⾼或最低,以及⽬前没有相关研究等),在疾病中利⽤qPCR验证它的表达情况(包括癌与正常样品,癌与癌旁以及初诊和缓解,初诊和复发等),并做临床预后分析(包括与疾病分型,危险度划分,⽣存时间等的相关性),妥妥凑到figure1a-g!⽐如我们今天要分析的这篇⽂章,研究者通过对58对肝癌癌组织和癌旁组织的DNA测序分析,发现有53个LncRNA存在基因拷贝数的改变(CNA),然后结合TCGA中的数据,发现有1082个LncRNA的表达量发⽣了2倍的变化,两组数据取交集,最终得到4个LncRNA,它们的基因拷贝数增加,并且表达上升,说明这4个LncRNA的⾼表达是由于基因拷贝数增加引起的。
然后选中LINC01138进⾏下⼀步分析,因为它的CNA变化最明显。
new tech--RNA pull down protein(RNA IP方法)

lncRNA与蛋白互作技术:RNA-Protein Pull-Down/RIP(2013-07-05 11:29:49)lncRNA与蛋白互作技术:RNA-Protein Pull-Down/RIP1、Thermo fisher试剂盒近日,赛默飞世尔科技全新推出了一款Pierce Magnetic RNA-Protein Pull-Down Kit,让研究人员能够以末端标记的RNA作为诱饵,轻松富集蛋白质-RNA的相互作用。
与抗体捕获相比,这种方法的优势在于脱硫生物素化的目标RNA能够直接富集RBP(或复合物)。
蛋白质与RNA的相互作用是许多细胞功能的核心,如蛋白质合成、mRNA组装、病毒复制、细胞发育调控等。
了解它们之间相互作用的分子机制对理解这些生物学过程非常重要。
然而,之前的分析方法往往受限于使用放射性标记,或实验步骤过多,不仅耗时费力,也增加了实验结果的不稳定。
此试剂盒利用脱硫生物素末端标记的RNA和链霉亲和素磁珠标记的来高效富集RNA结合蛋白(RBP)。
与抗体捕获相比,这种方法的优势在于脱硫生物素化的目标RNA能够直接富集RBP(或复合物)。
此外,试剂盒还提供了经过验证的对照,适用于标记和pull-down分析,也与多个下游应用兼容,如Western blotting和质谱(MS)。
试剂盒中包含了Pierce RNA 3’-End Desthiobiotinylation Kit。
它利用T4 RNA连接酶将单个脱硫生物素化的胞苷二磷酸连接到单链RNA的3’端。
3’端的末端标记不干扰RNA结构,因此,比标记核苷酸的随机掺入更加理想。
每个标记反应适合50 pmol RNA;不过,如有必要的话,标记反应也可扩展(从1 pmol 到1 nmol)。
标记反应需要20倍过量的脱硫生物素化核苷酸。
对于不太复杂的RNA,孵育时间可为37°C 30分钟,若是更长或更复杂的RNA,时间也延长到4-16°C过夜。
lncRNA研究的常见思路与策略
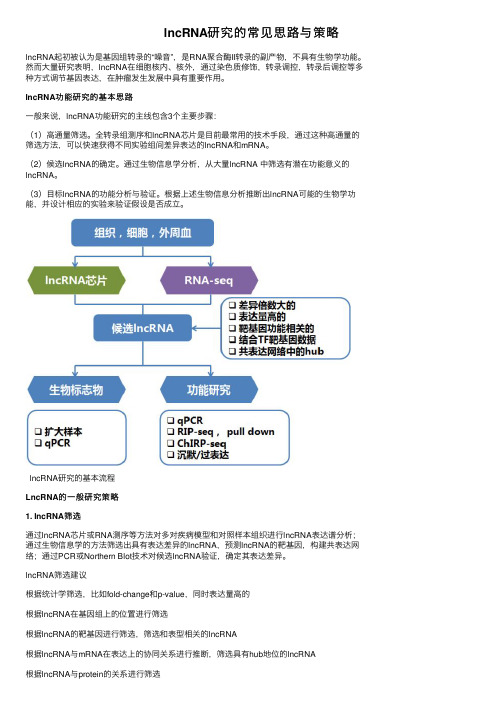
lncRNA研究的常见思路与策略lncRNA起初被认为是基因组转录的“噪⾳”,是RNA聚合酶II转录的副产物,不具有⽣物学功能。
然⽽⼤量研究表明,lncRNA在细胞核内、核外,通过染⾊质修饰,转录调控,转录后调控等多种⽅式调节基因表达,在肿瘤发⽣发展中具有重要作⽤。
lncRNA功能研究的基本思路⼀般来说,lncRNA功能研究的主线包含3个主要步骤:(1)⾼通量筛选。
全转录组测序和lncRNA芯⽚是⽬前最常⽤的技术⼿段,通过这种⾼通量的筛选⽅法,可以快速获得不同实验组间差异表达的lncRNA和mRNA。
(2)候选lncRNA的确定。
通过⽣物信息学分析,从⼤量lncRNA 中筛选有潜在功能意义的lncRNA。
(3)⽬标lncRNA的功能分析与验证。
根据上述⽣物信息分析推断出lncRNA可能的⽣物学功能,并设计相应的实验来验证假设是否成⽴。
lncRNA研究的基本流程LncRNA的⼀般研究策略1. lncRNA筛选通过lncRNA芯⽚或RNA测序等⽅法对多对疾病模型和对照样本组织进⾏lncRNA表达谱分析;通过⽣物信息学的⽅法筛选出具有表达差异的lncRNA,预测lncRNA的靶基因,构建共表达⽹络;通过PCR或Northern Blot技术对候选lncRNA验证,确定其表达差异。
lncRNA筛选建议根据统计学筛选,⽐如fold-change和p-value,同时表达量⾼的根据lncRNA在基因组上的位置进⾏筛选根据lncRNA的靶基因进⾏筛选,筛选和表型相关的lncRNA根据lncRNA与mRNA在表达上的协同关系进⾏推断,筛选具有hub地位的lncRNA根据lncRNA与protein的关系进⾏筛选根据lncRNA与miRNA的靶向关系筛选2. lncRNA全长克隆可以通过5'RACE获取lncRNA 5'全长,3'RACE获取lncRNA 3'全长,最终拿到完整的lncRNA序列。
lncRNA研究策略之RNAPullDown实验技术

【实验技巧】lncRNA研究策略之:RNA Pull Down实验技术lncRNA研究策略之:RNA Pull Down实验技术RNA pull-down是检测RNA结合蛋白与其靶RNA之间相互作用的主要实验手段之一。
RNA pull-down使用体外转录法标记生物素RNA探针,然后与胞浆蛋白提取液孵育,形成RNA-蛋白质复合物。
该复合物可与链亲和素标记的磁珠结合,从而与孵育液中的其他成分分离。
复合物洗脱后,通过Western Blot实验检测特定的RNA结合蛋白是否与RNA相互作用。
1) lncRNA筛选:通过lncRNA芯片或RNA测序等方法对多对疾病模型和对照样本组织进行lncRNA表达谱分析;通过生物信息学的方法筛选出具有表达差异的lncRNA,构建共表达网络,预测lncRNA的靶基因;通过PCR或Northern Blot技术对候选lncRNA验证,确定其表达差异。
2) lncRNA确定:通过5' RACE获取lncRNA 5'全长,3' RACE获取lncRNA3'全长,最终拿到完整的lncRNA序列。
3) 表达分析:细胞水平表达:在细胞水平进行检测表达差异。
组织分布:检测不同组织、不同阶段表达特性。
表达水平动力学变化:比较不同处理条件下,如药物处理、诱导处理下,表达水平差异。
4) 功能研究:功能获得性研究:构建lncRNA过表达载体:原则上是将全长lncRNA定向克隆到表达载体上实现lncRNA的过表达。
然而有些lncRNA很大或全长尚未分离,这时将视lncRNA在基因组上的定位采取不同的研究策略。
功能缺失性研究:可通过siRNA、shRNA、反义核酸等方法沉默lncRNA,干预lncRNA后检测其对疾病相关基因表达的影响和对细胞表型如增值、凋亡、侵袭、转移等的影响;采用RNA pull down、RNA-RIP(RNA Binding Protein Immunoprecipitation)、ChIRP-seq(Chromatin Isolation by RNA Purification)等方法检测与lncRNA结合的DNA、RNA、蛋白质。
ChIP、RIP、RNA pull-down、EMSA、Luciferase原理
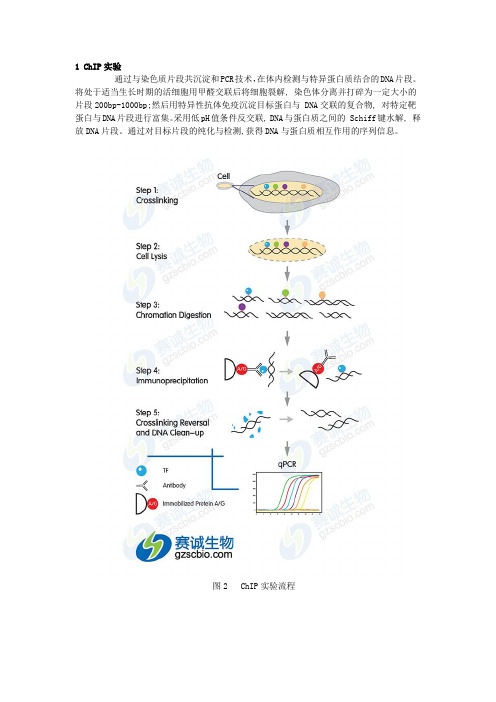
通过与染色质片段共沉淀和PCR技术,在体内检测与特异蛋白质结合的DNA片段。
将处于适当生长时期的活细胞用甲醛交联后将细胞裂解, 染色体分离并打碎为一定大小的片段200bp-1000bp;然后用特异性抗体免疫沉淀目标蛋白与 DNA交联的复合物, 对特定靶蛋白与DNA片段进行富集。
采用低pH值条件反交联, DNA与蛋白质之间的 Schiff键水解, 释放DNA片段。
通过对目标片段的纯化与检测,获得DNA与蛋白质相互作用的序列信息。
图2 ChIP实验流程RIP技术(RNA Binding Protein Immunoprecipitation,RNA结合蛋白免疫沉淀),是研究细胞内RNA与蛋白结合情况的技术。
运用针对目标蛋白的抗体把相应的RNA-蛋白复合物沉淀下来,然后经过分离纯化就可以对结合在复合物上的RNA进行分析;即用抗体或表位标记物捕获细胞核内或细胞质中内源性的RNA结合蛋白,防止非特异性的RNA的结合,免疫沉淀把RNA结合蛋白及其结合的RNA一起分离出来,结合的RNA序列通过microarray (RIP-Chip),定量RT-PCR或高通量测序(RIP-Seq)方法来鉴定。
是了解转录后调控网络动态过程的有力工具,能帮助我们发现miRNA的调节靶点。
图3 RIP实验流程3 RNA pull-down实验使用体外转录法标记生物素RNA探针,然后与胞浆蛋白提取液孵育,形成RNA-蛋白质复合物。
该复合物可与链霉亲和素标记的磁珠结合,从而与孵育液中的其他成分分离。
复合物洗脱后,通过western blot实验检测特定的RNA结合蛋白是否与RNA相互作用。
图4 RNA pull-down实验流程4 EMSA实验凝胶迁移或电泳迁移率实验(EMSA-electrophoretic mobility shift assay)是一种研究DNA结合蛋白和其相关的DNA结合序列相互作用的技术,可用于研究DNA结合蛋白和其相关的DNA结合序列相互作用、DNA定性和定量分析。
RNA pull down

RNA pull down 实验技术流程①目标RNA生物素标记②磁珠富集RNA③RNA结合蛋白孵育④RNA结合蛋白洗脱⑤WB或者MS检测RNA pull- down实验常见问题一.质粒转化、涂板、摇菌1. 取JM109感受态细菌80µl,加入1.5mlEP管中,用10µl枪头沾取质粒加入上述EP管中,混匀。
2. 冰上静置30min。
3. 42℃热休克90-120s。
4. 迅速移至冰上静置2min。
5. 在超净台内,于上述EP管中加入50µl lb培养基(Amp-),37℃,160rpm摇床,增菌0.5-1h。
6. 菌液4,000rpm离心10min,弃大部分上清,将沉淀重悬,菌液全部加入LB平板(Amp+)上,涂布均匀,37℃倒置培养(过夜12-15h)。
7. 将37℃培养(12-16h)平板取出,于无菌操作台中挑取单克隆放入内含5ml LB培养基(Amp+)的15ml离心管中,于37℃、250rpm摇床增菌过夜18H,看菌液是否浑浊。
菌液浑浊后进行质粒中提。
二. 质粒中提(TIAN gen,DP107-02)1. 柱平衡:向吸附柱CP3中(吸附柱放入收集管中)加入500µl的平衡液BL,12,000rpm离心1min,尽量吸除上清。
2. 取1.5ml过夜培养的菌液,加入离心管中,使用常规台式离心机,12,000rpm离心1min,尽量吸除上清。
3. 向留有菌体沉淀的离心管中加入250µl溶液P1使用移液器彻底细菌沉淀。
4. 向离心管中加入250µl溶液P2,温和的上下翻转6-8次使菌体充分裂解。
5. 向离心管中加入350µl溶液P3,立即温和的上下翻转6-8次,充分混匀,此时将出现白色絮状沉淀,12,000rpm,离心10min,此时在离心管底部形成沉淀。
6. 将上一步收集的上清液用移液器转移到吸附柱CP3中,12,000rpm,离心30-60sec,倒掉收集管中的废液,将吸附柱CP3放入收集管中。
神操作!5-10分的lncRNA-转录因子文章竟然是这么设计出来的!

神操作!5-10分的lncRNA-转录因子文章竟然是这么设计出来的!导读一、转录因子定义与分类1.转录因子定义2.常见转录因子(TF)类型二、实验设计思路1.实验课题设计思路:①实验课题设计思路-lncRNA研究②实验课题设计思路-lncRNA表达与特征③实验课题设计思路-lncRNA调控基因④实验课题设计思路-lncRNA通过转录因子调控基因⑤实验课题设计思路-lncRNA.基因体内功能2.HAND2-AS1通过E2F4调控C16orf74介导宫颈癌发展①lncRNA HAND2-AS1在宫颈癌中表达下降②HAND2-AS1抑制C16orf74的表达③HAND2-AS1抑制宫颈癌细胞增殖迁移④HAND2-AS1通过C16orf74/ PPP3CA调控宫颈癌发生⑤HAND2-AS1在体内抑制宫颈癌发展3.WT1-AS通过SPI1调控PIK3AP1介导宫颈癌细胞自噬和凋亡①lncRNA WT1-AS在宫颈癌中表达下降②WT1-AS促进PIK3AP1的表达③WT1-AS调控宫颈癌细胞自噬与凋亡④WT1-AS通过PIK3AP1调控宫颈癌发生⑤WT1-AS在体内抑制宫颈癌发展三、文献示例1.文章思路2.lncRNA在细胞高表达-实验内容3.lncRNA在维持干细胞特性-实验内容4.lncRNA调节的下游基因及通路-实验内容5.lncTCF7-转录因子调控示意图一、转录因子定义与分类1.转录因子定义与基因5`端特定序列专一性结合,调节基因以特定的强度在特定的时间与空间表达的蛋白质。
(1)在核内发挥作用的蛋白质;(2)每一个转录因子识别特异的核酸序列;(3)调节DNA向RNA 转录过程。
2.常见转录因子(TF)类型(1)构成型TF:普遍一直存在.结合基因启动子调控基因转录,Sp1, NF1等。
(2)条件型TF:① 发育型TF,表达受到严格控制,一旦表达即具有活性,如GATA. HNF.PIT-1.MyoD.Myf5. Hox. Winged Helix等。
提个小白问题:RIP和RNApulldown两种方法有何异同,有必要同时做吗?

提个小白问题:RIP和RNApulldown两种方法有何异同,有
必要同时做吗?
renzhashehui
最近接手课题组别人做到一半的课题,要
验证某个lncRNA的目的蛋白,课题计划里设
计了同时做这两个实验。
网上查找的一些资料
显示这两种方法目的似乎差不多,具体有何异
同不太清楚,有没有必要都做?求解。
RIP和RNA pulldown都是研究RNA和蛋白相互作用的经典方法,只是出发点不一样而已。
RIP,RNA 结合蛋白便宜共沉淀,是从蛋白出发研究蛋白RNA相互作用的技术。
就是已知一个蛋白,推测会与你的目的RNA相互作用,用蛋白的抗体做免疫共沉淀,把蛋白结合的RNA富集出来并鉴定目的RNA,以证实蛋白与RNA的相互作用。
RNA pulldown是从RNA出发研究蛋白与RNA相互作用的技术。
就是用已知的RNA 去拉蛋白,在做western验证以证实蛋白与RNA 的相互作用。
其实就是要证实蛋白与RNA两个分子相互作用,分别从蛋白和RNA的角度求证。
一般两个实验都是阳性才能说明他们相互作用。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
【实验技巧】lncRNA研究策略之:RNA Pull Down实验技术lncRNA研究策略之:RNA Pull Down实验技术RNA pull-down是检测RNA结合蛋白与其靶RNA之间相互作用的主要实验手段之一。
RNA pull-down使用体外转录法标记生物素RNA探针,然后与胞浆蛋白提取液孵育,形成RNA-蛋白质复合物。
该复合物可与链亲和素标记的磁珠结合,从而与孵育液中的其他成分分离。
复合物洗脱后,通过Western Blot实验检测特定的RNA结合蛋白是否与RNA相互作用。
1) lncRNA筛选:通过lncRNA芯片或RNA测序等方法对多对疾病模型和对照样本组织进行lncRNA表达谱分析;通过生物信息学的方法筛选出具有表达差异的lncRNA,构建共表达网络,预测lncRNA的靶基因;通过PCR或Northern Blot技术对候选lncRNA验证,确定其表达差异。
2) lncRNA确定:通过5' RACE获取lncRNA 5'全长,3' RACE获取lncRNA3'全长,最终拿到完整的lncRNA序列。
3) 表达分析:细胞水平表达:在细胞水平进行检测表达差异。
组织分布:检测不同组织、不同阶段表达特性。
表达水平动力学变化:比较不同处理条件下,如药物处理、诱导处理下,表达水平差异。
4) 功能研究:功能获得性研究:构建lncRNA过表达载体:原则上是将全长lncRNA定向克隆到表达载体上实现lncRNA的过表达。
然而有些lncRNA很大或全长尚未分离,这时将视lncRNA在基因组上的定位采取不同的研究策略。
功能缺失性研究:可通过siRNA、shRNA、反义核酸等方法沉默lncRNA,干预lncRNA后检测其对疾病相关基因表达的影响和对细胞表型如增值、凋亡、侵袭、转移等的影响;采用RNA pull down、RNA-RIP(RNA Binding Protein Immunoprecipitation)、ChIRP-seq(Chromatin Isolation by RNA Purification)等方法检测与lncRNA结合的DNA、RNA、蛋白质。
采用lncRNA芯片分析技术结合mRNA对lncRNA功能进行预测,研究lncRNA trans和cis作用机制。
采用配体指数级富集系统进化技术(systematic evolution of ligands by exponential enrichment,SELEX),设计一种RNA配体,与癌症相关的lincRNA结合达到抑制肿瘤细胞的生长和转移。
采用快速预测RNA与蛋白质相互作用与结构域(catRAPID)在线算法来预测RNA与蛋白质的相互作用,该算法根据RNA和蛋白质的二级结构、氢键和分子作用力来评估它们之间的相互作用的倾向。
采用非编码RNA沉默和定位分析(c-KLAN)技术对lncRNA进行功能缺失(Loss-of-function)研究和细胞定位,该技术是在基于核糖核酸内切酶制备的小干扰RNA(esiRNA)和荧光原位杂交(FISH)2种现有的研究方法的基础上建立起来的。
5) 表达调控:将lncRNA表达与其他领域相结合,解释lncRNA调控机理。
DNA甲基化:可通过检测相应基因甲基化差异与lncRNA结合分析。
转录因子:研究lncRNA与转录因子的调控机制。
染色质重塑:lncRNA表观调控。
一.质粒转化、涂板、摇菌1.取JM109感受态细菌80µl,加入1.5mlEP管中,用10µl枪头沾取质粒加入上述EP管中,混匀。
2.冰上静置30min。
3.42℃热休克90-120s。
4.迅速移至冰上静置2min。
5.在超净台内,于上述EP管中加入50µlLB培养基(Amp-),37℃,160rpm摇床,增菌0.5-1h。
6.菌液4,000rpm离心10min,弃大部分上清,将沉淀重悬,菌液全部加入LB平板(Amp+)上,涂布均匀,37℃倒置培养(过夜12-15h)。
7.将37℃培养(12-16h)平板取出,于无菌操作台中挑取单克隆放入内含5mlLB培养基(Amp+)的15ml离心管中,于37℃、250rpm摇床增菌过夜18H,看菌液是否浑浊。
菌液浑浊后进行质粒中提。
二.质粒中提(TIANGEN,DP107-02)1.柱平衡:向吸附柱CP3中(吸附柱放入收集管中)加入500µl的平衡液BL,12,000rpm离心1min,尽量吸除上清。
2.取1.5ml过夜培养的菌液,加入离心管中,使用常规台式离心机,12,000rpm离心1min,尽量吸除上清。
3.向留有菌体沉淀的离心管中加入250µl溶液P1使用移液器彻底细菌沉淀。
4.向离心管中加入250µl溶液P2,温和的上下翻转6-8次使菌体充分裂解。
5.向离心管中加入350µl溶液P3,立即温和的上下翻转6-8次,充分混匀,此时将出现白色絮状沉淀,12,000rpm,离心10min,此时在离心管底部形成沉淀。
6.将上一步收集的上清液用移液器转移到吸附柱CP3中,12,000rpm,离心30-60sec,倒掉收集管中的废液,将吸附柱CP3放入收集管中。
7.向吸附柱CP3中加入500µl去蛋白液PD,12,000rpm离心,离心30-60sec,倒掉收集管中的废液,将吸附柱CP3重新放回收集管中。
8.向吸附柱CP3中加入600µl去蛋白液PW,12,000rpm离心,离心30-60sec,倒掉收集管中的废液,将吸附柱CP3重新放回收集管中。
重复一次。
9.将吸附柱CP3重新放回收集管中,12000rpm离心2min。
10.将吸附柱CP3置于一个干净的离心管中,向吸附膜的中间部位滴加50µl洗脱缓冲液EB,室温放置2min,12,000rpm离心2min,将质粒溶液收集到离心管中,放冰盒,测浓度。
三.质粒线性化:本实验使用的酶为Biolabs的重组酶KpnⅠ。
酶切后进行跑胶。
四.琼脂糖凝胶电泳1.配胶。
成分:琼脂糖粉、TBE、ⅠH2O,少量EB。
2.TBE与H2O混合加入放好琼脂糖粉的锥形瓶中,摇匀,放入微波炉加热1-2min。
3.滴加少量EB,于锥形瓶中摇匀。
4.倒入胶板中,插入梳子,待琼脂糖凝固。
5.小心拔掉梳子,取10µl样品加入1µl的10×LoadingBuffer缓缓加入点样孔,并在最右边的点样孔加5µlDNAmaker。
6.接通电源。
7.电泳完毕,关闭电源。
从胶模中取出琼脂糖凝胶,于紫外灯下切下目的条带。
五.胶回收(TIANGEN,DP214-02)1.向吸附柱CB2中加入500µl平衡液BL,12,000rpm离心1min,倒掉收集管中的废液,将吸附柱重新放回收集管中。
2.将单一的目的DNA条带从琼脂糖凝胶中切下放入干净的离心管中,称取重量。
3.向胶块中加入等倍体积溶液PC,50℃水浴放置10min左右,其间不断的上下翻转离心管,以确保胶块充分溶解。
4.将上一步所得溶液加入一个吸附柱CB2中12,000rpm离心1min,倒掉收集管中的废液,将吸附柱CB2放入收集管中。
5.向吸附柱CB2中加入600µl漂洗液PW,12,000rpm离心1min,倒掉收集管中的废液,将吸附柱CB2放入收集管中。
6.重复操作步骤⑤。
7.将吸附柱CB2放入收集管中,12,000rpm离心2min,尽量除去漂洗液。
将吸附柱置于室温放置数分钟,彻底晾干。
8.将吸附柱CB2放入一个干净的离心管中,向吸附膜中间位置悬空滴加适量的洗脱缓冲液EB,室温放置2min,12,000rpm离心2min,收集DNA溶液。
六.转录以及生物素标记:1.取无RNA酶管,按下表操作:2.取出孵育好的EP管,加入2µl的DNaseⅠ,37℃孵育15min以除去体系中的DNA。
3.取出上述操作的EP管,加入2µl0.2MEDTA(pH=8.0)终止反应。
4.取1µgBiotin标记的RNA,加入适量StructureBuffer,使得RNA形成二级结构。
然后将RNA95℃加热2min,冰浴3min,室温静置30min。
5.磁珠准备:使用RIPWashBuffer500µl冲洗磁珠3次。
6.用50µlRIPWashBuffer重悬磁珠,然后将其加入到生物素标记并变性的RNA中,4℃过夜。
7.过夜的混合物3000rpm离心1min,去上清。
8.RIPWashBuffer冲洗3次,切记将液体沿壁加入或者滴加,上下缓慢翻转混匀,切勿用移液器吹打。
9.往磁珠-RNA混合物中加入细胞裂解液,裂解液中加入适量RNase抑制剂,室温放置1h。
10.将孵育好的磁珠-RNA-蛋白混合物低速离心,上清回收,使用RIPWashBuffer冲洗3次,1次1ml。
11.于样品中加5×SDS上样缓冲液,95℃变性10min,跑SDS-PAGE凝胶。
12.考染:取出SDS-PAGE凝胶于考马斯亮蓝染色液中,摇床过夜。
次日用考马斯亮蓝脱色液脱色1~2h,中间更换几次脱色液至条带清晰,背景低为止。
13.将目的条带切下送测序(质谱检测)。
问题1:RNA降解可能原因:1)无核酸酶的环境被破坏2)体外转录的RNA探针降解解决办法:1)清洗和使用新开的离心管和试剂等2)RNA探针合成后,电泳检测其长度和浓度问题2:RNA结合蛋白的亲和力不够:可能原因:1)结合缓冲环境没有优化2)裂解不完全3)磁珠用量不足4)RNA探针用量不足解决办法:1)优化孵育时间、温度、盐浓度等条件2)增加裂解液和蛋白上样量的比例3)增加裂解液4)增加磁珠用量5)增加探针用量6)确定生物素和链霉亲和素效率问题3:RNA结合蛋白没有结合可能原因:1)靶蛋白量不足2)缓冲体系不对3)RNA探针和蛋白的亲和力本来就低解决办法:1)增加上样蛋白量2)应用低盐体系3)加入交联试剂问题4:结合的非特异性高可能原因:1)缓冲环境没有优化2)缓冲环境严谨性低3)样品没有裂解完全和裂解体系没有优化解决方法:1)优化孵育时间温度盐浓度等条件2)使用严谨性高的缓冲体系3)调低RNA探针和样品的比例4)提高裂解液的量问题5:WB信噪比高可能原因:1)阳性信号率低2)一抗效率低3)蛋白没有充分溶解解决方法:1)增加二抗的量2)用敏感度的化学发光液3)用细胞裂解液预孵一抗4)增加样品的量5)确定有没有其他可能的结合情况6)增加裂解液用量。
