土壤酸碱性和氧化还原反应..
土壤酸碱反应和氧化还原反应

过度施用石灰的负面影响
土壤板结,结构变劣; 部分微量元素有效性降低;磷的有效性
也下降。 因此,施用石灰要适量。 影响石灰施用量的因素有:
土壤潜性酸和pH;盐基饱和度;质地; 有机质含量;石灰的种类和施用方法; 作物的要求等;
石灰需要量的估算
石灰需要量= 土壤体积*容重*CEC*(1-盐基饱和度) 单位:千克/公顷
不同作物对土壤酸碱性都有一定的要求, 这是植物长期的自然选择的结果。常见 植物对土壤pH的要求见下表:
植物适宜的pH范围
适应偏碱 性pH7-8
紫苜蓿
适应中到微 碱性pH6.57.5
苹果
适应中到微 适应偏酸性 适应酸性 酸性的pH6-7 的pH5.5-6.5 的pH5-6
蚕豆
水稻
小麦
金花菜 黄花苜蓿 碗豆
包权
人书友圈7.三端同步
土壤酸碱性的分级
强酸性 酸性 中性 碱性 强碱性
pH<5.0 pH5.0-6.5 pH6.5-7.5 pH7.5-8.5 pH>8.5
2、潜性酸
(1)概念与成因 土壤胶粒上吸附的氢离子和铝离子进
入土壤溶液后表现出来的酸度,称为潜 性酸。
在一般矿质土壤中, 由交换性铝离子产 生的酸度, 比由交换性氢离子产生的酸度 重要。红壤的交换性酸度,90%以上是 由交换性铝所引起。
档消耗一个共享文档下载特权。
年VIP
月VIP
连续包月VIP
享受100次共享文档下载特权,一次 发放,全年内有效
赠每的送次VI的发P类共放型的享决特文定权档。有下效载期特为权1自个V月IP,生发效放起数每量月由发您放购一买次,赠 V不 我I送 清 的P生每 零 设效月 。 置起1自 随5每动 时次月续 取共发费 消享放, 。文一前档次往下,我载持的特续账权有号,效-自
《土壤学》课程笔记

《土壤学》课程笔记第一章:什么是土壤?1.1 土壤的重要性与功能土壤不仅是地球表面的一个物理层,它还是一个动态的生态系统,具有多种重要性和功能:- 生命支持系统:土壤是植物生长的基础,为植物提供必需的养分、水分和栖息地,从而支撑着地球上绝大多数生物的生命活动。
- 水循环的关键参与者:土壤是大气降水的主要接收者,通过渗透、蒸发和径流等过程参与水循环,维持水文平衡。
- 养分循环的枢纽:土壤是生物地球化学循环的核心,包括碳、氮、磷、硫等元素的循环,这些元素是所有生命体必需的。
- 环境净化器:土壤具有过滤、吸附、降解和转化污染物质的能力,有助于保护地下水和地表水质量。
- 土壤保持文化遗产:土壤记录了地球历史和人类活动的信息,是自然和文化遗产的一部分。
1.2 一方水土养一方人土壤的特性直接影响着一个地区的生态环境、经济发展和人类生活方式:- 地域性:不同地区的土壤类型和特性不同,这决定了当地的植被类型、农作物种植模式和农业生产效率。
- 文化影响:土壤条件影响人类居住模式、饮食习惯和传统技艺,如稻田文化、葡萄种植文化等。
- 经济发展:土壤资源丰富与否直接影响地区经济的发展,如农业、矿业和旅游业等。
1.3 土壤的概念与土壤学内容土壤是由矿物质、有机质、水分、空气和生物组成的复杂混合体,具有以下特点:- 物理性质:土壤的物理性质包括质地、结构、孔隙度、水分和温度等。
- 化学性质:土壤的化学性质涉及pH值、养分含量、阳离子交换量、有机质含量等。
- 生物性质:土壤是地球上生物多样性最丰富的栖息地之一,包括微生物、昆虫、植物根系等。
土壤学内容主要包括:- 土壤的形成与演变:研究土壤如何从母质经过生物、气候和时间的作用形成,以及土壤剖面的发育过程。
- 土壤分类:根据土壤的形态、性质和发生特性,将土壤划分为不同的类型。
- 土壤的物理、化学和生物性质:研究土壤的物理结构、化学成分和生物活动对土壤功能的影响。
- 土壤肥力和植物营养:探讨土壤如何提供植物生长所需的养分,以及如何通过施肥等手段提高土壤肥力。
土壤(第九章)土壤酸碱性和氧化还原反应..

土壤碱化度分级:
ESP 5%~10% 10%~15%
>15%
轻度碱化土 中度碱化土 强碱化土
盐土——土壤表层可溶性盐(以NaCl、Na2SO4等 中性盐为主)超过一定含量(6~20g/kg)。
我国碱土定义:碱化层碱化度>30%, 表层含盐量<5g/kg,pH>9.0
土壤学
资源环境学院土地资源与农业化学系
(2)生物因素 Na、K 、Ca、Mg等盐基的生物积累。 一些植物适应在较干旱条件下生长,而且有
富集碱性物质的作用:海蓬子含Na2CO3 3.75%, 碱蒿含2.76%。盐蒿含2.14%。
土壤学
资源环境学院土地资源与农业化学系
(3)母质 碱性物质的基本来源。基性岩、超基性岩富含
碱性物质。含盐基物质多,形成的土壤为碱性。 (4)施肥和灌溉
碱性土还原pH下降,主要由于在嫌气条件 下有机酸和CO2的积累过程及其综合作用。
土壤学
资源环境学院土地资源与农业化学系
第三节 土壤氧化还原反应
一、土壤氧化还原体系
土壤中同一物质可区分为氧化态(剂)和还原态 (剂),构成相应的氧化还原体系 。
土壤学
资源环境学院土地资源与农业化学系
1.土壤空气中O2是主要氧化剂 通气良好的土壤中,氧体系控制氧化还原反应,使 多种物质呈氧化态,如NO3-、Fe3+、Mn4+、SO42-等。 2.土壤有机质特别是新鲜有机物是主要还原剂,在 土壤缺O2条件下,将氧化物转化为还原态。 3.土壤中氧化还原体系可分为无机体系和有机体系。
6.土壤氧化还原状况随栽培管理措施特别是灌水、 排水而变化
土壤学
资源环境学院土地资源与农业化学系
二、土壤氧化还原指标
1. 强度指标 (1)氧化还原电位(Eh)
第9-1章+土壤酸碱性和氧化还原反应
土壤学
Chapter 9. 土壤酸碱性和氧化还原反应 Soil acid-base and redox reaction §9.1 土壤酸度 §9.2 土壤碱度 §9.3 土壤氧化还原反应 §9.4 土壤缓冲性 §9.5 土壤酸碱性和氧化还原状况与生物环境
吉林大学植物科学学院农业资源与环境系
吉林大学植物科学学院农业资源与环境系
土壤学
交换酸度exchange acidity 用中性盐溶液(1mol/L
KCl、0.06mol/L BaCl2等)处理酸性土壤时, 土壤胶体 上交换性的阳离子大部分被浸提剂中的阳离子交换 下来进入溶液。此时,交换性氢离子可使溶液酸性 增加,而交换性Al3+因水解, 也使溶液酸性增加。
性酸。
xH+
colloid
colloid
(x-y)H+来自+ yH+
潜在酸的产生
2. 土壤胶体上吸附性氢离子被其他离子所代换 当施用硫铵、石灰或其他肥料时,土壤溶液盐基 离子浓度增加,吸附性H+离子部分被交换出 来进入溶液,土壤酸度随之变化。
colloid
xH + Ca2+
colloid
Ca (x-2)H
Acid drops movement
Acid lake
2. 土壤中铝的活化
氢离子进入土壤吸收复合体后,随着阳离子交换作用的进行, 土壤盐基饱和度下降,氢饱和度提高,胶粒晶体结构破坏, 铝八面体解体,铝离子成为活性铝离子,吸附后成交换性 Al3+离子,交换进入土壤溶液,溶液中的铝离子和阴离子形 成的盐类多为非中性盐,解离产生H+离子。
土壤酸碱反应是土壤重要的化学性质,直 接影响作物的生长和微生物的活动以及土 壤的其他性质。
土壤酸碱性和氧化还原反应

强酸性土壤 Soils with strong acidity
交换性Al3+与溶液Al3+处于平衡:
Soil colloid Al3+
Al3+
溶液中Al3+水解显示酸性:
Al3++3H2O
Al(OH)3+3H+
强酸性土中,Al3+大大多于交换性 H+,是活性酸(溶液 H+离子)的主要来源。 如:pH<4.8的红壤,交换性Al3+占总酸度的95%以上
M H
Soil colloid
M
+ 2H+
Soil colloid
H
+
2M+
土壤中H+的来源 Origin of H+ in soils
水的解离 Dissociation of H2O
HOH H OH
碳酸解离 Dissociation of H2CO3 有机酸的解离 Dissociation of organic acid
土壤酸碱性和氧化还原反应
第一节 土壤酸、碱性的形成
Formation of soil acidity and alkalinity
Importance
The soil reaction is a term used to indicate soil acidity/alkalinity or acid-base reactions in soils. Many soil chemical and biochemical reactions can occur only at specific soil acidity/alkalinity. The rate of decomposition of soil minerals and organic matter is influenced by soil acidity/alkalinity. Formation of clay minerals depends on soil pH. Plant growth is also affected either directly or indirectly by soil pH. H+ ions are reported to have a toxic effect on plants when present in high concentration.
6酸碱性及氧化还原反应

• 二、土壤酸碱性 • 土壤酸碱反应是土壤在其形成过程中受自 然成土因素(气候、生物、母质、地形等) 的综合作用所产生的重要属性,在耕地土 壤中,它们还受耕作、施肥、灌溉、排水 等一系列农业措施的影响而发生相应的变 化,并与土壤生物活动密切相关。因此, 在探讨土壤发生、演变的原因和规律、以 及合理利用和改良土壤时,都应当对土壤 酸碱性产生的原因及其对土壤物质的转化、 土壤理化性质的影响等有所了解。
• 一、土壤溶液 • 土壤水不是纯水,自然降水就溶有少量 的CO2、O2、HNO2,以及微量的• NH4+和 其它化合物,进入土壤后即和土壤组成物 质接触并发生作用,促使土壤中更多的可 溶性物质溶于水中,这种含有各种可溶性 物质的土壤水,便是土壤溶液。土壤溶液 是土壤中最活跃的组成部分,它直接参与 土壤的形成过程。土壤的酸碱反应和氧化 还原过程是在土壤溶液中进行的,而且在 土壤物质交换、植物营养以及水分的供应 等方面也起着重要作用。
• 三、土壤缓冲性能 • (一) 概念:在一定范围内,土壤溶液抵抗酸碱变化的能 力叫土壤缓冲性。 • (二) 土壤具有缓冲性的原因: • 1.土壤溶液中弱酸及其盐类的存在:土壤中存在一些 碳酸、磷酸、硅酸等及其盐类,构成缓冲系统,对酸碱具 有缓冲作用。 • H2CO3+Ca(OH)2→CaCO3+2H2O CaCO3+H2SO4→CaSO4+H2CO3 • 2.土壤中两性胶体的存在:土壤中的蛋白质、氨基酸、 胡敏酸等都是两性胶体,即能中和酸,又能中和碱。 • NH2 NH3Cl • R-CH-COOH+HCl→R-CH-COOH • NH2 NH2 • R-CH-COOH+NaOH→R-CH-COONa+H2O • 以上两类缓冲物质在土壤中的数量都很少,其缓冲作用 是有限的。
土壤酸碱性和氧化还原反应..

土壤胶粒-Na+CaSO4===土壤胶粒-Ca+NaSO4
(淋洗排出)
3、对碱化土、碱土,可施用石膏、硅酸钙, 以钙将土壤胶体上的钠代换下来,并随水排出, 从而降低土壤的PH,改善土壤理化性状。
桑 6.0-8.0 桦 5.0-6.0 泡桐 6.0-8.0 油桐 6.0-8.0 榆 6.0-8.0 侧柏 6.0-7.5 柽柳 6.0-8.0
四、土壤酸碱性的调节
(一)土壤酸性的调节
土壤酸性主要由胶体吸附的交换性H+和Al3+所控 制,在改良土壤酸性时,不仅要中和活性酸,更重 要的是中和潜在酸,才能从根本上改变酸性的大小。
• 碱化度>30%,含盐量<0.5%和pH >9.0定为碱土
• 碱化度5—10%轻度碱化
•
10—15%中度碱化
•
15—20%强碱化土壤
三、影响土壤碱化的因素
1、气候
碱土都分布在干旱、半干旱和漠境区由 于蒸降比一般为5—10,甚至20以上,明显 的季节性积盐和脱盐频繁交替的特点,是 土壤碱化的重要条件。
十4H20 当溶液中OH-离子增多时,铝离子周围的水分子 中就有一、两个水分子解离出H+,以中和加入的OH离子,生成水。
pH>5时,铝离子形成A1(OH)3沉淀,失去它的 缓冲能力。
三、影响缓冲作用的因素
• 1、土壤无机胶体蒙脱伊利>高岭>含水氧
•
化硅
• 2、土壤质地黏土>壤土 >砂土
• 3、土壤有机质含量高缓冲作用大
CH3COONa+H2O==CH3cooH+NaOH
土壤学第八章 土壤酸碱性和氧化还原过程

全文电子教材土壤与土壤资源学(上篇:土壤学)林学专业第八章土壤酸碱性和氧化还原过程第一节土壤酸碱性一、土壤酸度类型及来源1、活性酸由土壤溶液中游离的H+引起的,常用pH值表示,即溶液中氢离子浓度的负对数。
土壤中的水分含有各种可溶的有机、无机成分,有离子态、分子态,还有胶体态的,因此土壤中的水实际上是一种极为稀薄的溶液。
盐碱土中土壤溶液的浓度比较高。
土壤酸碱性主要根据活性酸划分:pH在6.6~7.4之间为中性。
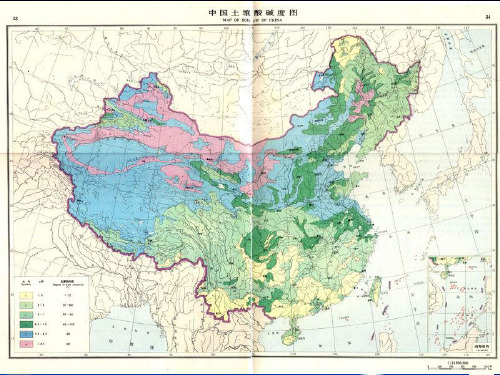
我国土壤pH一般在4-9之间,在地理分布上由南向北pH逐渐减小,大致以长江为界。
长江以南的土壤为酸性和强酸性,长江以北的土壤多为中性或碱性,少数为强碱性。
2、潜性酸土壤胶体上吸附的氢离子或铝离子,进入溶液后才会显示出酸性,称之为潜性酸,常用1000克烘干土中氢离子的厘摩尔数表示潜性酸可分为两类:(1)代换性酸:用过量中性盐(氯化钾、氯化钙等)溶液,与土壤胶体发生交换作用,土壤胶体表面的氢离子或铝离子被侵提剂的阳离子所交换,使溶液的酸性增加。
测定溶液中氢离子的浓度即得交换性酸的数量。
(2)水解性酸:用过量强碱弱酸盐(CH3COONa)浸提土壤,胶体上的氢离子或铝离子释放到溶液中所表现出来的酸性。
CH3COONa水解产生NaOH,pH值可达8.5,Na+可以把绝大部分的代换性的氢离子和铝离子代换下来,从而形成醋酸,滴定溶液中醋酸的总量即得水解性酸度。
要改变土壤的酸性程度,就必须中和溶液中和胶体上的全部交换性氢离子和铝离子。
在酸性土壤改良时,可根据水解性酸来计算所要施用的石灰的量。
3、土壤酸的来源(1)土壤中H+的来源由 CO2引起(土壤空气、有机质分解、植物根系和微生物呼吸);土壤有机体的分解产生有机酸;硫化细菌和硝化细菌还可产生硫酸和硝酸;生理酸性肥料(硫酸铵、硫酸钾等)的施用。
(2)气候对土壤酸化的影响在多雨潮湿地带,盐基离子被淋失,溶液中的氢离子进入胶体取代盐基离子,导致氢离子积累在土壤胶体上。
土壤学复习重点

土壤学复习重点第一章绪论1、土壤的物质组成 : 土壤由矿物质、有机质 ( 土壤固相 ) 、土壤水分 ( 土壤液相 ) 、和土壤空气 ( 土壤气相 ) 三相四类物质组成。
2、土壤肥力 : 指土壤在某种程度上能同时不断地供给和调节植物正常生长发育所需要的水分、养分、空气、热量的能力。
3、土壤生产力 : 土壤生长植物并提供产品的能力, 由土壤本身的肥力属性和发挥肥力作用的外界条件所决定。
4、成土因素 : 气候、生物、地形、母质和时间。
第二章土壤的矿物组成1、矿物 : 矿物是天然产生与地壳中具有一定化学组成、物理性质和内在结构的化合物或单质。
土壤矿物按矿物来源, 可分为原生矿物和次生矿物; 按矿物的结晶状态 , 可分为结晶质和非晶质。
2、岩石 : 岩石是指由一种或数种矿物组成的自然集合体。
3、风化作用 : 风化作用是指地壳最表层的岩石在空气、水、温度和生物活动的影响下 , 发生机械破碎和化学变化的过程。
包括物理风化、化学风化、生物风化三种类型。
4、物理风化 : 指岩石因受物理因素作用而逐渐崩解破碎的过程。
特点: 只能引起岩石形状大小的改变 , 而不改变其矿物组成和化学成分。
5、化学风化 : 指岩石在化学因素作用下, 其组成矿物的化学成分发生分解和改变 , 直至形成在地表环境中稳定的新矿物。
特点: 不仅使已破碎的岩石进一步变细,更重要的是岩石发生矿物组成和化学成分的改变, 产生新的物质。
6、生物风化 : 指动物、植物、微生物的生命活动及其分解产物对岩石矿物的风化作用。
7、构成层状硅酸盐粘土矿物的基本结构单位是硅氧四面体和铝氧八面体。
8、同晶替代 : 是指组成矿物的中心离子被电性相同、大小相近的离子替代而晶格构造保持不变的现象。
9、高岭组 :1:1型粘土矿物,晶层由一层硅片和一层铝片重叠而成。
两个晶层的层面间产生了键能很强的氢键 , 不易膨胀。
基层内没有或极少同晶替代现象 , 其电荷数量少。
颗粒较粗、总表面积相对较小 , 可塑性、粘结性、粘着性和吸湿性都较弱。
土壤酸碱性和氧化还原反应

第一节 第二节
土壤酸碱性 土壤氧化还原反应
a
1
教学目标
(1)熟悉土壤酸碱性及其成因,掌握土壤酸碱变化 规律,明确酸碱性对林木生长和土壤养分的影响。 (2)掌握土壤氧化还原性能的衡量指标
a
2
第一节 土壤酸碱性
a
3
a
4
中国土壤酸碱性分布规律
中国土壤的酸碱性反应,大多数在 pH4.5~8.5之间。在地理分布上有“东南酸 西北碱”的规律性。大致可以长江为界(北 纬33~35),长江以南的土壤为酸性或强酸 性,长江以北的土壤多为中性或碱性。我国 土壤的酸碱性南北差异很大,由南向北土壤 pH相差7个数量级。
二、土壤缓冲作用的机制
• 1.交换性阳离子的缓冲作用
由于土壤胶体表面 吸附有各种阳离子, 当土壤溶液中的H+增加时,胶体表面的交换 性盐基离子与其交换使土壤溶液中的H+浓度 基本不变。
当土壤溶液中的OH-增加时,胶体表面 的致酸离子与其交换,使土壤溶液中OH-浓 度基本不变。致酸离子中的Al3+水解后可产 生3个H+,对碱的缓冲能力特别强。
的能力强()
10.旱地通气条件良好,则Eh比水a田要高()
34
一、名词解释
思考题
土壤酸碱性 潜性酸 水解酸 交换性酸 土壤总酸度 总碱度 碱化度 土壤Eh 土壤缓冲性 二、思考
1、简述土壤酸碱性与土壤肥力的关系
2、土壤具有缓冲性能的原因是什么?
3、为什么在碱性土壤上,常发生作物缺Ca2+和K+的现象?
Al3++H2O⇋Al(OH)2++H+
Al(OH)2++ H2O⇋Al(OH)2++H+
第九章土壤酸碱性和氧化还原反应

水 解 酸
活性酸
Na+交换出的氢和铝离子产生的酸度
羟基化表面解离的H+
土壤活性酸与潜性酸的关系
活性酸与潜性酸具有动态平衡关系,是一个平衡体系中的 两种存在状态,他们同时存在且相互转化。
土壤活性酸(活性H+或Al3+)增多,可被土壤胶粒吸附成为潜性酸,促使潜性增多 潜性酸增多,胶体上的H+或Al3+又通过交换作用转移到土壤溶液中,促使活性酸增多
pH=pKa+lg[盐]/[酸]
pH=pKa+lg[盐基]/[H+、Al3+]
当土壤BS=50%时,对酸碱的缓冲能力最大。缓冲能力随 弱酸及其盐的总浓度或土壤CEC增加而增大。
(二)土壤酸碱缓冲体系(soil acid-base buffer system)
(1)碳酸盐体系:石灰性土壤的缓冲作用主要决定于
2、生物
主要是指具有富集碱性物质的植物,如海蓬子含Na2CO3 3.75%,碱蒿 2.76%,盐蒿2.14%,芦苇0.49%,这些植物死亡后,就将Na2CO3累积在土壤 中,从而导致土壤变碱。
3、施肥和灌溉
施用碱性肥料或用碱性水灌溉会使土壤碱化。如都江堰水质偏碱,长 期灌溉则会使稻田土壤pH升高。
4、母质
(2)土壤活性酸的测定
水浸酸:用水浸提得到的土壤酸度(pH水), 反应土壤活性酸
的强弱;
与盐浸酸:用KCl浸提获到的土壤酸度(pH盐),除反映土壤溶
液中的氢离子外,还反映由K+交换出的土壤胶体表面氢和铝 离子表现出的酸性。pH水通常大于pH盐
水土比对土壤pH值的影响:测定土壤pH值时的水土比一般用
4、植物根系的代谢作用:植物根系汾泌物可直接或间接影响根
土壤颜色自上而下变化的原因

土壤颜色自上而下变化的原因1.引言1.1 概述概述部分的内容可以从以下几个方面进行阐述:土壤是地球上最宝贵的自然资源之一,它承载着许多生态系统的养分和水分,并且对农业、生态环境、水循环等具有重要影响。
土壤的颜色变化是土壤性质和生态环境变化的一个重要指标。
土壤颜色的变化是由多种因素共同作用的结果。
首先,土壤颜色的变化与土壤中有机质的含量和质量有关。
有机质的垫层碳化程度愈高,土壤的颜色也会愈深。
其次,土壤中矿物质的类型和含量也会影响土壤的颜色。
一些矿物质比如铁氧化物会使土壤呈现红色、黄色等颜色,而含铝或含二氧化硅的土壤则呈现浅灰或淡黄色。
此外,土壤中的水分含量也会对土壤颜色产生影响。
在干燥的条件下,土壤中的水分含量减少,使得土壤颜色变得更加深沉。
而在湿润的条件下,土壤颜色可能呈现较浅的颜色。
了解土壤颜色自上而下变化的原因对于地质勘查、土壤分类和农业生产等具有重要意义。
在勘查矿产资源过程中,土壤颜色可以提供有关地下矿藏的信息。
在土壤分类中,土壤颜色是划分土壤类型的一个重要标准之一。
在农业生产中,土壤颜色对于作物生长和土壤肥力的评估也具有指导意义。
因此,本文将重点探讨土壤颜色自上而下变化的原因,旨在增进对土壤的认识和了解,为土壤管理和保护提供科学依据。
1.2文章结构2.文章结构本文将从土壤颜色自上而下变化的原因进行探讨。
首先,我们将在引言部分对本文的概述进行简要介绍,接着在正文部分分别讨论土壤表层颜色变化原因和土壤深层颜色变化原因。
最后,在结论部分对本文的主要内容进行总结,并展望未来的研究方向。
在正文部分,我们将详细探讨土壤表层颜色变化的原因。
土壤表层颜色的变化受多种因素的影响,包括有机质含量、氧化还原状态、氧化物的存在以及微生物活动等等。
我们将针对这些因素进行深入研究,分析它们在土壤表层颜色变化中所起的作用。
此外,我们还将讨论土壤深层颜色变化的原因。
相比于土壤表层,土壤深层更受地下水的影响,我们将探讨地下水中溶解物质对土壤颜色的影响,以及土壤颜色变化与地下水水质的关系。
土壤学第四章-土壤酸碱性和氧化还原反应

第二节 土壤氧化还原反应
一.土壤中的氧化还原体系
1、主要的体系:
Mn2+
Mn4+
锰
Fe3+
Fe2+
铁
O-2
O0
氧
S-2
S+6
硫
N-3
N+4
N+6 氮
H0
H+
氢
C-4
C+4
(有机)碳
2、主要的氧化剂和还原剂:
主要的氧化剂是土壤空气中的氧气当土壤中
的氧被消耗完后,依次NO-3、Mn4+、Fe3+、 SO42-作为电子受体被还原,这种依次被还原的 现象叫顺序还原作用.
三、土壤酸碱性和氧化还原状况与有毒物质的积 累:
1.强酸性土壤中Al3+、Mn2+的胁迫与毒害:
Al:PH<5.5 Al3+被活化, [Al3+]≥0.2 cmol/kg农作物受害,特别是幼苗。 PH5.5~6.3 可消除Al3+的毒害。
Mn:PH<5.5 [Mn2+]≥2~9cmol/kg、或植株干重 中含量为1000mg/kg时产生锰毒。
二、土壤碱性的形成: 1. 碱性形成机理: 土壤中碱性盐的水解是形成碱性反应的主要
机理 Ca Mg Na的CO32-和HCO3-以及吸附交换 性Na+
①CaCO3的水解: 石灰性土壤上交换性Ca2+占优势的土壤
CaCO3、CO2、H2O处于同一平衡体系中
CaCO3+H2O
Ca2++HCO3-+OH-
1>各种养分有效度较高的PH范围在6.5~7.5
第九章 土壤酸碱性和氧化还原反应

二.土壤酸度
1、 交换性酸 用中性盐溶液如1mol.L-1 KCL浸提土壤,土壤胶体表 面吸附的铝离子与氢离子进入溶液产生的酸。 2、水解性酸 用弱酸强碱盐溶液,如pH8.2的1mol.L-1 NaOAc溶 液浸提而产生的酸。
二.土壤酸度
(三)土壤酸化
是指在自然和人为条件下土壤pH下降的过程。 1、土壤酸化过程实质 2、土壤酸化的成因 (1)自然土壤发生过程 (2)生物地球化学过程 (3)施肥和土壤管理 (4)酸沉降 3、土壤酸化的环境效应 4、土壤酸化防治
土壤酸化过程
Al3+ Ca2+ 土壤 K+ 胶体 Na+ Mg2+ H+ + H+ Na Ca2+
Al3+
K+
Mg2+
H+
H+ 增加,土壤酸化 盐基离子淋溶
离子交换
二.土壤碱度
土壤碱性指标 1、pH 2、碱化度(钠碱化度;ESP-exchangeable sodium percentage) 是指土壤胶体吸附的交换性钠离子占阳离子交换量的百分率。
二.土壤酸度
(一)土壤活性酸 土壤溶液中的氢离子引起的酸,用pH表示。 土壤酸碱性划分 ﹤5.0 强酸性 5.0-6.5 酸性 6.5-7.5 中性 7.5-8.5 碱性 ﹥8.5 强碱性
二.土壤酸度
(二)土壤潜性酸 指土壤胶体上吸附的氢离子、铝离子等所产生 的酸,单位cmol.L-1/kg。 Al3++H2O⇋Al(OH)2++H+ Al(OH)2++ H2O⇋Al(OH)2++H+ Al(OH)2++H2O ⇋Al(OH)3+H+ 土壤中交换性铝离子是土壤潜性酸的主要贡献 者。在南方红壤土壤中占到90%以上。
氧化还原反应与酸碱性的关系

氧化还原反应与酸碱性的关系
溶液中的氧化还原反应和酸碱性有着密切的关系。
一般说碱性有利于低价化合物转变为高价化合物,而酸性有利于氧化剂夺取电子。
溶液中的氧化还原反应和酸碱性有着密切的关系。
一般说碱性有利于低价化合物转变为高价化合物,而酸性有利于氧化剂夺取电子。
根据元素周期表,酸或强酸弱碱盐的酸性越强,其酸根的非金属性越强,所以氧化性越强。
如H2SO4或(NH4)2SO4中S2的非金属很强,所以浓硫酸有强氧化性;碱或强碱弱酸盐的碱性越强,其金属离子的金属性越强,所以还原性越强。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
第二节 第三节 第四节 第五节 土壤碱性反应 土壤缓冲作用 土壤反应与土壤肥力 土壤氧化还原反应
第一节
土壤酸性反应
土壤酸碱性是土壤溶液的反应,即溶液 中 H+浓度和 OH- 浓度比例不同而表现出来的 性质。
一、土壤酸性的来源
1、土壤中有机物的分解和植物根系、微生物的 呼吸作用,产生大量CO2,CO2 溶于水形成H2CO3 , 解离出H+。
在极强酸性的土壤中,大量的铝、铁、锰化合 物变为可溶性的,常使植物受到毒害。而在石灰 性土壤和碱性土壤中,植物又往往发生缺铁症状;
铜和锌的情况也相同。在土壤pH7左右是临界 点, pH值大于此点时铜、锌的有效度极低;硼在很 酸的土壤和石灰性土壤中有效性都很低。 总的来说,大多数土壤养分在PH6.5左右时其 有效度都较高。
二、土壤反应与土壤微生物活性
微生物的活动对土壤PH很敏感,土壤细 菌和放线茵,均适于中性和微碱性环境;氨 化作用适宜的PH范围为6.5-7.5;硝化作 用为6.5-8.0;固氮作用为6.5-7.8。 真菌最适宜在酸性条件下活动,在PH <5的强酸土壤中,仍可对有机质进行矿化, 但其活动产物多呈强酸性,有时不利于肥力 的发展。
3、土壤中两性物质的存在
土壤中有许多两性物质存在,如蛋白质、氨基 酸、胡敏酸、无机磷酸等。如氨基酸,它的氨基 可以中和酸,羧基可以中和碱,因此对酸碱都有 缓冲能力。
R-CH-COOH+HC1=R-CH-COOH
∣ NH2 ∣ ∣ NH3Cl(氨基酸氯化铵盐) ∣
R-CH-COOH+Na0H=R-CH-COONa+H20 NH2 NH2(氨基酸钠)
如:Na2CO3+2H2O===2Na++2OH-+H2CO3
2、当土壤胶体上吸收性钠离子增加到一定的 饱和度时也会产生水解作用,而使溶液呈碱 性反应。 土壤胶体—Na++H2O===土壤胶体—H++NaOH 除 Na+ 外, K+ 、 NH4+ 等离子,也可发生 类似的水解,但不如Na+强烈。
二、碱性的表示方法
表7-11 主要栽培植物适宜的PH范围
大田作物 园艺作物 林业作物 水稻 5.0-6.5 豌豆 6.0-8.0 槐 6.0-7.0 小麦 5.5-7.5 甘蓝 6.0-7.0 松 5.0-6.0 大麦 6.5-7.8 胡萝卜5.3-6.0 洋槐6.0-8.0 玉米 5.5-7.5 番茄 6.0-7.0 白杨 6.0-8.0 棉花 6.0-8.0 西瓜 6.0-7.0 栎 6.0-8.0 大豆 6.0-7.0 南瓜 6.0-8.0 红松 5.0-6.0 马铃薯4.8-6.5 桃 6.0-7.5 桑 6.0-8.0 甘薯 5.0-6.0 苹果 6.0-8.0 桦 5.0-6.0 向日葵6.0-8.0 梨杏 6.0-8.0 泡桐 6.0-8.0 甜菜 6.0-8.0 茶 5.0-5.5 油桐 6.0-8.0 花 5.0-6.0 栗 5.0-6.0 榆 6.0-8.0 苕子 6.0-7.0 柑桔 5.0-6.5 侧柏 6.0-7.5 紫苜 7.0-8.0 菠萝 5.0-6.0 柽柳 6.0-8.0
4、酸性土壤中铝离子的缓冲作用
在极强酸性土壤中(pH<4),铝离子对碱可以 起缓冲作用,用下式表示: 2Al(H2O)33++2OH-——[A12(OH)2(H20)8]4+ 十4H20 当溶液中OH-离子增多时,铝离子周围的水分子 中就有一、两个水分子解离出H+,以中和加入的OH离子,生成水。 pH>5时,铝离子形成A1(OH)3沉淀,失去它的 缓冲能力。
2、水解酸度 用弱酸强碱盐溶液(如1N醋酸钠)浸提 土壤,从土壤中交换出来的氢、铝离子所产 生的酸度称为水解酸度。
由于醋酸钠水解,所得的醋酸的解离度很小,而 且生成的 NaOH 又与交换性 H+ 作用,得到解离度很 小的H20,所以使交换作用进行得更彻底。 另外,由于弱酸强碱盐溶液的 pH 值大,也使 胶体上的H+和Al3+易于解离出来。所以土壤的水解 酸度 一般都高于交换酸度。
1、pH值
土壤的碱性一般常用平衡溶液的PH值表示。
2、总碱度: 即土壤溶液或灌溉水中碳酸根和重碳酸 根的总量,单位为cmol/L 。
3、钠饱和度(ESP)(钠化率或交换性钠百 分率、碱化度。)
即交换性钠离子的数量占阳离子交换量的百分 数,也叫做土壤碱化度、 碱化度(%)=交换性钠/阳离子交换量×10O
• 碱化度>30%,含盐量<0.5%和pH >9.0定为碱土 • 碱化度5—10%轻度碱化 • 10—15%中度碱化 • 15—20%强碱化土壤
三、影响土壤碱化的因素
1、气候
碱土都分布在干旱、半干旱和漠境区由 于蒸降比一般为5—10,甚至20以上,明显 的季节性积盐和脱盐频繁交替的特点,是 土壤碱化的重要条件。
2 、土壤有机质及腐殖酸分解时产生的各种有机酸 (如醋酸、草酸等)都可解离出H+
3、施入土壤中的一些生理酸性肥料,如硫铵等水解 产生H+;酸性污水灌溉、酸雨等也可增加土壤的酸 性。
4、酸性土壤中,土壤胶体上吸附有大量代换性Al3+, 并有Al(OH)2+、Al(OH)2+等存在,它们水解都 可产生H+。
土壤养分有效度在不同PH值条件下差异很大。 pH<5,活性铁、铝多,造成磷素的固定。在PH>7 时则发生明显的钙对磷酸的固定。在pH6一7的土壤 中,土壤对磷的固定最弱,磷的有效性最大。 钙、镁和钾在酸性土壤中容易淋失。因此,酸性 愈强的土壤,这些元素对植物的供应愈加不足;钼的 有效性在PH较低的范围,也随PH增大而提高,在PH 低时,钼与镁形成难溶性化合物而变得无效,因此在 强酸性土壤上有些植物如柑桔会发生缺钼现象。
(二)土壤碱性的调节
1、施用有机肥料 利用有机肥分解释放出的大量CO2、有机酸降低 土壤PH值。 2、施用硫磺、硫化铁及废硫酸或黑矾. 利用它们在土壤中氧化或水解产生硫酸,硫酸再 中和碳酸钠或胶体上钠离子造成的碱性。 3、对碱化土、碱土,可施用石膏、硅酸钙,以钙将 土壤胶体上的钠代换下来,并随水排出,从而降低土 壤的PH,改善土壤理化性状。 土壤胶粒-Na+CaSO4===土壤胶粒-Ca+NaSO4
施用石灰来改良土壤酸性的作用如下: 土壤胶粒-2H + Ca(OH)2=== 土壤胶粒-Ca + 2H20 如果胶粒上是铝离子,则与石灰生成氢氧化 铝而沉淀: 土壤胶粒-2A1 + 3Ca(OH)2=== 土壤胶粒-3Ca + 2A1(OH)3。 施用石灰除中和酸度、促进微生物活动以外,还 为土壤增加了钙,有利于改善土壤结构,并减少磷 被活性铁、铝离子的固定。
二、土壤缓冲作用的机制
1、土壤胶体的阳离子代换作用是土壤产生缓 冲性的主要原因。
土壤胶粒-M+H+===土壤胶粒-H+M+ (M代表盐基离子,主要是Ca2+、Mg2+、k+等) 又如土壤溶液中加入 MOH,解离产生M+和OH-, 由于 M 和胶体上交换性 H+ 交换, H+ 转入溶液中,立 即同0H-生成极难解离的H20,溶液的pH值基 本不变。 土壤胶粒-H+MOH===土壤胶粒-M+H20
• 2、生物因素
• 高等植物选择性的吸收,富集了钙、 镁、钾、钠等盐基离子。
•3、母质因素
• 基性岩和超基性岩母质中富含钙镁等碱 性物质,风化体中含较多的碱性成分。
第三节
定义
土壤的缓冲性
一、土壤缓冲性的概念
土壤抗衡酸碱物质减缓pH变化的能力。
缓冲量
一般用来表示缓冲能力的大小。 即土壤溶液改变一个单位 PH值时所需要 一定量的酸或碱的厘摩尔数。
(二)潜在酸
潜在酸是指土壤胶体上吸附的H+、 A13+所引起 的酸度。 它们只有通过离子交换作用进入土壤溶液时, 才显示出酸性。是土壤酸性的潜在来源。通常用 100g烘干土中氢离子的厘摩尔数[Cmol(+)/kg] 来表示。
土壤潜在酸的大小常用土壤交换性酸度或 水解性酸度表示之。
1、交换性酸度
用 过 量 的 中 性 盐 溶 液 ( 如 1mol/L KCl 或 0.06 mol/L BaC12 )与土壤作用,将胶体表 面上的大部分H+或A13+交换出来,再以标准碱液 滴定溶液中的H+,这样测得的酸度称为交换性酸 度或代换性酸度。
由上可知盐基饱和度愈大的,对酸的缓冲 能力愈强;相反盐基饱和度愈小,潜在酸度愈 大的土壤,则对碱的缓冲能力愈强。
2、土壤溶液中的弱酸及其盐类的存在
土壤溶液中含有碳酸、硅酸、腐殖酸以及其它 有机酸及其盐类,构成一个良好的缓冲体系,故 对酸碱均有缓冲作用。 H2C03十Ca(0H)2==CaC03十2H20 Na2C03十2HCl==H2C03十2NaC1
四、土壤酸碱性的调节
(一)土壤酸性的调节
土壤酸性主要由胶体吸附的交换性 H+和Al3+所控 制,在改良土壤酸性时,不仅要中和活性酸,更重 要的是中和潜在酸,才能从根本上改变酸性的大小。 通常是施用石灰来改良;沿海地区可以用蚌壳 灰;草木灰既是良好的钾肥,同时也起中和酸性的 作用;沿海的咸酸田在采用淡水洗盐的同时,也能 把一些酸性物质除掉。
(淋洗排出)
3、对碱化土、碱土,可施用石膏、硅酸钙, 以钙将土壤胶体上的钠代换下来,并随水排出, 从而降低土壤的PH,改善土壤理化性状。 土壤胶粒-Na+CaSO4===
• •Βιβλιοθήκη (二)石灰位土壤酸度还决定于致酸离子和盐基离子 的相对比例,而在酸性土壤的盐基离子中, 钙离子约占盐基总量的65%—80%。因此 提出酸度的另一指标是石灰位。
