全面腐蚀与局部腐蚀精品PPT课件
合集下载
局部腐蚀PPT课件

第26页/共78页
• 当水的温度高于80℃时,电偶的极性就发生逆转,钢成为阳极而被腐蚀,而锌上的腐蚀产物使锌的电位提 高成为了阴极。溶液pH值的变化也会影响电极反应,甚至也会改变电偶电池的极性。例如,镁与铝偶合在 稀的中性或弱酸性氯化钠水溶液中,铝是阴极,但随着镁阳极的溶解,溶液变为碱性,导致两性金属铝成 为阳极。
第18页/共78页
• 定义金属M1作为阳极形成电偶后的腐蚀电流密 度 i ’cMl 和 它 单 独 存 在 时 的 腐 蚀 电 流 密 度 i cM 1 之
比,称为电偶腐蚀效应,一般用γ表示:该公式
表示金属M1和M2偶接后,阳极金属M1溶解腐 蚀速度增加的程度。γ越大,电偶腐蚀越严重。
(6-1)
• 一种金属与另一种电位较低的金属在腐蚀介质
• (3)存在电子导电回路。即低电位金属与电位 高的金属或非金属之间要么直接接触,要么通 过其他导体实现电连接,构成腐蚀电池的电子 导电回路。
第11页/共78页
• 在第二章中介绍了金属的标准电极电位和电位 序的概念,根据标准电极电位的高低可以从热 力学的角度判断金属变成离子进入溶液的倾向 大小,但是标准电极电位只给出了金属的理论 电位值,它是指无膜的金属浸在该金属盐的溶 液中且金属离子的活度处在标准态时用热力学 公式计算得到的。此外标准电位序也未考虑腐 蚀产物的作用,且没有涉及合金的排序,而含 两种或两种以上活性成分的合金是不可能建立 起标准电极电位的。因此标准电位序仅能用来 判断金属在简单腐蚀体系中产生腐蚀的可能性, 不能判断金属材料在某一特定腐蚀电解质中电 偶腐蚀倾向的大小,为了方便地判断金属材料 在某一特定腐蚀电解质中电偶腐蚀倾向的大小 而引入了电偶序。
第13页/共78页
• 在电偶序中腐蚀电位低的金属与离它越远的高 电位金属接触,电偶腐蚀的驱动力越大,电偶 腐蚀的倾向越高。然而,电偶腐蚀的速率除与 电极电位差有密切关系外,还受腐蚀金属电极 极化行为等因素的影响。由于金属材料的腐蚀 电位受多种因素影响,其值通常随腐蚀反应时 间而变化,即金属在特定电解质溶液中的腐蚀 电位不是一个固定值,而是有一定变化范围, 因此,电偶序中一般仅列出金属稳定电位的相 对关系或电位变化范围,而很少列出具体金属 的稳定电位值。另外,某些材料(如不锈钢和 Inconel合金等)有第活14页化/共和78页钝化两种状态,因此
• 当水的温度高于80℃时,电偶的极性就发生逆转,钢成为阳极而被腐蚀,而锌上的腐蚀产物使锌的电位提 高成为了阴极。溶液pH值的变化也会影响电极反应,甚至也会改变电偶电池的极性。例如,镁与铝偶合在 稀的中性或弱酸性氯化钠水溶液中,铝是阴极,但随着镁阳极的溶解,溶液变为碱性,导致两性金属铝成 为阳极。
第18页/共78页
• 定义金属M1作为阳极形成电偶后的腐蚀电流密 度 i ’cMl 和 它 单 独 存 在 时 的 腐 蚀 电 流 密 度 i cM 1 之
比,称为电偶腐蚀效应,一般用γ表示:该公式
表示金属M1和M2偶接后,阳极金属M1溶解腐 蚀速度增加的程度。γ越大,电偶腐蚀越严重。
(6-1)
• 一种金属与另一种电位较低的金属在腐蚀介质
• (3)存在电子导电回路。即低电位金属与电位 高的金属或非金属之间要么直接接触,要么通 过其他导体实现电连接,构成腐蚀电池的电子 导电回路。
第11页/共78页
• 在第二章中介绍了金属的标准电极电位和电位 序的概念,根据标准电极电位的高低可以从热 力学的角度判断金属变成离子进入溶液的倾向 大小,但是标准电极电位只给出了金属的理论 电位值,它是指无膜的金属浸在该金属盐的溶 液中且金属离子的活度处在标准态时用热力学 公式计算得到的。此外标准电位序也未考虑腐 蚀产物的作用,且没有涉及合金的排序,而含 两种或两种以上活性成分的合金是不可能建立 起标准电极电位的。因此标准电位序仅能用来 判断金属在简单腐蚀体系中产生腐蚀的可能性, 不能判断金属材料在某一特定腐蚀电解质中电 偶腐蚀倾向的大小,为了方便地判断金属材料 在某一特定腐蚀电解质中电偶腐蚀倾向的大小 而引入了电偶序。
第13页/共78页
• 在电偶序中腐蚀电位低的金属与离它越远的高 电位金属接触,电偶腐蚀的驱动力越大,电偶 腐蚀的倾向越高。然而,电偶腐蚀的速率除与 电极电位差有密切关系外,还受腐蚀金属电极 极化行为等因素的影响。由于金属材料的腐蚀 电位受多种因素影响,其值通常随腐蚀反应时 间而变化,即金属在特定电解质溶液中的腐蚀 电位不是一个固定值,而是有一定变化范围, 因此,电偶序中一般仅列出金属稳定电位的相 对关系或电位变化范围,而很少列出具体金属 的稳定电位值。另外,某些材料(如不锈钢和 Inconel合金等)有第活14页化/共和78页钝化两种状态,因此
3全面腐蚀与局部腐蚀85页PPT

的点蚀孔继续长大: 2)Ebr>E>Ep,不会形成新的点蚀扎,但原有的
点蚀孔将继续扩展长大; 3) E≤Ep,原有点蚀孔全部钝化,不会形成新的
点蚀孔。 Ebr值越正耐点蚀性能越好。 Ep与Ebr值越接近,钝化膜修复能力愈强。
B 点蚀源形成的孕育期
点蚀包括点蚀核的形成到金属表面出现宏观可见 的蚀孔。
局部腐蚀类型,主要有点蚀(孔蚀)、缝隙腐蚀、 晶间腐蚀、选择腐蚀,应力腐蚀、腐蚀疲劳、湍 流腐蚀等。
3.1.1 全面腐蚀的特征
全面腐蚀是常见的一种腐蚀。全面腐蚀是指整个 金属表面均发生腐蚀,它可以是均匀的也可以是 不均匀的。
钢铁构件在大气、海水及稀的还原性介质中的腐 蚀一般属于全面腐蚀。
全面腐蚀一般属于微观电池腐蚀。通常所说的铁 生锈或钢失泽.镍的“发雾”现象以及金属的高 温氧化均属于全面腐蚀。
点蚀是一种典型局部腐蚀形式,具有较大的隐患 性及破坏性。在石油、化工、海洋业中可以造成 管壁穿孔,使大量的油、气等介质泄漏,有时甚 至会造成火灾,爆炸等严重事故。
3.2.1 点蚀的形貌与特征 A点蚀的形貌 点蚀表面直径等于或小于它的深度。一般只有几
十微米。其形貌各异.有蝶形浅孔,有窄深形、 有舌形等等。
孔内O2浓度继续下降,孔外富氧,形成氧浓差 电池。其作用加速了孔内不断离子化,孔内 Fe2+浓度不断增加,为保持电中性,孔外Cl-向 孔内迁移,并与孔内Fe2+形成可溶性盐 (FeCl2)。
孔内氯化物浓缩、水解等使孔内pH值下降,pH 值可达2-3,点蚀以自催化过程不断发展下去。
孔底 由于孔内的酸化,H+去极化的发生及孔 外氧去极化的综合作用,加速了孔底金属的溶解 速度。从而使孔不断向纵深迅速发展,严重时可 蚀穿金属断面。
点蚀孔将继续扩展长大; 3) E≤Ep,原有点蚀孔全部钝化,不会形成新的
点蚀孔。 Ebr值越正耐点蚀性能越好。 Ep与Ebr值越接近,钝化膜修复能力愈强。
B 点蚀源形成的孕育期
点蚀包括点蚀核的形成到金属表面出现宏观可见 的蚀孔。
局部腐蚀类型,主要有点蚀(孔蚀)、缝隙腐蚀、 晶间腐蚀、选择腐蚀,应力腐蚀、腐蚀疲劳、湍 流腐蚀等。
3.1.1 全面腐蚀的特征
全面腐蚀是常见的一种腐蚀。全面腐蚀是指整个 金属表面均发生腐蚀,它可以是均匀的也可以是 不均匀的。
钢铁构件在大气、海水及稀的还原性介质中的腐 蚀一般属于全面腐蚀。
全面腐蚀一般属于微观电池腐蚀。通常所说的铁 生锈或钢失泽.镍的“发雾”现象以及金属的高 温氧化均属于全面腐蚀。
点蚀是一种典型局部腐蚀形式,具有较大的隐患 性及破坏性。在石油、化工、海洋业中可以造成 管壁穿孔,使大量的油、气等介质泄漏,有时甚 至会造成火灾,爆炸等严重事故。
3.2.1 点蚀的形貌与特征 A点蚀的形貌 点蚀表面直径等于或小于它的深度。一般只有几
十微米。其形貌各异.有蝶形浅孔,有窄深形、 有舌形等等。
孔内O2浓度继续下降,孔外富氧,形成氧浓差 电池。其作用加速了孔内不断离子化,孔内 Fe2+浓度不断增加,为保持电中性,孔外Cl-向 孔内迁移,并与孔内Fe2+形成可溶性盐 (FeCl2)。
孔内氯化物浓缩、水解等使孔内pH值下降,pH 值可达2-3,点蚀以自催化过程不断发展下去。
孔底 由于孔内的酸化,H+去极化的发生及孔 外氧去极化的综合作用,加速了孔底金属的溶解 速度。从而使孔不断向纵深迅速发展,严重时可 蚀穿金属断面。
5材料腐蚀与防护-全面腐蚀与局部腐蚀2ppt课件

4.7.3.2 吸氢变脆实际
根据SCC断口脆性特征, 而提出氢脆实际 — 裂痕内pH 下 降, 电位负移,发生: H+ 复原 H(渗入金属) H2 (析出), 使SCC前沿变脆而开裂
吸氢脆性 开裂SCC 模型
4.7.3.3 应力吸附破裂实际
纯机械破裂机理,环境中 某些破坏性组分对金属内外表 的吸附, 减弱金属原子间的结合 力, 在应力作用下而发生应力腐 蚀开裂。
4.6.2 黄铜脱锌
黄铜脱锌机理:优先溶解机制、溶解再堆积机制、 空位机制和渗流机制等。
海水中黄铜脱锌按下述步骤进展: 1〕黄铜中的锌和铜一同溶解; 2〕 Zn2+ 留在溶液中,而电位较高的Cu2+在接近溶解 地点的外表上迅速析出,堆积到黄铜外表。对应的反响 为: 阳极反响:Zn→ Zn2+ + 2e,Cu→ Cu+ + e 阴极反响:O2+2H2O+4e→4OH-
4.7 应力腐蚀开裂〔SCC〕
4.7.1 应力腐蚀开裂的定义和特点
应力腐蚀开裂简称应力腐蚀,英文缩写SCC,指 金属在特定腐蚀介质和固定拉〔张〕应力的同时作 用下发生的脆性开裂。
应力腐蚀开裂是危害性最大的部分腐蚀破坏形状 之一,资料可以在没有明显预兆的情况下几分钟内 破裂。在腐蚀过程中一旦构成微裂纹,其扩展速度 比其它类型的部分腐蚀速度要快几个数量级。
破裂时间
4.7.2.2 环境 不同资料发生SCC的环境不同(敏感介质)
腐蚀介质中某些离子或分子对SCC有特效,如大气中微量 H2S,NH3 可使高强钢、Cu发生SCC;ppm Cl-,在高温 下可使奥氏体不锈钢发生SCC,ppm S2O32- 可使奥氏体 不锈钢发生SCC。
硝脆、碱脆、氯脆等是特定介质对特定资料的作用而发生 SCC。 温度影响至关重要,SCC 热激活反响。 溶解O2对SCC有重要影响。pH下降, SCC敏感性增大, 破裂时间缩短。
《金属局部腐蚀》PPT课件

不均一性。
(2) 阳极区和阴极区的电化学条件差异在腐
蚀过程中一直保持下去。
精选PPT
返回
11
1.电 偶 腐 蚀
发生电偶腐蚀的几种情况 电偶腐蚀的影响因素 防止电偶腐蚀的措施
精选PPT
12
电偶腐蚀 :由电极为不同材料的双金 属组成原 池的作用引起的。
• 1.1发生电偶腐蚀的几种情况 (1)异金属部件的组合。 (2)金属镀层。
精选PPT
返回
8
主要类型
(1)晶间腐蚀、缝隙腐蚀 (2)电偶腐蚀、氢损伤、细菌腐蚀、杂散电流腐蚀 (3)小孔腐蚀、选择性腐蚀 (4)应力腐蚀、磨损腐蚀
精选PPT
返回
9
危害性
局部腐蚀破坏有如下特征 : • 复杂性 • 集中性 • 突发性
精选PPT
返回
10
发生局部腐蚀的条件
(1) 金属方面或溶液方面存在较大的电化学
以奥氏体系类的钢由18%铬-8%镍为基本组成,各元素
的加入量变化的不同,而开发各种用途的钢种。
1. 以化学成分分类:
①. Cr系列:铁素体系列、,
• 2. 以金相组织的分类: ①. 奥氏体不锈钢 Cr18Ni9(304) 又称:18-8型 ②. 铁素体不锈钢 Cr17、 Cr25Ti
极面积。 • (4)设计时还要安装一块比电偶接触的两块金属更负
的第三种金属,把容易更换的部分作为阳极。
精选PPT
27
2.点 腐 蚀
2.1现象和特性
定义:在一定介质条件下,腐蚀集中于 金属表面上的个别点或很小区域内,并深 入到金属内部,一般孔深大于孔径 —称 点腐蚀(孔腐蚀)。
精选PPT
28
精选PPT
精选PPT
(2) 阳极区和阴极区的电化学条件差异在腐
蚀过程中一直保持下去。
精选PPT
返回
11
1.电 偶 腐 蚀
发生电偶腐蚀的几种情况 电偶腐蚀的影响因素 防止电偶腐蚀的措施
精选PPT
12
电偶腐蚀 :由电极为不同材料的双金 属组成原 池的作用引起的。
• 1.1发生电偶腐蚀的几种情况 (1)异金属部件的组合。 (2)金属镀层。
精选PPT
返回
8
主要类型
(1)晶间腐蚀、缝隙腐蚀 (2)电偶腐蚀、氢损伤、细菌腐蚀、杂散电流腐蚀 (3)小孔腐蚀、选择性腐蚀 (4)应力腐蚀、磨损腐蚀
精选PPT
返回
9
危害性
局部腐蚀破坏有如下特征 : • 复杂性 • 集中性 • 突发性
精选PPT
返回
10
发生局部腐蚀的条件
(1) 金属方面或溶液方面存在较大的电化学
以奥氏体系类的钢由18%铬-8%镍为基本组成,各元素
的加入量变化的不同,而开发各种用途的钢种。
1. 以化学成分分类:
①. Cr系列:铁素体系列、,
• 2. 以金相组织的分类: ①. 奥氏体不锈钢 Cr18Ni9(304) 又称:18-8型 ②. 铁素体不锈钢 Cr17、 Cr25Ti
极面积。 • (4)设计时还要安装一块比电偶接触的两块金属更负
的第三种金属,把容易更换的部分作为阳极。
精选PPT
27
2.点 腐 蚀
2.1现象和特性
定义:在一定介质条件下,腐蚀集中于 金属表面上的个别点或很小区域内,并深 入到金属内部,一般孔深大于孔径 —称 点腐蚀(孔腐蚀)。
精选PPT
28
精选PPT
精选PPT
第六章局部腐蚀ppt课件
(4) 溶液的电阻
通常阳极金属腐蚀电流的分布是不均匀的,距离接合部愈 远,腐蚀电流越小,原因是电流流动要克服电阻,所以溶液电 阻大小影响“有效距离〞效应。电阻越大则“有效距离〞效应
越小(5。) 介质的电导率
介质电导率的高低直接影响阳极区腐蚀电流分布的不均匀性。 因为电流总是趋向于沿电阻最小的路径流动。实际观察电偶腐蚀 破坏的结果表明,阳极体的破坏最严重处是在不同金属接触处附 近。距离接触处越远,腐蚀电流越小,腐蚀就越轻。
• (d〕pH值
在较宽的pH值范围内,孔蚀电位Eb与溶液pH值 关系不大。当pH﹥10,随pH值升高,孔蚀电位
增大,即在碱性溶液中,金属孔蚀倾向较小。 (e〕温度 温度升高,金属的孔蚀倾向增大。当温度低于某 个温度,金属不会发生孔蚀。这个温度称为临界 孔蚀温度(CPT) ,CPT愈高,则金属耐孔蚀性能 愈好。
第六章 金属的腐蚀形态
▪ §6.1全面腐蚀与局部腐蚀
§6-2 电偶腐蚀〔Galvanic corrosion)
▪ 1.电偶腐蚀现象及概念 ▪ (1〕景象
示 意 图
▪ (2〕概念
▪ 异种金属在同一介质中接触,由于腐蚀电位 不相等有电偶电流流动,使电位较低的金属 溶解速度增加,造成接触处的电位较低的金 属溶解速度增大而发生的局部腐蚀的现象。
▪ 几乎所有金属和合金。
▪ 几乎所有溶液介质都可以引起缝隙腐蚀。
▪ 与孔蚀比,同种材料的缝隙腐蚀更容易发生。
2.缝隙腐蚀的机理
缝隙腐蚀可分为初期阶段和后期阶段。
初期阶段,缝内外的全部表面上发生金属的溶解和阴极的氧还原为氢氧离子的反应。
阳极反应: M→Mn++ ne 阴极反应 :O2+2H2O+4e→4OH -
(3〕金属材料 几乎所有的金属材料都会发生缝隙腐蚀 , 钝态的金属对缝隙钝态的金属材料在含氯 化物的溶液中容易发生,造成典型的局部腐蚀。 ②孔蚀和缝隙腐蚀成长阶段的机理都可以用闭 塞电池自催化效应说明。
通常阳极金属腐蚀电流的分布是不均匀的,距离接合部愈 远,腐蚀电流越小,原因是电流流动要克服电阻,所以溶液电 阻大小影响“有效距离〞效应。电阻越大则“有效距离〞效应
越小(5。) 介质的电导率
介质电导率的高低直接影响阳极区腐蚀电流分布的不均匀性。 因为电流总是趋向于沿电阻最小的路径流动。实际观察电偶腐蚀 破坏的结果表明,阳极体的破坏最严重处是在不同金属接触处附 近。距离接触处越远,腐蚀电流越小,腐蚀就越轻。
• (d〕pH值
在较宽的pH值范围内,孔蚀电位Eb与溶液pH值 关系不大。当pH﹥10,随pH值升高,孔蚀电位
增大,即在碱性溶液中,金属孔蚀倾向较小。 (e〕温度 温度升高,金属的孔蚀倾向增大。当温度低于某 个温度,金属不会发生孔蚀。这个温度称为临界 孔蚀温度(CPT) ,CPT愈高,则金属耐孔蚀性能 愈好。
第六章 金属的腐蚀形态
▪ §6.1全面腐蚀与局部腐蚀
§6-2 电偶腐蚀〔Galvanic corrosion)
▪ 1.电偶腐蚀现象及概念 ▪ (1〕景象
示 意 图
▪ (2〕概念
▪ 异种金属在同一介质中接触,由于腐蚀电位 不相等有电偶电流流动,使电位较低的金属 溶解速度增加,造成接触处的电位较低的金 属溶解速度增大而发生的局部腐蚀的现象。
▪ 几乎所有金属和合金。
▪ 几乎所有溶液介质都可以引起缝隙腐蚀。
▪ 与孔蚀比,同种材料的缝隙腐蚀更容易发生。
2.缝隙腐蚀的机理
缝隙腐蚀可分为初期阶段和后期阶段。
初期阶段,缝内外的全部表面上发生金属的溶解和阴极的氧还原为氢氧离子的反应。
阳极反应: M→Mn++ ne 阴极反应 :O2+2H2O+4e→4OH -
(3〕金属材料 几乎所有的金属材料都会发生缝隙腐蚀 , 钝态的金属对缝隙钝态的金属材料在含氯 化物的溶液中容易发生,造成典型的局部腐蚀。 ②孔蚀和缝隙腐蚀成长阶段的机理都可以用闭 塞电池自催化效应说明。
全面腐蚀与局部腐蚀

✓ 应力腐蚀开裂分为晶间型、穿晶型、混合型等。同一材料因介质变化,裂纹途径也可
能改变。
✓ 应力腐蚀开裂的裂纹扩展速度一般为10-6~10-3 mm/min,比均匀腐蚀快约106倍,但仅
为纯机械断裂速度的10-10。
✓ 应力腐蚀开裂是一种低应力的脆性断裂。
第七章 全面腐蚀与局部腐蚀
7.7.2 应力腐蚀的条件
阴极还原反应:O + 2H2 O + 4e → 4 −
形成缝隙内、外的
氧浓差电池
•
形成闭塞电池
金属离子发生水解
反应使介质酸化
自催化效应
氧浓差电池的形成,对缝隙腐蚀的初期起促进作用。但蚀坑的深化和扩展是从形成闭
塞电池开始的,因此闭塞电池的自催化作用是造成缝隙腐蚀加速进行的根本原因。
第七章 全面腐蚀与局部腐蚀
➢ 金属材料在环境介质中,大部分表面不发生腐蚀或腐蚀很轻微,但在个别地方或微小
区域内腐蚀不断向纵深方向发展,形成小孔腐蚀坑,这种腐蚀称为小孔腐蚀(点蚀)
➢ 小孔腐蚀是破坏性和隐患性最大的腐蚀形态之一
➢ 金属表面局部的电极电位达到并高于小孔腐蚀电位或击穿电位(Eb)
➢ 小孔腐蚀对钝化性金属比较敏感
➢ 镀层的孔隙处或缺陷处也容易发生小孔腐蚀
形成元素降低C在奥氏体中的溶解度,促进C的扩散和碳化物的析出。
✓ Ti、Nb:Ti、Nb都是有益的元素。
✓ N:扩大晶间腐蚀敏化温度范围并缩短加热时间,对晶间腐蚀起促进作用。
✓ Si:添加2%以上的Si能提高低碳奥氏体不锈钢在强氧化性介质中的耐晶间腐蚀稳定性。
✓ Mn:Cr-Mn在敏化温度范围内会发生严重的晶间腐蚀,用铌合金化可减少锰的影响。
(3)添加合适的缓蚀剂
能改变。
✓ 应力腐蚀开裂的裂纹扩展速度一般为10-6~10-3 mm/min,比均匀腐蚀快约106倍,但仅
为纯机械断裂速度的10-10。
✓ 应力腐蚀开裂是一种低应力的脆性断裂。
第七章 全面腐蚀与局部腐蚀
7.7.2 应力腐蚀的条件
阴极还原反应:O + 2H2 O + 4e → 4 −
形成缝隙内、外的
氧浓差电池
•
形成闭塞电池
金属离子发生水解
反应使介质酸化
自催化效应
氧浓差电池的形成,对缝隙腐蚀的初期起促进作用。但蚀坑的深化和扩展是从形成闭
塞电池开始的,因此闭塞电池的自催化作用是造成缝隙腐蚀加速进行的根本原因。
第七章 全面腐蚀与局部腐蚀
➢ 金属材料在环境介质中,大部分表面不发生腐蚀或腐蚀很轻微,但在个别地方或微小
区域内腐蚀不断向纵深方向发展,形成小孔腐蚀坑,这种腐蚀称为小孔腐蚀(点蚀)
➢ 小孔腐蚀是破坏性和隐患性最大的腐蚀形态之一
➢ 金属表面局部的电极电位达到并高于小孔腐蚀电位或击穿电位(Eb)
➢ 小孔腐蚀对钝化性金属比较敏感
➢ 镀层的孔隙处或缺陷处也容易发生小孔腐蚀
形成元素降低C在奥氏体中的溶解度,促进C的扩散和碳化物的析出。
✓ Ti、Nb:Ti、Nb都是有益的元素。
✓ N:扩大晶间腐蚀敏化温度范围并缩短加热时间,对晶间腐蚀起促进作用。
✓ Si:添加2%以上的Si能提高低碳奥氏体不锈钢在强氧化性介质中的耐晶间腐蚀稳定性。
✓ Mn:Cr-Mn在敏化温度范围内会发生严重的晶间腐蚀,用铌合金化可减少锰的影响。
(3)添加合适的缓蚀剂
全面腐蚀与局部腐蚀(1)

响
不锈钢在NaCl溶液中的点蚀
不锈钢在NaCl溶液中的点蚀
不锈钢在NaCl溶液中的点蚀
不锈钢在NaCl溶液中的点蚀
铝的点蚀
• 点蚀的影响因素
(1) 冶金因素
(2) 能够钝化的金属容易发生点蚀,故不 锈钢
(3) 比碳钢对点蚀的敏感性高。金属钝态 愈稳
(4) 定,抗点蚀性能愈好。点蚀最容易发 生在
SCE
1.0 点 蚀 电 位 〔 伏 〕 0.5 〔 〕
25-13-1MO-N 25-5-2MO
18-12-2MO
18-10
0
20
40
60
80
海水温度(摄氏度)
)
几
与 海 水 温
种 不 锈
度 的 关 系
钢 的 点
(
敞蚀
口电
体 系
位
点 1.6 蚀 电 位 1.2 〔 伏 〕
0.8
0.4
0
10
20
30
❖ 失效分析是人们认识事物本质和开展规律的 逆向思维和探索,是变失效为平安的根本环 节和关键,是人们深化对客观事物的认识源 头和途径。
点蚀
❖ 点蚀的概念〔Pitting〕 ❖ 点蚀即小孔腐蚀,亦称孔蚀。腐蚀破坏
形态是金属外表局部位置形成蚀孔或蚀坑, 一般孔深大于孔径。 ❖ 点蚀的表征 ❖ 点蚀程度用点蚀系数来表示
40
Cr 〔%〕
点蚀电位与Fe-Cr合金中Cr含量的关系
试验溶液: 0.1NNacl. PH=2,室温 (根据Kolotyrkin)
点蚀临界Cl-离子浓度与Cr 含量的关系
[H+]=iN
铬含量〔%〕点蚀临界Cl-离 子浓度〔N〕
Fe Fe-5.6Cr Fe-11.6Cr Fe-20Cr Fe-24.5Cr Fe-29.4Cr
不锈钢在NaCl溶液中的点蚀
不锈钢在NaCl溶液中的点蚀
不锈钢在NaCl溶液中的点蚀
不锈钢在NaCl溶液中的点蚀
铝的点蚀
• 点蚀的影响因素
(1) 冶金因素
(2) 能够钝化的金属容易发生点蚀,故不 锈钢
(3) 比碳钢对点蚀的敏感性高。金属钝态 愈稳
(4) 定,抗点蚀性能愈好。点蚀最容易发 生在
SCE
1.0 点 蚀 电 位 〔 伏 〕 0.5 〔 〕
25-13-1MO-N 25-5-2MO
18-12-2MO
18-10
0
20
40
60
80
海水温度(摄氏度)
)
几
与 海 水 温
种 不 锈
度 的 关 系
钢 的 点
(
敞蚀
口电
体 系
位
点 1.6 蚀 电 位 1.2 〔 伏 〕
0.8
0.4
0
10
20
30
❖ 失效分析是人们认识事物本质和开展规律的 逆向思维和探索,是变失效为平安的根本环 节和关键,是人们深化对客观事物的认识源 头和途径。
点蚀
❖ 点蚀的概念〔Pitting〕 ❖ 点蚀即小孔腐蚀,亦称孔蚀。腐蚀破坏
形态是金属外表局部位置形成蚀孔或蚀坑, 一般孔深大于孔径。 ❖ 点蚀的表征 ❖ 点蚀程度用点蚀系数来表示
40
Cr 〔%〕
点蚀电位与Fe-Cr合金中Cr含量的关系
试验溶液: 0.1NNacl. PH=2,室温 (根据Kolotyrkin)
点蚀临界Cl-离子浓度与Cr 含量的关系
[H+]=iN
铬含量〔%〕点蚀临界Cl-离 子浓度〔N〕
Fe Fe-5.6Cr Fe-11.6Cr Fe-20Cr Fe-24.5Cr Fe-29.4Cr
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
3.1 3.2 点腐蚀 3.3 缝隙腐蚀 3.4 电偶腐蚀 3.5 晶间腐蚀 3.6 选择性腐蚀 3.7 应力腐蚀开裂 3.8 腐蚀疲劳 3.9 磨损腐蚀 3.10 氢损伤
1
3.1 全面腐蚀
2
按材料腐蚀形态
3.1.1 腐蚀的类型
全面腐蚀
•均匀腐蚀 •不均匀腐蚀
局部腐蚀
•点蚀(孔蚀) •缝隙腐蚀及丝状腐蚀 •电偶腐蚀(接触腐蚀) •晶间腐蚀 •选择性腐蚀
16
(1)钝化膜破坏理 论
当电极阳极极化时,钝化膜中的电场强度增加,吸 附在钝化膜表面上的腐蚀性阴离子(如 Cl-离子)因 其离子半径较小而在电场的作用下进入钝化膜,使 钝化膜局部变成了强烈的感应离子导体,钝化膜在 该点上出现了高的电流密度。
当钝化膜-溶液界面的电场强度达到某一临界值时, 就发生了点蚀
e
21
闭塞电池的形成条件 在反应体系中具备阻碍液相传质过程的几何条件,如在
孔口腐蚀产物的塞积可在局部造成传质困难,缝隙及应 力腐蚀的裂纹也都会出现类似的情况 有导致局部不同于整体的环境 存在导致局部不同于整体的电化学和化学反应
22
蚀孔的自催化发展过程
点蚀一旦发生,蚀孔内外就会发生一系列变化: (a) 蚀孔外金属处于钝化态:
3
(1) 全面腐蚀 各部位腐蚀速率接近 金属的表面比较均匀地减薄,无明显的腐蚀形态差别 同时允许具有一定程度的不均匀性
(2) 局部腐蚀 腐蚀的发生在金属的某一特定部位 阳极区和阴极区可以截然分开,其位置可以用肉眼 或微观观察加以区分 同时次生腐蚀产物又可在阴、阳极交界的第三地点 形成
4
13
(2) 点蚀发生于有特殊离子的腐蚀介质中 不锈钢对卤素离子特别敏感,作用的顺序是:Cl- >Br->I-。这些阴离子在金属表面不均匀吸附易导致 钝化膜的不均匀破坏,诱发点蚀
14
(3)点蚀发生在特定临界电位(点蚀电位或破裂电位Eb)以上 具有活化-钝化转变行为的阳极极化曲线三个区域:
(a) E>Eb 将形成新的蚀孔,已有蚀孔 继续长大
3.1.2 全面腐蚀 (1) 全面腐蚀 腐蚀分布于金属的整个表面,使金属整体减薄 (2) 全面腐蚀发生的条件 腐蚀介质能够均匀地抵达金属表面的各部位,而且金 属的成分和组织比较均匀 (3) 腐蚀速率的表示方法 均匀腐蚀速率-失重或失厚 如通常用mm/a来表达全面腐蚀速率
5
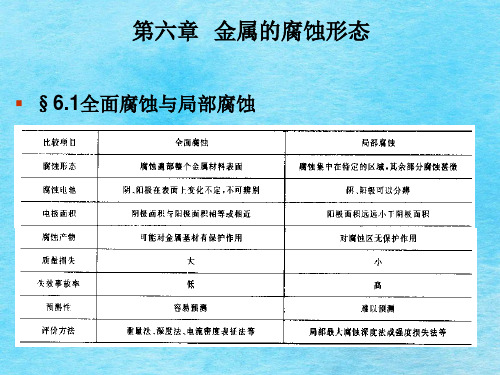
(4) 全面腐蚀的电化学特点 腐蚀原电池的阴、阳极面积非常小,甚至用微观方法 也无法辨认,而且微阳极和微阴极的位置随机变化 整个金属表面在溶液中处于活化状态,只是各点随时 间(或地点)有能量起伏,能量高时(处)呈阳极, 能量低时(处)呈阴极,从而使整个金属表面遭受腐 蚀
6
比较项目 腐蚀形貌
腐蚀电池
电极面积 腐蚀极化图
全面腐蚀
腐蚀分布在整个金属 表面上
阴阳极在表面上变幻 不定,阴阳极不可辨 别 阴极=阳极
局部腐蚀
腐蚀破坏主要集中在一 定区域上,其它部分不 腐蚀 阴阳极在微观上可以分 别
阳极〈〈阴极
7
3.2 点蚀
8
3.2.1 点蚀的概念 点蚀又称孔蚀,是一种腐蚀集中在金属表面的很小范围内, 并深入到金属内部的小孔状腐蚀形态,蚀孔直径小、深度深 ,其余地方不腐蚀或腐蚀很轻微。通常发生在易钝化金属或 合金中,同时往往在有侵蚀性阴离子与氧化剂共存条件下发 生
点蚀表面形貌和示意图
9
3.2.2 点蚀的危害 点蚀导致金属的失壁穿孔,从而导 致突发事故 对点蚀的检查比较困难,因为蚀孔尺寸很小,而且 经常被腐蚀产物遮盖,因而定量测量和比较点蚀的 程度也很困难 是破坏性和隐患性最大的腐蚀形态
10
3.2.3 点蚀的形貌
17
(2)吸附理论(吸附膜理论)
吸附理论认为蚀孔的形成是阴离子(如Cl-离子)与氧的竞 争吸附的结果
在除气溶液中金属表面吸附是由水形成的稳定氧化物离 子
一旦氯的络合离子取代稳定氧化物离子,该处吸附膜被 破坏,而发生点蚀
点蚀的破裂电位Eb是腐蚀性阴离子可以可逆地置换金属 表面上吸附层的电位。当E>Eb时,氯离子在某些点竞争 吸附强烈,该处发生点蚀
18
(3)蚀孔成核位置 金属材料表面组织和结构的不均匀性使表面钝化膜的某 些部位较为薄弱,从而成为点蚀容易形核的部位 晶界、夹杂、位错和异相组织
19
(4)蚀孔的孕育期 点蚀的孕育期 从金属与溶液接触到点蚀产生的时间 孕育期随溶液中Cl-浓度增加和电极电位的升高而缩短 Engell等发现低碳钢发生点蚀的孕育期 的倒数与Cl-浓 度呈线性关系。即: 1 k[Cl ]
点蚀的断面形状 (a)窄深形(b)椭圆形 (c)宽浅形(d)皮下形 (e)底切形(f)水平形与
垂直形
点蚀的截面金相照片
11
点蚀的形貌
12
3.2.4 点蚀发生的条件 满足材料、介质和电化学三个方面的条件 (1) 点蚀多发生在表面容易钝化的金属材料上(如不锈钢、 Al及Al合金)或表面有阴极性镀层的金属上(如镀Sn、Cu 或Ni的碳钢表面) 当钝化膜或阴极性镀层局部发生破坏时,破坏区的 金属和未破坏区形成了大阴极、小阳极的“钝化-活 化腐蚀电池”,使腐蚀向基体纵深发展而形成蚀孔
k-常数 [Cl-]在一定临界值以下,不发生点蚀
20
(5)蚀孔的生长(发展)
蚀孔内部的电化学条件发生了显著的改变,对蚀孔的生 长有很大的影响,因此蚀孔一旦形成,发展十分迅速
蚀孔发展的主要理论是以“闭塞电池” 的形成为基础, 并进而形成“活化-钝化腐蚀电池”的自催化理论
ClO2
ClO2
e
Fe2+ Fe2+
(b) Eb >E>Ep 不会形成新蚀孔,但原有蚀 孔将继续发展长大
(c) E≤Ep
原有蚀孔再钝化而不再发 展,也不会形成新蚀孔
点蚀电位Eb——在析氧电位以下由于点蚀而使电流密度急剧 上升的电位
保护电位Ep——逆向极化曲线与正向极化曲线相交点
15
(或电流降至零)所对应的电位
3.2.5 点蚀机理 第一阶段——蚀孔成核(发生) 钝化膜破坏理论和吸附理论 第二阶段——蚀孔生长(发展) “闭塞电池” 的形成为基础,并进而形成“活化 -钝化腐蚀电池”的自催化理论
1
3.1 全面腐蚀
2
按材料腐蚀形态
3.1.1 腐蚀的类型
全面腐蚀
•均匀腐蚀 •不均匀腐蚀
局部腐蚀
•点蚀(孔蚀) •缝隙腐蚀及丝状腐蚀 •电偶腐蚀(接触腐蚀) •晶间腐蚀 •选择性腐蚀
16
(1)钝化膜破坏理 论
当电极阳极极化时,钝化膜中的电场强度增加,吸 附在钝化膜表面上的腐蚀性阴离子(如 Cl-离子)因 其离子半径较小而在电场的作用下进入钝化膜,使 钝化膜局部变成了强烈的感应离子导体,钝化膜在 该点上出现了高的电流密度。
当钝化膜-溶液界面的电场强度达到某一临界值时, 就发生了点蚀
e
21
闭塞电池的形成条件 在反应体系中具备阻碍液相传质过程的几何条件,如在
孔口腐蚀产物的塞积可在局部造成传质困难,缝隙及应 力腐蚀的裂纹也都会出现类似的情况 有导致局部不同于整体的环境 存在导致局部不同于整体的电化学和化学反应
22
蚀孔的自催化发展过程
点蚀一旦发生,蚀孔内外就会发生一系列变化: (a) 蚀孔外金属处于钝化态:
3
(1) 全面腐蚀 各部位腐蚀速率接近 金属的表面比较均匀地减薄,无明显的腐蚀形态差别 同时允许具有一定程度的不均匀性
(2) 局部腐蚀 腐蚀的发生在金属的某一特定部位 阳极区和阴极区可以截然分开,其位置可以用肉眼 或微观观察加以区分 同时次生腐蚀产物又可在阴、阳极交界的第三地点 形成
4
13
(2) 点蚀发生于有特殊离子的腐蚀介质中 不锈钢对卤素离子特别敏感,作用的顺序是:Cl- >Br->I-。这些阴离子在金属表面不均匀吸附易导致 钝化膜的不均匀破坏,诱发点蚀
14
(3)点蚀发生在特定临界电位(点蚀电位或破裂电位Eb)以上 具有活化-钝化转变行为的阳极极化曲线三个区域:
(a) E>Eb 将形成新的蚀孔,已有蚀孔 继续长大
3.1.2 全面腐蚀 (1) 全面腐蚀 腐蚀分布于金属的整个表面,使金属整体减薄 (2) 全面腐蚀发生的条件 腐蚀介质能够均匀地抵达金属表面的各部位,而且金 属的成分和组织比较均匀 (3) 腐蚀速率的表示方法 均匀腐蚀速率-失重或失厚 如通常用mm/a来表达全面腐蚀速率
5
(4) 全面腐蚀的电化学特点 腐蚀原电池的阴、阳极面积非常小,甚至用微观方法 也无法辨认,而且微阳极和微阴极的位置随机变化 整个金属表面在溶液中处于活化状态,只是各点随时 间(或地点)有能量起伏,能量高时(处)呈阳极, 能量低时(处)呈阴极,从而使整个金属表面遭受腐 蚀
6
比较项目 腐蚀形貌
腐蚀电池
电极面积 腐蚀极化图
全面腐蚀
腐蚀分布在整个金属 表面上
阴阳极在表面上变幻 不定,阴阳极不可辨 别 阴极=阳极
局部腐蚀
腐蚀破坏主要集中在一 定区域上,其它部分不 腐蚀 阴阳极在微观上可以分 别
阳极〈〈阴极
7
3.2 点蚀
8
3.2.1 点蚀的概念 点蚀又称孔蚀,是一种腐蚀集中在金属表面的很小范围内, 并深入到金属内部的小孔状腐蚀形态,蚀孔直径小、深度深 ,其余地方不腐蚀或腐蚀很轻微。通常发生在易钝化金属或 合金中,同时往往在有侵蚀性阴离子与氧化剂共存条件下发 生
点蚀表面形貌和示意图
9
3.2.2 点蚀的危害 点蚀导致金属的失壁穿孔,从而导 致突发事故 对点蚀的检查比较困难,因为蚀孔尺寸很小,而且 经常被腐蚀产物遮盖,因而定量测量和比较点蚀的 程度也很困难 是破坏性和隐患性最大的腐蚀形态
10
3.2.3 点蚀的形貌
17
(2)吸附理论(吸附膜理论)
吸附理论认为蚀孔的形成是阴离子(如Cl-离子)与氧的竞 争吸附的结果
在除气溶液中金属表面吸附是由水形成的稳定氧化物离 子
一旦氯的络合离子取代稳定氧化物离子,该处吸附膜被 破坏,而发生点蚀
点蚀的破裂电位Eb是腐蚀性阴离子可以可逆地置换金属 表面上吸附层的电位。当E>Eb时,氯离子在某些点竞争 吸附强烈,该处发生点蚀
18
(3)蚀孔成核位置 金属材料表面组织和结构的不均匀性使表面钝化膜的某 些部位较为薄弱,从而成为点蚀容易形核的部位 晶界、夹杂、位错和异相组织
19
(4)蚀孔的孕育期 点蚀的孕育期 从金属与溶液接触到点蚀产生的时间 孕育期随溶液中Cl-浓度增加和电极电位的升高而缩短 Engell等发现低碳钢发生点蚀的孕育期 的倒数与Cl-浓 度呈线性关系。即: 1 k[Cl ]
点蚀的断面形状 (a)窄深形(b)椭圆形 (c)宽浅形(d)皮下形 (e)底切形(f)水平形与
垂直形
点蚀的截面金相照片
11
点蚀的形貌
12
3.2.4 点蚀发生的条件 满足材料、介质和电化学三个方面的条件 (1) 点蚀多发生在表面容易钝化的金属材料上(如不锈钢、 Al及Al合金)或表面有阴极性镀层的金属上(如镀Sn、Cu 或Ni的碳钢表面) 当钝化膜或阴极性镀层局部发生破坏时,破坏区的 金属和未破坏区形成了大阴极、小阳极的“钝化-活 化腐蚀电池”,使腐蚀向基体纵深发展而形成蚀孔
k-常数 [Cl-]在一定临界值以下,不发生点蚀
20
(5)蚀孔的生长(发展)
蚀孔内部的电化学条件发生了显著的改变,对蚀孔的生 长有很大的影响,因此蚀孔一旦形成,发展十分迅速
蚀孔发展的主要理论是以“闭塞电池” 的形成为基础, 并进而形成“活化-钝化腐蚀电池”的自催化理论
ClO2
ClO2
e
Fe2+ Fe2+
(b) Eb >E>Ep 不会形成新蚀孔,但原有蚀 孔将继续发展长大
(c) E≤Ep
原有蚀孔再钝化而不再发 展,也不会形成新蚀孔
点蚀电位Eb——在析氧电位以下由于点蚀而使电流密度急剧 上升的电位
保护电位Ep——逆向极化曲线与正向极化曲线相交点
15
(或电流降至零)所对应的电位
3.2.5 点蚀机理 第一阶段——蚀孔成核(发生) 钝化膜破坏理论和吸附理论 第二阶段——蚀孔生长(发展) “闭塞电池” 的形成为基础,并进而形成“活化 -钝化腐蚀电池”的自催化理论
