各种仪器分析的谱图数据的坐标表示
仪器分析3—红外吸收光谱法

傅立叶变换红外光谱仪
样品池
红外光源
摆动的 凹面镜
迈克尔逊 干扰仪
参比池
摆动的 凹面镜
检测器 干涉图谱 计算机 解析 还原
M1 II
同步摆动
I M2
红外谱图
BS
D
仪器组成
第五节 红外光谱法应用
红外光谱法由于操作简单,分析速度 快,样品用量少,不破坏样品,特征性 强等优点,在有机定性分析中应用广泛。 利用红外光谱可对化合物进行鉴定或结 构测定。 但由于吸收较复杂,在定量分析方面 应用受到一定限制。
第四章 红外吸收光谱分析法(IR)
Infrared Absorption Spectrometry
第一节
红外光谱基本知识
1、红外线波长范围: 光学光谱区域:10nm ~1000μm; 其中:10nm ~400nm为紫外光区 400nm ~760nm为可见光区, 760nm ~ 1000μm为红外光区。 为表示方便,红外光不用nm(纳米) 而用微米( μm)表示其波长。
由原理图可见,红外分光光度计也主要 由光源、样品吸收池、单色器、检测器、 记录仪等部件构成。 1、光源:能斯特灯或硅碳棒
红外光谱仪中所用的光源通常是一种惰性固体,用 电加热使之发射高强度的连续红外辐射。 常用的是Nernst灯或硅碳棒。 Nernst灯是用氧化锆、氧化钇和氧化钍烧结而成的 中空棒和实心棒。工作温度约为1700℃,在此高温下导 电并发射红外线。但在室温下是非导体,因此,在工作 之前要预热。它的特点是发射强度高,使用寿命长,稳 定性较好。 硅碳棒是由碳化硅烧结而成,工作温度在1200-1500℃ 左右。
ε>100 非常强峰(vs) 20<ε<100 强 峰(s) 10<ε<20 中强峰(m) 1<ε<10 弱 峰(w)
能谱分析是测什么的

能谱分析是测什么的做SEM或者TEM的时候,一般都会进行EDS打点或者区域扫描,这时软件会给出一个峰谱图,选择想要参与计算的元素及相应的线系后,就能得到各个元素的原子百分比。
今天给大详细介绍一下EDS能谱仪。
能谱分析是测什么的 1EDS能谱仪,又名显微电子探针,是一种分析物质元素的仪器,常与扫描电镜或者透射电镜联用,在真空室下用电子束轰击样品表面,激发物质发射出特征x射线,根据特征x射线的波长,定性与半定量分析元素周期表中Be以上的物质元素,检测流程包括电镜样品制备,上机操作分析,后提供成份分析谱图与半定量成份组成比等数据。
能谱分析是测什么的 21、EDS测试与扫描电镜或者透射电镜联用,选定微小位置区域,探测元素成份与含量;2、EDS测试是失效分析当中对于微小痕量金属物质检测的重要的检测手段;3、EDS测试是区分有机物与无机物的简便的手段,对于有机物只要发现检出大量碳和氧元素,基本可以断定含有大量有机物。
能谱分析是测什么的 31.如果不需要将样本切片,直接观察对话,用电子显微镜准备样本一般需要半个小时。
在电脑上观察前必须保持机器处于真空状态,半小时内即可获得图像数据。
一般你喜欢怎么看就怎么看。
2.需要液氮冷却探头。
如果不加液氮,要等一个小时才能冷却。
能谱分析是测什么的 4对于非金属样品,为了提高放大倍率,需要镀金,样品原貌会有一定改变;对于金属样品,不用镀金就可以进行元素分析;EDS的结构1、探测头:把x射线光子信号转换成电脉冲信号,脉冲高度与x射线光子的能量成正比。
2、放大器:放大电脉冲信号。
3、多道脉冲高度分析器:把脉冲按高度不同编入不同频道,也就是说,把不同的特征X射线按能量不同进行区分。
4、信号处理和显示系统:鉴别谱、定性、定量计算;记录分析结果。
EDS的分析技术1、定性分析:EDS的谱图中谱峰代表样品中存在的元素。
定性分析是分析未知样品的第一步,即鉴别所含的元素。
如果不能正确地鉴别元素的种类,最后定量分析的精度就毫无意义。
仪器分析实验------拉曼光谱法

拉曼光谱法建立谷物指纹图谱一. 实验目的1、了解拉曼光谱的基本原理,掌握显微共焦激光拉曼光谱仪的使用方法。
2、测量一些常规物质和复杂样品的拉曼光谱。
二. 实验原理当用波长比试样粒径小得多的频率为υ的单色光照射气体、液体或透明试样时,大部分的光会按原来的方向透射,而一小部分则按不同的角度散射开来,产生散射光。
散射光中除了存在入射光频率υ外,还观察到频率为υ±△υ的新成分,这种频率发生改变的现象就被称为拉曼效应。
υ即为瑞利散射,频率υ+△υ称为拉曼散射的斯托克斯线,频率为υ-△υ的称为反斯托克斯线。
△υ通常称为拉曼频移,多用散射光波长的倒数表示,计算公式为011λλν-=∆式中,λ和λ0分别为散射光和入射光的波长。
△υ的单位为cm -1。
由于拉曼谱线的数目、频移、强度直接与分子振动或转动能级有关。
因此,研究拉曼光谱可以提供物质结构的有关信息。
自从激光问世以来,拉曼光谱的研究取得了长足进展,已广泛应用于物理、化学、生物以及生命科学等研究领域。
图1显微共焦激光拉曼光谱仪结构三. 实验仪器和试剂1. 显微共焦激光拉曼光谱仪 Renishaw inVia (英国雷尼绍公司)2. 粉碎机、载玻片、盖玻片、胶头滴管 显微镜 样品狭缝光栅扩束器3. 测试样品常规物质:CCl4,CH2Cl2复杂样品:不同淀粉类作物自备样品:不同材料的小挂件四. 实验步骤1. 打开主机和计算机电源,同时打开激光器后面的总电源开关,将仪器预热20分钟左右。
2. 自检.静态取谱(Static),中心520 Raman Shift cm-1, Advanced -> Pinhole 设为in。
使用硅片,用50 倍物镜,1 秒曝光时间,100%激光功率取谱。
使用曲线拟合(Curve fit)命令检查峰位,检验仪器状态。
3.样品拉曼光谱的测定将样品放置在载玻片上,盖上盖玻片,置于显微镜的载物台上,调节显微镜载物台的高度使得显微镜能够清晰地观察到样品表面(上2,下1)。
仪器分析知识点

仪器分析题库第一章1. 几个常用公式:v=λν(v:传播速度,λ:波长,ν:频率)1eV=1.602*10^-19 J波动性:c=λf=f/σ(f:频率,σ=1/λ:波数)微粒性:E=hν=hc/λ(h:普朗克常数,其值为6.626*10^-34 J·s)2. 电磁波谱:电磁辐射按照波长或频率的大小顺序排列γ射线→X射线→紫外光→可见光→红外光→微波→无线电波(从左到右:波长越来越大,频率越来越小,能量越来越小)3. 光谱法按物质与能量作用形式(能量交换方向)分类:1)吸收能量(基态→激发态)M+hν→M*2)发射、辐射(激发态→基态)M*→M+hν按作用的物质对象分类:1)原子光谱,2)分子光谱4. 共振线:原子中的电子的基态和激发态能量差的辐射称为共振线第一共振线:从基态跃迁至能量最低的激发态(第一激发态)产生的共振线称为第一共振线(由于各类元素的第一共振线不同,故这种共振线称为元素的特征谱线)。
第一共振线灵敏度最高,所以又称为最灵敏线。
第二章1. 紫外-可见吸收光谱法(UV-Vis)是分子吸收光谱方法,也是带状光谱,是由分子中的价电子发生能级跃迁发生的。
2. 分子能级的高低顺序:σ<π<n<*π<σ*分子轨道间可能的跃迁有:σ→σ*, σ→*π, π→σ*, n→σ*, π→*π, n→*π跃迁能量最大:σ→σ*,跃迁能量最小:n→*π3. 朗伯-比尔定律1)它表明在稀溶液中,物质对单色光的吸光度(A)与吸光物质溶液的浓度(c)和液层厚度(l)的乘积成正比。
2)公式:A=lcε(ε:常数,称为吸光系数或吸收系数)3)摩尔吸光系数:在一定波长时,溶液浓度为单位摩尔浓度、液层厚度为单位厚度时的吸光度,其单位为L·cm-1·mol-1。
(偏离比尔定律的因素:1)化学因素:浓度,需要小于0.01mol/L;2)光学因素:非单色光;其他光学因素:反射,参比溶液;散射:胶体,细小颗粒物(应用均匀溶液,真溶液,若产生“假吸收”,会导致吸光度增加,导致结果偏高))4. 影响显色反应的因素:显色剂用量、溶液酸度(pH)、显色时间、显色温度第三章1. 红外光谱(IR)是分子光谱,是由于分子中原子振动或分子转动产生的吸收光谱。
人教版高中化学选修六 附录Ⅶ 几种仪器分析方法

试样从进样器进入离子源,在离子源中产生正离子。正离子加 速进入质量分析器,质量分析器将离子按质荷比大小不同进行分离。 分离后的离子先后进入检测器,检测器得到离子信号,放大器将 信号放大并记录在读出装置上。
2、质谱图 以荷质比m/z为横座标,以对基峰(最强离子峰,规定相对强度为
100%)相对强度为纵座标所构成的谱图,称之为质谱图。
选修六 附录Ⅶ 几种仪器分析方法简介
一、质谱分析法 二、红外光谱分析法 三、核磁共振氢谱分析法
一 质谱分析法
相对分子质量的测
定——质谱仪
1、原理:质谱分析是用高速电子来撞击气态分子或原子,将电离后 的正离子加速导入质量分析器,然后在磁场中按质荷比(m/z)大小进 行收集和记录,及得到质谱图。根据质谱峰的位置进行物质的定性 和结构分析,根据峰的强度进行定量分析。
反对称伸缩振动 对称伸缩振动 反对称伸缩振动 对称伸缩振动 弱吸收
3000 cm-1 以下
17
2.叁键(C C)伸缩振动区:2500 1900 cm-1 3. 双键伸缩振动区:1900 1500 cm-1 4. X—Y,X—H 变形振动区: < 1500cm-1
18
思考1:
红外光谱中同一官能团或化学键的吸收 峰位置和强度并不完全相同,产生这种现象 的原因是什么?
在谱图上出现的位置也不同,这种差异叫化学位移δ。 从核磁共振氢图谱上可推知该有机物分子有几种不同类型的氢原子
(波峰数)及它们的数目比(波峰面积比)。
核磁共振氢谱光谱鉴定分子结构
2、核磁共振氢谱图
横坐标:吸收峰的位置,用“化学位移”表示。 纵坐标:吸收峰的强度。
核磁共振谱图中化合物的结构信息
1、峰的数目:标志分子中磁不等性质子的种类,多少种; 2、峰的强度(面积):每类质子的数目(相对),多少个; 3、峰的位移( ):每类质子所处的化学环境,化合物中位置;
有机化合物的谱图解析

05
在分子光谱中,根据电磁波的波长(λ)划分为几个
06
不同的区域,如下图所示:
微粒性:可用光量子的能量来描述:
分子的总能量由以下几种能量组成:
红外光谱的表示方法 红外光谱
一般指中红外(振动能级跃迁)。
纵坐标:透过率(T %),表示吸收强度。T↓,表明吸收的 越好,故曲线低谷表示是一个好的吸收带。 表示透过光的强度; I0:表示入射光的强度。
在没有纯净的标准物质时,可用标准谱图比较。许多国家 都编制出版了标准谱图集,如萨特勒IR谱图集,汇集有十 余万张纯化合物的标准红外光谱图。
①了解与试样性质有关的其他资料 了解来源 元素分析的结果 相对分子质量 熔点、沸点等物理性质和有关的化学性质 由元素分析结果和相对分子质量推算出分子式 计算不饱和度:
力常数k:与键长、键能有关:键能↑(大),键长↓(短),k↑。
化学键
键长(nm)
键能(Kj.mol-1)
力常数 k(N.cm-1)
波数范围(cm-1)
C―C
0.154
347.3
4.5
700~1200
C=C
0.134
610.9
9.6
规定:双键(C=C、C=O)、饱和环状结构:Ω=1; 叁键(C≡C):Ω=2;苯环: Ω=4。
n1-1价原子数目 n3-3价原子数目 n4-4价原子数目
例: 计算甲苯C7H8的不饱和度。
答:甲苯的不饱和度为4。 甲苯的不饱和度为4,是因为苯可看作3个双键和1个环。
②试样的制备和红外光谱的制作 ☆被分析的试样应该是纯物质 ☆纯物质可以通过对试祥进行分离和精制的方法(如分馏、萃取、重结晶、层析等)得到 ☆根据试样的性质,按照试验条件制作红外光谱图
一些常见仪器分析方法的缩写、谱图和功能说明
常见仪器分析方法的缩写、谱图和功能说明AAAS 原子吸收光谱法AES 原子发射光谱法AFS 原子荧光光谱法ASV 阳极溶出伏安法ATR 衰减全反射法AUES 俄歇电子能谱法CCEP 毛细管电泳法CGC 毛细管气相色谱法CIMS 化学电离质谱法CIP 毛细管等速电泳法CLC 毛细管液相色谱法CSFC 毛细管超临界流体色谱法CSFE 毛细管超临界流体萃取法CSV 阴极溶出伏安法CZEP 毛细管区带电泳法DDDTA 导数差热分析法DIA 注入量焓测定法DPASV 差示脉冲阳极溶出伏安法DPCSV 差示脉冲阴极溶出伏安法DPP 差示脉冲极谱法DPSV 差示脉冲溶出伏安法DPVA 差示脉冲伏安法DSC 差示扫描量热法DTA 差热分析法DTG 差热重量分析法EEAAS 电热或石墨炉原子吸收光谱法ETA 酶免疫测定法EIMS 电子碰撞质谱法ELISA 酶标记免疫吸附测定法EMAP 电子显微放射自显影法EMIT 酶发大免疫测定法EPMA 电子探针X射线微量分析法ESCA 化学分析用电子能谱学法ESP 萃取分光光度法FFAAS(Flame Atomic Absorption Spectroscopy) 火焰原子吸收光谱法FABMS 快速原子轰击质谱法FAES 火焰原子发射光谱法FDMS 场解析质谱法FIA 流动注射分析法FIMS 场电离质谱法FNAA 快中心活化分析法FT-IR 傅里叶变换红外光谱法FT-NMR 傅里叶变换核磁共振谱法FT-MS 傅里叶变换质谱法GC 气相色谱法GC-IR 气相色谱-红外光谱法GC-MS 气相色谱-质谱法GD-AAS 辉光放电原子吸收光谱法GD-AES 辉光放电原子发射光谱法GD-MS 辉光放电质谱法GFC 凝胶过滤色谱法GLC 气相色谱法GLC-MS 气相色谱-质谱法HHAAS 氢化物发生原子吸收光谱法HAES 氢化物发生原子发射光谱法HPLC 高效液相色谱法HPTLC 高效薄层色谱法IIBSCA 离子束光谱化学分析法IC 离子色谱法ICP 电感耦合等离子体ICP-AAS 电感耦合等离子体原子吸收光谱法ICP-AES 电感耦合等离子体原子发射光谱法ICP-MS 电感耦合等离子体质谱法IDA 同位素稀释分析法IDMS 同位素稀释质谱法IEC 离子交换色谱法INAA 仪器中子活化分析法IPC 离子对色谱法IR 红外光谱法ISE 离子选择电极法ISFET 离子选择场效应晶体管LLAMMA 激光微探针质谱分析法LC 液相色谱法LC-MS 液相色谱-质谱法MMECC 胶束动电毛细管色谱法MEKC 胶束动电色谱法MIP-AAS 微波感应等离子体原子吸收光谱法MIP-AES 微波感应等离子体原子发射光谱法MS 质谱法NNAA 中子活化法NIRS 近红外光谱法NMR 核磁共振波谱法PPAS 光声光谱法PC 纸色谱法PCE 纸色谱电泳法PE 纸电泳法PGC 热解气相色谱法PIGE 粒子激发Gamma射线发射光谱法PIXE 粒子激发X射线发射光谱法RRHPLC 反相高效液相色谱法RHPTLC 反相液相薄层色谱法RIA 发射免疫分析法RPLC 反相液相色谱法SSEM 扫描电子显微镜法SFC 超临界流体色谱法SFE 超临界流体萃取法SIMS 次级离子质谱法SIQMS 次级离子四极质谱法SP 分光光度法SP(M)E 固相(微)萃取法STM 扫描隧道电子显微镜法STEM 扫描投射电子显微镜法SV 溶出伏安法TTEM 投射电子显微镜法TGA 热重量分析法TGC 薄层凝胶色谱法TLC 薄层色谱法UUPS 紫外光电子光谱法UVF 紫外荧光光谱法UVS 紫外光谱法XXES X射线发射光谱法XPS X射线光电子光谱法XRD X射线衍射光谱法XRF X射线荧光光谱法。
仪器分析(xrd、红外、拉曼等)

各种仪器分析的基本原理及谱图表示方法——牛人总结,留着备用来源:刘艳的日志紫外吸收光谱UV分析原理:吸收紫外光能量,引起分子中电子能级的跃迁谱图的表示方法:相对吸收光能量随吸收光波长的变化提供的信息:吸收峰的位置、强度和形状,提供分子中不同电子结构的信息荧光光谱法FS分析原理:被电磁辐射激发后,从最低单线激发态回到单线基态,发射荧光谱图的表示方法:发射的荧光能量随光波长的变化提供的信息:荧光效率和寿命,提供分子中不同电子结构的信息红外吸收光谱法IR分析原理:吸收红外光能量,引起具有偶极矩变化的分子的振动、转动能级跃迁谱图的表示方法:相对透射光能量随透射光频率变化提供的信息:峰的位置、强度和形状,提供功能团或化学键的特征振动频率拉曼光谱法Ram分析原理:吸收光能后,引起具有极化率变化的分子振动,产生拉曼散射谱图的表示方法:散射光能量随拉曼位移的变化提供的信息:峰的位置、强度和形状,提供功能团或化学键的特征振动频率核磁共振波谱法NMR分析原理:在外磁场中,具有核磁矩的原子核,吸收射频能量,产生核自旋能级的跃迁谱图的表示方法:吸收光能量随化学位移的变化提供的信息:峰的化学位移、强度、裂分数和偶合常数,提供核的数目、所处化学环境和几何构型的信息电子顺磁共振波谱法ESR分析原理:在外磁场中,分子中未成对电子吸收射频能量,产生电子自旋能级跃迁谱图的表示方法:吸收光能量或微分能量随磁场强度变化提供的信息:谱线位置、强度、裂分数目和超精细分裂常数,提供未成对电子密度、分子键特性及几何构型信息质谱分析法MS分析原理:分子在真空中被电子轰击,形成离子,通过电磁场按不同m/e分离谱图的表示方法:以棒图形式表示离子的相对峰度随m/e的变化提供的信息:分子离子及碎片离子的质量数及其相对峰度,提供分子量,元素组成及结构的信息气相色谱法GC分析原理:样品中各组分在流动相和固定相之间,由于分配系数不同而分离谱图的表示方法:柱后流出物浓度随保留值的变化提供的信息:峰的保留值与组分热力学参数有关,是定性依据;峰面积与组分含量有关反气相色谱法IGC分析原理:探针分子保留值的变化取决于它和作为固定相的聚合物样品之间的相互作用力谱图的表示方法:探针分子比保留体积的对数值随柱温倒数的变化曲线提供的信息:探针分子保留值与温度的关系提供聚合物的热力学参数裂解气相色谱法PGC分析原理:高分子材料在一定条件下瞬间裂解,可获得具有一定特征的碎片谱图的表示方法:柱后流出物浓度随保留值的变化提供的信息:谱图的指纹性或特征碎片峰,表征聚合物的化学结构和几何构型凝胶色谱法GPC分析原理:样品通过凝胶柱时,按分子的流体力学体积不同进行分离,大分子先流出谱图的表示方法:柱后流出物浓度随保留值的变化提供的信息:高聚物的平均分子量及其分布热重法TG分析原理:在控温环境中,样品重量随温度或时间变化谱图的表示方法:样品的重量分数随温度或时间的变化曲线提供的信息:曲线陡降处为样品失重区,平台区为样品的热稳定区热差分析DTA分析原理:样品与参比物处于同一控温环境中,由于二者导热系数不同产生温差,记录温度随环境温度或时间的变化谱图的表示方法:温差随环境温度或时间的变化曲线提供的信息:提供聚合物热转变温度及各种热效应的信息示差扫描量热分析DSC分析原理:样品与参比物处于同一控温环境中,记录维持温差为零时,所需能量随环境温度或时间的变化谱图的表示方法:热量或其变化率随环境温度或时间的变化曲线提供的信息:提供聚合物热转变温度及各种热效应的信息静态热―力分析TMA分析原理:样品在恒力作用下产生的形变随温度或时间变化谱图的表示方法:样品形变值随温度或时间变化曲线提供的信息:热转变温度和力学状态动态热―力分析DMA分析原理:样品在周期性变化的外力作用下产生的形变随温度的变化谱图的表示方法:模量或tgδ随温度变化曲线提供的信息:热转变温度模量和tgδ透射电子显微术TEM分析原理:高能电子束穿透试样时发生散射、吸收、干涉和衍射,使得在相平面形成衬度,显示出图象谱图的表示方法:质厚衬度象、明场衍衬象、暗场衍衬象、晶格条纹象、和分子象提供的信息:晶体形貌、分子量分布、微孔尺寸分布、多相结构和晶格与缺陷等扫描电子显微术SEM分析原理:用电子技术检测高能电子束与样品作用时产生二次电子、背散射电子、吸收电子、X射线等并放大成象谱图的表示方法:背散射象、二次电子象、吸收电流象、元素的线分布和面分布等提供的信息:断口形貌、表面显微结构、薄膜内部的显微结构、微区元素分析与定量元素分析等原子吸收AAS原理:通过原子化器将待测试样原子化,待测原子吸收待测元素空心阴极灯的光,从而使用检测器检测到的能量变低,从而得到吸光度。
仪器分析:红外吸收光谱分析

分子中其它部分对一定基团的振动频率略有影响,即同种 基团在不同物质中所处环境不同,能反映出结构上的特点。
stop
为了便于辨认各特征吸收频率所代表的基团,将红外光谱
图按(或波数)大小分为基频区和指纹区。
%
(cm )
图9.1 聚乙烯薄膜的红外光谱图
9.1 红外光谱法原理 9.2 红外分光光度计 9.3 红外光谱图的表示方法 9.4 红外光谱的特征吸收频
率及其分子结构的关系 9.5 红外光谱定性分析 9.6 红外光谱法应用
stop
9.1 红外光谱法原理
1. 红外吸收光谱的产生
当红外辐射照射物质时,由于辐射能量的大小与分子中
(cm1) 1 10 4 (cm) (m)
vC
红外光谱是物质受到红外辐射后,分子吸收部分红外辐射, 使分子中振动能级和转动能级跃迁所产生的分子吸收光谱。 分子吸收红外辐射后发生偶极矩变化,可产生红外光谱, 红外光谱与物质结构有关,不同结构的分子吸收红外光的 波长不同,故可用红外吸收光谱鉴定分子结构。
(1)基频区(波数4000~1350cm-1) 即基团的特征频率区,该区域的吸收光谱是由分子中的基 团引起的,主要反映分子中特征基团的振动。鉴定基团主要在 该区进行。基频区又可分为以下几个区域: 4000~2500 cm-1 :单键(X-H)伸缩振动区(X代表 C、O、N、
S等原子),该区主要包括N-H、O-H、C-H等的伸缩振动。即含
随着转动能级的跃迁,因此所得的红外光谱不是简单的吸收
线,而是吸收谱带。
产生红外光谱的条件:
(1)红外光能量应恰好满足分子中原子振动能级跃迁时所ຫໍສະໝຸດ 需的能量;stop
仪器分析 第四章--红外吸收光谱法

章节重点:
分子振动基本形式及自由度计算;
红外吸收的产生2个条件;
各类基团特征红外振动频率;
影响红外吸收峰位变化的因素。
第八章 红外吸收光谱分 析法
第三节 红外分光光度计
1. 仪器类型与结构
2. 制样方法
3. 联用技术
1. 仪器类型与结构
两种类型:色散型 干涉型(傅立叶变换红外光谱仪)
弯曲振动:
1.4 振动自由度
多原子分子振动形式的多少用振动自由度标示。
三维空间中,每个原子都能沿x、y、z三个坐标方向独 立运动,n个原子组成的分子则有3n个独立运动,再除 掉三个坐标轴方向的分子平移及整体分子转动。
非线性分子振动自由度为3n-6,如H2O有3个自由度。 线性分子振动自由度为3n-5,如CO2有4个自由度。
某些键的伸缩力常数:
键类型: 力常数: 峰位:源自-CC15 2062 cm-1
-C=C10 1683 cm-1
-C-C5 1190 cm-1
-C-H5.1 2920 cm-1
化学键键强越强(即键的力常数K越大),原子折合 质量越小,化学键振动频率越大,吸收峰在高波数区。
1.2 非谐振子
实际上双原子分子并非理想的谐振子!随着振动量子 数的增加,上下振动能级间的间隔逐渐减小!
(1)-O-H,37003100 cm-1,确定醇、酚、酸 在非极性溶剂中,浓度较小(稀溶液)时,峰形尖锐 ,强吸收;当浓度较大时,发生缔合作用,峰形较宽。
注意区分: -NH伸缩振动:3500 3300 cm-1 峰型尖锐
(2)饱和碳原子上的-C-H -CH3 2960 cm-1 2870 cm-1 反对称伸缩振动 对称伸缩振动
仪器分析笔记

第一章原子发射光谱法(AES)一、原理1、发射的定义:基态微粒吸收能量到达激发态,不稳定,迅速跃基态激发:低能级→高能级激发态驰豫:高能级→低能级2、谱线强度:g,统计权重,正比A,跃迁几率,正比E,激发电位,负指数T,激发温度N,基态原子数,正比T↑,谱线强度↑,T过高,谱线强度↓二、应用1、定性(标准光谱图:在放大20倍的不同破断的Fe的光谱图上标出68种元素的主要谱线)2、半定量(大概)3、定量(准确)(自吸干扰的消除,自吸会使谱线强度↓)自蚀 b lgI=lga+blgc第二章原子吸收光谱法(AAS)一、原理1、吸收的定义:基态粒子选择吸收特定频率的电磁波到激发态。
2、谱线及其测定(1)宽度(多普勒宽度、碰撞宽度、场致宽度、自然宽度)(2)朗伯比尔定律二、应用1、标准曲线法ii i igI A h N egν=iEKT-*,*X E X X X hν+→→+I ac=}*X h Xν+=I Ie=KNb-lg 2.303IA KNbI==A KC=第三章紫外可见分光光度法(UI-UIS)以分子的外层电子吸收紫外可见光,在分子的电子能级发生跃迁的基础的分析方法。
(使用材料简单,仪器造价低,广泛用于有机物的定量分析)一、原理分子光谱简介:电子光谱,紫外可见光谱,能级差约为1-20eV。
振转光谱,红外光谱,能级差约为0.05-1eV。
转动光谱,远红外光谱,能级差约为0.005-0.05eV。
紫外光谱吸收光线各类有机分子紫外光谱二、应用1.结构分析:分子骨架推断由于特征性差,UV-VIS应用于结构分析有局限性,仅用于两个方面:1.鉴定生色团种类2.辅助确定分子结构2.定量分析:多组分分析法测定色素、蛋白质、核酸、激素三、有机分子键、电子、轨道类型:键的类型:ζ键和π键电子的类型:ζ电子、π电子和n电子轨道类型:ζ成键轨道、π成键轨道、n非键轨道、π*反键轨道和ζ*反键轨道有机分子跃迁类型:ζ→ζ* 跃迁-单键,π→π*跃迁-双键、三键,n →ζ*跃迁-单键、杂原子,n→π*跃迁-双键、杂原子,电荷迁移跃迁-取代芳烃朗伯比尔定律基本式:A=abc 摩尔式:A=εbc,使用广泛质量式:A=Ebc 吸收曲线的绘制:将不同波长的单色光,依次通过待测物质,测得不同波长下的吸收参数,称为扫描。
仪器分析中各分析定量定性的依据

仪器分析中各分析定量定性的依据定量分析是依据统计数据,建立数学模型,并用数学模型计算出分析对象的各项指标及其数值的一种方法。
定性分析则是主要凭分析者的直觉、经验,凭分析对象过去和现在的延续状况及最新的信息资料,对分析对象的性质、特点、发展变化规律作出判断的一种方法。
1、气相色谱:色谱峰保留值和面积,这样气相色谱可根据这两个数据进行定性定量分析。
色谱峰保留值是定性分析的依据,而色谱峰面积则是定量分析的依据。
2、紫外光谱:最大吸收波长λ、摩尔吸收系数ε及吸收曲线的形状不同是进行物质定性分析的依据。
进行定量分析依据朗伯-比耳定律:A=εbc3、核磁:定量分析以结构分析为基础,在进行定量分析之前,首先对化合物的分子结构进行鉴定,再利用分子特定基团的质子数与相应峰谱的峰面积之间的关系进行定量测定。
定量分析的根据:吸收能量的大小取决于核的多少。
以磁场强度为横坐标提供定性分析所依据的参数,以吸收能量为纵坐标,纵坐标对应于不同H0的出峰面积就是定量分析参数。
4、质谱:利用电磁学原理,对物质气相离子依其质荷比(m/e)进行分离和分析的方法。
被分析的样品首先离子化,然后利用离子在电场或磁场中的运动性质,将离子按质荷比(m/e)分开并按质荷比大小排列成谱图形式,根据质谱图可确定样品成分、结构和相对分子质量。
5、原子吸收:原子吸收光谱法进行定量分析的依据是:试样中待测元素的浓度与待测元素吸收辐射的原子总数成正比,即A=k'C 。
定量分析方法有标准曲线法和标准加入法两种。
6、红外:红外光谱的定性主要根据图谱中的:基团的特征吸收频率红外光谱的定量是根据图谱中的:特征峰的强度7、离子:利用离子交换的原理,连续对多种阴离子进行定性和定量的分析。
保留时间定性,峰高或峰面积定量。
8、荧光:物质吸收的光,称为激发光;物质受激后所发射的光,称为发射光或荧光。
根据荧光的光谱和荧光强度,对物质进行定性或定量测定9、差热:定性分析:定性表征和鉴别物质依据:峰温、形状和峰数目方法:将实测样品DTA曲线与各种化合物的标准(参考)DTA曲线对照。
质谱学习知识

1.质谱分析法先将中性分子离子化,再顺次分离和记录各种离子的质荷比和丰度先将中性分子离子化,再顺次分离和记录各种离子的质荷比和丰度( 强度),从而实现分析目的的一种分析方法。
2.质谱不同质荷比的离子经质量分析器分离,而后被检测并记录下来的谱图叫作质谱图。
简称质谱。
质谱图的横坐标是质荷比(m/z) ,纵坐标是离子强度;质谱法(Mass Spectrometry) 即质谱分析法,一般亦简称为质谱;质谱计(Mass Spectrometer): 采用顺次记录各种质荷比离子的强度的方式测量化合物质谱的仪器;质谱仪(Mass Spectrography) :采用干板记录方式,同时记录下所有离子的质谱仪器。
氯霉素的质谱图3.质谱基础知识常用的质量单位Da=Dalton(道尔顿)质量单位,等于一个碳原子(12C)质量的十二分之一,约为1.66×10-24克;一克约为6×1023道尔顿。
amu=atomic mass unit ,原子质量单位1amu=1Da原子结构及其质量原子量* 国际协议赋予其确切的质量为12原子量(C) = 0.9889(12.0000) + 0.0111(13.0033)= 12.011一种元素的所有同位素的重量平均值叫作原子量同位素及同位素丰度同位素即具有相同的原子序数而又具有不同的质量数的原子叫作同位素。
同位素丰度即自然界中某同位素原子所占的百分数叫做该同位素的天然丰度。
同位素表示法质量数= 质子+ 中子具有相同的元素符号,在元素符号的左上角表明其质量数4.怎样计算质量数、分子量名义质量数采用元素质量数的整数进行计算,例如:C=12,H=1,O=16单同位素质量数或准确质量数用丰度最大的同位素准确质量数计算例如:12C=12,1H=1.0078,16O=15.9948平均质量数或化学质量数考虑到所有天然同位素丰度的该元素原子量来计算例如:C=12.001,H=1.00794,O=15.9994四极杆质谱获得的单电荷离子的m/z值,是单同位素质数,建议质谱峰标注到小数点后1位。
各种仪器分析的基本原理及谱图表示方法

各种仪器分析的基本原理及谱图表示方法仪器分析是化学分析中的重要分支,它利用各种仪器设备,通过对样品中成分的检测、鉴定和测量,实现对样品的分析和解释。
下面介绍几种常见的仪器分析方法及其基本原理和谱图表示方法。
原子吸收光谱法(AAS)1.基本原理:原子吸收光谱法是基于原子能级跃迁的吸收光谱法。
样品中的原子在高温烈焰中被激发为原子态,当光源发射的光束通过样品时,其中的某些元素会被吸收,导致光强减弱。
通过测量光强减弱程度,可以推算出样品中元素的含量。
2.谱图表示方法:原子吸收光谱的谱图表示吸光度(Absorbance)与波长(Wavelength)的关系。
横坐标为波长,纵坐标为吸光度。
在每个元素的吸收峰处,吸光度会显著增加,从而实现对元素的定性定量分析。
气相色谱法(GC)1.基本原理:气相色谱法是一种分离和分析复杂混合物的方法。
样品中的组分在气相状态下被载气携带通过色谱柱,不同组分在固定相和移动相之间的分配系数不同,因此会以不同的速度通过色谱柱,从而实现各组分的分离。
通过检测器对分离后的组分进行检测和测量,可以得到各组分的含量。
2.谱图表示方法:气相色谱图的横坐标为时间(Time),纵坐标为峰高(Peak Height)或峰面积(Peak Area)。
各组分会在不同的时间点出现,通过对比标准品可以得到各峰的定性结果,通过测量峰高或峰面积可以计算出各组分的含量。
紫外-可见光谱法(UV-Vis)1.基本原理:紫外-可见光谱法是一种基于分子吸收光子能量的光谱法。
样品中的分子在紫外-可见光照射下会吸收特定波长的光子能量,导致光强减弱。
通过测量光强减弱程度,可以推算出样品中分子的含量及分子结构信息。
2.谱图表示方法:紫外-可见光谱图的横坐标为波长(Wavelength),纵坐标为吸光度(Absorbance)或透过率(Transmittance)。
在每个分子的特征吸收峰处,吸光度会显著增加,从而实现对分子的定性定量分析。
现代仪器分析方法

1
单取代
1 1 (双峰) ~ 750 cm (强) , ~ 700 cm (较强) 单取代 Ar H
双取代
邻取代
1 (强,单峰) 邻取代 Ar H ~ 750cm
芳香族化合物
• 取代基效应——在苯环上引入取代基,一般使 吸收峰向长波方向移动,即发生红移。 注意:此规律尤其适用于单取代苯
例如:
化合物 λmax / nm 254 270 280
OH NO 2
芳香族化合物 • 共轭效应——随着共轭体系的增加,吸收峰向长 波方向移动,即发生红移 。
例如:
不饱和脂肪族有机化合物的紫外吸收 ① 孤立双键烯烃 如: CH2=CH2 λmax=171nm(ε =15530) ②共轭双键的化合物
如 : CH2=CH- CH=CH2 λmax=217nm(ε =21000) 原因:π 键与π 键相互作用(π –π 共轭), 生成大π 键,电子容易激发。
不饱和化合物脂肪族化合物 • 共轭效应——随着共轭链的增长,吸收峰向长 波方向移动,即发生红移 。
基值 四 个 烷 基 45 取代 二 个 环 外 25 双键 计算值(max) 实测值(max)
217 20 10 247 nm 247 nm
5. 各种有机化合物及官能团的紫外可见 吸收光谱特点
芳香族有机化合物的紫外吸收 一般都有三个吸收带,都是π →π * 跃
迁产生的。
苯的吸收带为: max= 184 nm ( = 47000)E1吸收带 max= 204 nm ( = 6900) E2吸收带 max= 255 nm ( = 230)较弱的一系列吸收带, 称为精细结构吸收带,B带。
1
3000 cm-1 以上
质谱名词术语

2006 Waters Corporation
质谱仪器名词与术语
离子源的种类:
EI: 电子轰击电离源 FAB: 快原子轰击电离源 ESI: 电喷雾电离源 APcI: 大气压化学电离源 API: 大气压电离源,泛指ESI和APcI MAlDI: 基质辅助激光解析电离源
2006 Waters Corporation
同位素离子:
由元素的重同位素构成的离子叫作同位素离子,它们 在质谱图中总是出现在相应的分子离子或碎片离子 的右侧
2006 Waters Corporation
质谱分析名词与术语
氮规则: 当化合物不含氮或含偶数个氮原子时,该化合物的分子量 为偶数, 当化合物含奇数个氮原子时,该化合物的分子量为奇数。 API电离方式使用氮规则时要将准分子离子还原成分子 量后再使用
2006 Waters Corporation
氯霉素的质谱图
2006 Waters Corporation
质谱基础知识
质谱中采用的质量单位
Da=Dalton (道尔顿 ) 质量单位,等于一个碳原子(12C)质量的十二分之一, 约为1.66×10-24克;一克约为6×1023道尔顿 amu=atomic mass unit ,原子质量单位 1amu=1Da
2006 Waters Corporation
质谱图名词与术语
基峰(Base peak): 在质谱图中,指定质荷比范围内强度最大的离子峰叫作 基峰。基峰的相对丰度为100% 本底(Back ground): 在与分析样品的相同条件下,不送入样品时所检测到的 质谱信号,包括化学噪声和电噪声
2006 Waters Corporation
2006 Waters Corporation
质谱图分析

同位素峰的强度比与同位素的天然丰度比是相当的。
4、碎片离子峰
一般有机化合物的电离能为7-13电子伏特,质谱中常用的
电离电压为70电子伏特,使结构裂解,产生各种“碎片”离子。
15 29 43 57
71
H3C CH2 CH2 CH2 CH2 CH3
正
71 57 43 29
15
己
烷 71 H3C CH2 CH2 CH2 CH2
亚稳离子是研究质谱碎裂机理的重要手段,它能指示 发生碎裂的离子(母离子)与产物离子(子离子)之 间的关联。亚稳离子必须用特殊的实验技术才能检测。
亚稳离子峰的质量数通常不是整数,其峰形不是一个 尖峰,而是一个跨几个质量数的宽峰。
3、同位素离子峰
一些同位素的天然丰度及丰度比
由于同位素的存在,
同位素
同 35Cl 位 37Cl
素 79Br
峰 81Br
天然丰度
99.985 0.015 98.893 1.107 99.634 0.366 99.759 0.037 0.204 95.0 0.76 4.22 75.77 24.23 50.537 49.463
丰度比(%)
2H/ 1H 0.015 13C/12C 1.11 15N/14N 0.37 17O /16O 0.04 18O/16O 0.20
本课章节
质谱图的组成 质谱峰类型
质谱中各种离子
一、质谱图的组成
质谱图由横坐标、纵坐标和棒线组成。 横坐标表示 m/z,由于分子离子或碎片离子在大 多数情况下只带一个正电荷,所以通常称m/z为质量 数,对于低分辨率的仪器,离子的质荷比在数值上 就等于它的质量数。 纵坐标表示离子强度,在质谱中可以看到几个高 低不同的峰,纵坐标峰高代表了各种不同质荷比的 离子丰度-离子流强度。
紫外光谱纵坐标

紫外光谱纵坐标紫外光谱是一种常用的分析方法,用于研究物质在紫外光波段的吸收特性。
在紫外光谱图中,纵坐标表示的是吸光度或者透射率,既是样品对紫外光的吸收或透射程度的定量表征。
紫外光谱谱图是由实验仪器测得的一系列数据点构成的图形。
纵坐标代表吸光度或透射率,横坐标表示波长(或者是频率)。
根据光的特性,紫外光波段的波长通常介于200 nm到400 nm之间。
光谱谱图中的纵坐标数据表示了光的强度,或者说是样品对光束的吸收或者透射程度。
吸光度是指样品溶液对入射光的吸收能力,透射率则表示样品溶液透过光束的程度。
在紫外光谱中,纵坐标通常使用吸光度来表示。
吸光度是一个无单位的数值,是通过比较入射光和透射光的光强度而得到的。
光谱仪器会记录光束通过不同波长下的吸光度数值,然后绘制出吸光度与波长之间的关系图,即紫外光谱谱图。
通过观察紫外光谱谱图的纵坐标数据可以得出很多结论。
例如,对于有机分子而言,它的吸收峰通常出现在200 nm到350 nm之间。
吸收峰的位置和强度可以提供关于物质结构和化学性质的有用信息。
纵坐标的数值范围在紫外光谱谱图中是根据样品的吸收强度来调整的。
如果样品的吸光度较低,那么纵坐标的数值范围会相对较小;如果样品的吸光度较高,纵坐标的数值范围则会相对较大。
这种调整可以使得各个数据点在图中都能够得到很好的显示。
此外,某些情况下也会使用透射率作为纵坐标。
透射率可以通过吸光度进行转化。
透射率是指光束透过样品的相对能力,常用百分比表示。
在紫外光谱谱图中,透射率的纵坐标范围通常是0%到100%。
总之,紫外光谱纵坐标用于表示样品溶液对紫外光的吸收或者透射程度。
吸光度是一种常用的纵坐标表示方式,它可以提供关于物质结构和化学性质的有用信息。
透射率也可以作为纵坐标,它表示光束透过样品的相对能力。
通过观察纵坐标数据,我们可以对物质进行定性和定量的分析,从而获得更深入的了解。
红外光谱图地纵坐标为解读汇报

1、红外光谱图的纵坐标为吸收强度,横坐标为波长λ单位( m )(微米)或波数1/λ单位:cm-12、红外光谱图提供结构分析的四大信息为:峰数,峰位,峰形,峰强。
3、红外光谱的主要应用:有机化合物的结构解析。
4、红外光谱的定性主要根据图谱中的:基团的特征吸收频率;5、红外光谱的定量是根据图谱中的:特征峰的强度6、红外吸收光谱产生的要满足两个条件是:(1)辐射应具有能满足物质产生振动跃迁所需的能量;(2)辐射与物质间有相互偶合作用。
7、对称分子没有偶极矩,辐射不能引起共振,在IR中:无红外活性。
如:N2、O2、Cl2 等。
8、非对称分子有偶极矩,辐射不能引起共振,在IR中:有红外活性。
9、在IR中对称分子无红外活性。
原因是:没有偶极矩,辐射不能引起共振,10、在IR中非对称分子有红外活性。
原因是:有偶极矩,辐射不能引起共振,11、有机化合物的IR取决于分子的结构特征。
各管能团发生振动能级跃迁需要能量的大小(键力常数K)取决于:键两端原子的折合质量和键的力常数,12、有机化合物的IR取决于分子的结构特征。
各管能团发生振动能级跃迁需要能量的大小取决于键两端原子的折合质量和键的力常数K,两端原子的折合质量越大(键力常数K 不变),振动能级跃迁向红移。
13、有机化合物的IR取决于分子的结构特征。
各管能团发生振动能级跃迁需要能量的大小取决于键两端原子的折合质量和键的力常数,两端原子的键的力常数越大(折合质量不变),振动能级跃迁向高波数(紫)移。
13、化学键键强越强(即键的力常数K越大)原子折合质量越小,化学键的振动频率越大,吸收峰将出现在高波数区。
14、化学键键强越小(即键的力常数K越小)原子折合质量越大,化学键的振动频率越小,吸收峰将出现在低波数区。
15、分子中基团的基本振动形式有两类为:伸缩振动和变形振动16、IR中的峰位的描述是化学键的力常数K越大,原子折合质量越小,键的振动频率越大,吸收峰将出现在:高波数区(短波长区);反之,出现在低波数区(高波长区)17、IR中的峰位的描述是化学键的力常数K越小,原子折合质量越大,键的振动频率越小,吸收峰将出现在:低波数区(高波长区)18、IR中的峰数描述是与分子自由度有关,无瞬间偶基距变化时,在IR 图中无红外吸收。
仪器坐标常用知识点总结

仪器坐标常用知识点总结1. 仪器坐标的概念仪器坐标是指用于描述仪器位置和姿态的坐标系统。
在测量和控制领域中,仪器坐标通常用于表示测量设备的位置、倾斜角度、方位角等信息,以便于进行数据处理和分析。
2. 仪器坐标的表示在实际应用中,仪器坐标通常由三个坐标轴(X、Y、Z)和三个旋转角(pitch、roll、yaw)组成。
其中,坐标轴用于表示位置信息,旋转角用于表示姿态信息。
3. 坐标轴的选择在选择坐标轴时,通常需要考虑仪器的使用环境和操作习惯。
例如,在地理测量领域中,通常使用地心坐标系统或地理坐标系统;在机械制造领域中,通常使用机械坐标系统。
4. 仪器坐标的转换在实际应用中,仪器坐标通常需要与其他坐标系统进行转换,以便于进行数据处理和分析。
常用的坐标转换方法包括平移、旋转、缩放等。
5. 坐标变换矩阵在进行坐标转换时,通常使用坐标变换矩阵来描述不同坐标系统之间的关系。
坐标变换矩阵可以将一个坐标系统的位置和姿态信息转换到另一个坐标系统中。
6. 仪器校准在使用仪器测量时,通常需要对仪器进行校准,以确保测量结果的准确性和可靠性。
常用的校准方法包括零点校准、线性校准、非线性校准等。
7. 仪器坐标的精度在实际应用中,通常需要对仪器坐标的精度进行评估和控制,以确保测量结果的准确性和可靠性。
常用的精度评估方法包括重复性测量、精度分析、误差分析等。
8. 仪器坐标的应用在实际应用中,仪器坐标常用于测量、导航、控制等领域。
例如,地理测量领域常用于测量地球表面的位置和高程信息;机械制造领域常用于控制机器人和数控机床的运动轨迹。
在日常工作中,熟练掌握仪器坐标相关知识是非常重要的。
希望以上知识点的总结能够对大家有所帮助,也希望大家能够在实际工作中不断提升自己的专业技能,为科学研究和工程应用做出更大的贡献。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
作业五:
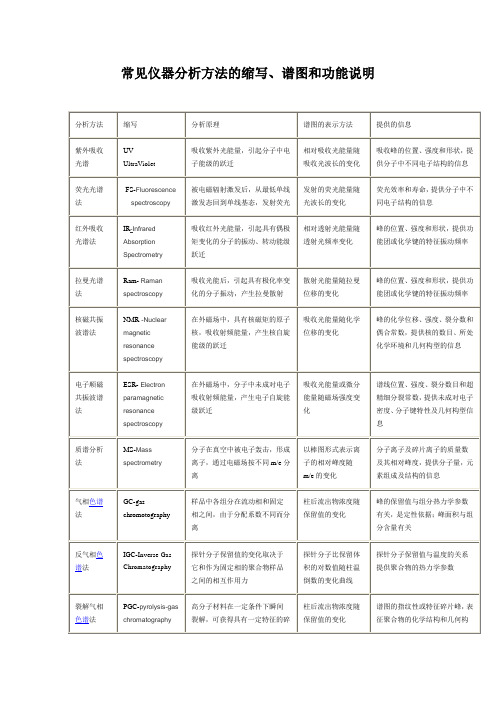
各种仪器分析的基本原理及谱图表示方法 紫外吸收光谱 UV
分析原理:吸收紫外光能量,引起分子中电子能级的跃迁
谱图的表示方法:相对吸收光能量随吸收光波长的变化
提供的信息:吸收峰的位置、强度和形状,提供分子中不同电子结构的信息
荧光光谱法 FS
分析原理:被电磁辐射激发后,从最低单线激发态回到单线基态,发射荧光 谱图的表示方法:发射的荧光能量随光波长的变化
提供的信息:荧光效率和寿命,提供分子中不同电子结构的信息 200300400500600700800900nm
标1(EM)
01000
2000
3000
红外吸收光谱法 IR
分析原理:吸收红外光能量,引起具有偶极矩变化的分子的振动、转动能级跃迁谱图的表示方法:相对透射光能量随透射光频率变化
提供的信息:峰的位置、强度和形状,提供功能团或化学键的特征振动频率
拉曼光谱法 Ram
分析原理:吸收光能后,引起具有极化率变化的分子振动,产生拉曼散射
谱图的表示方法:散射光能量随拉曼位移的变化
提供的信息:峰的位置、强度和形状,提供功能团或化学键的特征振动频率
核磁共振波谱法 NMR
分析原理:在外磁场中,具有核磁矩的原子核,吸收射频能量,产生核自旋能级的跃迁
谱图的表示方法:吸收光能量随化学位移的变化
提供的信息:峰的化学位移、强度、裂分数和偶合常数,提供核的数目、所处化学环境和几何构型的信息
质谱分析法 MS
分析原理:分子在真空中被电子轰击,形成离子,通过电磁场按不同m/e分离谱图的表示方法:以棒图形式表示离子的相对峰度随m/e的变化
提供的信息:分子离子及碎片离子的质量数及其相对峰度,提供分子量,元素组成及结构的信息
气相色谱法 GC
分析原理:样品中各组分在流动相和固定相之间,由于分配系数不同而分离
谱图的表示方法:柱后流出物浓度随保留值的变化
提供的信息:峰的保留值与组分热力学参数有关,是定性依据;峰面积与组分含量有关
热重法 TG
分析原理:在控温环境中,样品重量随温度或时间变化
谱图的表示方法:样品的重量分数随温度或时间的变化曲线
提供的信息:曲线陡降处为样品失重区,平台区为样品的热稳定区
热差分析 DTA
分析原理:样品与参比物处于同一控温环境中,由于二者导热系数不同产生温差,记录温度随环境温度或时间的变化
谱图的表示方法:温差随环境温度或时间的变化曲线
提供的信息:提供聚合物热转变温度及各种热效应的信息
示差扫描量热分析 DSC
分析原理:样品与参比物处于同一控温环境中,记录维持温差为零时,所需能量随环境温度或时间的变化
谱图的表示方法:热量或其变化率随环境温度或时间的变化曲线
提供的信息:提供聚合物热转变温度及各种热效应的信息。
