近年药物研发最热门靶点汇总分析
GPCR领域药物研发趋势深度解析(下)

GPCR领域药物研发趋势深度解析(下)Fig 1. The seven-transmembrane α-helix structure of a G protein–coupled receptor本⽂继续上期内容:GPCR领域药物研发趋势深度解析(上)GPCR与药物研发绝⼤多数药物靶点可归类于五⼤家族分⼦:GPCR、离⼦通道、激酶、核激素受体以及蛋⽩酶类。
长久以来,GPCR⼀直是最让⼈感兴趣的药物靶点,不仅调节着类别众多的⽣理学过程,还具有很多位于细胞表⾯的可成药位点。
据统计,在⽬前全球治疗性药物市场中,靶向GPCR 的药物占⽐⾼达27%;该类别药物在2011-2015年间销售额约8900亿美元。
本⽂即对所有的已上市GPCR药物及处于临床试验阶段的药物进⾏了深⼊分析,从⽽揭⽰出靶向GPCR药物领域在分⼦类型、药物靶点以及适应症⽅向的新趋势;同时对该领域的⽣物制剂、变构调节剂、⽼药新⽤开发、偏好性信号传导相关的GPCR结构数据及配体进⾏了分析。
同时我们还列出了最有可能上市的药物列表,并对GPCR家族中药物学尚未开始探索的靶点及相关联疾病进⾏了评估,以期抛砖引⽟。
靶向GPCR药物的适应症趋势Fig 2. Trends in the indications of approved GPCR-targeted drugs数据分析表明GPCR靶向药物的适应症范围很⼴,既包括历史上⼀直热门的治疗领域,如⾼⾎压、过敏、镇痛药、精神分裂症及抑郁症药物等,也包括⼀些新的焦点领域,如阿尔茨海默症及肥胖症等,如上图所⽰。
此外在过去的5年中,G蛋⽩偶联受体也被⽤于新的适应症,包括多发性硬化症(MS)、戒烟、短肠综合征和低钙⾎症等。
中枢神经系统疾病依旧为GPCR靶向药物的热门适应症对获批GPCR为靶点的药物适应症进⾏统计分析会发现,中枢神经系统疾病相关药物有124种,在所有获批的靶向GPCR药物中占⽐⾼达26%。
此外,⽬前有⾄少79种靶向于GPCR的药物处在不同阶段的临床试验中⽤于中枢神经系统疾病的治疗。
新型药物靶点的发现与设计

新型药物靶点的发现与设计随着科学技术的不断进步和医疗需求的增大,新型药物的研发和设计显得尤为重要。
药物的研发过程中,寻找合适的药物靶点是关键一环。
本文将探讨新型药物靶点的发现与设计,介绍其中的方法和技术,以及未来的发展前景。
一、药物靶点的定义与重要性药物靶点是指药物与生物体内某一特定分子或结构发生相互作用并发挥药物效应的部位。
药物靶点的发现和选择对于药物研发至关重要。
一个好的药物靶点应该具备以下特点:与所治疗疾病密切相关、可调控性高、靶点的结构与功能了解程度较高等。
二、常用的药物靶点发现方法1. 基因组学方法基因组学方法通过对基因组数据的挖掘和分析,寻找与疾病相关的基因和蛋白质。
其中,基因芯片技术、序列比较和功能标记等方法可以帮助识别出与疾病相关的靶点。
2. 蛋白质组学方法蛋白质组学方法主要利用质谱技术和蛋白质相互作用的分析,寻找与疾病相关的蛋白质靶点。
通过分析蛋白质的组成、结构和功能等特性,可以筛选出潜在的药物靶点。
3. 化学生物学方法化学生物学方法主要是通过分子筛选和化合物库筛选等技术,寻找具有活性的化合物,进而发现药物靶点。
化学生物学方法的优势在于能够直接检测化合物与靶点的相互作用,缩小药物靶点的范围。
三、新型药物靶点的设计1. 确定药物的目标在设计新型药物靶点之前,需要明确所治疗的疾病类型和病理机制。
通过对与疾病相关的信号通路和分子机制的了解,可以选择合适的药物靶点。
2. 分子建模与计算机辅助药物设计分子建模技术可以通过计算机模拟和预测分子的结构和性质,以便更好地理解药物与靶点的相互作用。
计算机辅助药物设计则可以快速筛选出具有潜在活性的化合物。
3. 高通量筛选技术高通量筛选技术是一种高效的药物靶点设计方法,它可以通过快速筛选大量的化合物,找到与特定靶点相互作用的潜在药物。
四、新型药物靶点的发展前景随着基因组学、蛋白质组学和化学生物学等领域的发展,新型药物靶点的发现和设计在未来将取得更大的突破。
药物靶点——精选推荐

药物靶点药物靶点是指药物在体内的作用结合位点,包括基因位点、受体、酶、离子通道、核酸等生物大分子。
即药物与机体生物大分子的结合部位。
此外,有些药物通过其理化作用或补充机体所缺乏的物质而发挥作用。
现有药物中,超过50%的药物以受体为作用靶点,受体成为最主要和最重要的作用靶点;超过20%的药物以酶为作用靶点,特别是酶抑制剂,在临床应用中具有特殊地位;6%左右的药物以离子通道为作用靶点;3%的药物以核酸为作用靶点;20%药物的作用靶点尚有待进一步研究。
酶酶是由机体细胞产生的具有催化活性和高度专一性的特殊蛋白质。
由于酶参与一些疾病发病过程,在酶催化下产生一些病理反应介质或调控因子,因此酶成为一类重要的药物作用靶点。
药物以酶为作用靶点,对酶产生抑制、诱导、激活或复活作用。
此类药物多为酶抑制剂,全球销量排名前20位的药物,有50%是酶抑制剂。
例如奥美拉唑通过抑制胃黏膜的H+-K+ATP酶,抑制胃酸分泌;喹诺酮类抑制DNA回旋酶,影响DNA合成而发挥杀菌作用;卡托普利抑制血管紧张素Ⅰ转换酶;西咪替丁抑制肝药酶。
苯巴比妥诱导肝药酶;解磷定使被有机磷酸酯类所抑制的胆碱酯酶复活等。
有些药物本身就是酶,例如胃蛋白酶、胰蛋白酶。
也有一些药物是酶的底物,需经转化后发挥作用。
例如左旋多巴通过血脑屏障后,在纹状体中被多巴脱羧酶所代谢,代谢产物多巴胺发挥补充中枢递质的作用。
磺胺类通过与对氨苯甲酸竞争二氢叶酸合成酶,妨碍二氢叶酸的合成,抑制细菌体内叶酸的代谢而干扰核酸的合成。
基因现代遗传学家认为,基因是DNA分子上具有遗传效应的特定核苷酸序列的总称,是具有遗传效应的DNA片段。
近年来,随着基因研究的深入,人类基因组计划的实施,某些疾病的相关基因陆续被找到。
基因治疗是指通过基因转移方式将正常基因或其他有功能的基因导入体内,并使之表达以获得疗效。
1990年人类历史上首次成功地进行了腺苷脱氨酶缺陷患儿人体基因治疗试验,掀起了人类医学上的一次革命。
小分子药物热门靶点
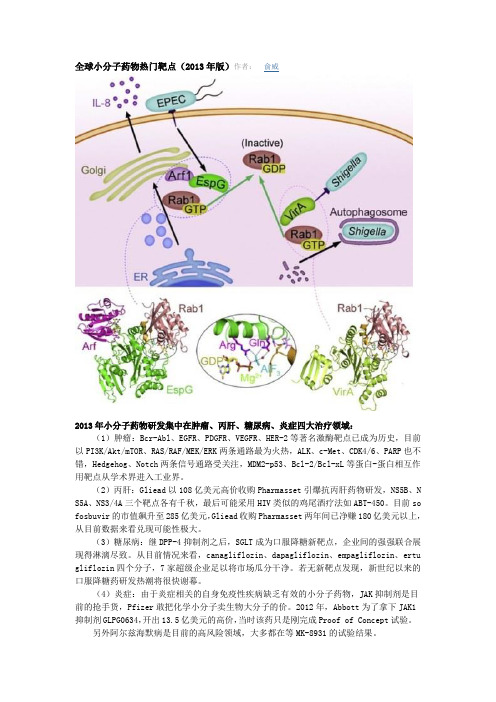
全球小分子药物热门靶点(2013年版)作者:俞威2013年小分子药物研发集中在肿瘤、丙肝、糖尿病、炎症四大治疗领域:(1)肿瘤:Bcr-Abl、EGFR、PDGFR、VEGFR、HER-2等著名激酶靶点已成为历史,目前以PI3K/Akt/mTOR、RAS/RAF/MEK/ERK两条通路最为火热,ALK、c-Met、CDK4/6、PARP也不错,Hedgehog、Notch两条信号通路受关注,MDM2-p53、Bcl-2/Bcl-xL等蛋白-蛋白相互作用靶点从学术界进入工业界。
(2)丙肝:Gliead以108亿美元高价收购Pharmasset引爆抗丙肝药物研发,NS5B、N S5A、NS3/4A三个靶点各有千秋,最后可能采用HIV类似的鸡尾酒疗法如ABT-450。
目前so fosbuvir的市值飙升至285亿美元,Gliead收购Pharmasset两年间已净赚180亿美元以上,从目前数据来看兑现可能性极大。
(3)糖尿病:继DPP-4抑制剂之后,SGLT成为口服降糖新靶点,企业间的强强联合展现得淋漓尽致。
从目前情况来看,canagliflozin、dapagliflozin、empagliflozin、ertu gliflozin四个分子,7家超级企业足以将市场瓜分干净。
若无新靶点发现,新世纪以来的口服降糖药研发热潮将很快谢幕。
(4)炎症:由于炎症相关的自身免疫性疾病缺乏有效的小分子药物,JAK抑制剂是目前的抢手货,Pfizer敢把化学小分子卖生物大分子的价。
2012年,Abbott为了拿下JAK1抑制剂GLPG0634,开出13.5亿美元的高价,当时该药只是刚完成Proof of Concept试验。
另外阿尔兹海默病是目前的高风险领域,大多都在等MK-8931的试验结果。
∙PI3K/Akt/mTOR通路抑制剂(包括PI3K抑制剂、Akt抑制剂、PI3K/mTOR双靶点抑制剂)适应症:乳腺癌、卵巢癌、子宫内膜癌、多发性骨髓瘤、非霍奇金淋巴瘤等Pfizer: PF-05212384(II期)Roche: RG7440(I期)、RG7604(I期)、pictilisib(II期)、RG7422(II期)Glaxosmithkline: GSK2636771(I期)、GSK2141795(I期)、GSK2110183(II期)Merck: MK-2206Novartis: buparlisib(III期)、BEZ235(II期)、BYL719(II期)Sanofi: SAR245408(II期)、SAR245409(II期)、SAR260301(I期)AstraZenca: AZD5363(I期)、AZD8186(I期)Bayer: 代号未知(II期)、代号未知(I期)Eli Lilly: p70S6/AKT双靶点抑制剂(I期)、PI3K/mTOR双靶点抑制剂(I期)Gilead: idelalisib(III期)、GS-9820(II期)∙RAS/RAF/MEK/ERK通路抑制剂(包括MEK-1/2抑制剂、Raf抑制剂)适应症:恶性黑色素瘤、肺癌、结直肠癌等Pfizer: PD-0325901(I期)Roche: vemurafenib(上市)、RG7421(III期)、RG7167(I期)、RG7304(I期)、RG7420(I期)Glaxosmithkline: trametinib(上市)、dabrafenib(上市)Novartis: MEK162(II期)AstraZenca: selumetinib(II期)Bayer: refametinib(II期)Sanofi: MSC1936369B(I期)∙ALK抑制剂适应症:非小细胞肺癌、淋巴瘤Roche: RG7853(II期)Novartis: LDK-378(III期)Eli Lilly: enzastaurin(III期)∙c-Met抑制剂适应症:肿瘤Glaxosmithkline: foretinib(II期)Sanofi: SAR125844(I期)AstraZenca: volitinib(I期)Eli Lilly: LY2801653(II期)∙CDK4/6抑制剂适应症:乳腺癌Pfizer: palbociclib(III期)Eli Lilly: LY2835219(II期)Bayer: 代号未知(I期)∙Hedgehog通路抑制剂(Smo抑制剂)Roche: vismodegib(上市)Novartis: erismodegib(III期)Eli Lilly: LY2940680(II期)∙Notch通路抑制剂(γ-secretase抑制剂)适应症:肿瘤Pfizer: PF-03084014(I期)Eli Lilly: 代号未知(I期)∙MDM2-p53抑制剂适应症:肿瘤Roche: RG7388Sanofi: SAR405838∙Bcl-2/ Bcl-xL抑制剂适应症:慢性淋巴细胞白血病Roche: RG7601(II期)AbbVie: ABT-199(II期)、ABT-263(II期)∙ChK1抑制剂适应症:肿瘤Roche: RG7602(I期)、RG7741(I期)Eli Lilly: LY2606368(II期)∙PARP抑制剂适应症:非小细胞肺癌、乳腺癌、卵巢癌Pfizer: rucaparib(II期)AbbVie: veliparib(II期)Sanofi: iniparib(III期)AstraZenca: olaparib(III期)∙HCV NS5B聚合酶抑制剂(包括核苷类、非核苷类)适应症:HCV感染Roche: mericitabine(II期)、setrobuvir(II期)Boehringer Ingelheim: BI 207127(III期)Gilead: sofosbuvir(III期)、tegobuvir(II期)、GS-9669(II期)∙HCV NS5A抑制剂适应症:HCV感染Bristol-Myers Squibb: daclatasvir(III期)Gilead: ledipasvir(III期)、GS-5816(II期)Merck: MK-8742(II期)Glaxosmithkline: GSK2336805(II期)Novartis: alisporivir(II期)∙HCV NS3/4A蛋白酶抑制剂Johnson & Johnson: simeprevir(III期)Roche: danoprevir(II期)Merck: MK-5172(II期)、vaniprevir(III期)Bristol-Myers Squibb: asunaprevir(III期)Boehringer Ingelheim: BI 201335(III期)AbbVie: ABT-450(III期)Gilead: GS-9451(II期)∙JAK1/2/3抑制剂适应症:类风湿性关节炎、骨髓纤维化、肿瘤Pfizer: tofacitinib(上市)Eli Lilly: baricitinib(III期)、LY2784544(II期)Novartis: ruxolitinib(上市)Sanofi: SAR302503(III期)Glaxosmithkline: GSK2586184(II期)∙BACE抑制剂(β-secretase抑制剂)适应症:阿尔兹海默病Roche: RG7129(I期)Merck: MK-8931(II期)∙SGLT1/2抑制剂适应症:II型糖尿病Pfizer/Merck: ertugliflozin(II期)Glaxosmithkline: GSK1614235(I期)Johnson & Johnson: canagliflozin(上市)AstraZenca/Bristol-Myers Squib: dapagliflozin(上市)Boehringer Ingelheim/Eli Lilly: empagliflozin(III期)Novartis: LIK066(II期)。
医药行业的创新药物研发进展

医药行业的创新药物研发进展近年来,医药行业的创新药物研发取得了长足的进步,为全球患者带来了福音。
新药的研发不仅能够解决现有药物无法治愈或控制的疾病,而且还能够提高治疗效果,减少副作用。
本文将介绍医药行业创新药物研发的最新进展。
一、基因编辑技术的应用基因编辑技术是目前医药行业创新药物研发领域的热门方向之一。
该技术能够对基因进行精确的修饰和编辑,进而纠正人体异常基因或缺陷基因,从根本上治愈一些遗传性疾病。
CRISPR/Cas9是目前最常用的基因编辑技术,它的开发极大地推动了医药行业的创新药物研发。
二、免疫疗法的突破免疫疗法是另一个备受关注的创新药物研发领域。
免疫疗法通过激活或增强患者自身免疫系统来攻击疾病,不仅可以治疗肿瘤等疾病,还可以治愈一些目前难以治疗的自身免疫性疾病。
近年来,免疫检查点抑制剂、CAR-T细胞疗法等创新药物相继获得批准上市,为患者提供了新的治疗选择。
三、人工智能在药物研发中的应用人工智能技术在医药领域的应用也越来越广泛。
通过利用大数据和算法,人工智能可以加速药物研发过程,提高新药的研发成功率。
人工智能可以帮助研究人员进行药物筛选、预测药物与靶点的相互作用等,大大提高了药物研发的效率,并且带来了更准确的预测结果。
四、精准医疗的发展精准医疗是医药行业创新药物研发的重要方向之一。
精准医疗通过对患者的个体遗传信息、环境因素和生活习惯等进行全面分析和评估,为患者提供个性化、精准的治疗方案。
精准医疗不仅能够提高药物疗效,还可以减少患者不必要的药物使用和治疗费用。
五、虚拟现实技术在临床试验中的应用临床试验是新药上市前必不可少的步骤。
虚拟现实技术在临床试验中的应用可以提高试验的安全性和效率。
利用虚拟现实技术,研究人员可以在模拟的环境中进行试验,减少对患者的侵入性操作,降低了试验的风险。
虚拟现实技术还可以帮助研究人员更直观地观察和评估试验结果,提高了试验的准确性。
六、药物再利用的研究药物再利用指的是将已经上市的药物用于治疗新的适应症。
史上最全肺癌靶向治疗的8个靶点和15种药物

史上最全肺癌靶向治疗的8个靶点和15种药物我们现在都说癌症是慢性病,并不是绝症。
为什么会这么说,有什么依据呢?随着医学的研究和发展,医生专家们提出:如果有毒性很低的药物,并且对于肿瘤的治疗十分有效,我们可以长期使用,一个药管几年,之后还可以再换另一种药,再管几年,那么这就有可能使癌症变成慢性病。
靶向药给肺癌治疗带来飞跃性的进步靶向药的出现,使得肺癌迈向慢性病的脚步又近了一些。
参考美国的情况,美国人群中EGFR突变的人群,中位生存已经活到了4.3年,这个过程里面就包括了从一代靶向药易瑞沙,到三代靶向药泰瑞沙,以及后续化疗等方案的贡献。
那么,我相信我们中国的人群在靶向药这方面将获得比美国更多的收益。
为什么呢?中外专家经过临床研究发现:东方人群使用靶向药物的生存期和有效率要明显优于西方人群,它被称为“上帝送给东方人的礼物”!那么美国人群的中位数是4.3年,我们中国人群是不是会更高呢?那么当提到靶向药的时候,有许多觅友们不知道自己是否可以使用靶向药,小编在这里要给大家一些提示:在用靶向药之前一定要做基因检测!千万不要认为医生让我们做基因检测是为了让我们多花钱,不是的!只有做了基因检测,我们才知道要用哪一种靶向药。
这其实是在帮助我们做更精准的治疗,更加节省时间,少走弯路。
没有组织,用血液也可以做基因检测哦!如果要用组织做检测,组织最好是在半年内的。
但是提到用靶向药治疗,做基因检测。
有许多觅友是不是又懵逼了?不知道该做哪些靶点的检测,不知道有哪些药物可以使用?下面小编就整理了肺癌有哪些靶点,对应哪些靶向药物,这些药物在中国是否上市,供大家学习和参考。
肺癌常见靶向药汇总一、EGFR (HER1/ERBB1)1、易瑞沙:Gefitinib(吉非替尼)--已上市2、特罗凯:Erlotinib(厄洛替尼)--已上市3、凯美纳:国产药(盐酸埃克替尼)--已上市3、泰瑞沙:Osimertinib(奥希替尼AZD9291)--已上市4、BIBW2992:Afatinib (阿法替尼)--已上市5、Necitumumab(耐昔妥珠单抗)--未上市二、ALK1、赛可瑞:Crizotinib(克唑替尼)--已上市1、Ceritinib(赛立替尼)--未上市2、Alectinib(艾乐替尼)--未上市3、Brigatinib (布加替尼) --未上市三、HER21、BIBW2992:Afatinib (阿法替尼)--已上市2、赫赛汀:Trastuzumab(曲妥珠单抗)--已上市四、MET1、赛可瑞:Crizotinib(克唑替尼)--已上市五、ROS11、赛可瑞:Crizotinib(克唑替尼)--已上市六、BRAF1、Dabrafenib (达拉非尼) --未上市七、MEK1、Trametinib (曲美替尼) --未上市八、VEGFR21、Ramucirumab(雷莫芦单抗)--未上市九、VEGF1、安维汀:Bevacizumab(贝伐珠单抗)--已上市小编温馨提示对于有经济压力的家庭,可以选择已上市并且有药物的靶点进行检测。
近年药物研发最热门靶点汇总分析

1.癌症2000年后肿瘤信号网络被逐渐阐释、完善,大量的分子靶向药物进入临床研究、走上市场,近年针对受体酪氨酸激酶靶点如Bcr-Abl(见1.1)、VEGF/VEGFRs(见1.2)、PDGF/PDGFRs(见1.3)、EGFR/HER2(见1.5)、ALk(见1.7)已有多个药物上市,me-too品种的研发逐渐放缓,但扩展适应症、克服耐药性、优化治疗方案的研究还没有结束。
目前肿瘤信号网络中,FGFR(见1.4)、c-Met(见1.6)、HER3(见1.5)、Hedgehog(见1.13)等靶点吸引了不少的研究,但最热的当是PI3K/Akt/mTOR (见1.15)、Raf/MEK/ERK(见1.16)两条细胞内信号通路。
2013年FDA批准了BTK抑制剂ibrutinib,对CLL的疗效很好,吸引了一些药企开发me-too/me-better药物。
涉及细胞周期调控的靶点如Aurora激酶(见1.8)、CDK(见1.9)、ChK(见1.10)也有不少新药在研,最耀眼的无疑是CDK4/6抑制剂,已经有三个分子推进到后期开发,而Aurora激酶和ChK抑制剂则大多在早期临床失败。
针对DNA 损伤修复的PARP(见1.11)的药物研发也回暖,而针对蛋白-蛋白相互左右的新靶点如Bcl-2(见1.12)、MDM2(见1.14)、IAP也有多个分子进入临床研究。
特别值得一提的是表观遗传调控剂,早年发现的阿扎胞苷、地西他滨等被证明为DNA甲基转移酶抑制剂,目前研究得最多的是HDAC抑制剂(见1.17),表观遗传的其他靶点如组蛋白赖氨酸甲基转移酶EZH2、组蛋白H3甲基转移酶DOT1L、溴结构域蛋白BET等也开展了大量基础研究。
近来抗癌领域最耀眼的无疑是免疫疗法,调节CTLA4、PD1/PDL1、4-1BB、OX40、CD27等免疫检查点(见1.18)可以激活T细胞免疫应答,而基因工程修饰的CAR、TCR T细胞的应用更是标志着个性化免疫治疗时代的到来。
一文学会:肺癌八大热门靶点和药物(内附表格)

一文学会:肺癌八大热门靶点和药物(内附表格)非小细胞肺癌约占所有肺癌的80%,可以说是肺癌中最常见、最重要的一种。
其治疗方法主要包括手术、放疗、化疗、免疫和靶向。
然而,由于大部分患者发现时已处于中晚期,难治愈,生存率低。
此时若是找到突变基因且给予靶向药物,生存率可以大大提高。
肺癌患者的基因突变有很多种,大部分的基因突变(约40%)仍处于未知。
最常发生的KRAS突变虽最多,占腺癌中的25-30%,但直到今年5月才出现第一个针对其的靶向药sotorasib。
其他被我们熟知且较重要的靶点包括EGFR、ALK、ROS1。
此外,还有BRAF V600E 突变、NTRK 1/2/3基因融合、MET 14外显子跳跃突变、RET重排等。
数据来源:NCCN NSCLCEGFR抑制剂1代:厄洛替尼*、吉非替尼*2代:阿法替尼*、达可替尼*3代:奥希替尼*(* 在中国上市)EGFR基因突变是非小细胞肺癌中最常见的靶点,占腺癌中的15-20%。
而在亚洲人种中比例更高,部分亚洲地区最高可达62%。
此外,EGFR突变常发生于非吸烟者/既往轻度吸烟者。
EGFR基因最常见的突变包括:19外显子缺失和21外显子 L858R 突变,其治疗如下:一线推荐:奥希替尼为首选,因为它不会诱导生成T790M耐药性,抑制肿瘤细胞生长的时间最长。
厄洛替尼也可以与VEGF抗体合用:厄洛替尼+雷莫芦单抗(NCCN推荐级别2A);厄洛替尼+贝伐珠单抗,仅用于非鳞状细胞癌(NCCN推荐级别2B)。
1、2代EGFR抑制剂耐药:使用1、2代EGFR抑制剂的患者中,60%会产生抗药性,机制包括2种:T790M突变、非小细胞肺癌组织学改变成为小细胞肺癌。
因此,当患者使用1、2代EGFR抑制剂后肿瘤进展时,应行基因检测检查T790M是否突变。
若T790M突变阳性,换3代EGFR抑制剂奥希替尼;若基因检测时发现其他突变基因靶点,则使用对应靶向抑制剂;若无任何突变基因靶点,换成以铂类为基础的化疗方案,治疗方案与无EGFR突变的非小细胞肺癌的化疗方案相同;目前无证据证明免疫治疗对携带EGFR突变的患者有效。
攻克肿瘤科常用单抗药,这几个靶点必须知道!

攻克肿瘤科常用单抗药,这几个靶点必须知道!恶性肿瘤严重威胁人类生命健康。
传统的化疗药物在杀伤肿瘤细胞的同时,也对正常细胞产生毒性。
基于抗体的靶向抗肿瘤药在肿瘤治疗中能够选择性地杀伤肿瘤细胞,具有高效、低毒、特异性强等特点。
本文对记忆抗体的抗肿瘤药物进行梳理。
临床常用的抗体靶向药大致可分三大类:1.作用肿瘤细胞表面的单克隆抗体;2.抗体偶联药物;3.辅助治疗药物,如抗骨转移药物。
1、作用肿瘤细胞表面的单克隆抗体这类药物的作用靶点主要为程序性死亡蛋白1/程序性死亡蛋白配体1(PD-1/PD-L1)、细胞分化抗原(CD)、血管内皮生长因子(VEGF)、人表皮生长因子受体(HER)等(表1)。
作用机制包括抗体的直接作用(通过受体阻断或激动、诱导细胞凋亡、药物或细胞毒性药物递送);免疫介导的细胞杀伤机制(包括补体依赖性细胞毒性(CDC)、抗体依赖性细胞毒性(ADCC)和T细胞功能调节),以及抗体作用于肿瘤血管和间质(图1)。
图1. 抗体杀死肿瘤细胞的作用机制。
a |抗体可与肿瘤细胞表面受体结合并激活(或抑制)它,介导细胞凋亡。
偶联的抗体可用于传递有效载荷(如药物、毒素、小干扰RNA或放射性同位素)到肿瘤细胞。
b |免疫介导的肿瘤细胞杀伤可通过诱导吞噬作用、补体激活、抗体依赖性细胞毒性(ADCC);基因修饰的T细胞通过单链可变片段(scFv)靶向肿瘤;抗体介导的抗原交叉呈递(树突状细胞)及T细胞活化;和抑制T细胞抑制性受体,如细胞毒性T淋巴细胞相关抗原-4(CTLA-4)。
c | 血管和间质细胞的受体拮抗或配体捕获;抑制间质细胞;向血管或间质细胞递送毒素。
MAC,膜攻击复合物;MHC,主要组织相容性复合体;NK, 自然杀伤细胞。
表1 常见的单克隆抗体药物及作用靶点(举例)2、抗体偶联药物抗体偶联药物(antibody-drugconjugate,ADC)由抗体、连接子和细胞毒性药物三部分组成,其一端是一种特异性识别癌细胞的抗体,另一端连接细胞毒性化疗药物,依靠抗体可把药物精准递送至癌细胞内(图2)。
肿瘤靶向药物靶点汇总

√
妇科癌症靶向药
中国
疾病
靶点
靶向药
是否
上市
卵巢癌
PARP
Olaparib(奥拉 帕尼)
×
卵巢癌
宫颈癌
VEGF
输卵管癌
软组织肉瘤靶向
药
疾病
靶点
VEGFR 软组织肉瘤 PDGFR
KIT 其他癌症靶向药
疾病
靶点
前列腺癌
骨巨细胞瘤 RANKL
基底细胞癌
PTCH Smoothened
头颈癌 高危神经母细 胞瘤 腹膜癌 胶质母细胞瘤
×
VEGFR2
Lenvatinib(乐 伐替尼)
×
KIT,VEGFR, PDGFR,RAF
Sorafenib (索拉非尼)
√
黑色素瘤靶向药
中国
疾病
靶点
靶向药
是否
上市
PD-1
Nivolumab(纳 武单抗)
×
Pembrolizumab (派姆单抗)
×
CTLA-4
Ipilimumab(易 普利姆玛)
×
Vemurafenib ×
√
Everolimus(依 维莫司)
√
靶向药
中国
疾病
结直肠癌
白血病靶向药 疾病
靶点
EGFR (HER1/ERBB1)
KIT, PDGFRβ, RAF, RET, VEGFR1/2/3
靶向药
Cetuximab(西 妥昔单抗) Panitumumab (帕尼单抗)
Regorafenib (瑞格非尼)
是否 上市 √
Sunitinib(舒 尼替尼)
√
VEGF
Bevacizumab (贝伐珠单抗)
肿瘤新十大基本特征分子靶点

肿瘤新十大基本特征分子靶点肿瘤新十大基本特征分子靶点肿瘤是一种严重的疾病,对患者的身体和心理都会造成巨大的影响。
为了更好地治疗肿瘤,科学家们一直在不断地探索肿瘤的发生机制和治疗方法。
在这个过程中,发现了许多肿瘤的基本特征分子靶点,这些靶点对于肿瘤的发生和发展起着至关重要的作用。
本文将为您介绍肿瘤新十大基本特征分子靶点,希望对您有所启发。
肿瘤新十大基本特征分子靶点:1. PI3K/AKT/mTOR信号通路:这是一个常见的肿瘤发生和发展的信号通路,其在调控细胞凋亡、增殖和生存中起着重要作用。
2. 肿瘤抑制基因:这一类基因通常能够抑制肿瘤的生长和扩散,对于肿瘤的治疗具有重要意义。
3. 转录因子:转录因子在肿瘤的发生和发展中扮演着关键角色,对于调控基因的表达和细胞功能至关重要。
4. 炎症调控因子:肿瘤常常伴随着炎症的发生,炎症调控因子对于肿瘤的发展起着重要作用。
5. 细胞周期调控:细胞周期调控是肿瘤细胞增殖的重要调节因子,对于肿瘤的治疗具有重要意义。
6. 紧张氧化应激:紧张氧化应激在肿瘤的发生和发展中扮演着关键角色,对于肿瘤的治疗具有重要意义。
7. 分化相关因子:分化是肿瘤细胞生长和扩散的重要调节因子,对于肿瘤的治疗具有重要意义。
8. 表观遗传调控:表观遗传调控在肿瘤的发生和发展中扮演着关键角色,对于肿瘤的治疗具有重要意义。
9. 血管生成因子:肿瘤的生长和扩散需要大量的营养和氧气供应,而血管生成因子则对此起着重要作用。
10. 免疫调控因子:免疫调控在肿瘤的发生和发展中扮演着关键角色,对于肿瘤的治疗具有重要意义。
这些肿瘤新十大基本特征分子靶点涵盖了肿瘤的发生和发展的多个方面,在科学家们的努力下,对于肿瘤的治疗提供了重要的思路和方法。
希望通过不断地研究和探索,我们能够找到更多的肿瘤治疗靶点,为肿瘤患者带来更多的希望。
总结回顾:本文介绍了肿瘤新十大基本特征分子靶点,从不同的角度全面探讨了肿瘤的发生和发展的重要因素。
基因靶点总结分析

基因靶点总结分析1. 引言基因靶点是指参与生物体内信息传递和调控的基因序列,是研究生物学、药物发现和疾病治疗的重要领域。
本文将对基因靶点进行总结分析,包括定义、分类、研究方法和应用等方面。
2. 定义基因靶点是指在细胞或组织中被特定药物或分子所作用的特定基因或基因产物。
它是指导药物发现、药物研究和疾病治疗的重要对象。
基因靶点可以是蛋白质、RNA或DNA等。
3. 分类基因靶点可以按照不同的分类标准进行分类。
常见的分类包括:3.1 功能分类基因靶点可以按照其功能进行分类,如酶类靶点、受体靶点、转运蛋白靶点等。
酶类靶点参与代谢过程,是药物作用的重要靶点。
受体靶点参与细胞信号传导和调节,是药物作用的重要靶点。
转运蛋白靶点参与物质转运过程,是药物作用的重要靶点。
3.2 基因组学分类基因靶点可以按照其在基因组中的位置进行分类,如编码区靶点、非编码区靶点、外显子靶点等。
编码区靶点是指在基因的编码区域,参与蛋白质的合成。
非编码区靶点是指在基因的非编码区域,参与调控基因的表达。
外显子靶点是指在基因的外显子区域,参与蛋白质的合成。
3.3 疾病相关性分类基因靶点可以按照其与疾病的相关性进行分类,如致病基因靶点、易感基因靶点、药物靶点等。
致病基因靶点是指与特定疾病发生发展密切相关的基因靶点。
易感基因靶点是指与特定疾病易感性相关的基因靶点。
药物靶点是指药物作用的特定基因靶点。
4. 研究方法研究基因靶点的方法主要包括以下几个方面:4.1 基因敲除技术基因敲除技术是通过转染、转导或转基因等方法将目标基因的功能失活,从而研究该基因在生物体内的功能和作用机制。
常用的基因敲除技术包括CRISPR-Cas9技术、RNA干扰技术等。
4.2 基因过表达技术基因过表达技术是通过转染、转导或转基因等方法将目标基因在生物体内过度表达,从而研究该基因的功能和作用机制。
常用的基因过表达技术包括转基因动物模型、腺病毒表达系统、质粒转染等。
4.3 基因突变分析技术基因突变分析技术是通过分析基因序列中的突变信息,研究基因靶点的变异类型和频率。
十三大类抗肿瘤药物靶点汇总@MedSci

十三大类抗肿瘤药物靶点汇总@MedSci恶性肿瘤是危害人们生命健康的重大疾病,抗肿瘤药物的研发任重而道远。
近年来,随着肿瘤生物学及相关学科的飞速发展,人们逐渐认识到细胞癌变的本质是细胞信号转导通路的失调导致的细胞无限增殖,随之而来的是抗肿瘤药物研发理念的重大转变。
研发的焦点正在从传统细胞毒药物转移到针对肿瘤细胞内异常信号系统靶点的特异性新一代抗肿瘤药物。
不同于传统细胞毒药物选择性差、毒副作用强、易产生耐药性等特点,靶点特异性抗肿瘤药针对于正常细胞和肿瘤细胞之间的差异,达到了高选择性、低毒性的治疗效果。
包括靶向酪氨酸激酶,血管新生,肿瘤细胞周期相关因子,组蛋白去乙酰酶抑制剂,微环境,肿瘤干细胞,肿瘤代谢异常等。
一、靶向蛋白酪氨酸激酶(tyrosine kinase)蛋白酪氨酸激酶是一类具有酪氨酸激酶活性的蛋白质,主要分布在细胞膜上,可分为受体型和非受体型,其功能都是催化ATP的磷酸基转移到下游蛋白的酪氨酸(Tyr)残基上,使其发生磷酸化。
蛋白酪氨酸激酶是一个庞大的体系,目前已经发现了100多种酪氨酸激酶,分属20多个受体酪氨酸激酶家族和10个非受体酪氨酸激酶家族。
蛋白酪氨酸激酶在细胞信号转导通路中占据了十分重要的地位,调节着细胞的生长、分化、死亡等一系列生理生化过程。
酪氨酸激酶的功能和肿瘤的发生、发展密切相关,超过50%的原癌基因和癌基因产物都是酪氨酸激酶,它们的异常表达通常导致细胞增殖调节发生紊乱,致使肿瘤发生。
此外,酪氨酸的异常表达还与肿瘤的侵袭、转移、肿瘤新生血管生成以及肿瘤的化疗抗药性密切相关。
基于近年来在基因组学、分子和细胞生物学以及生物信息学等学科取得的重大进展,越来越多的酪氨酸激酶被认为是很有希望的抗肿瘤分子靶点。
目前有超过20个分属不同家族的受体和非受体酪氨酸激酶被作为靶标进行抗肿瘤药物筛选,包括表皮生长因子受体(EGFR)、血管内皮细胞生长因子受体(VEGFR)、血小板衍生生长因子受体(PDGFR)、成纤维细胞生长因子受体(FGFR)、胰岛素受体(InsR)、Src、Abl等。
盘点!2021年发现的19个重大新药靶点

盘点!2021年发现的19个重大新药靶点发现更好的靶点是药物开发的关键。
自20世纪90年代以来,制药行业通过基于目标的药物发现(target-based drug discovery)模式开发了很多药物,改变了癌症和其他疾病的治疗。
因此,世界各地的科学家和药物开发人员都在这方面一直努力。
下一个PD-1级别的靶标是什么?哪些是真正能取代Aβ的有效AD靶标?能不能找到有望解决全球肥胖问题的新药靶标?科学家总是在寻找这些问题的答案。
这些答案也是实现下一个医学突破的关键。
2021,科学家在发现新靶点方面取得了许多重要成果,涉及的疾病包括阿尔茨海默病、NASH、糖尿病、老龄化、心血管疾病、动脉粥样硬化、肌萎缩侧索硬化、慢性阻塞性肺疾病、细菌感染、疼痛等。
在抗癌方面,出现了多个里程碑靶标,如ID3、SOX4、CLIP1-LTK、DDR1、GABA A受体、COP1、METTL3、CD161、NSD3、中性粒细胞弹性蛋白酶等。
CAR-T先锋Carl June教授的团队发现了两个重要的CAR-T治疗实体瘤的新靶点——ID3和SOX4。
肥胖也有了新的目标,如IL-27和GPR75。
其中,GPR75在论文发表后不到一个月就被阿斯利康公司看中,并与Regeneron达成了合作。
下面是2021年度的19个里程碑式的新目标,希望能为创新型药品提供参考。
ID3,SOX4领域:癌症,CAR-T12月2日发表在《细胞》上的一项研究中来自宾夕法尼亚大学Pelelman医学院Carl June教授和他的同事发现调节因子ID3和SOX4在T细胞衰竭过程中起着关键作用,沉默这两种因子可以大大增强CAR-T的肿瘤杀伤效果,为实体肿瘤的CAR-T治疗带来了新的希望。
B4GALT1领域:心血管疾病血液中低密度脂蛋白胆固醇(LDL-C)和纤维蛋白原水平升高是心血管疾病的独立危险因素。
12月2日发表在《科学》杂志上的一项研究中,来自马里兰大学和ReGeon遗传学中心的科学家发现,B4GALT1基因的变体不仅与低密度脂蛋白胆固醇水平降低有关,而且与纤维蛋白原水平的降低有关。
药物作用靶点

药物作用靶点逐个数时间:2021-01-07 14:42:00 来源:食品商务网大多数药物通过与器官、组织、细胞上的靶点作用,影响和改变人体的功能,产生药理效应。
由于药物结构类型的千差万别,因而呈现诸多作用靶点。
有些药物只能作用在单一靶点上,有些药物可以作用在多个靶点上。
目前已经发现的药物作用靶点约有500个。
研究说明,蛋白质、核酸、酶、受体等生物大分子不仅是生命的根底物质,有些也是药物的作用靶点。
现有药物中,以受体为作用靶点的药物超过50%,是最主要和最重要的作用靶点;以酶为作用靶点的药物占20%之多,特别是酶抑制剂,在临床用药中具有特殊地位;以离子通道为作用靶点的药物约占6%;以核酸为作用靶点的药物仅占3%;其余近20%药物的作用靶点尚待研究发现。
“斩草除根〞型:以核酸为作用靶点的药物核酸包括DNA和RNA,是指导蛋白质合成和控制细胞分裂的生命物质。
干扰或阻断细菌、病毒和肿瘤细胞增殖的根底物质核酸的合成,就能有效地杀灭或抑制细菌、病菌和肿瘤细胞。
以核酸为作用靶点的药物主要包括一些抗生素、抗病毒药、喹诺酮类抗菌药、抗肿瘤药等。
作用于RNA靶点的药物:包括利福霉素类抗生素,作用机制是影响RNA的合成;抗肿瘤药阿糖胞苷、氟尿嘧啶、放线菌素D、柔红霉素、多柔比星、普卡霉素等,作用机制是抑制RNA的合成。
作用于DNA靶点的药物:包括喹诺酮类抗菌药,作用机制是阻断DNA的合成;抗病毒药阿昔洛韦、碘苷、阿糖腺苷、齐多夫定等,作用机制是干扰DNA的合成;抗肿瘤药氮芥、环磷酰胺、塞替派、甲氨蝶呤、羟基脲、丝裂霉素、博来霉素、白消安、顺铂、喜树碱等,作用机制是破坏DNA的结构和功能。
“通道疏导〞型:以离子通道为作用靶点的药物离子通道是细胞膜上的蛋白质小孔,属于跨膜的生物大分子,具有离子泵的作用,可选择性地允许某种离子出入。
离子经过通道内流或外流跨膜转运,产生和传输信息,成为生命活动的重要过程,以此调节多种生理功能。
抗体药物靶点抗体药物研发关键——普健生物现有抗药靶点蛋白目录汇总

抗体药物靶点抗体药物研发关键——普健生物现有抗药靶点蛋白目录汇总抗体药物是以细胞工程技术和基因工程技术为主体的抗体工程技术制备的药物,亦称单克隆抗体治疗剂。
因其具有靶向性强、特异性高及毒副作用低等优势,已成为生物制品行业中占比最大的一类。
目前,抗体药物市场主要集中在肿瘤和自身免疫两大领域,随着人们对疾病了解的不断加深、新靶点的发现、抗体技术的不断进化,抗体药在心血管、神经系统疾病、痛风和感染等非传统的抗体药适应症领域也逐渐发展,并已取得了很多具有应用前景的研究成果。
人类大概有2.5-3万个基因,编码5000-7000个蛋白都可能成为药物靶点。
现已上市销售的所有药物仅有几百个靶点,而其中已获批的抗体药物靶点还不到十分之一,因此还有很大发展空间。
针对特定的分子靶点(抗原)可以制备相应的靶向抗体药物,因此作用靶点的选择是研制抗体靶向药物的关键。
普健生物(武汉)科技有限公司可以提供人的多种分子靶点,这些抗原大多数采用哺乳细胞表达系统重组表达,在蛋白结构修饰上更接近天然蛋白,具有生物活性的概率更高,为抗体药物研究提供更好的选择。
普健现有抗体药物靶点蛋白概览(蛋白目录及产品展示在文末)肿瘤坏死因子(TNF-α),是由巨噬细胞/单核细胞活化产生的一种细胞因子,在炎症反应、细胞免疫、肿瘤免疫等多种生理和病理过程中发挥关键作用。
神经损伤后,TNF基因编码多功能的促炎细胞因子,导致神经痛敏反应。
TNF-α是细胞信号通路中重要的一环,因此成为多个药物的靶向目标,是临床获批和临床研究最多的抗体药物靶点之一。
随着神经病理性疼痛机制研究的日趋深入,TNF-α靶点有望在创新药方面再创佳绩,全人源单抗、抗体小型化以及长效是TNF-α单抗的主要发展方向。
TNFRSF9(CD137,4-1BB)作为肿瘤坏死因子受体超家族成员之一,它介导的协同刺激信号能促进T细胞、B细胞、NK细胞、单核细胞等多种免疫细胞的活化、增殖、分化、凋亡及信号传导等过程,在免疫反应中发挥重要作用。
药物研发中的靶点选择和优化策略

药物研发中的靶点选择和优化策略药物研发一直是医疗领域中极为关键的一环,因为药物的研发能够帮助科学家们发现更好的治疗方案,减轻病人的痛苦。
现如今,药物研发涵盖了许多不同的领域,其中最关键的一个环节是靶点选择和优化策略。
在这篇文章中,我们将探讨药物研发中靶点选择和优化策略的一些基本原则和技巧。
一、什么是靶点选择?在药物研发中,靶点是一种可治疗疾病的分子或机制。
药物作用的靶点通常是蛋白质或其他生物分子,包括受体、酶和离子通道等。
药物和靶点之间的作用可以触发生物学反应并实现治疗目标。
因此,在药物研发中,选择一个正确的靶点至关重要的。
正确的靶点能够有效地帮助药物实现治疗目标,并提高药物的疗效。
二、如何选择靶点?靶点选择通常涉及几个方面的考虑。
首先,选择一个重要的靶点。
这通常意味着选择一个有助于治疗严重疾病的靶点。
其次,选择一个合适的靶点。
靶点必须能够以某种方式影响或触发疾病过程中的专利物质。
此外,靶点也需要具有一定的可及性,这可以通过在不同组织和细胞类型中观察靶点的表达来确定。
靶点还需要在药物的进一步研究和试验中表现出一定的适配性。
这意味着靶点和药物之间的相互作用必须足够强大,才能产生期望的治疗效果。
三、什么是靶点优化策略?一旦靶点被确定,药物研发人员还需要考虑实现有效的靶点选择和优化策略。
这通常涉及到选择合适的化合物来选择和优化靶点,以达到最佳治疗结果。
靶点优化策略不仅需要纳入不同药物的质量和表达方式,还要考虑毒性、溶解度、药物代谢和组织(每个药物对机体的影响以及它们在机体内的运动和转化等方面的变化)。
此外,靶点优化策略还涉及选择合适的药物剂量和疗程,以确保药物的效果最大化并减少任何不良反应。
四、如何开发更有效的靶点选择和优化策略?开发更有效的靶点选择和优化策略需要研究人员综合考虑多种因素。
在此过程中,研究人员可以考虑以下几个方面。
首先,研究人员可以使用计算方法来预测和评估靶点和药物之间的相互作用。
这可以使研究人员更好地理解药物和靶点之间的相互作用,以及他们如何影响疾病过程。
新型药物靶点的结构解析与优化

新型药物靶点的结构解析与优化在药物研发和治疗领域,寻找新的药物靶点以及对其进行结构解析与优化是至关重要的。
新型药物靶点的发现可以帮助我们理解疾病的发生机制,并为药物设计提供新的思路和方向。
在本文中,将探讨新型药物靶点的结构解析方法以及其优化的策略,以期为合理药物设计和治疗方案的研发提供参考。
一、新型药物靶点的结构解析方法1. X射线晶体学X射线晶体学是一种常用的药物分子与靶点之间相互作用的结构解析方法。
通过对药物分子和靶点的共结晶,利用X射线的散射原理和晶体学的方法,可以得到药物与靶点的高分辨率结构图像。
这种方法可以揭示化学键的形成、解构和靶点结合部位等信息,为我们分析药物与靶点之间的相互作用提供了重要的依据。
2. 核磁共振谱学(NMR)核磁共振谱学是另一种常用的药物结构解析方法。
通过对药物分子和靶点进行核磁共振实验,可以得到一系列关于分子结构和化学环境的信息。
利用核磁共振谱学,可以解析药物分子的立体构型、亚结构、化学平衡以及与靶点之间的相互作用等信息。
相对于X射线晶体学,核磁共振谱学可以在溶液中直接观察到分子的结构和动力学信息,具有更高的灵敏度和适用性。
3. 电子显微镜(EM)电子显微镜是一种用电子束代替光束来形成样品显微图像的显微镜技术。
在药物研发中,电子显微镜可以提供关于药物分子和靶点的高分辨率结构信息。
通过电子显微镜的技术,可以直接观察到药物分子与靶点之间的相互作用、结合部位以及药物在细胞内的定位情况等。
电子显微镜的高分辨率结构图像可以为药物研发和设计提供直观的结构依据。
二、新型药物靶点的结构优化策略1. 分子对接模拟分子对接模拟是一种通过计算机模拟药物分子与靶点之间的相互作用的方法。
通过构建靶点的三维结构和药物分子的结构,利用分子动力学模拟和能量优化算法,可以预测药物与靶点之间的相互作用能力和结合模式。
基于对接模拟的结果,可以对药物分子进行结构优化,以提高其与靶点的结合亲和力和选择性,从而提高药物的疗效和减少不良反应。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
1.癌症2000年后肿瘤信号网络被逐渐阐释、完善,大量的分子靶向药物进入临床研究、走上市场,近年针对受体酪氨酸激酶靶点如Bcr-Abl(见1.1)、VEGF/VEGFRs(见1.2)、PDGF/PDGFRs(见1.3)、EGFR/HER2(见1.5)、ALk(见1.7)已有多个药物上市,me-too品种的研发逐渐放缓,但扩展适应症、克服耐药性、优化治疗方案的研究还没有结束。
目前肿瘤信号网络中,FGFR(见1.4)、c-Met(见1.6)、HER3(见1.5)、Hedgehog(见1.13)等靶点吸引了不少的研究,但最热的当是PI3K/Akt/mTOR (见1.15)、Raf/MEK/ERK(见1.16)两条细胞内信号通路。
2013年FDA批准了BTK抑制剂ibrutinib,对CLL的疗效很好,吸引了一些药企开发me-too/me-better药物。
涉及细胞周期调控的靶点如Aurora激酶(见1.8)、CDK(见1.9)、ChK(见1.10)也有不少新药在研,最耀眼的无疑是CDK4/6抑制剂,已经有三个分子推进到后期开发,而Aurora激酶和ChK抑制剂则大多在早期临床失败。
针对DNA 损伤修复的PARP(见1.11)的药物研发也回暖,而针对蛋白-蛋白相互左右的新靶点如Bcl-2(见1.12)、MDM2(见1.14)、IAP也有多个分子进入临床研究。
特别值得一提的是表观遗传调控剂,早年发现的阿扎胞苷、地西他滨等被证明为DNA甲基转移酶抑制剂,目前研究得最多的是HDAC抑制剂(见1.17),表观遗传的其他靶点如组蛋白赖氨酸甲基转移酶EZH2、组蛋白H3甲基转移酶DOT1L、溴结构域蛋白BET等也开展了大量基础研究。
近来抗癌领域最耀眼的无疑是免疫疗法,调节CTLA4、PD1/PDL1、4-1BB、OX40、CD27等免疫检查点(见1.18)可以激活T细胞免疫应答,而基因工程修饰的CAR、TCR T细胞的应用更是标志着个性化免疫治疗时代的到来。
1.1.Bcr-Abl抑制剂Bcr-Abl抑制剂主要用于治疗慢性粒细胞白血病(CML),目前FDA已经批准伊马替尼、尼罗替尼、达沙替尼、ponatinib等多个药物,其中第三代Bcr-Abl 抑制剂ponatinib可克服T315I耐药突变。
我国自主研发的氟马替尼、美迪替尼已经进入临床研究,广药集团的ponatinib类似物HQP1351即将申报临床。
由于已经有多个药物上市,药企基本没有再研发新的Bcr-Abl抑制剂。
1.2.VEGF/VEGFRs抑制剂VEGF/VEGFRs是经典的血管生成信号通路,可用于治疗多种实体瘤和湿性年龄相关性黄斑变性(AMD),FDA已经批准的针对VEGF/VEGFRs单抗或融合蛋白有贝伐珠单抗、雷珠单抗、阿柏西普、ramucirumab,我国自主研发的康柏西普(商品名:朗沐)已于2013年上市。
针对VEGFR的小分子往往对其他酪氨酸激酶也有抑制作用,这类药物也已经上市了索拉非尼、舒尼替尼等多个,我国也申报了许多类似物。
值得注意的是,2014年FDA批准ramucirumab用于治疗胃癌,江苏恒瑞自主研发的阿帕替尼也即将上市。
1.3.PDGF/PDGFRs抑制剂PDGFRs与VEGFRs的相似度较高,很多小分子药物是VEGFRs/PDGFRs同时抑制的,比如索拉非尼、舒尼替尼、帕唑帕尼。
2014年1月Bayer支付2550万美元携手Regeneron,共同开发anti-PDGFRβ单抗,联合阿柏西普用于治疗湿性AMD;2014年5月Novartis以10.3亿美元从Ophthotech Corporation买下III期anti-PDGF药物Fovista,用于治疗湿性AMD。
1.4.FGF/FGFRs抑制剂FGFRs与VEGFRs、PDGFRs一样,也涉及肿瘤的增殖和血管的形成,但至今仍然没有FGFRs抑制剂上市。
Boehringer Ingelheim研发了VEGFR/PDGFR/FGFR抑制剂nintedanib,用于治疗非小细胞肺癌、特发性肺纤维化,2014年1月获得FDA突破性药物资格。
我国自主研发了FGFRs/VEGFRs抑制剂德立替尼(lucitanib, E-3810,AL3810),几经辗转美国、日本的权益为Clovis Oncology所有,美、日、中以外的权益被Servier收购,目前该药在国内已经申报临床,并且得到了重大新药创制专项的支持。
1.5.EGFR/HER2/HER3抑制剂EGFR、HER2、HER3都是ErbB家族酪氨酸激酶,已上市的药物包括anti-EGFR 单抗、anti-HER2单抗及ADC、EGFR抑制剂、EGFR/HER2抑制剂,用于治疗非小细胞肺癌、HER2阳性乳腺癌、结直肠癌、头颈癌等实体瘤。
第三代EGFR抑制剂可克服T790M耐药突变,AZD9291、CO-1686引起全球的关注,目前都已经获得FDA突破性药物资格。
我国自主研发的艾维替尼、迈华替尼也能克服T790M突变,目前已经申报临床。
1.6.HGF/c-Met抑制剂c-Met别名HGFR,与其他生长因子受体一样,也是抗癌药研发的热门靶点,已经上市的c-Met抑制剂有克唑替尼、卡博替尼,但这两个分子抑制c-Met的同时还抑制了其他靶点。
onartuzumab、tivantinib治疗非小细胞肺癌的III期临床失败对选择性c-Met抑制剂的研发是个重大打击,可能需要寻找更好的患者筛选方法或适应症。
AstraZeneca从国内和记黄埔医药买下沃利替尼,ASCO2014报道的数据显示,6例乳头状肾细胞癌患者服用该药后,3例实现部分应答,目前AstraZeneca 重点开发该适应症。
国内已经有多个c-Met抑制剂申报临床,包括和记黄埔的沃利替尼、贝达药业的BPI-9016M、北京浦润奥的伯瑞替尼。
1.7.ALK抑制剂ALK通过基因融合而激活致癌,70-80%间变性大细胞淋巴瘤存在NPM-ALK 融合,6.7%的非小细胞肺癌存在EML4-ALK融合。
FDA批准的第一个ALK 抑制剂是克唑替尼,用于治疗ALK阳性非小细胞肺癌,但克唑替尼对c-Met、RON也有抑制作用。
第二代ALK抑制剂不再抑制c-Met,能够克服克唑替尼耐药性,ceritinib、alectinib都获得了FDA突破性药物资格。
国内自主研发的ALK抑制剂有江苏豪森的氟卓替尼、北京赛林泰的CT-707。
1.8.Aurora激酶抑制剂Aurora激酶是调控细胞有丝分裂的一类丝氨酸/苏氨酸激酶,哺乳动物有Aurora A、Aurora B、Aurora C三种亚型,各药企研发了pan-Aurora抑制剂,也研发了选择性的Aurora A抑制剂和Aurora B抑制剂,但基本都在早期临床宣布失败。
1.9.CDK抑制剂CDK全称细胞周期蛋白依赖性激酶,有CDK1-11等多个亚型,能够与细胞周期蛋白结合,调节细胞周期。
Palbociclib、LEE011、LY2835219等三个CDK4/6抑制剂都已进入后期开发,用于治疗乳腺癌,江苏恒瑞自主研发的SHR6390也已申报临床。
1.10.ChK抑制剂ChK是checkpoint kinase的缩写,有ChK1和ChK2两种亚型,是细胞周期的关键调控子。
多家药企开发ChK1抑制剂用于治疗肿瘤,但大多在早期临床研究失败,目前Genentech的GDC-0575正在进行I期临床研究。
1.11.PARP抑制剂PARP全称poly(ADP-ribose) polymerase,它能够识别DNA单链断点启动修复,最初开发PARP抑制剂用于增强化疗药物的疗效,后来主要针对DNA修复缺陷型癌症。
2011-2012年olaparib和iniparib的临床研究受挫,PARP抑制剂的研发走冷,但随着olaparib、veliparib进入III期临床,iniparib被证明不是真正的PARP抑制剂,这类药物的研发复苏。
2013年11月德国1.7亿欧元收购百济神州开发的PARP抑制剂BeiGene-290,目前该药已经进入I期临床。
1.12.Bcl-2抑制剂Bcl-2蛋白家族是一类重要的凋亡调节因子,包括抗凋亡蛋白(如Bcl-2、Bcl-xL、Mcl-1)和促凋亡蛋白(如BID、BIM、BAD、BAK、BAX、NOXA)。
Bcl-2和Bcl-xL在许多肿瘤中过度表达,诱导癌细胞对癌症的治疗产生耐性。
Teva曾经将Bcl-2抑制剂obatoclax推进III期临床,但最终放弃了obatoclax的开发。
Obatoclax的Ki值只有0.22μM,而ABT-199的Ki值小于0.01nM。
国内江苏亚盛申报了两个Bcl-2抑制剂在研,其中R-(-)-醋酸棉酚处于II期临床,APG-1252处于临床前。
1.13.Hedgehog抑制剂Hedgehog是一条重要的癌症信号通路,由Hedgehog配体、Ptch/Smo受体复合物启动,Ptch/Smo分别由抑制癌基因Patched和癌基因Smothened编码,Ptch对Smo起负调控作用,开发的药物主要是Smo抑制剂。
Genentech上市了vismodegib用于治疗基底细胞癌,Novartis的同类药物sonidegib(erismodegib, LDE225)治疗基底细胞癌的II期试验成功,2014年第二季度已经向欧洲递交上市申请。
1.14.p53/MDM2 抑制剂p53是著名的抑癌基因,p53能够促进MDM2、MDM4的表达,MDM2反过来导致p53泛素化降解,最终p53与MDM2/MDM4处于一个平衡状态。
Roche 在2010年进行了一次RG7112的概念性探索,RG7112能够诱导p53、MDM2的表达上调,并且对癌症患者有一定的临床获益。
1.15.PI3K/Akt/mTOR抑制剂PI3K中文名为磷脂酰肌醇3-激酶,其主要功能是催化PIP2转化为PIP3,从而激活下游信号Akt/mTOR,而PTEN的功能与PI3K相反,它催化PIP3转化为PIP2。
PI3K有I、II、III三大类8个亚型,肿瘤中最重要的是I类四个亚型,即PI3Kα、PI3Kβ、PI3Kγ、PI3Kδ,都是由催化亚基(p110α、p110β、p110γ、p110δ)与调节亚基(p85)构成的杂聚体。
针对PI3K/AKT/mTOR 信号通路的药物包括Pan-PI3K抑制剂、选择性PI3K 抑制剂、雷帕霉素类似物、mTOR活性位点抑制剂、PI3K/mTOR双靶点抑制剂、Akt抑制剂。
已上市的有雷帕霉素类似物temsirolimus、everolimus和选择性PI3Kδ抑制剂idelalisib。
