兽药GSP检查验收申报材料完整版(2020年整理).pdf
兽药GSP检查验收申报材料完整版
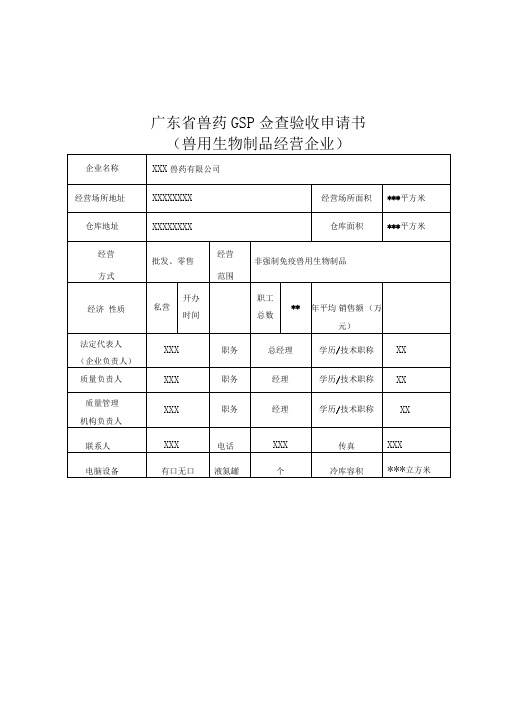
广东省兽药GSP佥查验收申请书(兽用生物制品经营企业)注:1.经营方式系指连锁经营、批发经营、零售经营、批零兼营。
2.经营范围系指兽用化学药品、中药制剂、外用杀虫剂、消毒剂、原料药、生化药品、中药材(中药饮片)、特殊药品(兽用麻醉药品、精神药品、易制毒化学药品、毒性药品、放射性药品),以及兽用生物制品等。
3.经济性质系指国有企业、外资企业、私营企业、个人独资企业。
4.企业所属非法人分支机构的,应另表说明。
企业人员情况一览表填报单位:填报日期:注:1.填报本表时,请将学历证书及专业技术职称证书的复印件附后。
2 .质量负责人、质量管理人员、验收人员、养护人员等应在职务/岗位一栏中注明。
3.质量管理人员参加县级以上兽医行政管理部门的培训、考核情况应在备注栏中注明企业经营设施、设备情况表填报单位:填报日期:说明:1.根据企业设施、设备的实际填写。
如无栏目所设项目,应注明“无”2.表中所有面积均为建筑面积,单位为平方米,冷库单位为立方米。
3•“营业场所及辅助、办公用房”栏目中“辅助用房”指库区中服务性或劳保用房。
企业所属非法人分支机构情况表填报单位:填报日期:兽药GSF现场验收报告兽药GSP认证自查报告、企业概况、管理职责、人员与培训四、设施和设备五、进货与验收六、陈列与储存七、销售与服务八、存在问题及改进措施:XX市XX兽药有限公司组织机构图XX市XX兽药有限公司公司经理:XX------ (博士)---XX市 XX 兽药有限公司质量管理机构图质量负责人:XXX丨XX 市:X 兽药有限公同文件为确保企业所经营生物制品质量,保证消费者使用安全,根据《广东-01质量养护员:XXX(编号售员)2010----- 质量管理员: XXX —文件名称质量管理机构的设置省兽药经营质量管理规范》、《兽药管理条例》要求,决定设立专职质量管理员,具体负责本企业的质量管理工作,在企业内部对生物制品质量进行裁决,对企业经营的生物制品质量具有一票否决权。
兽药GSP检查验收申请表

《兽药GSP检查验收》申请表申请企业名称:(公章)申请日期:年月日受理部门:受理日期:年月日填报说明1、申请书应为原件,用钢笔填写或打印,内容应准确、完整,不得涂改。
2、报送检查验收申请书和其他表格、资料,应按有关栏目填写的企业负责人员和质量管理人员情况,附质量管理人员学历证明、培训证书及专业技术职称证书的复印件。
3、检查验收申请书以外的资料,应使用A4纸打印,标明目录以及页码并装订成册。
企业负责人员和质量管理人员情况表填报单位:(盖章)填报日期:年月日注:1、填报本表时,请将学历证书及专业技术职称证书的复印件附后。
2、表中的企业分管质量负责人、质量管理人员、验收人员、采购人员、保管人员、销售人员、技术服务人员应在职务/岗位栏中注明。
企业经营场所情况表填报单位:(盖章)填报日期:年月日填写说明:1、根据企业设施、设备的实际填写。
如无栏目所设项目,应注明“无此项”。
2、表中所有面积均为建筑面积,单位为平方米。
3、“营业场所及辅助办公用房”栏目中“辅助用房”指库区中服务性或劳保用房。
企业所属非法人分支机构(直营门店)情况表填报单位:(盖章)填报日期:年月日《兽药经营许可证》申请表申请单位(盖章):申请日期:年月日受理日期:年月日中华人民共和国农业部制填表说明1、本表须用黑色钢笔、签字笔填写,也可以自制,用A4纸打印,一式二份。
字迹不清、项目填写不全者不予受理。
2、企业类型:指合资企业、外国独资企业、国内企业等。
3、经济性质:指国有、集体、私营、股份等。
4、经营范围:指兽药类别,如兽用化学药品、中药制剂、外用杀虫剂、消毒剂、兽用生物制品、生化药品、中药材(中药饮片)、特殊药品(兽用麻醉药品、精神药品、易制毒化学药品、毒性药品、放射性药品)等。
5、本表所填写人员应为企业专职工作人员。
6、根据需要,本表格填写项目可另附页。
7、兽用生物制品经营许可证由省级畜牧兽医行政管理部门审批,其它兽药由县级以上畜牧兽医行政管理部门审批。
兽药GSP验收自查汇报材料

兽药GSP验收自查汇报材料尊敬的检查组各位专家、各位领导:下午好,欢迎各位专家和领导光临我企业检查指导工作!下面我就本企业的基本概况GSP实施情况向各位专家和领导做一个简短的汇报:一、企业概况:海峰兽药饲料店属私营性质的兽药饲料零售企业,成立于2010年6月,注册地址为中宁县恩和镇恩和街,法人代表:陈海峰,目前共有企业员工3人,全部达到中等兽医专业以上的学历。
药店营业室面积30㎡,仓库面积40㎡。
药店经营范围包括:兽用化学药品、中药制剂、杀虫剂及饲料添加剂,经营品种30余种,预计年销售额10万余元。
在今年近几个月的兽药GSP准备阶段,最近用于软、硬件及环境改造的费用约13000余元。
我企业成立以来,在兽药经营过程中一直坚持“服务农户,质量第一”的原则,全面贯彻落实《兽药管理条例》、《兽药经营质量管理规范》等法律法规,加强基础管理,不断完善各项质量管理制度,确保各项质量管理制度落到实处,强化本企业人员的兽药质量意识,提高员工的业务素质,不断提升兽药经营质量管理水平,合法从事兽药经营活动。
开业近几个月以来,本企业无兽药质量事故发生,得到了广大养殖户的肯定和好评,本企业将在这次GSP检查验收工作过程中扬长避短,虚心学习,将兽药经营工作争取做得更好,最大限度的满足养殖客户的需求。
二、兽药GSP实施情况:近几个月来,我企业对照这次兽药GSP标准及其实施细则和兽药GSP验收现场检查项目评分标准的各条款,多次检查本企业兽药GSP管理的执行及整改情况,对不符合要求的项目及时改正,下面把最近一次自查整改的情况从7个方面进行简要阐述:1、质量管理组织设立和兽药经营质量管理文件的制定及落实简况。
由于本企业位于乡镇,加上本地区养殖规模不大、用户少、业务少,质量管理有1人担任,负责质量监督、质量管理和质量验收工作。
从今年8月份开始,我兽药店就按照兽药GSP要求制定了一套适合自己实际情况的药品经营质量管理文件,经营过程中,我药店严格按照GSP要求去做。
兽药经营企业GSP验收申报材料

兽药经营企业GSP验收申报材料尊敬的相关部门:我公司是一家兽药经营企业,现拟向贵部门申报兽药经营企业GSP验收。
根据相关要求,我们将提供以下申报材料,供贵部门审查。
1.公司基本信息1.1公司名称:XXX兽药经营企业有限公司1.2公司注册地址:XX省XX市XX区XX街道XX号1.3公司法定代表人姓名:XXX1.4公司成立时间:20XX年XX月XX日1.5公司注册资金:XXX万元1.6公司经营范围:从事兽药的购销、仓储、运输以及相关技术服务等2.经营场所2.1经营场所的证明文件:包括房屋证明文件或租赁合同等2.2经营场所的平面布局图:标明各区域的功能分区和兽药储存区域3.人员配备3.1总经理:XXX,负责兽药经营企业的全面管理3.2负责人员:XXX,具备相关的兽药经营知识和专业素养3.3仓储管理人员:XXX,具备仓储管理经验和相关知识3.4财务人员:XXX,负责企业财务管理和报税工作4.品质管理4.1兽药品质管理制度:包括采购、仓储、销售等各环节的品质管理制度文件4.2品质管理人员:XXX,负责兽药品质管理工作4.3兽药样品检验报告:提供多个兽药样品的检验报告,证明产品符合标准5.兽药经营记录5.1采购记录:提供兽药的采购记录,包括供应商名称、兽药名称、数量、单价等信息5.2销售记录:提供兽药的销售记录,包括客户名称、兽药名称、数量、单价等信息5.3库存记录:提供兽药库存记录,包括进货日期、销售日期、库存数量等信息6.质量控制6.1兽药的质量合格证明:提供兽药的质量合格证明文件,包括生产企业出具的合格证明等6.2兽药的有效期管理:提供兽药的有效期管理及过期兽药处理的制度文件6.3兽药的不良事件报告:提供兽药不良事件的记录和处理情况的文件7.仓储管理7.1兽药储存条件:提供兽药的储存条件,包括温度、湿度等要求的文件7.2兽药库存盘点记录:提供兽药库存盘点记录,包括盘点日期、盘点结果等信息8.运输管理8.1兽药运输管理制度:包括运输要求、运输工具的清洁消毒等制度文件8.2运输记录:提供兽药运输记录,包括运输日期、货物数量、运输工具等信息9.相关证照9.1营业执照副本复印件9.2税务登记证副本复印件9.3组织机构代码证副本复印件9.4产品批准文号复印件:提供所销售的兽药的批准文号的复印件以上为我公司准备的兽药经营企业GSP验收申报材料,共计1200字以上。
兽药GSP检查验收申报材料完整版
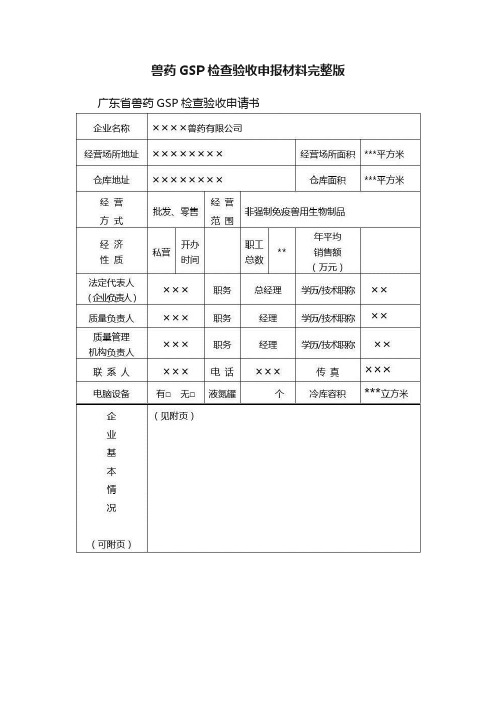
兽药GSP检查验收申报材料完整版广东省兽药GSP检查验收申请书注:1. 经营方式系指连锁经营、批发经营、零售经营、批零兼营。
2. 经营范围系指兽用化学药品、中药制剂、外用杀虫剂、消毒剂、原料药、生化药品、中药材(中药饮片)、特殊药品(兽用麻醉药品、精神药品、易制毒化学药品、毒性药品、放射性药品),以及兽用生物制品等。
3. 经济性质系指国有企业、外资企业、私营企业、个人独资企业。
4. 企业所属非法人分支机构的,应另表说明。
企业人员情况一览表填报单位:填报日期:注:1.填报本表时,请将学历证书及专业技术职称证书的复印件附后。
2.质量负责人、质量管理人员、验收人员、养护人员等应在职务/岗位一栏中注明。
3. 质量管理人员参加县级以上兽医行政管理部门的培训、考核情况应在备注栏中注明。
企业经营设施、设备情况表填报单位:填报日期:说明:1.根据企业设施、设备的实际填写。
如无栏目所设项目,应注明“无”。
2. 表中所有面积均为建筑面积,单位为平方米,冷库单位为立方米。
3.“营业场所及辅助、办公用房”栏目中“辅助用房”指库区中服务性或劳保用房。
企业所属非法人分支机构情况表填报单位:填报日期:兽药GSP现场验收报告兽药GSP认证自查报告一、企业概况二、管理职责三、人员与培训四、设施和设备五、进货与验收六、陈列与储存七、销售与服务八、存在问题及改进措施:××市××兽药有限公司组织机构图××市××兽药有限公司质量管理机构图为确保企业所经营生物制品质量,保证消费者使用安全,根据《广东省兽药经营质量管理规范》、《兽药管理条例》要求,决定设立专职质量管理员,具体负责本企业的质量管理工作,在企业内部对生物制品质量进行裁决,对企业经营的生物制品质量具有一票否决权。
主要职责是:一、贯彻执行有关的生物制品质量管理的法律、法规和行政规章。
二、起草企业生物制品质量管理制度,并指导、督促制度的执行。
兽药经营店GSP申报文件全套资料

《云南省兽药GSP检查验收申请书》申请企业名称:***兽药兽药经营店(公章)申请日期:年月日受理部门:受理日期:年月日填报说明1、申请书应为原件,用钢笔、签字笔填写或打印,内容应准确、完整,不得涂改。
2、报送检查验收申请书和其他表格、资料,应按有关栏目填写的企业负责人员和质量管理人员情况,附质量管理人员学历证明、专业技术职称证书以及质量管理人员上岗证书的复印件。
3、检查验收申请书以外的资料,应使用A4纸打印,标明目录以及页码并装订成册。
4、本表1~8栏由申请企业填写。
5、9~10栏由企业所在地设区市、县级畜牧兽医行政管理部门填写,并签字、盖章。
6、11栏由省级畜牧兽医行政管理部门填写。
1995、9销售额 100企业名称云南省兽药 GSP 检查验收申请书***兽药经营店地 址经 营 方 式*******批零兼营经 营 范 围 邮政编码 671600兽用化学药品、中药制剂、外用杀虫剂、 消毒剂。
经 济 性 质个体工 商户开办 时间职工总数5年平均(万元)法定代表 (企业负责人) *** 学历/技 术职称中专 电 话 ***质量管理 机构负责人联 系 人******学历/技 术职称电 话大学 电 话传 真*******企 业 基 本 情 况 (可附页)***兽药经营店,经营场所占地面积 100 平方米,仓库占地面积为 120 平方米。
兽药经营店人员配置共 4 个, 经营品种为兽药。
兽药饮料添加剂。
***兽药经营店自 1995 年开始经营起。
始终依法经营,依法交纳各种费用。
不断学习养殖业务知识。
不断招收专业人才,不断提升 市场竞争能力。
一直坚持买好产品。
卖好产品给养殖户。
兽药经营店一直直遵循产品失进先出的原则。
每一月清 仓一次对所存货物保持店内严禁销售假冒、劣货、销正 规产家的药品为经营方针。
)审查意见:州 市 县 级 兽 医 行 政 管 理 部 门 初 审 意 见省 州 市 级 兽 医 行 政 管 理 部 门 受年 月 日(公章)年 月 日(公章)理 意 见注:1. 经营方式系指连锁经营、批发经营、零售经营、批零兼营。
制作兽药GSP验收申报文件所需材料说明书

附件1制作兽药GSP验收申报文件所需材料说明书一、兽药供货单位(兽药生产企业)应提供:1、营业执照、兽药生产许可证、兽药GMP证书复印件2、售人员的合法资格(要求:兽药生产企业提供授权委托书和销售人员的身份证复印件)。
3、产品批准文号批件复印件。
4、供货单位两年来被农业部、省、市兽药管理部门通报的情况。
(要求:提供供货单位所在地县级以上畜牧兽医行政管理部门出具的无违法被通报的证明)。
5、兽药质量标准。
(要求:兽药质量标准指生产企业生产兽药产品执行的质量标准,由企业出具其参照执行兽药质量标准类别、编号、页码以及生产该种兽药执行的具体标准名称证明,并将兽药质量标准附于证明之后)。
6、检验报告。
(检验报告指兽药生产企业检验机构或者具有检验资质的监管检验机构出具的近期的检验报告对合法兽药产品按照生产企业执行的产品质量标准进行检验后的合格检验报告。
7、兽药标签、说明书等样稿。
(要求:提供与农业部审批一致的标签、说明书样稿)。
8、兽药的性能、用途、储存条件以及质量信誉等内容。
9、兽药生产企业产品目录。
(要求:由生产企业将出售给兽药经营企业的兽药产品按照农业部批准生产产品的批准文号按顺序登记汇总,编制《兽药生产企业产品目录》,提供纸质及电子文档)。
二、兽药经营企业应提供:1、兽药经营企业法定代表人、企业负责人、质量负责人和质量管理机构的负责人、员工身份证、毕业证、职称资格证、简历、体检健康证明复印件各3份、小2寸彩色照片2张及电子版。
(要求:(1)在市、县级城区内设立的兽药经营企业,其质量负责人和质量管理机构的负责人应当具有兽药、兽医等相关专业大专以上学历,或者具有兽药、兽医等相关专业中级以上专业技术职称。
在乡镇设立的兽药经营企业,其主管质量的负责人应当具有兽药、兽医等相关专业中专以上学历,或者具有兽药、兽医等相关专业初级以上专业技术职称。
(2)兽药质量管理人员不得在本企业以外的其他单位兼职。
(3)体检健康证明。
兽药店GSP验收所需资料准备

XX县兽药房(门店)GSP验收前的准备工作验收前的准备工作包括资料准备和现场准备一、资料准备:有9个方面的内容1、写好申请办理换证的报告。
2、填写《兽药经营许可证申请表》,可到政务中心畜牧兽医局窗口领取或者网上下载或复印取得。
3、药房部署平面图:可在丰都县地图上截取下载或者自绘。
图上要标明四周交通道路或标志性建筑。
4、经营和仓储设施清单。
5、兽药经营管理制度目录6、经营和仓储用房证明。
7、人员资质材料。
8、经营记录表格复印件。
9、索取并建立质量安全档案。
二、现场准备:包括营业间和仓库的准备两个方面(一)营业间准备兽药房必须有固定的经营场所,墙壁应当平整、干燥、洁净,门窗结构严密,照明、防尘避光设施齐备,营业间面积不少于20平方米。
营业间内应张贴下列内容:1、工作人员基本情况一览表。
2、产品质量承诺。
3、服务公约。
4、兽药经营管理制度。
5、《兽药经营许可证》、《兽药管理条例》。
要做到:1、兽药按用途、剂型等分类、分品种、分区摆放,并在对应位置上树立醒目标示牌。
2、兽药用物价标签明码标价。
3、配备一台办公电脑,并装载GSP软件和POS机(打印(二)仓库的准备:总面积不能少于20平方米,其中分常温库和阴凉库。
常温库内必须有货架或防潮垫板,阴凉库可用货架或防潮垫板存放兽药。
阴凉库内有一台正常工作的空调,常年温度控制在20度以下。
库内应进行功能区划分,同时摆放一个温湿度计和防鼠、虫、蝇、蚊、尘及应急灯、消防设备,并附有温湿度记录表,每天记录一次。
兽药经营企业申请兽药GSP检查验收应提交资料附件二附件三附件四1、各岗位职责、釆购、贮存、销售、质量验收、不良反应报告制度、安全检査制度、危险品管理制度、消防管理制度2、服务公约与质量承诺公示3、售后服务管理制度4、卫生管理制度5、内部功能区域布局图6、兽药质量管理体系与职能框图7、工作岗位服务一览表8、投诉处理流程图9、兽药供应商资质审核流程图管理机构与职能框图岗位服务一览表流程名称:投诉处理流程兽药供应商资质审核流程兽用生物制品中报材料另需要补充的资料1、营业场所、仓库(冰柜分区设置)平面图;2、阴凉库(柜)、冷库(柜)、温度计、真空度测定仪、发电机、运输设备或设施清单,并注明主要参数:3、兽用生物制品生产企业出具的委托代理合同。
兽药GMP检查验收申请表(填写说明)

附录 A
(资料性附录)
兽药GMP检查验收申请表及填写说明
兽药GMP检查验收申请表及填写说明
申请单位:(公章)
申请单位名称、盖章名称与营业执照登记的单位名称一致
所在地:省(自治区、直辖市)市县按实际情况填写
填报日期:申请当天日期
填报说明
1.企业申请检查验收如涉及2个及以上生产地址的,应分别写明生产地址和相应的申请验收范围。
2.申请事项类别中,新建是指新开办的兽药生产企业;原址改扩建是指在原生产地址改建和扩建生产车间;异地扩建是指在新的地址扩建兽药生产车间,原生产地址仍然从事兽药生产活动;迁址重建是指在新的地址重建兽药生产车间,原生产地址不再从事兽药生产活动。
3.企业类型:按《企业法人营业执照》标明内容填写。
外资企业请注明投资外方的国别或港、澳、台地区。
4.申请验收范围写法应规范:注射剂应注明小容量或大容量、静脉或非静脉、最终灭菌或非最终灭菌、粉针剂等;激素类应在括号中注明;口服固体制剂应注明粉剂、散剂、预混剂、片剂、胶囊剂、颗粒剂等;口服溶液剂应注明最终灭菌或非最终灭菌;中药提取车间应在括号中注明;原料药应在括号中注明品种名称;生物制品应注明生产线名称,需要注明剂型的应在括号中注明;消毒剂和杀虫剂应注明固体或液体。
5.生产剂型和品种表应填写已获得批准文号的全部产品及试生产的全部产品,兽药名称按通用名填写;年最大生产能力计算单位:万瓶、万支、万片、万粒、万袋、万毫升、万头(羽)份、吨等。
6.联系电话号码前标明所在地区长途电话区号。
7.本申请表填写应内容准确完整,字迹清晰,用A4纸打印,申请表格式不得擅自调整。
生产剂型品种表
(如填写空间不够,可另加附页)。
兽药GSP检查验收申请书

附件1:
兽药经营质(兽药GSP)
检査验收申请书
申请企业名称_____________________ (公章)
经营地址___________________________________
法定代表人_________________________________
法人电话___________________________________
企业电子邮箱_______________________________
申请类别___________________________________ 申请日期
表一
兽药GSP检查验收申请表
注:1.经营方式系指批发经营、零售经营、批零兼营。
2. 经营范围系指非国家强制免疫兽用生物制品。
3. 经济性质系指国有企业、集体企业、外资企业、合资企业、私营企业。
4. 所有地址要明细到门牌号。
表二
企业人员情况表
注:1.填报本表时,请将身份证、学历证书、专业技术职称证书及聘用合同(或聘书)的复印件装在附件材料中。
2.企业人员分设质量负责人、质量管理人员、验收人员、采购人员、保管人员、销售人员、技术服务人员,在职务/岗位栏中注明。
表三
企业经营场所和设施设备情况表
填写说明:1 •根据企业设施、设备的实际填写。
2•表中所有面积均为建筑面积,单位为平方米。
3.设施设备:指与保存兽药质量有关的一切设施设备、储存运输及消防等与安全生产有关的设备、应急电源、陈列设施等。
4.表格不够可另附页。
表四
提交的附件资料明细表。
兽药GSP申报材料(一)

兽药经营质量管理验收申报材料申请企业名称:(公章)申请日期:年月日受理部门:受理日期:年月日目录1、广东省兽药GSP检查验收申请书…………………………2、原《兽药经营许可证》、《营业执照》复印件……………………………………………………3、企业负责人身份证复印件……………………………4、企业质量负责人身份证复印件……………………………5、企业质量负责人毕业证书或职称资格证书复印件………6、企业质量负责人简历………………………………………7、《企业名称预先核准通知书》复印件……………………8、企业员工一览表……………………………………………9、企业所有人员学历证书复印件……………………………10、经营场所和仓库的使用证明复印件……………………11、企业质量管理组织、机构设置与职能框架图……………12、企业经营场所和仓库的方位示意图(经营场所和仓库未在一起的,应单独画出)………………………13、经营场所内部平面布局……………………………………14、仓库内部平面布局图………………………………………15、经营企业设施、设备情况表………………………………16、企业实施兽药GSP情况的自查报告………………………17、县级兽药管理部门出具的企业没有违规经销假劣兽药行为的证明文件…………………………………………………备注:1、新开办兽药经营企业不申报本目录2、6、16项材料。
2、已开办兽药经营企业需申报目录所有材料。
3、材料按目录所列次序装订。
4、表格材料由市局统一制订,附后。
受理编号:广东省兽药GSP检查验收申请书申请企业名称:(公章)申请日期:年月日受理部门:受理日期:年月日广东省畜牧兽医局制填表说明1、本表从《中华兽药在线》网上下载或自制,A4纸打印或以黑色钢笔、签字笔填写,一式二份。
申请书应为原件,内容应真实、准确、完整,不得涂改,字迹不清、项目填写不全的不予受理。
2、报送检查验收申请书和其他表格、资料,应按有关栏目填写的企业负责人员和质量管理人员情况,附质量管理人员学历证明及专业技术职称证书的复印件。
兽药GSP检查验收申报材料范本

兽药GSP检查验收申报材料范本篇一:兽药GSP申报材料完整篇XX兽药店GSP检查验收申请企业名称:XX兽药店(公章)申请日期:受理部门:受理日期:二O一二年六月十八日二O一二年六月二十八日填报说明1、申请书应为原件,用钢笔、签字笔填写或打印,内容应准确、完整,不得涂改。
2、报送检查验收申请书和其他表格、资料,应按有关栏目填写的企业负责人员和质量管理人员情况,附质量管理人员学历证明、专业技术职称证书以及质量管理人员上岗证书的复印件。
3、检查验收申请书以外的资料,应使用A4纸打印,标明目录以及页码并装订成册。
4、上述申报材料报送一式三份。
XX省兽药GSP检查验收申请书篇二:云南省兽药GSP检查验收申请书《云南省兽药GSP检查验收申请书》申请企业名称:申请日期:年月日受理部门:受理日期:日填报说明1、申请书应为原件,用钢笔、签字笔填写或打印,内容应准确、完整,不得涂改。
2、报送检查验收申请书和其他表格、资料,应按有关栏目填写的企业负责人员和质量管理人员情况,附质量管理人员学历证明、专业技术职称证书以及质量管理人员上岗证书的复印件。
3、检查验收申请书以外的资料,应使用A4纸打印,标明目录以及页码并装订成册。
4、上述申报材料报送一式三份。
云南省兽药GSP检查验收申请书注:1. 经营方式系指连锁经营、批发经营、零售经营、批零兼营。
2. 经营范围系指兽用化学药品、中药制剂、外用杀虫剂、消毒剂、原料药、生化药品、中药材(中药饮片)、特殊药品(兽用麻醉药品、精神药品、易制毒化学药品、毒性药品、放射性药品),以及兽用生物制品等。
3. 经济性质系指国有企业、外资企业、私营企业、个人独资企业、个体工商户。
4. 企业所属非法人分支机构的,应另表说明。
企业人员情况一览表填报单位:(盖章)填报日期:年月日注:1. 填报本表时,请将学历证书及专业技术职称证书的复印件附后。
2. 质量负责人、质量管理人员、验收人员、养护人员等应在职务/岗位一栏中注明。
兽药GMP检查验收申请表(定稿)

兽药GMP检查验收申请表(定稿)第一篇:兽药GMP检查验收申请表(定稿)附录1兽药GMP检查验收申请表申请单位:(公章)地址:填报日期:收件日期:中华人民共和国农业部制填报说明一、企业类型:按《企业法人营业执照》内容填写。
二、检查验收范围:填写各生产线名称,其中制剂须注明剂型名称;原料药须注明品种名称;生物制品须注明类别(弱毒苗/灭活苗/血清制品/诊断液)或产品名称。
三、建设性质:填写新建或改扩建。
四、固定资产和投资额计算单位:万元。
生产能力计算单位:万瓶、万支、万片、万粒、万袋。
五、填写内容应准确完整、字迹清晰。
申报材料用A4纸打印,装订成册,每册材料均应有目录。
企业名称(中英文)申请检查验收范围申请检查验收状态(新建/改扩建)注册地址生产地址(中英文)兽药生产许可证编号企业始建时间企业类型职工人数法定代表人姓名生产地址邮编最近更名时间合资企业外方国别或地区技术人员比例学历/ 职称专业学历/企业负责人姓名质量负责人姓名联系人姓名传真固定资产原值厂区占地面积(平方米)上年产值(万元)原料药生产品种(个)生产剂型和品种20.省级兽医行政管理部门审核意见备注职称专业学历/职称专业电话手机E-mail固定资产净值建筑面积(平方米)销售额(万元)制剂生产品种(个)列表(附申请书后),包括兽药名称、剂型文号或报批情况盖章年月日生产剂型和兽药品种表兽药名称原料药、制剂剂型规格(含量规格/包装规格)批或报第二篇:兽药GMP检查验收申请表(小五)表1兽药GMP检查验收申请表申请单位:(公章)所在地:省、自治区、直辖市填报日期:填报说明1.申报企业兽药GMP证书上如需英文信息(企业名称、生产地址等),请在申请表上自行填写。
2.企业类型:按《企业法人营业执照》标明内容填写。
外资企业请注明投资外方的国别或港、澳、台地区。
3.建设性质:填写新建(指新开办的兽药生产企业)、改扩建(指兽药生产企业新增生产线)、复验。
4.申请验收范围:注射剂应注明小容量或大容量、静脉或非静脉、最终灭菌或非最终灭菌、粉针剂等;口服固体制剂应注明粉剂、散剂、预混剂、片剂、胶囊剂、颗粒剂等;口服溶液剂应注明最终灭菌或非最终灭菌、酊剂等;青霉素类、β-内酰胺类、激素类应在括号中注明;中药提取车间应在括号中注明;原料药应在括号中注明品种名称;生物制品应注明生产线名称,需要注明剂型的应在括号中注明;消毒剂和杀虫剂应注明固体或液体,在括号中注明剂型如:粉剂、片剂等。
兽药经营质量管理规范检查验收申请书

兽药经营质量管理规范检查验收申请书Application for Inspection and Acceptance of Animal Pharmaceutical Quality Management StandardsIntroductionDear Sir/Madam,I am writing to submit an application for the inspection and acceptance of our animal pharmaceutical quality management standards. As an animal pharmaceutical company, we understand the importance of ensuring the safety and efficacy of our products. Therefore, we have implemented comprehensive quality management procedures in our operations. In this application, we will outline ourquality management system and request a thorough inspection to verify its compliance with industry regulations.Quality Management System DescriptionOur company has established a robust quality management system that encompasses various aspects of our operations. This system is divided into four key components:documentation control, supplier management, production processes, and product release.1. Documentation ControlWe maintain meticulous control over all documentation related to our animal pharmaceutical products. This includes standard operating procedures (SOPs), master batch records, validation protocols, deviation reports, change controls, and training records. All documents undergo rigorous review and approval processes before implementation.2. Supplier ManagementTo ensure the consistent quality of raw materials used in our products, we have implemented a stringent supplier management program. This program includes conducting supplier audits to evaluate their compliance with regulatory requirements and conducting regular inspections to verify the quality of incoming materials.3. Production ProcessesOur production processes adhere to strict guidelinesoutlined by regulatory authorities. We follow GMP (Good Manufacturing Practices) standards throughout each stage of production – from material receipt to finished product packaging. Our facilities are equipped with state-of-the-art equipment to enable efficient manufacturing while maintaining high product quality.4. Product ReleaseBefore releasing any animal pharmaceutical product onto the market, it undergoes rigorous testing and evaluation procedures in accordance with industry standards. Our QA (Quality Assurance) department performs thorough inspections on both intermediates and finished products to ensure they meet predefined specifications.Inspection RequestWe kindly request your esteemed organization to conduct an inspection of our facilities and processes based on the animal pharmaceutical quality management standards. We believe that our meticulous adherence to industry regulations, combined with our robust quality management system, positions us as a trusted provider of safe andeffective animal healthcare products.ConclusionIn conclusion, we have implemented a comprehensive animal pharmaceutical quality management system that encompasses documentation control, supplier management, production processes, and product release. We kindly request an inspection to validate the compliance of our operations with industry regulations. Thank you for considering our application and we look forward to welcoming your inspection team soon.致:兽药经营质量管理规范检查验收申请书引言尊敬的先生/女士,我写信是为了提交我们兽药经营质量管理规范检查验收的申请。
兽药经营质量管理规范GSP样本

兽药GSP检查验收申请书申请单位(盖章):法定代表人签名:检查验收范围:联系人:联系电话:申请日期:XX省农业厅制填表说明1.本表须用黑色钢笔、签字笔填写或用A4纸打印。
内容应当准确、完整,不得涂改。
字迹不清、项目填写不全者不予受理。
2.企业类型:指合资企业、外国独资企业、国内企业等。
3.经济性质:指国有企业、外资企业、私营企业、个人独资企业、个体工商户。
4.经营范围:指兽药类别,如兽用化学药品、中药制剂、外用杀虫剂、消毒剂、原料药、生化药品、中药材(中药饮片)、特殊药品(兽用麻醉药品、精神药品、易制毒化学药品、毒性药品、放射性药品),以及兽用生物制品等。
5.经营方式系指连锁经营、批发经营、零售经营、批零兼营。
6.本表所填写人员应当为企业专职工作人员。
7.根据需要,本表格填写项目可另附页。
8.本表应当为原件,签章复印件无效。
企业声明1.本企业对《兽药经营质量管理规范》、《XX省兽药经营质量管理规范实施细则》已充分理解。
2.本企业已按照《XX省兽药GSP检查验收评定标准》自查合格,可随时接收兽药GSP现场检查验收。
3.本申请书所填信息及附资料均真实可靠,若有虚假愿承担一切后果及有关法律责任。
法定代表人(负责人)签名(公章)2011年02 月17日表 1 企业基本情况表 2 企业基本情况表 3 企业人员一览表注:1.填报本表时,请将学历证书及专业技术职称证书的复印件附后。
2.质量负责人、质量管理人员、验收人员、养护人员等应当在职务/岗位一栏中注明。
3.质量管理人员参加所在地农业(畜牧兽医)局的培训、考核情况应当在备注栏中注明。
表 4 企业经营设施、设备情况表说明:1.根据企业设施、设备的实际填写。
如无栏目所设项目,应注明“无”。
2.表中所有面积均为建筑面积,单位为平方米。
3.“营业场所及辅助、办公用房”栏目中“辅助用房”指库区中服务性或劳保用房。
企业名称:验收日期:年月日XX省兽药GSP检查验收评定标准(化药、中药等)1、根据《兽药经营质量管理规范》、《XX省兽药经营质量管理规范实施细则》制定本评定标准。
兽药GSP检查验收申报材料完整版

兽药GSP检查验收申报材料完整版一、企业基本信息1.企业名称:2.注册地址:3.经营范围:4.法定代表人:5.营业执照副本复印件:6.组织机构代码证复印件:7.经营许可证复印件:二、质量体系文件请提供以下兽药质量体系文件:1.质量手册:2.稽查记录:3.原辅料采购合同:4.兽药生产记录:5.兽药质检报告:6.兽药存储条件监控记录:7.废弃物处理记录:三、人员及设施1.负责兽药质量管理及监督的人员名单及简历:2.相关人员培训记录:3.兽药生产设备清单及检验记录:4.兽药存储仓库及设施图纸:四、兽药生产1.兽药生产工艺流程图及验证记录:2.兽药生产设备清单及检验记录:3.原辅料购进管理记录:4.兽药生产记录:5.兽药质检报告:6.内部质量监控记录:7.异常处理与变更记录:五、兽药质量控制1.生产质量控制计划:2.兽药质量样品及测试记录:3.标准物质管理记录:4.检测设备及仪器校准记录:5.质量自查报告:6.异常处理与变更记录:1.包装材料清单及供应商质量合格证明:2.兽药包装缺陷与破损记录:七、兽药储存与运输1.兽药储存环境监测记录:2.兽药运输车辆及运输协议:3.药品损毁及丢失记录:八、兽药市场监管1.兽药市场监管合同:2.兽药产品上市许可证:3.兽药市场销售台账:4.兽药投诉与回访记录:以上是兽药GSP检查验收申报材料的一个完整版示例,申报材料应根据实际情况进行调整和补充,保证材料的真实性和完整性。
同时,在提交申报材料之前,建议企业进行内部审核,确保所有文件和记录的齐全和准确性。
兽药GMP检查验收材料(空白)

兽药GMP检查验收材料XXXX公司XXX年XX月XX日目录1.企业概况;2.企业组织机构图;3.企业负责人、部门负责人简历;专业技术人员及生产、检验、仓储等工作人员登记表(包括文化程度、学历、职称等),并标明所在部门及岗位;高、中、初级技术人员占全体员工的比例情况表;4.企业周边环境图、总平面布置图、仓储平面布置图、质量检验场所平面布置图及仪器设备布置图;5.生产车间概况及工艺布局平面图;空气净化系统的送风、回风、排风平面布置图;工艺设备平面布置图;6.生产的关键工序、主要设备、空调控温系统、检验仪器设备及产品工艺验证报告;7.检验用计量器具校验情况;8. 前6个月内洁净室(区)检测报告;9.生产设备设施、检验仪器设备目录;10.所有兽药GMP文件目录、具体内容及与文件相对应的空白记录、凭证样张;11.兽药GMP运行情况报告;12.生产兽药类别、剂型及产品目录;13.生产兽药国家标准产品的工艺流程图、主要过程控制点和控制项目;14.《兽药生产许可证》复印件和法定代表人授权书;15.企业自查情况和GMP实施情况;16.企业近3年产品质量情况,包括被抽检产品的品种与批次,不合格产品的品种与批次,被列为重点监控企业的情况或接受行政处罚的情况,以及整改实施情况与整改结果;17.已获批准生产的产品目录和产品生产、质量管理文件目录;所生产品种的工艺流程图、主要过程控制点和控制项目;18.中药提取工艺方法和与提取工艺相应的厂房设施清单及各类文件1.企业概况;2.企业组织机构图(须注明各部门名称、负责人、职能及相互关系);3.企业负责人、部门负责人简历;专业技术人员及生产、检验、仓储等工作人员登记表(包括文化程度、学历、职称等),并标明所在部门及岗位;高、中、初级技术人员占全体员工的比例情况表;4.企业周边环境图、总平面布置图、仓储平面布置图、质量检验场所平面布置图及仪器设备布置图;(书面材料)5.生产车间概况及工艺布局平面图(包括更衣室、盥洗间、人流和物流通道、气闸等,人流、物流流向及空气洁净级别);空气净化系统的送风、回风、排风平面布置图;工艺设备平面布置图;(书面材料)6.生产的关键工序、主要设备、空调控温系统、检验仪器设备及产品工艺验证报告;7.检验用计量器具(包括仪器仪表、量具、衡器等)校验情况;8. 前6个月内洁净室(区)检测报告;(书面材料)9.生产设备设施、检验仪器设备目录(需注明规格、型号、主要技术参数);10.所有兽药GMP文件目录、具体内容及与文件相对应的空白记录、凭证样张;11.兽药GMP运行情况报告;12.生产兽药类别、剂型及产品目录;(书面材料)13.生产兽药国家标准产品的工艺流程图、主要过程控制点和控制项目;14.《兽药生产许可证》复印件和法定代表人授权书;(书面材料)15.企业自查情况和GMP实施情况;16.企业近3年产品质量情况,包括被抽检产品的品种与批次,不合格产品的品种与批次,被列为重点监控企业的情况或接受行政处罚的情况,以及整改实施情况与整改结果;17.已获批准生产的产品目录和产品生产、质量管理文件目录(包括产品批准文号批件、质量标准目录等);所生产品种的工艺流程图、主要过程控制点和控制项目;18.中药提取工艺方法和与提取工艺相应的厂房设施清单及各类文件。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
广东省兽药GSP检查验收申请书注:1. 经营方式系指连锁经营、批发经营、零售经营、批零兼营。
2. 经营范围系指兽用化学药品、中药制剂、外用杀虫剂、消毒剂、原料药、生化药品、中药材(中药饮片)、特殊药品(兽用麻醉药品、精神药品、易制毒化学药品、毒性药品、放射性药品),以及兽用生物制品等。
3. 经济性质系指国有企业、外资企业、私营企业、个人独资企业。
4. 企业所属非法人分支机构的,应另表说明。
企业人员情况一览表填报单位:填报日期:注:1.填报本表时,请将学历证书及专业技术职称证书的复印件附后。
2.质量负责人、质量管理人员、验收人员、养护人员等应在职务/岗位一栏中注明。
3. 质量管理人员参加县级以上兽医行政管理部门的培训、考核情况应在备注栏中注明。
企业经营设施、设备情况表填报单位:填报日期:说明:1.根据企业设施、设备的实际填写。
如无栏目所设项目,应注明“无”。
2. 表中所有面积均为建筑面积,单位为平方米,冷库单位为立方米。
3.“营业场所及辅助、办公用房”栏目中“辅助用房”指库区中服务性或劳保用房。
企业所属非法人分支机构情况表填报单位:填报日期:兽药GSP认证自查报告一、企业概况二、管理职责三、人员与培训四、设施和设备五、进货与验收六、陈列与储存七、销售与服务八、存在问题及改进措施:××市××兽药有限公司组织机构图××市××兽药有限公司质量管理机构图为确保企业所经营生物制品质量,保证消费者使用安全,根据《广东省兽药经营质量管理规范》、《兽药管理条例》要求,决定设立专职质量管理员,具体负责本企业的质量管理工作,在企业内部对生物制品质量进行裁决,对企业经营的生物制品质量具有一票否决权。
主要职责是:一、贯彻执行有关的生物制品质量管理的法律、法规和行政规章。
二、起草企业生物制品质量管理制度,并指导、督促制度的执行。
三、负责首营企业和首营品种的质量审核。
四、负责建立企业所经营的生物制品包含质量标准等内容的质量档案。
五、负责生物制品质量的查询和生物制品质量事故或质量投诉的调查、处理及报告。
六、负责生物制品的验收管理,指导和监督生物制品保管、养护和运输过程中的质量工作。
七、负责质量不合格生物制品的审核,对不合格生物制品的处理过程实施监督。
八、收集和分析生物制品质量信息。
×××市×××兽药有限公司文件为确保购进生物制品质量,根据《兽药经营质量管理规范》、《兽药管理条例》等要求,特制定本制度。
一、购进生物制品应为合法企业所生产或经营的药品。
二、购进生物制品应认真审核供货单位的合法资格和质量信誉,从本单位合格供货方购进。
严禁从非法渠道或质量信誉不佳的单位进货。
三、购进生物制品应对与本单位进行业务联系的供货单位销售人员,进行合法资格的验证。
四、与首营企业开展业务关系或购进首营品种时,按照《首营企业和首营品种审核制度》规定执行。
五、购进进口生物制品,应索取盖有供货单位质量管理机构的印章的《进口兽用生物制品许可证》复印件,核对进口生物制品的合法性。
六、采购生物制品应签订进货合同,进货合同应有明确的质量条款。
若为口头要货、传真要货等非标准书面合同,应提前与供货单位签订质量保证协议,并注明有效期。
七、企业购进生物制品应有合法票据,做到票、帐、货相符。
八、购进生物制品,应建立购进记录,购进记录应注明生物制品的品名、规格、剂型、生产企业、产品批号、有效期、供货单位、购进数量、购进日期等内容。
购进记录保存至超过有效期1年,但不得少于2年。
合格供货方审核表生物制品购货计划表×××市×××兽药有限公司文件为确保企业经营行为的合法,把好生物制品购进质量关,根据《广东省兽药经营质量管理规范》及《兽药管理条例》等法律法规,特制定本制度。
一、“首营企业”指与本企业首次发生生物制品供需关系的生物制品生产企业或生物制品经营企业。
“首营品种”指本企业向某一生物制品生产企业首次购进的生物制品,包括生物制品的新规格、新剂型、新包装等。
二、首营企业和首营品种必须经质量管理员审核批准,方可开展业务往来并购进。
三、审批首营企业和首营品种的必备资料:(一)首营企业:加盖首营企业原印章的《兽药生产许可证》、《营业执照》复印件、兽药GMP证书;加盖企业原印章和企业法定代表人印章或签字的销售委托授权书,委托授权书应标明委托授权范围及有效期,销售人员身份证复印件;质量认证情况的有关证书。
(二)首营品种:生物制品生产批准证明文件;生物制品包装、标签、说明书实样;首次购进该批生物制品的出厂检验报告书;其他相关材料。
四、购进首次经营生物制品或准备与首营企业开展业务关系时,采购人员应详细填写“首营品种(企业)审批表”,连同以上资料及样品报质量管理员。
五、质量管理员对采购人员填报的“首营品种(企业)审批表”及相关资料和样品进行审核后,报企业负责人审批。
六、首营品种及首营企业的审核以资料的审核为主,对首营企业的审核如依据所报送的资料无法做出准确的判断时,采购人员会同质量管理员进行实地考察,并由质量管理员根据考察情况形成书面考察报告,再上报审批。
七、首营品种与首营企业的审批原则上应在3天内完成审批。
八、质量管理员将审核批准的“首营企业审批表”和“首营品种审批表”及报批资料等存档备查。
首营企业审批表首营品种审批表品、GMP证书及临床总结报告等资料。
×××市×××兽药有限公司文件为把好生物制品入库质量关,严防假劣生物制品进入本企业,根据《兽药经营质量管理规范》及《兽药管理条例》等法律法规要求,特制定本制度。
一、生物制品质量验收工作由质量验收员负责。
质量验收员应具有高中以上学历,并经岗位培训和地市级以上药品监督管理部门考核合格,取得岗位合格证书后方可上岗。
二、验收员应对照合同及凭证对购进的生物制品或销后退回的生物制品进行逐批验收。
三、生物制品应在待验区内并在规定的时限内及时验收,需冷藏生物制品应随到随验,需要进行质量查询或送检的生物制品应在查询或检验结果明确后日内验收完毕。
四、验收抽取的样品应具有代表性:整件药品不足2件时应逐件检查验收,50件以下抽取2件验收,50件以上每增加20件,增加抽取1件验收,不足20件按20件计。
对验收抽取的整件生物制品,应加贴标记,并进行复原封箱。
五、生物制品质量验收,包括生物制品外观的性状检查和生物制品内外包装及标识的检查。
包装、标识主要检查以下内容:(一)每件包装中,应有产品合格证。
(二) 生物制品包装的标签和所附说明书上,有生产企业的名称、地址,有药品的品名、规格、批准文号、产品批号、生产日期、有效期等;标签或说明书上还应有药品的成分、适应症或功能主治、用法、用量、禁忌、不良反应、注意事项以及贮藏条件等。
(三)进口生物制品,其包装的标签应以中文注明生物制品的名称、主要成分以及注册证号,并有中文说明书。
进口药品应有符合规定的进口生物制品许可证和进口兽药通关单等复印件。
六、验收中发现有下列情况之一的,验收员应填写《生物制品拒收报告单》,报质量管理员审核并签署处理意见,通知采购人员:(一)不属于本企业购进的生物制品;(二)从非法渠道购进的生物制品;(三)无合法票据的生物制品;(四)货单不符的生物制品;(五)质量异常和假劣生物制品;(六)包装标识不符合本制度第五条规定的生物制品;(七)有效期不足6个月的生物制品。
七、验收合格的生物制品,验收员与仓库保管员办理入库手续。
仓管员对货单不符、质量异常、包装不牢固或破损、标志模糊或有其他问题的品种,应填写《生物制品拒收报告单》报质量管理员。
八、生物制品验收应做好记录。
验收记录记载供货单位、数量、到货日期、品名、剂型、规格、批准文号、批号、生产厂商、有效期、质量状况、验收结论和验收人员、验收日期等项内容。
验收记录保存在至超过生物制品有效期一年,但不得少于三年。
生物制品质量验收记录/购进记录—20—生物制品拒收报告单×××市×××兽药有限公司文件为保证对生物制品仓库实行科学、规范的管理,正确、合理地储存药品,保证生物制品储存质量,根据《兽药经营质量管理规范》及《兽药管理条例》等法律法规要求,特制定本制度。
一、按照安全、方便、节约、高效的原则,正确选择仓位,合理使用仓容,堆码规范、合理、整齐、牢固,无倒置现象。
二、根据生物制品储存要求,将生物制品分别存放于常温库、阴凉库、冷库。
对有特殊温湿度储存条件要求的药品,应设定相应的库房温湿度条件,保证生物制品的储存质量。
其中,冷藏库在2—8℃之间,低温库温度在—15℃以下。
三、库存生物制品应按药品批号及有效期远近依序存放,不同批号生物制品不得混垛。
四、生物制品存放实行色标管理。
待验生物制品、退货生物制品区——黄色,合格品区、发货区——绿色,不合格品区——红色。
五、生物制品实行分区、分类管理。
具体要求:1、药品与非药品、内服药与外用药应分货位存放;3、不合格生物制品单独存放,并有明显标志。
六、对近效期的生物制品设立近效期标志,按月填报《近效期生物制品报表》。
七、报废、待处理及有质量问题的生物制品,必须与正常生物制品分开,防止错发或重复报损,造成帐货混乱和其它严重后果。
八、保持库房、货架上的清洁卫生,定期进行清理和消毒,做好防盗、防火、防潮、防腐、防鼠、防污染等工作。
库房温湿度记录表( 年月)×××市×××兽药有限公司文件为保证生物制品在库储存和零售门店陈列生物制品的质量,根据《兽药经营质量管理规范》及《兽药管理条例》,特制定本制度。
一、养护人员应具有高中以上文化程度,经岗位培训和地市级(含)以上药品监督管理部门考试合格,获得岗位合格证书后方可上岗。
二、养护人员应每3个月完成对在库生物制品的养护与检查,做好《库存生物制品质量检查记录》和《陈列生物制品质量检查记录》,发现质量问题,及时与质量管理员联系,并暂停销售。
三、养护人员每月完成陈列生物制品的养护检查,做好《陈列生物制品质量检查记录》,发现质量问题,及时与质量管理员联系,并暂停销售。
四、对近效期生物制品,应按月填报《近效期生物制品报表》。
五、对库房温湿度条件实施动态监测、控制工作,根据温湿度的变化,及时采取相应的通风、降温、除湿等措施。
每日上午9时、下午3时各记录一次库内温湿度,发现问题,及时采取调控措施。
六、定期汇总、分析和上报养护检查、近效期或长时间储存、陈列生物制品的质量信息。
七、建立生物制品养护档案。
