07硫酸阿米卡星注射液工艺规程分则
硫酸阿米卡星注射液使用说明方案(word版)

硫酸阿米卡星注射液使用说明书【药品名称】通用名:硫酸阿米卡星注射液英文名:AmikacinSulfateInjection汉语拼音:LiusuanAmikaxingZhusheye【成份】本品的主要成份为硫酸阿米卡星。
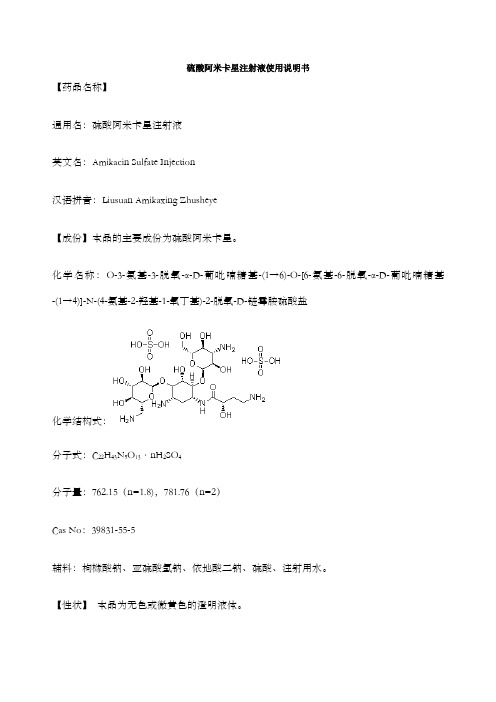
化学名称:O-3-氨基-3-脱氧-α-D-葡吡喃糖基-(1→6)-O-[6-氨基-6-脱氧-α-D-葡吡喃糖基-(1→4)]-N-(4-氨基-2-羟基-1-氧丁基)-2-脱氧-D-链霉胺硫酸盐化学结构式:分子式:C22H43N5O13·nH2SO4分子量:762.15(n=1.8),781.76(n=2)CasNo:辅料:枸橼酸钠、亚硫酸氢钠、依地酸二钠、硫酸、注射用水。
【性状】本品为无色或微黄色的澄明液体。
【适应症】本品适用于铜绿假单胞菌及部分其他假单胞菌属、大肠埃希菌、变形杆菌属、克雷伯菌属、肠杆菌属、沙雷菌属、不动杆菌属等敏感革兰阴性杆菌与葡萄球菌属(甲氧西林敏感株)所致严重感染,如菌血症或败血症、细菌性心内膜炎、下呼吸道感染、骨关节感染、胆道感染、腹腔感染、复杂性尿路感染、皮肤软组织感染等。
由于本品对多数氨基糖苷类钝化酶稳定,故尤其适用于治疗革兰阴性杆菌对卡那霉素、庆大霉素或妥布霉素耐药菌株所致的严重感染。
【规格】2ml:0.2g(20万单位)【用法用量】1.成人,肌内注射或静脉滴注。
单纯性尿路感染对常用抗菌药耐药者每12小时0.2g;用于其他全身感染每12小时7.5mg/kg,或每24小时15mg/kg。
成人一日不超过1.5g,疗程不超过10天。
2.小儿,肌内注射或静脉滴注。
首剂按体重10mg/kg,继以每12小时7.5mg/kg,或每24小时15mg/kg。
3.肾功能减退患者:肌酐清除率>50~90ml/min者每12小时给予正常剂量(7.5mg/kg)的60~90%;肌酐清除率10~50ml/min者每24~48小时用7.5mg/kg的20~30%。
肌酐清除率可直接测定或从血肌酐值按下式计算:(140-年龄)×标准体重(kg)成年男性肌酐清除率=───────────────72×患者血肌酐浓度(mg/dl)(140-年龄)×标准体重(kg)或──────────────50×患者血肌酐浓度(mol/dl)(140-年龄)×标准体重(kg)成年女性肌酐清除率=──────────────×0.8572×患者血肌酐浓度(mg/dl)(140-年龄)×标准体重(kg)或──────────────×0.8550×患者血肌酐浓度(mol/dl)【不良反应】1.患者可发生听力减退、耳鸣或耳部饱满感;少数患者亦可发生眩晕、步履不稳等症状。
硫酸阿米卡星注射液使用说明书版
硫酸阿米卡星注射液使用说明书【药品名称】通用名:硫酸阿米卡星注射液英文名:Amikacin Sulfate Injection汉语拼音:Liusuan Amikaxing Zhusheye【成份】本品的主要成份为硫酸阿米卡星。
化学名称:O-3-氨基-3-脱氧-α-D-葡吡喃糖基-(1→6)-O-[6-氨基-6-脱氧-α-D-葡吡喃糖基-(1→4)]-N-(4-氨基-2-羟基-1-氧丁基)-2-脱氧-D-链霉胺硫酸盐化学结构式:分子式:C22H43N5O13·nH2SO4分子量:762.15(n=1.8),781.76(n=2)Cas No:39831-55-5辅料:枸橼酸钠、亚硫酸氢钠、依地酸二钠、硫酸、注射用水。
【性状】本品为无色或微黄色的澄明液体。
【适应症】本品适用于铜绿假单胞菌及部分其他假单胞菌属、大肠埃希菌、变形杆菌属、克雷伯菌属、肠杆菌属、沙雷菌属、不动杆菌属等敏感革兰阴性杆菌与葡萄球菌属(甲氧西林敏感株)所致严重感染,如菌血症或败血症、细菌性心内膜炎、下呼吸道感染、骨关节感染、胆道感染、腹腔感染、复杂性尿路感染、皮肤软组织感染等。
由于本品对多数氨基糖苷类钝化酶稳定,故尤其适用于治疗革兰阴性杆菌对卡那霉素、庆大霉素或妥布霉素耐药菌株所致的严重感染。
【规格】2ml:0.2g(20万单位)【用法用量】1.成人,肌内注射或静脉滴注。
单纯性尿路感染对常用抗菌药耐药者每12小时0.2g;用于其他全身感染每12小时7.5mg/kg,或每24小时15mg/kg。
成人一日不超过1.5g,疗程不超过10天。
2.小儿,肌内注射或静脉滴注。
首剂按体重10mg/kg,继以每12小时7.5mg/kg,或每24小时15mg/kg。
3.肾功能减退患者:肌酐清除率>50~90ml/min者每12小时给予正常剂量(7.5mg/kg)的60~90%;肌酐清除率10~50ml/min者每24~48小时用7.5mg/kg的20~30%。
注射用硫酸阿米卡星生产工艺规程

1. 适用范围 本规程规定了注射用硫酸阿米卡星生产全过程的工艺技术、质量、 物耗、安全、工艺卫生、环境保护等内容,经验证合格,符合GMP规范 要求。本工艺规程具有技术法规作用。本工艺规程适用于注射用硫酸阿 米卡星的生产全过程,是各部门共同遵循的技术准则。 2. 引用标准 《中华人民共和国药典》2010年版 《中国生物制品主要原辅材料质控标准》(2000年版) 《药品生产质量管理规范》(1998年修订) 3. 职责 起草:生技部组织相关专业技术人员负责起草。 审批:技术总监和质量总监审核,总经理批准。 执行:各级生产质量管理人员及操作人员。 4. 产品名称及剂型 4.1. 产品通用名称:注射用硫酸阿米卡星 汉语拼音 Zhusheyong Liusuan Amikaxing 商品名: 英文名称:Amikacin Sulfate for Injection 4.2. 剂型:粉针剂 5. 产品概述 5.1. 成份:本品主要成份为硫酸阿米卡星,其化学名称为O-3-氨基-3脱氧-a-D-葡吡喃糖基-(1→6)-O-[(6-氨基-6-脱氧-a-D-葡吡喃糖基(1→4)-N-(4-氨基-2-羟基-1-氧丁基)-2-脱氧-D-链霉胺硫酸盐 5.2. 分子式:C22H43N5O13·nH2SO4(n=1.8) 5.3. 性状:本品为白色或类白色的结晶性粉末。 5.4.规格(1)0.1g (2)0.2g 5.5.贮藏 密封保存。 5.6.包装 (1)0.1g/支×10支/盒×50盒/箱;(2)0.2g/支×10支/盒×50盒/
可见异物
无异物、小白点
洗 胶 塞
内毒素
符合规定
可见异物
澄清、无异物
细菌内毒素
符合规定
原 料
度 PH值 装量 差异
澄清 3.0~5.5 ±3 0.1g (0.1g) 0.2g (0.2g ) 无异物、小 白点 符合规定 轧盖 符合规定 暗室无漏 光、清场卫 生合格 澄清、无污 痕 无色澄明 无毛点、色 点、白块、 小白点 清场卫生符 合规定 符合包装材 包装 灌装
硫酸阿米卡星注射液生产工艺研究

硫酸阿米卡星注射液生产工艺研究来萍利;王丽【摘要】目的探讨硫酸阿米卡星注射液的最佳生产工艺.方法选用不同用量的抗氧剂、络合剂、活性炭吸附剂,在相同生产工艺参数下进行试生产,对试生产的样品澄明度、色泽、pH、含量、热原进行检测.结果优选的用量抗氧剂焦亚硫酸钠为0.20%,络合剂枸橼酸钠为0.10%,活性炭吸附剂为0.03%.结论生产工艺中辅料按优选的用量生产硫酸阿米卡星注射液,工艺较稳定,产品质量指标较佳.【期刊名称】《中国药业》【年(卷),期】2013(022)020【总页数】2页(P58-59)【关键词】硫酸阿米卡星注射液;处方工艺;抗氧剂;络合剂;吸附剂【作者】来萍利;王丽【作者单位】西安阿房宫制药有限公司,陕西西安 710018;陕西省安康市食品药品检验所,陕西安康725000【正文语种】中文【中图分类】TQ460.6;R978.1+2硫酸阿米卡星为半合成氨基苷类抗生素,抗菌谱与庆大霉素相似,对金黄色葡萄球菌、绿脓杆菌、大肠杆菌及变形杆菌等均有效,对其他氨基苷类抗生素耐药菌株亦有效,临床上主要用于敏感菌所致肾盂肾炎、尿路感染、呼吸道及肺部感染、败血症等。
笔者对其注射液的工艺进行了研究,现报道如下。
1 仪器与试药Ultimate 3000型高效液相色谱仪,Chromeleon工作站(美国戴安公司);AG285型电子分析天平(瑞士梅特勒托利多仪器有限公司);pHS-3C型精密酸度计(上海大普仪器有限公司)。
阿米卡星对照品(中国药品生物制品检定所,批号为130335-200204);杂质A对照品(中国药品生物制品检定所,批号为130553-200501);邻苯二甲酸盐标准缓冲液,硼砂标准缓冲液,甲苯(天津市科密欧化学试剂有限公司);氯化钴、硫酸铜(郑州天邦化工有限公司);重铬酸钾(天津市万盛化工有限公司);磷酸二氢钾(苏州日出化工有限公司)。
2 方法与结果2.1 处方及工艺2.1.1 处方组成[1]硫酸阿米卡星100 g(1亿单位),焦亚硫酸钠(抗氧剂)2 g,枸橼酸钠(络合剂)1 g,10%硫酸(调pH)适量,活性炭(吸附热原及除杂)0.3 g,氮气(空气置换,抗氧保护)持续,注射用水(溶剂)加至1 000 mL。
硫酸阿米卡星注射液使用说明方案

硫酸阿米卡星注射液使用说明书【药品名称】通用名:硫酸阿米卡星注射液英文名:AmikacinSulfateInjection汉语拼音:LiusuanAmikaxingZhusheye【成份】本品的主要成份为硫酸阿米卡星。
化学名称:O-3-氨基-3-脱氧-α-D-葡吡喃糖基-(1→6)-O-[6-氨基-6-脱氧-α-D-葡吡喃糖基-(1→4)]-N-(4-氨基-2-羟基-1-氧丁基)-2-脱氧-D-链霉胺硫酸盐化学结构式:分子式:C22H43N5O13·nH2SO4分子量:762.15(n=1.8),781.76(n=2)CasNo:39831-55-5辅料:枸橼酸钠、亚硫酸氢钠、依地酸二钠、硫酸、注射用水。
【性状】本品为无色或微黄色的澄明液体。
【适应症】本品适用于铜绿假单胞菌及部分其他假单胞菌属、大肠埃希菌、变形杆菌属、克雷伯菌属、肠杆菌属、沙雷菌属、不动杆菌属等敏感革兰阴性杆菌与葡萄球菌属(甲氧西林敏感株)所致严重感染,如菌血症或败血症、细菌性心内膜炎、下呼吸道感染、骨关节感染、胆道感染、腹腔感染、复杂性尿路感染、皮肤软组织感染等。
由于本品对多数氨基糖苷类钝化酶稳定,故尤其适用于治疗革兰阴性杆菌对卡那霉素、庆大霉素或妥布霉素耐药菌株所致的严重感染。
【规格】2ml:0.2g(20万单位)【用法用量】1.成人,肌内注射或静脉滴注。
单纯性尿路感染对常用抗菌药耐药者每12小时0.2g;用于其他全身感染每12小时7.5mg/kg,或每24小时15mg/kg。
成人一日不超过1.5g,疗程不超过10天。
2.小儿,肌内注射或静脉滴注。
首剂按体重10mg/kg,继以每12小时7.5mg/kg,或每24小时15mg/kg。
3.肾功能减退患者:肌酐清除率>50~90ml/min者每12小时给予正常剂量(7.5mg/kg)的60~90%;肌酐清除率10~50ml/min者每24~48小时用7.5mg/kg的20~30%。
硫酸阿米卡星注射液含量的测定方法研究

硫酸阿米卡星注射液含量的测定方法研究
张幸生;何丽芳;石东方
【期刊名称】《时珍国医国药》
【年(卷),期】2005(16)9
【摘要】目的:建立硫酸阿米卡星注射液的含量测定方法.方法:采用旋光法和抗生素微生物检定法测定硫酸阿米卡星注射液含量.结果:硫酸阿米卡星注射液浓度在1~20 mg/ml范围内与其旋光度呈良好线性关系,回归方程:y=7.892 9x-0.035 6,r=0.999 9,平均回收率98.92 %,RSD为0.42%(n=5).结论:与抗生素法相比旋光法更简便易行,结果准确,可作为该制剂的检验方法.
【总页数】2页(P938-939)
【关键词】旋光法;抗生素微生物检定法;硫酸阿米卡星注射液;含量测定
【作者】张幸生;何丽芳;石东方
【作者单位】深圳职业技术学院;黄石理工学院医学院
【正文语种】中文
【中图分类】R927.2
【相关文献】
1.小儿氨酚烷胺颗粒含量测定方法及含量均匀度考察研究 [J], 胡兴娥
2.对《中国药典》中硫酸阿米卡星注射液含量测定方法的探讨 [J], 王立萍;刘辉;李少杰;姚永青
3.白茅根中绿原酸含量测定方法研究及不同产地含量测定 [J], 郑志远
4.安神补脑胶囊中维生素B1含量测定与含量均匀度测定方法研究 [J], 吴嫣艳;周娟娟;尚姝;冯有龙
5.岗梅总皂苷含量测定方法建立及不同部位含量比较研究 [J], 彭敏桦;张敏敏;沈雅婕;赖小平;李震华;李耿
因版权原因,仅展示原文概要,查看原文内容请购买。
注射用硫酸阿米卡星生产工艺规程

注射用硫酸阿米卡星生产工艺规程目录1.适用范围 (2)2.引用标准 (2)3.职责 (2)4.产品名称及剂型 (2)5.产品概述 (2)6.处方和依据 (3)7.生产工艺流程图 (5)8.准备生产 (6)9.操作过程及工艺条件 (6)10.质量标准 (14)11.技术经济指标及计算方法 (15)12.物料平衡计算方法 (16)13.使用说明书、标签的内容详见附录样稿 (16)14.技术安全及劳动保护 (16)15.工艺卫生及区域卫生 (18)16.综合利用与环境保护 (18)17.操作工时与生产周期 (19)18.劳动组织与岗位定员 (19)19.设备一览表及主要设备生产能力 (20)20.附录 (21)1.适用范围本规程规定了注射用硫酸阿米卡星生产全过程的工艺技术、质量、物耗、安全、工艺卫生、环境保护等内容,经验证合格,符合GMP规范要求。
本工艺规程具有技术法规作用。
本工艺规程适用于注射用硫酸阿米卡星的生产全过程,是各部门共同遵循的技术准则。
2.引用标准《中华人民共和国药典》2010年版《中国生物制品主要原辅材料质控标准》(2000年版)《药品生产质量管理规范》(1998年修订)3.职责起草:生技部组织相关专业技术人员负责起草。
审批:技术总监和质量总监审核,总经理批准。
执行:各级生产质量管理人员及操作人员。
4.产品名称及剂型4.1.产品通用名称:注射用硫酸阿米卡星汉语拼音Zhusheyong Liusuan Amikaxing商品名:英文名称:Amikacin Sulfate for Injection4.2.剂型:粉针剂5.产品概述5.1.成份:本品主要成份为硫酸阿米卡星,其化学名称为O-3-氨基-3-脱氧-a-D-葡吡喃糖基-(1→6)-O-[(6-氨基-6-脱氧-a-D-葡吡喃糖基-(1→4)-N-(4-氨基-2-羟基-1-氧丁基)-2-脱氧-D-链霉胺硫酸盐5.2.分子式:C22H43N5O13·nH2SO4(n=1.8)5.3.性状:本品为白色或类白色的结晶性粉末。
一种硫酸阿米卡星注射液及其制备方法[发明专利]
![一种硫酸阿米卡星注射液及其制备方法[发明专利]](https://img.taocdn.com/s3/m/9aa170841eb91a37f0115cce.png)
专利名称:一种硫酸阿米卡星注射液及其制备方法专利类型:发明专利
发明人:廖年生,邹明明,曾文辉,胡剑
申请号:CN201811604923.2
申请日:20181226
公开号:CN109568258A
公开日:
20190405
专利内容由知识产权出版社提供
摘要:本发明涉及药物制备技术领域,具体涉及一种硫酸阿米卡星注射液及其制备方法,所述硫酸阿米卡星注射液,包括活性成分、辅料和注射用水,所述活性成分包括硫酸阿米卡星、板蓝根多糖、野菊花内酯、盐酸小檗碱和抗坏血酸;本发明中通过在硫酸阿米卡星注射液中加入板蓝根多糖、野菊花内酯、盐酸小檗碱和抗坏血酸,不仅能够提高硫酸阿米卡星注射液的稳定性,延长储存时间;还可以提高其对革兰阴性杆菌、葡萄球菌等菌种的抗菌活性,提高用药安全性。
申请人:江西润泽药业有限公司
地址:341500 江西省赣州市大余县南安镇新世纪工业园区
国籍:CN
代理机构:北京润平知识产权代理有限公司
代理人:刘兵
更多信息请下载全文后查看。
硫酸阿托品注射液工艺规程

工艺规程GY复印号: /题目:硫酸阿托品注射液工艺规程制订人:审核人:批准人:颁发部门:制订日期:审核日期:批准日期:生效日期:分发部门:质量部□生产部□设备部□综合部□物流部□溶液剂车间□凝胶剂车间□文件编写/修订历史:本文件为第二次修订目录1.产品名称、剂型、规格、批准文号 (2)2.产品概述 (2)3.标准处方及批生产量 (3)4.工艺流程图 (4)5.生产工艺操作过程及操作要求 (4)6.质量控制点 (11)7.工艺过程涉及的相关操作规程 (14)8.原辅料质量、中间产品、成品质量标准和技术参数 (15)9.卫生和环境卫生 (16)10.关键设备的验证及其工艺验证的方案 (20)11.物料平衡、原辅料的消耗定额、技术经济指标以及各项指标的计算方法 (20)12.主要生产设备一览表 (21)13.技术安全与劳动保护 (22)14.劳动组织与岗位定员 (23)15.综合利用与“三废”排放标准 (23)16.能源、动力消耗 (23)17.附录 (24)18.本工艺版本变更原因说明(空白附页) (24)19.附件 (24)工艺规程GY复印号: /题目:硫酸阿托品注射液工艺规程本工艺规程为硫酸阿托品注射液工艺规程。
工艺规程是车间和公司各职能部门必须共同遵守的技术准则,是组织和指导生产的主要依据。
车间及岗位人员、有关职能部门都要提高本部门的工作质量,从各个专业角度共同监督保证工艺规程的全面贯彻严格执行。
本工艺规程自签字批准之后第7个工作日生效。
1.产品名称、剂型、规格、批准文号、产品代码、批量产品名称:硫酸阿托品注射液汉语拼音:Liusuan a tuopin Zhusheye剂型:注射剂规格:1ml:0.5mg;1ml:5mg;2ml:1mg。
批准文号:1ml:0.5mg国药准字H51022067;1ml:5mg国药准字H51023079;2ml:1mg国药准字H51023078。
产品代码:CP008-01(1ml:0.5mg);CP040-01(1ml:5mg);CP009-01(2ml:1mg)。
硫酸阿米卡星注射液的合理给药

硫酸阿米卡星注射液的合理给药
董烽
【期刊名称】《《中国保健营养(上旬刊)》》
【年(卷),期】1998(28)2
【总页数】2页(P56-57)
【作者】董烽
【作者单位】青海省人民医院药剂科
【正文语种】中文
【中图分类】R978.12
【相关文献】
1.常用抗菌药物的给药时间及临床合理用药分析 [J], 刘湘萍
2.常用抗菌药物的给药时间及临床合理用药分析 [J], 刘湘萍
3.常用抗菌药物的给药时间及临床合理用药分析 [J], 刘湘萍
4.硫酸阿米卡星注射液的合理给药 [J], 董烽
5.基层医院1268例患者鼻饲给药合理性调查分析 [J], 欧焕娇;周健辉;胡慧琴;陈家智;曾惠芬
因版权原因,仅展示原文概要,查看原文内容请购买。
硫酸阿米卡星注射液荧光光谱特性的研究

硫酸阿米卡星注射液荧光光谱特性的研究彭启文;孔祥翔【期刊名称】《中国激光医学杂志》【年(卷),期】2007(16)4【摘要】目的研究硫酸阿米卡星注射液荧光光谱的特性。
方法用激光激发硫酸阿米卡星注射液,得到其荧光光谱,并研究其寿命及地塞米松磷酸纳对硫酸阿米卡星注射液荧光光谱的影响。
结果不同浓度下的硫酸阿米卡星注射液荧光光谱具有一定的变化规律,荧光峰位随浓度的增加而呈线性红移、荧光强度随浓度的增加按照指数规律增大;由荧光衰减曲线得到了各荧光组份的含量;地塞米松磷酸钠对硫酸阿米卡星荧光具有猝灭效应。
结论荧光光谱法可以用以测定硫酸阿米卡星注射液的浓度及荧光组份,为药物测定提供了有效途径。
【总页数】5页(P214-218)【关键词】荧光光谱;硫酸阿米卡星;寿命;猝灭【作者】彭启文;孔祥翔【作者单位】东南大学物理系【正文语种】中文【中图分类】O644.18【相关文献】1.荧光光谱法研究PS分子链在不同溶剂中的荧光特性 [J], 鲁少林;方静;韩栋;游向前;刘学清;刘继延;胡成龙2.典型食用油的荧光光谱特性与拉曼光谱特性研究 [J], 冯巍巍;付龙文;孙西艳;田小雪;王传远;熊华;李延斌;陈令新3.稀土配合物的时间分辨荧光光谱法研究(Ⅱ)——Eu,Sm-DBM-TOPO体系的荧光衰减动力学特性和激光诱导时间分辨荧光光谱 [J], 胡继明;陈观铨;曾云鹗4.基于荧光光谱技术研究增效肥料对土壤富里酸荧光特性的影响 [J], 胡钰;魏丹;李艳;王伟;白杨;金梁;蔡姗姗5.激光诱导荧光光谱分析法研究Ⅳ.钐-三氟乙酰丙酮-三正辛基膦化氧-浓乳-100的荧光特性研究及应用 [J], 胡继明;陈观铨;曾云鹗因版权原因,仅展示原文概要,查看原文内容请购买。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
主题内容与适用范围
1. 本标准在小容量注射剂工艺规程通则的基础上,规定了硫酸阿米卡星注射液的处方与依据,
原辅材料,中间产品,成品质量标准,半成品的检验方法和控制,原辅材料的消耗定额等内容.
2. 本标准适用于硫酸阿米卡星注射液的生产质量控制及检查。
产品名称、剂型、规格
1. 产品名称:
1.1. 通用名称:硫酸阿米卡星注射液
1.2. 汉语拼音:Liusuan Amikaxing Zhusheye
1.3. 英文名:Amikacin Sulfate Injection
2. 剂型:注射剂
3. 规格:2ml:0.2g
4. 性状:本品为无色或微黄色的澄明液体。
产品处方和依据
1. 处方:
硫酸阿米卡星0.1kg(以阿米卡星计)
亚硫酸氢钠 2.5g
活性炭1~3‰
注射用水适量
全量1000ml
2. 依据:中国药典2005年版二部
3. 批准文号:国药准字H37021465
4. 安瓶质量要求:玻璃安瓶应为中性安瓶.外观,尺寸,折断力应符合小容量注射剂工艺规程通则要求. 4.1 安瓶精洗:注射用水终端经0.22μm聚砜滤器滤过。
4.2 滤器要求: 除炭过滤(5μm钛棒),粗滤(5μm钛棒),保证过滤(0.45μm聚砜)精滤(0.22μm聚砜).
5. 药液配制
5.1. 根据配制量,向浓配罐内注入配制总量1/2的90℃左右的注射用水,打开入料口盖向上反放稳妥.
5.2. 向盛有亚硫酸氢钠的桶内注入适量注射用水,以溶解亚硫酸氢钠。
5.3. 启动搅拌电源开关进行搅拌,边搅拌边将称好的硫酸阿米卡星原料缓慢加入浓配罐中溶
解。
注意不要把原料撒在加料口。
把溶解后的亚硫酸氢钠溶液倒入罐内,加入称量好的活性炭,把盛放原料的不锈钢桶用注射用水冲洗两遍,冲洗水倒入罐内。
5.4. 投完料关闭机械搅拌,用洁净工具在投料罐之处手工搅拌5~6分钟(防止浓配罐底原料
堆积结块),启动机械搅拌,转入机械自动搅拌。
5.5. 关闭机械搅拌,关紧所需进料的稀配罐底出料口阀门,打开进料口阀门,打开浓配罐底
放料口阀门。
5.6. 启动浓配输液泵,将浓配液送入稀配罐中,药液全部进入稀罐时关闭输液泵。
5.7. 向清洗球内通入注射用水冲洗浓配罐内壁的残存药液,待冲洗水约总体积的1/5时,关
闭冲洗水,再找开输送阀将冲洗水打入稀配罐,关闭输送泵。
同法再洗涤两次,洗涤水全部打入稀配罐。
5.8. 启动稀配罐搅拌电源,边搅拌边加注射用水至适量时,关闭搅拌。
5.9. 适当控制注射用水进量,待药液达到要求配制量时,关闭进水阀。
5.10. 打开夹层进水阀进行降温处理,降至40℃。
5.11. 关闭精滤阀,打开回流阀,启动搅拌电源,打开回流泵,让药液通过粗滤器循环15分钟.
5.12. 填写半成品请验单,请化验员取样化验。
5.13. 化验员取无水洁净玻璃瓶,用药液荡洗玻璃瓶3~5次,并冲洗瓶盖2~3次。
用一容器
接取冲洗药液作报废处理。
在稀配罐加料口取药液适量,盖塞,送化验室进行半成品检测。
半成品PH值5.5~6.0,含量95.0%~105.0%,成品4.0~7.0,含量90.0%~110.0%。
6. 装量限度:每支安瓿装量不得低于标示装量。
7. 安瓿充气种类及要求:氮气,纯度≥99.9%;充气速率4L/分钟。
8. 灭菌要求:灭菌程序100±1℃30分钟。
9. 贮藏:密闭,在凉暗处保存。
10. 有效期:2年半。
原辅材料质量标准
成品和半成品质量标准
1. 中间产品质量标准:
2.半成品质量标准
标准依据:中国药典2005年版二部
标准依据:中国药典2005年版二部
原辅材料的消耗定额
物料平衡计算方法
1. 配制工序:
实际配制量滤器储存
转交灌封药液数量+
×100%
2. 灌封工序:
()()
%
100
/
⨯
÷
+
支
配制转交量
支
不合格品数
支
灌封合格品数
ml
3. 灯检工序:
%100⨯+灭菌转交数
不合格品数
灯检合格品数
4. 印字包装工序:
%100⨯+灯检转交数
破损数
包装完成数
附录
1. 有关计算公式:
1.1. 药液稀释公式(两种方法):
1.1.1. 应加水体积=(测得标示量的%数-拟补到标示量的%数)×配制药液的ml 数 1.1.
2. 应加水体积=要求稀释体积-实际药液体积
要求稀释体积=
要求稀释百分含量
实际百分含量
×实际药液体积
1.2. 补加原料计算公式: 补料量(g ) =
原料实际含量
药液百分含量
补配液体积)(实配液体积测得标示量的拟补到标示量的⨯+⨯-)(%)%(ml
2. 常用法定计量单位:
2.1. 容量:ml 表示:1L=1000ml 1升=1000毫升 2.2. 重量:g 表示:1kg=1000g 1公斤=1000克
1g=1000mg 1公斤=1000克
2.3. 压力:Pa(帕) Kpa (千帕) MPa (兆帕)
注:1atm (标准大气压)=760mmHg 柱=101.3kPa 1mmHg=133.322Pa 0.1MPa=1kg/cm 2 1Pa=7.5×10-3mmHg 1atm=1.031g/cm 2
2.4. 标准溶液浓度:mol/L (摩尔/升) 2.5. 温度:“℃”(摄氏度)
2.6. 百分比“%”纯度百分比系指重量的比例(g/g )
溶液的百分比系指100ml 溶液含溶质的克数(g/ml )。
