有机化学 14第14章_含氮有机化合物
医用化学 第十四章 含氮有机化合物

易溶于水,不易溶于非极性溶剂。 季铵碱的命名和“碱”的命名相同。 [(CH3CH2)4N]+OH- 氢氧化四乙铵 [HO-CH2CH2-N(CH3)3]+OH氢氧化三甲基-2-羟基乙铵(胆碱)
化学工业出版社
第二节 酰胺
一、酰胺的结构和命名
CH2 NH2
苯胺
甲胺
乙胺 苯甲胺(苄胺)
化学工业出版社
2.氮原子上连有两个或三个烃基的胺, 在“胺”字前加上烃基的名称和数目。
(1)如果所连烃基相同,用数字“二” 或“三”表示烃基的数目。
CH3
NH
CH3CH2 NH CH2CH3
H3C N CH3
二苯胺
二乙胺
三甲胺
化学工业出版社
(2)如果所连烃基不同,则把简单的烃基名称 写在 前面,复杂的烃基名称写在后面。如
N-甲基-N-乙基苯胺 N,N-二甲基苯胺 3-甲基-N,N-二甲基苯胺
化学工业出版社
课堂练习
命名下列化合物
C2H5 N C2H5 C2H5
NHCH3
N(CH3) 2
CH3 NH2
CH3 N CH2CH3
化学工业出版社
(四) 胺的性质
1、 物理性质: 胺和氨一样是极性分子。伯胺、仲胺分子间都可 形成分子间氢键,沸点比分子量相近的烷烃高,比相 应的醇和羧酸低。低级胺能与水形成氢键而易溶于水, 随着相对分子量的增加,溶解度降低。 芳香胺是无色液体或固体,有特殊臭味,有毒, 使用时应予注意。
化学工业出版社
2、胺的化学性质
胺与氨相似,氮原子上都具有孤对
电子,所以它们的化学性质有相似之处。
有机化学第十四章含氮化合物

Z=O R XC RO
A、由于酰胺一般为晶体,且有固 定熔点,因此通过测定熔点可以推 测原来的胺,即用于伯胺、仲胺的 鉴别。
注意:
B、由于酰胺在强碱、强酸中易水解,且不易氧化,因此在有机合成中,往往 把芳胺酰化变成酰胺,保护氨基NH2,例如:
例如:由苯胺合成邻硝基苯胺(练习)
COX +
NH2 NHCH3
130
OH NO2
Cl NO2
NO2 NO2 Cl NO2
NO2
NaHCO3/H2O
100
NaHCO3
35
OH NO2
NO2
OH
NO2
NO2
NO2
Cl NO2
Cl
问题:下列化合物中那一个氯原子易发生亲核取代反应?
硝基使卤苯易水解、氨解、烷基化
OH
OH
1
NO2 pKBa、使9酚.8或9羧酸酸性增 7.15
物理测试表明,两个N-O键键长相等, 这说明硝基为P-π共轭体系(N原子是 以sp2杂化成键的,其结构表示如下:
O 二、硝基化合物O 的化学性质
R实N 验结果证明:(1)硝基有对R 称 N 结构;O
O
1.两个N-O键相 等 (0.121nm);
2.N原子SP2杂化, N原子的P轨道 与两个O原子 的P轨道侧面平 行重叠形成三 中心四电子的 大П键 。
其缩合过程是:硝基烷在碱的作用下脱去α- H形成碳负离子, 碳负离子再与羰基化合物发生缩合反应。
与HNO2反应-----鉴别伯、仲、叔N硝O基H化合物
NaOH
RCH2NO2
RC
(硝肟酸)
NO2
红色
R2CHNO2 HNO2
RCH2NO2 +HONO
第十四章含氮有机化合物

第十四章含氮有机化合物学习要求1 •掌握芳香族硝基化合物的制法,性质。
理解硝基对苯环邻对位取代基(质的影响。
x、OH )性2 •掌握胺的分类、命名和制法。
3 •熟练掌握胺的性质及胺的碱性强弱次序,理解影响胺的碱性强弱的因素。
4 •掌握区别伯、仲、叔胺的方法及氨基保护在有机合成中的应用。
5 •掌握重氮盐的反应和偶联反应在有机合成中的应用。
6・了解季鞍盐、季鞍碱的性质和应用,初步了解偶氮染料。
7•学习、掌握重要的分子重排反应。
分子中含有C-N键的有机化合物称为含氮有机化合物。
简单讨含氮有机化合物种类很多,本章论硝基化合物,重点讨论胺、重氮盐和分子重排反应。
§ 14-1硝基化合物硝基化合物一般写为R-NO2 , Ar-NO 2 不能写成R-ONO (R・ONO表示硝酸酯)一、分类、命名、结构1 •分类(略)2 •命名(与卤代疑相次似)3 •硝基的结构一般表示为N: ; Q (由一个N=o和一个N TO配位键组成)物理测试表明,两个N — O键键长相等,这说明硝基为sp^杂化P- n共馳体系(N原子是以成键的,其结构表示如下:例如:R_CH2-N—OH NaOHR-CH =N[° | Na*R-CH ——N ___ ”- 01O- O- 假酸式(主) 酸式(较少)(3)与拨基化合物缩合有a ・H 的硝基化合物在碱性条件下能与某些拨基化合物起缩合反应。
o-OH HR-CH2 N°2+ RfH 一…RQ 1C -N °2空 R *_ C AAC -NO 2H R *(FT)HR ,_(FT)(R n )碳负离子再弓拨基化合其缩合过程是:硝基烷在碱的作用下脱去a・H 形成碳负离子,物发生缩合反应。
______________ NaOHR-CH-NO2 R —C —NO2 Na 十 1 1 NO NO 蓝色结晶 溢干NaOH 呈红危溶沛NaOHR2-C-NO2不溶于NaOH 蓝色不变NO 蓝色结晶第三硝基烷与亚硝酸不起反应。
课件有机化学第14章 含氮化合物

第十四章含氮化合物Nitrogen Compounds1CONTENT1 2 3 4 5 6硝基化合物 胺的结构和物理性质 胺的制备 胺的化学性质 季铵盐化合物 重氮与偶氮化合物214.1 硝基化合物硝基化合物的结构(了解)O R N O R NO O3α-H 的反应CH3(CH2)7CHO + CH3NO2 NaOH CH3CH2OH OH CH3(CH2)7CHCH2NO2O CH3NO2 NaOH CH2NO2 RCHORCHCH2NO2 CH3CH2OH OH RCHCH2NO24硝基化合物的还原反应CH 3 NO 2 CH 3 H 2/ Ni 87 ~ 90% NH 2CH(CH 3)2 CH 3 NO 2CH(CH 3)2 CH 3 NH 2Fe / HCl EtOH,常用 常用 Fe // HCl HCl Fe Zn // HCl HCl ZnNO 2 NO 2 SnCl2 浓 HCl CHO74% NH 3NH 2 NH 2 NaOH5CHOCHONa2S, NaSH, (NH4)2S, NH4SHNO2 NaSH EtOH, NO2 79 ~ 85% NH2 NO2 H2S, NH4OH EtOH, NO2 52 ~ 58% NO26NH2NO2 NH2 NH2ExampleCl 10% NaOH 135~160℃ NO2 Cl NO2 NO2 Na2CO3, H2O 100℃ NO2 Cl O2N NO2 H2O H+ O2N NO2 OH NO2 OH H+OH H+NO2NO2NO2714.2 胺的结构和物理性质SP3 N R1 R2 R3N H HROH R2O RNH2 R2NH R3N 胺8H2O NH3胺的命名和物理性质(自学)CH3 CH3 C OH CH3叔醇CH3 CH3 N CH3叔胺CH3 CH3 C NH2 CH3伯胺CH3NH2(CH3)2NH(CH3)3N伯胺(一级胺) 仲胺(二级胺) 叔胺(三级胺)914.3 胺的制备1. Gabriel 合成法O NH O O N R O H+ or OH H2O RNH2 + KOH EtOH NK O CO2H CO2H10O R X注意事项•重氮盐是无色晶体,在干燥条件下不稳定,爆炸性强•重氮盐一般不溶于有机溶剂,可溶于水,其水溶液呈中性,在水溶液中发生离子化,溶液具有导电性•重氮化反应要在酸性条件下进行,酸的用量一般为1:1.530作业•P315: 14.2•P318: 14.6•P323: 14.8•P324: 14.9习题•P342: 6(3)(6), 7 (3)(4)(5) , 13(3).38。
曾昭琼《有机化学》(第4版)课后习题(含氮有机化合物)【圣才出品】
2 / 12
圣才电子书
十万种考研考证电子书、题库视频学习平 台
6.完成下列反应: (1)
N H (2)
(1)CH3I(过 量 )
CH3
?
加热
( 1) CH3I ?
?
(2)Ag2O,H2O
( 2)Ag2O,H2O
( 3) 加 热
CH3
CH3
Fe+HCl
(CH3CO)2O ?
(2) (3)
12.从甲苯或苯开始合成下列化合物: (1)间氨基苯乙酮 (2)邻硝基苯胺 (3)间硝基苯甲酸 (4)间溴甲苯
H2N (
COOCH2CH2NEt 2 );
7 / 12
圣才电子书
十万种考研考证电子书、题库视频学习平
台
NO2
(4)由简单的开链化合物合成
CH3
答:(1)
(2) 2HBr H2O2
HOH
(3)
Br 2 Na CN
Br
C OH O
C OH
CN Na
CN C2H5OH
COOH
(2)氯苯可以直接硝化生成 2,4-二硝基氯苯,但 2,4-二硝基氯苯因两个硝基的吸电 子作用,使其很易水解,生成 2,4-二硝基苯酚,所以得不到 2,4-二硝基氯苯的产物。
9.请判断下述霍夫曼重排反应能否实现,为什么?
答:不能实现,霍夫曼重排反应只能发生在氮原子上无取代的酰胺。
10.从指定原料合成: (1)从环戊酮和 HCN 制备环己酮; (2)从 1,3-丁二烯合成尼龙-66 的两个单体——己二酸和己二胺; (3)由乙醇、甲苯及其他无机试剂合成普鲁卡因
5 / 12
CH3 N
CH2CH2COOEt
有机化学课件(李景宁主编)第14章-含氮有机化合物

硝基化合物的命名: 以烃为母体,硝基 作取代基
CH3
CH3CH2NO2
CH3 CH CH3
CH3 C NO2
硝基乙烷 nitroethane (1°,伯)
NO 2
2 –硝基丙烷
2-nitropropane (2 °,仲 )
CH3 2 –甲基-2-硝基丙烷 2-methyl-2-nitroprppane
Compounds CH3NO2
MW.
61
b.p.(℃)
101
CH3COCH3 CH3CH2CH2OH
58
60
56.5
97.2
芳香族硝基化合物:无色或淡黄色高沸点液体或固体; 有苦杏仁
味。不溶于水,溶于有机溶剂。
多硝基化合物:是黄色晶体,多硝基化合物通常具有爆炸性,
可用作炸药。叔丁基苯的某些多硝基化合物具有类似天然麝香的 气味,可用作香料
O R CH N
Na
O
O
酸式 (较少)
结论:脂肪族含有α-氢原子的伯或仲硝基化合物能逐渐溶 于NaOH溶液中而生成钠盐。
(3)与羰基化合物缩合
有α- H的硝基化合物在碱性条件下可以发生类似于羟醛缩 合、克莱森缩合等反应以及Michael反应。
O C H3NO 2 + 3 H C H HO
C H2O H
OH
卤原子邻对位有吸电子基团时,如硝基,对苯环的亲核取代
反应有活化作用:
Cl
OH
Na2CO3 H+
130o
NO2 Cl
NO2 OH
NO2 Na2CO3 H+
100 o
reflux NO2
Cl
NO2
NO2 OH
第十四章 有机含氮化合物

NH2
-
-CHO O NHC-CH3
-
H2 / Ni
NO2 NO2 -NO2 或(NH4)2S
NH4SH
NH2 NH2 -NO2
-
-
四、胺的物理性质和光谱性质
1. 物理性质
① 状态 甲胺、二甲胺、三甲胺、乙胺常温下为气态。 丙胺以上为液态。 ② 气味 低级胺有氨味或鱼腥味 如: 甲胺、二甲胺—— 氨味 三甲胺、乙胺—— 鱼腥味
NH 2
按氨基数目不同分
RNH2
一元胺
H2NRNH2
二元胺
2. 命名 NH3 -NH2 —— 氨 —— 氨基
R-NH2 、R2CHNH2 、 R3CNH2 ——胺 R-NH- 、R2N- ——胺基 含有四个R 或H 的胺正离子为铵
R4N Cl
+
-
简单胺 由简单烃基组成的胺,按其所有含烃基的名称命名为某胺
三、胺的制法
1. 氨或胺的烃基化
① 脂肪胺 NH3 + R-X R-NH3 + X OH R-NH2 + H2O + R-NH2-R + X OH R2-NH +H2O
+
-
R-NH2 + R-X 醇也可用作烷基化剂:
CH3 OH + H NH2
Al2O3
CH3NH2 + H2O
CH3OH Al2O3,
生理或药理作用。例如:
N CHOHCHCH3 NHCH3 H OOCCH CH2OH CH3
阿托品
麻黄碱
一、胺的分类与命名
1. 分类
按氨所连烃基数目分
R-NH2 R-N-H R
有机化学(第五版)下册课后答案 李景宁
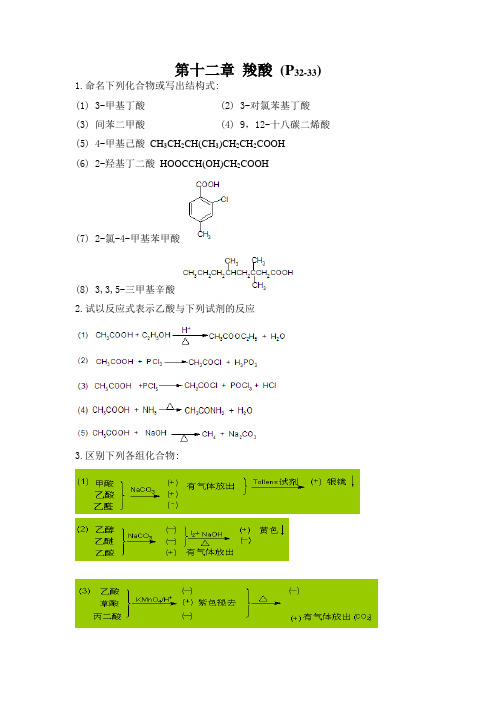
第十二章羧酸(P32-33) 1.命名下列化合物或写出结构式:(1) 3-甲基丁酸 (2) 3-对氯苯基丁酸(3) 间苯二甲酸 (4) 9,12-十八碳二烯酸(5) 4-甲基己酸CH3CH2CH(CH3)CH2CH2COOH(6) 2-羟基丁二酸HOOCCH(OH)CH2COOH(7) 2-氯-4-甲基苯甲酸(8) 3,3,5-三甲基辛酸2.试以反应式表示乙酸与下列试剂的反应3.区别下列各组化合物:4.指出下列反应的主要产物:(第四版保留)(1)C6H5CH2Cl 干醚MgC6H5CH2MgCl(1) CO2(2) H2OC6H5CH2COOH SOCl2C6H5CH2COCl 4.完成下列转变:5、怎样由丁酸制备下列化合物?6、解:7、指出下列反应中的酸和碱。
按lewis酸碱理论:凡可接受电子对的分子、离子或基团称为酸,凡可给予电子对的分子、离子或基团成为碱。
8.(1)按酸性降低的次序排列下列化合物:①酸性: 水>乙炔>氨;②酸性: 乙酸>环戊二烯>乙醇>乙炔(2)按碱性降低的次序排列下列离子:>>①碱性:CH3HC C CH3O②碱性:(CH3)3CO>(CH3)2CHO>CH3O9. 解:化合物A有一个不饱和度,而其氧化产物B含有两个不饱和度。
产物DC5H10有一个不饱和度。
从题意可知:D的结构式可能为环戊烷;C的结构为环戊酮;B的结构为己二酸;A的结构式为环己醇。
10.解:(1)由题意:该烃氧化成酸后,碳原子数不变,故为环烯烃,通式为CnH2n-2。
(2)该烃有旋光性,氧化后成二元酸,所以分子量=66*2=132。
故二元酸为CH3CH(CH2COOH)COOH11.由题意:m/e=179,所以马尿酸的分子量为179,它易水解得化合物D和E,D 的IR谱图:3200-2300cm-1为羟基中O-H键的伸缩振动。
1680为共扼羧酸的>C=O的伸缩振动;1600-1500cm-1是由二聚体的O-H键的面内弯曲振动和C-O 键的伸缩振动之间偶合产生的两个吸收带;750cm -1和700cm-1是一取代苯的C-H 键的面外弯曲振动。
有机化学课件(李景宁主编)第14章_含氮有机化合物习题

浓 NaOH CHO + CHO + CH 3 KMnO 4 KOH N K COOH COOH N COOH COOH KMnO 4 N O CH 2OH 稀 OH
-
+ O COOH
CH 3COCH 3
O
CH=CH COCH 3
碳水化合物
一、三个单糖和过量苯肼作用后,得到同样晶形的脎,其中一个
CHO
3、化合物A(C8H17N)其NMR中无双峰,A与2molCH3I反应后再与 湿的Ag2O作用,并加热生成B(C10H21N),再重复以上反应则生成 三甲胺及1,4—辛二烯和1,5—辛二烯,给出A、B 的结构并写出有 关反应方程式。
4、化合物A(C6H13O2N)有旋光性,A与HNO2作用放出N2,与 NaHCO3作用放出CO2,A与HNO2的水溶液作用生成B(C6H12O3), B仍有旋光性,B与浓H2SO4作用于脱水生成C(C6H10O2),C能使 KMnO4溶液褪色,与酸性KMnO4作用并加热则生成草酸和2—甲基丙 酸,写出A、B各对映异构体的Fisher投影式,并用R/S命名法命名, 写出C的结构式。
A 伯胺
B 仲胺
C 叔胺
D 都可以
)
7、下列化合物能溶于稀盐酸的是( A 苯胺 B 苯酚 C 苯甲酸
D 乙酰苯胺
8、下列化合物碱性最强的是( ) A CH 3COO-+NH4 C CH3CONH2 A 5%盐酸水溶液 B CH3(CH2)3NH2 D H2NCH2COOH ) D银氨溶液 B 苯磺酰氯和NaOH C 乙酸酐
9、能区分苯胺和N-甲基苯胺的是(
10、反应C6H5NH2 + H2SO4(1mol) A
SO3H NH2
含氮有机化合物和杂环汇总

CH3NHCH2CH3 甲乙胺 (仲胺) 甲基-乙基-环丙基 H 3C N CH2CH3 胺(叔胺)
6
NHCH 3
N-甲基苯胺
邻-甲基苯胺 N-甲基-N-乙基 苯胺
7
NH 2 CH3
N CH3 CH2CH3
CH2NH 2
+ NH 3 Cl
苯甲胺(苄胺) 氯化苯铵 溴化四甲铵
-
(CH3)4N Br
31
第二节 重氮化合物 和偶氮化合物
重氮化合物 R-N=N(Ar)
偶氮化合物
R-N=N-R’ (Ar)
32
重氮化合物的化学性质 1.重氮基取代反应(放氮反应)
33
OH
+
N2
H
+
3 PO 2+ H 2O
O H2
/ △
N2
N2
N) 2 C ( u 2 C N KC
+
Cu
2X 2
+H
X
CN N2
X
+
27
(3) 叔胺和亚硝酸反应
N(CH3)2
N(CH3)2
+ HNO2
N O
28
鉴别:
伯胺 脂 肪 族 仲胺
HNO2
N2 黄色油 状物
叔胺
溶解
29
五.与医学有关的胺类
苯胺
NH 2 + 3Br2(水)
Br Br NH 2 Br + HBr
白
30
ห้องสมุดไป่ตู้
拓展
“新洁尔灭”
溴化二甲基十二烷基苄基铵,又称苯扎溴 铵(C6H5CH2N+(CH3)2C12H25Br-),商品名为 “新洁尔灭”。它为季铵盐型阳离子表面活性 广谱杀菌剂,杀菌力和去垢效力强,对皮肤和 组织无刺激性,对金属、橡胶制品无腐蚀作用, 不污染衣服,性质稳定,易于保存,属消毒防 腐类药物。1:1000~2000的新洁尔灭溶液广泛 用于手、皮肤、粘膜、器械等的消毒。
含有氮元素的有机化合物就称为含氮有机化合物如我们学

§14· 1 硝基化合物
一、硝基化合物的命名和结构
1、
分类:
1>、据分子中–NO2的数目:分为一元和多元硝基 化合物。 2>、据与– NO2直接相连的碳原子的种类:伯、仲、 叔硝基化合物。
3>、据与– NO2相连的烃基的种类:脂肪族硝基化 合物和芳香族硝基化合物。
2、 命名:
硝基化合物的通式为R – NO2。命名与卤 代烃相似; – NO2只作取代基。如: 硝基甲烷、2 –硝基丙烷、4 –硝基甲苯、 硝基苯 3、 结构: N为SP2杂化, – NO2为共扼体系,与亚硝 酸酯R – ONO互为同分异构体。
1、 物理性质:沸点比相应的卤代烃高,有 毒,蒸汽可渗透皮肤;芳香族硝基化合物中, 除一元硝基化合物是高沸点的液体外,一般 为无色或黄色结晶体;多硝基化合物有爆炸 性。 2、 脂肪族硝基化合物的化学性质: 1>、还原:可催化加氢,也可用Fe/HCl等还 原。
如: RNO2+3H2
RNH2+H2O
2>、酸性:硝基化合物的a-H具有酸性,
—CH2N(CH3)2
H2O2
160℃
=CH2 —CH2N(CH3)2 O– 7、芳胺的特性:-NH2是第一类基,使苯环活 化。 1>、氧化:苯胺被二氧化锰氧化就成对苯醌; 苯胺也容易被空气中的氧所氧化。
2>、卤代:
NH2 Br NH2 Br
+3 Br2
Br NHCOCH3 + 3Br2 (白 ↓ )
LiAlH4
RCH2NH2 RNH2 CHNH2
H2
NaOBr
3、 还原氨化:
C
O
+NH3
–H2O
C
有机含氮化合物第14章

NH2
(HOCH2CH2)3N
¡¡¡© «
复杂的胺则以烃作为母体,氨基作为取代基。
CH3 NH2 CH3-CH-CH2-CH-CH2-CH3
2-¡¡-4-©¡¡¡ ¬ù ªù é
CH3 CH3 CH3-CH-CH2-CH-N-CH2-CH3 CH2-CH3
2-¡¡-4-(¡¡©¡)¡¡ ¬ù ¡ ªù ì é
NaNO2 + HCl
HO-N=O + NaCl
亚硝酸
脂肪伯胺与HNO2反应生成极不稳定的脂肪重氮盐。
R-NH2 NaNO2 HCl
R N N Cl
脂肪重氮盐
+
-
N2 ↑ + R+ + Cl醇、烯、卤烃等混合物
该重氮盐即使在低温下也会立即分解放出氮气,并 有醇、烯及卤代烃等混合物的形成。
HO-N=O + H +
一 芳香族硝基化合物的化学性质
(1) 芳环的亲核取代反应
芳环上连有硝基时,不易进行亲电取代反应,但可 发生亲核取代反应。
OCH3 NO2 NO2
Cl NO2 NO2
(1) Na2CO3 , H2O, 100 C (2) H2O, H+
o
NHPh + PhNH2
180o C ~80%
NO2 NO2
R' 快速翻转 N R R' R" R N "R R' R" N R
对映关系,无旋光性
由于转化所需的活化能较低(约 25kJ/mol),简单的手性胺不能分离 得到其中某一个对映体:
R1 手性中心
N N 无法翻转,有旋光性 R4
N R2 R3 无法翻转,有旋光性
14含N化合物

硝基化合物
二、性质
(三)芳香族硝基化合物的化学性质
2.硝基对苯环上其它基团的影响
(2) 对酚酸性的影响
OH - OH - -NO2 OH - - NO2 7.15 OH - -NO2 - NO2 4.0 OH - O2N- -NO2
- NO2
0.38
PKa
9.89
8.40
胺
一、胺的分类和命名
分类:胺可以被看作为是NH3的烃基衍生物。 氨中的H被一个、二个或三个烃基取代则分别生成伯、仲、 叔胺(或称第一、二、三胺)。 NH3 RNH2 R2NH R3 氨 伯胺 仲胺 叔胺 一级胺 二级胺 三级胺
[RN+H3] [OH-] [RNH2]
Kb =
pKb = - LgKb
NH3 pKb 4.75 所以有:
烷基胺 芳胺 3~5 9~10 烷基胺 > 氨 > 芳胺
胺
1.碱性
四、胺的化学性质
由于烷基是+I的基团,理论上烷基胺的碱性次序应为:
(CH3)3N
(CH3)2NH
>>
(CH3)2NH
>
CH3NH2
二、性质
(二)脂肪族硝基化合物的化学性质
R CH NO2 NO 硝肟酸蓝色结晶
溶于NaOH 呈红色溶液
R2 CH NO2 + HONO
R2 C NO2 NO 假硝醇蓝色结晶
不溶于 NaOH 蓝色不变
第三硝基烷与亚硝酸不起反应。 此性质可用于区别三类硝基化合物。
硝基化合物
1.还原
二、性质
(三)芳香族硝基化合物的化学性质
和
NHOH -
所以它们不能分离出来
硝基化合物
第十四章 含氮有机化合物

硝基乙烷
2-硝基丁烷
2-甲基-2-硝基丁烷
(伯硝基化合物,1°) (仲硝基化合物,2°) (叔硝基化合物,3°)
2、命名:以烃基为母体,硝基为取代基
14-3
一、硝基化合物的分类、命名和结构
3、结构
用物理方法测得有关硝基化合物的结构证明:
(1)硝基有对称结构;(2)两个N-O键相等(0.121nm);
Cl NO2 Na2CO3
OH NO2
Cl
OH
O2N
NO2 Na2CO3 O2N
NO2
130 oC
35 oC
NO2
NO2
随着邻对位-NO2数目的增加,反应所需的条件逐渐降低,即卤
素越来越容易取代。
Cl
OH
-NO2处于间位,则不能产生类
NO2 NaOH
NO2
似的活化效应。
Cl
Cl
14-13
(二)硝基对芳环影响
14-17
三、硝基化合物的化学性质
(三)硝基的还原反应
Fe(orSn)+HCl
Zn+NH4Cl+H2O
NO2
As2O3+NaOH
Zn+NaOH
NH2
苯胺
NHOH
N-羟基苯胺
N=N+ O- 氧化偶氮苯 Fe(orSn)+HCl
N=N
偶氮苯 Zn+NaOH
NH-NH
氢化偶氮苯
NH2
苯胺
14-18
第二节 胺 类
“二、三”等数字表示氨基的数目。
CH3CHCH2CH2CH2NH2 1,4-戊二胺 NH2
芳香胺的命名以苯胺为母体,将取代基的位 次及名称写在母体名称前。
有机化学第十四章含氮芳香化合物

H3C
N2 X
H3C
NH2
H3C
NO2
H3C
或
格氏试剂法
H3C
COOH
H3C
MgX +
CO2
•合成路线(重氮盐法)
HNO3 H2SO4 Fe HCl
H3C
H3C
NO2
H3C
NH2
除去邻位产物
NaNO2,HCl 0-5 C
o
H3C
N2Cl
CuCN
H3C
CN
H2O / H+
H3C
COOH
Br
例 3:
芳环 • 氨基的活化亲电 取代反应易进行 • 使苯环易被氧化
R
一.重氮盐(Diazonium salts)及其反应
重氮盐的制备
NaNO2 / HCl Ar NH2 0 5 C
o
Ar
N2 Cl
重氮盐
现制现用 • 温度升高易水解成酚 • 干燥时易爆炸
重氮盐的反应类型
• 取代(主要反应)
1. 重氮盐的取代反应
第十四章
含氮芳香化合物(1)
主要内容:
芳香族硝基化合物及其性质
三类含氮芳香族化合物
Ar N2 X
重氮盐
Diazonium salts
Ar NO2
芳香族硝 基化合物 Aryl nitro compoumds
Ar NH2
芳香胺 Arylamines
一. 芳香族硝基化合物
重要的化工原料
Ar
Br Br
间三溴苯
•直接溴代,得不到目标产物
Br2 Fe Br Br2 Fe Br Br Br + Br
有机化学课件第十四章

对氨基苯甲酸乙酯
氢氧化(2-羟乙基 三甲铵(俗名胆碱 俗名胆碱) 氢氧化 羟乙基) 三甲铵 俗名胆碱 羟乙基
§14—2 14—
1. 脂肪胺 脂肪胺: (1) )
胺的结构
sp3 N H3C
112.9 H
o
N为SP3杂化, 杂化, 为
105.9
o
不等性)杂化。 是(SP3不等性)杂化。
4. 季铵化合物:将负离子和取代基的名称放在“铵”字前 季铵化合物:将负离子和取代基的名称放在“ R4N+ X- 卤代四某铵;(CH3)4NCl 卤代四某铵;
[(CH3)2CH]4N+I-
氯代四甲铵 碘化四异丙铵
R4N+ OH- 氢氧化四某铵;(CH3)4NOH 氢氧化四甲铵 氢氧化四某铵;
H2NCH2CH2NH2
NH2 CH3CHCH2CHCH2NH2 CH3
CH3
H2NCH2CHCH2NH2
CH3 CH3
2-甲基 ,4-戊二胺; 甲基-1, 戊二胺 戊二胺; 甲基
CH3 CH3 N—CH2—N CH3 CH3
1,2-丙二胺; , 丙二胺 丙二胺;
1, 2, 3-苯三胺; 苯三胺; 苯三胺
N,N,N’,N’-四甲基甲二胺; 四甲基甲二胺; 四甲基甲二胺
季铵化合物: 季铵化合物:氮原子上连有四个不同基团的季铵化合物具 有旋光性, 有旋光性,
CH3 N H5C2
+
CH3 ph CH2=CHCH2 N+ C2H5
ph CH2CH=CH2
§14—3 14—
胺的物理性质
1.状态 甲胺、二甲胺、三甲胺、乙胺为气体。 状态: 甲胺、二甲胺、三甲胺、乙胺为气体。 状态 其它低级胺为液体。 其它低级胺为液体。 高级( > )胺为固体。 高级(C>12)胺为固体。 2. 气味:低级胺臭味。三甲胺为臭鱼味;丁二胺(腐胺)、戊胺 气味:低级胺臭味。三甲胺为臭鱼味;丁二胺(腐胺)、 )、戊胺 尸胺)是蛋白质腐败的气味。 (尸胺)是蛋白质腐败的气味。 3. 沸点: 沸点: 醇> 10 胺> 20胺> 30 胺 > 醚>烷
李景宁《有机化学》(第5版)(上册)配套题库[章节题库](含氮有机化合物)
](https://img.taocdn.com/s3/m/c7b9137a647d27284b735183.png)
第14章含氮有机化合物一、选择题1.下列胺中,碱性最大的是()?【答案】(b)2.下列化合物在水中溶解度最小的是()。
A.甲胺B.二甲胺C.三甲胺【答案】C3.邻甲氧基氯苯在NaNH2作用下生成()。
【答案】D4.不能与发生偶联反应的是()。
A.苯B.苯酚C.间苯二酚D.N,N-二甲基苯胺【答案】A5.下列化合物中碱性最弱的是()。
A.甲胺B.胺C.吡啶D.苯胺【答案】D6.下列化合物在水溶液中碱性最强的是()。
【答案】A7.相同分子量的正丙胺和三甲胺的沸点相差近46℃,前者比后者沸点高的主要原因是()。
A.正丙胺存在分子间氢键B.正丙胺的极性大C.三甲胺的结构接近球形D.正丙胺是直链化合物【答案】A8.下列化合物中碱性最强的是()。
【答案】A9.对于下列化合物碱性最强的是(),最弱的是()。
A.对氨基苯乙酮B.DMF C.吡啶D.苯胺E.三甲胺【答案】E;B二、填空题1.按碱性由强到弱的顺序排列下列化合物:。
①苯胺②乙胺③二乙胺④二苯胺【答案】③>②>①>④【解析】脂肪族胺的碱性大于芳香族胺。
2.下列化合物碱性由大到小的顺序是。
A.二甲苯胺B.苯胺C.对甲苯D.对溴苯胺【答案】C>B>A>D3.。
【答案】【解析】胺类化合物与羰基化合物的反应,分子内发生两次。
三、简答题1.A.邻甲苯胺B.N-甲苯胺C.苯甲酸D.邻羟基苯甲酸答:方法一:方法二:2.。
答:顺-4-甲基环己胺。
3.某化合物A,分子式为,其谱没有双重峰,它与反应,然后与湿的氧化银作用,接着加热生成中间体B,其分子式为,B进一步甲基化后与湿的氧化银作用,转变成氢氧化物,加热生成三甲胺、1,5-辛二烯和1,4-辛二烯混合物。
写出化合物A和B的结构。
答:A;B。
4.硝基是一个拉电子基团,还是推电子基团?它在硝基乙烷和硝基苯两个化合物中的电子效应是否相同?说出它们的异同点并解释原因。
答:硝基是拉电子基团,它在硝基乙烷和硝基苯两个化合物中的电子效应不完全相同。
硝基化合物.

中性介质时,可还原成N-羟基苯胺,也可还原成 苯胺。如要制备亚硝基苯,可由N-羟基苯胺氧化而得。
生物与化学工程系
有机化学
第十四章 含氮有机化合物 (c)金属加碱性介质
生物与化学工程系
有机化学
第十四章 含氮有机化合物
在碱性介质条件下还原时,中间产物亚硝基苯和N羟基苯胺会互相作用而生成双分子缩合产物。其中氢化 偶氮苯在强酸性介质中可发生分子重排生成联苯胺—联 苯胺重排。
胺的物理性质和波谱性质 一、物理性质 常温下,低级和中级脂肪胺为无色气体或液体,高级脂肪胺 为固体,芳香胺为高沸点的液体或固体。低级胺具有氨的气味或 鱼腥味,高级胺没有气味,芳香胺有特殊气味,并有较大的毒性。 由于胺是极性化合物,除叔胺外,其它胺分子间可通过氢键 缔合,因此胺的熔点和沸点比分子量相近的非极性化合物高。但 由于氮的电负性比氧小,所以胺形成的氢键弱于醇或羧酸形成的 氢键,因而胺的熔点和沸点比分子量相近的醇和羧酸低。 伯、仲、叔胺都能与水形成氢键,所以低级脂肪胺可溶于水。 随着烃基在分子中的比例增大,溶解度迅速下降,所以中级胺、 高级胺及芳香胺微溶或难溶于水。胺大都可溶于有机溶剂。
生物与化学工程系
有机化学
第十四章 含氮有机化合物
根据分子中烃基的结构,可把胺分为脂肪胺和芳 香胺。例如:
铵盐(NH4)+X-分子中的四个氢原子被四个烃基取 代后的化合物,成为季铵盐,如[N(CH3)4+]I-。
生物与化学工程系
有机化学
第十四章 含氮有机化合物
根据分子中氨基的数目,可把胺分为一元胺、二元 胺和多元胺等。例如:
生物与化学工程系
有机化学
第十四章 含氮有机化合物
一、硝基的结构 按照价键理论,硝基(—NO2)的结构通常表示为:
李景宁主编第五版有机化学11-14章复习资料

十一、醛酮影响亲核加成反应速率的因素常见的吸电子基团的吸电子能力:—NO 2 > —COR > —SO 2R > —COOR > —CN > —C 6H 5 > —CH =CH 2 1、羰基碳原子连有基团的体积↑,空间位阻↑,不利于 亲核试剂进攻,反应就越慢。
2、当羰基连有吸电子基时,使羰基碳上的正电性增加,有利于亲核加成的进行,吸电子基越多,反应就越快。
3、羰基上连有与其形成共轭体系的基团时,由于共轭作用可使羰基稳定化,因而亲核加成速度减慢。
4、试剂的亲核性愈强,反应愈快5、亲核试剂的体积对加成的影响LiAlH 4体积小—OH 在e 键稳定,LiBH(sec-Bu)3体积大,—OH 只能在a 键亲核加成反应一、与氢氰酸的加成反应:生成羟基氰1° 反应范围:醛、脂肪族甲基酮。
ArCOR 和ArCOAr 难反应。
2°反应的应用:α-羟基腈是很有用的中间体,它可转变为多种化合物,也是增长碳链的一种方法。
与HCN 加成的难易 电子效应 HCHO 〉RCHO 〉酮空间效应 HCHO 〉RCHO ; RCHO 〉R 2C=O ; 环内酮 〉同碳的烷酮。
二、与饱和亚硫酸氢钠的加成反应:生成羟基磺酸盐COH+ HCN羟基睛αCH 2=C-CN CH 3(CH 3)2CCN OH(CH 3)2CCOOH (CH 3)2CCH 2NH 2OHCH 2=C-COOCH 3CH3COH SO 3NaCSO 醇钠强酸强酸盐 ()(CH 3)3C HOH (CH 3)3C (CH 3)3C OH +LiAlH 490%10%LiBH(S Bu)312%88%主要决定于椅式构象中e 键的稳定.产要是进攻试剂体积庞大反式进攻有利反应的应用 a 鉴别化合物b 分离和提纯醛、酮c 用于制备羟基腈,是避免使用挥发性的剧毒物HCN 而合成羟基腈的好方法。
—SO 3Na 被—CN 取代三、与格式试剂的加成反应:生成各级醇四、与醇的加成反应:生成缩醛或酮 反应的应用: 有机合成中用来保护羰基,在加热条件下用稀酸水解:H +/H 2O 便可还原为原来的醛或酮五、与氨及其衍生物的加成反应六、与磷叶立德的加成反应:生成烯烃R C H ( R' )RC OH H SO 3( R' )O 3RCHO + Na 2SO 3 + CO 2 + H 2O RCHO + NaCl + SO 2 + H 2O 杂质不反应,分离去掉PhCHO 3H 2O PhCHSO 3Na PhCHCN HCl 67%回流OHOH OH C O δδδδC OMgX R 2R C OH +HOMgX无水乙醚R C O +ROH H R C OHHOR半缩醛+R C OR OR 缩醛R C RO +HO CH 2CH 2HO HR CRO O CH 2CH 2+H 2O2B CNOH H BNBNH 2B C N B NH 2OH (羟氨)NH 2NH 2(肼)NH 2NHC 6H 5(苯肼)NH 2NHCONH2(氨基脲)CN OH(肟)C N NH 2(腙)C N NHC 6H 5(苯腙)CNNHCONH 2(缩氨 脲)RR ′-Ph 3P C R R +CO -Ph 3PCR R CO Ph 3P O +CC R′′七、与西佛试剂(品红醛试剂)的反应:区别醛酮常用的方法还原反应一、催化氢化 :还原为醇所有不饱和键均被还原,若要保留羰基,条件为:H 2,5%Pd/C二、金属氢化物为还原剂还原:还原为醇(1)LiAlH4还原①选择性差,是强还原剂,除不还原C=C 、C ≡C 外,其它不饱和键都可被其原; ②不稳定,遇水剧烈反应,通常只能在无水醚或THF 中使用(2)NaBH 4还原 NaBH 4还原的特点:①选择性强(只还原醛、酮、酰卤中的羰基,不还原其它基团。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
NHCCH3 + CH3COOH
总目录
②兴斯堡(Hinsberg O)反应
1° RNH2 + C6H5SO2Cl
NaOH
C6H5SO2NHR
固体
[ C6 H5SO2 NR ] Na+
可溶于碱液
-
H
+
RNH2
2° R2NH + C6H5SO2Cl
NaOH ( —)
C6H5SO2NR
固体
H
+
R2 NH
+
+ NaX + 2 H2O
芳香族重氮盐
H 2° N
NO
+ HNO2
N
黄色固体
+
H 2O
H N CH3 + HNO2 N N O CH3
棕色油状
总目录
N(CH3)2 3° N(CH3)2
+ HNO2
NO
对亚硝基胺 (绿色叶片状)
用途: ①重氮盐用于有机合成; ②亚硝酸反应区别1°胺、2 °胺、3 °胺
总目录
2. 结构
偶极矩高 2个N—O键长均等 ① N:sp2杂化,其孤对 电子所在的p轨道与O的p 轨道形成共轭体系。
② 电负性: O>N
仍用右式表示:
O N O
总目录
• 共振式表示硝基结构:
R N
+
O O
R N
+
O O
• 硝基化合物与亚硝酸酯互为异构体:
硝基化合物
亚硝酸酯
总目录
二、性质
NH2 (CH3CO)2O NHCOCH3 Br2
NHCOCH3 NHCOCH3 Br
+
Br
总目录
③ 溶剂不同,产物不同
NHCOCH3 Br 2 NHCOCH3 CH 3COOH
(CH 3CO)2O H+ O 3
NH2
Br Br 2
(CH 3CO)2O
Br NH2 Br
NH2
NHCOCH3 + H 3O Br
> (CH3)3N > NH3
3°
Kb ×105
59.5
42.5
6.73
1.8
(原因见下页)
总目录
水溶液相不同的原因:
H O H O H H
a.主要因素:溶剂化效应,水合铵离子的稳定性
(CH3)2 N
+
H H
>
(CH3)3 N
+
H
O
H H
b.次要因素:空间效应 因此,胺的碱性强弱由电子效应、溶剂化效 应和空间效应所决定。
+
1°胺
OH
CH3NHR + RBr
-
胺 2°
CH3NHR + H2O
2°胺 CH3NHR2 + Br 3°胺 OH CH3NR2 + H2O
CH3 NR3 OH
+
CH3 NR2
+ RBr
+
+ Br -
3°胺 季 铵 盐 + 铵 碱 CH3 NR3 OH 季
NH3或RNH2的烷基化产物为混合物。
总目录
+
H2SO4
NH3HSO4Br 2
NH3 HSO4
NH2 NaOH Br
Br
总目录
(3)磺化
NH2
+ + H2SO4
NH3 HSO4
脱水
NH2
+
NH3
内盐,熔点高
SO3 H
SO3-
总目录
(4)硝化
NH2
(CH 3CO)2O
溶剂不同,结果不同 保护与否,结果不同
NHCOCH3 H+ O 3 NO2
+
+ R + X + N2
H
2° R2 NH + HNO2
+
R2NH
精制2°胺
定量
R2 N N O + H 2O
黄色油状或固体,N-亚硝基化合物
3° 不反 应
用途:
①鉴别1°胺、2 °胺、3 °胺; ③定量测定1°胺。 ②精制2 °胺;
总目录
(2)芳香胺
1° NH2
+ NaNO2+ HX
0-5℃
NX N
总目录
2.芳香族硝基化合物的化学性质
⑴ 还原:产物与介质酸碱性有关
Fe/HCl NH2 NHOH
苯胺 苯胲 氢化偶氮苯
NO2
Zn/NH4Cl
Zn/NaOH
NHNH
Fe/NaOH
N N
偶氮苯
总目录
⑵芳环上的亲核取代反应
芳环的特征反应是亲电取代反应 邻位或对位被硝基取代的芳香卤代物, 由于强吸电子基硝基的影响,使苯环 上的电子云密度降低,不利于亲电试 剂的进攻,容易发生亲核取代反应。
易在空气中氧化:
NH2
MnO2 H2SO4 10℃
O
O
当苯环上有吸电子基,如—X,—NO2,—CN 等时,氨基被氧化为硝基:
X NH2 X CF3COOOH CH2Cl2 X NO2 X
总目录
(2)卤代
① 活性大,难停留在一元取代阶段:
NH2 H2O Br NH2 Br
+ 3 Br 2
Br
②芳胺乙酰化,降低活性,可一元取代:
NHCOCH3 NO2 H+O 3
NH2
HNO3
NHCOCH3 CH3COOH
NO2
NH2
HNO3 (CH3CO)2O
NO2
NH2 H2SO4
+
NH3 HSO4 HNO3
NH3 HSO4
NaOH
NH2 NO2
NO2
总目录
8. 季铵盐和季铵碱
(1)季铵盐和相转移催化
R3 N + RX
C12 H25 N(CH3)3Cl
· ·
N CH3
H5C2 H N
CH3
· ·
两个对映体间的能垒差很低,室温下迅速转化, 目前尚未能分离。
总目录
当氮连接四个不同基团时,两对映体不能转 换:
CH3 C 6 H5CH2 CH2=CHCH2 N CH3
+
C 6 H5 C 6 H5
+N
CH2C 6 H5 CH2CH=CH2
总目录
四、胺的化学性质
· ·
H3C 108° H C 3 N CH3
总目录
1.氮的杂化态
· · · ·
· · ·
N H H 113.9°
·
苯胺:H—N—H平面与苯环平面夹角38°, 但仍可p-π共轭。
氮上有一对孤对电子,具有亲核性和碱性。
总目录
2. 手性氮
当氮上连接三个不同基团时,为手性氮:
· ·
H3C N H C2H5 C2H5 H
1.碱性和成盐
H
· · RNH +
2
HCl
R
N H Cl
+
-
H 强酸弱碱盐
RNH3Cl
+
-
+ NaOH
RNH2 + NaCl
+ H2O
用途:提纯胺
含杂质的胺溶于干燥的Et2O中,通过干燥的HCl, 生成胺的盐酸盐沉淀,分离后用碱将其析出。
总目录
胺的水溶液呈碱性:
+ + NH4
-
NH3 + H2O
OH
总目录
2. 胺的命名
简单胺: 某(基)胺
NH2
环己胺 cyclohexylamine 三甲胺 trimethylamine
己二胺 hexanediamine N,N-二甲基苯胺 N,N-dimethylaniline
(CH3)3 N
H2N(CH2)6NH2
N(CH3)2
总目录
2. 胺的命名
复杂胺:
OMe d
碱性 :d>a >c >b
总目录
2. 酸性
酸性较弱,但在强碱作用下可成盐:
CH3 NH2 + Na
(C2H5)2NH + C6H5Li
Fe
Na NHCH3 +
Et2O
+ -
H2
Li N(C2 H5)2 + C6H6
+ -
-
NHR、 NR2是强碱试剂。
-
总目录
3. 烃基化
CH3NH2 + RBr CH3NH2R + Br
总目录
第一节 硝基化合物
烃分子中的氢原子被硝基取代的化合物。 自然界存在量少,主要为人工合成。
多硝基化合物的性质:爆炸性,强烈的香味
总目录
一、命名和结构
1.命名
原则与卤代烃相似,—NO2作取代基
CH3CHCH3 NO2
2-硝基丙烷 2-nitropropane
NO2 NO2
1,3-二硝基苯(或:间二硝基苯) 1,3-dinitrobenzene
总目录
(2)1H NMR 胺 α-H δ2.2 ~ 2.8 N—Hδ0.6 ~ 5 醇 α-H δ≈4 O—Hδ1 ~ 5.5
总目录
三、胺的立体化学
1.氮的杂化态
N:1s2,2s22p3 脂肪胺:4个sp3杂化轨道、一对孤对电子,具 有亲核性和碱性
· ·
H 107.3° H N H
· ·
