电位滴定法课件
合集下载
电位滴定法的基本原理PPT课件

指示电极的选择
第1页/共5页
电位滴定法如何确定滴定终点
1、绘制E-V曲线法
以加入滴定剂的体积为
横坐标,E为纵坐标作
滴定曲线,所的曲线的
拐点即为滴定终点。
做两条余与滴定曲线相切,
并与横轴夹角为45度的直线
A、B,再做横轴h垂直于横源自轴使夹在AB间的线段被曲线交点C平分,即C点就是
拐点。
第2页/共5页
2、绘制ΔE/ΔV—V曲线法
以加入滴定剂的体积为 为横坐标,以ΔE/ΔV为 纵坐标,画出滴定曲线。 曲线的最高点即为滴定 终点。由最高点引横轴 的垂线,交点就是消耗 滴定剂的体积。
第3页/共5页
3、
以加入滴定剂的体积 为横坐标,以 为纵坐标。画出曲线, 图中C点即为滴定终 点。
C
第4页/共5页
谢谢您的观看!
第5页/共5页
第1页/共5页
电位滴定法如何确定滴定终点
1、绘制E-V曲线法
以加入滴定剂的体积为
横坐标,E为纵坐标作
滴定曲线,所的曲线的
拐点即为滴定终点。
做两条余与滴定曲线相切,
并与横轴夹角为45度的直线
A、B,再做横轴h垂直于横源自轴使夹在AB间的线段被曲线交点C平分,即C点就是
拐点。
第2页/共5页
2、绘制ΔE/ΔV—V曲线法
以加入滴定剂的体积为 为横坐标,以ΔE/ΔV为 纵坐标,画出滴定曲线。 曲线的最高点即为滴定 终点。由最高点引横轴 的垂线,交点就是消耗 滴定剂的体积。
第3页/共5页
3、
以加入滴定剂的体积 为横坐标,以 为纵坐标。画出曲线, 图中C点即为滴定终 点。
C
第4页/共5页
谢谢您的观看!
第5页/共5页
电位滴定法课件

+186
5.50
-135
8.00
-342
2.90
+177
6.00
-142
8.50
-364
3.00
+168
6.50
-152
9.00
-375
3.10
+148
7.00
-167
9.50
-383
7.10
-171
10.00
-389
解题(1)
解 :首先 计算在两个化学计量点附近的 △V,△E,△E/△V,△2 E/△V2的值如下表所示。
即:二级微商△2E/△V2 =0时的体积为滴定终点体积,用内插法计算:
24.34ml即为滴定终点时AgNO3消耗的体积
4、△2E/△V2 — V曲线
以二阶微商值为纵 坐标 ,加入滴定剂 的体积为横坐标作 图。 △2E/△V2 =0所 对应的体积即为滴 定终点。
计算示例
吸取Cl-和I-混合液25.00mL,稀释到100.00mL,以 0.1000mol•L-1的AgNO3溶液滴定.以银电极作指示电极,饱和 甘汞电极作参比电极,加入AgNO3的体积及相应的E值如下表 所示.计算Cl-及I-在化学计量点时所消耗AgNO3的体积,并计 算原来溶液中Cl-及I-的浓度各是多少?以g/L表示之。
电位分析法的依据
电位分析法是一种电化学分析方法。电极的电位与其乡相应离子活度之间的关系 可以用能斯特方程式表示。例如,某种金属M插入该金属离子的溶液中所构成 的电极,其电极电位为:
φMn+/M=φoMn+/M+RT/nFlnaMn+ φ—电极电位(V); φo—标准电极电位(V); R—理想气体常数(8.131445J.mol-1.K-1); T—热力学温度(K); F—法拉第常数(96487C); aMn+—金属Mn+的活度(mol.L-1)。
电位滴定法.ppt

永停电位滴定法的应用
重氮滴定:取供试品适量,精密称定,置烧杯中, 可加水40ml与盐酸溶液(1→2)15ml,而后置电磁搅拌 器上,搅拌使溶解,再加溴化钾2g,插入铂-铂 电极后,将滴定管的尖端插入液面下约2/3处,用亚 硝酸钠滴定液(0.1mol/L或0.05mol/L)迅速滴定,随滴随 搅拌,至近终点时,将滴定管的尖端提出液面, 用少量水淋洗尖端,洗液并入溶液中,继续缓缓 滴定,至电流计指针突然偏转,并不再回复,即 为滴定终点。 水分测定:用作水分测定的终点指示时,可调节 R<[1]>使电流计的初始电流为5~10μA,待滴定 到电流突增至50~150μA,并持续数分钟不退回, 即为滴定终点。
电位滴定法与永停滴定法
北京市药品检验所 周立春
电位滴定法的原理
电位滴定法是一种利用电极电位的突越来确定终 点的分析方法。进行电位滴定时,在溶液中插入 待测离子的指示电极和参比电极组成化学电池, 随着滴定剂的加入,由于发生化学反应,待测离 子浓度不断发生变化,指示电极的电位随着发生 变化,在计量点附近,待测离子的浓度发生突变, 指示电极的电位发生相应的突跃。因此,测量滴 定过程中电动势的变化,就能确定滴定反应的终 点,求出试样的含量。
手动计算实例(一)
以0.1000mol/LAgNO3滴定25.00mlNaCl试 样溶液,E为电池电动势(v-伏或mv-毫 伏),V为体积—ml
加入AgNO3的体 积V(ml)
E/v
5.00 15.00 20.00 22.00 23.00 24.00
0.062 0.085 0.107 0.123 0.138 0.146
药典中收载的品种
非水滴 酸碱滴 硝酸汞 银量法 碘量法 永停滴
定
定
电位滴定法测氯离子ppt课件

3、氯化物对人和温血动物的危害
水中氯化物浓度超过1500mg/L时,对牛、羊、猪等 家畜和家禽有危害,当浓度超过4000mg/L时,可以使 上述动物死亡。但是当水中阳离子为镁,氯化物浓度 为100mg/L时,即可使人致毒。
4、氯化物对生生物的危害
一般认为氯化物对淡水生物的毒性很小,但当水中 氯化物的浓度较高时,可以致鱼类死亡。氯化物对水 生物的毒性不仅与氯化物的浓度有关,也与水中存在 的阳离子有密切关系。
2、水样的测定
水样如果比较清洁,可取适量水样(氯化物含量不超过 10mg)置于250 ml烧杯中,加硝酸使pH3~5,按标定硝酸银 标准溶液的方法进行电位滴定。
污染较小的水样可加硝酸处理。如果水样中含有机物、 氰化物、亚硫酸盐或者其他干扰物,可于100ml水样中加1+1 硫酸,使溶液呈酸性,煮沸5分钟除去挥发物。必要时,再 加入适量硫酸使溶液保持酸性,然后加入3 ml过氧化氢煮沸 15分钟,并经常添加蒸馏水保持溶液体积在50 ml以上。加 入氢氧化钠溶液使呈碱性,再煮沸5分钟,冷却后过滤,用 水洗沉淀和滤纸,洗涤液和滤液定容后供测定用。亦可在 煮沸冷却后定容,静置使沉淀,取上清液进行测定。取适 量经预处理的水样,加硝酸使呈酸性,并过量0.5 ml(约10 滴),然后标定硝酸银标准溶液的方法进行电位测定。
和相对应的阳离子共同作用,使水产生不同的味觉, 使水质产生感官性状的恶化。如当水中氯化物浓度为 250mg/L,阳离子为钠时,人就会察觉出咸味。 2、氯化物对植物的危害
通常情况下,植物对低或稍高浓度的氯化物,出一 些特别敏感的植物种类外,都有一定忍耐能力,当氯 化物为100—350mg/L时,才会对一般植物有致毒作用。
在人类的生存活动中,氯化物有很重要的生理作用 和工业用途。
电位滴定法ppt课件

介电常数大,E值读数稳定,但突跃不明显;介电 常数小,突跃明显,易于滴定,但E值读数不稳定。
2. 氧化还原滴定:
➢ 常用电极:铂Pt电极作指示电极, 甘汞电极作参比电极。
精品课件
19
第十二节 电位滴定法的应用和指示电极的选择
3、沉淀滴定 指示电极:根据不同的沉淀反应来采用不同的指示电极. 如:硝酸盐标准溶液滴定卤素可用银电极做指示电极 参比电极:双盐桥甘汞电极
E E2 E1 V V2 V1
精品课件
10
(c)二阶微商法(等于零点):又称二阶微分滴定曲 线,纵坐标Δ2Ε/ΔV 2=0的点即为滴定终点。通过后点 数据减前点数据的方法逐点计算二阶微商。
2E V2
E E V 2 V 1
V
内插法:取二阶微商的正、负转化处的两个点的 体积值V+,V-。
V终V V 2E2V V V 2E2 V 2E2
精品课件
21
应用及计算示例
V /ml 24.00 24.10 24.20 24.30 24.40 24.50 24.60 24.70
E /V 0.174 0.183 0.194 0.233 0.316 0.34 0.351 0.358
V' /ml Δ E/ Δ V V" /ml
24.05 24.15 24.25 24.35 24.45 24.55 24.65
精品课件
16
自动电位分析仪简介
商品电位滴定仪有半 自动、全自动两种。全 自动电位分析仪至少包 括两的单元,即更换试 样系统(取样系统)和 测量系统,测量系统包 括自动加试剂部分(量 液剂)以及数据处理部 分。仪器结构框架如下 图:
精品课件
17
第十二节 电位滴定法的应用和指示电极的选择
2. 氧化还原滴定:
➢ 常用电极:铂Pt电极作指示电极, 甘汞电极作参比电极。
精品课件
19
第十二节 电位滴定法的应用和指示电极的选择
3、沉淀滴定 指示电极:根据不同的沉淀反应来采用不同的指示电极. 如:硝酸盐标准溶液滴定卤素可用银电极做指示电极 参比电极:双盐桥甘汞电极
E E2 E1 V V2 V1
精品课件
10
(c)二阶微商法(等于零点):又称二阶微分滴定曲 线,纵坐标Δ2Ε/ΔV 2=0的点即为滴定终点。通过后点 数据减前点数据的方法逐点计算二阶微商。
2E V2
E E V 2 V 1
V
内插法:取二阶微商的正、负转化处的两个点的 体积值V+,V-。
V终V V 2E2V V V 2E2 V 2E2
精品课件
21
应用及计算示例
V /ml 24.00 24.10 24.20 24.30 24.40 24.50 24.60 24.70
E /V 0.174 0.183 0.194 0.233 0.316 0.34 0.351 0.358
V' /ml Δ E/ Δ V V" /ml
24.05 24.15 24.25 24.35 24.45 24.55 24.65
精品课件
16
自动电位分析仪简介
商品电位滴定仪有半 自动、全自动两种。全 自动电位分析仪至少包 括两的单元,即更换试 样系统(取样系统)和 测量系统,测量系统包 括自动加试剂部分(量 液剂)以及数据处理部 分。仪器结构框架如下 图:
精品课件
17
第十二节 电位滴定法的应用和指示电极的选择
电位法及永停滴定法—电位滴定法(分析化学课件)

电位滴定法测亚铁离子含量 三、操作步骤 1.仪器准备 (1)安装滴定台 连接电极杆,
装入搅拌器、溶液杯支架,在溶液杯 中放入搅拌珠,锁紧搅拌器和溶液杯。
电位滴定装置图
14
电位滴定法测亚铁离子含量 (2)安装滴定管 在溶液杯中插入 滴定管,连接输液管,利用接口螺 母旋紧,不得有泄漏现象,插入温 度计传感器,接口插入对应的插座,连接搅拌器接 口。
1.在待测溶液中插入合适的指示电极和参比电极组成 原电池;
2.待测溶液与滴定液发生化学反应,使待测离子的浓 度不断变化;
3.指示电极的电位也相应发生变化;
4.在化学计量点附近,指示电极的电位发生突然变 化,导致电池电动势发生突变;
5.通过测量电动势的变化,可确定终点。
8
电位滴定法原理
1.准确度高 电
尖峰所对应的V值即为
化学计量点的体积
△E/△V- 曲线
3
确定化学计量点的方法(三) 2E / V—2 V 曲线法
又称二阶微商法,用 2E / V 2 对滴定液体积作图,得 到一条具有两个极值的曲线,如下图所示。
曲线上为零时所对 应的体积,即为化 学计量点的体积。
4
确定化学计量点的方法 在实际的电位滴定中传统的操作方法正逐渐被 自动电位滴定所取代,自动电位滴定能判断滴定终 点,并自动绘制出E-V曲线,E / V - V 曲线,在很大 程度上提高了测定的灵敏度和准确度。
确定化学计量点的方法 进行电位滴定时,每加一次滴定剂,测量一次 电动势,直到超过化学计量点为止。这样就得到一 系列的滴定剂用量V和相应的电动势E数据。下面介 绍几种图解法确定化学计量点的方法:
1
确定化学计量点的方法
(一)E-V曲线法
以滴定液体积V为横坐标,电位计读数值(电池
电化学分析法 电位滴定法 分析化学课件

每次使用前都应自动清洗和排空滴定管路原存放液体; 分析结束后排空计量管液体,并清洗; 长期未用或需更换滴定液时,可采用纯化水或乙醇多次清 洗滴定管单元及管路。
五、应用示例
在《中国药典》2020年二部中有187种原料药及其制剂采用电位滴定法进行含量测定。
滴定方法
水溶液氧化还原法 水溶液中和法
非水溶液中和法 水溶液银量法
二、确定滴定终点的方法
用内插法计算化学计量点
在化学计量点附近,滴定液近似直线段,故在实际 工作中常不做图,利用内插法计算滴定终点体积。
式中
为滴定终点体积; 为曲线过零前某点的体积;
的体积;
为曲线过零前的二级微商值;
零后的二级微商值。
为曲线过零后某点 为曲线过
二、确定滴定终点的方法
用内插法计算化学计量点
利用表中的数据,用内插法计算化学计量点时消耗的滴定液体积为多少ml?
解 从表查得加入滴定液体积为24.30ml时,其二级微商Δ2E/ΔV 2 = 4400。
加入24.40ml滴定剂时,Δ2E/ΔV 2 =-5900。设化学计量点(Δ2E/ΔV 2 = 0) 时,加入滴定液的体积为,则按下式进行比例计算:
二、确定滴定终点的方法
△E/△V- 曲线法
如图(b)所示。该曲线可看作E-V曲线的 一阶导数曲线,所以该法又称为一级微商 法。峰状曲线的最高点(极大值)所对应 的体积即为化学计量点的体积。
△2E/△V 2-V 曲线法
如图 (c)所示。曲线上△2E/△V 2为 零时所对应的体积,即为化学计量点 的体积。
随着滴定液的加入,滴定液与待测液发生 化学反应,使待测离子的浓度不断降低,因而 指示电极的电位也相应发生变化。
毫伏电 位计
甘汞电极 滴定杯
五、应用示例
在《中国药典》2020年二部中有187种原料药及其制剂采用电位滴定法进行含量测定。
滴定方法
水溶液氧化还原法 水溶液中和法
非水溶液中和法 水溶液银量法
二、确定滴定终点的方法
用内插法计算化学计量点
在化学计量点附近,滴定液近似直线段,故在实际 工作中常不做图,利用内插法计算滴定终点体积。
式中
为滴定终点体积; 为曲线过零前某点的体积;
的体积;
为曲线过零前的二级微商值;
零后的二级微商值。
为曲线过零后某点 为曲线过
二、确定滴定终点的方法
用内插法计算化学计量点
利用表中的数据,用内插法计算化学计量点时消耗的滴定液体积为多少ml?
解 从表查得加入滴定液体积为24.30ml时,其二级微商Δ2E/ΔV 2 = 4400。
加入24.40ml滴定剂时,Δ2E/ΔV 2 =-5900。设化学计量点(Δ2E/ΔV 2 = 0) 时,加入滴定液的体积为,则按下式进行比例计算:
二、确定滴定终点的方法
△E/△V- 曲线法
如图(b)所示。该曲线可看作E-V曲线的 一阶导数曲线,所以该法又称为一级微商 法。峰状曲线的最高点(极大值)所对应 的体积即为化学计量点的体积。
△2E/△V 2-V 曲线法
如图 (c)所示。曲线上△2E/△V 2为 零时所对应的体积,即为化学计量点 的体积。
随着滴定液的加入,滴定液与待测液发生 化学反应,使待测离子的浓度不断降低,因而 指示电极的电位也相应发生变化。
毫伏电 位计
甘汞电极 滴定杯
电位滴定法课件

10 11 165 174 15 15.1 319 327 23.4 24.4 387 389
Cl
(CV ) AgNO3 M Cl V水样 103
0.0114.28 35.5 50 103
101.39 mg L-1
E
400
350
300 Eep=267.15mV
250
200
150
Vep=14.28mL
4、下列数据时苯氧化还原滴定反应化学计量 点附近的点位读数。试计算终点时消耗滴定剂 的体积及化学计量点时的电极电位。
V滴定剂/mL 33.00 33.40 33.60 33.80 34.00 34.10
E/V 0.405 0.415 0.422 0.431 0.443 0.455
V滴定剂/mL 34.20 34.30 34.40 34.50 34.60 34.70
E/mV
330 333 336
34567 138 141 145 147 151 14.2 14.4 14.5 14.6 14.7 256 283 292 299 305 16.4 17.4 18.4 19.4 20.4 351 361 368 374 378
89 156 160 14.8 14.9 310 314 21.4 22.4 381 385
100 0
5
10
15
20
25
V
我国《生活饮用水卫生标准》规定自 来水中氯化物的含量应小于 250 mg/l, 通过实验可知,我们饮用水中Cl-的含量 符合我国饮用水的卫生标准。
课堂练习
1、电位滴定法中是通过_电__位__的变化确定滴 定终点的的方法,特别适用于化学反应中的 __平__衡__常__数__较__小___、__滴__定__突__越__不__明__显__、或 ___试__液__有__色__、__呈__现__浑__浊___的情况。
电位滴定实验PPT课件
• 4、清洗电极,将仪器复原,洗净玻璃仪器。
实验报告
1、列表:V PH ΔPH/ ΔV ⊿2PH/⊿V2 2、绘出pH-V曲线,并在图中标出滴定终点。 3、用内插法计算出滴定终点。
酸度计的使用
• 1、仪器安装 • 2、PH校正 • 3、测量未知液 • 4、整理复原
注意事项
• 1.电极安装、校正仪器。 • 2.转子勿丢
电位滴定终点的确定:
1.E ~V曲线法 滴定终点:曲线上转折点(斜率最大处)对应V 特点:应用方便
但要求计量点处电位突跃明显 2.⊿E/⊿V~ V曲线法 曲线:具一个极大值的一级微商曲线 滴定终点:尖峰处(⊿E/⊿V极大值)所对应V 特点:在计量点处变化较大,因而滴定准确;
但数据处理及作图麻烦 3.⊿2E/⊿V2~ V曲线法 曲线:具二个极大值的二级微商曲线 滴定终点:⊿2E/⊿V2由极大正值到极大负值与
纵坐标零线相交处对应的V
V PH ΔPH
2.00 2.12 4.02 2.34 ………. ……
11.80 3.97
11.90 4.14
12.00 4.47
12.10 4.72
0.17 0.33 0.25
…… .....
ΔV
0.10 0.10 0.10
ΔPH/ ΔV
V
⊿2PH/⊿V2
1.7
11.85
1.6
3.3
11.95
-0.8
2.5
12.05
内插法:
()︰()=()︰() 得(ml)
操作步骤
• 1、用标准缓冲溶液校准PH计(调“定位”,调“斜 率”)。
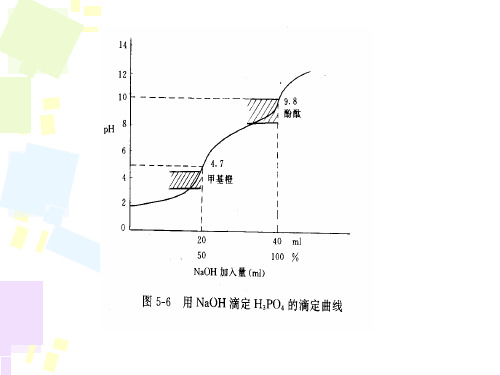
• 2、吸取磷酸,加蒸馏水30ml。放入转子,磁力搅拌。插 入电极。
• 3、用滴定。开始每2ml记录PH和V ,至第一计量点附近 ()每加两滴记录PH,第二计量点附近()又每加两滴 就记行电位滴定时,是将一个指示电极和一个参比电极浸入
实验报告
1、列表:V PH ΔPH/ ΔV ⊿2PH/⊿V2 2、绘出pH-V曲线,并在图中标出滴定终点。 3、用内插法计算出滴定终点。
酸度计的使用
• 1、仪器安装 • 2、PH校正 • 3、测量未知液 • 4、整理复原
注意事项
• 1.电极安装、校正仪器。 • 2.转子勿丢
电位滴定终点的确定:
1.E ~V曲线法 滴定终点:曲线上转折点(斜率最大处)对应V 特点:应用方便
但要求计量点处电位突跃明显 2.⊿E/⊿V~ V曲线法 曲线:具一个极大值的一级微商曲线 滴定终点:尖峰处(⊿E/⊿V极大值)所对应V 特点:在计量点处变化较大,因而滴定准确;
但数据处理及作图麻烦 3.⊿2E/⊿V2~ V曲线法 曲线:具二个极大值的二级微商曲线 滴定终点:⊿2E/⊿V2由极大正值到极大负值与
纵坐标零线相交处对应的V
V PH ΔPH
2.00 2.12 4.02 2.34 ………. ……
11.80 3.97
11.90 4.14
12.00 4.47
12.10 4.72
0.17 0.33 0.25
…… .....
ΔV
0.10 0.10 0.10
ΔPH/ ΔV
V
⊿2PH/⊿V2
1.7
11.85
1.6
3.3
11.95
-0.8
2.5
12.05
内插法:
()︰()=()︰() 得(ml)
操作步骤
• 1、用标准缓冲溶液校准PH计(调“定位”,调“斜 率”)。
• 2、吸取磷酸,加蒸馏水30ml。放入转子,磁力搅拌。插 入电极。
• 3、用滴定。开始每2ml记录PH和V ,至第一计量点附近 ()每加两滴记录PH,第二计量点附近()又每加两滴 就记行电位滴定时,是将一个指示电极和一个参比电极浸入
电位滴定法2节PPT课件

实际分析中的应用受到一定的限制,但仍成为 工业生产控制,环境监测,理论研究,以及与地质、 冶金、化工、农业、土壤、食品、医学等有关领域 中的重要分析工具。
.
16
1.特点
❖ 适用的浓度范围宽,能达几个数量级; ❖ 对于有色溶液和混浊试液中也能测定; ❖ 易于实现自动控制,可作为传感器: ❖ 能用于基本理论的研究和化学常数的测定: ❖ 直接电位法受实验条件影响较大,测定误差较
大;电位滴定法麻烦费时。
.
15
2. 应用
能用于测定许多阴、阳离子以及有机离子,生 物物质,特别适用于测定碱金属离子及一价离子分 析,并能用于气体分析。
自动电位滴定: a.自动控制终点:达到终点电位时,自动关闭 滴定管。 b.自动记录滴定曲线:经自动运算,显示终点 滴定剂的体积。
.
10
5.滴定反应和指示电极选择
滴定反应类型与普通容量分析完全相同,滴定 时,应根据不同的反应选择不同的指示电极。
(1)酸碱反应:
用玻璃电极指示电极。
(2)氧化还原反应:
.
2
2.方法原理
滴定剂
离子浓 度变化
电极电 位变化
确定终点,再根据标准溶液V和c计算出待测物 质的浓度。电位滴定与普通容量分析区别在于确定
滴定终点的方法不同。
3. 方法特点
➢ 准确度较电位法高,RE 可达到 0.2﹪。
➢ 能用于浑浊和有色溶液的滴定。
➢ 能用于非水溶液的滴定,如某些有机物的滴定。 ➢ 能连续滴定和自动滴定,并适用于微量分析。
其滴定过程中,氧化态和还原态的浓度比值发
生变化,一般采用铂电极为指示电极,以甘汞电极
为参比电极。
.
11
(3)沉淀反应:
.
16
1.特点
❖ 适用的浓度范围宽,能达几个数量级; ❖ 对于有色溶液和混浊试液中也能测定; ❖ 易于实现自动控制,可作为传感器: ❖ 能用于基本理论的研究和化学常数的测定: ❖ 直接电位法受实验条件影响较大,测定误差较
大;电位滴定法麻烦费时。
.
15
2. 应用
能用于测定许多阴、阳离子以及有机离子,生 物物质,特别适用于测定碱金属离子及一价离子分 析,并能用于气体分析。
自动电位滴定: a.自动控制终点:达到终点电位时,自动关闭 滴定管。 b.自动记录滴定曲线:经自动运算,显示终点 滴定剂的体积。
.
10
5.滴定反应和指示电极选择
滴定反应类型与普通容量分析完全相同,滴定 时,应根据不同的反应选择不同的指示电极。
(1)酸碱反应:
用玻璃电极指示电极。
(2)氧化还原反应:
.
2
2.方法原理
滴定剂
离子浓 度变化
电极电 位变化
确定终点,再根据标准溶液V和c计算出待测物 质的浓度。电位滴定与普通容量分析区别在于确定
滴定终点的方法不同。
3. 方法特点
➢ 准确度较电位法高,RE 可达到 0.2﹪。
➢ 能用于浑浊和有色溶液的滴定。
➢ 能用于非水溶液的滴定,如某些有机物的滴定。 ➢ 能连续滴定和自动滴定,并适用于微量分析。
其滴定过程中,氧化态和还原态的浓度比值发
生变化,一般采用铂电极为指示电极,以甘汞电极
为参比电极。
.
11
(3)沉淀反应:
电位滴定原理PPT课件

若:[Cu2+]=1mol/l ,则
Cu电极
Cu电极
25℃时,该电池的电动势为+0.344V,
即,
E电池
Cu电极
0.344V
第15页/共88页
(2)甘汞电极
由于氢电极使用不便,且实验条件苛 刻,故常用甘汞电极作为参比电极。
甘汞电极有多种,但基本 原理相同。
甘汞电极由汞、氯化亚汞 (Hg2Cl2.甘汞 )、和饱和氯 化钾溶液组成。
2 0.344 0.059 log[0.01]
2 0.285(V ) 换算成对SCE的电极电位为:
Cu 0.285 0.242 0.043(V )
第10页/共88页
3、电极电位的测量
单个电极的电位是无法测 量的,因此,由待测电极 与参比电极组成电池用电 位计测量该电池的电动势, 即可得到该电极的相对电 位。相对于同一参比电极 的的不同电极的相对电位 是可以相互比较的,并可 用于计算电池的电动势。 常用的参比电极有标准氢 电极与甘汞电极。
Na2O 22% CaO 6%
SiO2 72% 玻璃泡中装有PH一定的溶液(内参比溶液, 0.1 mol·l-1),其中插入一根银-氯化银电极作为内 参比电极。
第27页/共88页
当玻璃电极与待测溶液接触时,发生如下离 子交换反应:
H++Na+GI=Na++H+GI
溶液 玻璃 溶液 玻璃
上述反应的平衡常数很大,有利于反应相右 进行,进而在酸性和中性环境下,在玻璃表面上形 成一个硅酸水化层。由硅酸水化层到膜内部,H+ 数目逐渐减少,Na+数目 逐渐增加,再膜的中部 为“干玻璃层”。
2)
Fe3 e Fe2
Cu电极
Cu电极
25℃时,该电池的电动势为+0.344V,
即,
E电池
Cu电极
0.344V
第15页/共88页
(2)甘汞电极
由于氢电极使用不便,且实验条件苛 刻,故常用甘汞电极作为参比电极。
甘汞电极有多种,但基本 原理相同。
甘汞电极由汞、氯化亚汞 (Hg2Cl2.甘汞 )、和饱和氯 化钾溶液组成。
2 0.344 0.059 log[0.01]
2 0.285(V ) 换算成对SCE的电极电位为:
Cu 0.285 0.242 0.043(V )
第10页/共88页
3、电极电位的测量
单个电极的电位是无法测 量的,因此,由待测电极 与参比电极组成电池用电 位计测量该电池的电动势, 即可得到该电极的相对电 位。相对于同一参比电极 的的不同电极的相对电位 是可以相互比较的,并可 用于计算电池的电动势。 常用的参比电极有标准氢 电极与甘汞电极。
Na2O 22% CaO 6%
SiO2 72% 玻璃泡中装有PH一定的溶液(内参比溶液, 0.1 mol·l-1),其中插入一根银-氯化银电极作为内 参比电极。
第27页/共88页
当玻璃电极与待测溶液接触时,发生如下离 子交换反应:
H++Na+GI=Na++H+GI
溶液 玻璃 溶液 玻璃
上述反应的平衡常数很大,有利于反应相右 进行,进而在酸性和中性环境下,在玻璃表面上形 成一个硅酸水化层。由硅酸水化层到膜内部,H+ 数目逐渐减少,Na+数目 逐渐增加,再膜的中部 为“干玻璃层”。
2)
Fe3 e Fe2
仪器分析培训教学课件:电位滴定法(理论与操作)

0.183 0.194 0.233 0.316 0.340 0.351 0.358 0.373
25.50
0.385
△E/△V V /ml
0.11 0.39 0.83 0.24 0.11 0.07 0.050 0.024
△2E/△V2
2.8 4.4 -5.9 -1.3 -0.4
五、滴定终点确定的方法
E-V曲线法:取中点
但准确性稍差
一阶微商法 ΔE/ΔV - V曲线法
二阶微商法 Δ2E/ΔV2 - V曲线法
五、滴定终点确定的方法
1、E-V曲线法:取中点,但准确性稍差
以加入滴定剂的体积V(ml)为横坐标、 对应的电动势E(mv)为纵坐标, 绘制 E-V曲线, 曲线上的拐点所对应的体积为滴定终点
五、滴定终点确定的方法
2、一阶微商法 ΔE/ΔV - V曲线法
• 曲线的一部分用外延法绘制, 其最高点对应于滴定终点时 所消耗滴定剂的体积。
1、△E/△V值—一阶微商的计算
ΔE/ΔV :为电位(E)的变化值与相对应的加入滴定剂体 积的增量之比,是一阶微商dE/dv的近似值,例如: 24.10~24.20之间,相应的ΔE/ΔV 为:
E/mV
: : +168 +148 +87 -93 -102 -107
△V
:
: 0.10 0.10 0.10 0.10 0.10
:
△E
:
: -20 -61 -180 -9 -5
:
△E/△V
:
: -200 -610 -1800 -90 -50
:
△2E/△V2
-4100 -11900 +17100 +400
基本操作
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
指示电极和参比电极
指示电极
常用的指示电极,就类型来说可分为3类:
\\\DfsRoot$\IBD\HKG\Project\DAQO\Execution\Management Presentation\092308_Pre-IPO Investor Mgmt Pres_V11_DTP.ppt
3如果由于样品数据的错误输入或公式的错误而造成结果错误,无需重新 滴定,只要将相关数值重新输入或修改后仪器重新计算结果。
\\\DfsRoot$\IBD\HKG\Project\DAQO\Execution\Management Presentation\092308_Pre-IPO Investor Mgmt Pres_V11_DTP.ppt
\\\DfsRoot$\IBD\HKG\Project\DAQO\Execution\Management Presentation\092308_Pre-IPO Investor Mgmt Pres_V11_DTP.ppt
电位滴定法是在滴定过程中通过测量电位变化以确定滴定 终点的方法。和直接电位法相比,电位滴定法不需要准确 的测量电极电位值,因此,温度、液体接界电位的影响并 不重要,其准确度优于直接电位法,普通滴定法是依靠指 示剂颜色变化来指示滴定终点,如果待测溶液有颜色或浑 浊时,终点的指示就比较困难,或者根本找不到合适的指 示剂。电位滴定法是靠电极电位的突跃来指示滴定终点。 在滴定到达终点前后,滴液中的待测离子浓度往往连续变 化n个数量级,引起电位的突跃,被测成分的含量仍然通过 消耗滴定剂的量来计算。
沉淀滴定运用
参比电极:双盐桥甘汞电极;甘汞电极 (1) 指示电极:银电极 标准溶液:AgNO3; 滴定对象:Cl-、Br-、I-、CNS-、 S-2、CN-等。 可连续滴定 Cl-、Br-、I-;
\\\DfsRoot$\IBD\HKG\Project\DAQO\Execution\Management Presentation\092308_Pre-IPO Investor Mgmt Pres_V11_DTP.ppt
\\\DfsRoot$\IBD\HKG\Project\DAQO\Execution\Management Presentation\092308_Pre-IPO Investor Mgmt Pres_V11_DTP.ppt
电位滴定分析法的装置(简易)
1. 手动电位滴定装置 2. 自动电位滴定装置
\\\DfsRoot$\IBD\HKG\Project\DAQO\Execution\Management Presentation\092308_Pre-IPO Investor Mgmt Pres_V11_DTP.ppt
瑞士万通电位滴定仪
自动电位滴定计滴定工作原理
1取样:取样量尽量可能控制在使滴定剂消耗在滴定管体积的 20-90%范围;在 能满足精度的前提下取量越少越好。避免 超过滴定管满管体积。 2如果处理后的样品溶液太少,可以适当增加溶剂或选用较小 体积的滴定杯,以满足所有电极能够浸没在样品溶液中。 注意搅拌子不能触到电极以及滴定管头。
技巧与提示(瑞士万通电位滴定仪)
能斯特方程命名于它的提出者德国化学家能斯特(WaltherNernst)。 沃尔特.H.能斯特(WaltherH.Nernst)(1864-1941),1920年诺贝尔化学奖 获得者,以表彰他在热化学方面的工作。他对化学热力学的贡献是建立起联系 化学能和原电池电极电位关系的方程式。 在电化学中,能斯特(Nernst)方程用来计算电极上相对于标准电势(E0)来 说的指定氧化还原对的平衡电压(E)。能斯特方程只能在氧化还原对中两种物质 同时存在时才有意义。
4在自动识别等当点的模式下(MET、DET),滴定是过量的,因此每次滴 定结束后一定要仔细冲洗电极以及滴头,以免过量的滴定剂被带入到 下一个样品中。 5电极上的 电解液孔塞在使用时打开,停用时堵上。
电位滴定法的特点 电位滴定法比起用指示剂的容量分析法它有许多优越的地 方:首先可用于有色或混浊的溶液的滴定,使用指示剂是 不行的;在没有或缺乏指示剂的情况下,用此法解决;还 可用于浓度较稀的试液或滴定反应进行不够完全的情况; 灵敏度和准确度高,并可实现自动化和连续测定。因此用 途十分广泛。
\\\DfsRoot$\IBD\HKG\Project\DAQO\Execution\Management Presentation\092308_Pre-IPO Investor Mgmt Pres_V11_DTP.ppt
\\\DfsRoot$\IBD\HKG\Project\DAQO\Execution\Management Presentation\092308_Pre-IPO Investor Mgmt Pres_V11_DTP.ppt
\\\DfsRoot$\IBD\HKG\Project\DAQO\Execution\Management Presentation\092308_Pre-IPO Investor Mgmt Pres_V11_DTP.ppt
\\\DfsRoot$\IBD\HKG\Project\DAQO\Execution\Management Presentation\092308_Pre-IPO Investor Mgmt Pres_V11_DTP.ppt
方法的调试与修改(瑞士万通电位滴定仪)
技巧与提示(瑞士万通电位滴定仪)
\\\DfsRoot$\IBD\HKG\Project\DAQO\Execution\Management Presentation\092308_Pre-IPO Investor Mgmt Pres_V11_DTP.ppt
自动电位滴定计就是借助于电子技术以实现电位滴定自动化的仪器。 自动电位滴定计的设计基本上可分为两类。第一类为自动记录滴定曲 线的自动电位滴定计,它利用电子仪器自动滴加滴定剂,并记录滴定 剂体积和电池电动势的变化。第二类为自动控制滴定终点的自动电位 计。此类仪器有两种形式。一种是滴定到预定终点电位即自动停止, 自动停止滴定,首先根据被测物质及滴定剂的性质确定滴定终点电位 ,在滴定过程中,仪器将它自动滴定的电池电动势E与预定终点电位E′ 进行比较,用其差值E- E′去控制滴定管的开关控制器动作,在还没到 滴定预定终点电位时,滴定管为通路,自动地进行滴定,一旦到达预 定终点电位,滴定管即自动闭合,停止滴定;另一种是利用二次微商 D2E/DV2 电信号突然降落以确定滴定终点。因为在等当点时,二次微 商从极大值降到最小值。仪器内部的电子线路能将电池电动势转变为 二次微商并经放大后去启动继电器,在等当点前,二次微商电信号变 化小,不足以使继电器动作,在等当点时,由于电信号的大幅度变化 才会使继电器动作,并通过电磁阀关闭滴定管。
Pt Au
其电池反应为:
2.惰性金属电极
3.离子选择性电极
氧化态+ne≒还原态
指示电极和参比电极
离子选择性电极的电位与溶液里某给定离子的活度对数成线性关系.
指示电极和参比电极
参比电极
\\\DfsRoot$\IBD\HKG\Project\DAQO\Execution\Management Presentation\092308_Pre-IPO Investor Mgmt Pres_V11_DTP.ppt
电位滴定分析法
\\\DfsRoot$\IBD\HKG\Project\DAQO\Execution\Management Presentation\092308_Pre-IPO Investor Mgmt Pres_V11_DTP.ppt
电化学分析法分类
电位分析法分为直接电位法和电位滴滴定都可以采用电位滴定法;特别 适合于弱酸(碱)的滴定;可在非水溶液中滴 定极弱酸; 指示电极:玻璃电极,锑电极;
\\\DfsRoot$\IBD\HKG\Project\DAQO\Execution\Management Presentation\092308_Pre-IPO Investor Mgmt Pres_V11_DTP.ppt
1.金属-金属离子电极 如Cu Ag Hg等. Ag++e≒Ag 用能斯特方程式表示 φMn+/ Ag =φo Ag +/ Ag +RT/nFlna Ag + =φo Ag +/ Ag +0.058loga Ag +
\\\DfsRoot$\IBD\HKG\Project\DAQO\Execution\Management Presentation\092308_Pre-IPO Investor Mgmt Pres_V11_DTP.ppt
电位分析法
电位滴定法是依据滴定过程中,电池电动势的突变以 确定滴定终点的分析方法。
直接电位法是通过测量电池电动势以确定待测离子活 度的方法。
电位分析法的依据
电位分析法是一种电化学分析方法。电极的电位与其乡相应离子活度之间的关系 可以用能斯特方程式表示。例如,某种金属M插入该金属离子的溶液中所构成 的电极,其电极电位为:
B沉淀滴定,
C络合滴定,
电位滴定法的应用
D氧化还原滴定。
A中和滴定(酸碱滴定)
按照滴定反应的类型,电位滴定可用于:
\\\DfsRoot$\IBD\HKG\Project\DAQO\Execution\Management Presentation\092308_Pre-IPO Investor Mgmt Pres_V11_DTP.ppt
1.甘汞电极 半电池可以表示为: Hg, Hg2Cl2 ︱KCl(溶液) 电极反应为:Hg2Cl2(固)+2e≒2Hg (液)+2Cl2.银-氯化银电极 半电池可以表示为: Ag,AgCl(固) ︱KCl(溶液) 电极反应为:AgCl (固)+e≒ Ag(固) +Cl- (溶液)
电位滴定法定义 电位滴定法
