转染方法的比较
转化和转染的概念和区别资料

转化和转染的概念和区别转染和转化的区别转染的定义是“将具生物功能的核酸转移或运送到细胞内并使核酸在细胞内维持其生物功能”。
其中,核酸包括DNA(质粒和线性双链DNA),反义寡核苷酸及RNAi(RNA interference)。
基因转染技术已广泛应用于基因组功能研究(基因表达调控,基因功能,信号转导和药物筛选研究)和基因治疗研究。
基因转染需要一定的转染试剂将带有目的基因的载体运送到细胞内。
早期的磷酸钙转染法转染效率很低,且对很多细胞株无效,因此不能满足很多科研工作的需要。
目前,最常用的转染试剂是阳离子脂质体和阳离子聚合物,它们在克服细胞屏障方面跟病毒有很相象的特征,容易透过细胞膜。
其中,阳离子脂质体在体外基因转染中有很高的效率,然而在体内,它迅速被血清清除,在肺组织内累积,诱发强烈的抗炎反应,这将导致高水平的毒性,因此,在很大程度上限制了其应用。
由于阳离子脂质体的局限性,阳离子聚合物转染试剂日益受到重视。
转化特指将质粒DNA或以其为载体构建的重组DNA导入细菌体内,使之获得新的遗传特性的一种方法。
它是微生物遗传、分子遗传、基因工程等研究领域的基本实验技术之一。
受体细胞经过一些特殊方法(如:电击法,CaCl2等化学试剂法)处理后,使细胞膜的通透性发生变化,成为能容许外源DNA 分子通过的感受态细胞。
进入细胞的DNA分子通过复制、表达实现遗传信息的转移,使受体细胞出现新的遗传性状。
由外来DNA引起生物体遗传性状改变的过程称为转化(transformation)。
噬菌体常常可感染细菌并将其DNA注入细菌体内,也可引起细菌遗传性状的改变。
通过感染方式将外来DNA引入宿主细胞,并导致宿主细胞遗传性状改变的过程称为转染(transfection)。
转染是转化的一种特殊形式。
基因工程:有目的的通过分子克隆技术,人为的操作改造基因,改变生物遗传性状的系列过程。
载体:能在连接酶的作用下和外源DNA片段连接并运送DNA分子进入受体细胞的DNA分子。
细胞转染实验总结

细胞转染实验总结引言细胞转染是生物学研究中常用的实验技术,用于将外源DNA、RNA或蛋白质引入到目标细胞中。
通过细胞转染,可以实现基因表达、基因敲除、蛋白质定位等多种研究目的。
本文总结了细胞转染实验的基本原理、常用方法和注意事项。
基本原理细胞转染实验的基本原理是通过物理或化学方法将外源DNA、RNA或蛋白质传递到目标细胞内。
细胞内的转染物质可以在细胞内进行表达、干扰或定位,从而实现对目标细胞功能的研究。
常见的细胞转染方法包括:1.电穿孔法:通过应用电流使细胞膜发生临时孔洞,从而使转染物质进入细胞内。
2.化学转染法:利用聚合物、脂质体等化学物质,将目标物质载体化,并与细胞膜结合,实现内源化学转染。
3.病毒载体介导转染法:利用病毒(如腺病毒、逆转录病毒等)作为载体,传递目标物质到细胞内。
常用方法1. 电穿孔法电穿孔法是细胞转染中常用的物理方法之一。
通过应用高电压或脉冲电场,可以使细胞膜发生临时性孔洞,从而使外源DNA、RNA或蛋白质进入细胞内。
常用的电穿孔方法包括:•电转染:将转染物质与细胞悬浮液混合后施加电脉冲,使细胞膜发生孔洞并吸收转染物质。
•静电转染:将转染物质与带正电荷的载体(如聚乙烯亚胺)混合后,与带负电荷的细胞膜相互吸引,从而将转染物质导入细胞内。
2. 化学转染法化学转染法是一种通过化学物质介导的细胞转染方法。
常用的化学转染法有:•使用聚合物:聚合物(如聚乙烯亚胺、聚合丙烯酸等)能与转染物质结合成复合物,使其稳定且易于细胞摄取。
•脂质体转染:脂质体是由磷脂、胆固醇等成分构成的脂质双层结构,可以包裹转染物质形成脂质体-转染物复合物,通过与细胞膜融合实现内源转染。
3. 病毒载体介导转染法病毒载体介导转染法是细胞转染中较常用的方法之一。
常见的病毒载体包括:•腺病毒:腺病毒是一种双链DNA病毒,可以携带大片段的外源DNA,并有效地传递到目标细胞内。
•逆转录病毒:逆转录病毒(如 lentivirus、retrovirus等)可以将外源RNA逆转录成DNA,然后整合到宿主细胞基因组中。
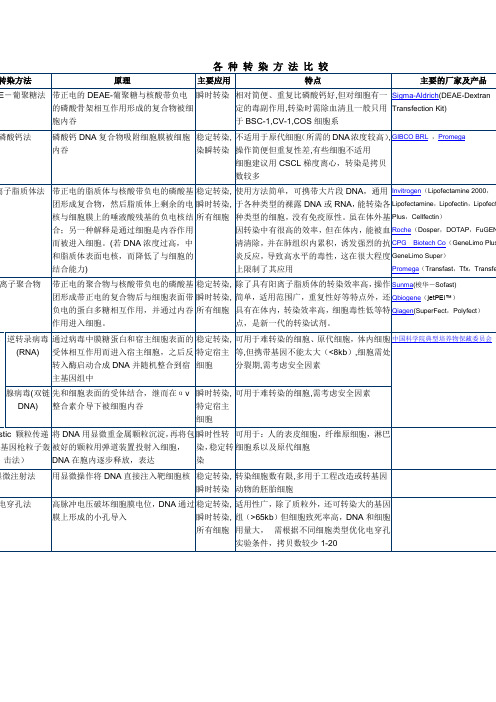
各种转染方法比较

各种转染方法比较
转染是一种常见的基因表达技术,在微生物、植物、动物等生物的基
因组研究与分析中被广泛应用。
它能够将外源DNA片段引入生物体,从而
产生基因表达,使得目的基因被特定的染色体位置激活。
此外,在转染中
作为功能基因的外源基因,可以约束提示其他的基因表达。
目前,转染在科学领域的应用众多,主要有包二聚体转染、质粒转染、酶联转染、质粒转化、脂质体转染、病毒转染等几种技术。
1、包二聚体转染
包二聚体转染是由三部分组成:DNA片段,10%二聚体和CaCl2溶液,将需要转染的DNA片段溶解在CaCl2溶液中,添加二聚体并调节pH值,
即可形成包二聚体复合体,将复合体注入细胞内,从而达到转染目的。
应
用包二聚体的转染方法可以很好地穿越细胞膜,可以达到突变外源基因的
目的,并且细胞损伤小,可以获得相对高的转染能力。
2、质粒转染
质粒转染是一种常见的转染技术,它是由PEG6000、KCl、CaCl2等混
合物组成,将要转染的DNA与混合物结合,然后把质粒-DNA复合物注入
细胞内,即可转染。
U937单核细胞几种不同转染方法的比较

Co p r s n o he t a s e to f i i nc f m a io f t r n f c i n e fc e y o U9 7 m o o y e y d f e e tm e h d 3 n c t s b if r n t o s
[ btat Obet e T rn fc rcmbn n ts d pRE 2E F - P no U9 7 mo oye y A s c] r jci o ta set eo ia tpami I S ~ G P TF I it 3 n c tsb v 2
dfee tm eh d ,a d t c ur h t o t etrta se t n ef in y M eh d Th el r i r n t o s n o a q i t eme h d wih b te r n fci fi e c . f e o c to s e c l we e s dvd d it r u s ta se td b ifrn to swi lcr p r t n, Efe tn r n fcin r a e t iie n o6 g o p r n fce y dfee tme h d t ee to o a i h o fce e ta se t e g n , o
将 重 组 pR S G PT P一 粒 体 外 成 功 转 染 人 U9 7单 核 细 胞 中 , 过 优 I E 2E F F I 2质 3 通
化 转 染 方 法 提 高 转 染 效 率 、 低 对 细 胞 活 力 的 影 响 , 基 因 治 疗 提供 了实 验 基 础 。 降 为
【 键词 1 U 3 关 9 7单 核 细 胞 ; 转 染 效 率 ; 电穿 孔 ; 脂 质 体 【 图分 类号 】 Q 3 3 3 中 4 . 7 【 文献 标 志码 】 A
转化和转染

转染和转化的区别转染的定义是“将具生物功能的核酸转移或运送到细胞内并使核酸在细胞内维持其生物功能”。
其中,核酸包括DNA(质粒和线性双链DNA),反义寡核苷酸及RNAi(RNA interference)。
基因转染技术已广泛应用于基因组功能研究(基因表达调控,基因功能,信号转导和药物筛选研究)和基因治疗研究。
基因转染需要一定的转染试剂将带有目的基因的载体运送到细胞内。
早期的磷酸钙转染法转染效率很低,且对很多细胞株无效,因此不能满足很多科研工作的需要。
目前,最常用的转染试剂是阳离子脂质体和阳离子聚合物,它们在克服细胞屏障方面跟病毒有很相象的特征,容易透过细胞膜。
其中,阳离子脂质体在体外基因转染中有很高的效率,然而在体内,它迅速被血清清除,在肺组织内累积,诱发强烈的抗炎反应,这将导致高水平的毒性,因此,在很大程度上限制了其应用。
由于阳离子脂质体的局限性,阳离子聚合物转染试剂日益受到重视。
转化特指将质粒DNA或以其为载体构建的重组DNA导入细菌体内,使之获得新的遗传特性的一种方法。
它是微生物遗传、分子遗传、基因工程等研究领域的基本实验技术之一。
受体细胞经过一些特殊方法(如:电击法,CaCl2等化学试剂法)处理后,使细胞膜的通透性发生变化,成为能容许外源DNA分子通过的感受态细胞。
进入细胞的DNA分子通过复制、表达实现遗传信息的转移,使受体细胞出现新的遗传性状。
由外来DNA引起生物体遗传性状改变的过程称为转化(transformation)。
噬菌体常常可感染细菌并将其DNA注入细菌体内,也可引起细菌遗传性状的改变。
通过感染方式将外来DNA 引入宿主细胞,并导致宿主细胞遗传性状改变的过程称为转染(transfection)。
转染是转化的一种特殊形式。
基因工程:有目的的通过分子克隆技术,人为的操作改造基因,改变生物遗传性状的系列过程。
载体:能在连接酶的作用下和外源DNA片段连接并运送DNA分子进入受体细胞的DNA分子。
稳定转染VS瞬时转染

稳定转染VS瞬时转染展开全文生物通报道:转染是将外源遗传物质导入真核细胞的过程,是细胞和分子生物学研究的重要工具,可用于研究基因表达对细胞生理水平的影响。
不论是质粒、DNA还是各种RNA(mRNA、siRNA或microRNA),要将这些外源核酸转入细胞并不容易,它们必须穿过细胞膜这层屏障才能进入细胞质。
转染方法可分为物理转染和化学转染,物理转染方法包括电穿孔、显微注射和基因枪等,化学转染可使用磷酸钙共沉淀、DEAE-Dx或基于阳离子脂质的转染试剂。
上述方法都可以解决转染面临的主要挑战,即让带负电荷的核酸分子穿过带负电的细胞膜。
物理转染方法一般是在细胞膜上打洞来克服静电排斥,使核酸插入。
而化学转染中,一般是利用带正电的转染试剂将带负电的核酸包裹起来。
这些方法都可以实现转染,可谓条条大路通罗马,那么究竟是选瞬时转染好还是选稳定转染好呢?瞬时转染的细胞中,外源基因得以表达但它们并不会整合到细胞的基因组中,也就不会被复制。
细胞中瞬时转染的外源基因表达时间有限,通常仅持续几天,直到外源基因在细胞分裂过程中因各种因素丢失为止我们如何区分细胞是否转染成功了呢?在转染质粒中往往都含有一个报告基因,来指示细胞中目标基因是否存在,这样的报告基因一般可以在转染后一两天内检测到。
稳定转染可以在瞬时转染的基础上建立,只不过需要一个重要的偶发过程:在少数转染细胞中,外源基因能够整合到细胞的基因组中。
外源基因成为细胞基因组的一部分从而得以复制,这就是稳定转染细胞的标志。
稳定转染细胞的子代细胞也同样表达外源基因,由此形成稳定转染的细胞系。
在建立上述稳定转染细胞系时,我们需要使用选择性标记来区分瞬时转染与稳定转染。
将这些选择性标记与基因共表达,我们就可以筛选出外源基因已成功整合到基因组的细胞,同时剔除瞬时转染的细胞。
将外源基因与抗生素抗性基因共转染(如新霉素抗性基因neo)是一种常用方法,随后可用相应抗生素(如geneticin或G418)对转染后的细胞进行筛选。
两种转染试剂转染 C2C12 细胞效率比较分

两种转染试剂转染 C2C12 细胞效率比较分精品论文两种转染试剂转染 C2C12 细胞效率比较分析韦伟,赵元元,张维娅,赵书红,李新云5 ,农业动物遗传育种与繁殖教育部重点实验室~华中农业大学~武汉 430070, 摘要:C2C12 细胞是鼠的骨骼肌成肌细胞~常用于体外研究肌细胞成肌分化~研究表明 C2C12 细胞的转染效率较低~为了提高 C2C12 细胞的转染效率~建立理想的转染条件~本研究对比分析了 FuGENE HD 和 Lipofectamine 2000 两种常用转染试剂的转染效率。
研究结果表明10 FuGENE HD 转染寡核苷酸的效率比 Lipofectamine 2000 高~而转染质粒的效率比Lipofectamine 2000 低。
另外我们还发现培养基中的血清会降低细胞的转染效率。
本研究结果为提高 C2C12 细胞的转染效率提供了新的信息。
关键词:转染效率,寡核苷酸,质粒,C2C12 细胞中图分类号:Q-3315Compare analysis of the transfection efficiency of twotransfection regents in C2C12 CellsWei Wei, Zhao Yuanyuan, Zhang Weiya, Zhao Shuhong, Li Xinyun(Key Lab of Agricultural Animal Genetics, Breeding and Reproduction of Ministry of Education,20 Huazhong Agricultural University, WuHan 430070)Abstract: C2C12 cells are the myoblast of mice, which are used asthe model for investigating the differentiation of myoblast in vitro. The transfection efficiency of the C2C12 cells was not good in many studies. In order to improve the transfection efficiency of C2C12 cells and contribute an ideal condition of transfection. The transfection efficiency of two transfection reagents, FuGENE25 HD and Lipofectamine 2000, was analyzed in this study. According the results, the transfection efficiency of FuGENE HD was higher than that of Lipofectamine 2000 when oligo nucleic acids was transfected, but it was lower than Lipofectamine 2000 when plasmid was transfected in the C2C12 cells. Also, we found that serum in cultured medium could inhibit the transfection efficiency. These results offered useful informationfor improving the transfection efficiency of30 C2C12 cells.Key words: transfection efficiency; oligo nucleic acids; plasmid;C2C12 cells0 引言简转染是指将外源遗传物质转入到真核细胞内的过程。
各种转染方法比较

各种转染方法比较不同的实验室转染方法选择会依赖于多个相关因素,如目标细胞类型、转染效率、细胞毒性、需求的表达时间、实验的规模和预算等。
以下是一些常见的转染方法的比较:1. 离子交换法(Calcium phosphate transfection)离子交换法是最早开发和使用的转染方法之一、它使用磷酸钙和DNA或RNA的复合物在细胞表面形成凝析沉淀物。
该方法简单、经济且较为普遍,适用于许多细胞类型。
然而,它的转染效率较低,存在较多的细胞毒性。
2. 迷走转染法(Lipofection)迷走转染法是当前最常用的转染技术之一,通过磷脂体(例如Lipofectamine)与质粒DNA形成复合物。
该方法转染效率高,而且适用于许多类型的细胞,包括哺乳动物和非哺乳动物。
然而,迷走转染法存在一些限制,如细胞毒性、稳定性较差,和细胞特异性。
3. 电穿孔法(Electroporation)电穿孔法是通过应用电场使细胞膜暂时性孔化来实现转染效果。
它可以用于转染各种类型的细胞,包括哺乳动物、鸟类和植物。
电穿孔法的转染效率高,但存在一定的细胞毒性和细胞损伤风险。
此外,电穿孔设备的成本较高,需要专门训练的技术人员来操作。
4. 病毒载体转染法(Viral vector transfection)病毒载体转染法使用经修饰的病毒作为转染载体,可实现高效的基因传递和表达。
常用的病毒载体包括腺病毒、衣壳病毒和逆转录病毒。
这些病毒对于不同类型的细胞具有不同的亲和力和转染效率。
然而,病毒载体转染法的主要限制是细胞对病毒的感染能力,以及在临床应用中可能引发的安全性问题。
5. 直接注射法(Direct microinjection)直接注射法是一种机械刺伤细胞膜直接将DNA注入细胞的方法。
这种方法对于特定的细胞类型具有高效转染的能力,如哺乳动物受精卵和干细胞。
它可以实现精确控制和单细胞水平的转染,但需要昂贵的设备和专业技能。
总结起来,转染方法的选择应根据实验的具体需求来进行。
各种细胞转染方法比较

GIBCO BRL,Promega
阳离子脂质体法
带正电的脂质体与核酸带负电的磷酸基团形成复合物,然后脂质体上剩余的电核与细胞膜上的唾液酸残基的负电核结合;另一种解释是通过细胞是内吞作用而被进入细胞。(若DNA浓度过高,中和脂质体表面电核,而降低了与细胞的结合能力)
显微注射法
用显微操作将DNA直接注入靶细胞核
稳定转染,瞬时转染
转染细胞数有限,多用于工程改造或转基因动物的胚胎细胞
电穿孔法
高脉冲电压破坏细胞膜电位,DNA通过膜上形成的小孔导入
稳定转染,瞬时转染,所有细胞
适用性广,除了质粒外,还可转染大的基因组(>65kb)但细胞致死率高,DNA和细胞用量大,需根据不同细胞类型优化电穿孔实验条件,拷贝数较少1-20
Roche(Dosper,DOTAP,FuGENE6)
CPG Biotech Co(GeneLimoPlus,GeneLimoSuper)
Promega(Transfast,Tfx,Transfectam)
阳离子聚合物
带正电的聚合物与核酸带负电的磷酸基团形成带正电的复合物后与细胞表面带负电的蛋白多糖相互作用,并通过内吞作用进入细胞。
瞬时转染,特定宿主细胞
可用于难转染的细胞,需考虑安全因素
中国科学院典型培养物保藏委员会
Biolistic颗粒传递法(基因枪粒子轰击法)
将DNA用显微重金属颗粒沉淀,再将包被好的颗粒用弹道装置投射入细胞,DNA在胞内逐步释放,表达
瞬时性转染,稳定转染
可用于:人的表皮细胞,纤维原细胞,淋巴细胞系以及原代细胞
稳定转染,瞬时转染,所有细胞
使用方法简单,可携带大片段DNA,通用于各种类型的裸露DNA或RNA,能转染各种类型的细胞,没有免疫原性。虽在体外基因转染中有很高的效率,但在体内,能被血清清除,并在肺组织内累积,诱发强烈的抗炎反应,导致高水平的毒性,这在很大程度上限制了其应用
各种转染方法比较

各种转染方法比较转染是将外源DNA或RNA导入体细胞的一种常用技术,用于研究基因功能、疾病机制、基因治疗等领域。
常用的转染方法包括化学法、电穿孔法、病毒载体介导转染和生物矢量直接注射法等。
下面将对这些转染方法进行详细比较。
1.化学法:化学法是最简单、最常用的转染方法之一,主要通过化学试剂与DNA或RNA形成复合物,进而被细胞摄取。
常用的化学试剂有钙磷酸盐、聚乙烯亚胺(PEI)、脂质体、高分子聚合物等。
化学法的优势在于易操作、适用于不同细胞类型,且无需特殊设备。
但其转染效率相对较低,引起细胞毒性的风险较高。
2.电穿孔法:电穿孔法又称为电转染法,通过利用电场作用使细胞膜发生瞬时通透性,使外源DNA或RNA进入细胞。
这种方法可使用电脉冲仪或特殊转染设备进行操作,适用于多种细胞类型。
相比于化学法,电穿孔法的转染效率更高,但对细胞的毒性稍高。
3.病毒载体介导转染:病毒载体介导转染是一种高效的转染方法,常用的病毒载体有腺病毒(Adenovirus)、腺相关病毒(Adeno-associated virus,AAV)、逆转录病毒(Retrovirus)和慢病毒(Lentivirus)等。
这些病毒载体不仅能将外源DNA或RNA导入细胞,还能使其在细胞内稳定表达。
病毒载体介导转染的优势在于高转染效率、稳定表达,适用于许多细胞类型。
然而,为了避免潜在的致病性和免疫反应,需要选择无毒性、无致病性的病毒载体。
4.生物矢量直接注射法:生物矢量直接注射法是将外源DNA或RNA直接注射到体内,让其进入目标细胞。
这种方法适用于许多动物模型研究,如小鼠、斑马鱼等。
生物矢量直接注射法的优势在于转染效率高、实验操作简单,但对于人体病理研究等实验要求较高的场景,其应用范围较窄。
根据以上比较,选择适合自己研究需求和细胞类型的转染方法非常重要。
需要考虑的因素包括转染效率、细胞毒性、操作难度、成本等。
在实际应用中,有时也可结合多种方法,例如将化学法与电穿孔法相结合,能够提高转染效率。
两种常用转染试剂转染siRNA至HL-60细胞转染效率的比较

两种常用转染试剂转染siRNA至HL-60细胞转染效率的比较王巍;张晓希;刘新光【摘要】目的比较两种常用转染试剂转染小干扰RNA(siRNA)至悬浮细胞的转染效率及对细胞毒性的影响.方法以羧基荧光素(FAM)标记的siRNA为报告基因,以lipofectamine 2000和siPORT NeoFX为转染试剂,用流式细胞仪检测转染效率,倒置显微镜观察细胞形态,MTT法检测细胞存活率.结果 siRNA>100 nmol/L 时,lipofectamine 2000的转染效率高于siPORT NeoFX(P<0.05);siRNA<100 nmol/L时,前者低于后者(P<0.05).siRNA终浓度及转染试剂用量相同时,lipofectamine 2000组HL-60细胞存活率与SiPORT NeoFX组比较,差异无统计学意义(P>0.05).结论在使用高浓度siRNA时,lipofectamine 2000对HL-60细胞有较高的转染效率和较小细胞毒性.%Objective To compare the transfection efficiency and cytotoxicity between two cationic transfection reagents. Methods Small interfering RNA(siRNA) marked with FAM as a report gene,lipofectamine 2000 and siPORT NeoFX were used as the transfection reagents. Flow cytometer,microscope and MTT assay were used to detect transfection efficiency and cytotoxicity. Results The transfection efficiency of lipofectamine 2000 was higher than siPORT NeoFX when siRNA was over 100 nmol/L(P<0.05) ,otherwise with siRNA under 100 nmol/L(P<0. 05). At the same siRNA concentration and transfection reagent volume, there was no significant difference of vial cells ratios between two groups(P>0.05). Conclusion lipofectamine 2000is an effective and safe transfection reagent to HL-60 cells when siRNA is over 100 nmol/L.【期刊名称】《重庆医学》【年(卷),期】2011(040)004【总页数】4页(P313-314,318,封2)【关键词】脂质体;转染;RNA,小分子干扰【作者】王巍;张晓希;刘新光【作者单位】广东医学院临床血液检验学教研室,东莞,523808;中国人民解放军第四二二医院,广东湛江,524023;广东医学院检验医学研究所,东莞,523808【正文语种】中文RNA干扰(RNA interference,RNAi)是指在进化过程中高度保守的、由双链RNA 诱发的、同源mRNA高效特异性降解的现象[1-3]。
几种转染方法的比较

几种转染方法的比较
目前,基因转染技术已经发展为分子生物学、生物工程和基因治疗等
领域的重要实用工具,它可以极大地提高研究的效率和准确度,是许多重
要的基础实验的重要手段。
基因转染,就是把DNA片段植入受体细胞,使
其形成完整的外源基因,从而使其编码的蛋白质可以表达出来。
其中,质
粒转染(经典CaCl2转染)、电穿孔转染、膜融合转染、磁珠转染、膜膜
转染、管状细胞转染(cylinder-mediated gene transfer)、病毒转染
和小肠转染等转染方法,是目前比较常用的基因转染方法。
一、质粒转染
质粒转染是将外源DNA片段载体在质粒上,用极低的浓度CaCl2诱导
细胞膜的瞬时通透性,使外源基因可以通过通透的细胞膜进入细胞,这是
质粒转染的原理,也是最常用的一种质粒转染方法。
质粒转染的优点:
(1)操作简单,易于大批量高效率的实验。
(2)操作条件宽松,不受受体细胞类型的限制,可以适应多种宿主
细胞。
(3)转染效率高,可以达到百分之九十以上。
(4)可以通过有效的筛选系统,有效控制外源DNA的插入和表达量。
质粒转染的缺点:
(1)转染过程对细胞毒性较大,转染效率有限。
转染步骤及经验(精华)

转染步骤及经验(精华)一、基础理论转染是将外源性基因导入细胞内的一种专门技术。
分类:物理介导方法:电穿孔法、显微注射和基因枪;化学介导方法:如经典的磷酸钙共沉淀法、脂质体转染方法、和多种阳离子物质介导的技术;生物介导方法:有较为原始的原生质体转染,和现在比较多见的各种病毒介导的转染技术。
理想细胞转染方法,应该具有转染效率高、细胞毒性小等优点。
病毒介导的转染技术,是目前转染效率最高的方法,同时具有细胞毒性很低的优势。
但是,病毒转染方法的准备程序复杂,常常对细胞类型有很强的选择性,在一般实验室中很难普及。
其它物理和化学介导的转染方法,则各有其特点。
需要指出的一点,无论采用哪种转染技术,要获得最优的转染结果,可能都需要对转染条件进行优化。
影响转染效率的因素很多,从细胞类型、细胞培养条件和细胞生长状态到转染方法的操作细节(见后文)。
二、转染操作流程(以常用的6孔板为例)(1) 细胞培养:取6孔培养板,以3x104/cm2密度铺板,37℃5%CO2培养箱中培养至70%~90%汇合。
(不同细胞略有不同,根据实验室优化的条件进行,汇合过分,转染后不利筛选细胞)。
(2) 转染液制备:在EP管中制备以下两液(为转染每一个孔细胞所用的量)A液:用不含血清培养基稀释1-10μg DNA,终量100μL,B液:用不含血清培养基稀释对应量的转染试剂,终量100μL;轻轻混合A、B液(1:1混匀),室温中置15分钟,稍后会出现微浊现象,但并不妨碍转染。
(3) 转染准备:用2mL不含血清培养液漂洗两次,再加入2mL不含血清及PS的培养液。
(4) 转染:把A/B复合物缓缓加入培养液中(缓慢滴加),轻轻摇匀,37℃温箱置6~8小时,吸除无血清转染液,换入正常培养液继续培养。
三、转染注意事项1. 血清A. DNA-阳离子脂质体复合物形成时不能含血清,因为血清会影响复合物的形成。
B.一般细胞对无血清培养可以耐受几个小时没问题,转染用的培养液可以含血清也可以不加,但血清一度曾被认为会降低转染效率,转染培养基中加入血清需要对条件进行优化。
不同转染方法包装慢病毒感染人白血病细胞的比较研究

生物技术进展2019年㊀第9卷㊀第3期㊀262~270CurrentBiotechnology㊀ISSN2095 ̄2341研究论文Articles㊀收稿日期:2019 ̄02 ̄15ꎻ接受日期:2019 ̄04 ̄02㊀基金项目:国家自然科学基金项目(81170228)ꎻ中国医学科学院医学与健康科技创新工程项目(2016 ̄I2M ̄2 ̄001)ꎻ天津市应用基础研究重点项目(16JCZDJC34500)资助ꎮ㊀作者简介:张明英ꎬ硕士研究生ꎬ研究方向为造血微环境和表观遗传调控研究ꎮE ̄mail:zhangmingying@ihcams.ac.cnꎮ∗通信作者:周圆ꎬ研究员ꎬ博士生导师ꎬ研究方向为造血微环境和表观遗传调控研究ꎮE ̄mail:yuanzhou@ihcams.ac.cn不同转染方法包装慢病毒感染人白血病细胞的比较研究张明英1ꎬ㊀袁佳佳1ꎬ㊀张晓茹1ꎬ㊀邢㊀文1ꎬ㊀白㊀洁2ꎬ㊀周㊀圆1∗1.中国医学科学院&北京协和医学院血液病医院(血液学研究所)ꎬ实验血液学国家重点实验室ꎬ天津300020ꎻ2.天津医科大学第二医院ꎬ天津300020摘㊀要:白血病研究中常需要在细胞中进行慢病毒介导的基因过表达或者敲降ꎬ但慢病毒生产方法存在成本高㊁对悬浮细胞感染效率低等问题ꎮ为解决这些问题ꎬ通过比较利用线性聚乙烯亚胺(linearpolyethylenimineꎬLPEI)和脂质体两种转染方法包装成的慢病毒对白血病细胞的感染能力ꎬ以及感染后对细胞生物学特性的影响ꎬ确定不同转染方法在白血病实验研究中的有效性和安全性ꎮ在相同条件下利用LPEI和脂质体产生慢病毒颗粒ꎬ比较发现用LPEI转染法包装的慢病毒滴度略高ꎮ根据病毒感染复数和慢病毒滴度分别感染3种白血病细胞系(K562㊁HL60和HEL)ꎬ两种方法间感染白血病细胞系效率无差别ꎮ在感染不同细胞系时两种不同转染方法对细胞增殖略有影响ꎬ但对其他生物学特性比如细胞诱导分化和克隆形成能力的影响是一致的ꎮ因此在白血病相关研究中ꎬ转染试剂LPEI包装慢病毒方法可以成为更加经济实用的选择ꎮ关键词:LPEIꎻ脂质体ꎻ慢病毒包装ꎻ白血病细胞系DOI:10.19586/j.2095 ̄2341.2019.0016ComparativeStudyonTransductionofLentivirusPackagedwithDifferentTransfectionMethodsinHumanLeukemiaCellsZHANGMingying1ꎬYUANJiajia1ꎬZHANGXiaoru1ꎬXINGWen1ꎬBAIJie2ꎬZHOUYuan1∗1.StateKeyLaboratoryofExperimentalHematologyꎬInstituteofHematologyandBloodDiseasesHospitalꎬChineseAcademyofMedicalScience&PekingUnionMedicalCollegeꎬTianjin300020ꎬChinaꎻ2.TheSecondHospitalofTianjinMedicalUniversityꎬTianjin300020ꎬChinaAbstract:Geneoverexpressionandknockdownmediatedbylentivirusisoftenusedinleukemiaresearch.Therearesomeproblemsꎬsuchashighcostandlowefficiencyinsuspensioncellinfection.Inordertoidentifytheeffectivenessandsafetyofthelentiviruspackagedwithdifferenttransfectionmethodinleukemiaresearchꎬsolvingtheproblemsoflowinfectionefficiencyandhighcostduringthelentivirusproductionꎬwepackagedlentiviruseswithlinearpolyethylenimine(LPEI)andliposomesꎬandthencomparedtheinfectionabilityandtheeffectsonbiologicalcharacteristicsofleukemiacelllinesoflentivirusesproducedwiththesetwomethods.UsingLPEIorliposomestogeneratelentiviralparticlesꎬrespectivelyꎬourstudiesshowedthatthetiteroflentiviruspackagedwithLPEIwasslightlyhigherthanthatpackagedwithliposomesunderthesamepackagingconditions.Threeleukemiacelllines(K562ꎬHL60andHEL)wereinfectedwiththesameamountlentiviralparticlesaccordingtomultiplicityofcellularinfection(MOI)andlentiviraltiterꎬandtherewasnodifferenceininfectionefficiencybetweenthetwogroups.ThecellproliferationofleukemiccellsinfectedwithlentivirusproducedwithLPEIwasslightlyslowerthanthatinliposomegroupꎬtheeffectsoninduceddifferentiationandcolonyformingabilityofthesetwomethodsweresimilar.ThereforeꎬusinglentivirusproducedwithLPEItransfectionmethodcanbeaneconomicalandpracticalchoiceinexperimentalstudiesinleukemia.Keywords:LPEIꎻliposomesꎻlentiviralpackagingꎻleukemiacelllines. All Rights Reserved.㊀㊀白血病是严重危害人民健康的重大疾病ꎬ位列我国肿瘤死亡率的第6位ꎬ而且其发病率还在呈逐年攀升趋势ꎮ关于白血病发生发展的相关研究受到越来越多的关注ꎬ在研究过程中面临着诸多问题ꎬ如悬浮的白血病细胞感染效率低㊁包装慢病毒(lentivirus)价格昂贵等ꎮ包装慢病毒常用的方法有脂质体转染法和聚乙烯亚胺转染法等ꎮ目前脂质体转染法产生的慢病毒滴度较高ꎬ但是包装慢病毒成本比较高ꎮ线性聚乙烯亚胺(linearpolyethylenimineꎬLPEI)作为非病毒类载体一直受到广泛的关注ꎬ而且具有价格便宜㊁配制方便㊁易获取等优点ꎬ在包装慢病毒时是一种非常实用的转染试剂ꎬ被认为可以作为转染试剂在一定程度上解决这些问题ꎬ但是利用其包装的慢病毒颗粒对悬浮的白血病细胞感染效率如何ꎬ对细胞增殖㊁分化等生物学特性有怎样的影响ꎬ一直未见明确报道ꎮ本实验通过分别用线性聚乙烯亚胺(linearpolyethylenimineꎬLPEI)和脂质体 ̄Lipofectamine2000转染试剂将携带SFFV启动子和增强型绿色荧光蛋白(enhancedgreenfluorescentproteinꎬEGFP)标签蛋白的慢病毒载体包装成慢病毒颗粒ꎬ通过比较两种转染试剂对慢病毒包装效率㊁病毒包装后感染白血病细胞系的能力以及感染白血病细胞系后对细胞的毒性作用ꎬ为今后LPEI转染试剂包装慢病毒在白血病研究中的应用提供实验依据ꎮ1㊀材料与方法1.1㊀主要试剂和仪器细胞培养基Dulbecco smodificationofEaglemedium(DMEM)㊁RPMI1640㊁Opti ̄MEM(减血清培养基)㊁脂质体(Lipofectamine2000)㊁CellTraceCFSE细胞增殖试剂盒均购自美国ThermoFisher公司ꎻ胎牛血清(FetalBovineSerumꎬFBS)购自以色列BiologicalIndustries公司ꎻLPEI购自美国AlfaAesar公司ꎻPolybrene㊁全反式维甲酸购自美国Sigma ̄Aldrich公司ꎻCellCountingKit ̄8(CCK8)购自日本Dojindo公司ꎻ流式细胞仪CantoII购自美国BectonDickinson公司ꎻ荧光倒置显微镜TE2000 ̄S购自日本Nikon公司ꎻ高速离心机(型号AvavtiJ ̄26XP)购自美国BeckmanCoulter公司ꎮ1.2㊀质粒包装载体psPAX2㊁pCMV ̄VSV ̄G由英国帝国理工学院ErnestoYague博士惠赠ꎮ慢病毒载体SFFV ̄eGFP由苏州泓迅生物科技有限公司构建ꎮ1.3㊀细胞株及培养条件K562㊁HL60㊁HEL㊁293T细胞均购自ATCC细胞库ꎬ由本所细胞库保存ꎮK562㊁HL60㊁HEL细胞悬浮培养于含10%FBS的RPMI1640培养液中ꎬ293T细胞培养于含10%FBS的DMEM培养液中ꎮ细胞于37ħ㊁5%CO2培养箱中培养ꎬ每2~3天离心换液ꎬ293T细胞在70%~90%融合后经0.125%胰蛋白酶消化后传代ꎮ1.4㊀慢病毒包装1.4.1㊀配制LPEI溶液㊀首先配制HBSꎬ称取2.19gNaCl溶于ddH2O中ꎬ用HEPES和1mol/LNaOH调pH至7.4ꎬ定容至250mL后ꎬ过0.2μm滤膜后放4ħ储存备用ꎮ称量LPEI粉末0.05mg溶于配好的50mLHBS中(终浓度为1mg/mL)ꎬ室温摇床过夜后观察LPEI粉末完全溶解后过0.2μm滤膜ꎬ分装储存在4ħ冰箱ꎮ1.4.2㊀用LPEI或脂质体包装慢病毒㊀LPEI转染法如图1所示:①45μLLPEI(1mg/mL)+900μLDMEM培养基室温静置5minꎻ②15μg质粒(慢病毒质粒10μgꎻpsPAX24μgꎻpCMV ̄VSV ̄G1μg)+900μLDMEM培养基ꎬ将①逐滴加入②中(LPEI加入质粒混合物中)ꎬ室温静置20minꎮ脂质体转染法如图1所示:①30μLLipo2000+500μLOPTI ̄MEM室温静置5minꎻ②15μg质粒(慢病毒质粒10μgꎻpsPAX24μgꎻpCMV ̄VSV ̄G1μg)+500μLOPTI ̄MEMꎬ将②逐滴加入①中(质粒混合物加入Lipo2000中)ꎬ室温静置10~20minꎮ取对数生长期的293T细胞ꎬ按每皿1ˑ107细胞接种一个10cm2培养皿ꎬ待细胞汇合至70%~90%ꎬ将培养皿中的细胞培养液换成4mL含有新鲜10%FBS的DMEMꎮ将PEI/脂质体与质粒的混合液逐滴㊁缓慢加入10cm皿中ꎬ轻轻晃动混匀ꎬ37ħ5%CO2温箱培养ꎮ培养6~8h后换5mL新鲜的DMEM/10%FBSꎮ1.4.3㊀慢病毒浓缩㊀分别于48h㊁72h收集病毒于离心管中ꎬ将收集的48h㊁72h病毒上清合并ꎬ2000r/min离心10min去除细胞碎片ꎬ上清经362张明英ꎬ等:不同转染方法包装慢病毒感染人白血病细胞的比较研究. All Rights Reserved.图1㊀脂质体和LPEI转染方法实验流程图Fig.1㊀FlowchartofliposomeandLPEItransfectionmethod.0.45μm滤膜过滤到病毒超离管中ꎬ4ħ20000r/min高速离心2.5hꎮ将浓缩后的病毒分装至EP管中放置-80ħ备用ꎮ1.5㊀病毒滴度测定提前一天将293T细胞按每个孔1ˑ106细胞接种于六孔板中ꎬ20~24h左右观察汇合度在70%~90%ꎮ按浓缩病毒原液及1ʒ10㊁1ʒ100㊁1ʒ1000的方案对病毒进行稀释ꎬ将不同浓度的病毒加入293T细胞ꎮ感染后48h收集细胞ꎬ用流式细胞仪检测GFP阳性率ꎮ选取荧光比例10%~20%的孔ꎬ按如下公式进行滴度计算:病毒滴度(TU/mL)=感染时293T细胞数ˑGFP阳性细胞%ˑ稀释倍数/加入病毒体积(mL)来测定LPEI和脂质体两种转染方法包装得到的慢病毒滴度ꎮ1.6㊀慢病毒感染白血病细胞取对数生长的K562㊁HL60和HEL细胞加入24孔细胞培养板中(1ˑ105/孔)ꎮ根据MOI值(K562=20~40ꎬHL60=100ꎬHEL=1~10)计算加入病毒体积(感染细胞数ˑ被感染细胞MOI值/浓缩后慢病毒滴度)ꎬ最后用含10%FBS的RPMI1640培养液定容至500μL/孔[1~3]ꎮ将24孔板配平后ꎬ1800r/minꎬ33ħꎬ离心90minꎬ8h后换液ꎮ第二天用相同方法做二次感染ꎮ感染48h后ꎬ收集细胞用PBS洗去慢病毒和培养液ꎬ通过流式细胞仪检测能够表达增强型绿色荧光蛋白(EGFP)细胞的阳性率ꎬ比较两种转染方法包装的慢病毒对白血病细胞感染效率的影响ꎮ1.7㊀细胞生物学特性观察1.7.1㊀细胞增殖检测㊀①生长曲线绘制ꎮ用含10%FBS的培养基将待测细胞配成单细胞悬液ꎬ调整细胞浓度为2ˑ104/mLꎬ每孔体积为100μLꎬ接种到96孔板ꎮ每种细胞设置3个平行孔ꎮ分别在培养后不同时间点(0d㊁1d㊁2d㊁3d㊁4d)每孔加入CCK ̄8溶液10μL检测生长情况ꎮ37ħ继续孵育4h后ꎬ在450nm波长测定各孔光吸收值(OD值)ꎬ记录结果ꎮ所有时间点吸光度值与0h比较ꎬ绘制细胞生长曲线[4~7]ꎮ②CFSE标记细胞增殖ꎮ取出1ˑ106细胞重悬在1mLPBS里ꎬ另取1ˑ105细胞ꎬPBS洗1次ꎬ2%PFA固定ꎬ作为阴性管ꎮ每1mL细胞液(1ˑ106)加入1μLCFSE染色液(5mmol/L)ꎬ立即涡旋ꎮ37ħꎬ避光孵育20minꎬ中间涡旋一次ꎮ加入5倍细胞液体积的至少含1%蛋白(血清)的培养基中止染色ꎬ静置5minꎮ4ħꎬ300g离心5minꎬ重复2次ꎮ用预热的完全培养基重悬细胞ꎬ取出3ˑ105细胞ꎬPBS洗一次ꎬ2%PFA固定ꎮ剩余细胞37ħ培养箱继续培养ꎮ培养过程中不同时间点取出3ˑ105细胞ꎬPBS洗一次ꎬ2%PFA固定ꎬ待所有时间点取完后一同进行流式检测[8]ꎮ1.7.2㊀细胞分化测定㊀取未感染的HL60细胞和LPEI及脂质体方法包装的慢病毒感染的HL60细胞分别接种于6孔板中ꎬ每孔接种2ˑ105/mLꎬ加入1mmol/L全反式维甲酸(all ̄trans ̄retinoicacidꎬATRA)5μL对细胞进行诱导分化ꎮ分别于2d后用抗人CD11b抗体标记ꎬ流式细胞仪检测细胞的分化情况[9~11]ꎮ1.7.3㊀细胞系克隆形成(colonyformationcellsꎬCFC)实验㊀对感染后细胞系计数ꎬ并调整细胞悬液浓度至1.5ˑ104/mLꎬ制备成10ˑ细胞悬液ꎮ分别取100μLꎬ加至1.6mLH4230甲基纤维素中ꎬ使最终每孔细胞数为500个ꎮ震荡混匀ꎬ4ħ静置20min至气泡升至液面上部ꎮ用1mL注射器将混匀的细胞加入24孔板中ꎬ每孔0.5mLꎬ3个重复孔ꎮ14d后计数CFC集落类型和数目ꎬ并用462生物技术进展CurrentBiotechnology. All Rights Reserved.0.05%甲紫染色ꎬPBS洗涤ꎬ扫描仪扫描ꎮ1.8㊀统计分析利用GraphPadPrism7.0对实验数据进行统计和作图ꎮUnpairedt ̄test用于两组之间比较ꎮ实验数据以均值ʃ标准误(MeanʃSEM)表示ꎬP<0.05被认为有统计学意义ꎮ2㊀结果与分析2.1㊀慢病毒制备和滴度测定用LPEI和脂质体转染方法在293T细胞中将SFFV ̄eGFP慢病毒质粒和包装质粒包装成慢病毒ꎬ收集病毒并分别进行浓缩ꎬ293T细胞经两种方法介导进行慢病毒包装时GFP表达情况如图2A所示ꎮ在293T细胞中ꎬ依次加入按梯度稀释的浓缩后慢病毒ꎬ流式细胞仪分析显示脂质体组加入1ˑ㊁1ʒ10㊁1ʒ100㊁1ʒ1000梯度稀释的慢病毒后细胞的eGFP阳性率分别为47.7%㊁10.4%㊁3.91%㊁2.68%ꎬ而LPEI组经同样梯度稀释的慢病毒感染后细胞eGFP阳性率分别为48.2%㊁12.9%㊁4.39%㊁3.05%(图2BꎬC)ꎬLPEI组eGFP阳性率略高ꎮ选取荧光比例10%~20%的孔计算病毒滴度(1ʒ10稀释组)ꎬ根据浓缩倍数换算ꎬ得到浓缩前等量慢病毒载体经LPEI和脂质体方法包装后的病毒滴度分别为4.7ˑ107TU/mL和4.1ˑ107TU/mLꎮ由此说明ꎬ与脂质体组相比ꎬLPEI组包装出的病毒滴度略高ꎮ图2㊀脂质体和LPEI转染方法检测慢病毒滴度Fig.2㊀TiterdetectingoflentiviruswithliposomeandLPEItransfectionmethod.注:A:荧光显微镜下ꎬ293T细胞包被慢病毒时GFP的表达情况ꎻB㊁C:不同浓度浓缩后慢病毒(1ˑꎬ1ʒ10ꎬ1ʒ100ꎬ1ʒ1000)感染293T细胞后ꎬ流式细胞仪检测GFP+的表达ꎬ以计算慢病毒滴度ꎮ562张明英ꎬ等:不同转染方法包装慢病毒感染人白血病细胞的比较研究. All Rights Reserved.2.2㊀慢病毒感染白血病细胞系的效率取对数生长期的K562㊁HL60和HEL细胞加入细胞培养板中ꎬ在同一细胞中加入等量的经LPEI或者脂质体包装出的慢病毒颗粒(不同细胞所需病毒总量根据MOI值计算)ꎮ取感染48h后细胞ꎬ以未感染慢病毒的白血病细胞为对照ꎬ通过流式细胞仪检测eGFP阳性率ꎬ比较两种转染方法包装产生的慢病毒感染白血病细胞的效率ꎮ结果显示K562 ̄LPEI和K562 ̄脂质体组的GFP阳性率分别为99.3%和99.6%ꎻHL60 ̄LPEI和HL60 ̄脂质体组的GFP阳性率分别为99.7%和99.7%ꎻHEL ̄LPEI和HEL ̄脂质体组的GFP阳性率分别为99.8%和99.8%ꎮ结果表明两种转染试剂包装后的慢病毒颗粒均能成功进入白血病细胞中ꎬ脂质体方法和LPEI方法包被出的病毒在感染白血病细胞系时ꎬ两组间的感染效率无明显差别(图3)ꎮ2.3㊀不同转染方法包装慢病毒对感染后白血病细胞增殖的影响为了验证LPEI和脂质体两种转染方法包装得到的慢病毒是否对目的细胞生物学特性产生影响ꎬ我们利用CCK ̄8和CFSE染色两种方法研究对比了经两种病毒感染后白血病细胞的增殖情图3㊀用相同脂质体和LPEI包被的慢病毒颗粒感染人白血病细胞系(K562㊁HL60㊁HEL)后阳性率比较Fig.3㊀DetectionofGFP+leukemiccells(K562ꎬHL60ꎬHEL)afterinfectionwithsameamountofvirusparticlespackagedwithLPEIorliposomesꎬrespectively.662生物技术进展CurrentBiotechnology. All Rights Reserved.图4㊀脂质体和LPEI包被的慢病毒感染人白血病细胞系后对白血病细胞系(K562㊁HL60㊁HEL)增殖的影响Fig.4㊀Comparisonofproliferationofleukemiccells(K562ꎬHL60ꎬHEL)infectedwithlentivirusespackagedwithliposomesandLPEI.注:A:利用CFSE分别标记K562㊁HL60和HEL细胞增殖ꎮB:利用CCK8方法绘制K562㊁HL60和HEL细胞的生长曲线ꎮ∗ꎬ∗∗∗分别表示在P<0.05与P<0.001水平差异显著ꎮNS:差异不显著ꎮ况ꎮ流式结果图拟合CFSE结果显示ꎬ经两种方法包装的病毒感染的K562㊁HL60和HEL细胞加入CFSE4d后增殖集中在第6代(parent6ꎬP6)和第7代(parent7ꎬP7)ꎬ并将1~4天的增殖指数762张明英ꎬ等:不同转染方法包装慢病毒感染人白血病细胞的比较研究. All Rights Reserved.(proliferationindex)进行统计学分析ꎬ用来比较脂质体组和LPEI组间增殖的差异(图4A)ꎮ综合CFSE法和CCK ̄8法结果显示:在K562细胞中ꎬ无论是CCK ̄8法还是CFSE法ꎬ两种转染方法包装的慢病毒对其增殖能力无显著影响ꎮ同样在HL60细胞中ꎬCCK ̄8结果显示两组间的增殖能力无显著差异ꎬ但CFSE法显示ꎬ经LPEI包装的慢病毒对HL60细胞增殖的影响比脂质体法更为明显(P<0.001)ꎮ此外ꎬ在HEL细胞中ꎬCCK ̄8法显示ꎬ经LPEI包装的慢病毒对HEL细胞增殖的影响比脂质体法更为明显(P<0.05)ꎬCFSE实验也有类似的趋势ꎬ但是两组之间没有达到显著统计学差异(P>0.05)(图4)ꎮ结果表明ꎬ在一部分白血病细胞中ꎬ与脂质体包装慢病毒方法相比ꎬLPEI包装慢病毒方法包装的慢病毒感染后细胞的增殖能力稍有减慢ꎮ2.4㊀不同转染方法包装慢病毒对感染后白血病细胞分化和克隆形成能力的影响HL60细胞为人急性早幼粒细胞模型ꎬ容易被ATRA诱导分化ꎮ为了对比两种转染方法对白血病细胞诱导分化能力的影响ꎬ我们将感染后并稳定增殖的HL60细胞分别用ATRA诱导2d后ꎬ通过抗CD11b抗体标记ꎬ观察细胞分化情况ꎮ结果表明ꎬ未感染病毒的对照组CD11b阳性率为33%ꎬ脂质体组和LPEI组CD11b阳性率分别为31.9%和30%(图5A)ꎬ所以脂质体转染方法和LPEI转染方法都不影响HL60细胞的分化ꎮ克隆形成能力可用来评估群体细胞中有增殖潜力的单个细胞的频率ꎬ为了进一步比较两种转染方法对细胞生物学特性的影响ꎬ我们继而对感染后的HL60细胞做了克隆形成实验ꎬ结果显示ꎬ未感染病毒的对照组㊁脂质体组和LPEI两组的克隆形成基本数量相同ꎬ3组间无统计学差异(P>0.05)(图5B)ꎮ3㊀讨论随着白血病研究的深入开展ꎬ将外源基因片段通过慢病毒介导的方法导入白血病细胞ꎬ建立稳定表达细胞株的研究是非常普遍的ꎮ由于白血图5㊀脂质体和LPEI包被的慢病毒感染人白血病细胞系后对白血病细胞系HL60分化的影响Fig.5㊀DetectionofATRA ̄induceddifferentiationabilityandcolonyformationabilityofHL60cellsinfectedwithlentivirusespackagedwithliposomesorLPEI.注:A:流式细胞仪分别检测脂质体组和LPEI组HL60细胞经ATRA诱导后CD11b的表达ꎻB:脂质体组和LPEI组HL60细胞的克隆形成细胞数和甲紫染色后的结果ꎮ862生物技术进展CurrentBiotechnology. All Rights Reserved.病细胞的悬浮特性和较高的MOI值ꎬ包被高滴度病毒并且达到较高的感染效率是白血病研究中的关键步骤ꎮ慢病毒载体是以HIV ̄1(人类免疫缺陷病毒Ⅰ型病毒)为基础发展起来的基因治疗载体ꎬ包装后的慢病毒可以将外源基因有效整合到宿主细胞染色体而实现长时间稳定表达ꎬ而且对分裂细胞和非分裂细胞尤其是难感染细胞均有很好的感染能力[12]ꎮ包装慢病毒除了需要目的质粒和辅助包装质粒以外ꎬ还需要借助转染试剂为产生病毒颗粒提供辅助作用ꎮ为获得满意的转染效果ꎬ选择高效㊁安全㊁低成本的转染试剂进行研究显得尤为重要ꎮ脂质体转染试剂是一种多用途且高效的转染试剂ꎬ应用于所有常见细胞系及许多难以转染的细胞系ꎮ脂质体表面带正电荷ꎬ能与核酸的磷酸根通过静电作用将质粒包裹入内ꎬ进而被表面带负电荷的细胞膜吸附ꎬ介导DNA ̄脂质体复合物进入细胞质ꎬ再进一步进入细胞核内转录㊁表达ꎮPEI是一种阳离子聚合物ꎬ一个重要特征是高浓度的带正电荷的氮原子促进带负电的DNA的有效结合和缩合[13~15]ꎮPEI作为一种被广泛研究的基因递送非病毒载体ꎬ在不同细胞和转染条件下展现出稳定高效的基因转染效果[16~19]ꎮ有研究报道ꎬ相比于其他结构的PEIꎬ线性PEI(LPEI)在基因治疗中表现出更高的转染效率[20]ꎮ有报道指出ꎬ在293T细胞(人胚肾上皮细胞)中ꎬ调整质粒和PEI质量比ꎬPEI转染效率可以和脂质体相当甚至超过脂质体[21]ꎮ但PEI也被报道瞬转后能阻止人乳头瘤病毒和人巨细胞病毒感染与细胞的粘附ꎬ降低感染效率[22]ꎮ本实验中采用psPAX2和pCMV ̄VSV ̄G为包装质粒的三质粒系统包装慢病毒ꎬ构建了能够在造血细胞中高效启动基因表达的SFFV启动子代替常用的CMV启动子构建慢病毒载体ꎬ下游eGFP基因以观察细胞的感染效率[23]ꎮ本研究分别用LPEI和脂质体两种方法将SFFV ̄eGFP慢病毒载体包装成慢病毒ꎬ结果与以往报道类似ꎬLPEI介导的慢病毒包装得到的滴度略高ꎮ进而ꎬ白血病细胞系的感染实验显示ꎬ两种包装方法得到的慢病毒对细胞感染效率无差异ꎬ在多种白血病细胞中感染效率均能达到98%以上ꎮ白血病是一类造血干细胞恶性克隆性疾病ꎬ具有过度增殖和分化阻滞特征ꎮ我们的实验结果显示ꎬ在一部分细胞中ꎬLPEI组的细胞增殖较脂质体组略有减弱ꎮ对于感染慢病毒后HL60细胞的分化和克隆形成能力ꎬ脂质体和LPEI组差异不明显ꎬ但是有待在更多白血病细胞中进行验证ꎮ总之ꎬ与脂质体相比ꎬLPEI作为转染试剂包装的慢病毒对某些白血病细胞的增殖略有影响ꎬ但是对分化和克隆形成影响不大ꎮ鉴于实验中还会存在利用同一感染方法包装的携带外源基因的载体以及对照载体ꎬ因此ꎬLPEI可以作为一种转染试剂用于包装转染白血病细胞的慢病毒载体ꎬ其包装出的慢病毒用于转染具有广泛㊁高效及稳定等特性ꎮLPEI的应用对于可以大大降低包装慢病毒的成本ꎬ可替代目前广泛应用的脂质体用于白血病研究中ꎮ参㊀考㊀文㊀献[1]㊀GuoYꎬZhengGꎬJinXꎬetal..HA117geneincreasedthemul ̄tidrugresistanceofK562cellsinvitro:Aninvestigationtothefunctionofanovelgenerelatedtodrugresistance[J].J.Exp.Clin.CancerRes.ꎬ2009ꎬ12:28-63.[2]㊀PriscilaMSCꎬEduardoJMNꎬCynthiaBꎬetal..Enhance ̄mentofzikainfectionbydengue ̄specificantibodiesdoesnotal ̄tertheproductionofinterleukin6inFcγRII ̄expressingK562cells[J].J.Infect.Dis.ꎬ2017ꎬ216(5):614-615. [3]㊀HolmesVMꎬMaluquerdeMCꎬRichardsPTꎬetal..Interac ̄tionbetweennectin ̄1andthehumannaturalkillercellreceptorCD96[J].PLoSONEꎬ2019ꎬ14(2):e0212443. [4]㊀黄勇ꎬ张萍ꎬ杜莉ꎬ等.腺病毒介导的SD ̄HA对K562细胞增殖抑制和凋亡诱导的作用机制[J].中华血液学杂志ꎬ2018ꎬ39(4):314-319.[5]㊀Laštᶄovi㊅ckaJꎬRatajMꎬBartuʎňkováJ.Assessmentoflymphocyteproliferationfordiagnosticpurpose:ComparisonofCFSEstainingꎬKi ̄67expressionand3H ̄thymidineincorporation[J].Hum.Immunol.ꎬ2016ꎬ77(12):1215-1222. [6]㊀LiZYꎬSunXHꎬLiuXMꎬetal..AntitumoreffectsofRuyip ̄ingoncellgrowthandmetastasisinbreastcancer[J/OL].CancerBiother.Radiopharm.ꎬ2019ꎬhttp://doi.org/10.1089/cbr.2018.2703.[7]㊀ChenLꎬHuWFꎬLiGHꎬetal..InhibitionofmiR ̄9 ̄5psup ̄pressesprostatecancerprogressbytargetingStarD13[J].Cell.Mol.Biol.Lett.ꎬ2019ꎬ24:20.[8]㊀AzariHꎬDeleyrolleLPꎬReynoldsBA.Usingcarboxyfluores ̄ceinSuccinimidylEster(CFSE)toidentifyquiescentglioblas ̄tomastem ̄likecells[J].MethodsMol.Biol.ꎬ2018ꎬ1686:59-67. [9]㊀HeoSKꎬNohEKꎬYoonDJꎬetal..Radotinibinducesapopto ̄sisofCD11b+cellsdifferentiatedfromacutemyeloidleukemiacells[J].PLoSONEꎬ2015ꎬ10(6):e0129853.[10]㊀ZhengXꎬGuoYꎬChenYꎬetal..Knockdownofadhesion ̄regu ̄latingmolecule1inhibitsproliferationinHL60cells[J].ActaHaematol.ꎬ2015ꎬ134(2):88-100.[11]㊀WangRꎬXiaLJꎬGabriloveJꎬetal..SorafenibinhibitionofMcl ̄1acceleratesATRA ̄inducedapoptosisindifferentiationre ̄962张明英ꎬ等:不同转染方法包装慢病毒感染人白血病细胞的比较研究. All Rights Reserved.sponsiveAMLcells[J].Clin.CancerRes.ꎬ2016ꎬ22(5):1211-21.[12]㊀李振宇.慢病毒载体构建及结构优化[J].国外医学(分子生物学分册)ꎬ2002(05):310-313.[13]㊀AdijantoJꎬNaashMI.Nanoparticle ̄basedtechnologiesforreti ̄nalgenetherapy[J].Eur.J.Pharm.Biopharm.ꎬ2015ꎬ95:353-367.[14]㊀YangSZꎬZhouXLꎬLiRXꎬetal..OptimizedPEI ̄basedtransfectionmethodfortransienttransfectionandlentiviralpro ̄duction[J].Curr.Protoc.Chem.Biol.ꎬ2017ꎬ9(3):147-157.[15]㊀ZiebarthJDꎬKennetzDRꎬWalkerNJꎬetal..Structuralcom ̄parisonsofPEI/DNAandPEI/siRNAcomplexesrevealedwithmoleculardynamicssimulations[J].J.Phys.Chem.Bꎬ2017ꎬ121(8):1941-1952.[16]㊀CollJLꎬCholletPꎬBrambillaEꎬetal..InvivodeliverytotumorsofDNAcomplexedwithlinearpolyethylenimine[J].HumanGeneTherapyꎬ1999ꎬ10(10):1659-1666. [17]㊀BoussifOꎬLezoualc HFꎬZantaMAꎬetal..Aversatilevectorforgeneandoligonucleotidetransferintocellsincultureandinvivo:Polyethylenimine[J].Proc.Natl.Acad.Sci.USAꎬ1995ꎬ92(16):7297-7301.[18]㊀LungwitzUꎬBreunigMꎬBlunkTꎬetal..Polyethylenimine ̄basednon ̄viralgenedeliverysystems[J].Eur.J.Pharm.Bio ̄pharm.ꎬ2005ꎬ60(2):247-266.[19]㊀NeuMꎬFischerDꎬKisselT.Recentadvancesinrationalgenetransfervectordesignbasedonpoly(ethyleneimine)anditsderivatives[J].J.GeneMed.ꎬ2005ꎬ7(8):992-1009. [20]㊀DelafosseLꎬXuPꎬDurocherY.Comparativestudyofpolyethyl ̄eniminesfortransientgeneexpressioninmammalianHEK293andCHOcells[J].J.Biotechnol.ꎬ2016ꎬ227:103-111. [21]㊀谈娟ꎬ郝朋ꎬ张喜慧ꎬ等.非病毒载体聚乙烯亚胺介导DNA转染的研究[J].医学分子生物学杂志ꎬ2007(03):229-233.[22]㊀SpodenGAꎬBesoldKꎬKrauterSꎬetal..Polyethylenimineisastronginhibitorofhumanpapillomavirusandcytomegalovirusinfection[J].Antimicrob.AgentsChemother.ꎬ2011ꎬ56(1):75-82.[23]㊀JenniferKWꎬJeanCYWꎬKristinJHꎬetal..Conceptsofhu ̄manleukemicdevelopment[J].Oncogeneꎬ2004ꎬ23:7164-7177.072生物技术进展CurrentBiotechnology. All Rights Reserved.。
细胞稳定转染方法

G418筛选稳定表达细胞系经验总结我做了稳定转染,从G418浓度确定到最后的单克隆化鉴定。
有自己的体会也有其他战友遇到的情况, 和大家分享. 没有总结好的地方,大家补充。
筛选之前确定G418浓度:1、由于每种细胞对G418的敏感性不同,而且不同的厂家生产的G418有效成分的比重不同,一般1g的粉剂中有效的G418含量大约为0.722g。
2、G418是新霉素的类似物,两者都是通过抑制核糖体的功能和蛋白质的合成而杀死细胞的。
但是新霉素对真核细胞无作用而G418对细菌和真核细胞都起作用。
neo就是编码3‘磷酸转移酶的基因,它表达的蛋白能够分解新霉素G418。
在进行转染时细胞膜受到影响,抗生素可能对细胞产生较大影响,加上G418有杀菌作用,所以有人主张转转染时不加其它抗生素。
3、汇合度对G418筛选结果的影响很大,一般筛选时汇合度不宜超过50%4,G418的活性不尽相同,所以在筛选之前,一定要确定G418的最佳筛选浓度。
具体如下:将细胞稀释到1000个细胞/ml,在100ug/ml~1mg/ml的G418浓度范围内进行筛选,选择出在10~14天内使细胞全部死亡的最低G418浓度来进行下一步的筛选试验。
一个具体试验:3x106个细胞电转后,分别接种1/4000,1/1000,1/300细胞到24孔板中,48h后加药筛选,此时1/300细胞孔内大约50%汇合度。
理论上1/4000孔内应有4%的汇合度。
筛选9天后,观察1/4000孔内有两三个克隆,按比例1/300孔内应该有几十个克隆,事实上,它们几乎全死光了,只有几个克隆。
加药时间和维持浓度1,由于基因转染到细胞内之后要一段时间才能表达出蛋白质。
所以筛选不能太早;但是也不能太晚,因为转染了外源基因的细胞代谢负荷较大,增值较慢,时间长了就会被没有外源基因转入的细胞所淹没,最终导致筛选不出阳性克隆,一般要在转染24小时之后才开始加G418筛选。
随着细胞的代谢G418的浓度和活性都会下降,所以每3~5天都要更换一次含有G418的筛选液。
32Dp210细胞稳定转染方法的比较

[ sr c] jcieTo s ac o h e ta po c e o ta setpa mi EGFP— CEB no 3 Dp 1 . M eh d t nc p lme dae Ab ta tObetv e rh fr teb s p ra h st rn fc ls d p P it 2 2 0 to sCai i oy rme itd o
G4 8 Re u t e to r n f ci n h d t e h g e t ta se t ta s e to fiin y( 8 ) wih t e mo tma c co e fs a l r n f ci n a d t e 1 . s l El cr t a se t a h i h s r n in r n fc i n efce c 5 .9 s o , t h s s ln s o t b y t a se t n h o l a tt e t k n t o m i a cco e ( 1 d y ) C t n cp l me e it d t a se t ta s e to n to i io o et a s e to a h o ef— e s i a e o f r b g m s l n s 2 a s . a i i o y rm d a e r n in r n fc i n a d Ca in c l s m r n fc in h d t el w fi m o p ce c ( . a d 5 8 in y 1 7 n . r s e tv l ) t e t t o sh d fw o iie co e ,ti mp s i l t e o ii e c l e p c ie y . h wo me h d a e p stv l n s i si o sb e o g tp st el Co c u i n E e to r n f ci n i v s. n l s l c r t a se t s o o
各 种 转 染 方 法 比 较
转染常用的报告基因报告基因(reporter gene)是一种编码可被检测的蛋白质或酶的基因,是一个其表达产物非常容易被鉴定的基因。
把它的编码序列和基因表达调节序列相融合形成嵌合基因,或与其它目的基因相融合,在调控序列控制下进行表达,从而利用它的表达产物来标定目的基因的表达调控,筛选得到转化体。
作为报告基因,在遗传选择和筛选检测方面必须具有以下几个条件:(1)已被克隆和全序列已测定;(2)表达产物在受体细胞中不存在,即无背景,在被转染的细胞中无相似的内源性表达产物;(3)其表达产物能进行定量测定。
在植物基因工程研究领域,已使用的报告基因主要有以下几种:胭脂碱合成酶基因(nos)、章鱼碱合成酶基因(ocs)nos、ocs这两个基因是致瘤土壤农杆菌(Agrobacterium tumfaciens)的Ti质粒特有的,对Ti质粒进行改造,用相应的致瘤农杆菌转化植物体时,如果外源基因转入植物体中,则这两种报告基因在植物根茎叶中均能表达,不受发育调控,检测时直接用转化体提取液进行纸电泳,染色后在紫外光下观察荧光即可。
新霉素磷酸转移酶基因(nptⅡ)、氯霉素乙酰转移酶基因(cat)nptⅡ、cat及庆大霉素转移酶基因,均为抗生素筛选基因,相关的酶可以对底物进行修饰(磷酸化、乙酰化等),从而使这些抗生素失去对植物生长的抑制作用,使得含有这些抗性基因的转化体能在含这些抗生素的筛选培养基上正常生长,也可以用转化体提取液体,外用同位素标记,放射自显影筛选转化体。
氯霉素乙酰转移酶基因测时可通过放射自显影观察荧光素酶基因(luciferase Gene)1985年从北美荧火虫和叩头虫cDNA文库中克隆出来的,该酶在有ATP、Mg2+、O2和荧光素存在下发出荧光,这样就可用转基因植物整株或部分直接用X-光片或专门仪器进行检测。
具有检测速度快、灵敏度比cat基因高30~1000倍、费用低、不需使用放射性同位素等优点,得到了广泛的采用。
猪成纤维细胞转染方法的比较

14 1 脂 质体法转染 ..
A液 : L质粒溶 于 20 L无血清 4I x 0
无 双抗 的 D M中 , 匀 , 置 5 mn ME 混 静 i。B液 : I 8 x 质体溶 L脂 于另一 20 I 0 L无血清无 双抗 的 D E x M M中 , 混匀 , 静置 5r n i。 a
将 A、 体混 匀 , 置 2 i 加入 到 细 胞 中; 育 B液 静 0 rn后 a 孵 5h后 , 换含血清的 D M培养液 , ME 培养 4 8h后 , 察绿 色荧 观
圈 1 脂质体法转染4 8 h
收稿 日期 :0 0—0 21 7—1 6 基金项 目: 广西 自然科 学基金 ( 编号 :0 0 X S A 10 7 ; 2 1 G N F 0 3 9 ) 广西畜牧 研究所基本科研 业务费( 编号 : 牧科基 2 0 0 ) 0 9— 1 。
13 质 粒 准备 .
可看到零星 发光 , 均 每个 视 野 发 光 细胞 数 相 当 ( 1 图 平 图 、
2 。转染 细胞 经过 G 1 ) 4 8高压筛选 1 后 , 周 转恒 压筛选 2周 , 2种方法转染 的细胞 均 出现 阳性 细胞集 落 ( 3 图 4 , 两 图 、 )但 者的细胞集落数差异不显著( 1 。 表 )
通信作者 : 炳坤 , 谢 博士。E— a :ki 6 .o 。 m i bx @13 cr l e n
关键词 : 脂质体 ; 磷酸钙 ;转染
中图分类号 : 88 1 ¥2.1 文献标 志码 : A 文章编 号 :0 2—10 (0 1 0 05 0 10 32 2 1 )3— 2 0— 2
光 蛋 白表 达情 况 。
近年来 , 转基 因技术是生物技术领域研究热点 , 其应用范 围已经渗透到农业 、 医药等诸多领域。在动物转基因领 域 , 体 细胞克隆法是生产转基 因动 物的主要 方法 , 经过多年 的研究 发展 , 转基 因绵羊 J转基 因犊 牛 J转基 因猪 相继 诞生 , 、 、 其 中所采用 的外 源基 因导入 动物 体细 胞方 法主要 为 电穿孔 法 、 磷酸钙沉淀法 、 脂质体法 、 毒载体法 等。本研 病 究以E F G P为报告基 因, 利用脂质 体法 与磷酸 钙法分别 转染 广西陆川猪胎儿成纤维细胞 , 比较 2种方法的转染效率 , 并筛 选出状态良好 的阳性细胞 , 旨在为下一 步利用体细 胞核移植 技术生产 转基 因动物奠定基础 。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
转染方法的比较
DEAE葡聚糖是最早应用哺乳动物细胞转染试剂之一,DEAE-葡聚糖是阳离子多聚物,它与带负电的核酸结合后接近细胞膜而被摄取,用DEAE-葡聚糖转染成功地用用于瞬时表达的研究,但用于稳定转染却不是十分可靠。
磷酸钙共沉淀法因为试剂易取得、价格便宜而被广泛用于瞬时转染和稳定转染的研究,先将DNA和CaCl2混合,然后加入到PBS中慢慢形成DNA磷酸钙沉淀,最后把含有沉淀的混悬液加到培养的细胞上,通过细胞胞膜的内吞作用摄入DNA。
磷酸钙似乎还通过抑制血清中和细胞内的核酸酶活性而保护外源DNA免受降解.
脂质体法采用阳离子脂质转染体,具有较高的转染效率,不但可以转染其他化学方法不易转染的细胞系,而且还能转染从寡核苷酸到人工酵母染色体不同长度的DNA,以及RNA,和蛋白质.此外,脂质体体外转染同时适用于瞬时表达和稳定表达,与以往不同的是脂质体还可以介导DNA和RNA转入动物和人的体内用于基因治疗。
人工合成的阳离子脂质体和带负电荷的核酸结合后形成复合物,当复合物接近细胞膜时被内吞成为内体进入细胞质,随后DNA复合物被释放进入细胞核内.利用脂质体转染法最重要的就是防止其毒性,因此脂质体与质粒的比例,细胞密度以及转染的时间长短和培养基中血清的含量
实用文档 1。
