药品拒收报告单
不合格药品管理档案

解除停售时间
药品名称
规格
剂型
生产厂家
供货单位
生产批号
有效期
解除停售原因:
通知部门:
通知人:年月日
质量管理员意见:
质量管理员签字:年月日
药店经理意见:
经理:年月日
药品拒收报告单
编号:建档时间:
通用名称
商品名称
验收员
剂型
单位
数量
规格
批号
有效期至
生产企业
供货企业
验收时间
质量问题
验收员:年月日
采购员意见
出厂检验
生产日期
供货企业
购进日期
购进数量
验收人员
验收日期
不合格数量
不合格药品
发生地点
不合格药品
发生时间
发现人姓名
不合格项目
验收员签字:年月日
质量管理部门意见
专职质量管理员签字:年月日
经理审核意见
经理签字:年月日
注:存档各查
不合格药品确认表
编号:填写日期:
通用名称
商品名称
规格
批准文号
生产批号
购进日期
年月日
不合格药品管理档案
单 位:
1、不合格药品报告表
2、不合格药品确认表
3、停售通知书
4、不合格药品台账
5、不合格药品报损审批表
6、报损药品销毁记录
7、解除药品停售通知书
8、药品拒收报告单
不合格药品报告表
编号:填写日期:
通用名称
商品名称
剂型
英文名或汉语拼音
批准文号
规格
生产企业
报告书
有效期至
质量标准
不合格药品管理制度最新

不合格药品管理制度最新制订人:制订日期:批准人:批准日期:执行日期:1、药品是用于防病治病的特殊商品,其质量与人体的健康密切相关。
为严格不合格药品的控制管理,严防不合格药品售出,确保消费者用药安全,特制定本制度。
2、质量负责人负责对不合格药品实行有效期控制管理。
3、质量不合格药品不得采购、入店堂和销售。
凡与法定质量标准及有关规定不符的药品,均属不合格药品,包括:①药品的内在质量不符合国家法定质量标准及有关规定的药品;②药品的外观质量不符合国家法定质量标准及有关规定的药品;4、在药品验收、陈列、养护、上柜、销售过程中发现不合格药品,应存放于不合格药品库(区),挂红色标识,及时上报质量负责人处理。
5、质量负责人在检查过程中发现不合格药品,应出具药品质量报告书或不合格药品通知单,及时通知仓储、营业等岗位立即停止出库和销售。
同时将不合格品集中存放于不合格药品区,挂红色标识。
7、不合格药品应按规定进行报损和销毁。
①不合格药品的报损、销毁由质管员负责,并填报不合格药品报损有关表格;其他各岗位不得擅自处理、销毁不合格药品;②不合格药品销毁时,应在质管员监督下进行,并填写“报损药品销毁记录”。
8、对质量不合格的药品,应查明原因,分清责任,及时制定与采取纠正、预防措施。
9、明确为不合格药品仍继续发货、销售的,应按经营责任制、质量责任制的有关规定予以处理,造成严重后果的,依法予以处罚。
10、应认真、及时、规范地做好不合格药品的处理、报损和销毁记录,记录应妥善保存至少五年。
1、不合格药品是指:药品的包装不合格、外观质量不合格、内在质量不合格。
2、不合格药品的确认:(1)国家或省、市各级药品监督管理部门发布的通知或质量公报中的不合格药品。
(2)质量验收、保管养护和销售过程中发现的外观、包装、标识不符,包装污染、破碎及超过有效期的药品,并报质量管理员确认为不合格的。
(3)各级药品监督管理部门抽查检验不合格的药品。
(4)符合药品管理法中有关假、劣药品定义的。
门店不合格药品、药品销毁管理制度

门店不合格药品、药品销毁管理制度1、目的:做好不合格药品管理,确保所有销售药品质量。
2、依据:《药品管理法》、《药品经营质量管理规范》及相关法律法规。
3、适用范围:门店不合格药品过程管理。
4、责任:质管科和门店质量管理员。
5、定义:5.1不合格药品:指药品质量(包括外观质量、包装质量和内在质量)不符合国家设定标准和有关管理规定的药品。
6、内容:6.1、不合格药品包括:6.1.1、门店验收员在进货验收时发现的外观质量及包装质量不符合法定质量标准的药品;6.1.2、门店养护员在养护检查中发现的外观质量及包装质量不符合法定质量标准的药品;6.1.3、过期、失效、霉烂、变质及有其他质量问题的药品;6.1.4、各级药品监督部门抽检验不合格的药品;6.1.5、药品监督管理部门禁止销售的药品。
6.2、各环节不合格药品处理程序:6.2.1、来货验收时发现质量有疑问的药品应拒收,由门店质管员填写“药品拒收报告单”办理退货手续;6.2.2、门店养护员、营业员在检查养护、销售、售后退回环节发现有质量问题的药品,应立即放置“停售牌”,并在计算机软件系统中锁定,填写“药品质量确认报告单”,(此表一式二联,一联存根,一联报质管科),报门店质管员处理,经质管员确认无质量问题的药品,应撤掉“停售牌”,并解除锁定,恢复销售。
确认为不合格的药品转入不合格品区,记录“不合格药品台帐”;.6.2.3、能够直观判断为不合格品的由门店质量管理员确认,“药品质量确认报告单”按月上报质管科。
对有可能涉及影响到整批次药品质量问题和有疑问药品,应及时送质管科进行确认,质管科应向委托配送公司质管科或厂家进行查询,根据查询结果,合格的药品继续销售,不合格药品及时转入不合格品区,并记录“不合格药品台帐”;6.2.4、上级药监部门抽查,检验为不合格药品,或药品监督管理部门禁止销售的不合格药品由公司质管科电话通知各连锁门店立即停止销售。
同时出具“药品召回通知单”,下发至各连锁门店。
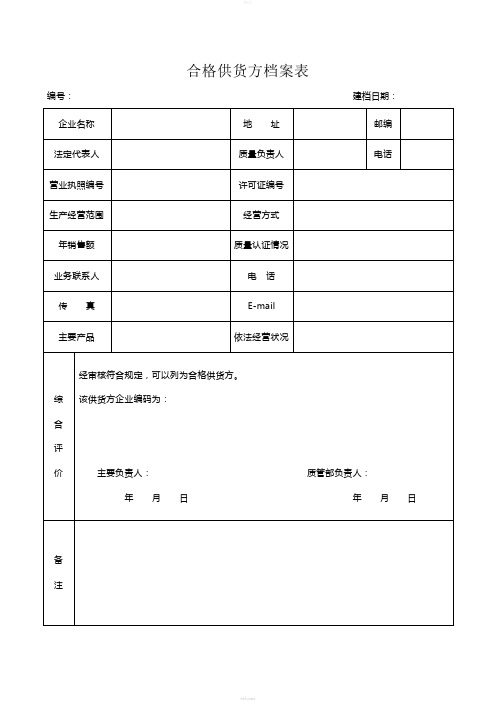
药店GSP管理表格-全套
商品名称
外文名称
有效期
规格
批准文号
剂型
GMP认证
生产企业
地址
邮编
用途
建档目的
检验项目
性状
包装情况
内:
储存条件
中:
外:体积:
养
护
质
量
问
题
摘
要
时间
生产批号
质量问题饮片装斗复核记录
日期
品名
规格
生产日期
生产厂商
装斗数量
操作人
质量状况
复核人
备注
药品拆零销售记录表
药品通用名称:商品名称:
药品通用名称
商品名称
品种类别
剂型
规格
有效期
批准文号
储存条件
生产企业
GMP证书号
供货联系人
电话
传真
质量状况
综
合
评
价
经审核符合规定,可以列为合格经营品种。
该药品品种编码为:
主要负责人:质管部负责人:
年月日年月日
备
注
附:1.药品质量标准、2.药品外包装、3.药品说明书
首营企业审批表
编号:
企业名称
进货数量
验收人员
验收日期
不合格数量
不合格情况发现地点
不合格情况发现日期
不合格原因
保管员:年月日
不合格情况复查
负责人:年月日
质量管理部意见
负责人:年月日
主管负责人审批意见
负责人:年月日
备注
不合格药品台帐
编号:
日期
通用
名称
商品
名称
生产
门店不合格药品、药品销毁管理制度范文(二篇)

门店不合格药品、药品销毁管理制度范文药品不合格的处理是保障药品质量和消费者安全的重要环节。
对于门店而言,建立健全药品销毁管理制度是非常关键的,下面是一个药品销毁管理制度的范本,供参考:第一章总则第一条为规范门店药品不合格的处理和销毁工作,保障药品质量和消费者安全,制定本制度。
第二条本制度适用于门店所有药品的不合格情况及相关药品销毁工作。
第三条本制度内容包括药品不合格的确认与处理、药品销毁的程序和要求、相关记录和报告等。
第四条门店药品销毁工作由门店负责人具体负责,相关人员配合执行并按程序核实签字确认。
第五条门店应建立健全的药品销毁档案,并定期自查、自评,加强对药品销毁工作的监督和管理。
第二章药品不合格的确认与处理第六条门店应制定药品质量控制标准,明确各类药品的质量要求和验收标准,并在进货前严格检查药品资质。
第七条若发现药品不合格,门店工作人员应立即将不合格药品与相关货物进行隔离,确保不合格药品不会流入销售环节。
第八条门店工作人员发现不合格药品,应立即向门店负责人报告,并按照相关程序进行处理。
第九条门店负责人接到报告后,应组织相关人员对不合格药品进行核实,并记录核实结果及处理过程。
第十条核实结果为药品不合格的,门店应将不合格药品集中存放,并按照相关法律法规的要求,主动配合相关部门进行取样、鉴定等工作。
第十一条在取样、鉴定过程中,门店应全力配合并积极提供相关信息和资料。
第十二条在相关部门对不合格药品取样鉴定过程中,门店应将不合格药品进行隔离存放,确保不会对其他药品和储存环境造成污染。
第十三条待确认的药品不合格后,门店应立即停止销售,并进行销毁处理。
第三章药品销毁的程序和要求第十四条药品销毁应由专业的医药废物处理单位负责。
门店应与医药废物处理单位签订合同,明确双方的权责和具体执行方式。
第十五条药品销毁前,门店应对不合格药品进行清点和记录,记录包括药品名称、规格、数量等信息。
第十六条不合格药品销毁程序包括:清点、封存、封存记录、运输、交接等。
通知书之药品拒收通知单

药品拒收通知单【篇一:某医药公司药品退货管理操作规程】药品退货管理操作规程目的:加强药品退货的管理,规范药品退货的操作。
适用范围:适用于公司各环节药品退货的作业流程。
责任部门:采购部销售部质量管理部储运部操作规程:1、药品购进退出管理操作规程:1.1一般药品的退出、合格药品因供货单位提出退回、或由本公司因某些原因要求退回的药品,经采购部与供货方联系,同意退货后,由采购部开具“药品购进退出通知单”,通知储运部、财务部,并与供货方办理退货手续。
1.2无质量问题购进退出的药品,如外包装破损、内包装完好,药品内在质量没问题的,采购部与供货方联系退货事宜,经供货方同意后,采购部填写“药品购进退出通知单”通知储运部、质量管理部、财务部,办理退货手续。
1.3在库药品中非质量原因的药品出现滞销或需要进行批号调剂时,由采购部与药品的供货单位联系协商后,办理退货手续,经质量部审核确认。
1.4购进的药品经质量验收发现其包装、标签或说明书有破损、文字标识模糊不清、缺少规定内容或文字内容错误等不规范情况,应办理不合格药品拒收单,由采购部与药品供货单位联系后,办理退货手续,由供货企业处理。
1.5购进退出药品退货的办理:(1)属供货方提出退回的,由采购部先审查供货方提货人的合法资格,如:供货方出具盖鲜章的法人委托书,提货人身份证复印件。
由保管员根据“药品购进退出通知单”办理退货,并做好“药品购进退出记录”。
(2)属公司退回供货方的,保管员凭采购部开具的“药品购进退出通知单”准备好退货药品,作好“药品购进退出记录”,再由购进人员和运输人员到供货单位,办理退货。
2、销后退回药品管理操作规程:2.1库房保管员对销后退回的药品,凭销售部开具的“销后退回通知单”收货,将退货存放于药品退货区,并做好“退货药品收货记录”。
2.2库房保管员核对该批药品的原始出库复核记录,确认为本公司售出药品后,在“销后退回通知单”上签署意见,并做好“药品销货退回记录”。
药品拒收报告单范文

药品拒收报告单范文报告人:XXX(药店名称)报告日期:YYYY年MM月DD日报告背景:根据我药店与供应商签订的合同,提供的药品应符合国家标准和相关规定。
然而,我们在收到下述药品时发现其存在以下问题,因此拒绝接收。
问题描述:1.药品名称:XXXX批号:XX规格:XXX问题描述:我们在仔细检查药品时发现,该批次药品包装破损,导致药品容易受到外界污染和氧化,无法保证药品的安全性。
要求:为确保药品安全,我们拒绝接收该批次药品,请供应商尽快提供新的药品。
2.药品名称:XXXX批号:XX规格:XXX问题描述:我们在检验药品时发现该批药品的生产日期已经超过保质期限,且在外观和质地上存在明显的异常,无法保证其疗效和安全性。
要求:为确保药品的质量和疗效,请供应商立即提供新的药品。
3.药品名称:XXXX批号:XX规格:XXX问题描述:我们在仔细观察药品包装时发现,该批药品的生产日期和有效期不符合国家标准,存在明显的生产误导和误导消费者的嫌疑。
要求:为确保药品生产和销售的合规性,请供应商核实批次信息并提供符合国家标准的药品。
报告影响:1.我们的库存中减少了可售药品的数量,影响了此类药品的供应和销售。
2.我们需要重新向供应商购买可靠的替代品,可能导致采购成本的增加和供应关系的延误。
3.我们需要对问题药品进行处理和销毁,以确保不会对患者的健康和安全造成任何威胁。
报告建议:1.我们建议供应商立即检查他们的生产和质量控制流程,确保提供的药品符合国家标准,并采取措施避免类似问题再次发生。
3.我们建议供应商提供一份书面的整改计划,详细描述他们会采取哪些措施来确保此类问题的不再发生。
结论:基于上述问题,我药店拒绝接收所述药品批次,并要求供应商立即采取措施以解决此问题。
我们将持续监测供应商的行动和改进,确保我们的药品符合国家标准并满足消费者的需求。
报告人签名:。
不合格药品、销毁管理制度(4篇)

不合格药品、销毁管理制度(1)为合理控制药品的经营过程管理,防止药品的过期失效,确保药品的储存、养护质量,根据《药品管理法》及《药品经营质量管理规范》等法律、法规,特制定本制度。
(2)药品应标明有效期,未标明有效期或更改有效期的按劣药处理,验收人员应拒绝收货。
(3)距失效期不到____个月的药品不得购进,不得验收入库。
(4)药品应按批号进行储存、养护,根据药品的有效期相对集中存放,按效期远近依次堆码,不同批号的药品不得混垛。
(5)近效期药品在货位上可设置近效期标志。
(6)对有效期不足____个月的药品应按月进行催销。
(7)对有效期不足____个月的药品应加强养护管理、陈列检查及销售控制。
(8)及时处理过期失效品种,严格杜绝过期失效药品售出。
(1)药品是用于防病治病的特殊商品,其质量与人体的健康密切相关。
为严格不合格药品的控制管理,严防不合格药品售出,确保消费者用药安全,特制定本制度。
(2)质管员负责对不合格药品实行有效控制管理。
(3)质量不合格药品不得采购、入库和销售。
凡与法定质量标准及有关规定不符的药品,均属不合格药品,包括:①药品的内在质量不符合国家法定质量标准及有关规定的药品;②药品的外观质量不符合国家法定质量标准及有关规定的药品;③药品包装、标签及说明书不符合国家有关规定的药品。
(4)在药品验收、储存、养护、上柜、销售过程中发现不合格药品,应存放于不合格药品区,挂红色标识,及时上报质量负责人处理。
(5)质量负责人在检查过程中发现不合格药品,应出具药品质量报告书或不合格药品通知单,及时通知仓储、营业等岗位立即停止出库和销售。
同时将不合格品集中存放于不合格药品区。
(6)上级药监部门监督检查、抽验发现不合格品,企业应立即停止销售。
同时,将不合格品移入不合格药品区,做好记录,等待处理。
(7)不合格药品应按规定进行报损和销毁。
①不合格药品的报损、销毁由质量负责人统一负责,其他各岗位不得擅自处理、销毁不合格药品;②不合格药品的报损、销毁由仓库提出申请,填报不合格药品报损有关单据;③不合格药品销毁时,应在质量负责人和其他相关人员的监督下进行,并填写“报损药品销毁记录”。
用友U8+GSP医药行业插件产品操作手册

用友U8+GSP医药行业插件产品操作手册+用友医药GSP管理行业插件产品U8操作手册目录一.应用场景说明产品范围医药行业GSP管理插件营业配景为了满意医药行业用户在GSP质量管理方面的管理需求,用友软件结合药品经营企业的特性,将GSP规范融于医药贸易企业日常管理的营业流程中,研制开辟了这一插件,该插件完美有用解决了质量管理和营业管理中存在问题,对医药贸易企业GSP能够顺利达标和吻合GSP质量管理规范的日常运作将产生宏大的辅佐作用,该插件的上风在于完全依照医药贸易企业的实践营业可、流程和管理需要,和国度GSP质量管理规范的标准管理流程举行开辟,在应用上具有实用性和合用性。
业务流程采购入库验收业务流程流程说明:✓采购到货后,质量部门根据到货单中对到货商品进行入库质量验收,填报采购入库质量验收记录。
✓采购入库质量验收记录有拒收数量,可填制药品拒收报告单,根据相应的到货单生成到货退回单,举行退货处理。
✓采购入库质量验收记录如果需要检验,则走检验流程,验收记录中的合格数量、不合格数量由检验报告回写。
✓采购入库质量验收记录有合格数量,则依据验收记录进行采购入库单。
✓采购入库质量验收记录有不合格品数量,系统撑持两个处理体式格局:先入库后处理:根据采购验收记录举行采购入库,然后填制不合格品处理审批单。
先处理后入库:根据采购验收记录填制不合格品处理审批单,确定不合格品处理体式格局,然后举行采购入库。
✓不合格品处理审批单根据处理方式按照不同处理逻辑不同:退货:采购管理参照GSP的不合格品处理审批单生成采购退货单。
报损:库存管理参照GSP的不合格品处理审批单天生不合格品记录单,然后举行不合格品销毁处理。
贩卖退货验收营业流程流程说明:✓根据贩卖退货单对退货商品登记贩卖退货质量验收记录。
✓药品退货质量验收记录单中,合格品填制红字销售出库单进行入库。
✓贩卖退货质量验收记录有不合格品数量,系统撑持两个处理体式格局:先入库后处理:根据贩卖退货质量验收记录举行入库,然后填制不合格品处理审批单。
不合格药品管理规定

不合格药品管理制度
1、不合格药品是指:药品的包装不合格、外观质量不合格、内在质量不合格;
2、不合格药品的确认:
1国家或省、市各级药品监督管理部门发布的通知或质量公报中的
不合格药品;
2质量验收、保管养护和销售过程中发现的外观、包装、标识不符,
包装污染、破碎及超过有效期的药品,并报质量管理员确认为不合格的. 3各级药品监督管理部门抽查检验不合格的药品;
4符合药品管理法中有关假、劣药品定义的;
5生产厂商、供货单位来函通知的不合格药品;
3、不合格药品一旦确认,即不能再销售,将不合格药品移入不合格区,并做好“不合格药品台帐”记录.
4、入库验收发现不合格药品,验收员填写“药品拒收报告单”交质量管理员,由质量管理员确认后,提出处理意见进行处理;
5、在储存、养护或出库时发现质量有疑问药品,应立即挂黄牌暂停销
售,填写“药品质量复查通知单”交质量管理员复验;复验合格,摘除黄牌;不合格,将不合格品移入不合格品区,填写“药品质量处理通知单”进行处理;
6、在门诊陈列、检查、销售过程中发现不合格药品应停止销售,立即下柜;
7、凡药监局公告或发文通知不合格的药品,以及抽查检验发现的不合格药品,应立即清查,集中存放于不合格区内,按要求上报;
8、各环节发现的不合格药品,均应及时报质量管理员,质量管理员每季度对不合格药品进行汇总和分析,分清质量责任,制定处理和预防措施. 9、对于包装破损或者包装不符合规定的不合格药品,可由采购员根据协议及时联系退货处理;对过期失效药品、超过供货商负责期的有质量问题药品、属假劣药品范围的不合格药品应报废,并在药品监督管理部门的监督下进行销毁处理;
10、不合格药品的确认、报告、报损、销毁应有完善的手续和记录;。
门店不合格药品、药品销毁管理制度范文(四篇)

门店不合格药品、药品销毁管理制度范文药品是一种特殊的商品,对于人类的生命和健康具有重要的保障作用。
然而,由于生产、流通、管理环节的不同因素,存在一定数量的不合格药品。
为了保障人民群众的健康和安全,门店应建立不合格药品的销毁管理制度。
本文将从不合格药品的定义、销毁管理制度的必要性和范围、制度内容和操作程序等方面对门店不合格药品的销毁管理制度进行论述。
一、不合格药品的定义不合格药品是指不符合药品质量标准或者药品生产、流通环节中发生了重大质量问题的药品,包括但不限于以下情况:1. 药品成分、含量与说明书不符;2. 药品生产过程不符合质量管理要求;3. 药品保存、运输等环节存在问题,导致药品质量下降;4. 药品存在严重污染或者存在其他影响药品质量的因素;5. 药品已经过期、损坏或者失去治疗效果。
二、销毁管理制度的必要性和范围1. 必要性门店作为药品销售的重要环节,应当负有销售符合质量要求的药品的责任。
不合格药品一旦流入市场,可能对人民群众的健康和安全造成严重威胁。
因此,门店有必要建立不合格药品销毁管理制度,从源头上控制不合格药品的销售,保障人民群众的健康和安全。
2. 范围门店销毁管理制度适用于门店内发现的不合格药品,包括但不限于以下情况:1. 供货商提供不合格药品;2. 门店自行检测发现的不合格药品;3. 患者或消费者投诉或反映的不合格药品。
三、制度内容1. 销毁管理责任制度由门店负责人或门店内设的专职负责人负责门店不合格药品的销毁管理工作,明确责任人的职责和权限。
2. 销毁管理操作规范门店应建立不合格药品销毁管理操作规范。
规范包括但不限于以下内容:1. 不合格药品的收集和记录:门店应建立不合格药品的收集和记录制度,及时收集门店内发现的不合格药品,并书面记录药品的相关信息,包括药品名称、批号、生产日期、生产企业等。
2. 销毁方式选择:门店应根据不合格药品的特点和数量,选择合适的销毁方式,包括委托专业机构销毁、与药品生产企业协商销毁等。
药店不合格药品管理程序

药店不合格药品管理程序1、目的:建立不合格药品控制性管理程序,规范不合格药品的管理工作。
2、依据:《药品经营质量管理规范》3、适用范围:本程序规定了企业不合格药品控制性管理的内容、方法和要求,明确了相关部门或人员的职责,适用于药品验收、在库养护、和销售过程中发现的不合格药品的处理。
4、职责:质量管理部门、购进部门、仓储部门、销售部门对本程序的实施负责。
5、内容:5.1不合格药品的发现:5.1.1购进验收时不合格药品的发现:药品验收人员根据药品法定标准和购进合同规定的质量条款对购进药品进行验收,遇以下药品质量问题,需填写《药品拒收报告单》,报质量管理人员确认。
5.1.1.1破损、污染、短少.5.1.1.2包装、标签、说明书不符合规定.5.1.1.3批号、有效期不符合规定。
5.1.1.4进口药品通关单不符合规定。
5.1.1.5假药、劣药。
5.1.2在库养护不合格药品的发现:在库发现以下质量可疑药品,需填写《药品质量复核单》,报质量管理部门确认。
5.1.2.1保管人员发现的质量可疑药品。
5.1.2.2养护人员对在库药品养护检查中发现质量有疑问的药品。
5.1.2.3超过有效期的药品。
5.1.2.4已发现有质量问题的同批号或相邻批号的药品。
5.1.3售后不合格药品的发现:销售部门对售后药品发现质量问题或疑问应填写《药品质量复核单》,报质量管理部门确认。
5.1.3.1购货单位发现质量不合格或有疑问而以口头、电话、书面函件等形式向销售人员或销售部门反映的药品。
5.1.4供货单位发现留样有质量问题而通知购货单位回收的药品。
5.1.5药品监督管理部门发文要求停止使用或回收的药品。
5.2不合格药品的报告:5.2.1验收人员填写《药品拒收报告单》后,向质量管理人员报告。
5.2.2养护人员、出库复核人员填写《药品质量复核单》后,向质量管理部门报告.5.2.3销售人员填写《药品质量复核单》后,应立即向质量管理部门报告.5.2.4.1在药品经营过程中发现假劣药品5.2.4.2销售人员被购货单位口头、电话或书面告之所销售药品发生新的或严重的不良反应以及临床事故.5.2.5质量管理部门接到购货单位的口头、电话或书面通知有关5.2.4所述情况时,应立即向当地药品监督管理部门报告做好记录。
药品拒收报告单
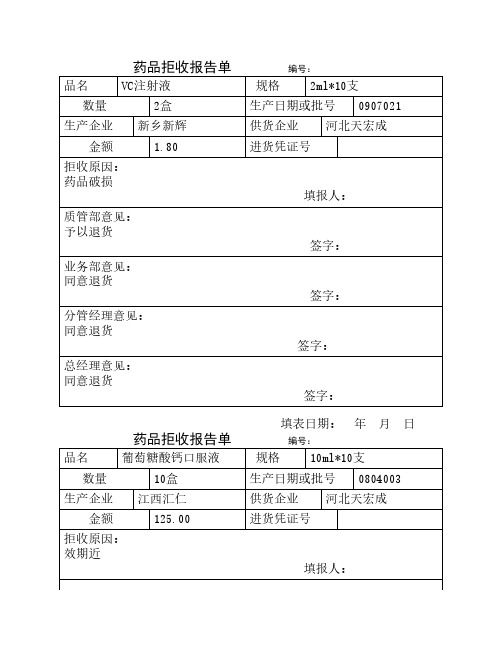
药品拒收报告单 编号:品名VC注射液规格2ml*10支数量2盒生产日期或批号0907021生产企业新乡新辉供货企业河北天宏成金额 1.80进货凭证号拒收原因:药品破损填报人:质管部意见:予以退货签字:业务部意见:同意退货签字:分管经理意见:同意退货签字:总经理意见:同意退货签字:填表日期: 年 月 日药品拒收报告单 编号:品名葡萄糖酸钙口服液规格10ml*10支数量10盒生产日期或批号0804003生产企业江西汇仁供货企业河北天宏成金额125.00进货凭证号拒收原因:效期近填报人:质管部意见:予以退货签字:业务部意见:同意退货签字:分管经理意见:同意退货签字:总经理意见:同意退货签字:填表日期: 年 月 日药品拒收报告单 编号:品名规格数量生产日期或批号生产企业供货企业金额进货凭证号拒收原因:填报人:质管部意见:签字:业务部意见:签字:分管经理意见:签字:总经理意见:签字:填表日期: 年 月 日药品拒收报告单 编号:品名规格数量生产日期或批号生产企业供货企业金额进货凭证号拒收原因:填报人:质管部意见:签字:业务部意见:签字:分管经理意见:签字:总经理意见:签字:填表日期: 年 月 日药品拒收报告单 编号:品名规格数量生产日期或批号生产企业供货企业金额进货凭证号拒收原因:填报人:质管部意见:签字:业务部意见:签字:分管经理意见:签字:总经理意见:签字:填表日期: 年 月 日药品拒收报告单 编号:品名规格数量生产日期或批号生产企业供货企业金额进货凭证号拒收原因:填报人:质管部意见:签字:业务部意见:签字:分管经理意见:签字:总经理意见:签字:填表日期: 年 月 日药品拒收报告单 编号:品名规格数量生产日期或批号生产企业供货企业金额进货凭证号拒收原因:填报人:质管部意见:签字:业务部意见:签字:分管经理意见:签字:总经理意见:签字:填表日期: 年 月 日药品拒收报告单 编号:品名规格数量生产日期或批号生产企业供货企业金额进货凭证号拒收原因:填报人:质管部意见:签字:业务部意见:签字:分管经理意见:签字:总经理意见:签字:填表日期: 年 月 日药品拒收报告单 编号:品名规格数量生产日期或批号生产企业供货企业金额进货凭证号拒收原因:填报人:质管部意见:签字:业务部意见:签字:分管经理意见:签字:总经理意见:签字:填表日期: 年 月 日药品拒收报告单 编号:品名规格数量生产日期或批号生产企业供货企业金额进货凭证号拒收原因:填报人:质管部意见:签字:业务部意见:签字:分管经理意见:签字:总经理意见:签字:填表日期: 年 月 日药品拒收报告单 编号:品名规格数量生产日期或批号生产企业供货企业金额进货凭证号拒收原因:填报人:质管部意见:签字:业务部意见:签字:分管经理意见:签字:总经理意见:签字:填表日期: 年 月 日药品拒收报告单 编号:品名规格数量生产日期或批号生产企业供货企业金额进货凭证号拒收原因:填报人:质管部意见:签字:业务部意见:签字:分管经理意见:签字:总经理意见:签字:填表日期: 年 月 日药品拒收报告单 编号:品名规格数量生产日期或批号生产企业供货企业金额进货凭证号拒收原因:填报人:质管部意见:签字:业务部意见:签字:分管经理意见:签字:总经理意见:签字:填表日期: 年 月 日药品拒收报告单 编号:品名规格数量生产日期或批号生产企业供货企业金额进货凭证号拒收原因:填报人:质管部意见:签字:业务部意见:签字:分管经理意见:签字:总经理意见:签字:填表日期: 年 月 日药品拒收报告单 编号:品名规格数量生产日期或批号生产企业供货企业金额进货凭证号拒收原因:填报人:质管部意见:签字:业务部意见:签字:分管经理意见:签字:总经理意见:签字:填表日期: 年 月 日。
药品收货管理制度

药品收货管理制度一、目的:为把好收货药品质量关,保证购进药品数量准确、质量完好防止不符合质量标准或疑似假、劣药的药品流入本公司。
二、适用范围:适用于本企业药品收货的质量管理。
三、职责:采购部、仓储部和质量管理人员对本制度的实施负责。
四、内容4. 1定义4.LL收货:指药品经营企业收货人员对到货药品,通过票据的查验、货源和实物检查核对票据和运输条件的检查、并将符合要求的药品按照其特性放入相应待验区的过程。
4. 1.2逐批:指按到货药品的批号逐一进行收货和验收,每个批号均应有完整的收货、验收记录。
4. 2收货标准:出现以下情况时,不得收货:4. 2. 1查验时发现不是本企业采购的药品。
4. 2. 2收货时,发现药品包装破损、污染、渗漏、关键封签脱落、关键字迹模糊无法识别的药品。
需冷藏的药品,收货时发现其运输温度超出标准,运输条件达不到要求的药品。
无随货同行单(票),无批次检验报告的药品。
随货通行单(票)的样式、印章与企业留存不一致的药品。
4. 3收货4.3. 1仓储部负责购进药品的收货工作。
4. 3. 2收货人员应对到货药品逐批进行收货,防止不合格药品入库。
4. 3. 3药品到货时,收货人员应当核实运输方式是否符合要求,假设发现运输方式不符合要求要及时通知采购部并报质量管理部门处理。
4. 3. 4对照随货同行单(票)和采购记录核对药品,做到票、账、货相符。
随货同行单(票)中药品的通用名称、剂型、规格、批号、数量、生产厂商等内容与药品实物不符的,应当拒收,并通知采购部门进行处理。
4. 3. 5冷藏、药品到货时,应当对其运输方式及运输过程的温度记录、运输时间等质量控制状况进行重点检查并记录,不符合温度要求的应当拒收。
填写《药品拒收报告单》,并通知采购部门和质量管理部门进行处理。
收货人员对符合收货要求的药品,应当将药品放于待验区域,10件以上的药品按照药品储存条件要求直接放置到相应的库区, 并放置“待验”标志牌。
药品经营-不合格药品处理操作规程

文件名称:不合格药品处理操作规程文件编号: JN-QP-013-2021起草人:起草日期:年月日版本号: 2021年2版审核人:审核日期:年月日颁发部门:质管部批准人:批准日期:年月日执行日期:年月日制定原因规范管理分发部门:☑质管部☑采购部☑销售部☑储运部☑行政信息部☑财务部目的:通过制定不合格药品处理操作规程,有效控制不合格药品的处理过程,以保证经营药品的质量符合规定的要求。
依据:《药品经营质量管理规范》(总局令第28号)、国家总局新修订《药品经营质量管理规范现场检查指导原则》(食药监〔2016〕160号)和国家总局新修订《附录》(2017年第197号)。
适用范围:适用于不合格药品处理的全过程。
职责:各有关部门、岗位人员负责对本部门或岗位所发现的不合格药品情况及时向质管部门报告。
质管部负责对不合格药品的确认、报告、报损、销毁全过程实施控制性管理。
内容:1.不合格药品的确认按《不合格药品、药品销毁的管理制度》的规定来界定。
2.不合格药品的核查、报告质管部在确认某一环节的不合格药品后,为了查清其他环节有否同一品种;或从公司外部得到确定的不合格药品信息后,应及时采用信息传递方式将不合格药品信息传递到相关部门并限定时间反馈核查结果,质管部根据返馈结果再提出处理意见。
3.经确认后不合格药品的存放与标识3.1质管部确认合格的药品,存放入合格品区,进入正常流程。
3.2质管部确认并建议拒收的药品,可以继续存放在待验区。
3.3确认有外观质量或内在质量不合格的药品,包括追回的不合格药品,移入不合格药品区。
3.4已售出的药品经质管部确认为外观质量或内在质量不合格的,应及时追回,存放入不合格药品区,保管员做好相应记录。
已售出的药品经质管部要求召回的药品,采购部应及时召回,存放入不合格药品区,保管员做好相应记录。
3.5确认为假、劣的药品存放入不合格药品区,并向当地药品监督管理部门报告。
4.不合格药品处理程序。
4.1收货、验收发现的不合格药品,属于到货凭证与实物的公司名称、批号、有效期、数量不符及外包装破损、污染而内包装完好等不合格药品,应拒绝收货,由验收员填写《药品拒收报告单》注明拒收原因,系统自动生成拒收记录,可供相关部门查询。
药品验收的管理制度

药品验收的管理制度(实用版)编制人:__________________审核人:__________________审批人:__________________编制单位:__________________编制时间:____年____月____日序言下载提示:该文档是本店铺精心编制而成的,希望大家下载后,能够帮助大家解决实际问题。
文档下载后可定制修改,请根据实际需要进行调整和使用,谢谢!并且,本店铺为大家提供各种类型的实用资料,如管理制度、企业管理、岗位职责、心得体会、工作总结、工作计划、演讲稿、合同范本、作文大全、其他资料等等,想了解不同资料格式和写法,敬请关注!Download tips: This document is carefully compiled by this editor.I hope that after you download it, it can help you solve practical problems. The document can be customized and modified after downloading, please adjust and use it according to actual needs, thank you!And, this store provides various types of practical materials for everyone, such as management systems, enterprise management, job responsibilities, experiences, work summaries, work plans, speech drafts, contract templates, essay compilations, and other materials. If you want to learn about different data formats and writing methods, please pay attention!药品验收的管理制度第1篇药品验收的管理制度1为确保购进药品的质量,把好药品的入库质量关,根据《药品管理法》及《药品经营质量管理规范》等法律、法规,特制定本制度。
不合格药品处理的操作程序(3篇)

不合格药品处理的操作程序1.目的:为规范对不合格药品的管理,保证不合格药品按规定处理,根据《药品管理法》、GSP、质量管理制度及实际工作需要,制定本程序。
2.适用范围:门店不合格药品的管理。
3.责任:质量员4.工作程序:4.1质量管理员对验收、养护及销售退回等环节中出现的不合格药品进行确认。
4.1.1对验收环节中确认的不合格药品,质量验收人员拒收,填写拒收通知单,并通知收货员及时处理。
同时,对拒收药品进行登记。
4.1.2对养护环节中确认的不合格药品,养护员挂红牌停止销售,将不合格药品移入不合格区并登记。
4.1.3对销售退回环节中确认的不合格药品,保管员将其存放于不合格区并登记。
4.2不合格药品的报损销毁处理。
4.2.1需报损的不合格药品由门店企业负责人填写《不合格药品报损表》,经业务部门、质管部门审核后,由经理批准。
4.2.2经批准销毁的,由门店企业负责人填写《药品销毁记录》,经业务经理批准,按药监部门要求进行处理。
4.3药品质量公报公布的及药检机构抽检确认的不合格药品,质量管理部下通知停售,质量管理员负责收集信息,养护员将药品放入不合格药品区并填写《不合格药品登记表》,按食品药品监督管理部门要求进行处理。
4.4药检机构抽检确认的不合格药品,应就地封存,按药监部门的规定上报并处理。
不合格药品处理的操作程序(二)一、目的。
对不合格药品实行控制性管理,防止购入不合格药品和将不合格药品销售给患者。
二、依据。
《____药品管理法》及其实施条例;《药品经营质量管理规范》及其实施细则;国家关于不合格药品管理的有关规定。
三、责任:(一)药剂科主任负责本制度的管理、指导工作。
(二)药房全体员工对本制度的实施负责。
四、主要内容:(一)不合格药品指购入过程中出现的:1、《____药品管理法》第四十八、四十九规定的假药、劣药。
2、质量证明文件不合格的药品。
3、包装、标签、说明书的内容不符合规定的药品。
4、批号、有效期不符合规定的药品。
药品GSP退货处理操作规程

药品GSP退货处理操作规程文件名称药品退货处理操作规程文件编号XX-XX-013-00执行日期编制人审核人批准人编制日期审核日期批准日期分发部门1.目的建立退回药品的处理操作规程。
2.适用范围适用于销后退回药品和购进退出药品的处理。
3职责3.1销售员:负责销后退回药品的确认、核实工作;3.2采购员:负责购进退出药品的质量查询工作;3.3验收员:负责销后退回药品的验收工作;3.4仓管员:负责退货药品的搬运、转仓作业;3.5质管员:负责监督指导各岗位人员执行本制度。
4.内容4.1销后退回药品的管理4.1.1在确认客户需要退货时,销售员应填写《销后退回通知单》,并交给质量管理部,同时通知储运部;4.1.2退货产品到货时,仓管员、业务员、验收员三方到场进行接收;4.1.3仓管员以退货通知单核对退回药品品名、规格、数量、批号、有效期等信息;4.1.4检查药品包装、标签是否完好无损;4.1.5验收;4.1.5.1验收员查阅销售记录,了解该批药品的质量情况及销售情况;4.1.5.2验收员按购进药品验收规程规定的步骤对退回药品进行验收;4.1.5.3验收员做好销后退回药品验收记录;4.1.5.4财务部查阅退回药品的发货发票,了解退货、收回药品的收款情况。
4.1.6入库4.1.6.1由仓管员填写《销后退回药品台账》,药品正式接收入库;4.1.6.2业务部给客户退款或换货;4.1.6.3财务部作账目上处理。
4.2购进退出药品的管理4.2.1验收过程经质量管理部确认拒收的药品,由验收员填写《药品拒收报告单》,仓管员填写《购进退出药品台账》,并由质量管理部及时通知业务部作退货处理;4.2.2因批号调剂或药品滞销需要退货的药品由业务部与供货方联系协商,经对方同意后,办理退货手续。
采购员填写《退货通知单》,经业务部负责人审核;仓管员根据退货通知单建立出库单,并由复核员对出库药品进行复核。
已办理退货的药品,仓管员及时做好《购进退出药品台账》。
