第4节氢原子光谱与能级结构
玻尔理论的基本假设现象氢原子光谱是分立线状

原子的能级结构
回顾
19世纪末20世纪初,人类叩开了微观世界
的大门,物理学家根据研究提出了关于原子
结构的各种模型,卢瑟福的核式结构模型能
够很好
盾.
经典电磁理论
经典电磁理论认为:电子绕核作匀速圆周运动, 绕核运动的电子将不断向外辐射电磁波。由于原子 不断地向外辐射能量,能量 v 逐渐减小,电子绕核旋转的频 e F
Em>En 发射光子, Em<En 吸收光子
能级结构猜想
能级:原子内部不连续的能量称为原子的能级。
数值上等于原子在定态时的能量值。 跃迁:原子从一个能级变化到另一个能级的过程。 在跃迁的过程中,原子辐射(或吸收)光子的能 量为:
hv= Em- En
Em和En分别为跃迁前后的能级
(1)处于高能级的原子会自发
由 T ( m ) T ( n ) 知道,氢原子辐射光谱的波长取决 于两光谱项之差;而hv=Em-En式则揭示出氢原子 辐射光的频率取决于两能级之差。 能级与光谱项之间的关系 最先得出氢原子能级表达式的,是丹麦物理学 家玻尔,他在吸取前人思想的基础上,通过大胆假 设,推导出氢原子的能级满足:
在解决核外电子的运动时 成功引入了量子化的观念
同时又应用了“轨 道”等经典概念和 有关牛顿力学规律
除了氢原子光谱外,在解决 其他问题上遇到了很大的困难.
半经典半量子理论,存在逻辑上的缺点,即把微观粒子看成是遵 守经典力学的质点,同时,又赋予它们量子化的特征。
玻尔理论解决了原子的稳定性和 辐射的频率条件问题,把原子结构的 理论向前推进了一步 .
率也逐渐改变,原子的发射光 谱应是连续谱。由于原子总能 量减小,电子将最终逐渐接近 原子核,而使原子变得不稳定。
氢原子能级

氢原子能级氢原子是最简单的原子系统之一,由一个质子和一个电子组成。
其电子围绕核心运动,而不同的电子轨道对应着不同的能级。
本文将介绍氢原子的能级结构,探讨其特性和相关的物理概念。
数据建模我们首先可以通过数学方法对氢原子的能级进行建模。
根据量子力学理论,氢原子的能级可以用以下方程表示:\[ E_n = -\frac{m_e e^4 Z^2}{2 \hbar^2 n^2} \]其中,\(E_n\) 表示第 n 能级的能量,\(m_e\) 是电子的质量,\(e\) 是基本电荷,\(Z\) 是原子序数(对于氢原子为1),\(\hbar\) 是约化普朗克常数,\(n\) 表示能级。
能级结构根据上述能量公式,我们可以计算出不同能级的能量值。
氢原子的能级是离散的,且具有以下特点:1.能级间距递减:氢原子的能级间距随着能级增加而减小。
这表现为不同能级之间的差值按照 \(~\frac{1}{n^2}\) 的比例递减。
2.基态能级:最低的能级称为基态,即 n=1 时的能级。
这是电子最稳定的状态,也是氢原子最常见的状态。
3.激发态:当电子受到外部能量激发时,它可以跳跃到更高的能级,形成激发态。
这些态相对不稳定,电子常常会回到基态释放能量。
能级转变氢原子的能级转变是物质吸收或发射光线时的基础。
当电子从高能级跃迁到低能级时,会释放光子能量。
反之,吸收光子能量的过程也与能级转变有关。
在氢原子中,能级转变的典型过程包括:1.吸收辐射:电子从低能级跃迁至高能级时吸收能量,这种现象通常用于激发原子。
2.自发辐射:电子自发跃迁至低能级时释放能量,导致光子的辐射。
3.受激辐射:当光子刺激原子跃迁时,光子与原子交换能量,导致受激辐射的发生。
应用与研究氢原子能级结构的研究对于光谱学、量子力学等领域有着重要意义。
科学家们通过对氢原子的能级分析,深入了解了原子内部结构和电子行为。
此外,氢原子的能级结构也在实际应用中有所体现,例如光谱分析、原子钟精度计算等都与氢原子的能级相关。
选修3-5-2.3~4光谱-玻尔的原子模型

玻尔的原子模型
丹麦物理学家 玻尔
定态(电子处于分立的、特 定 的轨道,不辐射能量) 能级(不同轨道上的能量)
玻尔的原子模型
不同能级的能量:
En=E1/n2 E1= - 13.6 eV 发射的光子的能量: hv= En-Em 不同能级的轨道半径: rn=n2r1
玻尔的原子模型
贡献:很好解释了氢原子的光谱中波长满足的规 律。引入了量子化概念,推动了量子力学发展。
选修3-5 第二章 原子结构
第3节 光谱 氢原子光谱 第4节 玻尔的原子模型 能级
几种光谱
炽热的固体、液体或高压气 体发射的多为连续谱 连续谱
稀薄的气体发射的多为线状谱
线状谱
光谱分析应用广泛
氢原子光谱
观察条件: 真空管充入稀薄氢气 分光仪器观察 现象及规律: 线状谱 各条谱线光波长满足巴尔末公式 2~3kV高压
rn=n2r1
跃迁发射的光子能量 hv= En-Em
不完善:无法说明光谱的强度和偏振情况, 无法解释有两个以上电子的原子复杂光谱。
小结
光谱 定义 将光按波长长短顺序排列 分类 连续谱,线状谱 发射谱,吸收谱
氢原子光谱
观察条件
规律
定态 能级
真空
稀薄氢 气
2~3kV 高压
分光仪器 观察
各条谱线波长满足巴尔末公式
一系列分立的、特定
理解氢原子的能级图

A.1200
B.2000
C.2200
D.2400
解:画出示意图,分步计算,不难得 4 3 出结论①400个,②400个,③400 个,④200个,⑤200个,⑥200个, 2 ⑦400个,共2200个。
1
③ ② ① ④ ⑤ ⑥ ⑦
例 6、原子从一个能级跃迁到一个较低的能级时,有时可能不发 射光子。 例如在某种条件下, 铬原子由 n=2 能级跃迁到 n=1 能级 时并不发射光子, 而是将相应的能量转交给 n=4 能级上的电子使 之电离, 这种现象叫做俄歇效应。 以这种方式电离出去的电子叫 做俄歇电子。已知铬原子的能级公式可简化表示为 E n A2 ,式
电子云
例2、(07年天津卷)图为氢原子能 级的示意图,现有大量的氢原子处于 n=4的激发态,当向低能级跃迁时 辐射出若干不同频率的光。关于这些 D ) 光下列说法正确的是( A.最容易表现出衍射现象的光是由 n=4能级跃到n=1能级产生的 B.频率最小的光是由n=2能级跃 迁到n=1能级产生的 C.这些氢原子总共可辐射出3种不 同频率的光 D.用n=2能级跃迁到n=1能级 辐射出的光照射逸出功为6.34eV的 金属铂能发生光电效应。
D、
12 1 2
例 4、 用光子能量为 E 的单色光照射容器中处于基态的氢原子。 停止照射后, 发现该容器内的氢能够释放出三种不同频率的光子,它们的频率由低到高依 次为ν1、ν2、ν3,由此可知,开始用来照射容器的单色光的光子能量可以 表示为:①hν1;②hν3;③h(ν1+ν2);④h(ν1+ν2+ν3) 以上表示式中 A.只有①③正确 B.只有②正确 C.只有②③正确 D.只有④正确
rn=
n2r
1
第4节氢原子光谱玻尔理论

1第4节 氢原子光谱 玻尔理论一、 氢原子光谱,422-=n n B λ∞=,,5,4,3 nA =7.3645B αH βH γH ∞H ,∞→nB =∞λ巴耳末系,:线系极限∞H =:线系极限波长B =∞λA 7.3645波数:沿波线单位长度内波的个数 ν~cνλν==1~λ )121()121(441(1411~2222222nR n B n B n n B -=-=-=-==λν,5,4,3=n 里德伯公式:里德伯恒量1710096776.14-⨯==m BR 帕邢系:, )131(1~22n R -==λν,6,5,4=n 原子光谱实验规律:“原子光谱都是彼此分立的线状光谱,每一条光谱线的波数由 两个光谱项的差值决定” 里兹并合原理,, )()(~n T k T -=νN k n ∈,k n >、:光谱项)(k T )(n T 氢原子:,2)(k R k T =2)(nRn T =碱金属原子:,2)()(α+=k R k T 2)()(β+=n Rn T 、都给定,给出一条光谱线的波数k n 一定,所有的取值对应的谱线构成一个谱线系 k n 不同,给出不同的谱线系 k二、 玻尔理论1、 原子的有核模型1911,卢瑟夫,粒子散射实验α 有核模型 与经典理论矛盾 按照经典理论: 原子光谱应是连续的,原子是不稳定的2、 玻尔的氢原子理论c2(1) 定态假设:原子只能处在一系列具有不连续能量的 稳定状态:定态,不辐射电磁波 定态1, 定态2,,, , 1E 2E , 轨道1, 轨道2, ,(2) 跃迁假设:的定态的定态 n E →k E 光子频率 hE E nk -=ν <,吸收一个光子,>,放出一个光子n E k E n E k E (3)角动量量子化假设:电子绕核转动的角动量:, n hnL ==π2 ,3,2,1=n:量子数n :约化普朗克常数,SI :=π2h = π2h= Js 341005.1-⨯三、 氢原子结构和氢原子光谱 1、 轨道半径(1) 20224r e r V m πε= (2),n mVr L == ,3,2,1=n (,)V m r P r L⨯=⨯=θθsin sin rmV rP L == ,, 222023141 n r e mr πε=22204n me r ⋅= πε ,3,2,1=n , 1=nA ==529.042201mer πε ,2=n 2122⋅=r r ,3=n2133⋅=r r21n r r n ⋅=<<<321r r r :玻尔半径A =529.01r 结论:电子的轨道半径是量子化的 2、 定态能量,, r e mV E 022421πε-=20224r e r V m πε=r e mV 022821πε= ,210202188n r e re E ⋅-=-=πεπε ,3,2,1=nVm e3,,,1=n eV r e E 6.1381021-=-=πε2=n eV E E 4.32/212-== ,,3=n ,51.13/213eV E E -== 21/n E E n =<<<321E E E 的定态:基态,的定态,激发态 1=n 1>n 结论:氢原子的定态能量是量子化的 每一个定态能量称为一个能级∞=n4=n51.1-3=neV 4.3-2=neV 6.13-1=n3、 氢原子光谱氢原子 ,n E →k E k n >辐射光子频率==h E E k n -=ν)(12121k E n E h -)11(221nk h E -- 波数, ==c νν~11(221n k hc E --k n > 令,, hc E R 1-===λν1~)11(22n k R -k n >= hcER 1-=1710097373.1-⨯m 例:赖曼系中波长最短的谱线光子能量是多少? 答:eV 6.13例:巴耳末系中波长最短的谱线光子能量是多少? 答:eV 4.3例:写出氢原子光谱各谱线系的极限波数表达式解:,, ==λν1~11(22n k R -∞→n 2)(~k R =∞ν赖曼系 (), = 1=k R =∞)(~赖ν1710097.1-⨯m 巴耳末系(), 2=k 1710274.04)(~-⨯==∞m R 巴ν5=n 赖曼系4四、 玻尔理论的缺陷氢原子及 类氢离子光谱 , ,, H +He +2Li +3Be Z= 1, 2, 3, 4碱金属元素的原子光谱,光谱的精细结构 塞曼效应,谱线宽度、强度、偏振逻辑上,玻尔理论自相矛盾 认识原子结构的里程碑 “定态”、“能级”、“跃迁” 例:氢原子由量子数为的定态()的定态 n →1-n 求:(1)辐射光子频率1-→n n ν (2)很大时,n 1-→n n νn ν≈:电子在第轨道上的转动频率n νn 解:(1)= 1-→n n ν22121211)1(12])1([1n n n h E n E n E h h E E n n --⋅-=--=--= ()22102)1(128n n n h r e --⋅πε10218r e E πε-= (2)= () n νn n n n n r mV mV r V ππ222=20224nn n r e r V m πε== (,) 31020214214nh r e n r e n ⋅=⋅πεππε n r mV n n =21n r r n ⋅= 很大时,== n 1-→n n ν22102)1(128n n n h r e --⋅πε310214nh r e ⋅≈πεn ν对应原理:当量子数很大时,量子方程应过渡到经典方程 n 经典理论是量子理论在很大时的极限 n 例:氢原子某谱线系的极限波长为,其中一条谱线A 3647 波长为A 6565求:该谱线对应的氢原子初态和末态的能级能量 ()1710097.1-⨯=m R 解:,,, ==λν1~11(22n k R -∞→n 21k R =∞λ2==∞λR k ,,= =λ1)121(22n R -221211n R -=λR nλ14112-=R R λλ44-344=-=R Rn λλ 初态,3=n eV E E 51.13/213-==末态,2=n eV E E 4.32/212-==。
光谱由氢原子核能级迁越产生

光谱由氢原子核能级迁越产生
光谱由氢原子核能级迁移产生是一个非常重要的物理现象。
当
氢原子中的电子从一个能级跃迁到另一个能级时,会释放或吸收特
定频率的光子,这种现象就是光谱。
这些能级迁移产生的光谱可以
分为几种类型,包括吸收光谱和发射光谱。
首先,让我们来看一下氢原子的能级结构。
氢原子的能级是量
子力学中的一个重要概念,它描述了电子在原子中可能具有的能量。
氢原子的能级是量子化的,即只有特定的能量值是允许的。
当电子
从一个能级跃迁到另一个能级时,它会释放或吸收能量,这就导致
了光谱的产生。
其次,让我们来看一下光谱是如何产生的。
当氢原子中的电子
跃迁到更低的能级时,会释放能量,这导致了发射光谱的产生。
而
当外部能量作用于氢原子,使得电子跃迁到较高能级时,则会吸收
能量,这导致了吸收光谱的产生。
这些光谱可以通过光谱仪进行观
测和分析,从而揭示出氢原子的能级结构和性质。
此外,光谱不仅在氢原子中产生,其他原子和分子也会产生光谱。
每种原子或分子都有其特定的能级结构,因此它们产生的光谱
也具有独特的特征,这为光谱分析提供了重要的依据。
总的来说,光谱由氢原子核能级迁移产生是一个涉及量子力学和光谱学等多个领域的重要现象,它不仅揭示了原子和分子的能级结构,也在实际应用中发挥着重要作用,例如在天文学、化学分析等领域都有着广泛的应用。
希望以上回答能够满足你对这个问题的多角度全面的了解。
氢原子光谱与能级结构

3 光谱分析
二、氢原子光谱的实验规律
氢原子是最简单的原子,其光谱也最简单。
气体放电管:玻璃管中的稀薄气体的分子在强 电场的作用下会电离,成为自由移动的正负电 荷,于是气体变成导体,导电时会发光。这样 的装置叫做气体放电管。
1885年,巴耳末对当时已知的,在可见光 区的14条谱线作了分析,发现这些谱线的 波长可以用一个公式表示:
除了巴耳末系,后来发现的氢光谱在红外 和紫个光区的其它谱线也都满足与巴耳末 公式类似的关系式。
其他谱系
巴尔末公式有正整数n出现,这里我们也用正整数n来标志
氢原子的能级。它们之间是否有某种关系?
1 1 1 巴尔末公式: R λ 22 n 2
氢 原 子 能 级 跃 迁 与 光 谱 图
轨道及转动频率不断变化,辐射电 磁波频率也是连续的, 原子光谱应 是连续的光谱。而实际上看到的是 分立的线状谱。
这些矛盾说明尽管经典物理学理论可 以很好地应用宏观物休,但它不能解 释原子世界的现象,引入新观念是必 要的。
光子
谢
谢
② 明线光谱
A 只含有一些不连续的亮线的光谱叫做明线光 谱。 明线光谱中的亮线叫谱线,各条谱线对应不同波 长的光。 B 稀薄气体或金属的蒸气的发射光谱是明线光谱。 C 各种原子的发射光谱都是线状谱,说明原子只 能发出几种特定频率的光。不同原子的亮线位置 不同,说明不同原子的发光频率是不一样的,因 此这些亮线称为原子的特征谱线。
(1)定义:物体发光直接产生的光谱叫做发射光谱。
(2)分类:发射光谱可分类:连续光谱和明线光谱。
①连续光谱 A 由波长连续分布的光组成的连在一起的光带叫连 续光谱。 特点:光谱看起来不是一条条分立的谱线,而是 连在一起的光带。 即连续分布的包含有从红光 到紫光各种色光的光谱。 B 炽热的固体、液体和高压气体的发射光谱是连续 光谱。 例如白炽灯丝发出的光、烛焰、炽热的钢水发出 的光都形成连续光谱。
原子物理 知识要点

原子物理 知识要点第一节 电子的发现与汤姆孙模型 1、阴极射线 2、汤姆孙的研究3. 汤姆生发现电子,根据原子呈电中性,提出了原子的葡萄干布丁模型。
第二节 原子的核式结构模型 1、粒子散射实验原理、装置 (1)粒子散射实验原理:(2)粒子散射实验装置 主要由放射源、金箔、荧光屏、望远镜几部分组成。
(3)实验的观察结果 入射的粒子分为三部分。
大部分沿原来的方向前进,少数发生了较大偏转,极少数发生大角度偏转。
2、原子的核式结构的提出三个问题:用汤姆生的葡萄干布丁模型能否解释粒子大角度散射?(1)粒子出现大角度散射有没有可能是与电子碰撞后造成的?(2)按照葡萄干布丁模型,粒子在原子附近或穿越原子内部后有没有可能发生大角度偏转?小结:实验中发现极少数粒子发生了大角度偏转,甚至反弹回来,表明这些粒子在原子中某个地方受到了质量、电量均比它本身大得多的物体的作用,可见原子中的正电荷、质量应都集中在一个中心上。
①绝大多数粒子不偏移→原子内部绝大部分是“空”的。
②少数粒子发生较大偏转→原子内部有“核”存在。
③极少数粒子被弹回 表明:作用力很大;质量很大;电量集中。
3、原子核的电荷与大小4.卢瑟福原子核式结构模型 第三节 波尔的原子模型卢瑟福原子核式结构学说与经典电磁理论的矛盾丹麦物理学家玻尔,在1913年提出了自己的原子结构假说。
1、玻尔的原子理论(1)能级(定态)假设:原子只能处于一系列不连续的能量状态中,在这些状态中原子是稳定的,电子虽然绕核运动,但并不向外辐射能量。
这些状态叫定态。
(本假设是针对原子稳定性提出的)(2)跃迁假设:原子从一种定态(设能量为En )跃迁到另一种定态(设能量为E m )时,它辐射(或吸收)一定频率的光子,光子的能量由这两种定态的能量差决定,即(h 为普朗克恒量)(本假设针对线状谱提出)(3)轨道量子化假设:原子的不同能量状态跟电子沿不同的圆形轨道绕核运动相对应。
原子的定态是不连续的,因此电子的可能轨道的分布也是不连续的。
无机与分析化学 第四章 物质结构简介
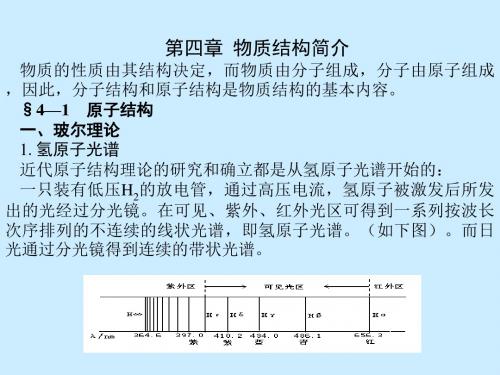
2.玻尔理论 1).电子只能在符合一定条件的轨道(能量不随时间而变)上 运动,不吸收也不放出能量(解释原子的稳定性)。 2).不同的轨道有不同的能量,轨道的能量是量子化的,电子 的能量也是量子化的。所谓量子化,即不连续。(“连续”和“ 不 连续”是看量的变化有没有一个最小单位,如长度、时间没有最 小单位,量的变化是连续的,电量的最小单位是一个电子的电 量,电量的变化是不连续的。)在一定的轨道上电子具有一定 的能量 电子运动时所处的能量状态称为能级。电子尽可能在距 13 .6 核较近、能量最低的轨道上运动,这时原子处于基态。 n En = (ev) rn = a0﹒n2
【特征】①不连续的线状光谱:从红外区到紫外区呈现多条具有 特征波长的谱线 ②从长波到短波, Hα 至 Hε 等谱线间的距离越来越小( n 越来 越大)表现出明显的规律性。 频率 R ( 1 1 ), ( n 3, 4, 5,...)
22 n2
式中R为里德堡常数。而且某一瞬间一个氢原子只能放出一条谱 线,许多氢原子才能放出不同的谱线。 为什么氢原子光谱是不连续的线状光谱?按照麦克斯威的电磁理 论,绕核运动的电子应不停地连续地辐射电磁波,得到连续光谱; 由于电磁波的辐射,电子的能量将逐渐减小,最终会落到带正电的 核上。可事实上,原子稳定的存在着。为解决这一问题,1913年, 年轻的丹麦物理学家玻尔,吸收了量子论的思想,建立了玻尔原子 模型,即玻尔理论。
r
d d 4 r dr
2 2 2
r
4 r 2
只考虑径向部分,则 d 4 r R dr 2 2 D(r ) 4 r R 令 D(r):径向分布函数,表示电子在离核为r的单位厚度(d r = 1)球 形薄壳中出现的概率。 作D(r)- r图(p.99 图4-10,图4-11),即为电子云(几率)径 向分布图。
粤教版高中物理选修3-5课件第三章第三四节原子的能级结构

(3)玻尔理论对氢原子光谱的解释. ①解释巴耳末公式: 按照玻尔理论,从高能级跃迁到低能级时辐射的光子 的能量为 hν=Em-En;巴耳末公式中的正整数 n 和 2 正 好代表能级跃迁之前和之后的定态轨道的量子数 n 和 2. ②解释氢原子光谱的不连续性: 原子从较高能级向低能级跃迁时放出光子的能量等 于前后两能级差,由于原子的能级是分立的,所以放出 的光子的能量也是分立的,因此原子的发射光谱只有一 些分立的亮线.
答案:CD
拓展一 氢原子光谱 如图所示为氢原子光谱. (1)仔细观察,氢原子光谱具有什么特点? (2)氢原子光谱的谱线波长具有什么规律?
提示:(1)氢原子光谱从左向右谱线间的距离越来越大. (2)氢原子光谱的谱线波长符合巴耳末公式.
1.原子光谱. (1)概念: 原子的气体通电后可以发光并产生固定不变的光 谱,这种光谱被称为原子光谱. (2)特点: ①每种原子都有自己特定的原子光谱. ②不同的原子,其原子光谱不同,原子光谱被称为 原子的“指纹”.
(4)玻尔理论的局限性. ①玻尔理论的成功之处:玻尔理论第一次将量子观 念引入原子领域.提出了定态和跃迁的概念,成功地解 释了氢原子光谱的实验规律. ②玻尔理论的局限性:过多地保留了经典理论,对 更复杂的原子发光无法解释.
2.氢原子能级. (1)氢原子的能级图如图所示,从玻尔的基本假设出 发,运用经典电磁学和经典力学的理论,可以计算氢原 子中电子的可能轨道及相应的能量. rn=n2r1,En=En21,式中 n=1,2,3,…其中 r1= 0.53×10-10 m,E1=-13.6 eV. n 取不同的量子数时,可求得各能级的能量值.
第三章 原子结构之谜
第三节 氢原子光谱 第四节 原子的能级结构
学习目标
1.了解氢原子光谱的不连 续性及各个线系. 2.了解能级结构猜想. 3.知道氢原子能级公式. 4.能够利用能级公式分析 一些有关能级的问题.
2019-2020学年鲁科版物理选修3-5新素养同步讲义:第2章 第3节 玻尔的原子模型 第4节 氢原子光谱与能级结

第3节玻尔的原子模型第4节氢原子光谱与能级结构1.了解玻尔理论的主要内容.2.掌握氢原子能级和轨道半径的规律.(重点+难点)3.了解氢原子光谱的特点,知道巴尔末公式及里德伯常量. 4.理解玻尔理论对氢光谱规律的解释.(重点+难点)一、玻尔原子模型1.卢瑟福的原子核式结构模型能够很好的解释α粒子与金箔中原子碰撞所得到的信息,但不能解释原子光谱是特征光谱和原子的稳定性.2.基本假设内容定态假设原子只能处于一系列能量不连续的状态中,在这些状态中,原子是稳定的,电子虽然做加速运动,但并不向外辐射能量,这些状态叫做定态.电子绕原子核做圆周运动,只能处在一些分立的轨道上,它只能在这些轨道上绕核转动而不产生电磁辐射跃迁假设原子从一种定态跃迁到另一定态时,吸收(或辐射)一定频率的光子能量hν,假如,原子从定态E2跃迁到定态E1,辐射的光子能量为hν=E2-E1轨道假设原子的不同能量状态对应于电子的不同运行轨道.原子的能量状态是不连续的,电子不能在任意半径的轨道上运行,只有轨道半径r跟电子动量m e v的乘积满足下式m e v r=nh2π(n=1,2,3,…)这些轨道才是可能的.n是正整数,称为量子数1.(1)玻尔的原子结构假说认为电子的轨道是量子化的.()(2)电子吸收某种频率条件的光子时会从较低的能量态跃迁到较高的能量态.()(3)电子能吸收任意频率的光子发生跃迁.()提示:(1)√(2)√(3)×二、氢原子的能级结构1.能级:在玻尔的原子理论中,原子只能处于一系列不连续的能量状态,在每个状态中,原子的能量值都是确定的,各个不连续能量值叫做能级.2.氢原子能级结构图根据玻尔理论,氢原子在不同能级上的能量和相应的电子轨道半径为E n=E1n2(n=1,2,3,…)r n=n2r1(n=1,2,3,…)式中,E 1≈-13.6__eV ,r 1=0.53×10-10__m . 根据以上结果,把氢原子所有可能的能量值画在一张图上,就得到了氢原子的能级结构图(如图所示).n =∞————————E ∞=0⋮n =5 ————————E 5=-0.54 eVn =4 ————————E 4=-0.85 eVn =3 ————————E 3=-1.51 eVn =2 ————————E 2=-3.4 eVn =1 ————————E 1=-13.6 eV3.玻尔理论对氢原子光谱特征的解释(1)在正常或稳定状态时,原子尽可能处于最低能级,电子受核的作用力最大而处于离核最近的轨道,这时原子的状态叫做基态.(2)电子吸收能量后,从基态跃迁到较高的能级,这时原子的状态叫做激发态.(3)当电子从高能级跃迁到低能级时,原子会辐射能量;当电子从低能级跃迁到高能级时,原子要吸收能量.因为电子的能级是不连续的,所以原子在跃迁时吸收或辐射的能量都不是任意的.这个能量等于电子跃迁时始末两个能级间的能量差.能量差值不同,发射的光频率也不同,我们就能观察到不同颜色的光.1.只要原子吸收能量就能发生跃迁吗?提示:原子在跃迁时吸收或辐射的能量都不是任意的,只有这个能量等于电子跃迁时始末两个能级的能量差,才会发生跃迁.三、氢原子光谱1.氢原子光谱的特点(1)从红外区到紫外区呈现多条具有确定波长(或频率)的谱线;(2)从长波到短波,H α~H δ等谱线间的距离越来越小,表现出明显的规律性.2.巴尔末公式:1λ=R ⎝⎛⎭⎫122-1n 2(n =3,4,5…)其中R 叫做里德伯常量,其值为R =1.096 775 81×107 m -1.3.红外区和紫外区:其谱线也都遵循与巴尔末公式类似的关系式.2.(1)光是由原子核内部的电子运动产生的,光谱研究是探索原子核内部结构的一条重要途径.( )(2)稀薄气体的分子在强电场的作用下会变成导体并发光.( )(3)巴耳末公式中的n 既可以取整数也可以取小数.( )提示:(1)× (2)√ (3)×四、玻尔理论对氢光谱的解释1.理论推导:由玻尔理论可知,当激发到高能级E 2的电子跃迁到低能级E 1时,就会释放出能量.根据E n =-13.6n 2 eV(n =1,2,3,…) 得E 2=-13.6n 22 eV ,E 1=-13.6n 21eV 再根据hν=E 2-E 1,得ν=13.6h ⎝⎛⎭⎫1n 21-1n 22 此式在形式上与氢原子光谱规律的波长公式一致,当n 1=2,n 2=3,4,5,6,…时就是巴尔末公式.2.巴尔末系:氢原子从相应的能级跃迁到n =2的能级得到的线系.2.玻尔理论是量子化的理论吗?提示:不是,玻尔理论的电子轨道是量子化的,并根据量子化能量计算光的发射和吸收频率,这是量子论的方法;而电子轨道的半径是用经典电磁理论推导的,所以玻尔理论是半经典的量子论.对玻尔原子模型的理解1.轨道量子化:轨道半径只能够是一些不连续的、某些分立的数值.模型中保留了卢瑟福的核式结构,但他认为核外电子的轨道是不连续的,它们只能在某些可能的、分立的轨道上运动,而不是像行星或卫星那样,能量大小可以是任意的量值.例如,氢原子的电子最小轨道半径为r 1=0.053 nm ,其余可能的轨道半径还有0.212 nm 、0.477 nm 、…不可能出现介于这些轨道半径之间的其他值.这样的轨道形式称为轨道量子化.2.能量量子化:与轨道量子化对应的能量不连续的现象.电子在可能轨道上运动时,尽管是变速运动,但它并不释放能量,原子是稳定的,这样的状态也称之为定态.由于原子的可能状态(定态)是不连续的,具有的能量也是不连续的.这样的能量形式称为能量量子化.3.跃迁:原子从一种定态(设能量为E 2)跃迁到另一种定态(设能量为E 1)时,它辐射(或吸收)一定频率的光子,光子的能量由这两种定态的能量差决定,即h ν=E 2-E 1(或E 1-E 2).可见,电子如果从一个轨道到另一个轨道,不是以螺旋线的形式改变半径大小的,而是从一个轨道上“跳跃”到另一个轨道上.玻尔将这种现象叫做电子的跃迁.4.总而言之:根据玻尔的原子理论假设,电子只能在某些可能的轨道上运动,电子在这些轨道上运动时不辐射能量,处于定态.只有电子从一条轨道跃迁到另一条轨道上时才辐射能量,辐射的能量是一份一份的,等于这两个定态的能量差.这就是玻尔理论的主要内容.(1)处于基态的原子是稳定的,而处于激发态的原子是不稳定的.(2)原子的能量与电子的轨道半径相对应,轨道半径大,原子的能量大,轨道半径小,原子的能量小.按照玻尔原子理论,氢原子中的电子离原子核越远,氢原子的能量________(选填“越大”或“越小”).已知氢原子的基态能量为E 1(E 1<0),电子质量为m ,基态氢原子中的电子吸收一频率为ν的光子被电离后,电子速度大小为________(普朗克常量为h ).[思路点拨] 根据玻尔原子理论与能量守恒定律求解.[解析] 根据玻尔理论,氢原子中电子离原子核越远,氢原子能量越大,根据能量守恒定律可知:h ν+E 1=12m v 2,所以电子速度为:v = 2(hν+E 1)m. [答案] 越大2(hν+E 1)m电子被电离后可认为离原子核无限远,即电子的电势能为零,所以此时电子的能量等于电子的动能.1.(多选)按照玻尔原子理论,下列表述正确的是( )A .核外电子运动轨道半径可取任意值B .氢原子中的电子离原子核越远,氢原子的能量越大C .电子跃迁时,辐射或吸收光子的能量由能级的能量差决定,即hν=E m -E n (m >n )D .氢原子从激发态向基态跃迁的过程,可能辐射能量,也可能吸收能量解析:选BC.根据玻尔理论,核外电子运动的轨道半径是确定的值,而不是任意值,A 错误;氢原子中的电子离原子核越远,能级越高,能量越大,B 正确;由跃迁规律可知C 正确;氢原子从激发态向基态跃迁的过程中,应辐射能量,D 错误.对氢原子能级跃迁的理解1.能级跃迁处于激发态的原子是不稳定的,它会自发地向较低能级跃迁,经过一次或几次跃迁到达基态.如图带箭头的竖线表示原子由较高能级向较低能级的跃迁.所以一群氢原子处于量子数为n 的激发态时,可能辐射出的光谱线条数为:N =n (n -1)2=C 2n .2.根据玻尔理论,当氢原子从高能级跃迁到低能级时以光子的形式放出能量.原子在始、末两个能级E m和E n(m>n)间跃迁时,辐射光子的能量等于前后两个能级之差(hν=E m-E n),由于原子的能级不连续,所以辐射的光子的能量也不连续,因此产生的光谱是分立的线状光谱.3.原子能量的变化(1)光子的发射原子由高能级向低能级跃迁时以光子的形式放出能量,发射光子的频率由下式决定.hν=E m-E n(E m、E n是始、末两个能级且m>n)能级差越大,放出光子的频率就越高.(2)光子的吸收由于原子的能级是一系列不连续的值,任意两个能级差也是不连续的,故原子发射一些特定频率的光子,同样也只能吸收一些特定频率的光子,原子吸收光子后会从较低能级向较高能级跃迁,吸收光子的能量仍满足hν=E m-E n.(m>n)(3)原子能量的变化当轨道半径减小时,库仑引力做正功,原子的电势能E p减小,电子动能增大,原子能量减小.反之,轨道半径增大时,原子电势能增大,电子动能减小,原子能量增大.4.原子跃迁时需注意的几个问题(1)注意一群原子和一个原子氢原子核外只有一个电子,这个电子在某个时刻只能处在某一个可能的轨道上,在某段时间内,由某一轨道跃迁到另一个轨道时,可能的情况只有一种,但是如果容器中盛有大量的氢原子,这些原子的核外电子跃迁时就会有各种情况出现.(2)注意直接跃迁与间接跃迁原子从一种能量状态跃迁到另一种能量状态时,有时可能是直接跃迁,有时可能是间接跃迁.两种情况的辐射(或吸收)光子的频率不同.(3)注意跃迁与电离原子跃迁时,不管是吸收还是辐射光子,其光子的能量都必须等于这两个能级的能量差.若想把处于某一定态上的原子的电子电离出去,就需要给原子一定的能量.如基态氢原子电离,其电离能为13.6 eV,只要能量等于或大于13.6 eV的光子都能被基态氢原子吸收而电离,只不过入射光子的能量越大,原子电离后产生的电子具有的动能越大.(1)对于处于高能级状态的一群氢原子,每个原子都能向低能级状态跃迁,且跃迁存在多种可能,有的可能一次跃迁到基态,有的可能经几次跃迁到基态.同样,处于基态的氢原子吸收不同能量时,可以跃迁到不同的激发态.(2)实物粒子和原子碰撞时,由于实物粒子的动能可全部或部分地被原子吸收,所以只要入射粒子的动能大于或等于原子某两定态能量之差,就可使原子受激发而向较高能级跃迁.大量氢原子处于不同能量激发态,发生跃迁时放出三种不同能量的光子,其能量值分别是:1.89 eV ,10.2 eV ,12.09 eV .跃迁发生前这些原子分布在________个激发态能级上,其中最高能级的能量值是________eV(基态能量为-13.6 eV).[思路点拨] 由于发出三种不同能量的光子,由N =n (n -1)2可知,大量氢原子跃迁前处于n =2和n =3两个激发态上.[解析] 大量氢原子跃迁发出三种不同能量的光子,跃迁情况为n =3的激发态到n =2的激发态或直接到n =1的基态,也可能是n =2的激发态到n =1的基态,所以跃迁发生前这些原子分布在2个激发态能级上,最高能量值满足E =-13.6 eV +12.09 eV ,即E 为-1.51 eV .[答案] 2 -1.51解答本题的关键是对氢原子的能级跃迁有深刻的理解.2.如图为氢原子能级示意图的一部分,则氢原子( )A .从n =4能级跃迁到n =3能级比从n =3能级跃迁到n =2能级辐射出电磁波的波长长B .从n =5能级跃迁到n =1能级比从n =5能级跃迁到n =4能级辐射出电磁波的速度大C .若要从低能级跃迁到高能级,必须吸收光子D .从高能级向低能级跃迁时,氢原子核一定向外放出能量解析:选A.氢原子跃迁时辐射出电磁波,h ν=hc λ=E m -E n =ΔE .可见λ与ΔE 成反比,由能级图可得从n =4能级跃迁到n =3能级时,ΔE =0.66 eV ,从n =3能级跃迁到n =2能级时,ΔE =1.89 eV ,所以A 正确;电磁波的速度都等于光速,B 错误;若有电子去碰撞氢原子,入射电子的动能可全部或部分被氢原子吸收,所以只要入射电子的动能大于氢原子两个能级之间的能量差,也可使氢原子由低能级向高能级跃迁,C 错误;从高能级向低能级跃迁时,是氢原子向外放出能量,而非氢原子核,D 错误.对氢原子光谱的理解1.对氢原子光谱的几点说明氢原子是自然界中最简单的原子,通过对它的光谱线的研究,可以了解原子的内部结构和性质.氢原子光谱线是最早发现、研究的光谱线.(1)氢光谱是线状的,不连续的,波长只能是分立的值.(2)谱线之间有一定的关系,可用一个统一的公式1λ=R ⎝⎛⎭⎫1m 2-1n 2表达. 式中m =2对应巴尔末公式:1λ=R ⎝⎛⎭⎫122-1n 2,n =3,4,5….其谱线称为巴尔末线系,是氢原子核外电子由高能级跃迁至n =2的能级时产生的光谱,其中H α~H δ在可见光区.由于光的频率不同,其颜色不同.m =1 对应赖曼线系;m =3 对应帕邢线系即赖曼线系(在紫外区)1λ=R ⎝⎛⎭⎫112-1n 2,n =2,3,4… 帕邢线系(在红外区)1λ=R ⎝⎛⎭⎫132-1n 2,n =4,5,6… 2.玻尔理论对氢光谱的解释(1)理解导出的氢光谱规律:按玻尔的原子理论,氢原子的电子从能量较高的轨道n 跃迁到能量较低的轨道2时辐射出的光子能量:hν=E n -E 2,但E n =E 1n 2,E 2=E 122,由此可得:hν=-E 1⎝⎛⎭⎫122-1n 2,由于ν=c λ,所以上式可写作:1λ=-E 1hc ⎝⎛⎭⎫122-1n 2,此式与巴尔末公式比较,形式完全一样.由此可知,氢光谱的巴尔末系是电子从n =3,4,5,6等能级跃迁到n =2的能级时辐射出来的.(2)成功方面①运用经典理论和量子化观念确定了氢原子的各个定态的能量,并由此画出了其能级图.②处于激发态的氢原子向低能级跃迁辐射出光子,辐射光子的能量与实际符合的很好,由于能级是分立的,辐射光子的波长也是不连续的.③导出了巴尔末公式,并从理论上算出了里德伯常量R 的值,并很好地解释甚至预言了氢原子的其他谱线系.④能够解释原子光谱,每种原子都有特定的能级,原子发生跃迁时,每种原子都有自己的特征谱线,即原子光谱是线状光谱,利用光谱可以鉴别物质和确定物质的组成成分.(3)局限性和原因①局限性:成功地解释了氢原子光谱的实验规律,但不能解释稍微复杂原子的光谱. ②原因:保留了经典粒子的观念,把电子的运动仍然看作经典力学描述下的轨道运动.(多选)关于巴尔末公式1λ=R ⎝⎛⎭⎫122-1n 2的理解,正确的是( ) A .此公式是巴尔末在研究氢光谱特征时发现的B .公式中n 可取任意值,故氢光谱是连续谱C .公式中n 只能取不小于3的整数,故氢光谱是线状谱D .公式不但适用于氢光谱的分析,也适用于其他原子的光谱分析[思路点拨] 根据巴尔末公式及氢原子能量的量子化解答. [解析] 此公式是巴尔末在研究氢光谱在可见光区的谱线时得到的,只适用于氢光谱的分析,且n 只能取大于等于3的正整数,则λ不能取连续值,故氢原子光谱是线状谱.故选AC.[答案] AC 3.对于巴尔末公式下列说法正确的是( )A .所有氢原子光谱的波长都与巴尔末公式相对应B .巴尔末公式只确定了氢原子发光的可见光部分的光的波长C .巴尔末公式确定了氢原子发光的一个线系的波长,其中既有可见光,又有紫外光D .巴尔末公式确定了各种原子发光中的光的波长解析:选C.巴尔末公式只确定了氢原子发光中一个线系波长,不能描述氢原子发出的各种波长,也不能描述其他原子的发光,A 、D 错误;巴尔末公式是由当时已知的可见光中的部分谱线总结出来的,但它适用于整个巴尔末线系,该线系包括可见光和紫外光,B 错误,C 正确.原子的能量与能量变化1.原子的能量包括电子绕核运动的动能和电子与核系统具有的电势能.(1)电子的动能电子绕核做圆周运动所需向心力由库仑力提供k e 2r 2=m v 2r ,故E k n =12m v 2n =ke 22r n. (2)系统的电势能电子在半径为r n 的轨道上所具有的电势能E p n =-ke 2r n(E p ∞=0). (3)原子的能量E n =E k n +E p n =ke 22r n +-ke 2r n =-ke 22r n.即电子在半径大的轨道上运动时,动能小,电势能大,原子能量大.2.跃迁时电子动能、原子电势能与原子能量的变化:当原子从高能级向低能级跃迁时,轨道半径减小,库仑引力做正功,原子的电势能E p 减小,电子动能增大,向外辐射能量,原子能量减小.反之,原子电势能增大,电子动能减小,原子能量增大.氢原子在基态时轨道半径r 1=0.53×10-10 m ,能量E 1=-13.6 eV .电子的质量m =9.1×10-31kg ,电荷量e =1.6×10-19 C .求氢原子处于基态时:(1)电子的动能;(2)原子的电势能.[思路点拨] 电子绕核运动的动能可根据库仑力充当向心力求出,电子在某轨道上的动能与电势能之和,为原子在该定态的能量E n ,即E n =E k n +E p n ,由此可求得原子的电势能.[解析] (1)设处于基态的氢原子核外电子速度为v 1,则k e 2r 21=m v 21r 1所以电子动能E k1=12m v 21=ke 22r 1=9×109×(1.6×10-19)22×0.53×10-10×1.6×10-19 eV ≈13.6 eV. (2)因为E 1=E k1+E p1所以E p1=E 1-E k1=-13.6 eV -13.6 eV =-27.2 eV .[答案] (1)13.6 eV (2)-27.2 eV该类问题是玻尔氢原子理论与经典电磁理论的综合应用,用电子绕核的圆周运动规律与轨道半径公式、能级公式的结合求解.4.氢原子的核外电子从距核较近的轨道跃迁到距核较远的轨道的过程中( )A .原子要吸收光子,电子的动能增大,原子的电势能增大B .原子要放出光子,电子的动能减小,原子的电势能减小C .原子要吸收光子,电子的动能增大,原子的电势能减小D .原子要吸收光子,电子的动能减小,原子的电势能增大解析:选D.根据玻尔理论,氢原子核外电子在离核较远的轨道上运动能量较大,必须吸收一定能量的光子后,电子才能从离核较近的轨道跃迁到离核较远的轨道,故B 错误;氢原子核外电子绕核做圆周运动,由原子核对电子的库仑力提供向心力,即:k e 2r 2=m v 2r,又E k =12m v 2,所以E k =ke 22r.由此式可知:电子离核越远,即r 越大时,电子的动能越小,故A 、C 错误;由r 变大时,库仑力对核外电子做负功,因此电势能增大,从而判断D 正确.[随堂检测]1.(多选)由玻尔理论可知,下列说法中正确的是( )A .电子绕核运动有加速度,就要向外辐射电磁波B .处于定态的原子,其电子做变速运动,但它并不向外辐射能量C .原子内电子的可能轨道是连续的D .原子的轨道半径越大,原子的能量越大解析:选BD.按照经典物理学的观点,电子绕核运动有加速度,一定会向外辐射电磁波,很短时间内电子的能量就会消失,与客观事实相矛盾,由玻尔假设可知选项A 、C 错误,B 正确;原子轨道半径越大,原子能量越大,选项D 正确.2.白炽灯发光产生的光谱是( )A .连续光谱B .明线光谱C .原子光谱D .吸收光谱解析:选A.白炽灯发光属于炽热的固体发光,所以发出的是连续光谱.3.如图所示是某原子的能级图a 、b 、c 为原子跃迁所发出的三种波长的光.在下列该原子光谱的各选项中,谱线从左向右的波长依次增大,则正确的是( )解析:选C.能量越大,频率越高,波长越短,根据能级图可以看出,三种光的能量按a 、c 、b 的顺序依次降低,所以波长也是按这个顺序依次增大.4.试计算氢原子光谱中巴尔末系的最长波和最短波的波长各是多少?解析:根据巴尔末公式:1λ=R ⎝⎛⎭⎫122-1n 2,n =3,4,5,…可得λ=1R ⎝⎛⎭⎫122-1n 2(n =3,4,5,…).当n =3时波长最长,其值为λmax =1R ⎝⎛⎭⎫122-1n 2=1536R =1536×1.10×107 m ≈6.55×10-7 m , 当n →∞时,波长最短,其值为λmin =1R ⎝⎛⎭⎫122-0=4R =41.10×107 m ≈3.64×10-7 m. 答案:6.55×10-7 m 3.64×10-7 m[课时作业]一、单项选择题1.关于玻尔的原子模型理论,下列说法正确的是( )A .原子可以处于连续的能量状态中B .原子的能量状态不是连续的C .原子中的核外电子绕核做变速运动一定向外辐射能量D .原子中的电子绕核运动的轨道半径是连续的解析:选B.玻尔依据经典物理在原子结构问题上遇到了困难,引入量子化观念建立了新的原子模型理论,主要内容为:电子轨道是量子化的,原子的能量是量子化的,处在定态的原子不向外辐射能量.由此可知B 正确.2.关于光谱,下列说法正确的是( )A .一切光源发出的光谱都是连续谱B .一切光源发出的光谱都是线状谱C .稀薄气体发出的光谱是线状谱D .作光谱分析时,利用连续谱和线状谱都可以鉴别物质和确定物质的化学组成解析:选C.不同光源发出的光谱有连续谱,也有线状谱,故A 、B 错误.稀薄气体发出的光谱是线状谱,C 正确.利用线状谱和吸收光谱都可以进行光谱分析,D 错误.3.一个氢原子从n =3能级跃迁到n =2能级,该氢原子( )A .放出光子,能量增加B .放出光子,能量减少C .吸收光子,能量增加D .吸收光子,能量减少解析:选B.由玻尔理论可知,氢原子由高能级向低能级跃迁时,辐射出光子,原子能量减少.4.汞原子的能级图如图所示,现让一束单色光照射到大量处于基态的汞原子上,汞原子只发出三种不同频率的单色光,那么,关于入射光的能量,下列说法正确的是()A.可能大于或等于7.7 eVB.可能大于或等于8.8 eVC.一定等于7.7 eVD.包含2.8 eV,5 eV,7.7 eV三种解析:选C.由玻尔理论可知,轨道是量子化的,能级是不连续的,只能发射不连续的单色光,于是要发出三种不同频率的光,只有从基态跃迁到n=3的激发态上,其能量差ΔE =E3-E1=7.7 eV,选项C正确,A、B、D错误.5.已知处于某一能级n上的一群氢原子向低能级跃迁时,能够发出10种不同频率的光,下列能表示辐射光波长最长的那种跃迁的示意图是()解析:选A.根据玻尔理论,波长最长的跃迁对应着频率最小的跃迁,根据氢原子能级图,频率最小的跃迁对应的是从5到4的跃迁,选项A正确.6.如图甲所示的a、b、c、d为四种元素的特征谱线,图乙是某矿物的线状谱,通过光谱分析可以确定该矿物中缺少的元素为()A.a元素B.b元素C.c元素D.d元素解析:选B.把矿物的线状谱与几种元素的特征谱线进行对照,b元素的谱线在该线状谱中不存在,故选项B正确,与几个元素的特征谱线不对应的线说明该矿物中还有其他元素.二、多项选择题7.根据玻尔理论,氢原子中量子数n越大()A.电子的轨道半径越大B.核外电子的速率越大C .氢原子能级的能量越大D .核外电子的电势能越大 解析:选ACD.根据玻尔理论,氢原子中量子数n 越大,电子的轨道半径就越大,A 正确;核外电子绕核做匀速圆周运动,库仑力提供向心力k e 2r 2=m v 2r,则半径越大,速率越小,B 错误;量子数n 越大,氢原子所处的能级能量就越大,C 正确;电子远离原子核的过程中,电场力做负功,电势能增大,D 正确.8.关于经典电磁理论与氢原子光谱之间的关系,下列说法正确的是( )A .经典电磁理论很容易解释原子的稳定性B .根据经典电磁理论,电子绕原子核转动时,电子会不断释放能量,最后被吸附到原子核上C .根据经典电磁理论,原子光谱应该是连续的D .氢原子光谱彻底否定了经典电磁理论解析:选BC.根据经典电磁理论,电子绕原子核转动时,电子会不断释放能量,最后被吸附到原子核上,经典物理学无法解释原子的稳定性,并且原子光谱应该是连续的.氢原子光谱并没有完全否定经典电磁理论,而是要引入新的观念.故正确答案为B 、C.9.如图所示,氢原子可在下列各能级间发生跃迁,设从n =4到n =1能级辐射的电磁波的波长为λ1,从n =4到n =2能级辐射的电磁波的波长为λ2,从n =2到n =1能级辐射的电磁波的波长为λ3,则下列关系式中正确的是( )A .λ1<λ3B .λ3<λ2C .λ3>λ2D .1λ3=1λ1+1λ2 解析:选AB.已知从n =4到n =1能级辐射的电磁波的波长为λ1,从n =4到n =2能级辐射的电磁波的波长为λ2,从n =2到n =1能级辐射的电磁波的波长为λ3,则λ1、λ2、λ3的关系为h c λ1>h c λ3>h c λ2,即1λ1>1λ3,λ1<λ3,1λ3>1λ2,λ3<λ2,又h c λ1=h c λ3+h c λ2,即1λ1=1λ3+1λ2,则1λ3=1λ1-1λ2,即正确选项为A 、B. 10.氢原子能级如图,当氢原子从n =3跃迁到n =2的能级时,辐射光的波长为656 nm.以下判断正确的是( )。
原子物理学第二章氢原子光谱

激发态(excited state) 电子轨道
巴耳末系 帕邢系
n 3
பைடு நூலகம்
赖曼系
2
能级(energy level)
1
n
1
2
3
4
En R Tn 2 n hc
hcR En 2 n
根据波尔理论,氢原子的光谱可以作如下的解释: 氢原子在正常状态时,它的能级最小,电子 位于最小的轨道,当原子吸收或放出一定的 能量时,电子就会在不同的能级间跃迁,多 余的能量便以光子的形式向外辐射,从而形 成氢原子光谱。
e Ze
Ze2 F 4π 0 r 2
e2 Ze2
2
n2 Z c rn a1 vn n 1, 2, 3, Z n Z 2 hcR 1 Z 2e2 En 2 2n 4π 0 a1 n2
En2 En1 hc
1 1 1 1 Z R 2 2 R 2 2 n1 Z n2 Z n1 n2
2 2 e 4 RA 2 3 (4 0 ) h c
2 2 me 4 M M R 2 3 (4 0 ) h c M m M m
(3)
我们看到,当原子核质量M→∞时, RA=R∞=109737.31cm-1。在一般情况下,可以 通过(3)式来计算里德伯常数。
里德伯常数随原子核质量变化的情况曾被 用来证实氢的同位素—氘的存在。还可以测 定原子量、电子的核质比、质子的质量和电 子的质量之比等。 起初有人从原子质量的测定问题估计有质量 是2个单位的中氢。 1932年,尤雷在实验中发现,所摄液氢赖 曼系的头四条谱线都是双线,双线之间波长 差的测量值与通过里德伯常数 R 计算出的双 线波长差非常相近,从而确定了氘的存在。
高三物理氢原子的光谱与能级结构

还 有 三
布喇开系
1
R
1 42
1 n2
个 线 系
普丰特线系
1
R
1
52
1 n2
n 4,5,6,
n 5,6,7,
n 6,7,8,
二、玻尔理论对氢原光光谱的解释
En
13.6 n2
eV
1
E1 hc
(
1 n2
1 22
)
n=6
n=5 n=4
486.1nm
1.几种特定频率的光
2.光谱是分立的亮线
Hα (红色)
652.2nm
λ/nm
原子光谱
每一种光谱-------印记
每一种原子都有自己特定的原子光谱,不同原子,其原子 光谱均不同
巴尔末的研究氢原子光谱
(可见光区)
(里德伯常数:R=1.09677581×107m-1)
R E1 hc
巴尔末公式
第4节 氢原子的光谱与能级结构
一、光谱
复色光经过色散系统(如棱镜、光栅)分光后,被色散 开的单色光按波长( 验
玻璃管充进氢气
连续光谱经过氢气的光谱
2. 氢原子的光谱图
(紫绿色) Hδ
410.1nm
特点
Hγ (青色)
434.0nm
Hβ (蓝绿色)
N > 6 的符合巴耳末公式的光谱线(大部分在紫外区) 巴尔末系
人们把一系列符合巴耳末公式的光谱线统称为巴耳末系 适用区域: 可见光区、紫外线区
氢原子光谱的其他线系
紫 外 线 区
赖曼线系
原子的能级结构

C.从n=4能级跃迁到n=1能级放出的光子频率 最大
D.从n=4能级跃迁到n=3能级放出的光子波长 等于从n=2能级跃迁到n=1能级放出的光子波长
7.如图所示为氢原子的能级图,现让一束单色 光照射到大量处于基态(量子数n=1)的氢原 子上,受激的氢原子能自发地发出3种不同频 率的光,则照射氢原子的单色光的光子能量
C.氢原子光谱说明氢原子能级是分立的
D.氢原子光谱的频率与氢原子能级的能量 差无关
4.用光子能量为E的单色光照射容器中处于
基态的氢原子。停止照射后,发现该容器内
的氢能够释放出三种不同频率的光子,它们
的频率由低到高依次为ν1、ν2、ν3,由此 可知,开始用来照射容器的单色光的光子能
量可以表示为
A. hν1;
在解决核外电子的运动时 成功引入了量子化的观念
同时又应用了“粒子、 轨道”等经典概念和 有关牛顿力学规律
除了氢原子光谱外,在解决其他 问题上遇到了很大的困难.
氦原子光谱
牛顿力学只适用于低速运动(相对于光速) 的宏观物体,对于微观粒子的运动,牛顿
力学不适用了。
二.氢原子的能级:
1.氢原子可能的轨道:
B. hν3;
C. h(ν1+ν2); D. h(ν1+ν2+ν3)
答案:BC
5.在氢原子光谱中,电子从较高能级跃迁到n =2能级发出的谱线属于巴耳末线系.若一群 氢原子自发跃过时发出的谱线中只有2条属于 巴耳末线系,则这群氢原子自发跃迁时最多 可发生 6 条不同频率的谱线.
6.大量氢原子处于n=4的激发态,当它们向各较 低能级跃迁时,对于多种可能的跃迁,下面说法 中正确的是 ( C) A.最多只能放出4种不同频率的光子
高中物理课件第2章 第4节 氢原子光谱与能级结构

[后思考]
被测电阻值越大,流过电流表表头的电流越小,电流的大小与被测电阻的阻
值成反比,这种说法对吗?为什么?
【提示】
电流I=
E Rx+R+Rg+r
,Rx越大,电流越小,但二者不是反比关
系.
[合作探讨]
甲
乙
丙
图2-8-2
如图2-8-2所示,甲、乙、丙分别为欧姆表红黑表笔短接、红黑表笔断开、被
测电阻为Rx所对应的电路图.
[再判断] 1.氢原子光谱是不连续的,是由若干频率的光组成的.( √ ) 2.由于原子都是由原子核和核外电子组成的,所以各种原子的原子光谱是相 同的.( × ) 3.由于不同元素的原子结构不同,所以不同元素的原子光谱也不相同.(√ )
[后思考] 氢原子光谱有什么特征,不同区域的特征光谱满足的规律是否相同? 【提示】 氢原子光谱是分立的线状谱.它在可见光区的谱线满足巴耳末公 式,在红外和紫外光区的其他谱线也都满足与巴耳末公式类似的关系式.
[后思考] 玻尔理论的成功和局限是什么?
【提示】 成功之处在于引入了量子化的观念,局限之处在于保留了经典粒 子的观念,把电子的运动看做是经典力作用下的轨道运动.
[核心点击] 1.成功方面 (1)运用经典理论和量子化观念确定了氢原子的各个定态的能量并由此画出能 级图. (2)处于激发态的氢原子向低能级跃迁辐射出光子,辐射光子的能量与实际符 合的很好,由于能级是分立的,辐射光子的波长也是不连续的. (3)不仅成功地解释了氢光谱的巴尔末系,计算出了里德伯常数,而且,玻尔 理论还预言了当时尚未发现的氢原子的其他光谱线系,这些线系后来相继被发 现,也都跟玻尔理论的预言相符.
[先填空]
1.理论推导
按照玻尔原子理论,氢原子的电子从能量较高的能级跃迁到n=2的能级上
第4章 4.氢原子光谱和玻尔的原子模型—新教材人教版(2019)高中物理选择性必修第三册讲义

4.氢原子光谱和玻尔的原子模型学习目标:1.[物理观念]知道光谱、连续谱、线状谱及玻尔原子理论基本假设的内容,了解能级、能级跃迁、能量量子化、基态、激发态等概念和相关的实验规律。
2.[科学思维]掌握氢原子光谱的实验规律和氢原子能级图,理解理论的局限性与不足,能用原子能级图分析、推理、计算,提高解决问题的能力。
3.[科学探究]通过对氢原子光谱实验规律的探究及玻尔理论的理解,揭示物理现象的科学本质,提高探究能力。
4.[科学态度与责任]学会用事实说话,坚持实事求是的科学态度,体验科学家的艰辛,激发探索科学规律的热情。
阅读本节教材,回答第84页“问题”并梳理必要的知识点。
教材P84“问题”提示:每种原子都有自己的特征谱线,食盐钠原子能发出黄色频率的光线。
一、光谱及氢原子光谱的实验规律1.光谱(1)定义:用棱镜或光栅可以把物质发出的光按波长(频率)展开,获得波长(频率)和强度分布的记录,即光谱。
(2)分类○1线状谱:有些光谱是一条条的亮线,叫作谱线,这样的光谱叫作线状谱。
○2连续谱:有的光谱看起来不是一条条分立的谱线,而是连在一起的光带,叫作连续谱。
○3特征谱线气体中中性原子的发射光谱都是线状谱,且不同原子的亮线位置不同,故这些亮线称为原子的特征谱线。
(4)光谱分析○1定义:利用原子的特征谱线来鉴别物质和确定物质的组成成分。
○2优点:灵敏度高。
说明:同一种原子可以发射和吸收同一种频率的谱线。
2.氢原子光谱的实验规律和经典理论的困难(1)氢原子光谱的实验规律○1巴耳末公式 1λ=R ∞⎝ ⎛⎭⎪⎫122-1n 2 n =3,4,5,… ○2意义:巴耳末公式以简洁的形式反映了氢原子的线状光谱的特征。
(2)经典理论的困难(1)用经典电磁理论在解释原子的稳定性时遇到了困难。
(2)用经典电磁理论在解释原子光谱是分立的线状谱时遇到了困难。
说明:氢原子光谱是线状谱,只有一系列特定波长的光。
二、玻尔原子理论的基本假设1.玻尔原子模型(1)原子中的电子在库仑力的作用下,绕原子核做圆周运动。
氢原子光谱与能级结构PPT教学课件

材料2:正当“嫦娥一号”奔月成功之际,刚刚启动建设的“文昌卫星发射中心” 也吸引着人们的目光。这将是我国继酒泉、太原、西昌卫星发射中心之后的第四个卫星发射 中心。
材料3:目前,国际上公认理想的发射场是设在北纬5°的库鲁发射场。
根据材料回答下列各题。
(1)对“嫦娥一号”发回的图片解译可知,月球高原暗色部分为玄武岩,而地球上
(2)特例分析 ①青藏高原成为太阳辐射的高值中心,主要是因为:a.海拔高,空气稀薄,空气中尘 埃含量较少,晴天较多,日照时间较长。b.大气对太阳辐射的削弱作用小,到达地面的太阳辐射 能量多。
②四川盆地为低值中心,其原因在于:盆地地形,水汽不易散发,空气中水汽含 量多,阴天、雾天较多,对太阳辐射削弱作用强,从而造成日照时间短,日照强度弱,太阳 能资源匮乏。
晴天多,到 达地面的太 阳辐射多
2.我国年太阳辐射总量的空间分布 (1)总体特征
我国太阳能资源的时空分布差异较明显,高值和低值的中心都处在北纬22°~ 35°之间,高值的中心在青藏高原,低值的中心在四川盆地。北纬30°~40°地区,随纬度 增高太阳辐射能增加。而北纬40°以北,由东向西太阳辐射能逐渐增加,呈东西向分布。
分析一个天体是否适合 生命存在和发展,应借助地球 上适宜生命存在和发展的温度、 大气、水三个方面的条件来考 虑,因为这些是生物生存的必 要条件,只有满足了这些条件, 才可能有生命的存在和发展。
例1 (2008年高考江苏卷)下图为“公转轨道相邻的三大行星相对位置示意图”。读图完成 (1)~(2)题。
【解析】 材料中提示“公转轨道相邻的 三大行星”,再结合图示可知,①是火星,②是 金星。还可以从图中看到此时地球的北极地区为 极昼。第(1)题,此时为北半球的夏季,北极极昼 时期,是北极科考的最佳时期;地球位于远日点 附近;越往北我国的昼越长;金星距太阳的距离 比水星远。第(2)题,地球具备生命的自身条件有 三:有适合生命呼吸的大气;有适宜的温度;有 原始大洋(水)的存在。结合题目中所提供的选项, A项是正确的。
原子的能级结构

Hδ Hγ
E2= -3.4ev410.1nm NhomakorabeaHβ
486.1nm
Hα
652.2nm
434.0nm
λ/nm n=1 E1= -13.6ev
其它线系
3、跃迁的规律。
⑷原子从激发态向基态跃迁时会随机发出的 不同波长的光
( E1 13.6eV )
氢原子基态能量 n=1 ,E1=-13.6ev;
En
E1 2 n
其他激发态的能 级为: n=2, E2=-3.4ev; n=3,E3=-1.51, n= 4,E4=-0.85ev …..
光谱线系的形成
• 能级间的跃迁产生不连续的谱线,从不同能级跃迁 到某一特定能级就形成一个线系,如巴耳末系是氢 原子从n=3,4,5,…能级跃迁到n=2的能级时辐 射出的光谱。
完
第四节 原子的能级结构
能级结构的猜想
猜想:在氢气放电过程中,辐射出来 光的同时氢原子的能量也在减少,而 能量的减少对应于原子从一个状态变 化到另外一个状态,如果能量是连续 减少的,那么形成的光谱必定是连续 光谱。但是氢原子的光谱是分立的, 因此我们猜想原子内部的能量也是不 连续的。
1.能级:原子内部不连续的能量称为原子能级 2.跃迁:原子从一个能级变化到另一个能级的 过程 3、跃迁的规律。 ⑴处于高能级的原子能自发向低能级跃迁, 并辐射光子; ⑵处于低能级的原子向高能级跃迁,则要吸 收光子或通过其他途径获得能量, ⑶光子的能量由两个能级的能量差决定 hν=Em-En 视频
氢原子的能级
1.玻尔的原子能级
推导:
2.氢原子的能级公式
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
光电效应、原子结构、原子构练习题
(适用于高中物理各种版本教材)
一、光电效应
1、概念:在光(电磁波)的照射下,从物体表面逸出的 的现象称为光电效应,这种电子被称之为 。
使电子脱离某种金属所做功的 ,叫做这种金属的逸出功,符号为W 0。
2、规律: 提出的“光子说”解释了光电效应的基本规律,光子的能量与频率的关系为 。
①截止频率:当入射光子的能量 逸出功时,才能发生光电效应,即:0____W hv ,也就是入射光子的频率必须满足v ≥ ,取等号时的______0=ν即为该金属的截止频率(极限频率);
②光电子的最大初动能:_________k m =E ,由此可知,对同一重金属,光电子的最大初动能随着入射光的频率增加而 ,随着入射光的强度的增加而 ,光电子从金属表面逸出时的动能应分布在 范围内。
3、实验:装置如右图,其中 为阴极,光照条件下发出光电子; 为
阳极,吸收光电子,进而在电路中形成 ,即电流表的示数。
①当A 、K 未加电压时,电流表 示数;
②当加上如图所示 向电压时,随着电压的增大,光电流趋于一个饱和值,
即 ;当电压进一步增大时,光电流 。
③当加上相反方向的电压( 向电压)时,光电流 ;当反向电压达
到某一个值时,光电流减小为0,这个反向电压U c 叫做 ,即使最有可能
到达阳极的光电子刚好不能到达阳极的反向电压,则关于U c 的动能定理方程
为 。
【练习1】某同学用同一装置在甲、乙、丙光三种光的照射
下得到了三条光电流与电压之间的关系曲线,如右图所示。
则可
判断出( )
A .甲光的频率大于乙光的频率
B .乙光的波长大于丙光的波长
C .乙光对应的截止频率大于丙光的截止频率
D .甲光对应的光电子最大初动能大于丙光的光电子最大初
动能
二、原子结构
1、物理学史: 通过对 的研究,发现了电子,从而认识到原子是
有内部结构的; 基于 实验中出现的少数α粒子发生 散射,提出了原子的核式结构模型; 在1913年把物理量取值分立(即量子化)的观念应用到原子系统,提出了自己的原子模型,很好的解释了氢原子的 。
2、波尔理论:
①原子的能量是量子化的,这些量子化的能量值叫做 ;原子能量最低的状态叫做 ,其他较高的能量状态叫做 ;
②原子在不同能量状态之间可以发生 ,当原子从高能级E m 向低能级E n 跃迁时 光子,原子从低能级E n 向高能级E m 跃迁时 光子,辐射或吸收的光子频率必须满足 。
③原子对电子能量的吸收:动能 两个能级之差的电子能量能被吸收,
吸收的数值是 ,剩余的能量电子带走。
④原子电离:电离态——电子脱离原子时速度也为零的状态,此时“原子—电子”系统能量值为E ∞= ;要使处于量子数为n 的原子电离,需要的能量至少是_____=-=∆∞n E E E 。
【练习2】如图所示为氢原子的能级示意图。
现用能量介于10eV —12.9eV 范围内的光子去照射一群处于基态的氢原子,则下列说法正确的是( )
A .照射光中只有一种频率的光子被吸收
B .照射光中有三种频率的光子被吸收
C .氢原子发射出三种不同频率的光
D .氢原子发射出六种不同频
率的光
【练习3】用大量具有一定能量的电子轰击大量处于基态的氢原子,观测到了一定数目的光谱线。
调高电子的能量再次进行观测,发现光谱线的数目比原来增加了5条。
用△n 表示两次观测中最高激发态的量子数n 之差,E 表示调高后电子的能量。
根据氢原子的能级图可以判断,△n 和E 的可能值为( )
A .△n =1,13.22 eV <E <13.32 eV
B .△n =2,13.22 eV <E <13.32 eV
C .△n =1,12.75 eV <E <13.06 eV
D .△n =2,12.75 eV <
E <13.06 ev
三、原子核
1、原子核的符号:X A Z 中Z 是原子核的 数,它等于原子核内的 数;A 是原子核的 数,它等于原子核内的 ;常见粒子的符号:质子 ,中子 ,电子(β粒子) ,α粒子 ,氘核 ,氚核 。
2、物理学史:最早发现天然发射现象的是法国物理学家 ,居里夫妇随后发现了放射性元素钋Po 、镭Ra ; 用α粒子轰击N 14
7原子核,发现了质子,
核反应方程为 ; 用α粒子轰击Be 94原子核,发现了中子,核反应方程为 ;小居里夫妇用α粒子轰击Al
27
13原子核,发现了人工放射性同位素P 30
15,核反应方程为 。
4、核反应:四大类型: 、 、重核裂变、 ;核反应遵循的基本规律是: 守恒, 守恒。
衰变规律:α衰变:He Y ____X 42A Z +→,β衰变:e Y ____X 0
1A Z -+→,两者均发生时,只有 衰变才引起质量数的变化,但两者均会引起电荷数的变化。
衰变的快慢用 来描述,它是一个微观概率概念、宏观统计概念;某种放射性元素的质量为m 0,经过时间t 后,该元素剩下的质量为m = ,已反应的质量
为 ;元素的半衰期只与 有关,而与核外甚至整个原子分子状态 关,,因此元素的化合状态、温度、压强的变化 引起半衰期变化。
5、核能:爱因斯坦质能方程 指出,物质具有的能量和质量具有简单的正比关系;核反应过程中辐射出(或吸收)能量时,就一定同时辐射出(或增加)了质量,即核反应中有 . △m ,辐射出(吸收)能量由公式 算出;
核能计算中的一些单位之间的关系:J __________eV 1=,
1MeV= eV ,1GeV= eV ,1u 对应 MeV 。
具体计算核能时,若△m 以kg 为单位,如△m = x kg ,则△E = △m · ,若△m 以u 为单位,如△m = x u ,则△E = 。
【练习4】天然放射性元素Th 23290(钍)经过一系列核衰变之后,变成Pb 20882(铅)。
下列论断中正确的是( )
A .铅核比钍核少23个中子
B .铅核比钍核少24个质子
C .衰变过程中共有4次α衰变和8次β衰变
D .衰变过程中共有6次α衰变和4次β衰变
【练习5】两个氘核聚变产生一个中子和氦核(氦的同位素).已知氘核的质量m D =2.013 60 u ,氦核的质量m He =3.015 0 u ,中子的质量m n =1.008 7 u. 该聚变方程为 ,该过程释放的核能为 MeV
= J 。
