化学:高三化学专题复习——元素周期律
2021高三化学物质结构 元素周期律核心考点总结

物质结构、元素周期律授课主题高一物质结构元素周期律教学目的1、掌握元素周期表的结构以及周期和族的概念2、掌握对原子结构和位置间的关系的推导3、认识元素周期表和元素周期律的关系教学重点1、同周期、同主族的性质变化规律2、元素原子结构、位置、性质之间的关系教学内容第一节元素周期表一、元素周期表(门捷列夫)1.编排原则:①按原子序数递增的顺序从左到右排列②将电子层数相同..。
称为周期(周期序数=原子的电子层数)......的各元素从左到右排成一横行③把最外层电子数相同..。
称为族........的元素按电子层数递增的顺序从上到下排成一纵行主族序数=原子最外层电子数=元素的最高正化合价2.结构特点:核外电子层数元素种类第一周期(2) 1 2种元素短周期第二周期(10) 2 8种元素周期第三周期(18) 3 8种元素元(7个横行)第四周期(36) 4 18种元素素(7个周期)第五周期(54) 5 18种元素周长周期第六周期(86) 6 32种元素(镧系元素)期第七周期(118)7 32种元素(锕系元素)表主族:ⅠA~ⅡA 、ⅢA~ⅦA共7个主族族副族:ⅢB~ⅦB、ⅠB~ⅡB,共7个副族(18个纵行)第Ⅷ族:三个纵行,位于ⅦB和ⅠB之间(16个族)零族:稀有气体第ⅠA族(氢除外):碱金属元素(锂Li钠Na钾K铷Rb铯Cs钫Fr)第ⅡA族:碱土金属元素(铍Be镁Mg钙Ca锶Sr钡Ba镭Ra)第ⅢA族:硼元素(硼B铝Al镓Ga铟In铊Tl)第ⅣA族:碳元素(碳C硅Si锗Ge锡Sn铅Pb)第ⅤA族:氮元素(氮N磷P砷As锑铋Bi)第ⅥA族:氧元素(氧O硫S硒Se碲Te钋Po)第ⅦA族:卤族元素(氟F氯Cl溴Br碘I砹At)0族:稀有气体元素(氦He氖Ne氩Ar氪Kr氙Xe氡Rn)二、元素的性质与原子结构1、碱金属元素(锂Li钠Na钾K铷Rb铯Cs)①原子半径逐渐增大,原子核对最外层电子的引力逐渐减弱②除铯Cs外,其余都是银白色,柔软,有延展性③密度都比较小,由上往下,密度逐渐增大(钾K除外ρ(K)=0.86g/cm3<ρ(Na)=0.97g/cm3)④熔点比较低,导热性导电性好,由上往下,熔沸点逐渐降低碱金属的化学性质:相似性和递变性相似性:①都能与氧气等非金属反应4Li+O22Li2O 2Na+S Na2S②都能与水反应,生成氢氧化物和氢气③均为强还原剂:M-e-== M+(M代表碱金属)从锂到铯递变规律:①与氧气反应越来越剧烈。
高三化学总复习之 元素周期律PPT课件
5
6
7
8
9
1 0
L K
8 2
3
11
1 2
III
B
IV B
VB
VI B
VII B
VIII
IB
II 1 B3
1 4
1 5
1 6
1 7
1 8
M L k
18 8 2
最4 外
1 9
2 0
2 1
2 2
2 3
24
25
26
2 7
2 8
2 9
3 0
3 1
3 2
3 3
3 4
3 5
3 6
层5 电
3
71
3
82
3 9
4 0
4 1
增 强
Rb Sr In Sn Sb Te I
酸 性 逐 渐 增 强
Cs Ba Tl Pb Bi Po At
碱性逐渐增强
第20页/共31页
3.气态氢化物的热稳定性
热稳定性增强
热 稳 定 性 减 弱
B CNO F
热
Si P S Cl
稳
定
As Se Br
性
Te I
增 强
At
热稳定性减弱
第21页/共31页
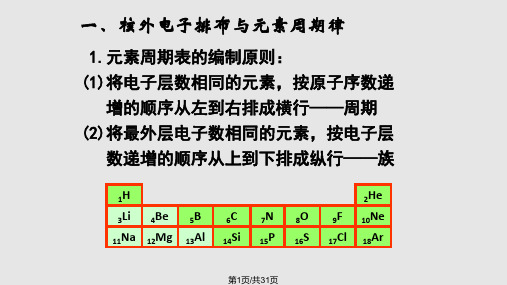
一、核外电子排布与元素周期律
1.元素周期表的编制原则: (1)将电子层数相同的元素,按原子序数递
增的顺序从左到右排成横行——周期 (2)将最外层电子数相同的元素,按电子层
数递增的顺序从上到下排成纵行——族
1H
2He
3Li 4Be 5B 6C 7N 8O 9F 10Ne
11Na 12Mg 13Al 14Si 15P 16S 17Cl 18Ar
高三 化学第一讲 原子结构、元素周期律

专题复习(一)原子结构班级姓名各位同学:这份学案是我们的二轮复习,请同学们认真学习。
认真填写学案然后核对答案(答案就在旁边),本讲的例题4、5、6、9在微视频中有详解,也请在全部做完再观看。
课后作业完成后请上传至智学网。
直击考点——知识梳理一、原子结构1、下列在探索原子结构的过程中形成的主要观点有道尔顿的原子论、汤姆逊提出的原子结构的模型;卢瑟福提出的原子结构的模型。
(答案:葡萄干面包、行星)2.原子是由原子核和核外电子构成的,其中原子核是由质子和中子构成的。
元素的种类由决定,原子的种类由决定,元素化学性质主要由决定。
答案及解析:元素的定义:具有相同核电荷数(即质子数)的一类原子。
因此元素的种类取决于质子数。
例如1H、2H、3H都是氢元素,但是不同的同位素原子,因此原子的种类取决于质子数和中子数。
元素的化学性质主要由原子的最外层电子数和电子层数决定。
3、微粒之间的关系:①质子数=核电荷数=原子序数=原子的核外电子数②质量数=质子数+中子数Ts)例题1:117号新元素Ts的中子数为176,则Ts的化学符号为(答案:293117二、同位素——概念辨析:同位素:质子数相同、中子数不同的不同原子互为同位素。
注意同位素一定是原子,不能是分子。
由于同位素的质子数相同使其核外电子排布相同,则同位素之间化学性质相同。
但同位素的中子数不同使其原子质量不同,因此同位素之间物理性质不同。
另外,同位素在自然界的丰度恒定不变同素异形体:同种元素构成的不同单质。
因此同素异形体一定是单质。
同分异构体:分子式相同,结构不同的化合物之间,例如正戊烷、异戊烷、新戊烷。
同系物:结构相似、分子组成上相差一个或若干个-CH2-的化合物,例如甲醇、乙醇。
同系物具有相同的通式,例如单炔烃的通式为C n H2n-2。
例题2、据报道,科学家已成功合成了少量N4,N4与N2互为,相同质量的N4和N2所含原子个数比为。
例题3、下列互为同位素的是()A.H2和D2B.H2O和D2OC.金刚石和石墨D.2He和3He例题4、H2O、D2O、T2O三者之间_(“是”或“不是”)同位素。
元素周期律及其应用2022年高考化学一轮复习过考点(解析版)

考点26 元素周期律及其应用一、1~18号元素性质的周期性变化规律 1.原子最外层电子排布变化规律周期序号 原子序数 电子层数最外层电子数结论第一周期 1→2 1 1→2 同周期由左向右元素的原子最外层电子数逐渐增加(1→8)第二周期 3→10 2 1→8 第三周期11→1831→8规律:随着原子序数的递增,元素原子的核外电子排布呈现周期性变化2.周期序号 原子序数 原子半径(nm)结论第一周期 1→2 ……同周期由左向右元素的原子半径逐渐减小(不包括稀有气体)第二周期 3→9 0.152→0.071大→小 第三周期11→170.186→0.099大→小规律:随着原子序数的递增,元素的原子半径呈现周期性变化3周期序号 原子序数 主要化合价 结论第一周期1→2+1→0 ①同周期由左向右元素的最高正价逐渐升高(+1→+7,O 和F 无最高正价); ②元素的最低负价由ⅣA 族的-4价逐渐升高至ⅦA 族的-1价; ③最高正价+|最低负价|=8第二周期3→9最高价+1→+5(不含O 、F) 最低价-4→-1规律:随着原子序数的递增,元素的主要化合价呈现周期性变化以第三周期元素为例探究元素性质的递变规律。
1.第三周期元素电子层数相同,由左向右元素的原子最外层电子数逐渐增加,原子半径依次减小,失电子的能力依次减弱,得电子的能力依次增强,预测它们的金属性依次减弱,非金属性依次增强。
2.钠、镁、铝元素金属性的递变规律 (1)钠、镁元素金属性强弱的实验探究 ①原理:金属与水反应置换出H 2的难易。
②实验操作:③现象:加热前,镁条表面附着了少量无色气泡,加热至沸腾后,有较多的无色气泡冒出,滴加酚酞溶液变为粉红色。
④结论:镁与冷水几乎不反应,能与热水反应,反应的化学方程式为Mg +2H 2O=====△Mg(OH)2+H 2↑。
结合前面所学钠与水的反应,可得出金属性:Na>Mg 。
(2)镁、铝元素金属性强弱的实验探究AlMg原理最高价氧化物对应水化物的碱性强弱实验操作沉淀溶解情况 沉淀逐渐溶解 沉淀逐渐溶解 沉淀溶解 沉淀不溶解相关反应的化学方程式 Al(OH)3+3HCl ===AlCl 3+3H 2OAl(OH)3+NaOH ===NaAlO 2+2H 2OMg(OH)2+2HCl ===MgCl 2+ 2H 2O实验结论金属性:Mg>Al(3)钠、镁、铝的最高价氧化物对应水化物的碱性NaOH Mg(OH)2 Al(OH)3 分类 强碱中强碱(属于弱碱)两性氢氧化物碱性强弱 NaOH>Mg(OH)2>Al(OH)3 结论金属性:Na>Mg>Al3.Si PSCl最高价氧化物对应水化物的酸性H 2SiO 3:弱酸H 3PO 4:中强酸H 2SO 4:强酸 HClO 4:强酸酸性:HClO 4>H 2SO 4>H 3PO 4>H 2SiO 3 结论Si 、P 、S 、Cl 的非金属性逐渐增强4.同一周期从左到右,元素金属性逐渐减弱,非金属性逐渐增强。
高三复习物质结构元素周期律

例1.A元素原子的L层比B元素原
A
子的L层少3个电子,B元素原子
核外电子总数比A元素原子核外
电子总数多5个,则A、B两元素
形成的化合物可表示为( )
A. A3B2
B.A2B3
B
C.AB3
D. A B 2
B
C
例2.设X、Y、 Z代表三种元 素,已知:
① X+和Y-两种离子具有相同的电子层结构
c.许多元素,具有多种同位素,因此原子的种类大大超过元 素的种类。
d.天然存在的某种元素里,不论是游离态还是化合态,各种 同位素所占的原子个数百分比一般是不变的。
e.同位素的质量数不同,物理性质不同;核外电子数相同, 化学性质相同。同位素的不同原子构成的单质是化学性质几乎 相同的不同单质。(如H2、D2、HD)
R2O ROH
RO
R2O3 RO2 R2O5 RO3
R2O7
R(OH)2 R(OH)3 H4RO4 H3RO4 H2RO4 HRO4
碱性渐弱,
酸性渐强
最低负价
-4
-3
-2
-1
对应氢化物 稳定性
RH4 RH3 H2R HR 逐渐增强
溶于水酸碱性
碱性渐弱,酸性渐强
假定元素的种类是有限的,那么周期表也是有限的。 根据元素周期律作出一些假说和预测:
202X
高三化学总复 习
物质结构 基本理论 元素周期律
一、原子结构
原子组成
0
两个关系式
1
原子序数=核电荷数=质子数=原子核外电子数 (阴、阳离子=?)
质量数(A)=质子数(Z)+中子数(N)
核组成符号 AZX
高三化学高考备考专题物质结构元素周期律课件

Cl2得到电子的能力比Br2的弱
如N2的电子式错写为N⋮⋮N。
CO2的结构式:O==C==O
正误判断,正确的打“√”,错误的打“×”
氯和溴属于同一主族,最外层电子数相等,D项错误。
备考要点
1.掌握微粒结构与相互作用力间的关系,能熟练书写微粒的电子式。 2.掌握表示微粒结构及组成的化学用语。 3.掌握元素周期表和元素周期律,会利用其推断“位—构—性”
4.理清化学键类型与物质类型的对应关系
5.表示物质组成和结构的化学用语 结构示意图
球棍模型 比例模型
电子式
CO2:
结构式
结构简式 分子式或化
学式
乙醇: 对二甲苯:
明矾:KAl(SO4)2·12H2O
6.常考微粒电子式类型 (1)阳离子,如:Na+、Ca2+、
(2)阴离子,如:
、
、
(3)官能团,如:羟基
对点训练
1.氮、磷、砷(As)、锑(Sb)、铋(Bi)、镆(Mc)为元素周期表中原子序数依 次增大的同族元素,则镆(Mc)在元素周期表中的位置为_第__七__周__期__Ⅴ__A_族__, 已知某种Mc同位素的质量数为288,则其中子数为__1_7_3_。 2.短周期元素aA+、bB2+、cC2-、dD-具有相同的电子层结构,则 (1)原子序数大小关系: b>a>d>c 。 (2)原子半径大小关系: A>B>C>D 。 (3)离子半径大小关系: C2->D->A+>B2+ 。
解析 等质量的氧气和臭氧,所含氧原子数相等,故电子数相同,B项 正确; 24 g镁、27 g铝的物质的量均为1 mol,1个镁原子和1个铝原子所含的质 子数分别为12、13,故24 g镁与27 g铝中含有的质子数分别为12 mol和13 mol, A项错误; 1个重水分子含有10个中子,1个水分子含有8个中子,1 mol重水与1 mol 水中含有的中子数之比为10∶8(5∶4),C项错误; 1个乙烷分子中含有7对共用电子,而1个乙烯分子中含有6对共用电子, 故1 mol乙烷与1 mol乙烯中,含有的化学键数之比为7∶6,D项错误。
高三化学总复习实用课件:必考5-2 元素周期律(人教版)

④所带电荷、电子层数均不同的离子可选一种离子参 照比较。例如:比较r(K+)与r(Mg2+)可选r(Na+)为参 照,可知:r(K+)>r(Na+)>r(Mg2+)
“三看”法快速判断简单粒子半径大小:
一看电子层数:最外层电子数相同时,电子层数越多,
半径越大。 二看核电荷数:当电子层结构相同时,核电荷数越大,
在同一周期,且B位于C右面,同周期元素自左向右,元素 的非金属性增强,则元素的非金属性B>C。 [答案]C
1.比较元素金属性强弱的方法
(1)根据原子结构
原子半径(电子层数)越大,最外层电子数越少,金属 性越强,反之越弱。
(2)根据在元素周期表中的位置
①同周期元素,从左到右随着原子序数的增加,金属 性逐渐减弱。
粒子的半径大小比较 例如:①电子层数相同(即同周期)时,随原子序数递增, 原子半径逐渐减小。 r(Na)>r(Mg)>r(Al)>r(Si)>r(P)>r(S)>r(Cl) ②最外层电子数相同(即同主族)时,随电子层数递增, 原子半径逐渐增大。例如: r(Li)<r(Na)<r(K)<r(Rb)<r(Cs)
原子相同的电子层结构可知:阴离子与其原子具有相同的
电子层,而阳离子比其原子少一个电子层,则X、Y、Ar三 原子在元素周期表中的大致位臵为:
从上图知:X、Y在相邻的周期,Y在X元素的上一周
期,是非金属,X的原子序数比Y的大,X是金属元素,其
原子的最外层电子数比Y的少。X原子比Y原子的电子层结 构多一层,且在元素周期表的左侧,故原子半径X>Y。X
1.下列叙述中能确定A金属性一定比B金属性强的是 ( B.A原子的电子层数比B原子的电子层数多 ) A.A原子的最外层电子数比B原子的最外层电子数少
元素周期律与元素周期表(高三化学二轮专题复习)
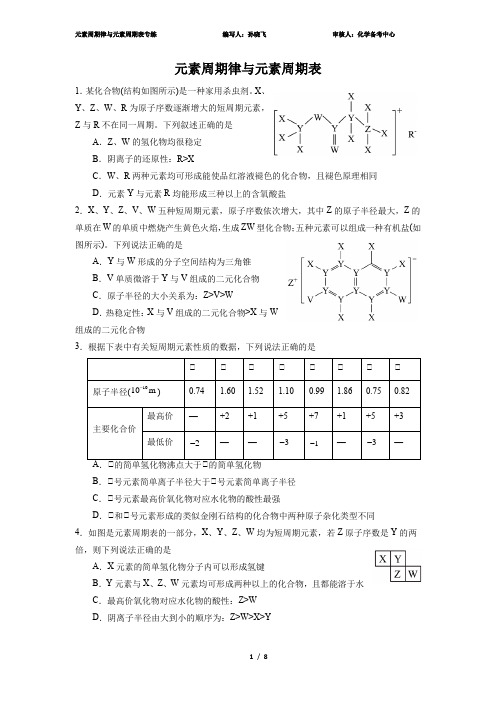
元素周期律与元素周期表1.某化合物(结构如图所示)是一种家用杀虫剂。
X 、Y 、Z 、W 、R 为原子序数逐渐增大的短周期元素,Z 与R 不在同一周期。
下列叙述正确的是A .Z 、W 的氢化物均很稳定B .阴离子的还原性:R>XC .W 、R 两种元素均可形成能使品红溶液褪色的化合物,且褪色原理相同D .元素Y 与元素R 均能形成三种以上的含氧酸盐2.X 、Y 、Z 、V 、W 五种短周期元素,原子序数依次增大,其中Z 的原子半径最大,Z 的单质在W 的单质中燃烧产生黄色火焰,生成ZW 型化合物;五种元素可以组成一种有机盐(如图所示)。
下列说法正确的是A .Y 与W 形成的分子空间结构为三角锥B .V 单质微溶于Y 与V 组成的二元化合物C .原子半径的大小关系为:Z>V>WD .热稳定性:X 与V 组成的二元化合物>X 与W 组成的二元化合物3.根据下表中有关短周期元素性质的数据,下列说法正确的是 ① ① ① ① ① ① ① ① 原子半径(1010m -) 0.74 1.601.52 1.10 0.99 1.86 0.75 0.82 主要化合价 最高价 — +2+1 +5 +7 +1 +5 +3 最低价 2- — — 3- 1- — 3-— A .①的简单氢化物沸点大于①的简单氢化物B .①号元素简单离子半径大于①号元素简单离子半径C .①号元素最高价氧化物对应水化物的酸性最强D .①和①号元素形成的类似金刚石结构的化合物中两种原子杂化类型不同4.如图是元素周期表的一部分,X 、Y 、Z 、W 均为短周期元素,若Z 原子序数是Y 的两倍,则下列说法正确的是A .X 元素的简单氢化物分子内可以形成氢键B .Y 元素与X 、Z 、W 元素均可形成两种以上的化合物,且都能溶于水C .最高价氧化物对应水化物的酸性:Z>WD .阴离子半径由大到小的顺序为:Z>W>X>Y5.R、X、Y、Z为原子序数依次增大的前20号元素。
2021届高三化学三轮复习 全国II卷—元素周期律(一)

2021届高三化学三轮复习全国II 卷—元素周期律(一)1.W 、X 、Y 、Z 为原子序数依次增大的四种短周期元素,A 、B 、C 、D 为上述四种元素中的两种或三种所组成的化合物,E 为单质。
已知室温下,10.1mol L A -⋅的水溶液 pH 为 1,B 分子中含有 10 个电子,D 具有漂白性,五种化合物间的转化关系如图所示。
下列说法正确的是()A .X 、Y 形成的二元化合物只有两种B .Z 元素在同周期元素中半径最小C .W 、Y 组成化合物的沸点一定低于 W 、Z 组成化合物的沸点D .D 中各原子均满足最外层 8e -稳定结构2.X 、Y 、Z 和W 为原子序数依次增大的四种短周期主族元素。
X 的一种核素可用于测定文物的年代,基态Y 原子的电子总数是其最高能级电子数的2倍,Z 是短周期中金属性最强的元素,W 的单质为黄绿色气体。
下列说法正确的是( )A. 第一电离能:W X Y Z >>>B. 原子半径:()()()()Z W Y X r r r r >>>C. Z 可与Y 形成化合物22Z YD. X 的氢化物中不存在非极性共价键3.已知W 、X 、Y 、Z 为短周期元素,原子序数依次增大。
W 、Z 同主族,X 、Y 、Z 同周期,其中只有X 为金属元素。
下列说法一定正确的是( )A.原子半径:X>Y>Z>WB.W 的含氧酸的酸性比Z 的含氧酸的酸性强C.W 的气态氢化物的稳定性小于Y 的气态氢化物的稳定性D.若W 与X 原子序数差为5,则形成化合物的化学式为X 3W 24.成功合成纳米氮化镓是我国科学家取得的一项重大科技成果,已知镓是ⅢA 族元素,则氮化镓的化学式可能是()A.Ga 2N 3B.Ga 3NC.Ga 3N 2D.GaN5.关于元素周期表的说法正确的是()A.短周期是指第一二周期B.ⅠA族的元素都是金属元素C.元素周期表有7个周期D.元素周期表有8个主族6.某元素的原子结构示意图为:,则该元素在元素周期表中的位置是( )A. 第二周期,第ⅠA族B. 第二周期,第ⅤA族C. 第三周期,第ⅣA族D. 第三周期,第ⅤA族7.下列关于元素周期表应用的说法正确的是( )A.在过渡元素中,可以找到半导体材料B.在第ⅠA、ⅡA族元素中,寻找制造农药的主要元素C.在金属与非金属的交界处,寻找耐高温、耐腐蚀的合金材料D.元素周期表为元素性质的系统研究提供指导,为新元素的发现提供线索8.下列说法正确的是( )A.元素周期表中所有的非金属元素都分布在右上角B.同周期相邻主族的两种元素,原子序数差一定为1C.卤族元素原子的核外电子层数不相同,但最外层电子数均相同D.主、副族元素的族序数从左到右都是依次由小到大排列(如ⅠB→ⅦB)9.某小组在研究前18号元素时发现:依据不同的标准和规律,元素周期表有不同的排列形式。
高三化学元素周期律与元素周期表

1、元素周期表的结构
短周期:3个(第1、2、3周期)
周期
7个
长周期:4个(第4、5、6、周期,
周期表 (七个横行) 其中第7周期为不完全周期)
主族7个:ⅠA-ⅦA
族
16个 (共18个纵行)
副族7个:IB-ⅦB 第Ⅷ族1个(3个纵行) 零族(1个)稀有气体元素
A. 原子序数=核电核数=质子数=核外电子数 B. 周期序数=原子核外电子层数 C. 主族序数=原子的最外层电子数=元素最高价数
⑤ (d)
元素性质的递变规律
周期 ⅠA ⅡA ⅢA ⅣA ⅤA ⅥA ⅦA
族
半径由大变小
1半
2径
3
由 小
4
变 大
5
6
7
非金属性逐渐增强
非
金
B
金
属
属
性
Al Si
性
逐
渐
Ge As
逐 渐
增 强
Sb Te
增 强
金属性逐渐增强
Po At
再见
网上订花 买花 订花 网上订花 买花 订花
A、非金属性强弱为:X>Y>Z
B、气态氢化物的稳定性由强到弱为X、Y、Z
C、原子半径大小是:X<Y<Z
D、对应阴离子的还原性按X、Y、Z顺序减弱
3.指出原子序数为5、17、20、35的元素的 位置在哪里?(用周期和族表示)
4.下列各组原子序数表示的两种元素,能形 成AB2型离子化合物的是( A )
7、 X、Y、Z为短周期三种元素,已知
X和Y同周期,Y和Z同主族,又知三种元 素原子最外层电子数总和为14,而质子数 总和为28,则三种元素为(D) (A)N、P、O (B)N、C、Si (C)B、Mg、Al (D)C、N、P
高三化学一轮复习——元素周期表 元素周期律知识梳理及训练

2021届高三化学一轮复习——元素周期表元素周期律知识梳理及训练知识梳理一、元素周期表和周期律1.强化记忆元素周期表2.识记理解元素周期律项目同周期(左→右)同主族(上→下)原子结构核电荷数逐渐增大逐渐增大电子层数相同逐渐增多原子半径逐渐减小逐渐增大离子半径阳离子逐渐减小阴离子逐渐减小r(阴离子)>r(阳离子)逐渐增大元素性质化合价最高正化合价由+1→+7(O、F除外)负化合价=-(8-主族序数)相同最高正化合价=主族序数(O、F除外)元素的金属性和非金属性金属性逐渐减弱非金属性逐渐增强金属性逐渐增强非金属性逐渐减弱离子的氧化性、还原性阳离子氧化性逐渐增强阴离子还原性逐渐减弱阳离子氧化性逐渐减弱阴离子还原性逐渐增强气态氢化物稳定性逐渐增强逐渐减弱最高价氧化物对应的水化物的酸碱性碱性逐渐减弱酸性逐渐增强碱性逐渐增强酸性逐渐减弱元素的第一电离能逐渐增大趋势逐渐减小趋势元素的电负性逐渐增大呈现减小趋势二、元素的电离能和电负性1.元素的电离能第一电离能:气态电中性基态原子失去一个电子转化为气态基态正离子所需要的最低能量叫做第一电离能。
常用符号I1表示,单位为kJ·mol-1。
(1)原子核外电子排布的周期性随着原子序数的增加,主族元素原子的外围电子排布呈现周期性的变化:每隔一定数目的元素,主族元素原子的外围电子排布重复出现从n s1到n s2n p6的周期性变化(第一周期除外)。
(2)元素第一电离能的周期性变化随着原子序数的递增,元素的第一电离能呈周期性变化:同周期从左到右,第一电离能有逐渐增大的趋势,稀有气体的第一电离能最大,碱金属和氢的第一电离能最小;同主族从上到下,第一电离能有逐渐减小的趋势。
说明同周期元素,从左到右第一电离能呈增大趋势。
同能级的轨道为全满、半满时第一电离能较相邻元素要大,即第ⅡA族、第ⅤA族元素的第一电离能分别大于同周期相邻元素。
如Be、N、Mg、P。
(3)元素电离能的应用①判断元素金属性的强弱电离能越小,金属越容易失去电子,金属性越强;反之,则越弱。
2021届高三化学大一轮复习课件———专题5 第16讲 元素周期律和元素周期表习题课(共40张PPT)

2.1869年俄国化学家门捷列夫制作出了第一张元素周期表,揭示了化学元素 间的内在联系,成为化学发展史上重要里程碑之一。下列有关元素周期表 的说法正确的是 A.元素周期表有7个横行、18个纵列,即有7个周期、18个族 B.在过渡元素中寻找半导体材料
1 2 3 4 5 6 7 8 9 10 11 12 13 14
3.部分元素在周期表中的分布如图所示(虚线为金属元素与非金属元素的分界 线),下列说法不正确的是
√A.B只能得电子,不能失电子
B.原子半径:Ge>Si C.As可作半导体材料 D.Po处于第6周期ⅥA族
1 2 3 4 5 6 7 8 9 10 11 12 13 14
解析 根据以上分析,B元素位于金属元素与非金属元素的分界线附近, 既能得电子,又能失电子,故A错误; 同一主族元素从上到下原子半径逐渐增大, 所以原子半径:Ge>Si,故B正确; As元素位于金属元素与非金属元素的分界 线附近,可作半导体材料,故C正确; Po为主族元素,原子有6个电子层,最外 层电子数为6,处于第6周期ⅥA族,故D正确。
1 2 3 4 5 6 7 8 9 10 11 12 13 14
7.下列各图中横坐标表示元素的电负性数值,纵坐标表示同一主族五种元素 的原子序数的是
√
1 2 3 4 5 6 7 8 9 10 11 12 13 14
8.如图是第3周期11~17号元素某些性质变化趋势的柱形图,下列有关说法 中正确的是 A.y轴表示的可能是第一电离能
元素在周期表中的位置为
A.ⅤB族
√C.Ⅷ族
B.ⅢB族 D.ⅤA族
解析 由该元素离子的电子排布式可推出其原子的电子排布式为 1s22s22p63s23p63d64s2,外围电子排布式为3d64s2,所以在Ⅷ族。
高三化学知识元素周期律

高三化学知识元素周期律高三化学知识:元素周期律元素周期律是化学中的一个基本原理,它揭示了元素的周期性变化规律。
对于高中生来说,理解和掌握元素周期律对于深入学习化学知识和解决化学题目具有重要意义。
本文将从元素周期律的发现、基本原理、周期表的结构、元素周期律的应用等方面进行详细讲解。
元素周期律的发现元素周期律的发现要归功于俄国化学家门捷列夫。
在1869年,门捷列夫发现了元素周期律,并首次编制了元素周期表。
他发现,当元素按照原子序数递增排列时,元素的性质会出现周期性的变化。
这一发现极大地简化了化学学习和元素的研究。
基本原理元素周期律的基本原理是基于元素的电子排布。
元素的性质主要由其最外层电子的数目和排布决定。
根据元素周期律,元素的性质会随着原子序数的增加而周期性地变化。
这种变化主要体现在以下几个方面:1.原子半径:原子半径随着原子序数的增加而周期性地变化。
在同一周期内,从左到右原子半径逐渐减小;在同一族内,从上到下原子半径逐渐增大。
2.电负性:电负性是指元素吸引电子的能力。
电负性随着原子序数的增加而周期性地变化。
在同一周期内,从左到右电负性逐渐增大;在同一族内,从上到下电负性逐渐减小。
3.价态:元素的价态也呈现出周期性的变化。
在同一周期内,元素的价态从左到右逐渐增加;在同一族内,元素的价态相同。
4.化合物的性质:元素形成的化合物性质也会出现周期性的变化。
在同一周期内,元素的化合物性质从左到右逐渐变化;在同一族内,元素的化合物性质相同。
周期表的结构元素周期表是元素周期律的具体表现形式。
它将元素按照原子序数递增的顺序排列,并将其分为若干个周期和族。
周期表中的水平行称为周期。
每个周期代表了元素原子的一个电子层的填充。
周期表共有7个周期,从第1周期到第7周期。
在同一周期内,元素的原子半径、电负性等性质会随着原子序数的增加而周期性地变化。
族也称为族系,是周期表中的垂直列。
族代表了具有相同外层电子数的元素。
周期表共有18个族,分为7个主族、7个副族、1个0族和1个第Ⅷ族。
高考化学元素周期律和元素周期表(精练)一轮复习(解析版)

元素周期律和元素周期表(精练)完卷时间:50分钟一、选择题(每小题只有一个正确选项,共12*5分)1.(2020年全国统一考试化学试题(新课标Ⅲ))W、X、Y、Z为原子序数依次增大的短周期元素,四种元素的核外电子总数满足X+Y=W+Z;化合物XW3与WZ相遇会产生白烟。
下列叙述正确的是A.非金属性:W> X>Y> Z B.原子半径:Z>Y>X>WC.元素X的含氧酸均为强酸D.Y的氧化物水化物为强碱【答案】D【解析】根据题干信息可知,W、X、Y、Z为原子序数依次增大的短周期元素,化合物XW3与WZ相遇会产生白烟,则WX3为NH3,WZ为HCl,所以W为H元素,X为N元素,Z为Cl元素,又四种元素的核外电子总数满足X+Y=W+Z,则Y的核外电子总数为11,Y为Na元素。
根据上述分析可知,W为H元素,X为N元素,Y 为Na元素,Z为Cl元素,则A.Na为金属元素,非金属性最弱,非金属性Y<Z,A选项错误;B.同周期元素从左至右原子半径依次减小,同主族元素至上而下原子半径依次增大,则原子半径:Na>Cl>N>H,B 选项错误;C.N元素的含氧酸不一定全是强酸,如HNO2为弱酸,C选项错误;D.Y的氧化物水化物为NaOH,属于强碱,D选项正确;答案选D。
2.(北京市2020年普通高中学业水平等级性考试)已知:33As(砷)与P为同族元素。
下列说法不正确的是A.As原子核外最外层有5个电子B.AsH3的电子式是C.热稳定性:AsH3<PH3D.非金属性:As<Cl【答案】B【解析】A.As与P为同族元素,为VA族元素,则其原子核外最外层有5个电子,A说法正确;B.AsH3属于共价化合物,电子式与氨气相似,为,B说法不正确;C.非金属的非金属性越强,其气体氢化物越稳定,非金属性As<P,热稳定性:AsH3<PH3,C说法正确;D.同周期元素,原子序数越小,非金属性越强,非金属性:As<Cl,D说法正确;答案为B。
邳州市第二中学高三化学专题复习专题五第二单元元素周期律与元素周期表课件

内容 主要化合价
同周期(从左到 同主族(从上 右) 到下) 最高正价:+ 最高正价数 1→+7最低负 =主族序数 价:-4→-1 (O、F除外) 酸性减弱碱 性增强
最高价氧化物, 酸性增强碱性 对应水化物的酸 减弱 碱性
气态氢化物 气态氢化物的 非金属元素气 的形成越来 形成越来越易, 态氢化物的形成 越难,其稳 其稳定性逐渐 及稳定性 定性逐渐减 增强 弱
A.比较两种单质的颜色 B.比较氢化物的稳定性
C.依据两元素在周期表中的位置
D.比较原子半径大小
E.比较最高价氧化物对应水化物的酸
性
(4)写出元素①、⑧形成的化合物与KOH 溶液反应的化学方程式:
_______________________________
_。 解析:(1)④、⑦元素由化合价知它们在 第ⅤA族,由于⑦的原子半径小于④,⑦ 为N,④为P。由①的原子半径小于⑦, ①为O。③、⑥位于第ⅠA族,且因③的 原子半径小于⑥,故③为Li,
低价阴离子半径随核电荷数增大而逐渐
减小(稀有气体元素除外),如
Na>Mg>Al>Si,Na+>Mg2+>Al3+,S2
->Cl-。
2.同主族元素的微粒
同主族元素的原子或离子半径随核电荷数增大
而逐渐增大,如Li<Na<K,Li+<Na+<K+.
3.电子层结构相同的微粒
电子层结构相同(核外电子排布相同)的离子半
⑥为Na,由于②、⑧是第ⅡA、第ⅢA族元 素且②的半径大于③,小于⑥,故②为Mg,
⑧为Al。则处于第2周期的有Li、O、N元素.
(2)Mg、Al、Na、Li中金属钠的金属性最强.
(3)N、P位于同一主族,可依元素周期律比
鸡驱学校高三化学总复习第四讲元素周期律

妨努州忍劲市鸡驱学校高三化学总复习第四讲元素周期律【同步信息】一. 本周教学内容:高三总复习第四讲元素周期律二. 、难点:1. 理解元素周期律的意义和实质,并能用元素周期律解释一些元素性质变化规律与组成元素的粒子结构的关系。
2. 对元素周期律的理解去表达元素周期表的意义、组成结构、元素递变规律与组成元素的粒子结构的联系。
3. 能初步具有总结元素递变规律的能力;能把元素的性质、元素周期位置与组成元素的粒子结构初步联系起来,并能较熟练地运用。
三. 具体内容:物质结构和元素周期律是化学教材中重要的根底理论。
本章学习借助于以前学过的知识,是对以前学过的知识进行概括、综合、实现由感性认识上升到理性认识,同时也能使同学们以原子结构、元素周期律的理论指导,来探索研究以后要学习的化学知识。
因此复习好本章知识为今后其他根本理论的学习及元素化合物知识的学习奠了根底。
〔一〕元素周期表的结构〔二〕元素周期表结构与元素性质的关系1.〔稀有气体除外〕同周期元素性质递变由最外层电子数和原子半径两方面决;同主族元素性质递变由原子半径变化决。
因此,前者变化幅度大,后者变化幅度小,即同周期相邻元素的性质主要表现为相异性,而同主族相邻元素的性质主要表现为相似性。
2. 元素金属性强弱判断的依据〔1〕根据周期表判断,在同一周期中,从左向右金属性逐渐减弱,非金属性逐渐增强;在同一主族中,从上向下,金属性逐渐增强,非金属性逐渐减弱。
〔2〕它的单质跟水〔或酸〕反置换氢的难易程度。
反越容易,那么元素的金属性越强;反之那么越弱。
〔3〕它的最高价氧化物的水化物——氢氧化物碱性强弱。
氢氧化物碱性越强,那么元素的金属性越强;反之,那么越弱。
如碱性:NaOH >2)(OH Mg >3)(OH Al 。
那么金属性:Na>Mg>Al 3. 元素非金属性强弱判断的依据〔1〕同2.〔1〕〔2〕它的最高价氧化物的水化物的酸性强弱。
假设该水化物的酸性越强,那么元素的非金属性越强;反之,那么越弱。
高三化学元素周期表复习
答案
D
且 Z 元素的原子半径小于 Y 元素的原子半径,则 Z 元素的原
子序数大于 Y 元素的原子序数。由此得出三种元素原子序数
的关系为 Z>Y>X。
规律方法 以上规律对于原子、离子之间的半径比较 均适用。稀有气体元素的原子半径与同周期中相邻非金属 原子半径不具有可比性,因测定依据不同。
即时巩固 2 下列粒子半径大小的比较正确的是( ) A.Na+<Mg2+<Al3+<O2- B.S2->Cl->Na+>Al3+ C.Na<Mg<Al<S D.Cs<Rb<K<Na
考点二 微粒半径大小比较的思维模型
例 2 X 和 Y 两元素的阳离子具有相同的电子层结
构,X 元素的阳离子半径大于 Y 元素的阳离子半径;Z
和 Y 两元素的原子核外电子层数相同,Z 元素的原子半
径小于 Y 元素的原子半径。X、Y、Z 三种元素的原子
序数的关系是( )
A.X>Y>Z
B.Y>X>Z
C.Z>X>Y
原子,可用符号 表示。
。 。
。
和一定数目
的一种
质子数
(2)同位素:
相同而
不同的同一种元素的不同核素互称为同位素。
(3)同位素的特征
①同位素化学性质几乎完全
。
②在自然界中同种元素的各种核素所占的原子百分
数
。
中子数 (或
相同
基本不 变
质量数)
考点一 关于元素周期表的结构 问题 1:如何根据原子序数确定元素在周期表中的 位置?
答案 D
解析 解决这类问题的关键是知道质量 数等于质子数与中子数之和,质子数决定元素 种类,质子数与中子数决定核素种类。
规律方法 元素、核素、同位素 这三个概念相近,容易混淆,可采用 右图区分。但应注意:
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
元素周期律1.复习重点1.同周期元素及其化合物性质的递变规律;2.同主族元素及其化合物性质的递变规律,理解元素周期律的实质3..理解元素周期律与原子结构的关系。
4..能根据元素周期律预测元素的性质。
2.难点聚焦元素周期律:(1)元素原子核外电子排布的周期性变化:随着原子充数的增加,元素排列呈周期性变化结论:随着原子序数的递增,元素原子的最外层电子排布呈现周期性变化。
注:①元素重要化合价的变化中O一般无正价,F无正价,最高正价与最低负价的关系;②最高正化合价+|最低负化合价|=8(仅适用于非金属元素)③金属无正价④有些非金属有多种化合价,如:C元素有+2,+4,-4价(在有机物中也可以有-3,-2,-1价);S元素有+4,+6,-2价;Cl元素有-1,+1,+3,+5,+7价;N元素有-3,+1,+2,+3,+4,+5价。
(4)元素的金属性和非金属性的周期性变化:电子层数相同,随着原子序数的递增,原子半径递减,核对核外电子的引力逐渐增强,失电子能力逐渐减弱,得电子能力逐渐增强,即元素的金属性逐渐减弱,非金属性逐渐增强。
①.元素的金属性:指元素气态原子失去电子的能力。
元素金属性强弱判断的实验依据:a.金属单质跟水或酸反应置换出氢气的难易程度:越容易则金属性越强,反之,金属性越弱;b.最高价氧化物对应水化物的碱性强弱:最高价氢氧化物的碱性越强,这种金属元素金属性越强,反之,金属性越弱;c.金属单质间的置换反应 例:比较1:①镁与2mL1mol/L 盐酸反应 ②铝与2mL1mol/L 盐酸反应32222l 6l 2l l 3g 2HCl MgCl H A HC A C H ↑↑+=+反应比较容易M +=+反应更加容易所以金属性:l Mg A >比较2:⑴钠与水反应(回忆) ⑵镁与水反应【实验5-1】2222222()22()Na H O NaOH H Mg H O Mg OH H ++↑++↑@冷=碱性:2aOH Mg(OH)N > 金属性:Na Mg Al >>②元素的非金属性:指元素气态原子得到电子的能力。
元素非金属性强弱判断的实验依据:a.非金属元素单质与氢气化合的难易程度及生成氢化物的稳定性强弱:如果元素的单质跟氢气化合生成气态氢化物容易且稳定,则证明这种元素的非金属性较强,反之,则非金属性较弱;b.最高价氧化物对应水化物的酸性强弱:酸性越强则对应的元素的非金属性越强;c.非金属单质间的置换反应例:222222()l 2HCl l r 2HBr r 2()H F HF H C HI HI +=+@垐垎?噲垐?2加热22阴暗处混合爆炸,HF 最稳定=(混合气体光照爆炸,HC 稳定)H +B (混合加热反应,HB 较稳定)H +I 缓慢反应,很不稳定非金属性:l r F C >>B >I对于同一周期非金属元素:如2i l S P S C 、、、等非金属单质与2H 反应渐趋容易,其气态氢化物的稳定性为:432i l S H PH H S HC <<<上述非金属元素最高价氧化物对应水化物的酸性强弱顺序为:2334244i l H S O H PO H SO HC O <<<非金属性:i l S P S C <<< 结论: a g l i l N M A S P S C金属性逐渐减弱,非金属性逐渐增强 (5)元素周期律的实质:元素性质的周期性变化是元素原子的核外电子排布的周期性变化的必然结果。
换言之,元素性质的周期性变化是由元素原子核外电子排布的周期性变化所决定的。
元素周期律的实质:元素原子核外电子排布的周期性变化规律 3.例题精讲【 例1】(2003年全国高考题)根据中学化学教材所附元素周期表判断,下列叙述不正确的是( )A .K 层电子为奇数的所有元素所在族的序数与该元素 原子的K 层电子数相等B .L 层电子为奇数的所有元素所在族的序数与该元素原子的L 层电子数相等C .L 层电子为偶数的所有主族元素所在族的序数与该元素原子的L 层电子数相等D .M 层电子为奇数的所有主族元素所在族的序数与该元素原子的M 层电子数相等【解析】 A 项为H 元素,根据最外层电子数=主族序数,B 和D 项最外层电子数为1、3、5、7,也为主族序数。
对于C 项如最外层电子数为8,则与说法不符。
【答案】C【命题意图】本题考查原子结构与周期表结构的关系。
周期数=电子层数, 主族数=最外层电子数2.元素周期律的迁移应用该类题目的主要特点是,给出一种不常见的主族元素,分析推测该元素及化合物可能或不可能具有的性质。
解答该类题目的方法思路是:先确定该元素所在主族位置,然后根据该元素性质变化规律进行推断判断。
【例2】 (1997年全国高考题)已知Be 的原子序数为4。
下列对铍及其化合物的叙述中,正确的是 ( )A.铍的原子半径大于硼的原子半径B.氯化铍分子中铍原子的最外层电子数是8C.氢氧化铍的碱性比氢氧化钙的弱D.单质铍跟冷水反应产物为氢气【解析】由Be的原子序数为4,可推知它位于第二周期、第ⅡA族。
根据其位置及同周期、同主族元素原子结构和性质的递变规律,其原子半径大于B,A正确;碱性Be(OH)2比Ca(OH)2弱,C正确;Be的金属性小于Mg,已知Mg跟冷水不反应,Be就更不可能,故D 错误;Be原子的最外层电子数是2个,在BeCl2分子中Be最外层2个电子跟Cl共用两对电子,其最外层电子数为4个,B错误。
【答案】A、C【命题意图】本题考查同周期、同主族元素原子结构和性质的递变规律,根据元素周期律预测元素的性质。
3.确定“指定的几种元素形成的化合物”的形式该类题目的主要特点是,给出几种元素的原子结构或性质特征,判断它们形成化合物的形式。
解答该类题目的方法思路是:推价态、定元素、想可能、得形式。
该类题目也可由化合物形式判断元素的原子序数。
【例3】(1999年全国高考题)X、Y、Z为短周期元素,这些元素原子的最外层电子数分别为1、4、6,则由这3种元素组成的化合物的化学式不可能是( )A. XYZB. X2YZC. X2YZ2D. X2YZ3【解析】原子最外层电子数为1、4、6的短周期元素分别是:“1”——H、Li、Na,“4”——C、Si,“6”——O、S。
可将H、C、O三元素作为代表,它们可组成的物质有:H2CO3、HCHO、HCOOH等,将其与题中选项对照,即得答案。
【答案】A【命题意图】本题考查1—18元素的原子核外电子排布的特点及核外电子排布规律。
【例4】砹(At)是原子序数最大的卤族元素,推测砹或砹的化合物不可能具有的性质是A. HAt很稳定B. 易溶于某些有机溶剂C. AgAt不溶于水D. 是有色固体[解析]由题意,砹在周期表中与碘相邻,故它的性质与碘具有相似性,但它的非金属性应比碘弱。
HAt的稳定不如HI,故选项A错误;碘易溶于某些有机溶剂,则砹也应溶解;AgI不溶于水,则AgAt也不溶于水;碘是紫黑色固体,根据相似性砹也是有色固体。
本题正确选项为A。
【例5】铜有两种天然同位素6329Cu和6529Cu,参考铜的原子量(63.5)估算6529Cu的百分含量约是A. 20%B. 25%C. 50%D. 66.7%E. 75%[解析]用十字交叉法可求得两种同位素的原子个数比65 0.5 (65Cu)63.563 1.5 (63Cu)即65Cu与63Cu的原子个数比为1:3,所以6529Cu%=%25%100311=⨯+,故应选B。
【例6】若短周期中的两种元素可以形成原子个数比为2:3的化合物,则这两种元素的原子序数之差不可能是A. 1B. 2C. 5D. 6[解析]设两种元素的符号分别为X和Y,则化合物的化学式为X2Y3,即X为+3价,Y 为-2价,在短周期元素中满足此要求的X元素有5B、7N、13Al,Y元素有8O和16S,原子序数差值见下表本题正确答案为D。
【例7】X和Y两元素的阳离子具有相同的电子层结构,X元素的阳离子半径大于Y元素的阳离子半径,Z和Y两元素的原子核外电子层数相同,Z元素的原子半径小于Y元素的原子半径。
X、Y、Z三种元素原子序数的关系是A. X>Y>ZB. Y>X>ZC. Z>X>YD. Z>Y>X[解析]对于电子层结构相同的离子,核电荷数越大,半径越小,现X元素的阳离子半径大于Y,故核电荷数应是Y>X。
Z和Y的电子层数相同,则它们在同一周期,随着核电荷数的递增,原子半径逐渐减小,现Z的原子半径小于Y,则核电荷数是Z>Y。
综合以上关系得Z>Y>X。
本题正确答案为D。
六、原子结构知识的综合推断【例8】周期表中相邻的A、B、C三元素中,A、B同周期,A、C同主族。
已知三种元素的原子最外层电子数之和为19,三种元素的原子核中质子数之和为41。
则这三种元素是A______、B_______、C________、D_________(填元素符号)。
[解析]本题采用平均值法解答比较简单。
由A、B、C三元素为相邻元素以及它们的平均质子数41/3≈14<18,可知A、B、C三元素为短周期元素;又根据最外层电子数的平均值19/3≈6.3<7,推知其中必有最外层电子数为7的元素,所以A、B、C三种元素应分布在ⅥA、ⅦA族,经推断A为S,B为Cl、C为O符合题意。
【例9】已知某主族金属元素X的原子核内质子数和中子数之比为1:1,含该金属阳离子0.192g的溶液恰好能将20mL0.4mol/L的Na2CO3溶液中的CO32-全部沉淀,推断X是什么元素及在周期表中的位置。
[解析]周期表中质子数与中子数相等的金属元素只有Mg和Ca两种,它们都是+2价金属。
设金属的相对原子质量为M,由关系式X2+~Na2CO3得:M:1=0.192:(0.4×0.02),解得M=24。
则X为镁,位于第3周期第ⅡA族。
4.实战演练一、选择题1.下列原子序数所代表的元素中,全属于主族元素的是( )A. 22 26 11B. 13 15 38C. 29 31 16D. 18 21 312.(2001年全国高考题)下列说法错误的是( )A.原子及其离子核外电子层数等于该元素所在的周期数B.元素周期表中从ⅢB族到ⅡB族10个纵行的元素都是金属元素C.除氦以外的稀有气体原子的最外层电子数都是8D.同一元素的各种同位素的物理性质、化学性质均相同3.某周期ⅡA族元素的原子序数为x,则同周期的ⅢA族元素的原子序数不可能是A.x+1B.x+2C.x+11D.x+254.科学家根据元素周期律和原子结构理论预测,原子序数为114的元素属于第七周期ⅣA 族,称为类铅元素.下面关于它的原子结构和性质预测正确的是( )A.类铅元素原子的最外层电子数为4B.其常见价态为+2、+3、+4C.它的金属性比铅强D.它的原子半径比铅小5.下列各组顺序的排列不正确的是( )A.离子半径:Na+>Mg2+>Al3+>F -B.热稳定性:HCl>H2S>PH3>AsH3C.酸性强弱:HAlO2<H2SiO3<H2CO3<H3PO4D.溶点:NaCl>SiO2>Na>CO26.已知元素X、Y的核电荷数分别是a和b,它们的离子X m+和Y n-的核外电子排布相同,则下列关系式正确的是()A.a=b+m+nB.a=b-m+nC.a=b+m-nD.a=b-m-n7.若短周期中的两种元素可以形成原子个数比为2:3的化合物,则这种元素的原子序数之差不可能是A. 1B. 3C. 5D. 68.X元素的阳离子和Y元素的阴离子具有与氩原子相同的电子层结构,下列叙述正确的是( ).A.X的原子序数比Y的小B.X原子的最外层电子数比Y的大C.X的原子半径比Y的大D.X元素的最高正价比Y的小9.X和Y属短周期元素,X原子的最外层电子数是次外层电子数的一半,Y位于X的前一周期,且最外层只有一个电子,则X和Y形成的化合物的化学式可表示为A、XYB、XY2C、XY3D、X2Y310.下列叙述正确的是A、同主族金属的原子半径越大熔点越高B、稀有气体原子序数越大沸点越高C、分子间作用力越弱分子晶体的熔点越低D、同周期元素的原子半径越小越易失去电子11.下列关于稀有气体的叙述不正确的是A、原子的最外电子层都有8个电子B、其原子与同周期IA、IIA族阳离子具有相同的核外电子排布C、化学性质非常不活泼D、原子半径比同周期ⅦA族元素原子的大12.甲、乙是周期表中同一主族的两种元素,若甲的原子序数为x,则乙的原子序数不可能是A.X+2B.X+4C.X+8D.X+1813.A和M为两种元素,已知A位于短周期,且A2-与M+的电子数之差为8,则下列说法正确的A.A和M原子的电子总数之和可能为11B.A和M的原子序数之差为8C.A和M原子的最外层电子数之和为8D.A和M原子的最外层电子数之和为7二、填空题:14.A、B、C、D是短周期元素,A元素的最高价氧化物的水化物与它的气态氢化物反应得到离子化合物,1摩该化合物含有42摩电子,B原子的最外层电子数是内层电子数的3倍。
