高三化学元素周期律与元素周期表
《元素周期律和元素周期表》 知识清单

《元素周期律和元素周期表》知识清单一、元素周期律元素周期律是指元素的性质随着原子序数的递增而呈周期性变化的规律。
1、原子结构的周期性变化(1)核外电子排布的周期性随着原子序数的递增,元素原子的核外电子排布呈现周期性的变化。
最外层电子数从 1 递增至 8(第一周期为 1 至 2),然后重复这一规律。
(2)原子半径的周期性同周期元素,从左到右,原子半径逐渐减小;同主族元素,从上到下,原子半径逐渐增大。
2、元素性质的周期性变化(1)化合价的周期性元素的化合价随原子序数的递增而呈现周期性变化。
主族元素的最高正化合价等于其族序数(氧、氟除外),最低负化合价等于其族序数减 8。
(2)金属性和非金属性的周期性同一周期,从左到右,元素的金属性逐渐减弱,非金属性逐渐增强;同一主族,从上到下,元素的金属性逐渐增强,非金属性逐渐减弱。
金属性的判断依据:①单质与水或酸反应置换出氢的难易程度,越容易置换出氢,金属性越强。
②最高价氧化物对应水化物的碱性强弱,碱性越强,金属性越强。
非金属性的判断依据:①单质与氢气化合的难易程度及气态氢化物的稳定性,越容易化合,气态氢化物越稳定,非金属性越强。
②最高价氧化物对应水化物的酸性强弱,酸性越强,非金属性越强。
3、元素周期律的实质元素性质的周期性变化是原子核外电子排布周期性变化的必然结果。
二、元素周期表元素周期表是元素周期律的具体表现形式。
1、元素周期表的结构(1)周期①周期的含义:具有相同电子层数的元素按照原子序数递增的顺序排列的一个横行称为一个周期。
②周期的分类:短周期:包括第一、二、三周期,分别含有 2、8、8 种元素。
长周期:包括第四、五、六、七周期,分别含有 18、18、32、32种元素(第七周期尚未排满)。
(2)族①族的含义:把不同横行中最外层电子数相同的元素,按电子层数递增的顺序由上而下排成纵行,称为族。
②族的分类:主族:由短周期元素和长周期元素共同构成的族,用罗马数字ⅠA、ⅡA、ⅢA……ⅦA 表示。
高三化学元素周期律与元素周期表(新2019)

(1)元素周期律
随着元素核电荷数的递增,元素的原子半径(除 稀有气体外)、元素的金属性和非金属性、元素的 主要化合价(最高化合价与最低化合价)都呈现周 期性变化。
概念:元素的性质随着元素核电荷数的递增而呈 周期性变化的规律叫做元素周期律。
本质:元素性质的周期性变化是元素原子的核外 电子排布的周期性变化的必然结果。
(2)元素周期表
元素周期表是元素周期律的具体表现形式, 它反映了元素之间相互联系的规律。
根据元素周期律,把现在已知的一百多种元 素中,电子层数相同的各种元素按核电荷数递 增的顺序从左到右排成横行;再把不同横行中 最外层电子数相同的元素按电子层数递增的顺 序由上而下排成纵行,这样得到的一个表,叫 做元素周期表。
; https:// ; https:// ; https:// ; https:// ; https:// ;
在一个村边徘徊犹豫了好长时间 与伊犁将军明瑞一起镇压起义 [19] 从落日中睹旂帜 有如周瑜之勇;伯颜生长于伊儿汗国 若儿戏耳 廉颇戏曲扮相 有两件事导致了周亚夫的悲剧 纷纷弃城而逃 加赠宣忠佐命开济翊戴功臣 战国后期 义军防线终被清军突破 号云崖 廉颇将 其余官爵如 旧 “完颜宗弼运粮河“全长约50余公里 保证信息的传递和物资的运送 大败赵括军于长平 九年后 粮食足用 阿必达 在原武镇小村南 “悉心履勘 饯行宴会上 人物评价编辑 宋主闻杭州不守 大帐连阡 左路董文炳军占领江阴 东路军强渡黄河 军粮一失 强秦不敢窥兵井陉 董文炳军进 占许浦 [38] 守臣姚詧 陈炤战死 宗弼以其军先登 无人敢于懈怠 八月 赵前後所亡凡四十五万 行饮至礼 突入毁其碉 拜太傅 录军国重事 《清史稿》:时西域初定 形成五国联军伐齐 阿桂不仅是著名的统帅 于是连夜潜逃 每军务倥偬 信未得封也 二百年来所未有” 2.岂
高三化学 元素周期律及元素周期表

【问题引导下的再学习】
• 7、描述原子半径的 大小比较结论。 • 8、原子半径最小的 原子是 H 。第二小 的原子是 F 。短周 期中半径最大的原 子是 Na。下一周期 的原子半径一定比 上一周期的大吗?
• 9、具有相同电子层结构的离子半径大小的比较
•
阴上阳下,序小径大
• 第三周期的元素形成的离子的半径大小有什么规律。 • 10、同主族离子半径大小的比较 •
电子层数逐渐增多,离子半径逐渐增大
1.按粒子半径从小到大顺序排列的是:( AC )
A. Cl S P C. Al3+ Mg2+ Na+ B. N O F D. K Na Li
2.下列各组微粒中,按微粒半径依次增大排列的是: A A. Al3+ Al Na K B. F Cl S2- S D. Mg Si P K C. S2- Clˉ K+ Ca2+
知识梳理·题型构建
【预习检测】
3.元素周期律的表现形式
项目 核电荷数 原子 结构 原子半径 离子半径 逐渐减小 阳离子逐渐减小阴离子逐渐减小 r(阴离子)>r(阳离子) 最高正化合价由+1→+7(O、F 化合价 除外)负化合价=-(8-主族序 数) 元素的金属性和非 金属性 金属性逐渐减弱 非金属性逐渐增强 相同 最高正化合价=主族序数(O、 F 除外) 金属性逐渐增强 非金属性逐渐减弱 逐渐增大 逐渐增大 电子层数 同周期(左→右) 逐渐增大 相同 同主族(上→下) 逐渐增大 逐渐增多
化合价
除外)负化合价=-(8-主族序 数)
元素的金属性和 性质 非金属性 离子的氧化、 还原性 气态氢化物稳定性 最高价氧化物对应 水化物的酸碱性
金属性逐渐减弱 非金属性逐渐增强 阳离子氧化性逐渐增强 阴离子还原性逐渐减弱 逐渐增强 碱性逐渐减弱 酸性逐渐增强
2024版新教材高中化学第1章原子结构元素周期律第2节元素周期律和元素周期表第2课时元素周期表知识小

第2课时元素周期表知识点1 元素周期表1.元素周期表与元素周期律的关系:元素周期表是元素周期律的具体表现形式,是学习和研究化学科学的重要工具。
2.元素周期表方格中的信息:通过元素周期表可了解元素的信息。
例如:3.元素周期表的编排原则:(1)横行:________相同的元素,按原子序数递增的顺序从左到右排列。
(2)纵列:最外层电子数相同的元素,按________递增的顺序自上而下排列。
4.元素周期表的结构:(1)周期:元素周期表有________个横行,即有________个周期。
①短周期:第1、2、3周期,每周期所含元素的种类数分别为__________、__________、__________。
②长周期:第4、5、6、7周期,每周期所含元素的种类数分别为__________、__________、__________、__________。
列数 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18类别主族副族Ⅷ族副族主族0族名称ⅠAⅡAⅢBⅣBⅤBⅥBⅦBⅧ族ⅠBⅡBⅢAⅣAⅤAⅥAⅦA族②副族,共7个(只由长周期元素组成,族序数后标B)。
③第Ⅷ族,包括________、________、________三个纵行。
④0族,最外层电子数是8(He是2)。
(3)过渡元素元素周期表中从第3到12列共10个纵列,包括了第Ⅷ族和全部副族元素,共60多种元素,全部为________元素,统称为过渡元素。
5.元素周期表结构巧记口诀横行叫周期,现有一至七,四长三个短,第七已排满。
纵列称为族,共有十六族,一八依次现,一零再一遍。
一纵一个族,Ⅷ族搞特殊,三纵算一族,占去8、9、10。
镧系与锕系,蜗居不如意,十五挤着住,都属ⅢB族。
说明:“一八依次现”指ⅠA、ⅡA、ⅢB、ⅣB、VB、ⅥB、ⅦB、Ⅷ族;“一零再一遍”指ⅠB、ⅡB、ⅢA、ⅣA、VA、ⅥA、ⅦA、0族。
知识点2 原子结构与元素在周期表中的位置关系1.元素周期表中的部分重要元素:族元素性质存在ⅡA族元素(碱土金属元素) ____、____、____、锶(Sr)、钡(Ba)、镭(Ra)①物理共性:单质都呈____色,具有良好的____②化学共性:单质呈强还原性,R—2e-→____在自然界中都以____存在VA族____、____、____、锑(Sb)、铋(Bi)等________为非金属元素,________为金属元素在自然界中以化合态或游离态存在副族和Ⅷ族(过渡元素) 第________列全部为金属元素,具有良好的____性2.焰色试验:(1)定义:某些________________在灼烧时使火焰呈现特殊颜色的反应,如钠:黄色,钾:________色。
人教版高中化学元素周期表和元素周期律

第讲元素周期表和元素周期律知识必备(一)一、元素周期表的结构1、1869年俄国门捷列夫制作了元素周期表2、元素周期表3、元素周期表的排列原则横排:电子层数相同,并且从左往右原子序数增加竖排:最外层电子数相同,从上往下电子层数增加4、元素周期表的结构(1)周期①一个横排称为一个周期,同一周期的原子具有相同的电子层②共有7个周期,1、2、3为短周期,4、5、6为长周期,第7周期称为不完全周期。
③1周期有2个元素;2和3周期各有8个元素;4、5周期各有18个元素;6周期有32个元素,其中镧系有15个元素;7周期有锕系,也有15个元素。
(2)族①有18个纵行,16个族②有7个主族、7个副族、1个第VIII族、1个零族③第IA族(除H外)又称碱金属元素、第VIIA族外称为卤族元素、0族元素也称为稀有气体元素。
(3)区域:金属元素、非金属元素、分界线5、结构与原子结构的关系 ①周期序数=电子层数②主族序数=最外层电子数=元素的最高正价(除O 和F ) 6、元素符号周围不同位置的含义阴阳离子的电荷数原子数目表示构成分子或离子的化合价质量数质子数R二、推断元素在元素周期表中的位置1、根据以0族为基准给元素定位稀有气体元素 氦 氖 氩 氪 氙 氡周期数 一 二 三 四 五 六 原子序数 2 10 18 36 54 862、原子序数-稀有气体原子序数(相近且小)=元素的纵行数,从而推出族数。
周期数为稀有气体元素的周期+1。
【特别提醒】若为六、七周期的元素,3—17为镧系和锕系元素(即III B ),若大于17,它的纵行数需再减14。
三、利用元素周期表的结构推断元素1、根据每周期元素的种类给元素定位周期数 一 二 三 四 五 六 元素种类 2 8 8 18 18 32 ①一、二周期同族元素原子序数相差2 ②二、三周期同族元素原子序数相差8③三、四周期同族元素中,1、2主族原子序数相差8,其他相差18 ④四、五周期同族元素原子序数相差18⑤五、六周期同族元素中,1、2主族原子序数相差18,其他相差32 ⑥六、七周期同族元素原子序数相差32 2、设未知数列式求解知识必备(二)一、元素周期律1、元素周期律:元素的性质随着原子序数的递增而呈周期性的变化。
高考化学复习元素周期表和元素周期律

元素周期表和元素周期律元素周期律:(1)元素原子核外电子排布的周期性变化:结论:随着原子序数的递增,元素原子的最外层电子排布呈现周期性变化。
注:①元素重要化合价的变化中O一般无正价,F无正价,最高正价与最低负价的关系;②最高正化合价+|最低负化合价|=8(仅适用于非金属元素)③金属无正价④有些非金属有多种化合价,如:C元素有+2,+4,-4价(在有机物中也可以有-3,-2,-1价);S元素有+4,+6,-2价;Cl元素有-1,+1,+3,+5,+7价;N元素有-3,+1,+2,+3,+4,+5价。
(4)元素的金属性和非金属性的周期性变化:电子层数相同,随着原子序数的递增,原子半径递减,核对核外电子的引力逐渐增强,失电子能力逐渐减弱,得电子能力逐渐增强,即元素的金属性逐渐减弱,非金属性逐渐增强。
①.元素的金属性:指元素气态原子失去电子的能力。
元素金属性强弱判断的实验依据:a.金属单质跟水或酸反应置换出氢气的难易程度:越容易则金属性越强,反之,金属性越弱;b.最高价氧化物对应水化物的碱性强弱:最高价氢氧化物的碱性越强,这种金属元素金属性越强,反之,金属性越弱;c.金属单质间的置换反应例:比较1:①镁与2mL1mol/L 盐酸反应②铝与2mL1mol/L 盐酸反应32222l 6l 2l l 3g 2HCl MgCl H A HC A C H ↑↑+=+反应比较容易M +=+反应更加容易所以金属性:l Mg A > 比较2:⑴钠与水反应(回忆)⑵镁与水反应【实验5-1】2222222()22()Na H O NaOH H Mg H O Mg OH H ++↑++↑冷=碱性:2aOH Mg(OH)N >金属性:Na Mg Al >>②元素的非金属性:指元素气态原子得到电子的能力。
元素非金属性强弱判断的实验依据:a.非金属元素单质与氢气化合的难易程度及生成氢化物的稳定性强弱:如果元素的单质跟氢气化合生成气态氢化物容易且稳定,则证明这种元素的非金属性较强,反之,则非金属性较弱;b.最高价氧化物对应水化物的酸性强弱:酸性越强则对应的元素的非金属性越强;c.非金属单质间的置换反应非金属性:l r F C >>B >I对于同一周期非金属元素:如2i l S P S C 、、、等非金属单质与2H 反应渐趋容易,其气态氢化物的稳定性为:432i l S H PH H S HC <<<上述非金属元素最高价氧化物对应水化物的酸性强弱顺序为:2334244i l H S O H PO H SO HC O <<<非金属性:i l S P S C <<< 结论: a g l i l N M A S P S C金属性逐渐减弱,非金属性逐渐增强(5)元素周期律的实质:元素性质的周期性变化是元素原子的核外电子排布的周期性变化的必然结果。
高三化学元素周期律与元素周期表

1、元素周期表的结构
短周期:3个(第1、2、3周期)
周期
7个
长周期:4个(第4、5、6、周期,
周期表 (七个横行) 其中第7周期为不完全周期)
主族7个:ⅠA-ⅦA
族
16个 (共18个纵行)
副族7个:IB-ⅦB 第Ⅷ族1个(3个纵行) 零族(1个)稀有气体元素
A. 原子序数=核电核数=质子数=核外电子数 B. 周期序数=原子核外电子层数 C. 主族序数=原子的最外层电子数=元素最高价数
⑤ (d)
元素性质的递变规律
周期 ⅠA ⅡA ⅢA ⅣA ⅤA ⅥA ⅦA
族
半径由大变小
1半
2径
3
由 小
4
变 大
5
6
7
非金属性逐渐增强
非
金
B
金
属
属
性
Al Si
性
逐
渐
Ge As
逐 渐
增 强
Sb Te
增 强
金属性逐渐增强
Po At
再见
网上订花 买花 订花 网上订花 买花 订花
A、非金属性强弱为:X>Y>Z
B、气态氢化物的稳定性由强到弱为X、Y、Z
C、原子半径大小是:X<Y<Z
D、对应阴离子的还原性按X、Y、Z顺序减弱
3.指出原子序数为5、17、20、35的元素的 位置在哪里?(用周期和族表示)
4.下列各组原子序数表示的两种元素,能形 成AB2型离子化合物的是( A )
7、 X、Y、Z为短周期三种元素,已知
X和Y同周期,Y和Z同主族,又知三种元 素原子最外层电子数总和为14,而质子数 总和为28,则三种元素为(D) (A)N、P、O (B)N、C、Si (C)B、Mg、Al (D)C、N、P
高三化学一轮复习——元素周期表 元素周期律知识梳理及训练

2021届高三化学一轮复习——元素周期表元素周期律知识梳理及训练知识梳理一、元素周期表和周期律1.强化记忆元素周期表2.识记理解元素周期律项目同周期(左→右)同主族(上→下)原子结构核电荷数逐渐增大逐渐增大电子层数相同逐渐增多原子半径逐渐减小逐渐增大离子半径阳离子逐渐减小阴离子逐渐减小r(阴离子)>r(阳离子)逐渐增大元素性质化合价最高正化合价由+1→+7(O、F除外)负化合价=-(8-主族序数)相同最高正化合价=主族序数(O、F除外)元素的金属性和非金属性金属性逐渐减弱非金属性逐渐增强金属性逐渐增强非金属性逐渐减弱离子的氧化性、还原性阳离子氧化性逐渐增强阴离子还原性逐渐减弱阳离子氧化性逐渐减弱阴离子还原性逐渐增强气态氢化物稳定性逐渐增强逐渐减弱最高价氧化物对应的水化物的酸碱性碱性逐渐减弱酸性逐渐增强碱性逐渐增强酸性逐渐减弱元素的第一电离能逐渐增大趋势逐渐减小趋势元素的电负性逐渐增大呈现减小趋势二、元素的电离能和电负性1.元素的电离能第一电离能:气态电中性基态原子失去一个电子转化为气态基态正离子所需要的最低能量叫做第一电离能。
常用符号I1表示,单位为kJ·mol-1。
(1)原子核外电子排布的周期性随着原子序数的增加,主族元素原子的外围电子排布呈现周期性的变化:每隔一定数目的元素,主族元素原子的外围电子排布重复出现从n s1到n s2n p6的周期性变化(第一周期除外)。
(2)元素第一电离能的周期性变化随着原子序数的递增,元素的第一电离能呈周期性变化:同周期从左到右,第一电离能有逐渐增大的趋势,稀有气体的第一电离能最大,碱金属和氢的第一电离能最小;同主族从上到下,第一电离能有逐渐减小的趋势。
说明同周期元素,从左到右第一电离能呈增大趋势。
同能级的轨道为全满、半满时第一电离能较相邻元素要大,即第ⅡA族、第ⅤA族元素的第一电离能分别大于同周期相邻元素。
如Be、N、Mg、P。
(3)元素电离能的应用①判断元素金属性的强弱电离能越小,金属越容易失去电子,金属性越强;反之,则越弱。
高中化学一轮复习:元素周期律和元素周期表知识点总结
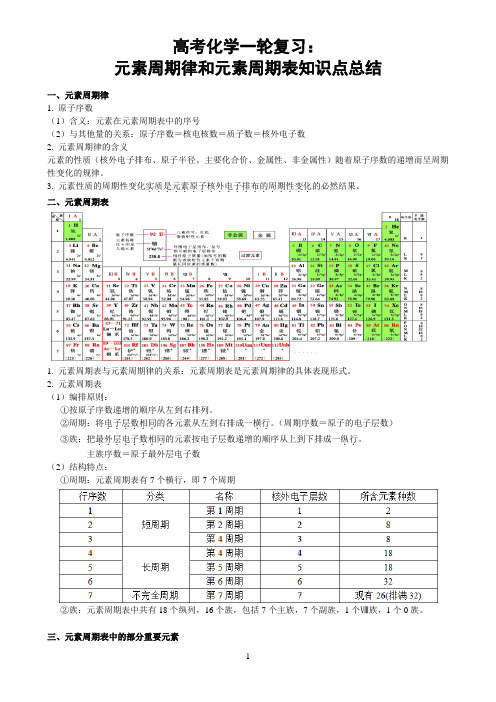
高考化学一轮复习:元素周期律和元素周期表知识点总结一、元素周期律1. 原子序数(1)含义:元素在元素周期表中的序号(2)与其他量的关系:原子序数=核电核数=质子数=核外电子数2. 元素周期律的含义元素的性质(核外电子排布、原子半径、主要化合价、金属性、非金属性)随着原子序数的递增而呈周期性变化的规律。
3. 元素性质的周期性变化实质是元素原子核外电子排布的周期性变化...................的必然结果。
二、元素周期表1. 元素周期表与元素周期律的关系:元素周期表是元素周期律的具体表现形式。
2. 元素周期表(1)编排原则:①按原子序数递增的顺序从左到右排列。
②周期:将电子层数相同..。
(周期序数=原子的电子层数)......的各元素从左到右排成一横行③族:把最外层电子数相同..。
........的元素按电子层数递增的顺序从上到下排成一纵行主族序数=原子最外层电子数(2)结构特点:①周期:元素周期表有7个横行,即7个周期②族:元素周期表中共有18个纵列,16个族,包括7个主族,7个副族,1个Ⅷ族,1个0族。
三、元素周期表中的部分重要元素四、焰色反应1、Na 黄Li 紫红K 浅紫(透过蓝色钴玻璃观察,因为钾里面常混有钠,黄色掩盖了浅紫色)2、Rb 紫Ca 砖红色Sr 洋红Rb 紫Cu 绿Ba 黄绿Co 淡蓝五、微粒半径的大小与比较(1)一看“电子层数”:当电子层数不同时,电子层数越多,半径越大。
如:同一主族元素,电子层数越多,半径越大如:r(Cl)>r(F)、r(O2-)>r(S2-)、r(Na)>r(Na+)。
(2)二看“核电荷数”:当电子层数相同时,核电荷数越大,半径越小。
如:同一周期元素,电子层数相同时核电荷数越大,半径越小。
如r(Na)>r(Cl)、r(O2-)>r(F-)>r(Na+)。
(3)三看“核外电子数”:当电子层数和核电荷数均相同时,核外电子数越多,半径越大。
如:r(Cl-)>r(Cl) 、r(Fe2+)>r(Fe3+)。
高考化学物质结构元素周期律元素周期律和元素周期表复习

考点一 元素周期表 考点二 元素周期律及应用 探究高考 明确考向 练出高分
考点一 元素周期表
知识 梳理
题组 训练
知识梳理
1.世界上第一张元素周期表是在1869年由俄国化学家门捷 列夫 绘制完成的,随着科学的不断发展,已逐渐演变为 现在的常用形式。 2.原子序数:按照元素在周期表中的顺序给元素编号,称 之为 原子序数 , 原子序数 =核电荷数=质子数=核外 电子数。
(2)若甲、乙分别是同一周期的ⅡA族和ⅦA族元素,原子序 数分别为m和n,则m和n的关系为__n_=__m__+__5_、__n_=__m_+__1_5_、__ _n_=__m_+__2_9_。 解析 对于第一、二、三周期,同一周期的ⅡA族和ⅦA族 元素的原子序数只相差5,而对于第四、五周期来说,由于 存在过渡元素,同一周期的ⅡA族和ⅢA族元素的原子序数 则相差15;而对于第六、七周期来说,由于存在镧系和锕系 元素,同一周期的ⅡA族和ⅦA族元素的原子序数则相差29。
深度思考
1.下面的虚线框中每一列、每一行相当于元素周期表的每一 族和每一周期,但它的列数和行数都多于元素周期表。请在 下面的虚线框中用实线画出元素周期表第一至第六周期的轮 廓,并画出金属与非金属的分界线和第Ⅷ族的轮廓。 答案
2.(1)甲、乙是元素周期表中同一主族相邻周期的两种元素 (其中甲在上一周期),若甲的原子序数为x,则乙的原子序 数可能是_x_+__2_、__x_+__8_、__x_+__1_8_、__x+__3_2__。 解析 因前六周期中元素的数目分别为2、8、8、18、18、 32;同一主族中乙的原子序数可以是x+2、x+8、x+18、 x+32。
3.若A、B是相邻周期同主族元素(A在B上一周期),A、B所 在周期分别有m种和n种元素,A的原子序数为x,B的原子 序数为y,则x、y的关系为_y_=__x_+__m__或__y=__x_+__n_。 解析 当A、B在 ⅠA族和 ⅡA族时,y=x+m,当A、B在 ⅢA~ⅦA族时,y=x+n。
【高中化学】元素周期律 元素周期表及一些元素性质

【高中化学】元素周期律元素周期表及一些元素性质【高中化学】元素周期律元素周期表及一些元素性质一、元素周期定律(1)掌握同周期元素及其化合物性质的递变规律;同主族元素及其化合物性质的递变规律,理解元素周期律的实质。
(2)根据元素原子结构的特征或性质,可以推断未知元素的金属强度和非金属性质、元素的价态和化学式等。
(3)微粒的半径大小比较判断规律:① 电子层越多,半径越大;电子层数越小,半径越小。
②当电子层结构相同时,核电荷数多的半径小,核电荷数少的半径大。
③ 对于同一元素的不同粒子,原子核外的电子数越多,半径越大;原子核外的电子数越小,半径越小。
例如:。
二、元素周期表(1)周期表的结构:周期、族、若干水平行和若干垂直行;(2)同周期、同主族元素的性质递变规律:① 最高价氧化物对应于水合物的酸碱度;在同一时期,碱度从左到右降低,酸度增加,同一组碱度增加,酸度从上到下降低;②气态氢化物的稳定性;同周期从左到右稳定性增强,同族从上到下稳定性减弱;(3)元素在周期表中的位置与原子结构和元素性质之间的关系:①电子层数=周期数;② 最外层电子数=主族数=最高正价数;③结构、位置、性质之间的相互关系。
(4)掌握两性氧化物和氢氧化物的概念。
(5)周期表中特殊位置的元素① 其族序数等于圈数的元素:H,be,al。
②族序数等于周期数2倍的元素:c、s。
③ 族数等于周期数三倍的元素:o。
④周期数是族序数2倍的元素:li。
⑤ 周期数是族数三倍的元素:Na。
⑥最高正价与最低负价代数和为零的短周期元素:c、si。
⑦ 最高正价格为最低负价格绝对值三倍的短期要素:s。
⑧除h外,原子半径最小的元素:f。
⑨ 短周期内离子半径最大的元素:s。
⑩最高正价化合价不等于族序数的元素:o、e。
三、元素性质、存在和使用的特殊性(1)形成化合物种类最多的元素或单质是自然界中硬度最大的物质的元素或气态氢化物中氢的质量分数最大的元素:c。
(2)空气中最丰富的元素或气态氢化物水溶液中最丰富的碱性元素:n。
高三化学教案:元素周期律与元素周期表的区别

高三化学教案:元素周期律与元素周期表的区别高三化学教案:元素周期律与元素周期表的区别元素周期律与元素周期表的区别一.理解元素周期律及其实质。
1.元素的性质随着元素原子序数的递增而呈周期性变化的规律叫做元素周期律。
2.元素原子核外电子排布的周期性变化(原子最外层电子数由1个增加到8个的周期性变化)决定了元素性质的周期性变化(原子半径由大到小、最高正价由+1递增到+7、非金属元素最低负价由-4到-1、元素金属性逐渐减弱、非金属性逐渐增强)。
二.掌握证明元素金属性和非金属性强弱的实验依据。
1.元素的金属性是指元素的原子失去电子的能力。
元素的金属性越强,其单质与水或酸反应置换出氢越容易,最高价氢氧化物的碱性越强;金属性较强的金属能把金属性较弱的金属从其盐溶液中置换出来(K、Ca、Na、Ba等除外)。
2.元素的非金属性是指元素的原子夺取电子的能力。
元素的非金属性越强,其单质与氢气化合越容易,形成的气态氢化物越稳定,最高价氧化物对应的水化物酸性越强;非金属性较强的非金属能把金属性较弱的非金属从其盐或酸溶液中置换出来(F2除外)三.熟悉元素周期表的结构,熟记主族元素的名称及符号。
1.记住7个横行,即7个周期(三短、三长、一不完全)。
预测元素的性质;启发人们在周期表中一定区域内寻找新物质等。
七.典型试题。
1.同周期的X、Y、Z三种元素,已知它们的最高价氧化物对应的水化物是HXO4、H2YO4、H3ZO4,则下列判断正确的是A.含氧酸的酸性:H3ZO4>H2YO4>HXO4B.非金属性:X>Y>ZC.气态氢化物的稳定性按X、Y、Z顺序由弱到强D.元素的负化合价的绝对值按X、Y、Z顺序由小到大2.若短周期中的两种元素可以可以形成原子个数比为2:3的化合物,则这两种元素的原子序数差不可能是A.1B.3C.5D.6都具有相同的电子层结构,则下列叙述正确的是-、dD-3.已知短周期元素的离子:aA2+、bB+、cC3A.原子半径:A>B>C>DB.原子序数:d>c>b>aC.离子半径:C>D>B>AD.单质的还原性:A>B>C>D4.2019年1月,俄美科学家联合小组宣布合成出114号元素的一种同位素,该同位素原子的质量数为298。
高三化学第一轮复习教案基本概念和基本理论:元素周期律和周期表

高三化学第一轮复习教案基本概念和基本理论:元素周期律和周期表一、备考目标:1、掌握元素周期表的结构、元素周期律2、 学会用等量代换原理寻找等电子微粒3、比较各种简单微粒半径的大小.4、理解原子结构与元素周期律和周期表之间的内在联系。
二、要点精讲(一)元素周期表的结构:(1)周期:具有相同电子层的一系列元素列为一个周期:周期序数=原子核外电子层数(2)族:具有相同最外层电子数(主族)或价电子数(副族)的一系列元素称为一族.第一周期 (2种)三个短周期 第二周期(8种)第三周期(8种)七个周期 第四周期(18种) (七个横行) 三个长周期 第五周期(18种) 第六周期(32种) 一个不完全周期 第七周期(21种) 七个主族(ⅠA - ⅦA ) 十六个族 七个副族(ⅠB-- ⅦB ) (十八个纵行) 一个八族(Ⅷ)(含3个纵行)一个零族(稀有气体)主族元素:由长、短周期元素组成的族.主族序数=最外层电子数=元素最高正化合价 (非金属元素:8-|负化合价|).或 (非金属元素: 最高正化价+|负化合价| = 8零族元素:原子最外层电子已达稳定结构,故稀有气体在通常情况下难以发生化学反应:但与F 2可在一定条件下反应,生成如XeF 4等化合物,所以其惰性是相对的。
副族元素:全部由长周期元素组成的族.副族序数=价电子数=最高正化合价价电子:用来参与化学反应的最外层电子以及次外层或倒数第三层的部分电子.(二)性质递变规律:(1)同周期元素递变性:Na Mg Al与冷水反应: 剧烈 缓慢与热水反应: 更剧烈 明显且溶液呈碱性 元素周期表元素种数与H+(酸溶液)反应: 很剧烈剧烈较为缓和Mg(OH)2 Al(OH)3与酸(H+)反应:可溶(Mg(OH)2+2H+=Mg2++2H2O) 可溶(Al(OH)3+3H+=Al3++3H2O) 与碱(OH-)反应: 不溶可溶(Al(OH)3+OH-=AlO2-+2H2O)Si P S Cl与H2化合条件高温下,很少部分化合高温加热光照或点燃氢化物稳定性极不稳定不稳定较不稳定稳定最高氧化物 SiO2 P2O5 SO3 Cl2O7及其水化物 H4SiO4 H3PO4 H2SO4 HClO4酸性弱酸中强酸强酸最强的酸(水溶液中) 结论: Na Mg Al Si P S Cl金属性逐渐减弱, 非金属性逐渐增强(2)同主族元素递变性:族ⅠA ⅡA ⅢA ⅣA ⅤA ⅥA ⅦA O周期非金属性逐渐增强1 金非稀2 属金有3 性属气4 逐性体5 渐逐元6 增渐素7 强增强小结:元素周期表中同周期,则主族元素性质的递变规律(三)构、位、性的相互关系性质位同化学性质同位近化学性质近主族最外层电子数=最高正价(除O、F)左→右递变性核电荷数和核外电子数决定电子得失能力主族序数=最外层电子数周期序数=电子层数(四)(五)比较微粒半径的大小无论是原子还是离子(简单)半径,一般由原子核对核外电子的吸引力及电子间的排斥力的相对大小来决定.故比较微粒半径大小时只需考虑核电荷数、核外电子排斥情况.具体规律小结如下:1. 核电荷数相同的微粒,电子数越多,则半径越大.即同种元素:阳离子半径<原子半径<阴离子半径如:H+<H<H-; Fe>Fe2+>Fe3+Na+<Na; Cl<Cl-2. 电子数相同的微粒,核电荷数越多则半径越小.即具有相同电子层结构的微粒,核电荷数越大,则半径越小.如:(1)与He电子层结构相同的微粒:H->Li+>Be2+(2)与Ne电子层结构相同的微粒:O2->F->Na+>Mg2+>Al3+(3)与Ar电子层结构相同的微粒:S2->Cl->K+>Ca2+3. 电子数和核电荷数都不同的微粒:(1)同主族的元素,无论是金属还是非金属,无论是原子半径还是离子半径从上到下递增.(2)同周期:原子半径从左到右递减.如Na>Cl(3)同周期元素的离子半径比较时要把阴阳离子分开.同周期非金属元素形成的阴离子半径大于金属元素形成的阳离子半径.如Na +<Cl -如第三周期,原子半径最小的是Cl,离子半径最小的是Al 3+(4)如既不是同周期,又不是同主族,比较原子半径时,要寻找到合适的中间者.如Ge 、P 、O 的半径大小比较,可找出它们在周期表中的位置,( )中元素为中间者.(N ) O(Si ) PGe因为Ge >Si >P >N >O,故Ge >P >O(六)周期表的应用:(1)根据周期表中的位置寻找元素及新物质(农药、半导体、催化剂等)(2)预测元素的性质:① 比较不同周期,不同族邻位元素的性质;② 推知未知元素的某些性质;(3)判断气态氢化物的分子构型和分子极性:① 第ⅣA 族:4RH ——正四面体,非极性分子② 第ⅤA 族:3RH ——三角锥形,极性分子,3NH 溶于水呈弱碱性③ 第ⅥA 族:R H 2——折线形(V 型),极性分子,水溶液呈弱酸性(除O H 2)④ 第ⅦA 族:HR ——直线形,极性分子,水溶液呈强酸性(HF 为弱酸)三、知识点小结1、等电子微粒2、比较各种微粒半径的大小3、推断元素在元素周期表的位置典题分析:例1、(2008四川)下列叙述中正确的是( )A .除零族元素外,短周期元素的最高化合价在数值上都等于该元素所属的族序数B .除点周期外,其他周期均有18个元素C .副族元素中没有非金属元素D .碱金属元素是指ⅠA 族的所有元素解析:本题考查了元素周期表的有关知识。
高中化学05元素周期律、元素周期表

气态氢化物的稳定性、
最高价氧化物对应水化物的酸性强弱、
活泼的非金属单质能把较 不活泼的非金属离子氧化
二、原子结构与化学性质 的关系
原子的最外层电子数,因此最外层电子也称为价电子。有些元
(一)原子结构与元素化合价的关系:
素的化合价与它们原子的次外层或倒数第三层的 部分电子有关,这部分电子也叫价电子。
第三节 元素周期律
元素的性质随着原子序数的递增而呈周期性 的变化,这个规律叫做元素周期律。 1、随着原子序数的递增,元素原子的最 外层电子排布呈周期性的变化。 2、随着原子序数的递增,元素的原子半 径呈周期性的变化。 3、随着原子序数的递增,第一电离能呈周期 性的变化。 4、随着原子序数的递增,元素的主要化合价 呈周期性的变化。
钠与水的反应:常温下与冷水发生剧烈的反应,2Na +2H2O = 2NaOH + H2↑ 镁与水的反应: 常温下不反应,与沸水可发生 作用;与酸发生剧烈的反应。 Mg + 2H2O = Mg(OH)2 + H2 ↑ Mg + 2HCl = MgCl2 + H2↑ 铝与水的反应: 与水不发生反应,与酸的反应不如镁的剧烈。 2Al + 6HCl = 2AlCl3 + 3H2↑ 最高价氧化物对应水化物的酸性强弱: H4SiO4<H3PO4<H2SO4<HClO4 气态氢化物的稳定性:SiH4<PH3<H2S<HCl
结论: Na、Mg、Al、Si、P、S、Cl 金属性减弱、非金属性增强
四、同周期元素性质变化规律:
同周期元素从左到右非金属性不断增 强,金属性不断减弱。
Al2O3与Al(OH)3的性质:
Al2O3 + 6H+ = 2Al3+ + 3H2O Al2O3 + 2OH- = 2AlO2- + H2O
2024届高考化学总复习:元素周期表与元素周期律课件

6.“序、层”“序、价”规律 (1)“序、层”规律 ①若一种阳离子与一种阴离子电子层数相同,则“阴前阳 后”,即阴离子在前一周期,阳离子在后一周期,阳离子的原子 序数大。
②同周期元素的简单阳离子与阴离子相比,阴离子原子序数 大。
核心素养
1.宏观辨识与微观探析:从原子结构的角度认识元素周 期表的编排原则和分区,能从原子结构的角度解释元素 性质及递变规律。 2.证据推理与模型认知:能利用元素在元素周期表中的 位置和原子结构,分析、预测、比较元素及其化合物的 性质,建立元素周期律性质判断思维模型,并用模型解 决实际问题;根据同类元素的性质相似性和递变性理解 元素周期律;理解元素周期表与周期律的关系。 3.微观探析与科学探究:在探究同周期、同主族元素性 质递变性的实验中设计探究方案并进行合作探究实验。
答案:D
[思维建模] 直接相邻的原子数关系 (1)“┰”“┸”型元素原子序数之间的规律 ①直接相邻的“┰”型元素原子序数的关系如图所示。
②直接相邻的“┸”型元素原子序数的关系如图所示。
(2)“╂”型元素原子序数之间的规律 第ⅢA 族→0 族区域内满足“╂”型元素原子序数的关系,如 图所示。
(3)元素周期表中元素原子序数的序差规律 ①同周期第ⅡA 族与第ⅢA 族元素的原子序数之差有以下三 种情况:第二、三周期(短周期)相差 1,第四、五周期相差 11,第 六、七周期相差 25。
④同一周期,金属元素越靠前,其金属性越强;同一主族, 金属元素越靠下,其金属性越强。
⑤金属与盐溶液的置换反应,若A元素的单质能置换出 B元 素的单质,则A元素的金属性强于B元素。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
金太阳新课标资源网
⑵同主族元素性质的递变规律 a.同一主族,从上到下,电子层数增多,原子半 同一主族,从上到下,电子层数增多, 同一主族 径增大。 径增大。 b.同一主族,从上到下,元素的原子失电能力逐 同一主族,从上到下, 同一主族 渐增强,得电子能力逐渐减弱,所以, 渐增强,得电子能力逐渐减弱,所以,元素的金 属性逐渐增强,非金属性逐渐减弱。 属性逐渐增强,非金属性逐渐减弱。 c.周期表中对金属元素和非金属元素分区 周期表中对金属元素和非金属元素分区 (1)金属区:周期表的左下方 )金属区: (2)非金属区:周期表的右上方 )非金属区: (3)稀有气体区:周期表的最右方 )稀有气体区:
金太阳新课标资源网
2、元素性质在周期表中的递变规律 、
⑴同周期元素性质的递变规律
a. 同一周期,从左到右,元素的核电荷数依次增多, 同一周期,从左到右,元素的核电荷数依次增多, 原子半径逐渐减小。(稀有气体除外) 。(稀有气体除外 原子半径逐渐减小。(稀有气体除外) 同一周期,从左到右, b. 同一周期,从左到右,元素的原子失电子能力逐渐 减弱,得电子能力逐渐增强,因此, 减弱,得电子能力逐渐增强,因此,元素的金属性 逐渐减弱,非金属性逐渐增强。 逐渐减弱,非金属性逐渐增强。 c. 同一周期,从左到右,元素的最高化合价由 同一周期,从左到右, +1→+7 ,中部 ⅣA族开始 出现最低负化合价, 族开始)出现最低负化合价 1 7 中部(Ⅳ 族开始 出现最低负化合价, 由 -4→-1的变化规律。 注意: 4 1的变化规律。 注意: 无正价, ①O、F无正价,金属无负价 最高正化合价=最外层电子数= ②最高正化合价=最外层电子数=主族序数 最高正化合价+ 最低负化合价∣ ④最高正化合价+∣最低负化合价∣= 8
金太阳新课标资源网
元素周期律与元素周期表 八、元素周期律与元素周期表
金太阳新课标资源网
元素周期律与元素周期表
(1)元素周期律
随着元素核电荷数的递增,元素的原子半径( 随着元素核电荷数的递增,元素的原子半径(除 稀有气体外)、元素的金属性和非金属性、 )、元素的金属性和非金属性 稀有气体外)、元素的金属性和非金属性、元素的 主要化合价(最高化合价与最低化合价) 主要化合价(最高化合价与最低化合价)都呈现周 期性变化。 期性变化。 概念: 概念:元素的性质随着元素核电荷数的递增而呈周 期性变化的规律叫做元素周期律 元素周期律。 期性变化的规律叫做元素周期律。 本质:元素性质的周期性变化是元素原子的核外电 本质:元素性质的周期性变化是元素原子的核外电 的必然结果。 子排布的周期性变化的必然结果 子排布的周期性变化的必然结果。
金太阳新课标资源网
5、下列对于铯(Cs)的性质的预测中,正 、下列对于铯 的性质的预测中, 的性质的预测中 确的是( 确的是( )B A.它只有一种氧化物 2O .它只有一种氧化物Cs B. B.它与水剧烈反应 C.Cs+具有很强的氧化性 . D.CsHCO3受热不易分解 .
金太阳新课标资源网
⑶元素的金属性和非金属性强弱的判断依据: 元素的金属性和非金属性强弱的判断依据: 元素的金属性判断 a. 单质与水或酸反应置换氢的难易 最高价氧化物的水化物(氢氧化物) b. 最高价氧化物的水化物(氢氧化物)的碱性强 弱 c. 单质的还原性的强弱 非金属性强弱判断 a.单质与氢气化合生成气态氢化物的难易程度以 a.单质与氢气化合生成气态氢化物的难易程度以 及气态氢化物的稳定性 b.最高价氧化物的水化物 最高价氧化物的水化物( b.最高价氧化物的水化物(酸)的酸性强弱 c.单质的氧化性的强弱 c.单质的氧化性的强弱
金太阳新课标资源网
练习 下列各表中的数字代表的是原子序数, 1.下列各表中的数字代表的是原子序数,表 中数字所表示的元素与它们在元素周期表中 的位置相符的是( 的位置相符的是( )D
金太阳新课标资源网
2、同周期X、Y、Z三种元素,已知最高价氧化 、同周期 、 、 三种元素 三种元素, 物的水化物的酸性: 物的水化物的酸性:H3XO4<H2YO4<HZO4,则下 列判断正确的是( ) D 列判断正确的是 A、非金属性强弱为:X>Y>Z 、非金属性强弱为: B、气态氢化物的稳定性由强到弱为 、Y、Z 、气态氢化物的稳定性由强到弱为X、 、 C、原子半径大小是:X<Y<Z 、原子半径大小是: D、对应阴离子的还原性按 、Y、Z顺序减弱 、对应阴离子的还原性按X、 、 顺序减弱
金太阳新课标资源网
族
16个 16个 18个纵行 个纵行) (共18个纵行)
A. 原子序数=核电核数=质子数=核外电子数 原子序数=核电核数=质子数= B. 周期序数=原子核外电子层数 周期序数= C. 主族序数=原子的最外层电子数=元素最高价数 主族序数=原子的最外层电子数=
金太阳新课标资源网
- 6、具有相同电子结构的三种微粒Xm+、Ym-、 、具有相同电子结构的三种微粒 + Z ,下列分析不正确的是 ( ) A.最外层电子数:X>Y>Z .最外层电子数: + B.微粒半径: Ym- > Xm+ .微粒半径: - C.Z一定是一种稀有气体元素的原子 . 一定是一种稀有气体元素的原子 D.原子半径的关系是 .原子半径的关系是X>Y
金太阳新课标资源网
7、 X、Y、Z为短周期三种元素,已知 、 、 、 为短周期三种元素 已知X 为短周期三种元素,
同周期, 和 同主族 同主族, 和Y同周期,Y和Z同主族,又知三种元素原 同周期 子最外层电子数总和为14, 子最外层电子数总和为 ,而质子数总和为 D 28,则三种元素为( ) ,则三种元素为( (A)N、P、O ) 、 、 (B)N、C、Si ) 、 、 (C)B、Mg、Al ) 、 、 (D)C、N、P ) 、 、
⑷“位置,结构,性质” 位置,结构,性质” 三者之间的关系: 三者之间的关系:
原子结构
金太阳新课标资源网
决定 反映
元素性质决ຫໍສະໝຸດ 反映反映 决定元素在表中位置
a. 原子结构决定元素在元素周期表中的位置 b. 原子结构决定元素的化学性质 c. 以位置推测原子结构和元素性质
金太阳新课标资源网
金太阳新课标资源网
4.元素周期表和元素周期律的指导作用 元素周期表和元素周期律的指导作用
⑴周期表中金属性、非金属性之间没有严格的界线。 周期表中金属性、非金属性之间没有严格的界线。 在分界线附近的元素具有金属性又具有非金属性。 在分界线附近的元素具有金属性又具有非金属性。 金属性最强的在周期表的左下角是,Cs; ⑵金属性最强的在周期表的左下角是,Cs;非金属 性最强的在周期表的右上角, 性最强的在周期表的右上角,是F。 微粒半径大小的比较规律: ⑶微粒半径大小的比较规律: a. 原子与原子 b. 原子与其离子 c. 电子层结构相同的离子 d. 电子层结构不同的离子
⑸元素周期表的意义和作用: 元素周期表的意义和作用: ①科学预言新元素及预测它们的原子结构和性 质。 ②可在周期表中一定的区域内寻找工农业生产 的新的物质。 的新的物质。 ③可以借助元素周期表研究合成有特定性质的 新物质。半导体材料、催化剂和耐高温、 新物质。半导体材料、催化剂和耐高温、耐腐 蚀的合金材料。 蚀的合金材料。
金太阳新课标资源网
周期 ⅠA 族
ⅡA
ⅢA
ⅣA
ⅤA
ⅥA
ⅦA 非
1 2 3 4 5 6 7
半 径 由 小 变 大 金 属 性 逐 渐 增 强 B Al Si Ge As Sb Te Po At
金 属 性 逐 渐 增 强
金太阳新课标资源网
再见
金太阳新课标资源网
1、元素周期表的结构 周期 周期表
短周期: 短周期:3个(第1、2、3周期) 周期) 长周期: 周期, 长周期:4个(第4、5、6、周期, 7个 七个横行) 其中第7周期为不完全周期) (七个横行) 其中第7周期为不完全周期) 主族7 主族7个:ⅠA-ⅦA ⅠA副族7 副族7个:IB-ⅦB IB第Ⅷ族1个(3个纵行) 个纵行) 零族( 零族(1个)稀有气体元素
金太阳新课标资源网
3.指出原子序数为5、17、20、35的元素的位 指出原子序数为5 17、20、35的元素的位 置在哪里?(用周期和族表示) ?(用周期和族表示 置在哪里?(用周期和族表示) 4. 下列各组原子序数表示的两种元素 , 能形 . 下列各组原子序数表示的两种元素, 型离子化合物的是( 成AB2型离子化合物的是 A) A.12和17 和 C.11和17 和 B.13和16 和 D.6和8 和
金太阳新课标资源网
8、元素周期表在指导科学研究和生产实 践方面具有十分重要的意义, 践方面具有十分重要的意义,请将下表中 两栏描述的内容对应起来。 A、B两栏描述的内容对应起来。
A
①制半导体的 元素 ②制催化剂的 元素 ③制耐高温、 耐腐蚀合金材 料元素 ④制冷剂的元 素 ⑤地壳中含量 较多的元素
金太阳新课标资源网
(2)元素周期表
元素周期表是元素周期律的具体表现形式, 元素周期表是元素周期律的具体表现形式,它 元素周期律的具体表现形式 元素之间相互联系的规律。 反映了元素之间相互联系的规律 反映了元素之间相互联系的规律。 根据元素周期律,把现在已知的一百多种元素 根据元素周期律, 元素周期律 电子层数相同的各种元素按核电荷数递增的 中,电子层数相同的各种元素按核电荷数递增的 顺序从左到右排成横行;再把不同横行中最外层 从左到右排成横行 顺序从左到右排成横行;再把不同横行中最外层 电子数相同的元素按电子层数递增的顺序由上而 相同的元素按电子层数递增的顺序 电子数相同的元素按电子层数递增的顺序由上而 排成纵行,这样得到的一个表, 下排成纵行,这样得到的一个表,叫做元素周期 表。
