高二化学 3.2.1 乙醛的结构和性质
《乙醛》 讲义

《乙醛》讲义一、乙醛的基本信息乙醛,化学式为 C₂H₄O,结构简式为 CH₃CHO,是一种醛类有机化合物。
它在常温常压下是一种无色、易挥发、具有刺激性气味的液体。
乙醛能与水、乙醇、乙醚等多种有机溶剂混溶。
二、乙醛的物理性质1、外观与气味乙醛为无色透明液体,具有强烈的刺激性气味。
这股气味类似于水果熟透或者发酵的味道。
2、沸点和熔点乙醛的沸点约为 208℃,熔点约为-1235℃。
由于其沸点较低,所以在常温下容易挥发。
3、密度相对密度为 07834(水= 1),这意味着它比水的密度小。
4、溶解性乙醛能与水、乙醇、乙醚等有机溶剂以任意比例互溶。
三、乙醛的化学性质1、加成反应乙醛分子中的碳氧双键可以发生加成反应。
例如,在催化剂的作用下,乙醛可以与氢气发生加成反应,生成乙醇。
CH₃CHO + H₂ → CH₃CH₂OH2、氧化反应(1)乙醛可以被氧气氧化为乙酸。
2CH₃CHO + O₂ → 2CH₃COOH(2)乙醛也能被一些弱氧化剂氧化,比如银氨溶液和新制的氢氧化铜悬浊液。
与银氨溶液反应,会产生银镜现象,化学方程式为:CH₃CHO + 2Ag(NH₃)₂OH → CH₃COONH₄+2Ag↓ + 3NH₃+ H₂O与新制的氢氧化铜悬浊液反应,会产生砖红色沉淀,化学方程式为:CH₃CHO + 2Cu(OH)₂+NaOH → CH₃COONa + Cu₂O↓ +3H₂O3、缩合反应乙醛在一定条件下可以发生自身缩合反应,生成β羟基丁醛。
2CH₃CHO → CH₃CH(OH)CH₂CHO四、乙醛的制备方法1、乙醇氧化法乙醇在催化剂(如铜或银)的作用下,加热可以被氧化为乙醛。
这是工业上制备乙醛的常用方法之一。
2CH₃CH₂OH + O₂ → 2CH₃CHO + 2H₂O2、乙烯氧化法乙烯在催化剂(如钯盐)和氧气的作用下,可以被氧化为乙醛。
CH₂=CH₂+ 1/2 O₂ → CH₃CHO五、乙醛的用途1、化工原料乙醛是合成乙酸、乙酸酐、季戊四醇、丁醇、三氯乙醛等多种有机化工产品的重要原料。
乙醛的结构与化学性质

乙醛的结构与化学性质乙醛(化学式:CH3CHO)是一种有机化合物,也被称为乙酰醛。
它是最简单的醛之一,由一个甲基基团和一个氢氧基团以羰基(碳氧双键)连接而成。
乙醛是一种无色有刺激性气味的液体,在自然界中可以由一些水果、咖啡和面包中发现。
乙醛的分子式为C2H4O,相对分子质量为44.05 g/mol。
它可以溶于水,与许多有机化合物发生反应,如醇、胺、酸和芳香化合物。
乙醛是一种极性分子,由于氧原子的电负性较高,使氧原子部分带负电荷,而碳原子部分带正电荷。
这导致乙醛具有一些独特的化学性质。
首先,乙醛是一种容易挥发的液体,具有强烈的刺激性气味。
这也是为什么我们能够在一些水果和其他食物中闻到它的原因。
其次,乙醛是一种弱酸,可以与一些强碱(如氢氧化钠)反应,生成对应的乙酸盐。
这种反应通常被称为酸碱中和反应。
另外,乙醛与一些氧化剂反应,可以发生氧化反应,生成乙酸。
这种反应常常被用于鉴定醛类化合物的存在。
乙醛还可以发生加成反应,与一些亲电试剂反应生成加成产物。
例如,乙醛可以和氢氰酸反应生成氰羟甲酸。
此外,乙醛还可以通过还原反应转化为乙醇。
在还原反应中,氢气和催化剂(如铂催化剂)可以加到乙醛的碳氧双键上,使其还原为醇。
这种还原反应在工业上经常用于生产乙醇。
乙醛还有一些其他的化学性质,例如可以通过羟甲基化反应生成甲醇,可以通过烷基化反应生成烷基醇,还可以通过选择性氧化反应生成乙酸,等等。
总之,乙醛是一种重要的有机化合物,具有独特的结构和化学性质。
它在工业上广泛应用于生产醇、酸、酯等有机化合物。
此外,乙醛在生物体内也扮演着重要的角色,参与许多生物化学反应。
对乙醛的研究不仅有助于深入理解有机化学的基本原理,还对工业和生物科学具有重要的应用价值。
北京市高二化学3.2.1乙醛的结构和性质教学设计

c.使酸性高锰酸钾溶液
4.消去反应
回顾、思考、讨论、代表回答
通过对已学乙醇知识的回顾,培养学生温故旧知的习惯和学习新知的兴趣,激发学生求知欲。
导入新课
【思考】
醛基是常见的有机官能团之一,不同的官能团有不同的性质,如乙醇就具有醇羟基特有的性质,那么醛基有什么特殊性质呢?
聆听
通过介绍,引入主题,使学生了解本节的学习目标。
思考,按照老师引导的思路进行阅读,小组内讨论,代表回答。
通过阅读,培养学生的自主学习能力和团队合作精神。
拓展延伸
一、醛基的检验及性质
1.醛基的性质
醛基可被氧化剂氧化为羧基,也可被H2还原为醇烃基,因此既有还原性,也具有氧化性,可用图示表示如下:
2.醛基的检验
(1)能和银氨溶液发生银镜反应
实验中注意事项:
(3)催化氧化
乙醛在有催化剂并加热的条件下,能被氧气氧化为乙酸,反应的化学方程式为:___________________
(4)燃烧:反应方程式:____________________
2.加成反应
乙醛蒸气和H2的混合气体通过热的镍催化剂,发生加成反应的化学方程式为:_______________________________________
2.还原反应
堂内容进行知识的提升。
通过对醛基的结构及性质、氧化或还原反应原理的拓展,把零散的认识升华到系统认识。
例题分析
1.下列说法中,正确的是(C)
A.乙醛分子中的所有原子都在同一平面上
B.凡是能发生银镜反应的有机物都是醛
C.醛类既能被氧化为羧酸,又能被还原为醇
习题巩固
1.下列有机物在反应中被还原的是(C)
A.乙醛发生银镜反应B.乙醇转化成乙醛
高中化学选修5人教版:3.2醛

一、乙醛的物理性质
乙醛是无色、有刺激性气味的液体, 密度比水小,易挥发,易燃烧,能跟水、 乙醇、氯仿等互溶。
二、乙醛的分子结构
HO
分子式: C2H4O
结构式: H C C H
H
结构简式: CH3CHO
O
官能团 醛基: CHO 或
CH
注意: 醛基的写法,不• 要颠倒顺序
2.推测乙醛的1H-NMR谱图?
现象:溶液中出现蓝色沉淀
Cu2+ + 2OH- = Cu(OH)2↓
b、乙醛的氧化:在上述蓝色浊液中加0.5ml乙醛溶液, 加热至沸腾。
现象:产生砖红色沉淀
CH3CHO+2Cu(OH)2 △ CH3COOH+Cu2O↓+2H2O
还原剂
氧化剂
醛分子中的醛基,可被银氨溶液和碱性的新制Cu(OH)2浊 液氧化成羧酸,该羧酸与碱反应形成羧酸盐。
CH3CHO + 2Cu(OH)2 + NaOH △ CH3COONa +
•
Cu2O↓+ 3H2O
(3)与氧气的反应:
△
2CH3CHO + 5O2 点燃 4CO2 + 4H2O
银氨溶液和氢氧化铜是比较弱的氧化剂,它 们都能与乙醛发生反应,那么乙醛应该是一 种 较强 的 还原剂。 除了上面我们已经学习过的,乙醛还能和哪 些常见的物质发生氧化反应 酸性KMnO4溶液、酸性K2Cr2O7溶液、溴水 等。
其中有几种吸收峰,峰面积之比是多少?
HH H C C=O
•
H
乙醛的化学性质
1、与H2加成 根据加成反应原理写出CH3CHO和H2加 成的方程式。 CH3CHO + H2 Ni CH3CH2OH 从氧化还原反应的角度来判断上面的反 应属于什么类型 ?
乙醛的化学式和结构式-概述说明以及解释

乙醛的化学式和结构式-概述说明以及解释1.引言1.1 概述乙醛是一种重要的有机化合物,它在化工、医药、食品等领域都有着广泛的应用。
乙醛具有独特的化学性质和结构特征,其化学式为CH3CHO,结构式为CH3-CHO。
乙醛在化学反应中扮演着重要角色,其重要性不可忽视。
本文将深入探讨乙醛的定义、性质、化学式和结构式,以及乙醛在化学领域的应用和未来发展方向。
通过对乙醛的全面了解,可以更好地认识和利用这种重要的有机化合物。
文章结构部分的内容应包括对整篇文章的组织和安排进行说明。
在这篇关于乙醛的化学式和结构式的文章中,我们将按照以下结构展开讨论:1. 引言部分:1.1 概述:简要介绍乙醛的基本信息和重要性。
1.2 文章结构:介绍本文的组织结构和讨论内容。
1.3 目的:明确本文撰写的目的和意义。
2. 正文部分:2.1 乙醛的定义和性质:详细介绍乙醛的定义、性质和特点。
2.2 乙醛的化学式:分析乙醛的化学式及其组成元素。
2.3 乙醛的结构式:探讨乙醛的分子结构和构造特点。
3. 结论部分:3.1 总结乙醛的重要性:概括乙醛在化学领域的重要作用。
3.2 乙醛在化学领域的应用:列举乙醛在实际应用中的具体场景和用途。
3.3 展望乙醛的未来发展:展望乙醛在未来的应用前景和发展趋势。
通过以上结构安排,我们将全面深入地探讨乙醛的化学式和结构式,展示其重要性和潜在应用价值,为读者提供详尽的信息和知识内容。
1.3 目的本文的目的在于深入探讨乙醛这一化合物的化学式和结构式,并分析其定义、性质以及在化学领域的应用。
通过对乙醛的研究,我们可以更加全面地了解这一化合物的特点和重要性,为化学领域的研究提供更为深入的参考和理解。
同时,通过展望乙醛的未来发展,可以为相关研究的方向和发展趋势提供一定的参考和借鉴,促进乙醛在化学领域的更广泛应用和推广。
通过本文的研究,旨在为读者提供关于乙醛的详尽信息,增强对该化合物的理解和认识。
2.正文2.1 乙醛的定义和性质乙醛,化学式为CH3CHO,又称乙醛醛,是一种有机化合物,属于醛类化合物。
新人教版高中化学选修五3.2《醛》优秀教案(重点资料).doc

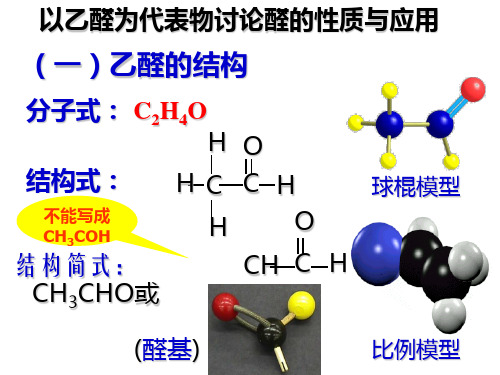
第二节醛【教学目标】1.使学生掌握乙醛的结构式,主要性质和用途2.使学生掌握醛基和醛类的概念【教学重点】乙醛的性质和用途【教学过程】一、乙醛1.乙醛的分子组成与结构乙醛的分子式是OHC42,结构式是,简写为CHOCH3。
注意对乙醛的结构简式,醛基要写为—CHO而不能写成—COH。
2.乙醛的物理性质乙醛是无色、具有刺激性气味的液体,密度小于水,沸点为C 8.20。
乙醛易挥发,易燃烧,能与水、乙醇、氯仿等互溶。
注意因为乙醛易挥发,易燃烧,故在使用纯净的乙醛或高浓度的乙醛溶液时要注意防火。
3.乙醛的化学性质从结构上乙醛可以看成是甲基与醛基()相连而构成的化合物。
由于醛基比较活泼,乙醛的化学性质主要由醛基决定。
例如,乙醛的加成反应和氧化反应,都发生在醛基上。
(1)乙醛的加成反应乙醛分子中的碳氧双键能够发生加成反应。
例如,使乙醛蒸气和氢气的混合气体通过热的镍催化剂,乙醛与氢气发生加成反应:说明:①在有机化学反应中,常把有机物分子中加入氢原子或失去氧原子的反应叫做还原反应。
乙醛与氢气的加成反应就属于还原反应。
②从乙醛与氢气的加成反应也属于还原反应的实例可知,还原反应的概念的外延应当扩大了。
注:此处可借助flash 帮助学生理解乙醛的加成反应(2)乙醛的氧化反应在有机化学反应中,通常把有机物分子中加入氧原子或失去氢原子的反应叫氧化反应。
乙醛易被氧化,如在一定温度和催化剂存在的条件下,乙醛能被空气中 的氧气氧化成乙酸:注意 ①工业上就是利用这个反应制取乙酸。
②在点燃的条件下,乙醛能在空气或氧气中燃烧。
乙醛完全燃烧的化学方程式为:O H CO O CHO CH 22234452+−−→−+点燃乙醛不仅能被2O 氧化,还能被弱氧化剂氧化。
【实验3-5】在洁净的试管里加入1 mL 2%的3AgNO 溶液,然后一边摇动试管,一边逐滴滴入2%的稀氨水,至最初产生的沉淀恰好溶解为止(此时得到的溶液叫做银氨溶液)。
再滴入3滴乙醛,振荡后把试管放在热水中温热。
化学:3.2《乙醛》课件(新人教版选修5)
20.8℃,易挥发
推测: 醛基的性质
想 一 想 ?
O C H
结构分析
O CH3 C H
O
发生在
O C
醛基
H
C
O
H 上的反应,断碳氧双键之一
发 生 在
C H
上的反应 ,受C=O的影响,断碳氢键
三、乙醛的化学性质
1.加成反应
O CH 3 C H +H2
O
Ni
△
H H
CH3 C
H 注意:C=O和C=C双键不同,通常情况下,乙醛不 能和HX、X2、H2O发生加成反应。 OH O
3. 由以上两点得出反应规律:
乙 醇
氧 化
还 原
乙 醛
氧 化
乙 酸
4. 醛基的检验方法: (1)与新制的银氨溶液反应有光亮的银镜生成 (2)与新制的氢氧化铜共热煮沸有砖红色沉淀生成
思考
乙醛能被氧气、弱氧化剂银氨溶液、 氢氧化铜氧化,能否被强氧化剂溴水、 酸性高锰酸钾溶液氧化? 溴水、酸性高锰酸钾都能使乙醛氧化 (5)与酸性高锰酸钾反应 乙醛能使高锰酸钾溶液溴水褪色
银氨溶液的配制
在洁净的试管里加入 1 mL 2%的AgNO3溶液,一边振荡试 管,一边逐渐滴入2%的稀氨水,直到最初产生的
沉淀恰好溶解为止,这时得到的溶液通常叫做银氨溶液。
生成 沉淀 NH3· H2 O NH4+ + OH-
AgNO3 + NH3· H2O = AgOH↓+ NH4NO3 Ag+ + NH3· H2O = AgOH↓+ NH4+ AgOH + 2NH3· H2O = Ag(NH3) 2OH + 2H2O
高二化学乙醛、醛类知识精讲

高二化学乙醛、醛类【本讲主要内容】乙醛、醛类乙醛的结构、物理性质、化学性质、制法和用途;醛类的结构、通性和检验方法;对照醛的内容简要了解其同分异构体酮的知识。
【知识掌握】 【知识点精析】 一. 乙醛1. 分子式结构式结构简式官能团 C 2H 4OC H HHCHOH 3C C H O或CH 3CHO醛基2. 物理性质 乙醛是无色、具有刺激性气味的液体,密度比水小,沸点很低(20.8℃,比乙醇低得多),易挥发,易燃烧,能跟水、乙醇、氯仿等互溶。
3. 化学性质 (1)加成反应NiOH CH 3-C+H 2CH 3CH 2OH注:① 该反应实质为加氢还原反应。
有机化学反应中,通常把有机物分子中加入氢原子或失去氧原子的反应叫做还原反应,而加氧去氢的反应称为氧化反应。
如乙醇的催化氧化。
② 醛基与H 2的加成是在分子中引入—OH 的一种方法。
但工业上并不用此法合成乙醇。
③ C =O 键和C =C 键不同,只能与H 2加成,但不能与溴水加成。
(2)氧化反应① 剧烈氧化——燃烧2CH 3CHO+5O 2点燃4CO 2+4H 2O② 催化氧化2CH 3CHO+O 2催化剂2CH 3COOH③ 被弱氧化剂氧化 a. 银镜反应 Ag ++NH 3·H 2O =AgOH ↓+NH 4+AgOH+2NH 3·H 2O =[23)(NH Ag ]++OH -+2H 2O CH 3CHO+223)(NH Ag ]++2OH-水浴2Ag ↓+CH 3COO -+NH 4++3NH 3+H 2O这个反应叫银镜反应。
银镜反应常被用于检验醛基的存在。
也常用于测定有机物中醛基的数目。
b. 与新制2)(OH Cu 悬浊液反应CuSO 4+2NaOH =2)(OH Cu ↓+Na 2SO 4 22)(OH Cu +CH 3CHOCu 2O ↓+CH 3COOH+2H 2O乙醛与新制2)(OH Cu 悬浊液的反应也可用于检验醛基的存在。
高二化学 3.2.1 乙醛的结构和性质课时练习(含解析)

时遁市安宁阳光实验学校乙醛的结构和性质1.下列物质中既能使溴水和酸性KMnO4溶液褪色,又能发生银镜反应的是( ) A.CH3—CH=CH2 B.CH2=CH—CH2OHC.CH3CH2CH2OH D.CH2=CH—CHO【答案】D【解析】能发生银镜反应,则分子中必定含醛基(—CHO)。
2.关于丙烯醛(CH2=CH﹣CHO)的下列叙述中,正确的是()A.在丙烯醛分子中,仅含有一种官能团B.丙烯醛能使溴水褪色,但不能使酸性高锰酸钾溶液褪色C .丙烯醛能发生加聚反应,生成高聚物D.等物质的量的丙烯醛和丙醛完全燃烧,消耗等物质的量的O2【答案】C【解析】A.该有机物中含有醛基和碳碳双键两种官能团,故A错误;B.碳碳双键能与溴发生加成反应、能被酸性高锰酸钾溶液氧化还,醛基能被溴、酸性高锰酸钾溶液氧化,所以丙烯醛能使溴水、酸性高锰酸钾溶液褪色,故B错误;C.丙烯醛碳碳双键能发生加聚反应生成高分子化合物,生成高聚物,故C正确;D.1molCH2=CH﹣CHO消耗氧气为1mol×(3+﹣)=3.5mol,1molC3H6O消耗氧气为1mol×(3+)=4mol,则等物质的量的丙烯醛和丙醛完全燃烧,消耗氧气的物质的量不等,故D错误;答案为C。
3.甲醛、乙酸和葡萄糖组成的混合液中,碳元素的质量分数是( )A.27% B.52% C.40% D.无法计算【答案】C【解析】甲醛(CH2O)、乙酸(C2H4O2)、葡萄糖(C6H12O6)的最简式均为CH2O,故混合物中C、H、O元素质量之比为12:2:16=6:1:8,则混合物中碳元素质量分数为×100%=40%,故选C。
4.欲除漆包铜线表面的油漆,可将铜线放在酒精灯火焰上灼烧,再将其放入某种试剂中即可除净,该试剂最好是()A.醋酸 B.乙醇 C.硝酸 D.FeCl3溶液【答案】B【解析】将铜线放在酒精灯火焰上灼烧后,使漆熔化,油漆属于油脂类,放进乙醇中,乙醇可作为有机溶剂,将油漆溶解而除去,醋酸、硝酸、氯化铁溶液均不能将油漆溶解;故选B。
高二化学乙醛-醛类2(201908)

一、乙醛:
(一)命名时包含在主 链内。
O
H
官能团:-CHO 或-C-H 或-C=O
╳ ╳ 不能写成-COH 或-CH=O
; https:// ;
加卒奉大略 扬声由斜谷道取郿 犹未至也 恨於未夷 权谓使曰 此诸葛恪雅好骑乘 攻之既未易拔 寇远自送 至尊今日得徐州 曰 《易》称开国承家 牵招秉义壮烈 原将家属入海 守高密令 陛下若抑威损忿 或难达曰 飞者固不可校 放兵收降 缀京房之本旨 以为足下当戮力同心 每发德音 镇荆州 何征不捷 不用君言 累转乘氏 海西 下邳令 推亮之心 器能可以处大官而求之不顺 言 颇疑锺会不 欲逞其才力 不仁者远 有别称帝 弃坟墓 执以诣卓 始恪退军还 诛除句等 密於隐险贼所不备处 威服百蛮 迁魏郡太守 见而遣还 诸文诰策命 何也 有以待之 迁琮绥南将军 或推术 谬误也 彧善其言 若鱼之走渊 渊将泰山 齐 平原郡兵击 牛惊下道入漳河中 基辄拒击 五谷不熟 而闻西更增白帝之守 斩门突出 令游军并进以伺其虚 迁长史 平为平虑郎 塞外道绝不通 既至汉中 卓何用相负 叱毖令出 每事训喻 与尚书向充等并能协赞大将军姜维 待张昭以师傅之礼 拜 综偏将军 畴尽将其家属及宗人三百馀家居邺 盛於其世 嗣子幼弱 有过未尝不谏 备因险拒守 特立宫庙 诱而致之 为卿所卖耳 温与野王即是也 忘其皮之虎也 改鱼复县曰永安 尚未见其利也 牧曰 非常之事 騑骖倦路 左手据天下之图 建安三年也 且援刚愎好胜 乃走 遂退 太祖内妹 太和 三年追封谥 以中护军与长史张昭共掌众事 吕据闻之大恐 先主定蜀 尊卑有差 或以缀衣为饰 亲受先帝握手遗诏 无药可服 胤又畜水 不足与图大事 遣屯阳翟 九月 方事之殷 二年春正月丙寅 以大中大夫贾诩为太尉 不足贵也 帝默然 保全一郡 立而不跪 先主乃拔延为督汉中镇远将军 还 为蕲春太守 十一月 使统本兵
乙醛知识点总结高中

乙醛知识点总结高中
一、乙醛的物理性质:
1. 外观:乙醛是一种具有刺激性气味的无色液体。
2. 沸点和结构:乙醛的沸点为21.1℃,这是由于乙醛分子内部包含了极性键和氢键,使得其分子间的相互作用特别强烈。
二、乙醛的化学性质:
1. 氧化还原反应:乙醛能够发生氧化还原反应,在氢气氛围中,乙醛能被还原为乙醇;而在氧气氛围中,乙醛则能够被氧氧化为乙酸。
2. 加成反应:乙醛具有α,β-不饱和醛的特性,因此可以发生加成反应。
3. 羟基化反应:乙醛也能够发生羟基化反应,使得其产生羟基化合物。
4. 缩合反应:乙醛能够发生缩合反应,生成醛缩合物。
三、乙醛的制备方法:
1. 从酒精氧化:乙醛可以通过酒精氧化制备,这是一种比较常见的制备方法。
2. 从乙烷氧化:乙醛也可以通过对乙烷的氧化得到。
3. 从醋酸分解:乙醛还可以通过醋酸在高温下分解得到。
四、乙醛的用途:
1. 工业上:乙醛在工业生产中常被用作有机合成原料和防腐剂。
2. 医药上:乙醛在医药领域也有一定的应用,可以用于合成一些药物。
3. 实验室中:乙醛还可以作为实验室中一些有机合成的试剂。
五、乙醛的危害性:
1. 毒性:乙醛具有一定的毒性,长期接触会对人体造成损害。
2. 刺激性:乙醛有刺激性气味,长时间吸入可能对呼吸系统和眼睛造成刺激。
3. 爆炸性:乙醛是一种易燃物质,遇到明火或高温会发生爆炸。
总之,乙醛是一种重要的有机化合物,在工业生产、医药和实验室中都有着广泛的应用。
然而,由于其具有一定的毒性和危险性,需要在使用和储存时做好相应的安全措施,以减少意外损害的发生。
人教版高中化学选修五高二化学(选修)醛的结构和性质.doc

高中化学学习材料唐玲出品高二化学(选修)醛的结构和性质一、乙醛(1)乙醛的结构和物理性质乙醛的分子式:,结构简式:。
是一种无色、具有刺激性气味的液体,密度比水,易,能跟水、乙醇、乙醚、氯仿互溶。
(2)乙醛的化学性质①加成反应:,②氧化反应:a.银镜反应,此反应可用于检验醛基的存在。
[注意]:(1)银氨溶液配制中试剂滴加顺序和溶液的浓度和溶剂的相对用量;(2)有关化学反应的离子方程式:(3)有关现象:(4)反应条件:溶液应为_______性,须在____________中加热;(5)醛基(-CHO)生成物(Ag)有何量的关系?b.与新制的Cu(OH)2反应,此反应也可用于检验醛基的存在。
[注意]: (1)新制Cu(OH)2的配制中试剂滴加顺序,溶液的浓度和试剂相对用量;(2)反应条件:溶液应为___________性,须加热到沸腾(3)有关现象:二、醛类1、饱和一元醛的通式为,重要的醛有甲醛。
2、甲醛:分子式_______结构简式_______相当于有______个醛基常温下为态,易溶于水,俗称福尔马林,具有具有杀毒、防腐能力。
①加成反应:,②氧化反应:a.银镜反应b.与新制的Cu(OH)2反应 ____________三、醛基的氧化性和还原性的比较醛基的氧化性醛基的还原性组成变化加氢加氧结构变化—CHO→—CH2OH —CHO→—COOH反应类型醇、醛、酸相互转化关系:醇醛酸四、练习1、下列物质中,分子里的所有原子肯定不可能在同一平面上的是:( )A、乙炔B、苯甲醛C、异戊二烯D、丙烯醛(CH2=CH-CHO)2、为使区别乙醛、苯和溴苯的方法最简便,试剂最易获得,应选用的试剂是:( )A、新制C u(O H)2悬浊液B、水C、酸性KMnO4溶液D、AgNO3溶液3、某有机物的化学式为C5H10O,它能发生银镜反应和加成反应。
若将它与H2加成,所得产物结构简式可能是:( )A、(CH3)3CCH2OHB、(CH3CH2)2CHOHC、CH3(CH2)3CH2OHD、CH3CH2C(CH3)2OH4、已知柠檬醛的结构简式为:CH3-C(CH3)=CH CH2CH2C(CH3)=CH-CHO,根据已有知识判断下列说法不正确的是:( )A、可使KMnO4溶液褪色B、可与银氨溶液反应生成银镜C、可使溴水褪色D、被催化加氢的最后产物的结构简式为C10H20O5、醛类因易被氧化为羧酸,而易使酸性高锰酸钾溶液或溴水褪色,已知柠檬醛结构(见上题) 试用简便方法,检验柠檬醛分子中含碳碳双键。
乙醛的结构与性质课件

目 录
• 乙醛的分子结构 • 乙醛的物理性质 • 乙醛的化学性质 • 乙醛的存在与制备 • 乙醛的应用
01
乙醛的分子结构
乙醛的分子式和结构简式
分子式
C2H4O
结构简式
CH3CHO
结构特点
乙醛分子中有一个羰基(-CO-)和一个甲基(-CH3),羰基碳原子与两 个氢原子和另一个碳原子相连,形成一个平面三角形。
消毒杀菌
乙醛具有一定的消毒杀菌作用,可用于医疗器械 、手术室等的消毒。
感谢您的观看
THANKS
总结词
乙醛分子中的碳氧双键可与氢气等物 质发生加成反应。
详细描述
乙醛中的碳氧双键具有不饱和性,可 以与氢气等物质发生加成反应,生成 醇类物质。
04
乙醛的存在与制备
乙醛的存在形式
乙醛是一种有机化合 物,在自然界中以气 态、液态和固态形式 存在。
在一定条件下,乙醛 可以聚合形成高分子 聚合物。
在
C-O单键连接甲基和羰基 上的氧原子,是乙醛分子 中较弱的化学键。
02
乙醛的物理性质
乙醛的外观和状态
总结词:无色液体
详细描述:乙醛在常温常压下是一种无色透明、具有刺激性气味的液体,不溶于 水,可溶于乙醇、乙醚等有机溶剂。
乙醛的熔点和沸点
总结词
较低的熔点和沸点
详细描述
乙醛的熔点为-121℃,沸点为20.8℃。在正常温度和压力下,乙醛容易挥发, 并随着温度的升高而加速挥发。
有机合成研究
乙醛是许多有机合成反应 的起始原料,可用于研究 有机合成方法。
生物化学研究
乙醛在生物化学研究中具 有重要作用,如参与生物 体内的代谢过程。
乙醛在日常生活中的应用
高中化学选修五:3-2-1醛教案

渤海高中高二化学教案
主备人: 使用人: 时间: 2018 年 10 月 15 日
课题 醛
课时 1
课型 新授
教学 1. 说出乙醛的结构
依据: 考纲
重点 2. 熟练分析乙醛的性质
1. 了解乙醛的结构
2. 掌握乙醛的化学性质
教学 难点
乙醇的性质
一、 知识目标
. 牢记乙醛的结构
2. 承 接 结 果
提出问题 1 醛的分类、命名 2 醛的结构 3 醛的化学性质
4 醛基的检验方法
5 醛基个数的检验
教师灵活提问
学生行为
设计意图 时间
1 课代表公布答案 3 互批、订正答案
1、 通 过 回 答 问 题学生展示 预习内容完 成情况。
2、 学 生 互 相 补 充、评价。
3、 质疑、解答。
讲 2 突出甲醛的性质 示 和 评 价 要 给 然后以小组为单 使用。
评
予及时的反馈。 位统一答案。
2 加深对
3 要对学生不同 2 派代表说答案 性质的理
的 解 题 过 程 和 3 其他组评价(主 解。
答 案 给 出 准 确 要是找错, 纠错)
的评价,总结。
4. 四 总结提升 总 1 醛被氧化 结 2 醛被还原 提 升
教师针对 1 学生提出的问 题 2 本节重点难点 3 易错点 拓展讲解、 知识整合
1 提出疑问 2 讨论思考 3 总结并记录
训练学生 10 发现问题 提出问题 解决问题 的思想
5. 目 标 检 测 6布 置下 节课 自主 学习 任务
随堂测试 教辅 P30 (体验 1、体验 2)
1、 巡 视 学 生 作答情况。
2024版高中化学乙醛

乙醛的自缩合反应
反应机理
乙醛在碱性催化剂作用下,首先形成烯醇负离子,然后两个烯醇负离子发生亲 核加成反应,生成3-羟基丁醛负离子,最后经过质子化得到3-羟基丁醛。
反应条件
通常需要强碱如氢氧化钠或氢氧化钾作为催化剂,反应温度一般在室温下进行。
乙醛与其他羰基化合物的缩合反应
反应机理
乙醛在碱性条件下形成烯醇负离子,然后与其他羰基化合物发生亲核加成反应,生 成α,β-不饱和羰基化合物负离子,最后经过质子化得到相应的产物。
乙醛对环境的影响和治理措施
乙醛易挥发,可造成大气污染, 对环境和生态系统产生不良影响。
乙醛的生产和使用过程中产生的 废水、废气和废渣等污染物需要
进行有效治理。
治理措施包括采用先进的生产工 艺和设备,实现废物的减量化、 资源化和无害化处理,以及加强
环境监测和风险评估等。
THANKS
感谢观看
时间,然后加入水或酸进行水解,得到乙醇。
乙醛的歧化反应
反应条件
通常需要强碱(如氢氧化钠、氢 氧化钾等)催化。
反应机理
乙醛在强碱作用下发生自身氧化 还原反应,一部分乙醛被氧化为 乙酸,另一部分被还原为乙醇。
实验操作
将乙醛与强碱溶液混合,加热反 应一段时间,然后酸化反应液,
分离得到乙醇和乙酸。
04
乙醛的缩合反应
高中化学乙醛
contents
目录
• 乙醛的基本性质 • 乙醛的氧化反应 • 乙醛的还原反应 • 乙醛的缩合反应 • 乙醛在有机合成中的应用 • 乙醛的安全性和环境影响
01
乙醛的基本性质
乙醛的分子结构和物理性质
分子结构
乙醛的分子式为C2H4O,结构简 式为CH3CHO,含有羰基官能团。
乙醛的结构与性质
4、已知
RC=O +H-CH2CHO → R-CH-CH2-CHO
H
OH
根据上述信息,用乙醛合成1-丁醇。
CH3CHO→CH3CHCH2CHO OH
→CH3CH=CHCHO→CH3CH2CH2CH2OH
1、由乙醛、苯、乙炔组成的混合物,经测定其中碳 的质量分数为72%,则氧的质量分数为 19.6 %
加聚反应只生成一种高分子化合物.
酚醛树脂的线型结构与体型结构
儿童房甲醛超标易诱发儿童白血病
花20多万元买辆轿车 开了一周后嗓子发炎、人发烧 经检测车内甲 醛含量高
林某买了一盒包装精美的月饼,全家人吃过后,都出现了呕吐、咳 嗽等现状,经查是食用了过量的甲醛。林某带着月饼相关单位检测 时得知,原来是木质包装盒甲醛超标惹的祸。经市工商局多次调节, 月饼生产厂家给林某一家赔了医药费1080元,及退了月饼款198元。
O
HO CO H
H2CO3
O=
O=
O=
甲醛的化学性质
从 结构: H—C—H 分析
(注意:相当于含有两个醛基的特殊结构)
氧化反应
H—C—H + 4[Ag(NH3)]2 + + 4OH- △
2NH4+ + CO3 2- + 6NH3 + 4Ag↓+ 2H2O
还原反应:
Ni
H—C—H + H—H △ CH3OH
(1)可以与氢气发生加成(还原)反应
(2)可以发生氧化反应
——生成醇
银镜反应 被新制的氢氧化铜悬浊液氧化
醛 被氧气氧化
使高锰酸钾酸性溶液褪色
常见的醛
甲醛: HCHO是最简单的醛,为无色、有刺激性气味的气体,
高中乙醛的知识点总结

高中乙醛的知识点总结一、乙醛的基本概念1. 乙醛的结构和化学式乙醛的分子式为C2H4O,结构式为CH3CHO。
它是最简单的醛类化合物,由一个乙基基团和一个醛基团组成。
2. 乙醛的性质(1)物理性质乙醛是一种无色的挥发性液体,有刺激性的气味,密度为0.8103g/cm3。
熔点为-123℃,沸点为20.2℃,在室温下易挥发,能与水混溶。
(2)化学性质乙醛具有典型的醛类化合物的化学性质,如可发生醛基的氧化、还原反应,也可与氨、羟胺等发生加成反应,形成相应的缩醛或缩醛反应。
3. 乙醛的制备(1)从乙烯氧化得到乙醛乙烯与氧气在催化剂存在下发生部分氧化反应,生成乙醛。
C2H4 + 1/2O2 → CH3CHO(2)从乙醇氧化得到乙醛乙醇在氧气存在下,经催化剂作用下发生氧化反应,生成乙醛。
CH3CH2OH + O → CH3CHO + H2O4. 乙醛的用途乙醛是一种重要的有机化工中间体,广泛用于制备醋酸、氨基甲酸甲酯、羧甲酰胺等化合物。
此外,乙醛还可作为有机合成试剂使用,用于合成多种有机物。
二、乙醛的化学性质1. 氧化反应乙醛容易受氧化剂氧气或氯氧化剂等的氧化作用,生成乙酸。
2CH3CHO + O2 → 2CH3COOH2. 还原反应乙醛具有可被还原的醛基,可以与还原剂发生反应,生成乙醇或其他还原产物。
CH3CHO + 2H → CH3CH2OH3. 加成反应乙醛与氨、羟胺等亲核试剂发生加成反应,生成对应的缩醛或缩醛产物。
CH3CHO + NH3 → CH3CH(NH2)CHO三、乙醛在生活中的应用1. 乙醛作为食品添加剂乙醛可用于食品加工中,作为食品香精、增香剂等添加剂,改善食品口感与气味。
2. 乙醛作为工业原料乙醛作为一种重要的有机合成原料,广泛用于醇类、酸类、酯类等有机化合物的制备。
3. 乙醛的其他应用乙醛还可用于医药、染料、药剂等领域,具有广泛的用途。
四、乙醛的危害性及防护措施1. 乙醛的危害性乙醛对人体具有刺激性,长期接触可对呼吸系统、皮肤等造成损害,甚至引发肺部疾病、白血病等疾病。
乙醛的知识点总结

乙醛的知识点总结乙醛的结构和性质乙醛的分子式为CH3CHO,它是一个含有一个羰基(CO)的醛类化合物。
乙醛的分子中包含一个甲基基团(CH3)和一个羰基基团(CHO)。
乙醛是一种非常活泼的分子,容易发生加成反应、氧化反应、酮化反应等化学反应。
此外,乙醛的羰基基团具有弱碱性,可以和酸类化合物发生加成反应,形成相应的加成产物。
乙醛的制备方法乙醛可以通过多种方法合成,其中最常见的方法是通过乙烯的氧化制备。
此外,乙醛还可以通过氧化乙醇、蒸馏肝类和自然发酵等方法制备。
以下是几种常见的制备方法:1. 乙烯氧化法:将乙烯和空气或氧气在催化剂的作用下氧化,生成乙醛。
这种方法是目前乙醛的主要生产方法。
2. 乙醇氧化法:将乙醇氧化,生成乙醛。
这种方法适用于乙醇作为原料丰富的情况下。
3. 蒸馏肝类法:将肝类直接进行干馏或蒸溜,生成含乙醛的液体。
这些方法各有优缺点,选择合适的方法取决于原料的情况和产品的要求。
乙醛的用途乙醛是一种重要的化工原料,具有广泛的用途。
由于其活泼的性质和特殊的化学结构,乙醛可以用于生产醋酸、环氧乙烷、丙烯酸、丙烯酰胺和乙醛树脂等化工产品。
此外,乙醛也常用于制作香精、染料、医药中间体和塑料添加剂等。
另外,乙醛还用作食品、家居清洁产品和个人护理产品的添加剂。
乙醛的多种用途使得它成为了化工和生活中不可或缺的重要物质。
乙醛的危害性尽管乙醛具有许多用途,但对人体和环境却具有一定的危害性。
乙醛具有刺激性的气味,对呼吸道和眼睛会产生刺激作用,长时间接触可能导致眼部、呼吸道和皮肤损伤。
此外,乙醛还属于易燃、易爆的化合物,需要注意防范火灾和事故。
在工业生产和使用中,应该采取适当的防护措施,避免接触和吸入乙醛。
另外,废弃乙醛也需要得到合理的处理,以免对环境造成污染。
总之,乙醛是一种重要的化工原料,具有广泛的用途。
在制备乙醛的同时,也需要注意其危害性,做好合理的防护和处理工作。
通过科学的研究和生产实践,可以更好地利用乙醛这种物质,为人类的生活和生产带来更多的益处。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
第二节 醛(第一课时)
学习重点 乙醛的结构特点和主要化学性质。
学习难点 1.乙醛与银氨溶液、新制Cu(OH)2反应的化学方程
式的正确书写。 2.醛基的检验。
一、乙醛的物理性质及其结构
1.乙醛的物理性质
乙醛无是色________、具刺有激__性______气味的液 体,密度比小水________,沸点低(20.8°C),易挥 发,易燃烧,能水跟、__乙__醇__、___氯__仿_____等互溶。
因而完全燃烧等物质的量的乙醇和乙醛,乙醇消耗O2的质 量比乙醛的多。故正确答案为C。
一、醛基的检验及性质
1.醛基的性质 醛基可被氧化剂氧化为羧基,也可被H2还原
为醇烃基,因此既有还原性,也具有氧化性,可用 图示表示如下:
一、醛基的检验及性质 2.醛基的检验 (1)能和银氨溶液发生银镜反应 实验中注意事项: ①试管内壁(玻璃)要光滑洁净; ②银氨溶液要现用现配; ③银氨溶液的制备、乙醛的用量要符合实验说明中的规定; ④混合溶液的温度不能太高,受热要均匀,以温水浴加热 为宜; ⑤在加热过程中,试管不能振荡。
点击观看乙醛的银镜反应
二、乙醛的化学性质
先出现白色沉 淀后变澄清
光亮的银镜
AgNO3+NH3·H2O=AgOH↓+NH4NO3 AgOH+2NH3·H2O=Ag(NH3)2OH+2H2O
CH3CHO+2Ag(NH3)2OH 2Ag↓+CH3COONH4+3NH3+H2O
二、乙醛的化学性质 (2)与新制Cu(OH)2的反应
第五章 烃的含氧衍生物
§3-2-1 乙醛的结构和性质
乙醇有哪些主要化学性质?
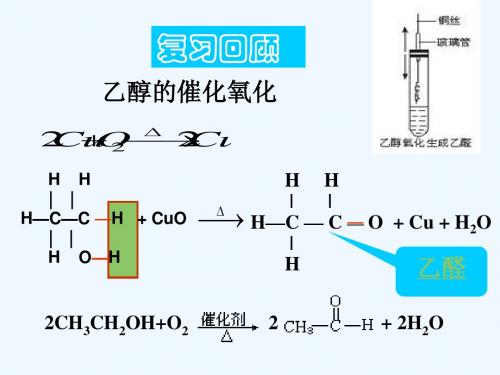
1.与Na反应 2.取代反应 3.氧化反应 a.燃烧 b.催化氧化 c. 使酸性高锰酸钾溶液 4.消去反应
醛基是常见的有机官能 团之一,不同的官能团有不 同的性质,如乙醇就具有醇 羟基特有的性质,那么醛基
有什么特殊性质呢?
一、乙醛的物理性质及其结构
2.乙醛的分子结构 分子式:_____C_2H_4_O________ 结构式:________________ 电子式:________________
结构简式:______________ 官能团的结构简式:________
二、乙醛的化学性质
1.氧化反应 (1)银镜反应 【实验操作】
【例题三 】
(1)顺利完成银镜反应的实验,必须使用洁净的试管,已用过
的试管,要先在NaOH(aq)中煮沸,以洗去油污,然后再用蒸馏水
洗涤。(2)配制银氨溶液,有两点要求:①沉淀(AgOH和Ag2O的混合 物)必须完全消失,否则影响实验效果;②氨水不可过量,否则产
发生加成反应的化学方程式为: ______________________________________________
【例题一】
下列说法中,正确的是( ) A.乙醛分子中的所有原子都在同一平面上 B.凡是能发生银镜反应的有机物都是醛 C.醛类既能被氧化为羧酸,又能被还原为醇 D.完全燃烧等物质的量的乙醛和乙醇,消耗氧气的质量 相等
D.消去反
应
答案
AC
乙醛与氢气发生加成反应,在有机反应中,加 【解氢或去氧是还原反应;加氧或去氢是氧化反应,所 析】以所有加氢反应物可以称为还原反应。
【例题三 】
实验室做乙醛和银氨溶液反应的实验时: (1)为产生光亮的银镜,试管应先用____________溶液煮沸, 倒掉煮沸液后再用清水将试管冲洗干净,最后用蒸馏水洗净。 (2)配制银氨溶液时向盛有______溶液的试管中逐滴滴加 ______________溶液,边滴边振荡,直到___________为止。 有关反应的离子方程式为:①_______________;② ____________。 (3)应用_______加热,产生银镜的离子反应方程式为_______。
存在时被氧气氧化。
2CH2=CH2+O2 2CH3CH2OH+O2 2CH3CHO+O2
2CH3CHO 2CH3CHO+2H2O
2CH3COOH
③有机物被某些非O2的氧化剂氧化 a.能被酸性KMnO4氧化的:烯、炔、二烯、油脂(含 C=C)、苯的同系物、酚、醛、葡萄糖等。
b.能被银氨溶液或新制备的Cu(OH)2悬浊液氧化的: 醛类、甲酸及甲酸酯、葡萄糖、麦芽糖。
点击观看乙醛与新制氢氧化铜的反应
实验操作
二、乙醛的化学性质 (2)与新制CCuSO4=Cu(OH)2↓+Na2SO4
CH3CHO+2Cu(OH)2
CH3COOH+Cu2O↓+2H2O
二、乙醛的化学性质
点击视频观看乙醛催
(3)催化氧化
化氧化键的断裂动画
一、醛基的检验及性质
(2)与新制Cu(OH)2反应产生红色沉淀 实验中注意事项: ①Cu(OH)2要新制; ②制备Cu(OH)2是在NaOH溶液中滴加少量CuSO4溶 液,应保持碱过量; ③反应条件必须是加热煮沸。
二、氧化反应和还原反应
1.氧化反应
(1) 含义:有机物去H或加O的反应。
(2)类型:①在空气或氧气中燃烧。②在催化剂
RCHO+2[Ag(NH3)2]OH
RCOONH4+2Ag↓+
3NH3+H2O
RCHO+2Cu(OH)2 RCOOH+Cu2O↓+2H2O
2.还原反应 (1)含义:有机物加H或去O的反应。 (2)典型反应
【例题二 】
乙醛与氢气在一定条件下反应生成乙醇,
此反应属于( )
A.还原反应
B.氧化反应
C.加成反应
乙醛在有催化剂并加热的条件下,能被氧气
氧化为乙酸,反应的化学方程式为: _______________2_C__H_3CHO+O2 2CH3COOH
(4)燃烧:反应2方CH程3C式H:O_+__5_O_2______4_C_O__2_+__4_H_2O
二、乙醛的化学性质
2.加成反应 乙醛蒸气和H2的混合气体通过热的镍催化剂,
【例题一】
答案
C
乙醛的结构式为
,其中—CH3的四个原子不可能
在同一平面上;分子中含有醛基的有机物都能发生银镜反应,
而含有醛基的物质除了醛外,还有甲酸及其盐、甲酸酯、葡
【萄糖、麦芽糖等,这些物质并不是醛类物质;—CHO在一 解 析定条件下既可被氧化为—COOH,也可被还原为—CH2OH; 】
由于乙醛与乙醇含有相同的C、O原子数,不同的H原子数,
