醋酸钠过饱和溶液之结晶共61页
醋酸钠

中文名: 醋酸钠;三水醋酸钠英文名: Sodium acetate trihydrate别名: Acetic acid sodium salt trihydrate 分子结构:分子式: C2H3NaO2.3(H2O)分子量: 136.08物理化学性质熔点:58ºC水溶性:762G/L(20ºC)安全信息安全说明: S24/25:防止皮肤和眼睛接触。
其他信息产品应用:醋酸钠(6131-90-4)的用途:一般用于印染、制药、摄影、电镀等,也用作酯化剂、防腐剂、缓冲剂、呈味剂、增香剂、pH值调节剂。
可用来表演水中抓冰魔术。
作为调味料的缓冲剂,可缓和不良气味并防止变色。
改善风味时使用0.1%~0.3%。
具有一定的防霉作用,如使用0.1%~0.3%于鱼肉糜制品及面包。
亦可用作调味酱、酸菜、蛋黄酱、鱼糕、香肠、面包、年糕等的酸味剂。
与甲基纤维素、磷酸盐等混合,用于提高香肠、面包、年糕等的保存性。
生产方法及其他:醋酸钠(6131-90-4)的制备方法:将含量15%的醋酸溶液160kg投入反应釜中。
在搅拌下加入25kg纯碱。
中和至pH值为8,充分搅拌得醋酸钠水溶液。
加热浓缩至27℃Be'冷却结晶,离心脱水得粗品。
用水重结晶后得精品。
离心脱水,干燥得成品。
产品规格:指标名称指标含量/% 99~100.5氯化物(Cl-)/% 0.001磷酸盐(Po2-4)/% 0.0002镁/% 0.0002钙/% 0.0002水不溶物/% 0.002硫酸盐(SO2-4)/% 0.005重金属/% 0.0005铝/% 0.0005铁/% 0.0002醋酸钠(6131-90-4)的过饱和现象:用品:烧杯、玻棒、酒精灯、滤纸、平底烧瓶、石棉网。
醋酸钠晶体、硫代硫酸钠晶体、蒸馏水。
步骤:①醋酸钠过饱和溶液的制备500 毫升烧杯中加入250 克未潮解的醋酸钠晶体和150 毫升蒸馏水,用微火加热,不断搅拌,使其完全溶解。
化工单元操作项目8结晶任务1认识结晶3课件

量无水乙醇洗涤产品,抽滤。将产品转移至干净的表面皿上,
用吸水纸吸干,称量,计算收率(回收母液)。
项目8 结晶 / 任务1 认识结晶
《化工单元操作》第16页,共19页。
任务实施
任务导入
任务描述
任务目标
相关知识
任务实施
任务评价
知识拓展
提 纯 硫 酸 铜
硫酸铜与硝酸铜的溶解度
温度(K)
273 293 313 333 353 373
项目8 结晶 / 任务1 认识结晶
《化工单元操作》 第8页,共19页。
相关知识
任务导入
任务描述
任务目标
相关知识
任务实施
任务评价
知识拓展
二、重结晶
1.溶解度 物质溶解性的大小用溶解度来表示。在一定温度下,某种物质在100g水(或其它溶 剂)里达到饱和状态时所溶解的克数,叫做这种物质的溶解度。
2.过饱和溶液 并不是所有盐类的饱和溶液在冷却后都能自发地把多余的溶质分离出来。例如,当把硫酸钠、硫代硫 酸钠、醋酸钠和醋酸铅等饱和溶液小心谨慎地、不加摇动地冷却,结果是多余的溶质仍然能保留在溶 液中,并不分离出来,在这时候,溶液中所含溶质的量,已经超过它的溶解度,这样的溶液,叫做过 饱和溶液。
1.出勤情况 2.遵章守纪 3.主动学习 4.完成作业 5.独立探究问题
1.考勤表 2.学生及教师观察 3.课堂笔记 4.课前准备 5.个人或小组作业
1.信息搜集与加工 2.分工协作 3.观点表达 4.理解沟通
1.乐于请教和帮助同学 2.小组活动协调和谐 3.协作教师教学管理 4.学生及教师观察
1.创新思维 2.创新技能
五水硫酸铜 23.1 32.0 44.6 61.8 83.8 114.0
醋酸钠和硫酸铜结晶

醋酸钠和硫酸铜结晶一、引言醋酸钠和硫酸铜是常见的化学试剂,它们可以通过结晶的方式制备纯度较高的产物。
本文将详细介绍醋酸钠和硫酸铜结晶的实验方法及其原理。
二、实验材料1. 醋酸钠2. 硫酸铜3. 蒸馏水4. 醋酸5. 滤纸6. 烧杯、三角漏斗、玻璃棒等实验器材。
三、实验步骤1. 醋酸钠结晶实验步骤:(1)将适量的蒸馏水倒入烧杯中,加入少量的醋酸,搅拌均匀。
(2)将适量的醋酸钠加入溶液中,搅拌均匀至完全溶解。
(3)将溶液缓慢地加热至沸腾,持续加热直至大部分水分蒸发掉。
(4)将烧杯取出并放置于冷却器中,等待结晶。
(5)用滤纸过滤溶液,并将产物洗净。
(6)将产物放置于干燥器中,待其完全干燥后称重。
2. 硫酸铜结晶实验步骤:(1)将适量的蒸馏水倒入烧杯中,加入少量的硫酸铜,搅拌均匀。
(2)将溶液缓慢地加热至沸腾,持续加热直至大部分水分蒸发掉。
(3)将烧杯取出并放置于冷却器中,等待结晶。
(4)用滤纸过滤溶液,并将产物洗净。
(5)将产物放置于干燥器中,待其完全干燥后称重。
四、实验原理1. 醋酸钠结晶原理:醋酸钠在水中易溶解,在加热的过程中随着水分的蒸发浓度不断增加,当浓度达到一定程度时就会开始结晶。
由于醋酸钠在水中的溶解度随温度升高而增大,在冷却过程中结晶速率会相应提高。
通过这种方式可以制备出纯度较高的醋酸钠晶体。
2. 硫酸铜结晶原理:硫酸铜在水中易溶解,加热时水分蒸发,浓度逐渐增大,当浓度达到一定程度时就会开始结晶。
硫酸铜的结晶速率与温度、搅拌等因素有关。
通过这种方式可以制备出纯度较高的硫酸铜晶体。
五、实验注意事项1. 实验过程中应注意安全,避免接触化学试剂。
2. 在加热过程中应注意火源控制以及烧杯的稳定性。
3. 结晶过程中应尽量避免振动和搅拌,以免影响结晶速率和产物的纯度。
4. 在称重前应确保产物完全干燥,以减少误差。
六、实验结果分析通过实验可以得出醋酸钠和硫酸铜的结晶方法,并得到相应的产物。
通过称重可以计算出产物的收率,并通过比较实验前后颜色、形态等特征来判断产物的纯度。
太空冰雪实验用文字记录

太空冰雪实验用文字记录
实验的原理很简单,即过饱和乙酸钠溶液结晶。
在温度80度左右时,醋酸钠在水中的大量溶解至饱和。
静待过饱和乙酸钠溶液冷却到40℃以下就会形成过饱和溶液。
它非常不稳定,一旦遇到结晶核,晶体就会立即从结晶核开始向外生长,生成的物质是三水合醋酸钠,有点像冰。
因为结晶过程中会有热量放出,所以航天员说这里的“冰球”其实是一个“热球”。
这个实验又叫做“热冰实验”,非常有名。
在一定温度下,向一定量溶剂里加入某种溶质,当溶质不能继续溶解时,所得到的溶液叫做这种溶质的饱和溶液;还能继续溶解的溶液,叫做这种溶质的不饱和溶液。
大家都知道,只有溶液达到饱和状态,才会出现结晶沉淀。
如果溶液未达到饱和状态,它会继续溶解,不会结晶。
地面上受重力影响,液体从杯子底部开始往上结晶。
在太空失重环境下,像漫天飞雪一样,液体的四面八方都结晶。
在杯子边缘和空中等,每个方位,每个有水的地方,都有出现结晶的现象。
而且,这种结晶会比地面上的更为舒展。
堆积起来的晶体会像雪花一样落下来,浪漫壮观。
三年级实验作文300字滴水成冰

三年级实验作文300字滴水成冰
“终于成功了!”你可能要问:“什么成功了?”那就是我做得有趣的小实验“滴水成冰”。
大家一定很想知道这个有趣的小实验是怎么做的吧!别着急,我来告诉大家。
我们先准备要用的材料:醋酸钠结晶、塑料滴管、碗、100度开水、自封袋、取样勺和搅拌棒。
我先用取样勺将醋酸钠结晶装到自封袋中,再往碗中倒入100度开水,然后我小心翼翼地把自封袋中的醋酸钠结晶放进开水中,用搅拌棒往下压。
刚开始,先是一些结晶,一些溶液,后来就完全是溶液了。
这个步骤一定要把自封袋封紧。
最后,我全神贯注地用滴管取了一点醋酸钠结晶,轻轻伸入冷却的醋酸钠溶液中,仔细观察。
可是,这次实验好像并不成功,我愁眉苦脸地看着无动于衷的溶液想:会不会因为水冷了,才没有成功呢?于是,我把它放进微波炉里加热,重新搅拌。
等待许久后,醋酸钠溶液像一朵朵小花一样,慢慢绽开,变成了冰条。
这是为什么呢?原来,醋酸钠结晶遇到高温会溶解成醋酸钠过饱和溶液,暂时处于亚稳态,当受到某些刺激,则此状态会失去平衡,过多的溶质就会结晶,恢复成一个适合此时温度的平衡状态。
做实验太有趣了,以后,我也要当一名伟大的科学家。
结晶醋酸钠无水醋酸钠

结晶醋酸钠无水醋酸钠标题:结晶醋酸钠无水醋酸钠:化学反应的奇妙之旅导言:当谈论化学反应时,醋酸钠和无水醋酸钠这两个物质常常被提及。
它们在实验室和工业中都广泛应用,具有重要的化学性质和用途。
本文将深入探讨结晶醋酸钠无水醋酸钠的形成、性质以及其在实际应用中的价值。
一、结晶醋酸钠无水醋酸钠的形成1. 结晶醋酸钠的制备过程结晶醋酸钠是由醋酸和钠碱反应得到的,反应过程通常是通过将醋酸与碳酸钠相互作用,生成乙酸钠和二氧化碳的反应进行的。
在这个过程中,乙酸钠会与周围的水分子结合形成水合物,形成晶体。
2. 结晶醋酸钠无水醋酸钠的制备过程在结晶醋酸钠的基础上,通过去除结晶醋酸钠中结合的水分子,即可得到无水醋酸钠。
这个过程通常是通过加热结晶醋酸钠晶体或在低湿度环境中处理结晶醋酸钠来完成的。
二、结晶醋酸钠无水醋酸钠的性质1. 结晶醋酸钠的化学性质结晶醋酸钠是一种无色结晶体,具有强烈的吸湿性和可溶性。
它在水中溶解后,会完全离解为醋酸根离子和钠离子。
结晶醋酸钠也可以与其他物质发生反应,产生不同的化学变化。
2. 无水醋酸钠的化学性质无水醋酸钠是一种无色晶体,相较于结晶醋酸钠,其吸湿性更低,并且在加热或在低湿度环境中更加稳定。
它可以被水分子吸附,重新转变为结晶醋酸钠。
三、结晶醋酸钠无水醋酸钠的应用领域1. 实验室应用结晶醋酸钠无水醋酸钠常用于实验室中作为干燥剂,用于吸附空气中的水分。
这对于某些实验来说至关重要,因为它们需要在干燥的环境中进行。
2. 工业应用结晶醋酸钠无水醋酸钠在工业上也具有广泛的应用。
在纤维和纺织品工业中,它被作为染料、助剂或脱色剂使用。
在制造乙酸纤维、制药和油漆等领域也发挥重要作用。
个人见解:结晶醋酸钠无水醋酸钠作为常用的化学物质,在实验室和工业中的重要性不可忽视。
它们的制备过程和特性使其具备了多种应用的潜力。
然而,我们在使用这些物质时,也需要注意其吸湿性和化学性质,确保安全使用。
为了更好地发挥结晶醋酸钠无水醋酸钠的应用潜力,我们还可以进一步研究其与其他物质的反应及其在不同领域的新应用。
《化学反应进行的方向》实验设计--过饱和乙酸钠溶液的结晶

二、实验试剂、j士栏与现象 试剂:无水己酸钠、蘸馏水 仪器:烧杯、玻璃棒、酒精灯、石棉网,托盘天平、锥形瓶、探针式电子温度41 步鹱:(1)片j烧杯盘取50mL燕馏水,称取1209无水已酸钠加入水中搅拌溶解。 (2)持续加热烧杯中的过饱和溶液,不断搅拌使乙酸钠进步溶解。 (3)待乙酸钠不再溶解形成过饱和溶液时t停止加热并将L层清液转移至锥形瓶中. 冷却。
120一套集电解饱和食盐水与氢氯电池为一体的实验装置
淮南市第十五中学 、实验目的:l、高效学习原电池、电解池原理 2、搛究电解饱和食盐水室际实验现象的原因 胡波
二、实验仪器及试剂:具支0塑管(1个)、带铁夹的铁架台(1个)、穿有铅笔芯的腔塞(2
个)、带鳄鱼是的导线(2条)、学生电源(1台)、PH试纸、镊子、酚酞溶液、注射器和透 明胶(或气球和橡皮筋) .、实验仪器装置削及仪器的组装说明: 1实验装置图
[1]李昌华.符斌实用化学手册,北京:化学工业出版社,2006:296
[2]傅献彩,沈文霞,姚天扬物理化学(第四版上册)北京:高等教育出版社,1990:260
【3JJⅢG
2005:1269
Speight
Lange‘s HarIdbook ofChemistry(Sixteenth Edition)MCGRAW—HILL
(4)待溶液冷去至室温时.将溶液缓缓倾倒在少许己酸钠晶体上,溶液迅速结品,}运
新堆积形成塔状晶体。 (5)使用探针式电子温度计测量结晶前后温度的变化。 实验现象:将过饱和乙酸钠溶液缓缓倾倒在少许乙酸钠晶体上,倒出的};莩液不会如液体 状叫处流淌,而迅速在乙酸钠晶体j‘结晶。随着逐渐倾倒过饱和溶液,乙酸钠晶体呈塔状并 逐渐堆#{增高,其现象类似十熔化后的石蜡液体倒出井遇冷迅速凝固。用探针式温度计测量 结晶后的温度,可由室温(约20℃)上升至50℃ 左右。如无温度计,也町直接触觉感受此自发过程明显爿温。 参考文献
过饱和乙酸钠结晶原理吸热

过饱和乙酸钠结晶原理吸热引言结晶是化学实验中经常使用的过程之一。
乙酸钠是一种常用的试剂,在实验中可以使用过饱和乙酸钠水溶液进行结晶。
过饱和乙酸钠水溶液在结晶过程中会发生吸热现象,本文将详细探讨这一现象的原理。
过饱和乙酸钠的制备1. 直接在水中加入多余量的乙酸钠,加热至完全溶解,然后冷却至室温。
在这个过程中,乙酸钠在过饱和状态下,当然这需要保证环境保持在恒定条件。
2. 将稀溶液无限蒸发,以达到过饱和状态。
这两种方法都可以制备出过饱和乙酸钠水溶液。
当乙酸钠在过饱和状态下,它容易通过晶核形成结晶。
过饱和乙酸钠溶液中的乙酸钠分子之间的互相作用应为吸引作用,这意味着它们趋向于粘在一起。
这个过程需要克服一定的势垒才能开始,称之为晶核形成。
晶核形成时需要消耗一定的热量,也就是发生吸热现象。
过饱和乙酸钠在结晶过程中,由于溶液中的乙酸钠分子热运动而产生的扰动,导致溶液中的某些分子先聚集成微小颗粒而形成晶核,进而导致中心核心逐渐长大,形成了结晶固体。
显然,这个过程需要克服晶体表面和母液之间的物理吸引作用,它们需要先克服表面张力,然后才能脱离母液而成长。
由于结晶的生长需要克服表面张力和母液间的物理相互作用力,因此需要从母液中吸收一些能量来推动这个过程。
在结晶的过程中,固体晶体的维度不断增加,它们需要从周围环境中吸收更多的热量以满足其结晶过程中逐渐变大的需求。
这些因素都会导致结晶过程中产生的吸热现象。
实验中检测吸热现象可以将过饱和乙酸钠水溶液放在热量计中,然后缓慢加热至结晶温度。
在过程中,如果呈现出显著的吸热现象,则说明结晶过程中确实有能量被消耗了。
当溶液中出现晶体接触时,晶体会继续长大,此过程还会进一步放热,在实验中可以观察到热释放的现象。
结论过饱和乙酸钠在结晶过程中,会发生吸热现象。
这是由晶核形成时需要克服一定的势垒,以及结晶固体生长需要克服表面张力和母液间的物理相互作用力,以及晶体的维度逐渐增大需要吸收更多热量所导致的。
2022年高考北京卷化学高考真题(解析版)

2022年高考北京卷化学高考真题一、单选题1.2022年3月神舟十三号航天员在中国空间站进行了“天宫课堂”授课活动。
其中太空“冰雪实验”演示了过饱和醋酸钠溶液的结晶现象。
下列说法不正确的是A.醋酸钠是强电解质B.醋酸钠晶体与冰都是离子晶体>C.常温下,醋酸钠溶液的pH7D.该溶液中加入少量醋酸钠固体可以促进醋酸钠晶体析出【答案】B【详解】A.醋酸钠在水溶液中能完全电离,醋酸钠是强电解质,故A正确;B.醋酸钠晶体是离子晶体,冰是分子晶体,故B错误;>,故C正确;C.醋酸钠是强碱弱酸盐,常温下,醋酸钠溶液的pH7D.过饱和醋酸钠溶液处于亚稳态,加入少量醋酸钠固体可以促进醋酸钠晶体析出,形成饱和溶液,故D正确;选B。
2.下列化学用语或图示表达不正确的是≡A.乙炔的结构简式:HC CHB.顺2--丁烯的分子结构模型:C.基态Si原子的价层电子的轨道表示式:Na O的电子式:D.22【答案】C≡,A项正确;【详解】A.乙炔中含有碳碳三键,其结构简式为HC CHB.顺2--丁烯中两个甲基位于双键同侧,其结构模型为,B项正确;C.基态Si原子的价层电子排布式为3s23p2,其轨道表示式为,C项错误;D .22Na O 是离子化合物,其电子式为,D 项正确;答案选C 。
3.38Sr (锶)的87Sr 、86Sr 稳定同位素在同一地域土壤中8786Sr /Sr 值不变。
土壤生物中8786Sr /Sr 值与土壤中8786Sr /Sr 值有效相关。
测定土壤生物中8786Sr /Sr 值可进行产地溯源。
下列说法不正确的是A .Sr 位于元素周期表中第六周期、第ⅡA 族B .可用质谱法区分87Sr 和86SrC .87Sr 和86Sr 含有的中子数分别为49和48D .同一地域产出的同种土壤生物中8786Sr /Sr 值相同4.下列方程式与所给事实不相符的是A .加热3NaHCO 固体,产生无色气体:32322Δ2NaHCO Na CO H O CO ++↑B .过量铁粉与稀硝酸反应,产生无色气体:-+3+32Fe+NO +4H =Fe +NO +2H O↑C .苯酚钠溶液中通入2CO ,出现白色浑浊:D .乙醇、乙酸和浓硫酸混合加热,产生有香味的油状液体:Δ3233232CH CH OH+CH COOH CH COOCH CH +H Oƒ浓硫酸【详解】A .碳酸氢钠受热之后分解生成碳酸钠、水和二氧化碳,A 正确;B .过量的铁粉与稀硝酸反应,应该生成Fe 2+,B 错误;C.苯酚钠溶液中通入二氧化碳利用强酸制取弱酸生成苯酚和碳酸氢钠,C正确;D .乙醇和乙酸在浓硫酸混合加热的条件下发生酯化反应产生有香味的油状液体乙酸乙酯和水,D 正确;故选B 。
结晶醋酸钠合成方程式

结晶醋酸钠合成方程式结晶醋酸钠是一种无机化合物,化学式为NaC2H3O2·3H2O。
它主要由醋酸与钠氢氧化物反应经过结晶过程得到。
下面将重点介绍结晶醋酸钠的合成方程式,并详细解释合成的步骤和原理。
结晶醋酸钠的合成反应方程式如下:NaOH + CH3COOH → NaCH3COO + H2O此方程式描述了醋酸与钠氢氧化物发生反应,生成结晶醋酸钠和水。
反应中,醋酸(CH3COOH)与钠氢氧化物(NaOH)在适当的反应条件下进行反应,产生结晶醋酸钠(NaCH3COO)和水(H2O)。
此反应是一种酸碱中和反应。
结晶醋酸钠的合成步骤如下:1.准备实验室用具和试剂。
首先,需要准备醋酸、氢氧化钠、蒸馏水、玻璃器皿、磁力搅拌器和热源等实验室用具和试剂。
同时,确保实验操作符合安全规范。
2.配制反应溶液。
向适量的蒸馏水中慢慢加入醋酸,搅拌至完全溶解。
然后,在另一个容器中加入适量的蒸馏水,并慢慢加入氢氧化钠固体,搅拌至完全溶解。
3.缓慢将醋酸溶液倒入氢氧化钠溶液中,同时加热。
在此过程中,需要缓慢倒入醋酸溶液,以避免剧烈反应和产生大量气体。
同时,通过加热反应溶液可以加快反应速度。
4.持续搅拌和加热。
在醋酸与氢氧化钠反应的过程中,持续搅拌反应溶液,并保持适当的加热温度,以促使反应进行。
5.结晶过程。
在反应结束后,将反应溶液冷却到室温,结晶醋酸钠会逐渐析出并形成结晶。
可以适当调整溶剂的浓度、冷却速度和温度等参数,以控制结晶的质量和形态。
6.分离与收集结晶。
经过结晶过程后,可以使用过滤、洗涤等方式将结晶醋酸钠分离出来。
然后,将结晶醋酸钠进行干燥,得到最终的产物。
需要注意的是,合成结晶醋酸钠时应注意安全,并遵循实验操作规范。
由于化学实验操作存在一定的风险性,建议在专业人士指导下进行。
总结:结晶醋酸钠的合成方程式描述了醋酸和氢氧化钠进行酸碱中和反应的过程。
通过适当的实验步骤和操作,可以合成出纯度较高的结晶醋酸钠。
掌握相应的实验技术和安全规范,是进行结晶醋酸钠合成实验的关键。
醋酸钠

量体积称重算密度(比重)---不同浓度的HAC对应不同的比重!结晶醋酸钠标准:操作变因:醋酸钠溶液的温度T(℃)应变变因:醋酸钠的最大溶解M(克)T(℃)21.5 26.0 30.0 34.5 40.5 49.5 50.5M(克)20.01 32.62 35.04 38.07 42.1 47.13 66.34乙酸钠产品名称:醋酸钠乙酸钠(俗名醋酸钠)CA登记号:6131-90-4英文名:Sodium acetate trihydrate别名:乙酸钠;结晶醋酸钠分子式:CH3COONa·3H2O用途:用于印染、制药、摄影、电镀等,也用作酯化剂、防腐剂等分子量:82.03PH(50g/L,25℃):7.5~9.0化学品描述:无色无味的结晶体,在空气中可被风化,可燃。
溶于水和乙醚,微溶于乙醇。
123℃时失去结晶水密度:1.45克/厘米3,无水物的密度1.528克/厘米3三水醋酸钠的熔点:58℃无水醋酸钠的熔点324℃。
自燃点:607.2℃用途:用作有机合成的酯化剂以及摄影药品、医药、印染媒染剂、缓冲剂、化学试剂、肉类防腐、颜料、鞣革等许多方面。
可用于制取各种化工产品,如呋喃丙烯酸、醋酸酯和氯乙酸等。
该品作为调味料的缓冲剂,可缓和不良气味并防止变色,具有一定的防霉作用。
亦可用作调味酱、酸菜、蛋黄酱、鱼糕、香肠、面包、粘糕等的酸味剂。
与甲基纤维素、磷酸盐等混合,用于提高香肠、面包、粘糕等的保存性制法:由醋酸钙与纯碱进行复分解反应,变为醋酸钠,将反应液浓缩至26°Be,加活性炭脱色,然后进行冷却结晶,离心分离即得成品。
当需获得无水醋酸钠时,将结晶醋酸钠再重新熔化,真空吸滤,将母液结晶放在不锈钢槽中冷却,然后再离心、吸滤、甩干后,用电加热法使晶体脱水,干燥,即得无水品。
也可用醋酸和苛性钠直接反应生成醋酸钠。
英文名: Sodium acetate分子式: CH3COONa·3H2O物理性质:本产品为无色或白色晶体,暴露于潮湿空气中易潮解于干燥空气中易风化.比重1.45,熔点58度,在123摄氏度时失去结晶水,变为无水醋酸钠。
趣味实验:“热冰”及其原理

趣味实验:“热冰”及其原理一般情况下,水在凝固点0℃时能凝固成冰,那么热水也能结冰吗?央视财经频道《是真的吗》栏目曾报道“手能迅速把液体变固体”一则传闻,热心的网友们与栏目组互动求证,并实地验证了实验的可行性,我们在家里可完成瞬间能凝结成“热冰”的趣味实验,设计如下“热冰”实验简单方案,观察实验现象将观赏性与趣味性融于一体。
【实验用品】酒精灯、温度计、铝箔纸、石棉网、铁架台、滴管、量筒、大烧杯、锥形瓶、玻璃棒、表面皿、天平(砝码);实验药剂有:无水乙酸钠(醋酸钠)、蒸馏水。
【做一做】:⑴将10mL蒸馏水倒入干净的烧杯中(用蒸馏水多次清洗),放置于石棉网上持续加热,避免温度下降太多,但不要沸腾;⑵待1~2分钟后,将约100g乙酸钠(醋酸钠)晶体加入烧杯中,并持续搅拌溶解至不能溶解为止,上层澄清的溶液即饱和的乙酸钠溶液。
⑶将上层澄清的乙酸钠饱和溶液倒入外层套有铝箔纸的干净锥形瓶中,铝箔纸的作用是防止有异物的掺入,并放置温度计,在置于冰箱或冰浴中冷却,待温度降至40℃以下,可进行如下两项有趣的实验操作;⑷图甲实验:小心将澄清的溶液倒入干净的表面皿中,然后用手或玻璃棒轻轻碰触溶液表面,这时可观察到乙酸钠溶液,由接触点扩散迅速凝结成白色固体;⑸图乙实验:在培养皿中放置少许几粒乙酸钠固体,将已冷却的乙酸钠溶液慢慢倒在培养皿中,两者刚接触,溶液立即就冷凝成固体,随着倒入的溶液一直往上凝结。
【想一想】热冰趣味实验的原理是什么?此实验原理是在过饱和乙酸钠(醋酸钠)溶液中加入乙酸钠晶体,类似于水结冰一样放出大量热,静待过饱和乙酸钠溶液冷却到40℃以下,由于过饱和溶液极不稳定,若用手或玻璃棒轻轻触碰乙酸钠溶液的表面,晶体就会立即从触碰点开始结晶凝结,接触点会给结晶提供可立足之地。
再用手接触烧杯外壁,可发现会有微微烫手的感觉,说明乙酸钠晶体结晶时也会放出热量,因此称其为“热冰”。
有一款“暖宝宝”是利用乙酸钠在结晶时放热的原理制作的。
醋酸钠过饱和溶液加热垫

醋酸钠过饱和溶液加热垫
醋酸钠过饱和溶液加热垫是一种可以用来加热醋酸钠过饱和溶液
的设备。
这种设备可以在实验室中广泛使用,以研究醋酸钠过饱和溶
液的性质和行为。
醋酸钠过饱和溶液是一种溶液,其中醋酸钠已经达到了最大的可
溶性,然而在高温条件下仍然可以增加溶液的饱和度。
这种溶液可以
用于许多化学和生物学实验中,例如生长晶体和研究气体溶解度。
使用醋酸钠过饱和溶液加热垫可以有效地加热这种溶液,并且可
以精确控制溶液的温度。
这种垫子通常由高质量的绝缘材料制成,以
防止热能从垫子中逃逸。
它还配备了一个精密的控制器,可以让实验
者非常容易地调节温度。
在使用酸钠过饱和溶液加热垫的时候一定要注意安全事项。
操作
人员必须戴上手套和护目镜等相关防护措施,并确保垫子的使用安全。
为了防止溶液飞溅到手上和其他地方,必须保持垫子和容器干净,同
时必须小心地加料和搅拌。
总的来说,醋酸钠过饱和溶液加热垫是实验室必备的设备之一。
它可以精确控制醋酸钠溶液的温度,为实验者提供方便而又安全的条件,以便他们可以进行更为精细的研究和实验。
醋酸钠溶液实验报告单

醋酸钠溶液实验报告单实验目的:本实验旨在制备醋酸钠溶液,进一步了解溶液的制备方法和醋酸钠的性质。
实验原理:醋酸钠,化学式为CH3COONa,是一种无色晶体,可溶于水中。
其溶液呈弱碱性,并具有良好的稳定性。
醋酸钠可以通过将醋酸与钠氢氧化物(氢氧化钠)反应得到。
实验步骤:1. 准备实验器材:量瓶、容量瓶、移液管、试剂瓶、搅拌棒等。
2. 准备所需试剂:醋酸和氢氧化钠。
3. 使用天平称取一定质量的醋酸,并转移至量瓶中。
4. 使用天平称取一定质量的氢氧化钠,并转移至另一个试剂瓶中。
5. 将醋酸与氢氧化钠的试剂瓶标签分别记为试剂瓶A和试剂瓶B。
6. 向试剂瓶A中加入适量的蒸馏水,然后用搅拌棒搅拌均匀,直至醋酸完全溶解。
7. 重复上述步骤,将试剂瓶B中的氢氧化钠完全溶解。
8. 将试剂瓶B中的氢氧化钠溶液缓慢滴加至试剂瓶A中的醋酸溶液中,并同时用搅拌棒搅拌均匀。
9. 继续滴加氢氧化钠溶液直至出现微弱的碱性反应,此时停止滴加。
10. 使用容量瓶从试剂瓶A中取出适量的醋酸钠溶液,倒入干净的容量瓶中,并加入足够的蒸馏水使其总体积达到容量。
11. 用标签标记含有醋酸钠溶液的容量瓶,并记录相关信息。
实验结果:通过上述步骤,制备了一定浓度的醋酸钠溶液。
溶液呈无色透明,pH值略高于7,表明溶液呈微弱碱性。
实验注意事项:1. 实验过程中要注意安全操作,避免溶液溅洒到皮肤或者眼睛,如有溅洒应立即用大量清水冲洗。
2. 使用天平称取试剂时要精确操作,避免误差。
3. 制备醋酸钠溶液时要注意逐滴添加氢氧化钠溶液,避免过量加入。
4. 所有实验器材要提前清洗、干燥,以免杂质影响实验结果。
5. 实验结束后,要将废液及废弃物正确处理,保持实验室的清洁与整齐。
实验总结:通过本次实验,我们成功制备了醋酸钠溶液,并充分了解了其制备方法和性质。
在实验过程中,我们注意到了实验的安全操作,严格控制试剂用量,并留意了溶液的性质。
这些实验技能对于今后的化学实验操作具有重要意义。
点水成冰实验报告

“点水成冰”这一现象引起了人们的极大兴趣,它似乎是一种神奇的现象。
为了探究这一现象的原理,我们设计并进行了以下实验。
二、实验目的1. 探究“点水成冰”现象的原理。
2. 了解过饱和溶液的性质及其稳定性。
3. 培养学生的动手操作能力和科学探究精神。
三、实验材料1. 醋酸钠晶体2. 蒸馏水3. 烧杯4. 玻璃棒5. 温度计6. 酒精灯四、实验步骤1. 在烧杯中加入40ml蒸馏水。
2. 将60g醋酸钠晶体加入烧杯中。
3. 使用酒精灯加热烧杯,使醋酸钠晶体溶解。
4. 继续加热几分钟,使溶液达到饱和状态。
5. 将烧杯从酒精灯上取下,静置冷却至室温。
6. 用玻璃棒轻轻摩擦烧杯壁或搅动溶液,观察现象。
五、实验现象当用玻璃棒轻轻摩擦烧杯壁或搅动溶液时,溶液内迅速析出针状结晶,整个烧杯底部布满结晶,就像结成了冰块。
1. 醋酸钠晶体溶解在蒸馏水中,加热后溶液达到饱和状态。
2. 静置冷却过程中,溶液逐渐过饱和,但由于溶液的稳定性,结晶作用并未发生。
3. 当用玻璃棒搅动溶液时,打破了溶液的稳定性,导致过饱和的醋酸钠迅速析出结晶。
七、实验结论1. “点水成冰”现象是由于过饱和溶液在受到扰动时,溶液的稳定性被打破,导致过饱和的溶质迅速析出结晶。
2. 本实验成功验证了过饱和溶液的性质及其稳定性。
八、实验心得1. 通过本次实验,我们了解了“点水成冰”现象的原理,感受到了科学的魅力。
2. 在实验过程中,我们学会了如何操作实验器材,培养了动手操作能力和科学探究精神。
3. 实验过程中,我们遇到了一些问题,通过查阅资料、讨论和尝试,最终解决了问题,增强了我们的解决问题的能力。
九、实验拓展1. 尝试改变实验条件,如改变醋酸钠的用量、加热时间等,观察结晶现象的变化。
2. 探究其他物质在过饱和溶液中的结晶现象,如硝酸钾、氯化钠等。
3. 研究过饱和溶液在日常生活、工业生产中的应用。
过饱和溶液

过饱和溶液一定温度、压力下,当溶液中溶质的浓度已超过该温度、压力下溶质的溶解度,而溶质仍不析出的现象叫过饱和现象,此时的溶液称为过饱和溶液。
1定义左图为硝酸铜饱和溶液,右图为过饱和溶液过饱和溶液的性质不稳定,当在此溶液中加入一块小的溶质晶体作为“晶种”,即能引起过饱和溶液中溶质的结晶。
把高温饱和溶液缓慢冷却,就有机会形成过饱和溶液。
常见的过饱和溶液有碳酸水。
过饱和溶液能存在的原因,是由于溶质不易在溶液中形成结晶中心即晶核。
因为每一晶体都有一定的排列规则,要有结晶中心,才能使原来作无秩序运动着的溶质质点集合起来,并且按照这种晶体所特有的次序排列起来。
不同的物质,实现这种规则排列的难易程度不同,有些晶体要经过相当长的时间才能自行产生结晶中心,因此,有些物质的过饱和溶液看起来还是比较稳定的。
但从总体上来说,过饱和溶液是处于不平衡的状态,是不稳定的,若受到振动或者加入溶质的晶体,则溶液里过量的溶质就会析出而成为饱和溶液,即转化为稳定状态,这说明过饱和溶液没有饱和溶液稳定,但还有一定的稳定性。
因此,这种状态又叫介稳状态。
2实验用品:烧杯、玻棒、酒精灯、平底烧瓶、石棉网。
醋酸钠晶体、硫代硫酸钠晶体、蒸馏水。
步骤①醋酸钠过饱和溶液的制备:在500 毫升烧杯中加入250 克未潮解的醋酸钠晶体(CH3COONa·3H2O)和150 毫升蒸馏水,用微火加热,不断搅拌,使其完全溶解。
趁热将溶液过滤到500 毫升洁净并干燥的平底烧瓶中(注意!不能把溶液滴在烧瓶颈部)。
静置冷却后,用洁净的橡皮塞将瓶口盖严。
②硫代硫酸钠过饱和溶液的制备:取250 克硫代硫酸钠晶体(Na2S2O3·5H2O)置于干燥洁净的平底烧瓶中,用水浴加热,使其溶于结晶水中。
静置冷却,用洁净橡皮塞将瓶口盖严备用。
操作:向瓶中投入同种溶质的小晶体,使晶体迅速布满整个烧瓶。
注意事项:①醋酸钠晶体容易吸潮,药品量可适当增加。
②尘土亦能使过饱和溶液结晶,所以平底烧瓶要洁净,瓶口要盖严。
结晶醋酸钠
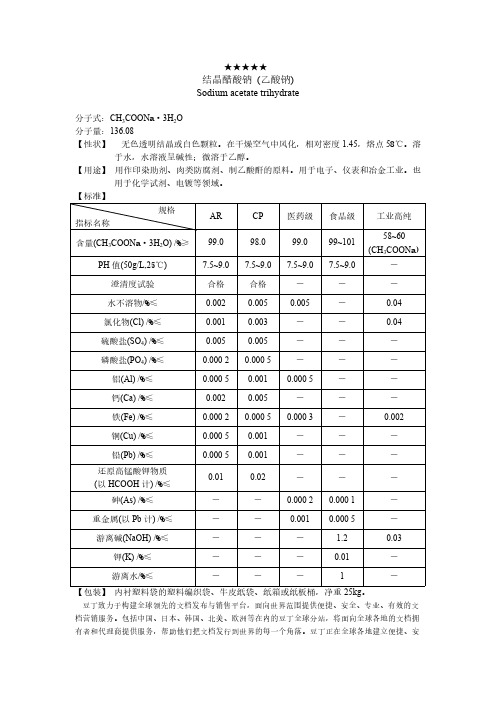
用于化学试剂、电镀等领域。
【标准】
指标名称
规格
AR
CP
医药级 食品级 工业高纯
58~60
含量(CH3COONa·3H2O) /%≥ 99.0
98.0
99.0 99~101
(CH3COONa)
PH 值(50g/L,25℃)
7.5~9.0 7.5~9.0 7.5~9.0 7.5~9.0
-
澄清度试验
合格
合格
0.002 0.005
-
-
-
铁(Fe) /%≤
0.000 2 0.000 5 0.000 3
-
0.002
铜(Cu) /%≤
0.000 5 0.001
-
-
-
铅(Pb) /%≤
0.000 5 0.001
-
-
-
还原高锰酸钾物质
0.01
0.02
-
-
-
(以 HCOOH 计) /%≤
砷(As) /%≤
-
-
0.000 2 0.000 1
全、高效的支付与兑换渠道,为每一位用户提供优质的文档交易和账务服务。
★★★★★
结晶醋酸钠 (乙酸钠) Sodium acetate trihydrate
分子式:CH3COONa·3H2O 分子量:136.08
【性状】 无色透明结晶或白色颗粒。在干燥空气中风化,相对密度 1.45,熔点 58℃。溶
于水,水溶液呈碱性;微溶于乙醇。
【用途】 用作印染助剂、肉类防腐剂、制乙酸酐的原料。用于电子、仪表和冶金工业。也
-
-
-
水不溶物/%≤
0.002 0.005 0.005
