化学竞赛-第22届国家化学奥林匹克理论试题答案
化学竞赛试题及答案

化学竞赛试题及答案一、选择题(每题3分,共30分)1. 下列元素中,属于非金属元素的是:A. 铁B. 铜C. 氧D. 钠答案:C2. 化学方程式2H2 + O2 → 2H2O中,氧气的化学计量数是:A. 1B. 2C. 3D. 4答案:B3. 以下哪种物质属于有机化合物?A. 水B. 二氧化碳C. 甲烷D. 碳酸钙答案:C4. 根据元素周期表,下列元素中原子序数最大的是:A. 氢C. 钠D. 氯答案:D5. 在化学反应中,能量变化通常表现为:A. 光B. 热C. 电D. 声音答案:B6. 以下哪种化合物属于共价化合物?A. 氯化钠B. 硫酸铜C. 氢氧化钠D. 二氧化碳答案:D7. 根据酸碱理论,下列物质中属于酸的是:A. 碳酸氢钠B. 氢氧化钠C. 硫酸D. 氯化钠答案:C8. 以下哪种元素的原子结构中,最外层电子数为8?B. 氧C. 硫D. 氩答案:D9. 金属活动性顺序中,最不活泼的金属是:A. 金B. 银C. 铜D. 钠答案:A10. 以下化学反应中,属于氧化还原反应的是:A. 2NaOH + H2SO4 → Na2SO4 + 2H2OB. 2H2O → 2H2 + O2C. 2H2 + O2 → 2H2OD. NaCl + AgNO3 → AgCl + NaNO3答案:C二、填空题(每题5分,共20分)11. 元素周期表中,第IA族的元素具有____个价电子。
答案:112. 根据化学键的类型,氯化钠中的离子键是由____和____之间的静电作用形成的。
答案:阳离子;阴离子13. 根据化学平衡原理,当一个化学反应达到平衡状态时,正反应和逆反应的速率____。
答案:相等14. 根据摩尔质量的定义,1摩尔水的质量是____克。
答案:18三、简答题(每题10分,共20分)15. 请简述什么是同位素,并给出一个例子。
答案:同位素是指具有相同原子序数但不同质量数的原子。
例如,氢元素的同位素包括氕、氘和氚。
第22届全国高中学生化学竞赛决赛理论试题-掌门1对1

友应:
・NH。
设配制的NaCN水溶液的浓度为1.00×
10一mol/L、生成的[Au(CN):]一配离子的浓度为
1.00×10~mol/L、空气中02的体积分数为0.210, 计算298 K时在空气中溶金反应的自由能变。. 1—3当电极反应中有H+或()H一时,其电极 电势E将受pH的影响,E—pH图体现了这种影响。 E—pH图上有3种类型的线:电极反应的E与 pH有关,为有一定斜率的直线;电极反应的E与 pH无关,是一条平行于横坐标的直线;非氧化还原 反应,是一条平行于纵坐标的直线。 电对的E—pH线的上方,是该电对的氧化型 的稳定区,E—pH线的下方,是还原型的稳定区;位 于高位置线的氧化型易与低位置线的还原型反应; 各曲线的交点所处的E和pH,是各电极的氧化型 和还原型共存的条件。 下图是氰化法溶金过程的Au—CN—HzO系 统的E—pH图,试借助该图对溶金反应和溶金的 工艺条件进行讨论。
--30.58 kJ・tool~,
厶H:1(298.2 K)=一20.10 kJ・mol~,厶G≈0 310.2 K(人体温度)时反应: ② 谷氨酸盐+NHg=谷氨酰胺+Hzo
△,僻。2(3lO.2
K)一15.70埘・tool_1
5—1通过计算回答在310.2 K,标准状态下, 人体内能否由下述反应合成谷氨酰胺? 谷氨酸盐+NH:-+ATP=谷氨酰胺+ ADP+Pi(磷酸盐)③ 5—2计算310.2 K时反应③的标准平衡常数 K专o 5—3 ATP消耗后,可通过另外的途径复生。 在另一种酶的催化作用下,ADP可以接受能量,同 时与一个磷酸结合,从而转化成ATP。例如在糖酵 解反应的过程中,如果1 mol葡萄糖完全降解,消耗 2 tool ATP,又产生38 mol ATP。计算在标准状态 下,310.2 K时,1 mol葡萄糖完全降解过程贮能 △fG是多少?
中国化学会第22届全国高中学生化学竞赛答案

第一题C H 2NC H 2H 2C N H 2C CH 2H 2C COO -COO --OOC-OOC H H (2分) 答(-OOCCH 2)2NCH 2CH 2N(CH 2COO -)2H H或CH 2NH(CH 2COO -)22 得2分,质子必须在氮原子上。
Pb 2+ + Ca(EDT A)2- = Ca 2+ + Pb (EDT A)2-(1分)不能。
若直接用EDTA 二钠盐溶液,EDT A 阴离子不仅和Pb 2+反应, 也和体内的Ca 2+结合造成钙的流失。
(答案和原因各0.5分,共 1分)(2分)硫氧键画成双键或画成S →O ,氮硫键画成N →S ,均不影响得分。
结构式1分,正负号1分。
答H 3NSO 3、H 3N-SO 3等不得分。
正确标出了正负号,如+H 3NSO 3-、+H 3N-SO 3-得1分。
其他符合题设条件(有三重轴,有极性)的结构,未正确标出正负极,得1分,正确标出正负极,得2分。
Fe(II) 答II 或+2也可 (2分)[Fe(CN)5(NO)]2-+S 2- = [Fe(CN)5(NOS)]4- 配合物电荷错误不得分 (1分)CaSO 4 + H + = Ca 2+ + HSO 4- (1分)写成 2CaSO 4 + 2HNO 3 = Ca(NO 3)2 + Ca(HSO 4)2 也得分。
高氯酸同。
答案若生成H 2SO 4 不得分。
Pb 2+与NO 3-形成络离子(配离子或配合物)。
(1分)写方程式也可,如PbSO 4 + H + + NO 3- = HSO 4- + Pb(NO 3)+。
若将络离子(配离子或配合物)写成Pb(NO 3)2或Pb(NO 3)3-也得分,但方程式须配平。
B: CaC 2 C: CaCN 2 D: C 2H 2 或Ca(OH) 2 E: NH 2CN [C(NH)2也可]X: C Y: N第二题 ClO 2 53π 2ClO 3- + H 2C 2O 4 + 2H += 2ClO 2 + 2CO 2 + 2H 2O (1分)或 2NaClO 3 + H 2C 2O 4 + H 2SO 4 = 2ClO 2 + 2CO 2 + Na 2SO 4 + 2H 2O2NaClO 2 + Cl 2 = 2ClO 2 + 2NaCl (1分)NaClO 2是固体,写成ClO 2-,不得分。
1990年第22届国际化学奥林匹克竞赛理论试题及答案

1990年第22届IChO理论题一、无机化学:磷酸以克/摩尔表示的原子量为:P:31; Ca:40; O:16; H:1.0; F:19; C:12; Si:28;S:32pK:(K为解离常数)HSO4-/SO42-: 2.0;HF/F-: 3.0;H3PO4/H2PO4-:2.0;H2PO-/HPO42-:7.0;HPO42-/PO43-:12.0。
4在自然界,磷在磷灰石中以磷酸盐形式存在,此矿石除了磷酸盐外,尚有二氧化硅和下列离子:Ca2+,CO32-,SO42-,SiO32-和F-。
我们假定此矿石是Ca3(PO4)2,CaSO4,CaF2,CaCO3,和SiO2,的混合物。
作为化肥使用时,要制成Ca(H2PO4)2,可溶于水;为此,磷灰石用磷酸和硫酸的混合物来处理。
同时,此操作消除了杂质的大部分。
磷灰石的元素分析结果如下,除氟以外,其它元素的百分数均以氧化物形式表示,操作1.m0克磷灰石样品,用50.0ml的溶液处理(该溶液含有0.500mol·L-1磷酸和0.100mol·L-1硫酸),此混合物在约70℃搅拌,避免温度超过90℃,进行完全除水。
此操作在通风柜中进行,因为有有毒气体逸出。
将干燥的残余物磨细、称重,得到m1克残余物。
在此种条件下,只有一种磷酸盐以Ca(H2PO4)2形式存在,二氧化硅和硅酸盐不能反应。
操作2.取1.00克上述残余物,在40℃用50.0ml水处理。
然后过滤,干燥和称重,得到m2克,该第二种残余物主要是石膏(CaSO4·2H2O),它的溶解度可认为在20~50℃间维持不变,相当于2.30g·L-1。
1.请平衡有关的反应式。
2.假定反应是按化学计量进行的,试问开始时需要多少磷灰石?3.开始时有m0克磷灰石,得到残余物m1=5.49克,①理论上应该得到多少重量?②实验结果可以用某些存在的产物来解释,但这些存在的产物却在残余物中是找不到的。
第22届全国高中学生化学竞赛决赛理论试题参考答案

D×V×N
M
一3.730 g‘cm-3><(840.5 pro)3 X6.022X——1—0—2—3—m——o—1—-——'
(6.94十2X47.88十4×16.00)g・mol叫
≈8
晶胞中的原子数为:7×8=56E8个Li+,16个
(其他画法合理也得分) 4—2结构基元为1个a-Li。N 简单六方点阵 N3一的Li+离子配位数为8 4—3由LizN一平面层中原子分布和画出的结构可 作如下计算: 层中Li—N间距离为: (Ti3++Ti4+),32个02一] ②假定面对角线上的()2一离子处于接触状态 (正离子填隙町能使()2一处于撑开状态,实际不一定 接触),设02一离子半径为r,则存在8r=√2口的关 系:02一离子最大可能半径为: r=J2a/8----42×840.5 pm/8—148.6 pm ③由题意和晶胞中()2一离子数目(32个)可推
pm
1
dlA-N薪一三i矿一210・6
1
音dN—N音×364.8
知,该晶胞叮以看成是由8个ccp堆积的立方单位
pm
并置而成。 将Li+选为晶胞顶点,Li+在晶胞中的位置与金 刚石中的C相当。如下图:
(上述计算中可有多种方法) 4—4①快离子导体必须具备2个条件,其一是存 在未填充的空隙,其二是离子可以在空隙间迁移。 已知N3一半径为146 pm,N—N间距离为
V
=--0.438 V
(4)△后。一一刀FE
=--4×96.485×Eo.616一(一o.438)]
一--407(kJ・mol一1)
lg[H+]4・户(02)/矿
一1.229 V+(O.0591/4)V×
1—3由图可见,生成[Au(CN)z]一的电极电势比
氧化还原反应及电化学-例题解析

第十四讲氧化还原反应及电化学【例题解析】【例1】(2005年江苏省化学竞赛夏令营选拔赛试题)铝是一种重要的金属材料,广泛用于制作导线、结构材料和日用器皿,铝合金大量用于飞机和其它构件的制造。
十九世纪曾以电解熔融氧化铝的方法制备金属铝,当时铝由于价格昂贵而只被贵族用作装饰品。
现代工业上是通过在1000℃左右的高温下电解氧化铝和冰晶石(Na3AlF6)的熔融液制备铝的。
请回答下列问题:(1) 现代工业电解制备铝过程中正极和负极实际发生的反应分别为:在正极放电产生;在负极放电产生。
(2) 电解反应方程式为。
(3) 以现代工业方法制备的铝价格下降的可能原因是:。
(4) 若电流效率为75%,则制备1kg金属铝需以10A电流电解小时。
(5) 电解NaCl-AlCl3熔融液制备铝比电解Al2O3-Na3AlF6的熔融液制备铝节省电能约30%,为什么现在仍用后一种方法制备铝? 。
【解析】(1) O2-3+(2)O OAl2(3) 纯氧化铝熔点很高(>2000℃),加入Na3AlF6后由于形成共熔体使其熔点大大降低,从而使制备铝成本降低(4) 397(5) 由于AlCl3没有天然矿藏,制备AlCl3所需氯气仍需电解制得,电能没有省下。
【例2】(2006年江苏省化学竞赛夏令营选拔赛试题)锂离子电池、金属氢化物-镍电池(MH-Ni)、无水碱性锌-锰电池、燃料电池、太阳能电池等是21世纪理想的绿色环保电源。
其中液态锂离子电池是指Li+嵌入化合物为正负电极的二次电池。
正极采用锂化合物LiCoO2、LiNiO2或LiMn2O4,负极采用碳电极,充电后成为锂-碳层间化合物Li x C6(0<x≤1),电解质为溶解有锂盐LiPF6、LiAsF6等的有机溶液。
(1)在电池放电时,Li+在两个电极之间往返嵌入和脱嵌。
写出该电池的充放电反应方程式:(2)金属锂放电容量(3861mAh·g-1)最大。
其中mAh的意思是指用1毫安(mA)的电流放电1小时(h)。
第22届全国高中生化学竞赛(省级赛区)模拟试题6

第22届全国高中生化学竞赛(省级赛区)模拟试题第一题:(4分)本题考考你对化学史的了解程度,请将下面的化学家与主要的贡献连线配对阿雷尼乌斯化学热力学的奠基人范特霍夫配合物结构理论的奠基人维尔纳发现有机镁试剂并广泛用于有机物合成格利亚电解质溶液电离理论的创始人第二题:(6分)铝是地球上最丰富的元素,历史上冶炼铝的过程十分的曲折,德国的化学家Wohler在1827年时,通过下面的两个过程制得了铝:1)将氧化铝,糖,碳及油脂压紧,烧结得到致密的混合物,将该混合物置于炙热的管子中,通入氯气,产生另一种气体X。
2)Na与X反应,生成金属铝1.请写出X的化学式。
2.请写出上面两步的方程式。
第三题:(6分)在单环共轭体系中,如果共轭的电子数为4n+2个,那么该环状体系显示出特殊的稳定性(芳香性),由此请解释下列现象:1、烃类的极性应该非常小,而下面化合物的极性非常大:2、空间结构成四元环状的24S 离子可以稳定存在第四题(8分)液晶是我们生活中使用非常广泛的一种物质状态,它是液态的,但却是各向异性的,所以它既有液态物质的性质也有晶态物质的性质。
下面的反应是合成液晶的一种反应:1、请模仿上述反应完成下列反应式1)2)2、合成液晶的反应可以用Pd做催化剂,有人提出了一种合适的Pd做催化剂的反应机理,请在下面的框图中填入合适的分子。
第五题:(14分)氟化硝酰(NO2F)是一种无色有刺激性臭味的化合物,熔点107K,沸点201K,有极性,是良好的氟化剂和氧化剂。
1、在Pt管中将AgF加热到513K,通入NO2Cl气体,可生成NO2F。
1)请写出该化学反应方程式。
2、请分析NO2F分子中个原子的成键情况,并指出NO2F分子的空间结构。
3、NO2F分子与Zn作用后产物中有N2O3生成,请写出反应的化学方程式。
4、NO2F与AsF5作用可以生成一种离子化合物,请分别写出这个离子化合物中阴阳离子的化学式与立体构型。
第六题:(13分)化学镀镍由于具有镀层厚薄均匀,抗腐蚀性能和耐磨性能号,操作方便的优点,在众多的工业领域中有广泛的应用,化学镀镍所用的还原剂主要是次磷酸盐,硼氢化钠,水和肼等,当用次磷酸钠作为反应的还原剂时需要及时分析,补充调整次磷酸钠的浓度,所以反应的过程中需要快速地测定次磷酸钠的浓度,一般使用容量分析的方法。
中国化学会第22届全国高中学生化学竞赛(省级赛区)

中国化学会第22届全国高中学生化学竞赛(省级赛区)试题、标准答案及评分细则题号1 2 3 4 5 6 7 8 9 10 11 总分 满分 14 5 4 10 5 11 14 9 7 11 10 100评分通则:1.凡要求计算的,没有计算过程,即使结果正确也不得分。
2有效数字错误,扣分,但每大题只扣1次。
3单位不写或表达错误,扣分,但每大题只扣1次。
4只要求1个答案、而给出多个答案,其中有错误的,不得分。
5方程式不配平不得分。
6不包括在此标准答案的分的题,可由评分组讨论决定是否给分。
第1题 (14分)1-1 EDTA 是乙二胺四乙酸的英文名称的缩写,市售试剂是其二水合二钠盐。
(1)画出EDTA 二钠盐水溶液中浓度最高的阴离子的结构简式。
C H 2NC H 2H 2C N H 2C CH 2H 2CCOO -COO --OOC-OOC H H (2分)答(-OOCCH 2)2NCH 2CH 2N(CH 2COO -)2H H或CH 2NH(CH 2COO -)22 得2分,质子必须在氮原子上。
(2) Ca(EDTA)2-溶液可用于静脉点滴以排除体内的铅。
写出这个排铅反应的化学方程式(用Pb 2+ 表示铅)。
Pb 2+ + Ca(EDTA)2- = Ca 2+ + Pb (EDTA)2- (1分)(3)能否用EDTA 二钠盐溶液代替Ca(EDTA)2-溶液排铅?为什么?不能。
若直接用EDTA 二钠盐溶液,EDTA 阴离子不仅和Pb 2+反应, 也和体内的Ca 2+结合造成钙的流失。
(答案和原因各分,共 1分)1-2 氨和三氧化硫反应得到一种晶体,熔点205o C ,不含结晶水。
晶体中的分子有一个三重旋转轴,有极性。
画出这种分子的结构式,标出正负极。
N S HO O H O(2分)硫氧键画成双键或画成S →O ,氮硫键画成N →S ,均不影响得分。
结构式1分,正负号1分。
答H 3NSO 3、H 3N-SO 3等不得分。
2009第22届中国化学会全国高中生化学竞赛(省级赛区)试卷及答案

第1题 (20分)1-1 F 4Si -N(CH 3)3 + BF 3 → F 3B -N(CH 3)3 + SiF 4 ; F 3B -N(CH 3)3 + BCl 3 → Cl 3B -N(CH 3)3 + BF 3BCl 3 > BF 3 > SiF 4 顺序错误不给分 (2分) 1-2 (1)BFFF分子构型为平面三角形,不画成平面形不给分 (0.5分) sp 2(0.5分)H 3C33分子构型为三角锥形, 不画成三角锥形不给分 (0.5分) sp 3(0.5分)(2)CH 3H 3C H 3CFB FF B :sp 3 (1分)+ (1分)CH 3H 3C H 3CFFFFSi ,sp 3d (1分)+ (1分)1-3 BCl 3 + 3H 2O = B(OH)3+ 3HCl 不配平不给分 (1分) BCl 3 + C 5H 5N = Cl 3B-NC 5H 5或BCl 3 +N=Cl 3N(1分)1-4BeCl Clsp结构简式和杂化轨道各0.5分 (1分)BeClBeClClCl结构简式1.5分sp 2杂化轨道0.5分 (2分)ClBeCl Be结构简式1.5分sp 3杂化轨道0.5分画成Cl BeCln 也得分(2分)1-5只有画出7配位的结构简式才能得满分,端基氮不配位得0分,二级氮不配位得1分 (2分)Cr 的氧化态为+4(1分)1-6MnOC CCH 3CO CO O3(1分)不要求配体的位置Mn 的氧化态为+1(1分)第2题 (6分) 下列各实验中需用浓HCl 而不能用稀HCl 溶液,写出反应方程式并阐明理由。
2-1 SnCl 2 + 2HCl = SnCl 42- + 2H +不配平不给分 (1分)浓HCl 的作用是形成SnCl 42-,可防止Sn(OH)Cl 的形成,抑制SnCl 2水解。
(1分) 写配平的水解方程式,加浓盐酸平衡向左移动,抑制水解 也得分2分2-2 MnO 2 + 4HCl = MnCl 2 + Cl 2 + 2H 2O不配平不给分 (1分)加浓HCl 利于升高MnO 2的氧化电位,降低Cl -的还原电位,使反应正向进行。
第22届全国高中生化学竞赛(省级赛区)试题及答案

评分通则:1.凡要求计算的,没有计算过程,即使结果正确也不得分。
2有效数字错误,扣0.5分,但每大题只扣1次。
3单位不写或表达错误,扣0.5分,但每大题只扣1次。
4只要求1个答案、而给出多个答案,其中有错误的,不得分。
5方程式不配平不得分。
6不包括在此标准答案的0.5分的题,可由评分组讨论决定是否给分。
第1题 (14分)1-1 EDTA 是乙二胺四乙酸的英文名称的缩写,市售试剂是其二水合二钠盐。
(1)画出EDTA 二钠盐水溶液中浓度最高的阴离子的结构简式。
C H 2NC H 2H 2C N H 2C CH 2H 2CCOO -COO --OOC-OOC H H (2分)答(-OOCCH 2)2NCH 2CH 2N(CH 2COO -)2H H或CH 2NH(CH 2COO -)22 得2分,质子必须在氮原子上。
(2) Ca(EDTA)2-溶液可用于静脉点滴以排除体内的铅。
写出这个排铅反应的化学方程式(用Pb 2+ 表示铅)。
Pb 2+ + Ca(EDTA)2- = Ca 2+ + Pb (EDTA)2-(1分)(3)能否用EDTA 二钠盐溶液代替Ca(EDTA)2-溶液排铅?为什么?不能。
若直接用EDTA 二钠盐溶液,EDTA 阴离子不仅和Pb 2+反应, 也和体内的Ca 2+结合造成钙的流失。
(答案和原因各0.5分,共 1分)1-2 氨和三氧化硫反应得到一种晶体,熔点205o C ,不含结晶水。
晶体中的分子有一个三重旋转轴,有极性。
画出这种分子的结构式,标出正负极。
(2分)硫氧键画成双键或画成S →O ,氮硫键画成N →S ,均不影响得分。
结构式1分,正负号1分。
答H 3NSO 3、H 3N-SO 3等不得分。
正确标出了正负号,如+H 3NSO 3-、+H 3N-SO 3-得1分。
其他符合题设条件(有三重轴,有极性)的结构,未正确标出正负极,得1分,正确标出正负极,得2分。
1-3Na2[Fe(CN)5(NO)]的磁矩为零,给出铁原子的氧化态。
中国化学会第22届全国高中学生化学竞赛(决赛).

化学奥林匹克中国化学会第22届全国高中学生化学竞赛(决赛)理论试题(2009年1月7日陕西西安)第1题金在自然界中主要以分散的单质形式存在,需要先富集再提炼。
富集后的精矿用混汞法、氰化法等工艺提取金。
混汞法是使矿浆中的金粒与汞生成金汞齐,然后蒸去汞得到海绵金(又称汞金)。
氰化法是在氧化剂(如空气或氧气)存在下,用可溶性氰化物(如NaCN)溶液浸出矿石中的金(浸出产物为IAu(CN)2]-),再用置换法或电沉积法从浸出液中回收金。
1-1 写出用氰化物溶金反应和用zn粉置换金的化学反应方程式。
设配制的NaCN水溶液的浓度为 1.00X10-3mol/L、生成的[Au(CN)2]-配离子的浓度为1.00 X10-4·mol/L、空气中O2的体积分数为0.210,计算298 K时在空气中溶金反应的自由能变。
1-3 当电极反应中有H+或OH-时,其电极电势E将受pH的影响,E-pH图体现了这种影响。
E-pH图上有3种类型的线:电极反应的E与pH有关,为有一定斜率的直线;电极反应的E与pH无关,是一条平行于横坐标的直线;非氧化还原反应,是一条平行于纵坐标的直线。
电对的E-pH线的上方,是该电对的氧化型的稳定区,E-pH线的下方,是还原型的稳定区;位于高位置线的氧化型易与低位置线的还原型反应;各曲线的交点所处的E和pH,是各电极的氧化型和还原型共存的条件。
下图是氰化法溶金过程的Au-CN-H2O系统的E-pH图,试借助该图对溶金反应和溶金的工艺条件进行讨论。
第2题液氨是一种广泛使用的类水溶剂。
2-1 作为溶剂,NH3分子也能发生类似于H2O分子的缔合作用,说明发生这种缔合的原因和比较这种缔合作用相对于水的大小。
2-2 以液氨作为溶剂最引起化学家兴趣的是它能够溶解一些金属,如电极电势小于-2.5 V的碱金属、部分碱土金属及镧系元素可溶于液氨,形成蓝色的具有异乎寻常性质的亚稳定态溶液,这种溶液具有顺磁性和高的导电性,溶液的密度比纯溶液的密度小。
全国高中化学竞赛初赛备用试题答案
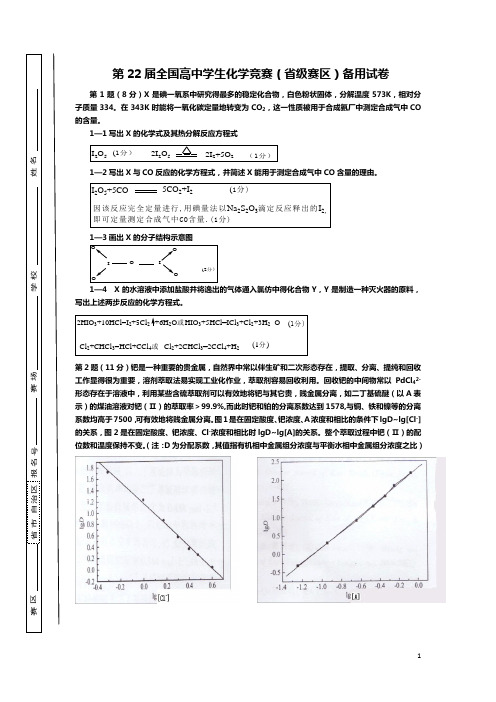
第22届全国高中学生化学竞赛(省级赛区)备用试卷第1题(8分)X 是碘一氧系中研究得最多的稳定化合物,白色粉状固体,分解温度573K ,相对分子质量334。
在343K 时能将一氧化碳定量地转变为CO 2,这一性质被用于合成氨厂中测定合成气中CO 的含量。
1—1写出X 的化学式及其热分解反应方程式I 2O 5 2I 2O 52I 2+5O 2(1分)(1分)1—2写出X 与CO 反应的化学方程式,并简述X 能用于测定合成气中CO 含量的理由。
I 2O 5+5CO5CO 2+I 2 (1分)因该反应完全定量进行,用碘量法以Na 2S 2O 3滴定反应释出的I 2,即可定量测定合成气中CO 含量.(1分)1—3画出X 的分子结构示意图IOIOOOO (2分)1—4 X 的水溶液中添加盐酸并将逸出的气体通入氯仿中得化合物Y ,Y 是制造一种灭火器的原料,写出上述两步反应的化学方程式。
2HIO 3+10HCl=I 2+5Cl 2+6H 2O 或HIO 3+5HCl=ICl 3+Cl 2+3H 2(1分)Cl 2+CHCl 3=HCl+CCl 4或Cl 2+2CHCl 3=2CCl 4+H 2(1分)O第2题(11分)钯是一种重要的贵金属,自然界中常以伴生矿和二次形态存在,提取、分离、提纯和回收工作显得很为重要,溶剂萃取法易实现工业化作业,萃取剂容易回收利用。
回收钯的中间物常以PdCl 42-形态存在于溶液中,利用某些含硫萃取剂可以有效地将钯与其它贵,贱金属分离,如二丁基硫醚(以A 表示)的煤油溶液对钯(Ⅱ)的萃取率>99.9%,而此时钯和铂的分离系数达到1578,与铜、铁和镍等的分离系数均高于7500,可有效地将贱金属分离。
图1是在固定酸度、钯浓度、A 浓度和相比的条件下lgD~lg[Cl -]的关系,图2是在固定酸度、钯浓度、Cl -浓度和相比时lgD~lg[A]的关系。
整个萃取过程中钯(Ⅱ)的配位数和温度保持不变。
中国奥林匹克高中组化学竞赛试题

1、下列哪种物质在常温下能自发进行氧化还原反应?A、铁和硫酸铜溶液B、铜和稀硫酸C、银和氯化钠溶液D、金和稀盐酸(答案:A)解析:铁能置换硫酸铜溶液中的铜离子,发生氧化还原反应。
而铜、银、金在金属活动性序列中位于氢之后,不能与稀硫酸或稀盐酸发生置换反应,也不会与氯化钠溶液反应。
2、下列哪种物质属于非电解质?A、氯化钠B、醋酸C、氨气D、氢氧化钾(答案:C)解析:非电解质是指在水溶液中和熔融状态下都不能导电的化合物。
氨气溶于水后生成一水合氨,虽然一水合氨能导电,但氨气本身并不直接电离,因此被视为非电解质。
氯化钠、醋酸、氢氧化钾在水溶液中均能导电,属于电解质。
3、下列哪种仪器常用于分离沸点相近的液体混合物?A、分液漏斗B、蒸馏烧瓶C、色谱柱D、漏斗(答案:C)解析:色谱柱利用不同物质在固定相和流动相之间的分配系数差异进行分离,特别适用于沸点相近或性质相似的混合物。
分液漏斗用于分离不互溶的液体,蒸馏烧瓶用于分离沸点差异较大的液体,漏斗则用于过滤固体和液体。
4、下列哪种物质是常见的路易斯酸?A、氨气B、水C、三氯化铝D、氢氧化钠(答案:C)解析:路易斯酸是指能接受电子对的物质。
三氯化铝中的铝原子具有空轨道,可以接受电子对,是路易斯酸。
氨气、水、氢氧化钠则更倾向于提供电子对,属于路易斯碱。
5、下列哪种物质在光照下容易发生分解反应?A、氯化钠B、硝酸钾C、次氯酸钙D、硫酸钠(答案:C)解析:次氯酸钙在光照下会分解产生氯化钙和氧气,是常见的光敏性物质。
氯化钠、硝酸钾、硫酸钠在光照下通常稳定,不易发生分解反应。
6、下列哪种方法可以用于制备胶体?A、蒸馏B、过滤C、煮沸并快速冷却D、萃取(答案:C)解析:煮沸并快速冷却某些溶液可以形成胶体,这是因为快速冷却阻止了溶质分子的有序排列,形成了胶体粒子。
蒸馏用于分离沸点不同的液体,过滤用于分离固体和液体,萃取用于利用溶解度差异分离物质,它们都不能用于制备胶体。
7、下列哪种物质是常见的有机酸?A、硫酸B、盐酸C、醋酸D、硝酸(答案:C)解析:醋酸是一种含有羧基(-COOH)的有机化合物,属于有机酸。
2022年全国高中化学奥林匹克竞赛预赛试题及答案

全国高中化学奥林匹克竞赛初赛试题(满分100分时间120分钟)也许用到旳相对原子质量:H-1 C-12 N-14 O-16 Na-23 Mg-24 Al-27 S-32Cl-35.5 K-39 Fe-56 Cu-64 Zn-65 Ag-108 Ba-137一、选择题(本题涉及18小题,每题2分,共36分,每题有.1.~.2.个.选项符合题意。
多选错选不得分,有两个答案旳只选一种且答对者得1分)1.两位美国科学家彼得·阿格雷和罗德里克·麦金农,由于发现细胞膜水通道,以及对离子通道构造和机理研究作出旳开创性奉献而获得诺贝尔化学奖。
她们之因此获得诺贝尔化学奖而不是生理学或医学奖是由于( )。
A.她们旳研究和化学物质水有关B.她们旳研究有助于研制针对某些神经系统疾病和心血管疾病旳药物C.她们旳研究进一步到分子、原子旳层次D.她们旳研究进一步到细胞旳层次2.为了摸索月球上与否有生命存在旳痕迹,就要分析月球岩石中与否包藏有碳氢化合物(固然这仅仅是摸索旳第一步)。
科学家用氘盐酸(DCl)和重水(D2O)溶液解决月球岩石样品,对收集旳气体加以分析,成果只发既有某些气体状态旳碳氘化合物。
这个实验不能用一般盐酸,其理由是( )。
A.一般盐酸旳酸性太强B.一般盐酸具有挥发性C.一般盐酸和月球岩石中旳碳化物无法反映D.无法区别岩石中本来具有旳是碳化物,还是碳氢化合物3.下列与“神舟五号”载人飞船有关旳说法不对旳...旳是( )。
A.飞船旳表面覆盖旳一层石墨瓦之因此能起到保护作用是由于石墨可以耐高温B.宇航员旳食物做成大小可口旳“一口酥”,目旳是避免飞船内产生飘尘C.飞船在宇宙中运营时,船舱内温度低、氧气少,无法划着火柴D.在飞船上使用LiOH吸取多余旳CO2而不使用NaOH4.下列解释不科学...旳是( )。
A.“水滴石穿”重要是溶解了CO2旳雨水与CaCO3长期作用生成了可溶性Ca(HCO3)2旳缘故B.长期盛放NaOH溶液旳试剂瓶不易打开,是由于NaOH与瓶中旳CO2反映导致瓶内气体减少形成“负压”旳缘故C.严格地讲,实验室使用“通风橱” 防污染是不负责任旳,由于实验产生旳有害气体没有得到转化或吸取D.“雨后彩虹”与“海市蜃楼”都是自然界旳光学现象,也与胶体旳知识有关5.12月31日,世界上第一条商业磁悬浮铁路在上海投入运营。
