第15章 氨基酸、多肽和蛋白质 ppt课件
合集下载
有机化学ppt-氨基酸蛋白质

蛋白质能够形成稳定亲水胶体溶液,主要有两方面的原因: 形成保护性水化膜。粒子带有同性电荷。
如果改变条件,破坏蛋白质的稳定因素,就可以使蛋白质分 子从溶液中凝聚并析出。这种现象称为蛋白质的沉淀。
盐析法:在蛋白质溶液中加入大量盐[如 NaCl、硫酸铵、 Na2SO4等],由于盐既是电解又是亲水性的物质,它能破坏蛋白 质的水化膜,因此当加入的盐达到一定的浓度时,蛋白质就会从 溶液中沉淀析出,盐浓度变稀时蛋白质溶解,为可逆沉淀。
2.氨基酸的分类
(1)据氨基和羧基的相对位置分为α-氨基酸、β-氨基酸 和γ—氨基酸,与人关系最为密切的是α-氨基酸。
R αCH COOH NH2
α 氨基酸
R β CH α CH2COOH NH2
β 氨基酸
R γ CH β CH2αCH2COOH NH2
γ 氨基酸
(2)按分子中氨基和羧基的数目分为
系统命名法: 氨基酸的命名可以采用系统命名法,与羟基酸的命名相似 ,即以羧酸为母体,氨基为取代基,称为“氨基某酸”。 氨基的位置,习惯上用希腊字母α、β、γ等来表示,并写在 氨基酸名称前面。
CH3CH CHCOOH CH3 NH2
α-氨基--甲基丁酸
CH2CH COOH NH2
α-氨基--苯基丙酸
习惯命名法: 氨基酸多根据其来源或某些特性使用俗名,有时还用中文 或英文缩写符号表示。 α-氨基乙酸因具有甜味俗名甘氨酸,中文缩写为“甘”, 英文缩写为“Gly”。天门冬氨酸是因最初是从植物天门冬的幼 苗中分离出来而得名,中文缩写“天”, 英文缩写为“Asp”。
负离子存在。在一定介质时,主要以两性离子存在。
R CH COOH
NH3+ (Ⅰ) 正离子
OH- R CH COO- OH-
如果改变条件,破坏蛋白质的稳定因素,就可以使蛋白质分 子从溶液中凝聚并析出。这种现象称为蛋白质的沉淀。
盐析法:在蛋白质溶液中加入大量盐[如 NaCl、硫酸铵、 Na2SO4等],由于盐既是电解又是亲水性的物质,它能破坏蛋白 质的水化膜,因此当加入的盐达到一定的浓度时,蛋白质就会从 溶液中沉淀析出,盐浓度变稀时蛋白质溶解,为可逆沉淀。
2.氨基酸的分类
(1)据氨基和羧基的相对位置分为α-氨基酸、β-氨基酸 和γ—氨基酸,与人关系最为密切的是α-氨基酸。
R αCH COOH NH2
α 氨基酸
R β CH α CH2COOH NH2
β 氨基酸
R γ CH β CH2αCH2COOH NH2
γ 氨基酸
(2)按分子中氨基和羧基的数目分为
系统命名法: 氨基酸的命名可以采用系统命名法,与羟基酸的命名相似 ,即以羧酸为母体,氨基为取代基,称为“氨基某酸”。 氨基的位置,习惯上用希腊字母α、β、γ等来表示,并写在 氨基酸名称前面。
CH3CH CHCOOH CH3 NH2
α-氨基--甲基丁酸
CH2CH COOH NH2
α-氨基--苯基丙酸
习惯命名法: 氨基酸多根据其来源或某些特性使用俗名,有时还用中文 或英文缩写符号表示。 α-氨基乙酸因具有甜味俗名甘氨酸,中文缩写为“甘”, 英文缩写为“Gly”。天门冬氨酸是因最初是从植物天门冬的幼 苗中分离出来而得名,中文缩写“天”, 英文缩写为“Asp”。
负离子存在。在一定介质时,主要以两性离子存在。
R CH COOH
NH3+ (Ⅰ) 正离子
OH- R CH COO- OH-
蛋白质、多肽、氨基酸概述及分类重点 PPT

步进行 ❖ 组氨酸可在生理条件解离、结合质子
❖ 咪唑环形成质子传递体系
亲核试剂:给出电子
(3)Neutral Amino Acids中性氨基酸
❖ 中性氨基酸侧链不提供也不接受质子
❖ (1) Glysine甘氨酸 最简单、没有光学活性的氨基
酸
❖ (abbreviation:Gly)
❖ 显然与这种氨基酸相关的化学反应比较少,在生物学 上的意义主要是作为结构成份,大量的结构蛋白质如: 胶原和丝素中含有大量的甘氨酸。
CO2H H2N C H
R
R的结构
-H -CH3 -CH(CH3)2 -CH2CH(CH3)2 -CH(CH3)CH2CH3
N H
CO2H
-CH2C6H5
CH2
OH
CH2
N H
-CH2OH -CH(OH)CH3 -CH2CO2H -CH2CH2CO2H -CH2CONH2 -CH2CH2CONH2
-CH2SH -CH2CH2SCH3 -CH2CH2CH2CH2NH2 -CH2CH2CH2NHC(=NH)NH2
❖ 亲水性特别好,但第二个羟基(仲羟基)形成氢键能力弱、
HOOC
NH2
CCHH来自OH CH3❖ (3) Cysteine半胱氨酸 ❖ (abbreviation:Cys)
NH2 HOOC C CH2 SH
H
用 sulfur(硫) 取代丝氨酸的氧,较高pH值下能够给出质子 离 解
硫原子是特别好的亲核试剂
❖ α-,β-,γ-,orδ-氨基酸、
❖ γ-aminobutyric acid γ-氨基丁酸 (GABA):
❖ 神经传递素
❖ 2,5-diiodotyrosine 2, 5-二碘酪氨酸 ❖ 甲状腺激素前体
❖ 咪唑环形成质子传递体系
亲核试剂:给出电子
(3)Neutral Amino Acids中性氨基酸
❖ 中性氨基酸侧链不提供也不接受质子
❖ (1) Glysine甘氨酸 最简单、没有光学活性的氨基
酸
❖ (abbreviation:Gly)
❖ 显然与这种氨基酸相关的化学反应比较少,在生物学 上的意义主要是作为结构成份,大量的结构蛋白质如: 胶原和丝素中含有大量的甘氨酸。
CO2H H2N C H
R
R的结构
-H -CH3 -CH(CH3)2 -CH2CH(CH3)2 -CH(CH3)CH2CH3
N H
CO2H
-CH2C6H5
CH2
OH
CH2
N H
-CH2OH -CH(OH)CH3 -CH2CO2H -CH2CH2CO2H -CH2CONH2 -CH2CH2CONH2
-CH2SH -CH2CH2SCH3 -CH2CH2CH2CH2NH2 -CH2CH2CH2NHC(=NH)NH2
❖ 亲水性特别好,但第二个羟基(仲羟基)形成氢键能力弱、
HOOC
NH2
CCHH来自OH CH3❖ (3) Cysteine半胱氨酸 ❖ (abbreviation:Cys)
NH2 HOOC C CH2 SH
H
用 sulfur(硫) 取代丝氨酸的氧,较高pH值下能够给出质子 离 解
硫原子是特别好的亲核试剂
❖ α-,β-,γ-,orδ-氨基酸、
❖ γ-aminobutyric acid γ-氨基丁酸 (GABA):
❖ 神经传递素
❖ 2,5-diiodotyrosine 2, 5-二碘酪氨酸 ❖ 甲状腺激素前体
S-15氨基酸多肽蛋白质ppt课件

R C H = C H C O O H + N H 3
③ γ-氨基酸和δ -氨基酸受热则分子内氨基与羧 基失水形成内酰胺。
CH 2 △ CHCH O 2 +H CH CH COOH R 2 R CH 2 2 HNC H N 2 O γ氨 基 酸 γ内 酰 胺 O C H H 2C 2 R C H C H C H C H C O H 2 2 2 + R C H H O C H 2 2 N HH N HC
H H NCH C N 2
CH 3O
CH 2 COOH
丙 氨 酰 -甘 氨 酸 , 简 写 为 丙 -甘 ( A l a -G l y ) ( Ⅱ )
三肽含由6种异构体;四肽有24种;五肽有120 种;… …
命名原则: 以含 C—端的氨基酸为母体,把肽链中其它氨 基酸名称中的酸字改为酰字,将含N—端的氨基 酸写在最前,然后按它们在链中的顺序依次排列 至最后含C—端的氨基酸。除C-端氨基酸保留原 名,其它都用“酰”来代替“酸”。
+ NH 3 ( Ⅰ )
+ NH 3
H
NH 2 ( Ⅱ ) 负 离 子
正 离 子
两 性 离 子
氨基酸在强 酸性溶液中 以正离子存 在。
在等电点时, 氨基酸主要 以两性离子 存在。
在强碱性 溶液中以 负离子存 在。
说明结晶状态的氨基酸的高熔点、易溶于水、 难溶于非极性有机溶剂等物理性质的原因。
(3)等电点 等电点:当溶液调节至一定的pH值时,氨基酸可以两 性离子的形式存在,将此溶液置于电场中,氨基酸不 向电场的任何一极移动,即处于电中性状态,这时溶 液的pH值称为氨基酸的等电点。 中性氨基酸的等电点略小于7,一般在5~6.3之间。 酸性氨基酸的等电点小于7,一般在2.8~3.2之间。 碱性氨基酸的等电点大于7,一般在7.6~10.8之间。
第15章 蛋白质的生物合成
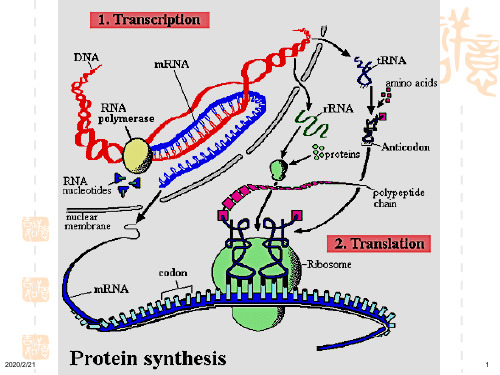
tRNA反密码子 第1位碱基
I
U G AC
mRNA密码子 第3位碱基
U, C, A A, G U, C U G
2020/2/21
21
Robert W. Holley 1922~1993
Har Gobind Khorana
1922~
Marshall W. Nirenberg
1927~2010
The Nobel Prize in Physiology or Medicine 1968
• 原核细胞中数个结构基因常串联为一个转录 单位,转录生成的mRNA可编码几种功能相关
的蛋白质,为多顺反子(polycistron) 。
2020/2/21
5
原核生物的多顺反子
5 PPP
3
真核生物的单顺反子
5 mG - PPP
蛋白质
3
蛋白质
非编码序列
核蛋白体结合位点
编码序列
起始密码子
终止密码子
"for their interpretation of the genetic code and
2020/2/21
its function in protein synthesis"
22
二、核糖体是多肽链合成的装置
2020/2/21
23
2020/2/21
24
2020/2/21
27
原核、真核生物核蛋白体的组成
4. 通用性(universal)
▪ 蛋白质生物合成的整套密码,从原核生 物到人类都通用。
▪ 已发现少数例外,如动物细胞的线粒体、 植物细胞的叶绿体。
▪ 密码的通用性进一步证明各种生物进化 自同一祖先。
《多肽与蛋白质》PPT课件

31 目 录
(一)肽键是一个刚性的平面
参与肽键的6个原子C1、 C、O、N、H、C2位于同一平 面 , C1 和 C2 在 平 面 上 所 处 的 位置为反式(trans)构型,此同 一平面上的6个原子构成了所 谓的肽单元 (peptide unit) 。
第一节 第二节 第三节 第四节 第五节 第六节
超二级结构形式有3种:αα,βαβ,ββ
第一节 第二节 第三节 第四节 第五节 第六节
36 目 录
钙结合蛋白中结 合钙离子的模体
锌指结构
第一节 第二节 第三节 第四节 第五节 第六节
37 目 录
(六)氨基酸残基的侧链可影响二级结构的形成
蛋白质二级结构是以一级结构为基础的。 一段肽链其氨基酸残基的侧链适合形成-螺旋 或β-折叠,它就会出现相应的二级结构。
2GSH
GSH过氧 化物酶
GSSG
NADP+
GSH还原酶
NADPH+H+
第一节 第二节 第三节 第四节 第五节 第六节
16 目 录
2.体内有许多激素属寡肽或多肽
第一节 第二节 第三节 第四节 第五节 第六节
17 目 录
3. 神经肽是脑内一类重要的肽
在神经传导过程中起重要作用的肽类称为 神经肽(neuropeptide)。
第一节 第二节 第三节 第四节 第五节 第六节
35 目 录
(五)模体是蛋白质的超二级结构
在许多蛋白质分子中,由几个具有二级结 构的肽段,在空间上相互接近、相互作用,所 形成的折叠模样,称为超二级结构 (supersecondary structure),又称折叠(fold) 或模体(motif)。
第一节
第二节
氨基酸多肽和蛋白质类药物课件

氨基酸药物 二、氨基酸药物生产
水解法 发酵法
以糖为碳源,以氨或尿素为氮源,通过微生物的 发酵繁殖,直接生产氨基酸,或利用菌体的酶系, 加入前体物质合成特定氨基酸的方法。
菌种的培养、接种发酵、产品的提取及分离纯化
文档仅供参考,不能作为科学依据,请勿模仿;如有不当之处,请联系本人改正。
氨基酸药物 二、氨基酸药物生产
半必需氨基酸 精氨酸和组氨酸
基本知识
文档仅供参考,不能作为科学依据,请勿模仿;如有不当之处,请联系本人改正。
二、氨基酸基本知识
氨基酸 功能
合成蛋白质
氮平衡作用
转变为糖或脂肪
参与酶、激素及部分维 生素的组成
基本知识
文档仅供参考,不能作为科学依据,请勿模仿;如有不当之处,请联系本人改正。
三、多肽基本知识
氨酸对肝细胞内三羧酸循环代谢过程的间接促 进作用,促进了肝细胞的能量生成,使得被损 伤的肝细胞的各项功能得以迅速恢复。
文档仅供参考,不能作为科学依据,请勿模仿;如有不当之处,请联系本人改正。
文档仅供参考,不能作为科学依据,请勿模仿;如有不当之处,请联系本人改正。
个
中国药科大学生物制药专业
人
山东大学制药工程硕士
山东药品食品职业学院制药工程
简 系生物制药教研室主任 副教授
介 生物制药技术专业负责人
文档仅供参考,不能作为科学依据,请勿模仿;如有不当之处,请联系本人改正。
目 录
01 / 氨基酸、多肽及 蛋白质基本知识
水解法 发酵法 化学合成法
化学合成法是利用有机合成和化学工程相结合的 技术生产氨基酸的方法。
文档仅供参考,不能作为科学依据,请勿模仿;如有不当之处,请联系本人改正。
氨基酸药物 二、氨基酸药物生产
水解法 发酵法
以糖为碳源,以氨或尿素为氮源,通过微生物的 发酵繁殖,直接生产氨基酸,或利用菌体的酶系, 加入前体物质合成特定氨基酸的方法。
菌种的培养、接种发酵、产品的提取及分离纯化
文档仅供参考,不能作为科学依据,请勿模仿;如有不当之处,请联系本人改正。
氨基酸药物 二、氨基酸药物生产
半必需氨基酸 精氨酸和组氨酸
基本知识
文档仅供参考,不能作为科学依据,请勿模仿;如有不当之处,请联系本人改正。
二、氨基酸基本知识
氨基酸 功能
合成蛋白质
氮平衡作用
转变为糖或脂肪
参与酶、激素及部分维 生素的组成
基本知识
文档仅供参考,不能作为科学依据,请勿模仿;如有不当之处,请联系本人改正。
三、多肽基本知识
氨酸对肝细胞内三羧酸循环代谢过程的间接促 进作用,促进了肝细胞的能量生成,使得被损 伤的肝细胞的各项功能得以迅速恢复。
文档仅供参考,不能作为科学依据,请勿模仿;如有不当之处,请联系本人改正。
文档仅供参考,不能作为科学依据,请勿模仿;如有不当之处,请联系本人改正。
个
中国药科大学生物制药专业
人
山东大学制药工程硕士
山东药品食品职业学院制药工程
简 系生物制药教研室主任 副教授
介 生物制药技术专业负责人
文档仅供参考,不能作为科学依据,请勿模仿;如有不当之处,请联系本人改正。
目 录
01 / 氨基酸、多肽及 蛋白质基本知识
水解法 发酵法 化学合成法
化学合成法是利用有机合成和化学工程相结合的 技术生产氨基酸的方法。
文档仅供参考,不能作为科学依据,请勿模仿;如有不当之处,请联系本人改正。
氨基酸药物 二、氨基酸药物生产
蛋白质的构件-氨基酸(共77张PPT)

苯丙氨酸
酪氨酸
色氨酸
3、杂环aa〔2种)
组氨酸
脯氨酸
按R基的极性性质分类:
1、非极性R基aa
丙氨酸
缬氨酸
亮氨酸
异亮氨酸
苯丙氨酸 酪氨酸
蛋氨酸
脯氨酸
2、不带电荷的极性R基aa
丝氨酸
苏氨酸
酪氨酸
天冬酰胺
谷氨酰胺
半胱氨酸
甘氨酸
3、带正电荷的R基aa
赖氨酸
精氨酸
组氨酸
4、带负电荷的R基aa
天冬氨酸
逆形M流成分 Sec布hitf原f’s侧理碱〔反自响链学〕 上甲硫基:强亲核基团与烃化试剂成锍盐
氨基酸是蛋白质的根本结构单元
固定相是液体,吸附在滤纸上,将样品点在纸上,用流动相展开
K值可以用测定滴定曲线的实验方法获得
C=O + H2N CH
C=N CH
Cu2+,Fe2+,Co2+或Mn2+时,易被氧化
〔Asp+〕
COO-
CH—NH3+
CH2
COOH K2
COO-
CH—NH3+
CH2
COO-
K3
〔Asp0〕 〔Asp-〕
COO-
CH—NH2
CH2
COO-
〔Asp--〕
〔一〕氨基酸的解离
COOH
CH—NH3+
(CH2)4
NH3+
K1
〔Lys++〕
COO-
CH—NH3+
(CH2)4
NH3+
K2
〔Lys+〕
谷氨酸
〔二〕不常见的蛋白质氨基酸
《氨基酸和多肽》课件

翻译后修饰是指多肽链在翻译后进行的化学修饰,如 磷酸化、糖基化、乙酰化等,这些修饰可以影响多肽
的稳定性、活性和功能。
04
翻译是指核糖体将mRNA上的密码子转译成氨基酸序 列的过程,通过tRNA的反密码子与mRNA上的密码 子配对,将相应的氨基酸连接到肽链上。
氨基酸和多肽的生物合成过程
氨基酸的生物合成过程包括原料 准备、合成阶段和产物输出等步
在生物技术领域,氨基酸和多肽可以用于设计和合成具有特定功能的蛋白质和抗体 ,为生物工程和生物制药等领域提供技术支持。
04 氨基酸和多肽的生物合成
氨基酸的生物合成
氨基酸是构成蛋白质的基本单位,具 有多种生物学功能。
转氨基作用是指氨基酸在转氨酶的作 用下,将氨基转移给α-酮戊二酸,生 成新的氨基酸和谷氨酸。
氨基酸的生理功能主要表现在合成蛋白 质和参与细胞代谢等方面,而多肽的生 理功能则更加多样化和复杂化,涉及信 号转导、免疫调节、激素和神经递质等
方面。
在生物体内,氨基酸和多肽相互协调和 配合,共同维持机体的正常生理功能。
氨基酸和多肽在生物体内发挥着重要 的生理作用,如蛋白质合成、细胞信 号转导等。
氨基酸的种类和排列顺序决定了多肽 的生物活性和功能。
氨基酸与多肽的区别
氨基酸是构成蛋白质的基本单位,是一种小分子,具有侧链基团;而多 肽则是由两个或多个氨基酸通过肽键连接而成的短肽链,具有相对复杂 的空间结构和生物活性。
骤。
多肽的生物合成过程包括转录、 翻译、翻译后修饰等步骤。
氨基酸和多肽的生物合成过程中 需要多种酶的参与,这些酶的作 用是促进化学反应的进行,并调
节代谢平衡。
05 氨基酸和多肽的生理功能
氨基酸的生理功能
合成蛋白质
有机化学第15章氨基酸多肽与蛋白质

H+ 水解 105oC
NHCH 2 CN H C H C NHCHCOH CH 3 CH 2 C 6 H 5 NO 2
DNFB-Gly-Ala-Phe
O O 2N NH CH 2 COH NO 2 O O + H 2 N CHC O H + H 2 NC HCOH CH 3 CH 2 C 6 H 5
甜菜碱
存在于多种蛋白性的动物保护组织(如毛发、角、指甲)中,通过氧化还 NH 2 原而相互转化。
-2 H 2 H SC H 2C H C O O H 2H NH2 SC H 2C H C O O H NH 2 SC H 2C H C H 2O O H
半胱氨酸
胱氨酸
3. 色氨酸
N H
C H 2C H C O O H NH2
R CH NH2 CH2 COOH R CH CH COOH
β-氨基酸受热失氨形成α, β-不饱和酸
R CH NH2 CH 2 C H 2CO O H R HC HN
H2 C CH2 + H O 2 C O
γ -氨基酸受热分子内氨基与羧基失水形成内酰胺(五元环内酰胺)
H2 C R CH NH2 CH2 CH2 C H 2C O O H HN C O CH 2 R HC CH 2
一 氨基的保护
1. 用氯代甲酸苯甲酯(或称苯甲氧基甲酰氯)保护
O
C6H5CH2OH+COCl2(光气)
C 6 H 5 CH 2 OCCl
Benzoxycarbonyl(简写Cbz)
反应过程:
+NH 3CH2CO2 -
O
C 6 H 5 CH 2 OCCl
O C 6 H 5 CH 2 OC-N H C H 2 C O O
氨基酸多肽及蛋白质

O
N H 2
O O+R C H 2C H C O O H
荧 光 胺
C O O H
RC H
N
+H 2 O
O O
*
食品化学 第六章 食品中的氨基酸、多肽及蛋白质类物质
生物活性肽也称作功能肽,是近年来非常活泼的研究领域,其应用涉及 到生物学、医药学、化学等多种学科,在食品科学研究及功能食品开发中 也显示出美好的前景。
去除正电荷
琥珀酸酐
O R NHCCH3
在Lys上引入正电荷
硫代仲康酸**
O C O O H 在Lys残基引入巯基
R N H C C H 2C H C H 2SH
*
食品化学 第六章 食品中的氨基酸、多肽及蛋白质类物质
官能团及反应
试剂及条件
产物
评价
6.芳基化
FDNB***
NO2
R NH
NO2
氨基酸序列测定
官能团及反应
氨基酸和蛋白质中官能团的化学反响性
试剂和条件
产物
评论
A.非α氨基 1.还原甲基化 2.胍基化 3.乙酰化 4.琥珀酰化 5.巯基化
甲醛、NaBH4 邻甲基异脲*,pH10.6,4℃,4d
+
R NHCH 32
+
NH2
R NHCNH2 O
蛋白放射性标记 Lys转换成Arg
乙酸酐
R NHCCH3
感染性疾病曾一度是人类生存所面临的最大威胁。随着抗生素的创造 和广泛使用,感染性疾病得到了一定程度的控制,但仍然是人类死亡的 一个重要原因。据WHO报告,2000年全球死亡人数5570万,其中 1440万由感染性疾病引起,占总死亡人数的15.9%。过去的几十年里, 耐药性微生物的不断产生和生物耐药性问题的日益恶化,开发新的抗感 染药物已成为治疗感染疾病的必由之路。昆虫抗菌肽因其独特的抗菌、 杀菌效果和良好的应用前景近来成为抗感染新药开发的热点。*目前国外
蛋白质氨基酸PPT课件

凝固作用分两个阶段: 首先是变性; 其次失去规律性的肽链聚集缠绕在一起而凝固或结絮;
2021
33
蛋白质变性的应用
理论上:
研究蛋白质分子结构与功能,分子量测定,亚单位拆分;
生产生活中有利的一面:
食品加工,消毒灭菌等; 非蛋白生物物质提取纯化,终止酶促反应;
生产生活中不利的一面:
活性蛋白制品(酶、抗体)的分离提取和保存;
第二十四章
氨基酸和蛋白质
2021
1
2021
2
2021
3
2021
4
2021
5
2021
6
2021
7
【观察与思考】
【思 考】:从结构上看,其共同点是什么?
2021
8
氨基酸分子中均含有羧基(-COOH)和 氨基(-NH2)原子团。α-氨基酸分子中氨基 接在离羧基最近的碳原子上。
多个氨基酸分子可以在分子间脱水,而形成 多肽(多肽是螺旋状的长链),再构成蛋白质。
系统命名法 a-氨基乙酸
a-氨基丙酸
Hale Waihona Puke NH2谷氨酸 HOOC (CH2)2 CH COOH
NH2
a-氨基戊二酸
苯丙氨酸
NH2
CH2 CH COOH a-氨基β-苯基丙酸
2021
12
3.物理性质
。
4.化学性质
(1)氨基酸的两性
氨基-NH2:能接受H+,显碱性
羧基-COOH:能提供H+,显酸性
R CH COOH OH- R CH COOH OH- R CH COO-
NH3+
H+
NH2
H+
NH2
氨基酸、肽和蛋白质ppt课件

➢ 含pro,HO-pro多不易变性凝固; 亚氨基酸,阻止支链交联
温度
蔗糖
水分含量
pH
2、低温处理下的变化
食品的低温贮藏可延缓或阻止微生物的生 长并抑制酶的活性及化学变化。 冷却(冷藏) 冷冻(冻藏)
➢ 冰结晶,蛋白质变性 水化作用降低;
➢ 快速冷冻法。
蛋白质与氧化剂之间的相互作用
食品常用氧化剂 H2O2 过氧苯甲酰 次氯酸钠
影响因素
有机溶剂
导致蛋白质溶解度下降或沉淀
降低水介质的介电常数 提高静电作用力 静电斥力导致分子结构的展开 促进氢键的形成和反电荷间的静电吸引
4、蛋白质的胶凝作用(Gelation)
沉淀作用:是指由于蛋白质的溶解性完全或部分
丧失而引起的聚集反应。
絮凝:是指蛋白质未发生变性时的无规则聚集反
离子强度
影响蛋白质结合水的环境因素
蛋白质浓度 ➢ 5-10%,浓度,水合作用
➢ 15-20%,Pr沉淀
pH
➢ pH= pI 水合作用最低 ➢ 高于或低于pI,水合作用增强
(净电荷和推斥力增加) ➢ pH 9-10时水合能力较大
温度
温度,蛋白质结合水的能力 (变性蛋白质结合水的能力一般比天然
蛋白质高约10%)
起泡性质的评价
蛋白质的起泡力 测定泡沫稳定性
影响泡沫形成和稳定性的因素:
蛋白质的分子性质
有良好起泡力的蛋白质不具有稳定泡沫的能力, 而能产生稳定泡沫的蛋白质往往不具有良好的
起泡力。
影响泡沫形成和稳定性的因素:
蛋白质的浓度
2%一8%,随着浓度增加起泡性增加。 超过10%,气泡变小,泡沫变硬。
用、乳化和起泡性等,都取决于水-蛋白质的相 互作用。
温度
蔗糖
水分含量
pH
2、低温处理下的变化
食品的低温贮藏可延缓或阻止微生物的生 长并抑制酶的活性及化学变化。 冷却(冷藏) 冷冻(冻藏)
➢ 冰结晶,蛋白质变性 水化作用降低;
➢ 快速冷冻法。
蛋白质与氧化剂之间的相互作用
食品常用氧化剂 H2O2 过氧苯甲酰 次氯酸钠
影响因素
有机溶剂
导致蛋白质溶解度下降或沉淀
降低水介质的介电常数 提高静电作用力 静电斥力导致分子结构的展开 促进氢键的形成和反电荷间的静电吸引
4、蛋白质的胶凝作用(Gelation)
沉淀作用:是指由于蛋白质的溶解性完全或部分
丧失而引起的聚集反应。
絮凝:是指蛋白质未发生变性时的无规则聚集反
离子强度
影响蛋白质结合水的环境因素
蛋白质浓度 ➢ 5-10%,浓度,水合作用
➢ 15-20%,Pr沉淀
pH
➢ pH= pI 水合作用最低 ➢ 高于或低于pI,水合作用增强
(净电荷和推斥力增加) ➢ pH 9-10时水合能力较大
温度
温度,蛋白质结合水的能力 (变性蛋白质结合水的能力一般比天然
蛋白质高约10%)
起泡性质的评价
蛋白质的起泡力 测定泡沫稳定性
影响泡沫形成和稳定性的因素:
蛋白质的分子性质
有良好起泡力的蛋白质不具有稳定泡沫的能力, 而能产生稳定泡沫的蛋白质往往不具有良好的
起泡力。
影响泡沫形成和稳定性的因素:
蛋白质的浓度
2%一8%,随着浓度增加起泡性增加。 超过10%,气泡变小,泡沫变硬。
用、乳化和起泡性等,都取决于水-蛋白质的相 互作用。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
按分子中氨基和羧基的数目分为中性 氨基酸,酸性氨基酸,碱性氨基酸。
2.命名: 多按其来源或性质而命名。国际 上有通用的符号(见P616表20-1)。
3.构型: 用D/ L体系表示——在费歇尔投 影式中氨基位于横键右边的为D型,位于 左边的为L型。例如:
ppt课件
6
COOH H C NH2
R
COOH NH2 C H
物理性质
大部分的氨基酸在水中有一定的溶解度;
酸性的氨基酸在水中的溶解度较差;
氨基酸在200度以下都是稳定的;
氨基酸的pKa为2左右;
每一个光学纯的氨基酸都有旋光值。
ppt课件
10
二、氨基酸的性质
1、氨基酸的酸-碱性——两性与等电点 氨基酸分子中的氨基是碱性的,而羧
基是酸性的,因而氨基酸既能与酸反应, 也能与碱反应,是一个两性化合物。
ppt课件
8
8个人体必需氨基酸
(C H 3 )2 C H C H (N H 2 )C O O H( C H 3 ) 2 C H C H 2 C H ( N H 2 ) C O O H
缬氨酸
亮氨酸
C2H5CHCH(NH2)COOH CH3 异亮氨酸
CH3CHCH(NH2)COOH OH 苏氨酸
C 6 H 5 C H 2 C H (N H 2 )C O O HC H 3 S ( C H 2 ) 2 C H (N H 2 )C O O H
酐等都可用作酰化剂。在蛋白质的合成过程
中为了保护氨基则用苄氧甲酰氯作为酰化剂。
O
R
OR
C 2O H C C + N l 2 C H C H OOH C 2O H C NC H C H O
ppt课件
15
(2)氨基的烃基化 氨基酸与RX作用则烃基化 成N-烃基氨基酸:
N2O R
N2O R
N2O F+N 2C HC HOO N H 2O NC HC HOO
(1)两性
H
OH
RCC HOOH RCC HOOH RCC HOO
N3H
N2H
N2H
ppt课件
11
氨基酸在一般情况下不是以游离的羧 基或氨基存在的,而是两性电离,在固态 或水溶液中形成内盐。
RCH COOH RCH COO
N2 H
N3 H
ppt课件
12
(2)等电点
在氨基酸水溶液中加入酸或碱,至使羧基和氨 基的离子化程度相等(即氨基酸分子所带电荷呈中 性——处于等电状态)时溶液的pH值称为氨基酸 的等电点。常以pI表示。
ppt课件
2
精品资料
• 你怎么称呼老师?
• 如果老师最后没有总结一节课的重点的难点,你 是否会认为老师的教学方法需要改进?
• 你所经历的课堂,是讲座式还是讨论式? • 教师的教鞭
• “不怕太阳晒,也不怕那风雨狂,只怕先生骂我 笨,没有学问无颜见爹娘 ……”
• “太阳当空照,花儿对我笑,小鸟说早早早……”
氨基酸
组成蛋白质的氨基酸(天然产氨基酸) 都是α-氨基酸,即在α-碳原子上有一个氨 基,可用下式表示:
H
天然产的各种不同
R C COOH
的α- 氨基酸只是R不同
NH 2
而已。
氨基酸目前已知的已超
过100种以上,但在生物体内作为合成蛋白
质的原料只有20种pp(t课件见P285表15-1)。 5
1.分类: 按烃基类型可分为脂肪族氨基酸, 芳香族氨基酸,含杂环氨基酸。
碱性氨基酸 pI = 7.6~10.8
2°等电点时,偶极离子在水中的溶解 度最小,易结晶析出。
ppt课件
14
2、氨基酸氨基的反应
(1)氨基的酰基化 氨基酸分子中的氨基 能酰基化成酰胺。
R
R
RC ' O +N C 2C H lC HOOR H C 'NC HC HO +H OC H
O
乙酰氯、醋酸酐、苯甲酰氯邻苯二甲酸
R
天然氨基酸(出甘氨酸外)其他所有
α-碳原子都是手性的,都有旋光性,而 且发现主要是L型的(也有D型的,但很 少)。
ppt课件
7
存在形式:氨基酸都以偶极离子的形式存在。
CH3-CH-COONH3
+
丙氨酸
HO 2C(C2H )2-CH C-OO谷氨酸
NH 3
+
CH2-CH-COO
N
NH3
+
N H
组氨酸
氟代二硝基苯在多肽结构分析中用作测定N 端的试剂。
(3)与亚硝酸反应
R CC HO +H O 2 N H O R CC HO + N 2 O + H 2 H O
N 2H
OH
反应是定量完成的,衡量的放出N2,测定 N2的体积便可计算出氨基酸只氨基的含量。
ppt课件
16
(4)与茚三酮反应
α-氨基酸在碱性溶液中与茚三酮作用, 生成显蓝色或紫红色的有色物质,是鉴别 α-氨基酸的灵敏的方法。
CO CO
CO
C
OH O
水合茚三酮
C
O OH
C + RCHCOOH
C OOH NH2
ppt课件
CO
O C
C NC
CO
C HO
RCHO + CO
3H2O
17
3、氨基酸羧基的反应
氨基酸分子中羧基的反应主要利用它 能成酯、成酐、成酰胺的性质。这里值得 特别提出的是将氨基酸转化为叠氮化合物 的方法(氨基酸酯与肼作用生成酰肼,酰 肼与亚硝酸作用则生成叠氮化合物)。
苯丙氨酸 H 2 N (C H 2 )4 C H (N H 2 )C O O H
蛋氨酸
CH2CH(NH2)COOH
赖氨酸
ppt课件
N H
色氨酸
9
一、 名称和物理性质
名称
氨基酸的碳原子(除甘氨酸外)都是手性碳原子。 其构型的表示方法与糖一样,用D或L表示。 每个氨基酸都有俗名,并都用一个缩写符号表示。
第十五章、氨基酸、多肽和蛋白质
学习要求:
1、掌握α-氨基酸的结构、两性、等电点、 主要化学性质及制法。
2、了解肽的命名、结构和多肽结构的测定 方法。
3、掌握蛋白质的性质,了解蛋白质复杂结 构及在构成生命体上的作用。
ppt课件
1
蛋白质是天然高分子化合物,是生命 物质的基础。我们知道,生命活动的基本 特征就是蛋白质的不断自我更新。蛋白质 是一切活细胞的组织物质,也是酶、抗体 和许多激素中的主要物质。所有蛋白质都 是α-由氨基酸构成的,因此,α-由氨基酸 是建筑蛋白质的砖石。要讨论蛋白质的结 构和性质,首先要研究α-由氨基酸。
R CHCOOH NH2
OH R CHCOO
R CHCOO
H
R CHCOOH
NH2
H
NH3
OH
NH3
溶液pH>等电点 等电点(pI)
溶液pH<等电点
ppt课件
13
注:1°等电点为电中性而不是中性(即 pH=7),在溶液中加入电极时其电荷迁 移为零。
中性氨基酸 pI = 4.8~6.3
酸性氨基酸 pI = 2.7~3.2
2.命名: 多按其来源或性质而命名。国际 上有通用的符号(见P616表20-1)。
3.构型: 用D/ L体系表示——在费歇尔投 影式中氨基位于横键右边的为D型,位于 左边的为L型。例如:
ppt课件
6
COOH H C NH2
R
COOH NH2 C H
物理性质
大部分的氨基酸在水中有一定的溶解度;
酸性的氨基酸在水中的溶解度较差;
氨基酸在200度以下都是稳定的;
氨基酸的pKa为2左右;
每一个光学纯的氨基酸都有旋光值。
ppt课件
10
二、氨基酸的性质
1、氨基酸的酸-碱性——两性与等电点 氨基酸分子中的氨基是碱性的,而羧
基是酸性的,因而氨基酸既能与酸反应, 也能与碱反应,是一个两性化合物。
ppt课件
8
8个人体必需氨基酸
(C H 3 )2 C H C H (N H 2 )C O O H( C H 3 ) 2 C H C H 2 C H ( N H 2 ) C O O H
缬氨酸
亮氨酸
C2H5CHCH(NH2)COOH CH3 异亮氨酸
CH3CHCH(NH2)COOH OH 苏氨酸
C 6 H 5 C H 2 C H (N H 2 )C O O HC H 3 S ( C H 2 ) 2 C H (N H 2 )C O O H
酐等都可用作酰化剂。在蛋白质的合成过程
中为了保护氨基则用苄氧甲酰氯作为酰化剂。
O
R
OR
C 2O H C C + N l 2 C H C H OOH C 2O H C NC H C H O
ppt课件
15
(2)氨基的烃基化 氨基酸与RX作用则烃基化 成N-烃基氨基酸:
N2O R
N2O R
N2O F+N 2C HC HOO N H 2O NC HC HOO
(1)两性
H
OH
RCC HOOH RCC HOOH RCC HOO
N3H
N2H
N2H
ppt课件
11
氨基酸在一般情况下不是以游离的羧 基或氨基存在的,而是两性电离,在固态 或水溶液中形成内盐。
RCH COOH RCH COO
N2 H
N3 H
ppt课件
12
(2)等电点
在氨基酸水溶液中加入酸或碱,至使羧基和氨 基的离子化程度相等(即氨基酸分子所带电荷呈中 性——处于等电状态)时溶液的pH值称为氨基酸 的等电点。常以pI表示。
ppt课件
2
精品资料
• 你怎么称呼老师?
• 如果老师最后没有总结一节课的重点的难点,你 是否会认为老师的教学方法需要改进?
• 你所经历的课堂,是讲座式还是讨论式? • 教师的教鞭
• “不怕太阳晒,也不怕那风雨狂,只怕先生骂我 笨,没有学问无颜见爹娘 ……”
• “太阳当空照,花儿对我笑,小鸟说早早早……”
氨基酸
组成蛋白质的氨基酸(天然产氨基酸) 都是α-氨基酸,即在α-碳原子上有一个氨 基,可用下式表示:
H
天然产的各种不同
R C COOH
的α- 氨基酸只是R不同
NH 2
而已。
氨基酸目前已知的已超
过100种以上,但在生物体内作为合成蛋白
质的原料只有20种pp(t课件见P285表15-1)。 5
1.分类: 按烃基类型可分为脂肪族氨基酸, 芳香族氨基酸,含杂环氨基酸。
碱性氨基酸 pI = 7.6~10.8
2°等电点时,偶极离子在水中的溶解 度最小,易结晶析出。
ppt课件
14
2、氨基酸氨基的反应
(1)氨基的酰基化 氨基酸分子中的氨基 能酰基化成酰胺。
R
R
RC ' O +N C 2C H lC HOOR H C 'NC HC HO +H OC H
O
乙酰氯、醋酸酐、苯甲酰氯邻苯二甲酸
R
天然氨基酸(出甘氨酸外)其他所有
α-碳原子都是手性的,都有旋光性,而 且发现主要是L型的(也有D型的,但很 少)。
ppt课件
7
存在形式:氨基酸都以偶极离子的形式存在。
CH3-CH-COONH3
+
丙氨酸
HO 2C(C2H )2-CH C-OO谷氨酸
NH 3
+
CH2-CH-COO
N
NH3
+
N H
组氨酸
氟代二硝基苯在多肽结构分析中用作测定N 端的试剂。
(3)与亚硝酸反应
R CC HO +H O 2 N H O R CC HO + N 2 O + H 2 H O
N 2H
OH
反应是定量完成的,衡量的放出N2,测定 N2的体积便可计算出氨基酸只氨基的含量。
ppt课件
16
(4)与茚三酮反应
α-氨基酸在碱性溶液中与茚三酮作用, 生成显蓝色或紫红色的有色物质,是鉴别 α-氨基酸的灵敏的方法。
CO CO
CO
C
OH O
水合茚三酮
C
O OH
C + RCHCOOH
C OOH NH2
ppt课件
CO
O C
C NC
CO
C HO
RCHO + CO
3H2O
17
3、氨基酸羧基的反应
氨基酸分子中羧基的反应主要利用它 能成酯、成酐、成酰胺的性质。这里值得 特别提出的是将氨基酸转化为叠氮化合物 的方法(氨基酸酯与肼作用生成酰肼,酰 肼与亚硝酸作用则生成叠氮化合物)。
苯丙氨酸 H 2 N (C H 2 )4 C H (N H 2 )C O O H
蛋氨酸
CH2CH(NH2)COOH
赖氨酸
ppt课件
N H
色氨酸
9
一、 名称和物理性质
名称
氨基酸的碳原子(除甘氨酸外)都是手性碳原子。 其构型的表示方法与糖一样,用D或L表示。 每个氨基酸都有俗名,并都用一个缩写符号表示。
第十五章、氨基酸、多肽和蛋白质
学习要求:
1、掌握α-氨基酸的结构、两性、等电点、 主要化学性质及制法。
2、了解肽的命名、结构和多肽结构的测定 方法。
3、掌握蛋白质的性质,了解蛋白质复杂结 构及在构成生命体上的作用。
ppt课件
1
蛋白质是天然高分子化合物,是生命 物质的基础。我们知道,生命活动的基本 特征就是蛋白质的不断自我更新。蛋白质 是一切活细胞的组织物质,也是酶、抗体 和许多激素中的主要物质。所有蛋白质都 是α-由氨基酸构成的,因此,α-由氨基酸 是建筑蛋白质的砖石。要讨论蛋白质的结 构和性质,首先要研究α-由氨基酸。
R CHCOOH NH2
OH R CHCOO
R CHCOO
H
R CHCOOH
NH2
H
NH3
OH
NH3
溶液pH>等电点 等电点(pI)
溶液pH<等电点
ppt课件
13
注:1°等电点为电中性而不是中性(即 pH=7),在溶液中加入电极时其电荷迁 移为零。
中性氨基酸 pI = 4.8~6.3
酸性氨基酸 pI = 2.7~3.2
