小而密低密度脂蛋白胆固醇(sd LDL-C)测定试剂盒(过氧化物酶法)产品技术要求百奥泰康
低密度脂蛋白胆固醇测定试剂盒产品技术审评规范版完整版

低密度脂蛋白胆固醇测定试剂盒产品技术审评规范版HEN system office room 【HEN16H-HENS2AHENS8Q8-HENH1688】附件4低密度脂蛋白胆固醇测定试剂(盒)产品技术审评规范(2017版)本规范旨在指导注册申请人对低密度脂蛋白胆固醇测定试剂(盒)注册申报资料的准备及撰写,同时也为技术审评部门对注册申报资料的技术审评提供参考。
本审评规范是对低密度脂蛋白胆固醇测定试剂(盒)的一般要求,申请人应依据具体产品的特性对注册申报资料的内容进行充实和细化,并依据产品特性确定其中的具体内容是否适用。
本规范是对申请人和审查人员的指导性文件,但不包括注册审批所涉及的行政事项,亦不作为法规强制执行,如果有能够满足相关法规要求的其他方法,也可以采用,但需要提供详细的研究资料和验证资料。
应在遵循相关法规的前提下使用本规范。
本规范是在现行法规和标准体系以及当前认知水平下制定的,随着法规和标准的不断完善,以及科学技术的不断发展,本规范相关内容也将进行适时调整。
一、适用范围低密度脂蛋白胆固醇测定试剂(盒)用于体外定量测定人血清和/或血浆中的低密度脂蛋白胆固醇的含量。
从方法学考虑,本规范主要指基于分光光度法原理,利用全自动、半自动生化分析仪或分光光度计,在医学实验室进行低密度脂蛋白胆固醇定量检验所使用的临床化学体外诊断试剂。
本规范不适用于干式低密度脂蛋白胆固醇测定试剂(盒),但适用处可参照执行。
依据《体外诊断试剂注册管理办法》(国家食品药品监督管理总局令第5号,以下简称《办法》)、《食品药品监管总局关于印发体外诊断试剂分类子目录的通知》(食药监械管[2013]242号)低密度脂蛋白胆固醇测定试剂盒管理类别为Ⅱ类,分类代号为6840。
二、注册申报资料要求(一)综述资料综述资料主要包括产品预期用途、临床意义、产品描述、有关生物安全性方面说明、研究结果的总结评价以及同类产品上市情况介绍等内容,应符合《体外诊断试剂注册管理办法》和《关于公布体外诊断试剂注册申报资料要求和批准证明文件格式的公告》(国家食品药品监督管理总局〔2014〕第44号公告)相关要求。
小而密低密度脂蛋白胆固醇测定试剂盒(过氧化物酶法)产品技术要求zsbk

小而密低密度脂蛋白胆固醇测定试剂盒(过氧化物酶法)适用范围:本试剂用于体外定量测定人血清中小而密低密度脂蛋白胆固醇的含量。
1.1包装规格试剂1(R1):60mL×1,试剂2(R2):20 mL×1;试剂1(R1):60mL×2,试剂2(R2):20 mL×2;试剂1(R1):45mL×1,试剂2(R2):15 mL×1;试剂1(R1):15mL×1,试剂2(R2): 5 mL×1;校准品(选配)(冻干粉):1mL×1;2mL×1;质控品(选配)(冻干粉,2个水平):冻干粉型1mL×2;2mL×2。
1.2规格划分说明根据净含量和复溶体积划分规格。
1.3主要组成成分2.1 外观试剂盒中各组件的外观应满足:2.2.1 试剂1(R1)应为无色至淡褐色液体,无沉淀及絮状物,外包装完整无破损;2.2.2 试剂2(R2)应为淡黄色至黄色液体,无沉淀及絮状物,外包装完整无破损;2.2.3 校准品应为白色或淡黄色冻干粉,复溶后应为无色或淡黄色溶液,无混浊,无未溶解物,外包装完整无破损;2.2.4 质控品应为白色或淡黄色冻干粉,复溶后应为无色或淡黄色溶液,无混浊,无未溶解物,外包装完整无破损。
2.2 净含量液体试剂净含量应不少于标示值。
2.3 试剂空白吸光度在波长600nm(580 nm~620nm)(光径1cm)处,试剂空白吸光度(A)应≤0.05。
2.4 准确度与已上市同类试剂分别测定40例血清样本,计算两组数据的相关系数(r)及测值的相对偏差,在[4,70]mg/dL范围内,线性相关系数r应≥0.975;在[4,30]mg/dL范围内,线性绝对偏差应不超过±4.5mg/dL;在(30,70]mg/dL 范围内,线性相对偏差应不超过±15%。
2.5分析灵敏度对应于浓度为40mg/dL的样本所引起的吸光度变化在0.02~0.20之间。
小而密低密度脂蛋白胆固醇(sd LDL-C)测定试剂盒(过氧化物酶法)产品技术要求百奥泰康

小而密低密度脂蛋白胆固醇(sd LDL-C)测定试剂盒(过氧化物酶法)适用范围:该产品用于体外定量测定人血清或血浆中小而密低密度脂蛋白胆固醇的含量。
1.1 产品规格1.2 组成成分1.2.1 试剂组成试剂1:Tris 缓冲液 100mmol/L胆固醇酯酶(CHE) 1600U/L胆固醇氧化酶(CHO) 600U/L磷脂酶 2700U/L过氧化氢酶 1200U/L2-羟基-3-间甲苯胺丙磺酸钠 2mmol/L试剂2:Tris 缓冲液 100mmol/L过氧化物酶(POD) 5000U/L4-氨基安替比林4mmol/L1.2.2校准品的组成校准品为冻干品,校准品组成是在磷酸盐缓冲液中加入含一定浓度的小而密低密度脂蛋白胆固醇纯品,稳定剂<5%。
1个水平校准品目标浓度为1.1 mmol/L(42.5 mg/dL),浓度有批特异性,具体定值详见瓶签。
1.2.3质控品的组成两水平冻干质控品,在20g/L牛血清中加入小而密低密度脂蛋白胆固醇纯品,稳定剂<5%。
靶值范围分别为:0.259 ~ 1.036 mmol/L(10.0~40.0 mg/dL)、1.036 ~2.072 mmol/L(40.0~80.0 mg/dL)。
2.1 外观试剂 1 为无色到淡褐色液体,目测不得有任何沉淀及絮状悬浮物;试剂 2 为淡黄色到黄色液体,目测不得有任何沉淀及絮状悬浮物;校准品为白色或淡黄色粉末状物质,复溶后为无色或淡黄色液体,目测不得有任何沉淀及絮状悬浮物;质控品为白色或淡黄色粉末状物质,复溶后为无色或淡黄色液体,目测不得有任何沉淀及絮状悬浮物。
2.2 净含量液体试剂的净含量不得低于标示体积。
2.3 空白吸光度试剂空白吸光度应≤0.1。
2.4 分析灵敏度浓度为2.59 mmol/L(100.0 mg/dL)时,吸光度变化应≥0.05。
2.5 线性测试血清样本,试剂线性在[0.1,2.59] mmol/L([4.0,100.0] mg/dL)范围内,线性相关系数(r)应不小于0.99;测定结果在[0.1,0.777] mmol/L([4.0,30.0] mg/dL)时绝对偏差不超过±0.078 mmol/L (± 3 mg/dL);在(0.777,2.59]mmol/L ((30,100.0] mg/dL)范围内的相对偏差不超过±10%。
小而密低密度脂蛋白胆固醇

Any hardcopy, printed or photocopied, is considered an uncontrolled copy, unless it is the original, signed-off version 记录改版或修订需更改的内容:1检验目的规范小而密低密度脂蛋白胆固醇(sdLDL-C)的检测试验,确保检测结果的准确性和重复性。
2检验项目方法和原理2.1方法:直接清除法2.2原理:小而密低密度脂蛋白胆固醇(sdLDL-C)测定试剂盒采用的测定方法为直接清除法:试剂I中的聚阴离子和抗人高密度脂蛋白抗体选择性地抑制sdLDL以外的脂蛋白,适量的非离子表面活性剂在胆固醇氧化酶(CO)和胆固醇脂酶(CE)、过氧化氢酶存在下消除非sdLDL脂蛋白中的胆固醇。
剩余的sdLDL-C与胆固醇酶试剂反应而显色。
3标本要求3.1原始样本类型:血清。
3.2标本容器:真空采血管中的红盖管。
添加剂为促凝剂。
3.3标本保存和运送:室温保存,及时送检。
15-25℃可稳定1天,2-8℃可稳定3天,(-15)-(-25)℃可保存2月。
3.4标本采血量:静脉血2 ml。
3.5标本处理:2500~3000r/min离心6-10min,分离血清待上机。
3.6注意事项:试剂变浑浊或空白吸光度值>0.200时,将不能使用,应弃去。
4患者准备要求患者采样前需禁食8-12小时,最好3天内不要暴食5试剂和仪器5.1试剂5.1.1来源:浙江东瓯诊断产品有限公司5.1.2规格:R1:3×50 ml, R2:1×50 ml5.1.3试剂盒组成:R1 N-乙基-N-(3-磺丙基)-3-甲基苯胺≥0.1 g/L;胆固醇氧化酶≥0.2 KU/L; 胆固醇酯酶≥1 KU/L;过氧化氢酶≥500 KU/L;抗人高密度脂蛋白抗体≥10 mg/L;聚阴离子≥0.2 g/L;表面活性剂适量R2 过氧化氢酶≥5 KU/L; 4-氨基安替比林≥0.1 g/L;表面活性剂适量; 稳定剂适量5.1.4储存和稳定性:2-8℃冷藏,避光保存至有效期,保持竖直向上存放。
小而密低密度脂蛋白胆固醇测定试剂盒(过氧化物酶法)产品技术要求jiuqiang
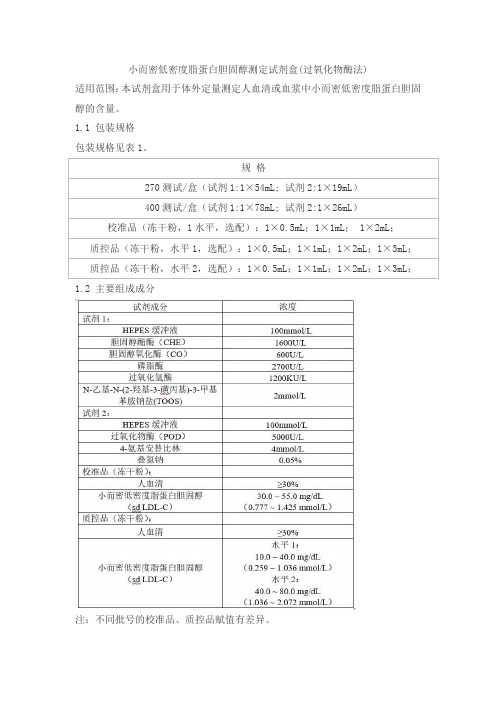
小而密低密度脂蛋白胆固醇测定试剂盒(过氧化物酶法)适用范围:本试剂盒用于体外定量测定人血清或血浆中小而密低密度脂蛋白胆固醇的含量。
1.1 包装规格包装规格见表1。
1.2 主要组成成分注:不同批号的校准品、质控品赋值有差异。
2.1 外观试剂1为无色到淡褐色液体,目测不得有任何沉淀及絮状悬浮物;试剂2为淡黄色到黄色液体,目测不得有任何沉淀及絮状悬浮物;校准品为白色或淡黄色粉末状物质,复溶后为无色或淡黄色液体,目测不得有任何沉淀及絮状悬浮物;质控品为白色或淡黄色粉末状物质,复溶后为无色或淡黄色液体,目测不得有任何沉淀及絮状悬浮物。
试剂盒标签标识清晰,外包装完整无损。
2.2 净含量液体试剂的净含量应不少于标称量。
2.3 试剂空白吸光度A600nm下测定空白吸光度应≤ 0.05。
2.4 准确度与已上市产品进行比对试验:在 [4.0,100.0] mg/dL([0.104,2.59] mmol/L)区间内,相关系数r≥0.975,在 [4.0,30.0] mg/dL([0.104,0.777] mmol/L)区间内测定的绝对偏差应不超过±3 mg/dL (±0.0777 mmol/L),在(30,100.0] mg/dL ((0.777,2.59] mmol/L)区间内测定的相对偏差应不超过±10%。
2.5 分析灵敏度样本浓度为100.0 mg/dL(2.59 mmol/L)时,其吸光度变化在0.0500~0.2500之间。
2.6 线性区间在[4.0,100.0] mg/dL([0.104,2.59] mmol/L)区间内,线性相关系数r≥0.990, 在[4.0,30.0] mg/dL([0.104,0.777] mmol/L)区间内测定的绝对偏差应不超过±3 mg/dL(±0.0777 mmol/L),在(30,100.0] mg/dL((0.777,2.59] mmol/L)区间内测定的相对偏差应不超过±10%。
sdLDL-C小而密低密度脂蛋白胆固醇测定试剂盒(过氧化物酶法)产品技术要求

医疗器械产品技术要求编号:小而密低密度脂蛋白胆固醇测定试剂盒(过氧化物酶法)1.产品型号/规格及其划分说明R1:2×15ml 、R2:2×5mL ;校准品(选配):1×2ml ;质控品(选配):2×1ml (2个水平,每个水平1mL )。
2.性能指标2.1外观2.1.1试剂盒各组分应齐全、完整、液体无渗漏;中文包装标签应清晰、准确、牢固。
2.1.2 R1为无色液体,R2为无色或淡黄色液体。
2.2净含量液体试剂净含量应不少于标示值。
2.3试剂空白吸光度试剂空白吸光度A cm nm1600应<0.5。
2.4分析灵敏度测试(1.02±0.2)mmol/L 的样品,吸光度差值( A )应≥0.01。
2.5线性范围在[0.1~2.6]mmol/L 内线性相关系数r≥ 0.990。
在[0.1,0.5]mmol/L 范围内,绝对偏差≤0.5mmol/L ;在(0.5,2.6]mmol/L 范围内,相对偏差应不超过±15%。
2.6精密度2.6.1 重复性变异系数,CV 应≤10%。
2.6.2批间差相对极差,R ≤15%。
2.7准确度相对偏差应不超过±15%。
2.8 校准品、质控品2.8.1校准品、质控品外观白色或微黄色冻干品。
2.8.2校准品、质控品的准确度相对偏差在±15.0%范围内。
2.8.3校准品、质控品的均一性变异系数CV≤10.0%。
2.8.4校准品、质控品的批内瓶间差批内瓶间差CV≤15.0%。
3 检验方法检测条件:a)生化分析仪波长600nm;温度37℃±0.1℃。
b)恒温装置、准确加样器、生化分析仪。
测试方法按说明书规定,因不同机型使用试剂最终浓度相同。
在此推荐以本公司的BECKMAN或HITACHI全自动生化分析仪进行测试。
3.1 外观目测检查,应符合2.1的要求。
3.2 净含量用通用量具测量,应符合2.2的要求。
小而密低密度脂蛋白胆固醇测定试剂盒(过氧化物酶法)产品技术要求jiuqiang

小而密低密度脂蛋白胆固醇测定试剂盒(过氧化物酶法)适用范围:本试剂盒用于体外定量测定人血清或血浆中小而密低密度脂蛋白胆固醇的含量。
1.1 包装规格包装规格见表1。
表1 包装规格包装规格试剂1:3×20mL、试剂2:1×20mL试剂1:1×60mL、试剂2:1×20mL试剂1:2×60mL、试剂2:2×20mL试剂1:3×60mL、试剂2:3×20mL试剂1:6×60mL、试剂2:2×60mL试剂1:4×90mL、试剂2:2×60mL试剂1:2×90mL、试剂2:1×60mL试剂1:1×45mL、试剂2:1×15mL试剂1:2×45mL、试剂2:2×15mL试剂1:24×3.8mL、试剂2:12×2.6mL试剂1:12×3.8mL、试剂2:6×2.6mL试剂1:1×18mL、试剂2:1×6mL试剂1:6×60mL、试剂2:2×45mL试剂1:4×90mL、试剂2:2×45mL试剂1:2×90mL、试剂2:1×45mL试剂1:1×60mL、试剂2:1×15mL试剂1:2×60mL、试剂2:2×15mL试剂1:1×40mL、试剂2:1×10mL试剂1:2×40mL、试剂2:2×10mL试剂1:1×20mL、试剂2:1×5mL试剂1:24×3.8mL、试剂2:6×3.8mL试剂1:1×50mL、试剂2:1×10mL试剂1:2×50mL、试剂2:2×10mL试剂1:2×60mL、试剂2:2×12 mL试剂1:1×25mL、试剂2:1×5 mL试剂1:30×3.8mL、试剂2:6 ×3.8mL校准品(冻干粉,1水平):1×0.5mL;1×1mL;1×2mL;质控品(冻干粉,水平1):1×0.5mL;1×1mL;1×2mL;1×3mL;质控品(冻干粉,水平2):1×0.5mL;1×1mL;1×2mL;1×3mL;1.2 主要组成成分表2 主要组成成分2.1 外观试剂1为无色到淡褐色液体,目测不得有任何沉淀及絮状悬浮物;试剂2为淡黄色到黄色液体,目测不得有任何沉淀及絮状悬浮物;校准品为白色或淡黄色粉末状物质,复溶后为无色或淡黄色液体,目测不得有任何沉淀及絮状悬浮物;质控品为白色或淡黄色粉末状物质,复溶后为无色或淡黄色液体,目测不得有任何沉淀及絮状悬浮物。
低密度脂蛋白胆固醇(LDL-C)测定试剂盒(直接法-保护性试剂法)产品技术要求kemei

低密度脂蛋白胆固醇(LDL-C)测定试剂盒(直接法-保护性试剂法)适用范围:本试剂盒用于体外定量测定人血清中低密度脂蛋白胆固醇(LDL-C)的浓度。
1.1包装规格1.2主要组成成分2.1外观2.1.1试剂1应为无色或淡黄色透明溶液,无混浊,无未溶解物;2.1.2试剂2应为无色或淡黄色透明溶液,无混浊,无未溶解物;2.1.3校准品应为无色至淡黄色固体;2.1.4质控品应为无色至淡黄色固体。
2.2净含量液体试剂的净含量应不少于标示值。
2.3试剂空白LDL-C试剂盒在波长(600±20)nm处测定空白样品的吸光度值,应不大于0.0500。
2.4分析灵敏度LDL-C试剂盒测试1.00mmol/LLDL-C时,吸光度差值(ΔA)应大于0.0300。
2.5准确度测定国际参考物质SRM1951,测定结果的相对偏差不大于10%。
2.6精密度2.6.1重复性重复测试(2.50±0.50)mmol/L和(5.00±1.00)mmol/L的样品,所得结果的变异系数CV应不大于3%;2.6.2批间差测试(2.50±0.50)mmol/L的样本,所得结果的批间相对极差应不大于10%;2.7线性范围LDL-C试剂盒在[0.30,10.00] mmol/L范围内,线性相关系数(r)应不小于0.995;在[0.30,3.00] mmol/L区间内,线性绝对偏差应不超过±0.30mmol/L;在(3.00,10.00] mmol/L区间内,线性相对偏差应不超过±10%。
2.8质控品赋值有效性重复测定质控品,测定结果应在质控范围内。
2.9稳定性原包装的试剂盒在2℃~8℃密封避光贮存,有效期为12个月。
原包装校准品与质控品在2℃~8℃密封避光贮存,有效期为18个月。
在有效期满后2个月内,试剂性能应符合2.1、2.3、2.4、2.5、2.6.1、2.7、2.8的要求。
2.10校准品/质控品批内瓶间差批内瓶间差的变异系数(CV)应≤3%。
武汉生之源生物科技股份有限公司产品推荐手册说明书

武汉生之源生物科技股份有限公司WUHAN LIFE ORIGIN BIOTECH JOINT STOCK CO., LTD.电话:+86-027-******** 传真:+86-27-87196320 武汉生之源生物科技股份有限公司WUHAN LIFE ORIGIN BIOTECH JOINT STOCK CO., LTD.生化类|POCT类发光类|PRODUCT RECOMMENDATIONS重点产品推荐手册武汉生之源生物科技股份有限公司(以下简称“生之源”或“该公司”)是一家集研发,生产和销售于一体的国家高科技企业。
作为科技驱动型企业,公司拥有国内领先的生化产品研发平台、胶乳增强免疫比浊平台、POCT产品研发平台、化学发光产品研发平台和参考实验室平台,形成由产品研发到成品销售的完整产品链。
生之源已成为在中国拥有完整IVD试剂产业链的极少数IVD试剂公司之一。
作为体外诊断试剂和科学试剂的制造商,目前,已有80多种体外诊断试剂产品关于生之源公司介绍COMPANYPROFILE 通过了CFDA注册和CE认证。
产品主要涉及的临床应用包括:肾功能,葡萄糖代谢,胰腺,肝功能,电解质,血脂,心血管,特殊蛋白质和无机离子。
生之源的目标是提供最高质量的体外诊断试剂和科研试剂,通过与优秀团队的良好合作以及高端技术人才的吸收,公司不断完善自身技术领域的技术平台,优化产品性能,以更好地满足客户的各种需求。
限公司的全资子公司,是一家专业从事体外诊断试剂研发,生产、技术服务于一体的高新技术企业,公司坐落于位于长沙——山和医药健康产业园。
公司秉持着“用生物技术为人类服务,让人类生活更美好”的美好愿景,重视产品技术实验、技术创新以及产品升级研发,致力于为诊断客户提供性能卓越的体外诊断试剂产品。
盖肝功能,肾功能,心脑血管,代谢疾病,免疫功能及炎症等多个临床应用方向,其中包括了多个前沿的创新诊疗项目,致力于为患者提供全方位的诊断服务。
低密度脂蛋白胆固醇(LDL-C)测定试剂盒(酶直接法)使用说明书
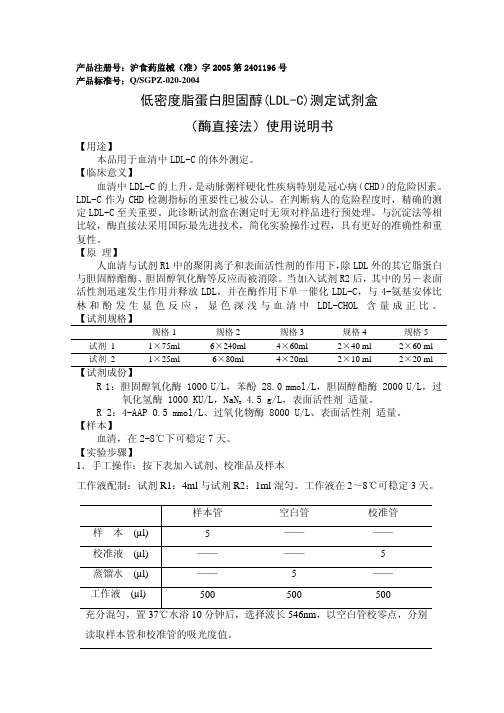
产品注册号:沪食药监械(准)字2005第2401196号产品标准号:Q/SGPZ-020-2004低密度脂蛋白胆固醇(LDL-C)测定试剂盒(酶直接法)使用说明书【用途】本品用于血清中LDL-C的体外测定。
【临床意义】血清中LDL-C的上升,是动脉粥样硬化性疾病特别是冠心病(CHD)的危险因素。
LDL-C作为CHD检测指标的重要性已被公认。
在判断病人的危险程度时,精确的测定LDL-C至关重要。
此诊断试剂盒在测定时无须对样品进行预处理。
与沉淀法等相比较,酶直接法采用国际最先进技术,简化实验操作过程,具有更好的准确性和重复性。
【原 理】人血清与试剂R1中的聚阴离子和表面活性剂的作用下,除LDL外的其它脂蛋白与胆固醇酯酶、胆固醇氧化酶等反应而被消除。
当加入试剂R2后,其中的另-表面活性剂迅速发生作用并释放LDL,并在酶作用下单一催化LDL-C,与4-氨基安体比林和酚发生显色反应,显色深浅与血清中LDL-CHOL含量成正比。
【试剂规格】规格1 规格2 规格3 规格4 规格5 试剂 1 1×75ml 6×240ml 4×60ml 2×40 ml 2×60 ml试剂 2 1×25ml 6×80ml 4×20ml 2×10 ml 2×20 ml【试剂成份】R 1:胆固醇氧化酶 1000 U/L,苯酚 28.0 mmol/L,胆固醇酯酶 2000 U/L,过4.5 g/L,表面活性剂 适量。
氧化氢酶 1000 KU/L,NaN3R 2:4-AAP 0.5 mmol/L、过氧化物酶 8000 U/L、表面活性剂 适量。
【样本】血清,在2-8℃下可稳定7天。
【实验步骤】1.手工操作:按下表加入试剂、校准品及样本工作液配制:试剂R1:4ml与试剂R2:1ml混匀。
工作液在2~8℃可稳定3天。
样本管空白管校准管样本(µl) 5 ————校准液(µl) ———— 5蒸馏水(µl) —— 5 ——工作液(µl) 500 500 500 充分混匀,置37℃水浴10分钟后,选择波长546nm,以空白管校零点,分别读取样本管和校准管的吸光度值。
低密度脂蛋白胆固醇测定试剂盒(直接法-表面活性剂清除法)产品技术要求海丰
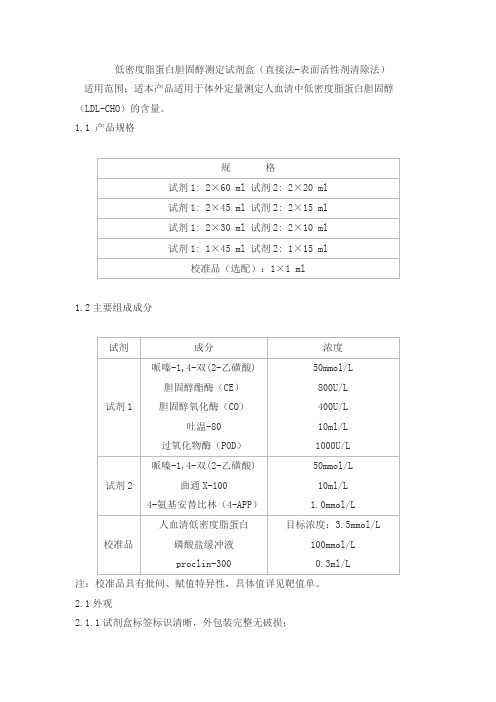
低密度脂蛋白胆固醇测定试剂盒(直接法-表面活性剂清除法)适用范围:适本产品适用于体外定量测定人血清中低密度脂蛋白胆固醇(LDL-CHO)的含量。
1.1 产品规格1.2主要组成成分注:校准品具有批间、赋值特异性,具体值详见靶值单。
2.1外观2.1.1试剂盒标签标识清晰,外包装完整无破损;2.1.2试剂1为无色澄清液体,目测不得有任何沉淀及絮状悬浮物;2.1.3试剂2为无色或淡黄色澄清液体,目测不得有任何沉淀及絮状悬浮物;2.1.4校准品:无色或浅黄色干粉,复溶后不得有任何沉淀及絮状悬浮物。
2.2净含量净含量不低于标示值。
2.3空白吸光度在主波长600nm、副波长700nm、37℃条件下,试剂空白吸光度应不大于0.05。
2.4线性范围[0.3,11.0]mmol/L范围内,相关系数r≥0.995;[0.30,3.00]mmol/L范围内,绝对偏差不超过±0.3mmol/L;(3.00,11.00]mmol/L范围内,相对偏差不超过±10%。
2.5分析灵敏度在产品说明书规定参数设定条件下,浓度为1.0mmol/L时,吸光度变化△A应不小于0.03。
2.6 精密度2.6.1批内重复性CV≤3.0%。
2.6.2批间差相对极差R≤10.0%。
2.7 准确度与已上市产品比对:相关系数(r)应不低于0.990;[0.30,3.00]mmol/L 范围内,绝对偏差不超过±0.3mmol/L;(3.00,11.00]mmol/L范围内,相对偏差不超过±10%。
2.8 校准品2.8.1均一性CV≤5%。
2.8.2瓶间差CV≤5%。
2.9稳定性未开封试剂2℃~8℃储存,可稳定12个月。
取到效期后2个月内产品进行检测,检测结果应满足2.3、2.4、2.5、2.6.1、2.7的要求。
2.10 溯源性依据GB/T 21415—2008《体外诊断医疗器械生物样品中量的测量校准品和控制物质赋值的计量学溯源性》的要求,校准品溯源至(GBW09178)。
小而密低密度脂蛋白胆固醇测定试剂盒(过氧化物酶法)产品技术要求baiding

小而密低密度脂蛋白胆固醇测定试剂盒(过氧化物酶法)适用范围:用于体外定量测定人血清中小而密低密度脂蛋白胆固醇的含量。
1.1 规格校准品(选配):1×1mL;质控品(选配):水平1:1×1mL,水平2:1×1mL。
1.2 组成注:校准品靶值、质控品质控范围详见包装标签。
2.1 外观2.1.1试剂1:无色到淡褐色液体,无可见不溶物。
2.1.2试剂2:淡黄色到黄色液体。
2.1.3校准品:冻干粉,复溶后为无色至淡黄色液体,无可见不溶物。
2.1.4质控品:冻干粉,复溶后为无色至淡黄色液体,无可见不溶物。
2.1.5包装外观应整洁,标签字迹清晰,不易脱落。
2.2 净含量液体试剂的净含量不低于标示体积。
2.3 试剂空白吸光度试剂空白吸光度≤0.05。
2.4 分析灵敏度样本浓度为50mg/dL时,吸光度差值应≥0.02。
2.5 线性区间在[8,100] mg/dL的范围内,线性相关系数r≥0.990。
测试浓度在[8,30] mg/dL 时;绝对偏差应不超过±3mg/dL;测试浓度在(30,100] mg/dL时,相对偏差应不超过±10%。
2.6 精密度2.6.1重复性用高、低2个浓度的样本测试试剂盒,各重复测试10次,其变异系数(CV)应不大于10%。
2.6.2批间差用样本分别测试3个不同批次的试剂盒,每个批次测试3次,其相对极差(R)应不大于10%。
2.7 准确度与已上市产品进行对比试验,在[8,100] mg/dL的范围内,线性相关系数r≥0.975。
测试浓度在[8,30] mg/dL时,绝对偏差应不超过±3mg/dL;测试浓度在(30,100] mg/dL时,相对偏差应不超过±10%。
2.8 质控品赋值有效性测试结果在质控范围内。
2.9 校准品/质控品瓶内重复性校准品/质控品瓶内重复性(CV)应不大于10%。
2.10 校准品/质控品批内瓶间差校准品/质控品批内瓶间差(CV)应不大于10%。
过氧化物酶法检测小而密低密度脂蛋白胆固醇的分析性能评价

过氧化物酶法检测小而密低密度脂蛋白胆固醇的分析性能评价刘晓丽;顾向明;黄阶胜【摘要】Objective To evaluate the performance of the peroxidase method reagent kit for small and dense low density lipopro-tein cholesterol(sdLDL-C).Methods Based on the requirements of Clinical and Laboratory Standards Institute EP documents,the precision,linearity range,reference interval,recovery test and anti-interference ability of the peroxidase method reagent kit for de-tecting sdLDL-C were evaluated.Results The total coefficient of variation(CV)of low value in the peroxidase method was 3.14%, which of high value was 2.80 %;the linearity was good,R2=0.981 3,the related equation was Y=1.07X-0.24;the sdLDL-C lev-el had significant sexual difference,the young and middle-aged group reference intervals were(0.66 ± 0.36)mmol/L and older age-group were(0.86 ± 0.51)mmol/L for male,and young and middle-aged group(0.58 ± 0.27)mmol/L and older age-group were (0.89 ± 0.55)mmol/L for female;the average recovery rate was 99.54%;which could be resistant to clinical common interference. Conclusion The peroxidase method reagent kit of sdLDL-C has less interfere factors,good reproducibility,wider linear range and is simple to operate,which is suitable for the requirements of clinical laboratory routine detection.%目的评价小而密低密度脂蛋白胆固醇(sdLDL-C)过氧化物酶法检测试剂盒的分析性能.方法参照美国临床实验室标准协会EP文件要求评估过氧化物酶法检测sdLDL-C液态双试剂检测试剂盒的精密度、线性范围、参考区间、回收试验、抗干扰能力.结果过氧化物酶法低值总变异系数(CV)为3.14%,高值总 CV为2.80%;线性良好 R2=0.9813,相关方程为Y=1.07 X-0.24;sdLDL-C水平存在明显的性别差异,参考区间男青中年组为(0.66 ± 0.36)mmol/L、老年组为(0.86 ± 0.51) mmol/L,女中青年组为(0.58 ± 0.27)mmol/L、老年组为(0.89 ± 0.55)mmol/L;平均回收率为99.54%;可抵抗临床常见的干扰.结论 sdLDL-C过氧化物酶法检试剂盒干扰因素少、重复性好、线形范围较宽且操作简单,符合实验室常规检测的需要.【期刊名称】《检验医学与临床》【年(卷),期】2017(014)020【总页数】3页(P3018-3020)【关键词】小而密低密度脂蛋白胆固醇;过氧化物酶法;性能评价【作者】刘晓丽;顾向明;黄阶胜【作者单位】广州中医药大学附属中山中医院检验科,广东中山528400;广州中医药大学附属中山中医院检验科,广东中山528400;广州中医药大学附属中山中医院检验科,广东中山528400【正文语种】中文小而密低密度脂蛋白胆固醇(sdLDL-C)是低密度脂蛋白胆固醇中密度大而颗粒半径小的一种分型,临床试验研究表明其是致动脉粥样硬化的主要亚型[1]。
小而密低密度脂蛋白胆固醇(sd LDL—C)测定试剂盒(过氧化物酶法)产品技术要求mairui

2性能指标2.1外观R1试剂应为澄清透明的液体,无沉淀、悬浮物和絮状物;R2试剂应为澄清透明的液体,无沉淀、悬浮物和絮状物;校准品复溶前应为浅黄色冻干粉末,复溶后应为浅黄色液体。
试剂盒各组分应齐全、完整,液体无渗漏;包装标签文字符号应完整、清晰。
2.2净含量液体试剂的净含量应不少于标示值,标示值见表1。
2.3试剂空白吸光度试剂以水为空白在37℃±1℃,605nm波长条件下,吸光度应小于0.05 A。
2.4分析灵敏度当样本浓度为0.52 mmol/L 时,吸光度变化应不小于0.01 A。
2.5线性范围试剂盒在(0.104 ~ 2.59)mmol/L范围内:a)线性相关系数r应不小于0.9900;b)当样本浓度不大于0.777 mmol/L 时,线性绝对偏差应不大于±0.078 mmol/L;当样本浓度大于0.777 mmol/L 时,线性相对偏差应不大于±10.0%。
2.6测量精密度2.6.1重复性变异系数:CV应不大于10.0%。
2.6.2批间差相对偏差:R应不大于10.0%。
2.7准确度1测定企业参考品,测定结果与靶值的相对偏差应不大于±10.0%。
2.8分析特异性血红蛋白浓度在500 mg/dL内、内源性酯浓度在600 mg/dL内、胆红素浓度在40mg/dL 内、抗坏血酸在50mg/dL内,对试剂检测结果的偏差影响在±10.0%范围内。
2.9校准品均一性试剂盒校准品的瓶内均一性:CV应不大于10.0%。
2.10生物安全性校准品的HBsAg、HIV抗体、HCV抗体、梅毒螺旋体TP抗体检测应为阴性。
2。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
小而密低密度脂蛋白胆固醇(sd LDL-C)测定试剂盒(过氧化物酶法)
适用范围:该产品用于体外定量测定人血清或血浆中小而密低密度脂蛋白胆固醇的含量。
1.1 产品规格
1.2 组成成分
1.2.1 试剂组成
试剂1:Tris 缓冲液 100mmol/L
胆固醇酯酶(CHE) 1600U/L
胆固醇氧化酶(CHO) 600U/L
磷脂酶 2700U/L
过氧化氢酶 1200U/L
2-羟基-3-间甲苯胺丙磺酸
钠 2mmol/L
试剂2:Tris 缓冲液 100mmol/L
过氧化物酶(POD) 5000U/L
4-氨基安替比林4mmol/L
1.2.2校准品的组成
校准品为冻干品,校准品组成是在磷酸盐缓冲液中加入含一定浓度的小而密低密度脂蛋白胆固醇纯品,稳定剂<5%。
1个水平校准品目标浓度为1.1 mmol/L(42.5 mg/dL),浓度有批特异性,具体定值详见瓶签。
1.2.3质控品的组成
两水平冻干质控品,在20g/L牛血清中加入小而密低密度脂蛋白胆固醇纯品,稳定剂<5%。
靶值范围分别为:0.259 ~ 1.036 mmol/L(10.0~40.0 mg/dL)、1.036 ~2.072 mmol/L(40.0~80.0 mg/dL)。
2.1 外观
试剂 1 为无色到淡褐色液体,目测不得有任何沉淀及絮状悬浮物;
试剂 2 为淡黄色到黄色液体,目测不得有任何沉淀及絮状悬浮物;
校准品为白色或淡黄色粉末状物质,复溶后为无色或淡黄色液体,目测不得有任何沉淀及絮状悬浮物;
质控品为白色或淡黄色粉末状物质,复溶后为无色或淡黄色液体,目测不得有任何沉淀及絮状悬浮物。
2.2 净含量
液体试剂的净含量不得低于标示体积。
2.3 空白吸光度
试剂空白吸光度应≤0.1。
2.4 分析灵敏度
浓度为2.59 mmol/L(100.0 mg/dL)时,吸光度变化应≥0.05。
2.5 线性
测试血清样本,试剂线性在[0.1,2.59] mmol/L([4.0,100.0] mg/dL)范围内,线性相关系数(r)应不小于0.99;测定结果在[0.1,0.777] mmol/L([4.0,30.0] mg/dL)时绝对偏差不超过±0.078 mmol/L (± 3 mg/dL);在(0.777,2.59]mmol/L ((30,100.0] mg/dL)范围内的相对偏差不超过±10%。
2.6 重复性
试剂盒测试项目重复性CV≤10%。
2.7 批间差
不同批号之间测定结果的相对极差应≤15%。
2.8 准确度
与已上市试剂盒比对,相关系数(r)应≥0.975;测定结果[0.1,0.777]mmol/L 时绝对偏差不超过±0.078mmol/L;在(0.777,2.59]mmol/L,范围内的相对偏差不超过±10%。
2.9质控品赋值有效性
测定值在质控靶值范围内。
2.10 瓶间重复性(均一性)
校准品、质控品瓶间重复性CV≤5%。
2.11校准品溯源性
依据GB/T21415-2008《体外诊断医疗器械生物样品中量的测量校准品和控制物质赋值的计量学溯源性》的要求,校准品溯源至企业工作校准品,与北京九强生物技术股份有限公司生产的小而密低密度脂蛋白胆固醇(sd LDL-C)测定试剂盒比对赋值。
2.12 稳定性
2.12.1试剂效期稳定性
原包装试剂,在(2~8)℃下有效期为18个月,取失效期的试剂盒检测其试剂空白、分析灵敏度、线性、重复性、准确度和质控品赋值有效性,试验结果满足2.3、2.4、2.5、2.6、2.8和2.9的要求。
2.12.2校准质控复溶稳定性:
校准品和质控品开瓶复溶后,在(2~8)℃密封避光保存,可以稳定24小时,在满24小时后再次检测,相对偏差应在±10%范围内。
