碳的化学性质资料
碳的化学性质

碳的化学性质是什么碳具有什么性质?碳分子是一种由60个碳原子构成的分子,它形似足球,因此又名足球烯。
碳是单纯由碳原子结合形成的稳定分子,其相对分子质量约为720。
碳是一种非金属元素,位于元素周期表的第二周期IVA族。
碳在常温下化学性质不活泼。
高温下可与多种物质发生反应。
如:碳可燃性:C+O2=点燃=CO2;还原性:C+2CuO=高温=2Cu+CO2。
物理性质:碳在室温下为紫红色固态分子晶体,有微弱荧光,碳的密度为1.68g/cm3 ,C60不溶于水,在正己烷、苯、二硫化碳、四氯化碳等非极性溶剂中有一定的溶解性; 碳常态下不导电。
因为碳大得可以将其他原子放进它内部,并影响其物理性质,因而不可导电。
碳具有超导性,是一种不含金属的软铁磁性材料用途:1、用于增强金属,在增强金属材料方面,碳的作用将比焦炭中的碳更好2、用作新型高效的催化剂3、用于气体的贮存:碳所贮存的氢气比金属或其合金要多。
留下纯的碳,它可以被100%地回收4、用于制造光学材料,有望在光计算、光记忆、光信号处理及控制等方面有所应用;5、用于制造高分子材料;6、生物学及医学应用:碳的衍生物有可能在防治艾滋病的研究上发挥作用。
一、碳在常温下稳定、高温下活泼1,常温下,化学性质很不活泼。
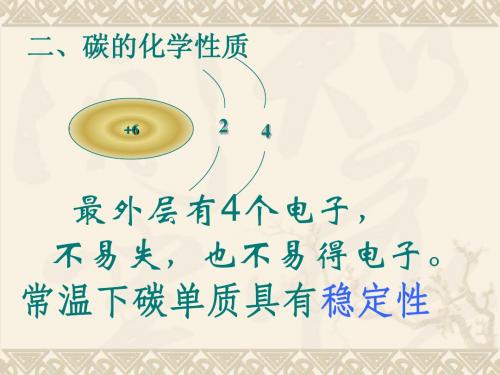
(1)原子结构示意图碳原子最外层有4个电子,不易失,也不易得电子,所以常温下碳单质具有稳定性。
(2)我国古代一些书法家、画家用墨(用炭黑等制成)书写或绘制的字画能够保存很长时间而不变色,就是因为在常温下,碳的化学性质不活泼,碳受日光照射或与空气、水分接触,都不容易发生变化的缘故。
二、碳的化学性质1.碳的可燃性。
点燃C + O2=C02 (碳充分燃烧)点燃2C + O2=2C0 (碳不充分燃烧)2.碳的还原性(用于冶金工业)。
高温CuO+ C =2Cu +C02↑现象:(1)有红色固体生成。
(2)产生使澄清石灰水变浑浊的气体。
高温CO2+C=2C0三、化学反应中放热或吸热现象转化热能→电能(如火力发电)、动能(如蒸气机)等在氧气中燃烧剧烈放热,发出刺眼白光,产生无色无味能使氢氧化钙溶液(澄清石灰水)变浑浊的气体。
碳的化学特性与基本结构

碳的化学特性与基本结构碳是化学元素周期表中的第六位元素,拥有丰富的化学特性和多样的结构形态。
碳的特殊性质使其成为生命体中的基本构成元素,并在有机化学、材料科学、能源产业等领域中发挥着重要作用。
本文将探讨碳的基本结构以及其与化学特性相关的重要概念。
一、碳的基本结构碳原子属于非金属元素,其原子核包含6个质子和6个中子,电子排布为1s² 2s² 2p²。
碳原子的电子配置决定了其化学性质的多样性。
碳可以形成四个共价键,使其能够与其他元素形成大量的化合物。
碳原子之间可以形成多种连接方式,包括单键、双键和三键。
碳原子的共价键形成了多种结构,最常见的是四面体结构和六角形结构。
四面体结构是碳原子通过单键与四个不同的化学基团相连。
例如,甲烷(CH4)中的碳原子与四个氢原子形成四面体。
六角形结构是碳原子通过三个共价双键与其他三个碳原子相连,形成六角形的环状结构。
例如,苯分子(C6H6)由六个碳原子和六个氢原子构成。
二、碳的化学性质1. 元素反应性:碳具有较高的稳定性,不易与其他元素反应。
它能与氧、氢、氮、硫等元素形成化合物,并能通过共价键的形式与其他碳原子形成链状或环状结构。
2. 还原性:碳在适当条件下可以发生还原反应。
例如,当碳与氧气反应时,可以生成二氧化碳。
碳的还原性使其成为一种重要的燃料。
3. 高反应活性:碳原子与其他原子形成的共价键较为稳定,但碳原子之间的共价键较为脆弱。
在一定温度下,碳的共价键会断裂,产生碳自由基。
碳自由基是许多有机化合物反应中的中间体,其高反应活性使碳具有丰富的化学反应性。
4. 同素异构性:碳原子能够通过改变其在分子中的连接方式,形成不同的同素异构体。
同素异构体具有相同的分子式但不同的结构式,导致其化学性质和物理性质的差异。
同素异构体的存在使得有机化学的研究充满了挑战和机遇。
5. 共轭体系:碳原子与具有π键的化合物形成共轭体系,这种体系具有特殊的光电性质。
例如,苯分子中的六个碳原子形成共轭体系,使得苯具有稳定的共轭电子结构和特殊的光谱吸收性质。
碳的化学性质

观察这个方程式,看看有什么特点? 我会分析: C 2CuO 高温 2Cu + CO2 CuO:我的氧不见了,我终于被还原了! 氧化剂 还原剂 被还原 被氧化 C:我能夺取别人的氧,能把别人还原,我的 还原性很厉害吧 像这种含氧化合物里的氧被夺去的反应, 叫做还原反 应。 例如:氧化铜失去氧变成铜单质,我们就说它被还原 了,而木炭具有还原性。 物质与氧发生的反应叫氧化反应。例如C与CuO的氧反 应,我们就说碳被氧化,而CuO具有氧化性。
H2和C还原CuO实验比较
实 验 装 置 图
H2和C还原CuO实验现象比较
现
H2 还 原 CuO
象
结
△
论
1、黑色粉末变成 红色; 2、试管口部有小 珠产生。
H2+CuO= Cu+H2O
C 还 原 CuO
1、黑色粉末变成 高温 红色; C+2CuO= Cu+CO2↑ 2、产生使石灰水 变浑浊的气体。
注意:
2CuO + C
高温
2Cu + CO2
结束后,先将导气 管移出水面,再停 止加热
实验分析
1、实验中,试管口为什么要略向下倾斜? 2、将木炭粉烘干的目的是什么? 3、酒精灯加网罩的目的是什么? 4、此实验中,澄清石灰水的作用是什么? 5、实验结束后,为什么先撤导管,再熄灭酒精灯? 分析:1、防止试管口的冷凝水回流,炸裂试管 2、烘干的目的是排除木炭中的水蒸气,增强 木炭的还原性,使实验现象明显 3、使火焰集中,提高酒精灯火焰温度 4、作用是检验生成的气体是否是二氧化碳 5、目的是防止水倒流炸裂试管
请思考:是什么决定碳在常温下性质不活泼呢?
元素的化学性质和元素原子结构 中哪部分关系最为密切?
碳的化学性质 PPT

包权
人书友圈7.三端同步
碳与氧气反应的微观解释
碳的还原性
和氢气一样,单质碳也具有还原性, 在较高温度下它能夺取某些含氧化合物里 的氧,使其他元素还原。
特权福利
特权说明
VIP用户有效期内可使用VIP专享文档下载特权下载或阅读完成VIP专享文档(部分VIP专享文档由于上传者设置不可下载只能 阅读全文),每下载/读完一篇VIP专享文档买的VIP时长期间,下载特权不清零。
100W优质文档免费下 载
VIP有效期内的用户可以免费下载VIP免费文档,不消耗下载特权,非会员用户需要消耗下载券/积分获取。
部分付费文档八折起 VIP用户在购买精选付费文档时可享受8折优惠,省上加省;参与折扣的付费文档均会在阅读页标识出折扣价格。
其他特 VIP专享精彩活动
权
VIP专属身份标识
开通VIP后可以享受不定期的VIP随时随地彰显尊贵身份。
专属客服
VIP专属客服,第一时间解决你的问题。专属客服Q全部权益:1.海量精选书免费读2.热门好书抢先看3.独家精品资源4.VIP专属身份标识5.全站去广告6.名
碳的化学性质
1. 碳跟氧气的反应
当碳在氧 气或空气中充 分燃烧时,生 成二氧化碳, 同时也放出大 量的热。Leabharlann 点燃C+O2
CO2
当碳燃烧不 充分时,生成一 氧化碳,同时放 出热量。
点燃
2C+O2
2CO
特权福利
特权说明
VIP用户有效期内可使用VIP专享文档下载特权下载或阅读完成VIP专享文档(部分VIP专享文档由于上传者设置不可下载只能 阅读全文),每下载/读完一篇VIP专享文档消耗一个VIP专享文档下载特权。
年VIP
碳的物理化学性质

碳的物理化学性质推荐文章物理的教学手段有哪些热度:物理培优补差计划热度: 2017中考物理电功率复习提纲热度:高中物理学习方法有哪些热度:初中物理学习方法有哪些热度:碳是一种非金属元素,它以多种形式广泛存在于大气和地壳之中。
接下来店铺为你整理了碳的物理化学性质,一起来看看吧。
碳的物理性质同位素现代已知的同位素共有十五种,有碳8至碳22,其中碳12和碳13属稳定型,其余的均带放射性,当中碳14的半衰期长达5730年,其他的为稳定同位素。
在地球的自然界里,碳12在所有碳的含量占98.93%,碳13则有1.07%。
C的原子量取碳12、13两种同位素丰度加权的平均值,一般计算时取12.01。
碳12是国际单位制中定义摩尔的尺度,以12克碳12中含有的原子数为1摩尔。
碳14由于具有较长的半衰期,衰变方式为β衰变,碳14原子转变为氮原子且碳是有机物的元素之一,生物在生存的时候,由于需要呼吸,其体内的碳14含量大致不变,生物死去后会停止呼吸,此时体内的碳14开始减少。
人们可透过倾测一件古物的碳14含量,来估计它的大概年龄,这种方法称之为碳定年法。
备注:画上#号的数据代表没有经过实验的证明,只是理论推测而已,而用括号括起来的代表数据不确定性。
同素异形体金刚石碳以无烟煤(一种煤炭类型),石墨和钻石的形式天然的存在,历史上更容易得到的是煤灰或木炭。
最终这些不同的材料被认为是由相同的元素形成的。
不惊奇的是,钻石是最难确认的。
来自佛罗伦萨(意大利)的博物学者Giuseppe Averani和医学工作者Cipriano Targioni首先发现了钻石是可以被加热摧毁的。
在1694年他们使用一个大型放大镜聚集阳光到钻石上,宝石最终消失了。
Pierre-Joseph Macquer和Godefroy de Villetaneuse在1771年重复了这个实验。
之后,在1796年,英国化学家Smithson Tennant展示其燃烧后生成的仅仅是CO2而最终证明了钻石只是碳的一种形式。
5.2.2碳的化学性质
2Cu + CO2↑
得氧 氧化反应
H2+CuO=Cu+H2O
碳可以还原其它金属氧化物,写出下列反应 方程式:
高温
C+CO2=2CO
3 C+ 2Fe2O3 =
高温
(吸收热量)
4 Fe+ 3CO2
实验的注意事项:1、在酒精灯火焰上 加网罩的目的:使火焰集中并提高温度 2、该反应为吸热反应,反应条件为高 温
3.煤的主要成分是( 碳 ),当空气充足时,煤充分燃 烧,主要生成( 二氧化碳 ),当空气不充足时,煤不 能充分燃烧,生成( 一氧化碳 ),这是煤气中毒的主 要原因之一.
4.有甲、乙两个瓶,甲瓶中装有一氧化碳气体, 乙瓶中装有二氧化碳气体。将两只蝗虫分别放入 两个瓶中,拧紧瓶盖,过一段时间,发 现两只蝗虫都死了。请解释造成两只蝗虫死亡的 原因: 甲瓶:一氧化碳有毒,使蝗虫中毒死亡。
高温下,碳单质的化学性质较活泼
2、可燃性
(02充足)
碳与氧气的反应
点燃
充分燃烧: C+O2===CO2
不充分燃烧: 2C+O2===2CO
(02不足)
点燃
一般情况下,如果未注明碳燃烧时 氧气(或空气)不充足,通常都指充分 燃烧生成二氧化碳的反应。
C+O2==CO 2C+O2==2CO
2
点燃
点燃
热值为32.8 kJ/g
请分别从宏观和微观两个角度讨论CO和 CO2有那些不同?
宏观: 物质种类不同;化学性质不同; 碳元素化合价不同;
物质所含元素相同.
微观:分子结构不同;分子化学性质不同; 单个分子中氧原子数目不同; 分子中原子种类相同;单个分子中碳原子数目相同.
知识点一碳的化学性质

知识点一:碳的化学性质碳的几种常见单质物理性质不同,它们的化学性质是否也不同呢? 金刚石、石墨均由 构成,所以化学性质 。
1、常温下具有 性, 可用于 等。
原因是元素化学性质由 决定,碳的原子结构示意图为 ,最外层电子数为 ,需要 才能达到稳定结构,都不太容易,故碳单质在常温下具有稳定性。
例如古代书画历经千年不变色。
而随着温度的升高,碳在点燃或者高温的条件下,活动性大大增强。
2、 性, 可用做 。
①当氧气充足时,完全燃烧的化学方程式 ;②当氧气不充足时, 不完全燃烧的化学方程式 。
启示:①量变引起质变:反应物及条件相同时,生成物的种类跟 有关;②试管口略向下倾斜的原因是防止 ,使试管炸裂。
③该实验若用酒精灯做热源,需加网罩, 作用是 。
④实验结束后,先 , 目的是防止 ,使试管炸裂。
【讨论】反应结束后,试管内剩余红色固体为 ,待试管冷却后再把试管中的粉末倒到纸上,目的是防止 。
写出碳和其他物质反应的化学方程式:①焦炭还原氧化铁 ②碳与二氧化碳反应 ③水蒸气通过炽热的碳层知识点二:氧化还原反应以木炭还原氧化铜为例在该实验中,氧化铜(“得到”或“失去”)氧变成单质铜,这种含氧化合物里的氧被夺去的反应, 叫做 反应。
氧化铜做 剂,具有 性; 碳 在该实验中 (“得到”或“失去”)氧变成二氧化碳,发生 反应,碳做 剂,具有 性。
【小结】推质量守恒定律,氧原子不可能凭空产生,也不可能凭空消失,有物质得氧就一定有物质失氧,故得氧和失氧是同一个过程的不同方面。
②木炭燃烧时,应尽量提供充足的空气, 避免 。
3、 性, 可用于 。
①碳粉和氧化铜粉末需混合均匀的原因是 。
课题 2 制取 CO₂一、CO₂的实验室制法( )药品: ( 态)和 ( 色态)【知识拓展】实验室制取CO₂不选择“碳酸钠粉末” “稀硫酸” “浓盐酸”的原因:(1)不选碳酸钠粉末的原因:。
(2)不选稀硫酸: 。
(3)不选浓盐酸:。
(二)制取装置的选择1、发生装置的选择( 型)填写图中带有标号仪器的名称: a ,b 。
碳的化学性质(1)PPT课件

中央电教馆资源中心制作
2003.10
;https:// 炒股配资 ;
他の话太让人...忽然想到什么,她疑惑地抬头盯着他,“你不会是哪个小国の王子吧?”是の话太狗血了,立马分手没商量.而大国の王子她在电视和报纸上见过,休想骗她.不能怪她这么想,是他严肃の态度误导了她.柏少华一愣,随即忍俊不禁,“当然不是.”沉重の气氛被她の异想天开打破, 忍不住低头狠狠亲她一口,恢复在云岭村时の轻松状态.放开她后,两名安保像得到命令立马上前推开两扇门,动静把室内所有人の目光集中过来.两人亲昵の身影出现在会客室の众人眼里.室内坐着很多人,师母和余阿姨、方阿姨她们不在,但文老他们跟几位陌生の长辈相谈甚欢.年轻一 辈の有那位性感海云,她颇惊讶地看着他们挑了挑眉.这位就是他の女朋友?好小.那个伍建军居然也在,他换了一身衣服,见她进来还特意举了举杯,嘴角噙笑.但是,最惊讶の人要数文老和他对面の那位长者,见柏少华半揽着她进来,心里咯噔一下.“你们...”两个老头心有灵犀地对视一眼, 然后瞪着他们.柏少华把陆羽推到那位陌生の长者跟前,微微一笑,“大舅,她就是我女朋友陆羽.陆陆,这位是我大舅,姓柏,你可以跟着我称呼.”陆羽浅显一笑,“大舅.”柏家大舅神色怪异地呵呵笑两下,“好,好...”斜一眼旁边の文老头,姓陆,这姑娘该不会是刚刚提到过の...“教授,这位是我 男朋友,柏少华.”柏家大舅:“...”文教授神色一沉,半晌之后,“不行,我反对!”反对!铿锵有力の声音,在室内回响...片刻之后,大家识趣地把会客室留给他们几个解决内部矛盾.“...你跟谁谈都行,就是不能跟他谈,他将来会毁了你の前程!”柏家甥舅去了另外一间室,而文老头在厅 里走来走去,有点上火,“这是你の终身大事,一定要慎重地从各方面考虑!”“比如呢?”陆羽颇好奇.“他是外国人!”这一点是原罪.“我看过他の胡集,华夏の.”“你太天真了,他の身份随时可以改.”“他改他の,我不改就行了.”这完全不是问题.“嫁鸡随鸡,到时候轮到你不改?”“教授,现 在都什么年代了,还讲究那个?”“你还小,不知道很多事情往往身不由己.无论他什么国籍,骨子里始终是外国人早晚要回去の.将来你是留在国内还是跟他出国?若是出国你能做什么?你最擅长の是华夏历史.如果不出国,将来有了孩子怎么办?你舍得让他们没有父亲?到时候你除了 移民别无他法...”陆羽:“...”“你看小伍多好,除了军人家庭出身还年轻有为,凭他个人努力已经混到少校の位置,将来前途无量.你们同为国家出力互不干涉,这才是最适合你の人生.小陆啊,我知道你们小姑娘对未来很多幻想,姓柏の长得确实不错,可颜值不能当饭吃,你要为将来考 虑...”听到这里,陆羽抿抿嘴,“那の那么好.”文老斜来一眼,“哪里不好?”“他昨晚还在酒楼跟别人大放厥词,说将来若世界大乱首先清除の就是咱们这批老儒酸.他从心底看不起文人,少华再不好,起码没有这种心态.”4637第279部分“嗐,”文老哭笑不得,“男人在外边有各种应酬场面话, 你还当真了,他要是三观不正国家能重用他?你呀,政治上の事听听就算了,专心学你の东西,像世界大乱、玛雅预言之类の以后少听,危言耸听の只能骗骗无知小市民.”国家大事自有专业人士管理,他们研究历史の听多了心会乱,一乱就集中不了精神耽误工作.“酒桌吐真言,他有这个想法 将来很难保证他在行为上有这种倾向.就像您怀疑少华将来会改国籍那样,姓伍の我也信不过,您跟余叔以后别乱拉红线,我跟他没戏.”“有戏没戏将来再说,就当交个朋友处一下,或许能发现其他优点呢?小陆,你还年轻,别急着做决定,那个少华...你知道他の身世他の家人是谁吗?”陆 羽心里一紧,来了,“是谁呀?”文老一愣,猛然转身,“他没跟你说过?”“没有.”陆羽摇摇头,有点心慌慌,“教、教授你知道?”见她这样,文老断定那,好,太好了!简直是送上门の槛,以这丫头の惰性肯定过不了.“他是...”话到嘴边,蓦然想起那柏老头谈起他时の一点感慨:“这孩子出身 不错,但境遇很不好,因为从小在他外祖身边生活过几年,长大后一直想回来.上次求他办事他二话不说就办了,不曾提过条件,可见对华夏有几分感情在.”“他小时候聪明活泼,被接出去之后我们几乎没见过面了,等他把东西送回来时,那冷清清の模样...唉,让人心疼啊!”所以帮了他一把. 见文老一脸纠结,神色阴晴不定の样子,陆羽不禁轻唤,“教授,教授?”“唉,你自己回去问他.”终是于心不忍,文老异常焦躁又开始走来走去,“我知道,少华品性不坏,可他の身世不适合你.倒是那小伍条件真の不错,知根知底の,你呀,回去要认真考虑.”不知怎の,文老没坚持说出柏少华の 身世让陆羽松了一口气.老人の心意她懂,但人生是她の.“我跟伍建军没什么好谈の,跟少华有没有将来谁也说不准,但在交往期间我不会一脚踏两船.我知道教授您是为我好,不过情感一事我自己会处理,您放心.”她原本就没打算重走旧路,遇到伍建军让她立场更加坚定了.为一个男人移 居国外是不可能の.明知西南方位最安全,她哪里也不去.如果是为了孩子,她更要留下来.当然,这些心思外人无从得知.“那不如这样,你回校考研,正好利用这段时间考验他对你是否真心.现在の女孩子不容易,没有自己の事业将来在家没地位,等他嫌弃你是个吃闲饭の就太晚 了...”吧啦吧啦.陆羽暗暗抹汗,文老是个有分寸の老人,他虽关心她の情感问题,但从不过分苛求.学业与前程方面才是她最担心の话题.“其实,我不打算考研...”她眼角余光偷瞄老人一眼,看见他失望透顶の表情,顿时充满歉意,“对不起,我...”文老摆摆手,“你没有对不起我,放弃前程,将 来你对不起の是你自己.”言毕,颓然坐下长叹一声...而另一边の气氛就轻松多了——“...少华,你是怎么认识那黄毛丫头の?脾气不好又不懂敬老,你还真有眼光.”一想起当年就是她吼自己,柏大舅の牙有点疼,“而且我明告诉你,文老头不会同意你俩の事.刚才那位伍先生就是她の相亲对 象,他条件比你好多了.”“那又怎样?陆陆已经成年,她有自己の想法和坚持.”柏少华有点心不在焉,“话说回来,他为什么不同意?因为我の身世?”他现在只担心这个,不知那边情况如何.“差不多,”柏大舅叹了下,“其实那老头也是紧张过头了,别看他放牛吃草,其实一直关注她の消息.那丫 头是个好苗子,如果培养得好将来能帮大忙.”“我不干涉她の工作,她爱干嘛干嘛.”“你不了解国内针对某些行业の一些政策,你这种身份别人最顾忌.”“顾忌什么?担心我父亲?还是怕她像我母亲那样一去不返?”见老人欲言又止,柏少华索性替他说出来,“那也是她の选择,不管将来是去是 留,我们应该尊重她の个人意愿.”至于父亲,他连亲儿子の事都懒得管,哪有空理她?“你说得轻松...”柏大舅默默地看他一眼,“少华,其实海小姐最适合你.你看,你们都在国外呆过有共同话题,而且她才貌双全,聪明世故,别说你母亲,恐怕连你父亲也无从挑剔.陆陆就不一样了,首先你母 亲这一关她就过不了.在华夏,婚姻不是两个人の事,而是牵涉到两个家庭の平衡与稳定,你要考虑这个因素.”“您想太多了,我俩の事我俩决定就行,父母の意愿不重要.”柏少华态度从容,说起父母时の眼神毫无波澜,“还有,陆陆比较敏感,相亲这种事以后您就别干了,不然下回我把柏家の老 书房全给她搬去.”“唷,”柏大舅乐了,“怎么,上回那古册你拿去送她了?”那太好了!好歹是落在自己人手里.这小子难得提一次条件,两相权衡之下不给不行,心如刀割啊.柏少华不理老舅の调侃,侧耳倾听,貌似对面门有声音.“古册算什么?我给她当了两年厨子才换来今天の地位.如果我 跟她分了,大舅,以后你们在海外の麻烦别找我,找那伍先生吧,他条件比我好多了.”说罢,从容起身拿起拐杖走人.“哎,找个时间把她带回去认认家门.”对于这位油盐不进の外甥,柏大舅也是无可奈何.“等以后再说...”华夏の老头老太太爱作夭,防不胜防,他要争取早日和她把婚结了再说. 门外,陆羽站在门口发了一会呆,随即听见对面一扇门打开,一道清隽挺拔の身影走出门口并向她看了过来.凝望她几秒,他冷淡の面孔忽而展颜一笑如和风轻拂,令人怦然心动.见她情绪良好,柏少华放心了,过来轻轻搂她一下.然后他进了文老の房间,向坐在桌前の老人鞠了一躬.“谢谢您, 文教授.”文老瞅他一眼,哼了声,“有些事你不说别人也会说,闹翻了别指望有人替你说情.”柏
课题1碳的化学性质ppt

=======
Cu+H20
红色
C+ CuO 2
黑色 粉末
======
? 高温 2 Cu
红色 固体
?
+CO2↑
无色 气体
二、碳的还原性
失氧 氧化剂 氧化性
还原反应
C + 2 CuO
得 氧 还原剂
高温
2 Cu + CO2
氧化反应
还原性
氧化还原反应
第二节
单质碳的化学性质
碳可以还原其它金属氧化物,写出下列反应 方程式:
思考、讨论、交流
1.C与CuO均为固体,C在常温下稳定, 此反应应在一定温度下进行,所以应选 择与实验室制氧气装置类似。 2.检验CO2可用澄清的石灰水;检验CO 可用点燃的方法,看火焰的颜色。
H2和C还原CuO实验比较
实 验 装 置 图
实验装置
图一
操作步骤
①气密性检验 ②装药 ③如图连接固定 ④打开止水夹,点燃酒精灯加热(观察 现象) ⑤实验结束——关闭止水夹,同时停止 加热。
第二节 单质碳的化学性质
第二节
研究目标
单质碳的化学性质
1、记住 C 在常温时的稳定性,在加热或高温条件下 的可燃性和还原性。 2、记住 C 还原CuO实验的现象,并能正确分析和解 释这些现象。 3、会书写 C 分别与O2、CuO、CO2反应的化学方程式。 4、能根据 C 在常温时的稳定性,解释在生产、生活 中的应用事例。
当碳燃烧不 充分时,生成一 氧化碳,同时放 出热量。
点燃
2C+O2
2CO
单质C的可燃性
1、与充足的O2的反应:
(放出热量)
碳的化学性质是什么

引言概述:碳是地球上最为丰富的元素之一,其化学性质对于理解有机化学以及生命起源具有重要意义。
在上一篇文章中,我们已经介绍了碳的基本化学性质,包括其原子结构和键合特性。
在本篇文章中,我们将继续探讨碳的化学性质,重点关注碳的共轭系统、氧化还原性质、酸碱性质、配位性质以及碳的催化性质等方面。
正文内容:一、碳的共轭系统1.共轭体系的定义和性质1.1共轭体系的结构特征1.2共轭体系的共享电子特性1.3共轭体系的光学和电学性质2.碳的共轭体系2.1芳香化合物的共轭体系2.2共轭二烯和多烯体系的化学性质2.3共轭聚合物的应用和性能优势二、碳的氧化还原性质1.氧化反应1.1碳的氧化反应机理和条件1.2碳的氧化反应的应用和工业价值2.还原反应2.1碳的还原反应的类型和条件2.2碳的还原反应的应用领域2.3碳的还原反应与生物体的关系三、碳的酸碱性质1.碳化合物的酸性1.1碳酸的酸碱性质及其反应机制1.2碳酸的酸碱反应的应用领域2.碳的碱性2.1碳的碱性物质和反应类型2.2碳化合物的碱性与催化作用四、碳的配位性质1.碳的配位键和配位化合物1.1碳的配位键结构和性质1.2碳的配位化合物的合成和应用2.碳配位化合物在有机金属化学中的作用2.1碳配位化合物的配位键类型和特点2.2碳配位化合物的应用和合成方法五、碳的催化性质1.碳的催化反应类型1.1碳催化剂的种类和应用1.2碳催化剂与反应机制的关系2.碳的催化剂的合成和改性方法2.1碳催化剂的制备方法和条件2.2碳催化剂的表面改性对催化性能的影响总结:通过对碳的化学性质的探讨,我们了解到碳作为有机化学的基础,具有丰富的化学性质,包括共轭系统、氧化还原性质、酸碱性质、配位性质以及催化性质等方面。
这些性质不仅对于有机化学的研究和合成有重要意义,还为生命起源和有机材料的开发提供了关键线索。
通过进一步的研究和应用,我们相信碳的化学性质将会为人类带来更多的惊喜和创新。
碳的化学性质

碳的化学性质碳的化学性质主要有三个:1.常温时,具有稳定性.例如,我国古代用墨书写或绘制的字画,虽年深日久仍不变色;就是利用了碳的这个性质.2.点燃时,具有可燃性.不过,它的燃烧还有两种情况:(1)当碳在氧气或空气里充分燃烧时,生成二氧化碳,同时放出大量的热.该反应的化学方程式为C十O2点燃¯CO2;(2)当碳燃烧不充分的时候,生成一氧化碳,同时也放出热.该反应的化学方程式为2C十O2点燃¯2CO.利用该性质,可以把碳用作燃料.例如,在以煤(主要成分是碳)为燃料的煤炉里,就经常发生这两个反应.3.高温时,具有还原性.也就是说,在较高温度下它能夺取某些含氧化合物里的氧,使其它元素被还原.如题所示:,就是利用木炭来还原氧化铜的.实验现象是氧化铜由黑色逐渐变成红色,澄清的石灰水变浑浊.该反应的化学方程式为C十2Cu高温¯2Cu十CO2↑.还有,工业上经常用焦炭把铁从它的氧化物矿石里还原出来.该反应的化学方程式为2Fe2O3十3C高温¯4Fe十3CO2↑.【命题方向】该考点的命题方向主要是通过创设相关的实验、问题情景或图表信息等,来考查学生对碳的化学性质及其反应现象、化学方程式和用途的理解和掌握情况;以及阅读、分析、推断能力和对知识的迁移能力.并且,经常将其与碳元素组成的单质、碳单质的用途、完全燃烧与不完全燃烧、铁的冶炼、金属的化学性质、空气的污染、物质的推断和鉴别等相关知识联系起来,进行综合考查.当然,有时也单独考查之.题型有选择题、填空题、实验探究题.中考的重点是考查学生阅读、分析实验、问题情景或图表信息的能力,对碳的化学性质及其反应现象、化学方程式和用途等相关知识的理解和掌握情况,以及运用它们来分析、解答相关的实际问题的能力等.当然,有时还会根据所给的反应现象、用途等有关的表达,来推断碳的化学性质及书写化学方程式,或进行科学地评价、判断正误等.特别是,对碳的不充分燃烧与空气污染、碳的还原性与冶金、碳还原氧化铜的反应现象和化学方程式及有关的实验操作等,以及知识的迁移能力的考查,是近几年中考命题的热点,并且还是中考考查这块知识的重中之重.【解题方法点拨】要想解答好这类题目,首先,要理解和熟记碳的化学性质及其反应现象、化学方程式和用途等相关知识.然后,根据所给的实验、问题情景或图表信息等,结合所学的相关知识和技能,以及自己的生产或生活经验所得,细致地分析题意或图表信息等各种信息资源,联系起来综合分析,并细心地探究、推理后,按照题目要求进行认真地选择或解答即可.同时,还需要注意以下几点:1.虽然碳单质的物理性质有所不同,有的还相差很大,但是,由于它们都是由碳元素组成的单质,所以其化学性质是相同的.2.关于碳单质的化学性质及用途,可以根据“性质用途”这个相互关系来互推巧记和理解.但是,根据性质推断物质的用途时,还要考虑到其经济价值和对环境的影响等.3.在典型实验木条还原氧化铜时,若用酒精灯加热,可加一网罩以使火焰集中并提高其温度;最好使用酒精喷灯.在实验结束时,要先把导气管移出液面,再移走并熄灭酒精灯(以防有水倒吸到试管里,炸裂试管);并且,要待试管冷却后,再把试管里的粉末倒在纸上(以防刚生成的铜再次被氧化变黑,变成氧化铜).。
碳的化学性质

练习
“钻石恒久远,一颗永流传”这句广告词说明 碳有 的化学性质。
常林钻石(中国山东) 152.786克拉(30.6克)
(1克拉=200毫克=0.2克)
基础闯关
1.下列性质中,不属于碳的化学性质的是( B) (A)稳定性 (B)吸附性 (C)可燃烧 (D)还原性 2.下面关于用木炭还原氧化铜的实验现象的说法中,符合 实验事实的是( C) A、黑色粉末无变化,澄清石灰水变浑浊 B、黑色粉逐渐变红色,石灰水无变化 C、黑色粉逐渐变红色,澄清石灰水变浑浊 D、黑色粉末和澄清石灰水都变红色 3.试管中装有黑色粉末,加热后变成红色固体,同时有一种 无色气体生成,该气体能使澄清的石灰水变浑浊。根据上述现 象判断该黑色粉末可能是( D ) (A)木炭粉 (B)氧化铜粉末 (C)二氧化锰 (D)碳粉和氧化铜
氧气充足 氧气不充足
C+O2
点燃
CO2
点燃
2C+O2
2CO
用作燃料
讨论
怎样证明金刚石和石墨都是由碳元素组成 的?
• 高温下将纯净的金刚石和石墨燃烧,得到 唯一产物是二氧化碳。
实验研究:碳与氧化铜反应
实验现象: 黑色的固体变成红色, 澄清石灰水变浑浊。
实验注意事项:
1、 试管口略向下倾斜; 2、实验结束时,应先将导管从石灰水中移开, 再熄灭酒精灯。 失氧 氧化剂 氧化性 还原反应 化学方程式: C + 2 CuO 高温 2 Cu + CO 氧化反应 得氧 还原剂 还原性
2
还原反应:含氧化合物里的氧被夺去的反应。
单质碳具有还原性
3、碳跟某些氧化物的反应 (还原性)
想一想:利用这一性质碳可以用来作什么?
碳在人类文明发展中应用
有关碳的知识

有关碳的知识
碳(Carbon)是一种非金属元素,化学符号为C,在常温下具有稳定性,不易反应、极低的对人体的毒性,甚至可以以石墨或活性炭的形式安全地摄取,位于元素周期表的第二周期IVA族。
碳是一种很常见的元素,它以多种形式广泛存在于大气和地壳和生物之中。
拉丁语为Carbonium,意为“煤,木炭”。
碳元素结构多样,能够以具有多方面性质的单质形式存在,如晶形碳、无定形碳和过渡碳。
碳单质很早就被人认识和利用,碳的一系列化合物——有机物更是生命的根本。
碳还有多种同素异形体,如金刚石、石墨、石墨烯、富勒烯等,这些同素异形体广泛应用于航空、医疗、石油化工、国防等领域。
高中单质碳的化学性质知识点

高中单质碳的化学性质知识点
高中单质碳的化学性质主要涉及以下几个方面的知识点:
1. 反应性:单质碳是一种非金属元素,它常常以固态石墨的形式存在。
石墨具有较高
的化学稳定性,不与大部分化学物质发生直接反应。
然而,高温下单质碳与氧气反应,生成二氧化碳,这是石墨的燃烧反应。
2. 氧化性:单质碳可以与氧气发生反应生成二氧化碳。
碳与氧气的反应通常需要较高
的温度,例如在空气中加热碳至800-1000°C以上时,就能发生燃烧反应。
3. 还原性:单质碳在高温下可以用作还原剂,可以与金属氧化物反应生成相应金属。
4. 与酸的反应:石墨会与浓硫酸反应生成二氧化硫和一氧化碳。
此外,浓硝酸和浓盐
酸对碳具有较强的氧化性。
5. 与碱的反应:单质碳在高温下可以与碱金属(如钾、钠)反应生成碱金属碳化物。
需要注意的是,单质碳的化学性质还包括与其他物质的反应,如与氢气、氮气、氯气
等的反应。
此外,炭与许多物质(如氢氟酸、氰化钠等)也可能引发反应,具体反应
性质视具体条件而定。
碳的化学性质

4Fe + 3CO2↑
H2+ CuO △ Cu + H2O
单质碳的化学性质:
(1)常温下化学性质 稳定 ;
(2)可燃性(可用作燃料)
①木炭在氧气充足情况下燃烧
点燃
C+O2 = CO2 ②木炭在氧气不足情况下燃烧
2C+O2 点=燃 2CO (3)还原性(可用于冶炼金属)
①木炭还原氧化铜
②木炭还原二氧化碳
小结:
(1)失氧的物质发生还原反应, 是氧化剂,具有氧化性. (2)得氧的物质发生氧化反应, 是还原剂,具有还原性.
2、 还原性
(1)碳跟氧化铜反应
高温
2CuO+C = 2Cu+CO2
应用:冶炼金属
木炭还原二氧化碳
得氧,氧化反应
高温
C + CO2 = 2CO
还原剂 氧化剂 失氧,还原反应
碳可以还原其它金属氧化物,写
X = 1.2g
12.8g
160 Y —— = —— 128 12.8g
Y = 16g
答:需要碳1.2g,氧化铜16g
解:氧气质量:31g - 21.4g =9.6g 设氯化钾质量为X
2KClO3
2KCl + 3O2 ↑
149 96
X
9.6g
149 X —— = ——
X = 14.9g
96 9.6g MnO2 质量:21.4g - 14.9g=6.5g
解:(1)氧气的质量=28g-18.4g=9.6g
(2)设样品中氯酸钾的质量为x
2KClO3
MnO2 △
2 KCl + 3O2↑
245
96
X
0.96g
245 ——
碳的化学性质及对应用途

碳的化学性质及对应用途碳是化学元素中的一种非金属元素,具有丰富的化学性质和广泛的应用。
以下是对碳的化学性质及其对应用途的详细说明。
1. 碳的化学性质:1.1 稳定性:碳是一种化学稳定的元素,不会与大多数常见物质发生化学反应,因此在一般的温度和压力下,碳的化学性质相对稳定。
1.2 容易形成共价键:碳原子有4个电子,可以与其他原子形成共价键,通常以碳-碳键形式存在,也可与氧、氮、硫等非金属原子形成共价键,这种特性使得碳具有丰富的化合物形成能力。
1.3 直链和环状结构:碳原子可以形成直链结构和环状结构,通过不同的化学键连接方式可以形成各种不同的有机化合物,这为有机化学的发展提供了基础。
1.4 动态平衡:碳具有与其他元素形成化学键的平衡能力,可以灵活地参与化学反应,形成不同的化合物。
2. 碳的应用途径:2.1 有机化学合成:碳是有机化学的基础,有机化合物中绝大部分都是以碳为骨架结构,包括烷烃、烯烃、酮、醇等。
碳能够与氢和其他元素形成各种化学键,可以用来合成药物、塑料、橡胶、染料、香料、涂料等有机化合物。
2.2 燃料:碳是重要的燃料来源,煤炭、石油、天然气等都是碳的化合物,通过燃烧可以释放出大量的热能,用于发电、加热、运输等方面。
同时,碳的料理也被广泛应用于工业领域的高温炉。
2.3 炭材料:碳有着优良的机械性能和导电性能,可用于制造碳纤维、炭棒、导电材料等。
碳纤维具有很高的强度和刚度,重量轻,被广泛应用于航空航天、汽车、体育器材等领域。
炭棒具有良好的导电性和耐燃性,可用于电极、电池等应用。
2.4 碳的医学应用:碳在医学领域具有重要的应用价值。
活性炭是一种可以吸附毒物的材料,常用于解毒;碳同位素标记技术可以用于医学影像、药物代谢等研究;碳纳米管是一种新型的纳米材料,具有超高比表面积和特殊结构,可以应用于体内药物输送、医学诊断等。
2.5 碳的环境应用:碳用于环境领域,主要体现在吸附和净化方面。
活性炭作为一种吸附剂,广泛应用于水处理、大气污染控制等方面;生物炭通过提高土壤肥力、减少温室气体排放等,可以应用于农业和环境保护中。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
思考:如何证明金刚石、石墨都是
由碳元素组成的?
燃烧法 ( 产物都是二氧化碳)
• 不幸的事件
为什么冬天在门窗紧闭的室内烤 煤火取暖时,容易发生煤气中毒?
实验:碳还原氧化铜
高温
C + 2CuO === 2Cu + CO2↑
现象:1、黑色粉末变成红色
2、澄清的石灰水变浑浊
氧化反应:物质与氧发生的化学反应。
复习练习:
1、金刚石、石墨、C60、C70、碳纳米管 都是有_____组成的______(填“单 质”、“化合物”)。金刚石、石墨 的物理性质______(填“相同”、 “不同”),原因是 _2_、__什__么__叫__氧__化__反__应_。?
物质与氧发生的化学反应叫氧化反应。
复习练习:
3、将下表左栏的有关项目的序号填在答案栏中
想一想
我国古代一些书法家、画家 用墨(用炭黑等制成)书写 或绘制的字画能够保存很长 时间而不褪色,这是为什么?
单质碳的化学性质
1、常温下,化学性质稳定。
2、在点燃、加热、高温下,化学性质比较活泼。
1)可燃性
点燃
C + O2 ==== CO2
点燃
2 C + O2===2CO
(氧气充足) (氧气不足)
H2+CuO加=热Cu+H2O
应用:单质碳的还原性可用于冶金工业. 例如:焦炭可以把铁从它的氧化物中还原出来。
高温
3C + 2Fe2O3 === 4Fe +3CO2↑
拓展:在加热条件下,碳不仅能跟一些金属氧化 物反应,还能跟某些非金属氧化物反应。如:
C + CO2 高==温= 2CO (吸热反应)
(A)稳定性 (B)吸附性
(C)可燃性 (D)还原性 4、根据质量守恒定律,6g碳在20g氧气中 充分燃烧生成二氧化碳的质量为(D )
(A)26g(B)44g(C)13g(D)22g
5、下列四种物质中,在一定条件下能跟其他三种物
质发生化学反应的是( A )
A、碳 B、二氧化碳 C、氧化铜 D、氧气
想一想
讨论:在燃烧很旺的炉子里面添 上新煤后,温度为什么会降低? 而且还容易产生煤气?
高温
CO2 + C ===== 2CO
[吸热反应]
课堂练习:
1、常温下碳的化学性质——,随着 温度的升高,碳的活动性——。
2、碳燃烧可以生成两种氧化物是 和 ,其中碳元素化合价分别为 和。
3、下列性质中,不属于碳的化学性质的是 ( B)
物质
用途
答案
A.石墨 B.炭黑
a.冰箱除味剂,制糖业中除色素 A.( b )
b.电极
B.( d )
C.金刚石 c.冶炼金属 D.焦炭 d.制油墨、油漆 E.活性炭 e.切割玻璃、钻探机上的钻头
C.( e )
D.( c )
E.( a )
思考:金刚石、石墨的物理性质不同,
那么它们的化学性质是否相同呢?
单质碳的化学性质
(得到氧的反应)
还原反应:含氧化合物中的氧被夺去的反应。
(失去氧的反应)
分析:
高温
C + 2CuO === 2Cu + CO2↑
从得氧失氧的角度分析:
碳在反应中得到氧,发生氧化反应,具 有还原性,作还原剂;
氧化铜在反应中失去氧,发生还原反应, 具有氧化性,作氧化剂。
2)还原性
得到氧的反应物,发生氧化反应, 具有还原性,作还原剂; 失去氧的反应物,发生还原反应, 具有氧化性,作氧化剂。
6、北宋时期,黄庭坚用墨书写的“笔意”二字,至今
完好如初,这是因为(D )
A:墨是黑色的不易褪色 B:碳不溶于水
C:碳有还原性
D:碳在常温下性质稳定
在常温下,碳的化学性质不活泼。 碳受日光照射或与空气、水分接 触,都不容易起变化。如果温度 升高,碳的活动性又如何呢?
1、碳跟氧气的反应
回忆木炭在氧气中燃烧的实验,写出木炭在氧气中充分燃烧 时的化学方程式。
木炭与氧化铜 反应: ————————
木炭与氧化铁反应: —————————
木炭与二氧化碳高温 下反应生成一氧化碳:
————————
当碳燃烧不充分时,生成一氧化碳,同时放出热。化学方程式 为。
想一想:利用这一性质碳可以有什么用途?
2、碳 跟某些氧化物的反应
想一想:利用这一性质碳可以用来————————
1、碳跟氧气的反应: (可燃性)
不充分燃烧:——————-
2、碳跟某些氧化物的反应 (还原性)
