分子的性质(知识点总结+典例导析)
人教版八年级上册数学《分式的基本性质》分式PPT教学课件(第1课时)

同类题检测:平板推题
1.下列分式中,是最简分式的是
(填序号).
x3 (1)
3x
;(2)x+y 2x
;(3) c
c 2+7c
;(4)xx2++yy2
;(5)xx2++yy2 .
2.下列约分正确的是( ) A. 2(b c) 2 a 3(b c) a 3
B.
(a b)2 (b a)2
1
C.
的分子分母中各项的系数都化为整数,
4
结果为
。
自学释疑、拓展提升
知识点二:分式的约分 自学问题:分式约分的关键是约去公因式,对于分子分母是多项式的需
要先进行因式分解后再约去公分母;约分进行式子变形时,易忽略分子 与分母的符号变化。 学生典型问题展示: 展示《15.1.2分式的基本性质(1)课前自测》中第5、6题的正确率 ,以及做错的学生的错题选项;学案上知识点二学生中存在问题图片展 示。 问题解决: 问题1:观察教材129页例2(1)中的两个分式,在变形前后的分子、分 母有什么变化?类比分数的相应变形,你联想到什么? 归纳总结: 根据分式的基本性质,把一个分式的分子与分母的公因式约去,叫做分
A.x<0 B.x>0 C.x≠0 D.x≠0且x≠-2
2.下列等式:①
(a b) a b
c
c
x y ;② x
x y x
a b a b
;③ c
c
;④
m n m n
m
m
中,成立的是( )
A.①②
B.③④
C.①③a
D.②④
0.4b
3.不改变分式的值,将分式
2 0.6a 3 b
课前检测和学案整体完成情况较好的学生:图片展示(课前自主学习整体完成优秀展示)
高二化学《应用广泛的高分子材料 功能高分子材料》知识点归纳总结+典例导析

应用广泛的高分子材料 功能高分子材料【学习目标】1、了解常见功能高分子材料的成分及优异性能,了解“三大合成材料”的结构、性能和用途;2、了解功能高分子材料在人类生产、生活中的重要应用,了解治理“白色污染”的途径和方法;3、了解各类功能高分子材料的优异性能及其在高科技领域中的应用;4、以合成高分子化合物的背景,了解有机合成在发展经济、提高生活质量方面的贡献、合成材料品种特别多,按用途和性能可分为合成高分子材料(包括塑料、合成纤维、合成橡胶、黏合剂、涂料等);功能高分子材料(包括高分子分离膜、液晶高分子、导电高分子、医用高分子、高吸水性树脂等)和复合材料。
其中,被称为“三大合成材料”的塑料、合成纤维和合成橡胶应用最广泛。
【要点梳理】要点一、塑料1、塑料的成分。
塑料的主要成分是合成高分子化合物即合成树脂、在塑料的组成中除了合成树脂外,还有依照需要加入的具有某些特定用途的加工助剂以改进其性能。
如,提高柔韧性的增塑剂,改进耐热性的热稳定剂,防止塑料老化的防老化剂,赋予塑料颜色的着色剂等。
3、几种重要的塑料的性质、(1)聚乙烯塑料的性质。
①聚乙烯塑料无嗅、无毒、具有优良的耐低温性能,最低使用温度可达—100℃;化学稳定性好,能耐大多数酸、碱的腐蚀;常温下不溶于一般溶剂,吸水性小;电绝缘性能优良。
②聚乙烯塑料品种特别多,应用广泛,主要有:薄膜(低密度聚乙烯,有良好的透明度和一定的抗拉强度)用于各种食品、医药、衣物、化肥等的包装;中空制品(高密度聚乙烯,强度较高)用于塑制各种瓶、桶、罐、槽等容器;管板材(高密度聚乙烯)用于铺设地下管道和建筑材料;纤维(线型低密度聚乙烯)用于生产渔网绳索;包覆材料,用做包覆电缆、电线的高频绝缘材料。
(2)酚醛树脂。
①酚醛树脂是用酚类(如苯酚)与醛类(如甲醛)在酸或碱的催化下相互缩合而成的高分子化合物、 ②酚醛树脂属于热固性塑料,体型酚醛树脂受热后都不能软化或熔融,也不溶于任何溶剂。
生物医用高分子知识点总结

载体材料要求(1)一定机械强度,加工性能(2)生物相容性与生物降解性(3)根据使用要求,其它一些特殊性能,例如pH 响应性、靶向性等载体材料分类根据材料的来源:天然与合成高分子材料根据材料的降解性能:降解与非生物降解高分子材料根据材料在水中的溶解性:疏水与水溶性高分子材料根据材料对外界信号响应性:刺激响应与惰性材料根据材料化学结构分类(以疏水性生物降解材料为例)(1)聚酯:PLGA PCL聚碳酸酯等(2)聚酸酐(3)聚氨基酸(4)聚膦腈(5)聚磷酸脂典型非生物降解疏水性高分子:聚氨酯典型疏水性生物降解材料-1. 聚酯聚(丙交酯-材料,这主要归co-乙交酯)(PLGA是一类应用最早、最为广泛的合成疏水性生物生物降解聚酯的合成开环聚合(以聚乳酸PLA的合成为例)1.分子量可从几千到几百万广泛可调2.采用手性单体聚合可得到旋光性聚合物,具有很高的机械强度,可作为骨替代材料3.其它生物降解聚酯如聚已内酯、聚(三甲基碳酸酯)等均采用类似的合成路线缩合聚合:合成可生物降解塑料的方法,但目前还仅能得到低分子量的产物生物降解聚酯研究进展:PEG-b-PLA合成PEGb-PLA的性质:温敏性避免网状内皮系统的吞噬持续释放药物典型疏水性生物降解材料-2. 聚酸酐类开环聚合仅适用于环己二酸酐的聚合,其它环状酸酐例如琥珀酸酐、戊二酸酐由于环较稳定,还不能通过开环聚合得到聚酸酐。
所得聚已二酸酐分子量较低,一般在5,000 以下。
熔融缩聚1.除热不稳定、易成环二酸单体外,其它所有二酸均可通过这种方法聚合2.聚酸酐分子量与二酸结构以及聚合条件有关,单体柔性越大、真空度越高,聚合物分子量越大脱三甲基氯硅烷法溶液缩聚1.适用于热不稳定二酸单体2.聚酸酐分子量在几千左右微波聚合合成聚酸酐优点1 )无需真空2)反应时间短3)预聚-缩合一步完成聚(酰亚胺-酸酐)提高常规聚酸酐力学强度,有可能用作骨替代材料主链型高分子前体药物:水杨酸光交联聚酸酐单体与预聚物观察不到荧光主链中仅当亚甲基数为2的聚酸酐可发荧光苯环上取代基团对荧光激发与发射波长有影响荧光强度基本随聚合物分子量增大线性增强与其它二酸单体共聚,荧光波长会发生偏移,其中脂肪族二酸发生蓝移,而芳香二酸发生红移共聚物序列结构对荧光性质影响不大疏水性生物降解高分子材料的两种降解方式:本体降解表面降解降解方式的决定因素聚合物基质的水化速度(V hydr。
3.1分子和原子(考点解读)

3.1 分子和原子(考点解读)(解析版)1、分子、原子、离子、元素与物质之间的关系(1)物质的宏观组成和微观构成关系构成物质的微粒有:分子、原子、离子。
大多数物质由分子构成,少数物质(金属、稀有气体、部分非金属固体)由原子构成,一些物质是由离子构成的。
如:水由水分子构成,铁由铁原子构成,氯化钠由氯离子和钠离子构成。
(9)分子、原子、离子、元素与物质之间的区别是:它是用来描述物质的宏观组成的,用“组成”来描述;例如,水是由氢元素和氧元素组成的(但不能说“水是由二个氢元素和一个氧元素组成的”)。
氢原子和一个氧原子构成的;但不能说“一个水分子是由氢元素和氧元素组成的”);铁是由铁原子构成的;氯化钠是由钠离子和氯离子构成的.④对于分子、原子和离子来说,分子是保持物质化学性质的最小粒子,它在化学变化中是2、分子和原子的区别和联系分子和原子的区别和联系,如表所示:分子原子(1)分子极小,其质量和体积都很小。
(2)分子在不断的运动。
温度越高,分子受热能量增大,运动速率加快。
①应用:用分子不停地运动解释闻到气味、溶解、扩散、挥发、蒸发等生活现象。
用分子运动受温度的影响解释太阳下晒湿衣服比阴凉处干得快。
②分子运动实验的证明浓氨水显碱性,有强烈的挥发性。
酚酞试液是酸碱指示剂,遇到碱性溶液变红。
解释:实验3中A烧杯变红原因:浓氨水挥发出的氨气分子运动到B烧杯中溶于水,形成氨水使酚酞变红。
(3)分子间有间隔①分子间间隔大小:一般情况下,气体物质分子间的间隔相对较大,固体和液体物质分子间的间隔相对较小。
解释生活现象:气体体积容易压缩,固体和液体较难被压缩。
②分子间间隔受温度和压强的影响:a、温度升高,分子间隔增大,温度降低,分子间隔变小。
解释生活现象:物质的热胀冷缩、物质三态变化、给自行车胎打气、等体积的酒精和水混合后总体积变小。
夏天车胎、篮球等打气太满容易爆炸,酒精温度计测温度。
(给自行车胎打气,分子间隔变小)(水银是金属,由原子构成;水银温度计测温度,是因为受热汞原子间隔变大。
《分子和原子》知识点归纳与例题导析

分子和原子【学习目标】1.认识物质是由分子、原子等微小粒子构成的;掌握分子的性质;掌握用粒子的观点解释某些常见的现象。
2.认识分子是保持物质化学性质的最小粒子;原子是化学变化中的最小粒子。
3.能用分子的观点来区别物理变化和化学变化、纯净物和混合物。
【要点梳理】知识点一、分子1.分子是真实存在的:(1)能闻到花香酒香及品红的扩散等现象,充分说明物质是由分子等微粒构成的,分子在不断地运动。
(2)运用现代科学技术手段已观察到了一些分子和原子,也充分证明分子是真实存在的。
2.分子的定义:分子是保持物质化学性质的最小粒子。
(1)构成物质的每一个分子与该物质的化学性质是一致的,分子保持的是物质的化学性质,如氧气的化学性质由氧分子保持,二氧化碳的化学性质由二氧化碳分子保持。
(2)分子不保持物质的物理性质。
物质的物理性质(如颜色、状态)是由大量分子聚集在一起才能表现出来的,是宏观现象,不是单个分子能表现出来的。
3.分子的性质:(1)分子的质量和体积都很小。
(2)分子在不断地运动。
温度越高分子运动的速率越快,如阳光下湿衣物干得快。
(3)分子之间有间隔。
气体的分子之间间隔较大,液体和固体的分子之间间隔较小。
气体比液体和固体容易压缩,不同液体混合后的总体积小于二者的原体积之和,都说明分子之间有间隔。
(4)同种物质的分子性质相同,不同种物质的分子性质不同。
我们都有这样的生活体验:若口渴了,可以喝水解渴,吃几块冰块也可以解渴,这就说明:水和冰都具有相同的性质,因为水和冰都是由水分子构成的,同种物质的分子,性质是相同的。
【要点诠释】1.构成物质的微粒具有质量小、体积小、不断运动、有间隔等基本特征。
2.分子是构成物质的一种粒子,而不是唯一的微粒,构成物质的微粒还有原子、离子。
3.分子是由原子构成的,不同分子的构成是不同的。
如1个水分子是由两个氢原子和一个氧原子构成的,而1个氢分子是由两个氢原子构成的。
知识点二、原子1.原子的定义:原子是化学变化中的最小粒子。
有机化学基础知识点整理手性分子的定义与分类

有机化学基础知识点整理手性分子的定义与分类手性分子的定义与分类手性分子是指具有非对称碳原子或其他不对称中心的分子。
在有机化学中,手性分子是一类非常重要的分子,它们的不对称性决定了它们在化学反应中特殊的性质和行为。
本文将对手性分子的定义和分类进行整理,以帮助读者更好地理解有机化学中的手性分子。
一、手性分子的定义手性分子是指在空间中无法与其镜像重合的分子。
手性分子具有两个互为镜像的异构体,称为对映异构体,即“左手”和“右手”。
这种对称性的缺失使得手性分子的物理性质和化学反应与非手性分子截然不同。
手性分子的不对称性通常来自于碳原子上的取代基或其他中心原子上的取代基的配置不同。
在有机化学中,碳原子上的取代基可以有四种不同的取代方式,即氢、烷基、卤素或其他取代基。
二、手性分子的分类手性分子可以根据其不对称中心的数量进行分类。
根据不对称中心的数量,手性分子可以分为单手性分子和多手性分子。
1. 单手性分子单手性分子是指只有一个不对称中心的手性分子。
在这种分子中,只存在两个对映异构体,即一对“左手”和“右手”。
典型的例子是乙醇分子(C2H5OH),它在空间中有一个不对称碳原子,因此存在两种对映异构体。
2. 多手性分子多手性分子是指具有两个或多个不对称中心的手性分子。
在这种分子中,存在更多的对映异构体。
多手性分子的对映异构体数量可以通过2的n次方计算,其中n是不对称中心的数量。
例如,丙二醇(C3H8O2)是一种多手性分子,它有两个不对称碳原子,因此存在4种对映异构体。
这些对映异构体可以用R和S来表示,以帮助区分它们的构型。
总结:手性分子是具有非对称碳原子或其他不对称中心的分子。
手性分子的不对称性决定了它们特殊的性质和行为。
根据不对称中心的数量,手性分子可以分为单手性分子和多手性分子。
对映异构体的存在使得手性分子的化学反应和物理性质与非手性分子有所不同。
理解手性分子的定义和分类对于研究有机化学以及相关领域的学生和科研人员非常重要。
九年级化学 第二单元 第一节 水分子的运动(一)知识精讲 鲁教版
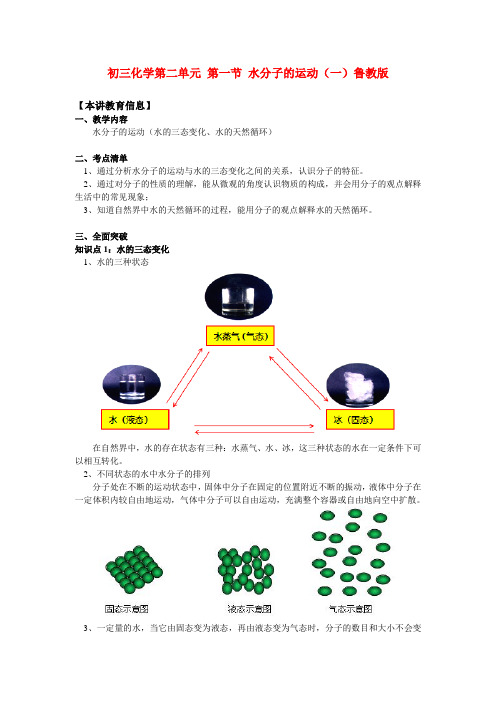
初三化学第二单元第一节水分子的运动(一)鲁教版【本讲教育信息】一、教学内容水分子的运动(水的三态变化、水的天然循环)二、考点清单1、通过分析水分子的运动与水的三态变化之间的关系,认识分子的特征。
2、通过对分子的性质的理解,能从微观的角度认识物质的构成,并会用分子的观点解释生活中的常见现象;3、知道自然界中水的天然循环的过程,能用分子的观点解释水的天然循环。
三、全面突破知识点1:水的三态变化1、水的三种状态在自然界中,水的存在状态有三种:水蒸气、水、冰,这三种状态的水在一定条件下可以相互转化。
2、不同状态的水中水分子的排列分子处在不断的运动状态中,固体中分子在固定的位置附近不断的振动,液体中分子在一定体积内较自由地运动,气体中分子可以自由运动,充满整个容器或自由地向空中扩散。
3、一定量的水,当它由固态变为液态,再由液态变为气态时,分子的数目和大小不会变化,变化的只是水分子间的距离和排列方式,这样的变化是物理变化。
【典型例题】例1、某同学对水的有关知识进行了下列总结:①、水是由氢元素和氧元素组成的;②、水是无色无味的液体;③、水在通电条件下能分解;④、水资源短缺已成为制约经济发展的重要因素之一。
其中正确的是()A、只有②④;B、只有①②③;C、只有①③④;D、①②③④【解析与答案】本题通过对水的知识的总结,考查学生对化学基础知识的掌握情况,难度不大,但涉及的知识点较多。
答案:D例2、在一封闭的针筒中,把少量水煮沸,体积明显增大,水分子在此过程中发生的变化是()A、水分子本身变大了B、水分子之间的间隔变大了C、水分子的数目变多了D、水分子受热都冲到针筒的一边了【解析与答案】因为一定量的水,当它由固态变为液态,再由液态变为气态时,分子的数目和大小不会变化,变化的只是水分子间的距离和排列方式,所以答案为B选项。
知识点2:分子的性质1、分子的性质:①分子的体积和质量都很小;②分子之间有间隔;③分子在不断的运动。
化学键(知识点归纳及典例解析)(二)

化学键(知识点归纳及典例解析)(二)化学键是化学反应中的核心概念,它决定了分子的结构和性质。
在上一篇文章中,我们介绍了化学键的基本概念、类型和特点。
一、离子键1. 定义离子键是由正负离子之间的电荷吸引力形成的化学键。
在离子化合物中,一个或多个电子从一个原子转移到另一个原子,形成带正电荷的阳离子和带负电荷的阴离子。
2. 特点(1)电荷吸引力:离子键的主要特点是电荷吸引力,这种力比共价键的共用电子对之间的斥力要大。
(2)电性:离子键具有极性,因为正负离子之间的电荷分布不均匀。
(3)熔点:离子化合物的熔点通常较高,因为要破坏离子键需要较大的能量。
(4)溶解性:离子化合物在水中的溶解性通常较好,因为水分子可以与离子形成氢键。
3. 典型实例(1)氯化钠(NaCl):氯化钠是由钠离子(Na+)和氯离子(Cl)组成的离子化合物。
在固态NaCl中,每个Na+离子与六个Cl离子相邻,反之亦然。
(2)硫酸钙(CaSO4):硫酸钙是由钙离子(Ca2+)和硫酸根离子(SO42)组成的离子化合物。
在水中,硫酸钙的溶解度较低,这是因为它与水分子形成的氢键较弱。
二、共价键1. 定义共价键是由两个或多个原子共享一个或多个电子对形成的化学键。
共价键主要存在于非金属原子之间。
2. 特点(1)共享电子:共价键的特点是原子之间共享电子,使各原子达到稳定的电子排布。
(2)极性:共价键的极性取决于原子之间的电负性差异。
电负性相差较大的原子形成的共价键,极性较大。
(3)熔点:共价化合物的熔点通常较低,因为要破坏共价键需要较小的能量。
(4)溶解性:共价化合物在水中的溶解性通常较差,因为它们与水分子的相互作用较弱。
3. 典型实例(1)甲烷(CH4):甲烷是由一个碳原子和四个氢原子组成的共价化合物。
在甲烷分子中,碳原子与每个氢原子之间形成一个共价键。
(2)水(H2O):水是由两个氢原子和一个氧原子组成的共价化合物。
在水中,氢原子与氧原子之间形成一个极性共价键。
初中化学《物质的组成、性质和分类》知识点

初中化学《物质的组成、性质和分类》知识点考点1物质的组成1.元素一一宏观概念,说明物质的宏观组成。
元素是质子数相同的一类原子的统称。
质子数相同的微粒不一定是同一种元素, 因为微粒的含义要比原子广泛。
2.分子、原子、离子一一微观概念,说明物质的微观构成。
(1)分子是保持物质化学性质的一种微粒。
(单原子分子、双原子分子、多原子分子)(2)原子是化学变化中的最小微粒。
(不是构成物质的最小微粒)(3)离子是带电的原子或原子团。
(基:中性原子团)3.核素一一具有一定数目的质子和一定数目的中子的一种原子同位素一一具有相同质子数和不同中子数的原子互称为同位素同素异形体一一同种元素形成的结构不同的单质特别提醒:离子基团定义帝电的原子或嫌子团化学中对原子团和基的总称区别带有正电荷或员电荷不带电’为缺电子物质’呈电中性联系两者通过得失电子可以互相转化实例___ QIL—1Wq:一艷二」 2 -α -g⅛1.离子与基团:2.同位素与同素异形体:]j同位素同素异形体定义同种元素形成的不同种原子同种元素形成的不同种单质≡区别≡ 是种嫌子\、 ____ ⅞-⅜¾⅜ 联系同位素原子在一定条件下以一定的方式可构成同素异形体一「实例 16O 和】8O 5 12C 和 叱 ] O 2和6 ;金刚石和石墨[知识规律]物质到底是由分子、原子还是离子构成?这与物质所属的晶体类型有关。
如金 刚石(C )、晶体Si 都属原子晶体,其晶体中只有原子;NaCI > KCIO3属离子晶 体,其晶体中只有阴阳离子;单质S 、P,属分子晶体,它们是由原子形成分子, 进而构成晶体的。
具体地:(1)由分子构成的物质(分子晶体):① 非金属单质:如H2、X 2> 02s O, N2、P4、S 、C6。
、稀有气体等 ② 非金属氢化物:如HX 、⅛0、NH3、H 2S 等 ③ 酸Sh 如 SO :、Co2、So3、P 2O 5s N 2O 5 等 ④ 酸类:如 HClOx HCIO 、H 2SO H H 3PO H H 2SiO 3 等 ⑤ 有机物:如坯类、怪的衍生物、糖类、氨基酸等 ⑥ 其它:如No 、Ng 、ALCl6等(2 )由原子直接构成的物质(原子晶体):稀有气体、金刚石、晶体硅、二 氧化硅、碳化硅、石墨(混合型晶体)等;(3 )由阴阳离子构成的物质(离子晶体):绝大多数盐、强碱、低价金属氧 化物。
五年级下册第四单元分数的性质和意义知识点总结

第四单元 分数的意义和性质1、分数的意义:一个物体、一物体等都可以看作 ,把这个整体 分成若干份,这样的一份或几份都可以用 来表示.2、单位“1":一个整体可以用自然数1来表示,通常把它叫做 。
(也就是把什么平均分什么就是单位“1”。
)3、分数单位:把单位“1”平均分成若干份,表示其中 的数叫做 。
如54的分数单位是51。
4、分数与除法A ÷B=B A (B ≠0, 不能为0, 也不能够为0) 例如: 4÷5=54 5、真分数和假分数、带分数1、真分数: 。
真分数 1.2、假分数: 。
假分数 1。
3、带分数: 。
带分数 1。
4、 <1≤ <1<6、假分数与整数、带分数的互化(1)假分数化为整数或带分数,用 ÷ ,商作为整数, 作为分子, 如:510=10÷5=2 521=21÷5=451 (2)整数化为假分数,用整数乘以分母得分子 如:把2化成分母是4的假分数;2=48)( 2×4=8 (8作分子) (3)带分数化为假分数,用整数乘以分母加分子,得数就是假分数的分子,分母不变,如: 551=526)( 5×5+1=26 (4)1等于任何分子和分母相同的分数。
如: 1=22=33=44=55=…=100100=… 7、分数的基本性质: .分数的基本性质:分数的分子、分母同时扩大或缩小相同的倍数,分数的大小不变。
8、最简分数: ,像这样的分数叫做最简分数. 一个最简分数,如果 中除了 以外,不含其他的质因数,就能够化成 。
反之则不可以。
9、约分: ,叫做约分. 如:3024=54 10、最简分数: 叫做最简分数分子和分母只有公因数1的分数叫做最简分数(最简真分数、最简假分数)11、通分: ,叫做通分。
如: 52和41 可以化成208和205 12、分数和小数的互化(1)小数化为分数:数小数位数。
一位小数,分母是10;两位小数,分母是100…… 能约分的要约分如:0。
第4讲分数的意义和性质(学生版)(知识梳理典例分析举一反三巩固提升)人教版

第4讲分数的意义和性质分数的意义和性质分数的意义分数的意义分数的产生分数与除法单位“1”分数单位求一个数是另一个数的几分之几分数的种类真分数假分数带分数或整数化成通分分数的基本性质约分最简分数约分及其方法分数和小数的互化比较分数的大小通分及其方法知识点一:分数的意义1.分数的意义:把一个整体平均分成若干份,这样的一份或者几份都可以用分数来表示。
2.单位“1”的含义:一个物体、一个计量单位和一些物体等都可以看作一个整体。
这个整体可以用自然数1来表示,通常把它叫做单位“1”。
3.把单位“1”平均分成若干份,表示其中一份的数叫分数单位。
4. ,。
5.求一个数是另一个数的几分之几,用除法计算。
6.商是分数,表示的是两个数的倍比关系,后面不写单位。
知识点二:真分数和假分数1.分子比分母小的分数叫做真分数。
真分数小于 1 。
2.分子比分母大或者分子和分母相等的分数叫做假分数。
假分数大于 1 或者等于1 。
3.如果能整除,那么商就是所要化成的整数。
4.如果不能整除,那么商就是带分数的整数部分,余数是带分数的分数部分的分子,分母不变。
知识点三:分数的基本性质分数的分子和分母同时乘或除以相同的数(0除外),分数的大小不变。
知识点四:约分1.几个数公有的因数,叫作这几个数的公因数;其中最大的一个,叫作这几个数的最大公因数。
2.在铺地砖问题中,要使地面铺满且使用的地砖是整块时,就是求长和宽的公因数;要求地砖的边长最大是多少,就是求长和宽的最大公因数。
3.约分的方法:①用分子和分母共有的质因数依次去除;②直接用分子和分母的最大公因数去除。
知识点五:通分1.几个数公有的倍数,叫做这几个数的公倍数;其中最小的一个,叫做这几个数的最小公倍数。
2.利用公倍数和最小公倍数可以解决生活中的很多问题,如铺地砖问题、学生排队问题、同一天到达问题等等。
3.同分母分数比较大小的方法:分母相同的两个分数,分子大的分数大。
4.同分子分数比较大小的方法:分子相同的两个分数,分母小的分数反而大。
分子知识点

分子知识点
分子的特点:
(1)分子在不断地运动;如:在厨房炒菜,在其他地方可以闻到香味。
(2)分子之间有间隙;如:100ml酒精加100ml水得到的溶液小于200ml。
(3)分子的体积和质量都非常小;如:1ml水中大约有1.67×1021 个水分子。
(4)同种物质的分子性质相同,不同种物质的分子性质不同。
(5)分子在化学变化中可以再分。
注:说明分子在运动的离子很多,比如能闻到的各种香味,就是各种分子在空气中不停的运动造成。
分子间有间隔的例子有:气体可以压缩存于钢瓶中,气体热胀冷缩的额现象。
应用:
(1)分子是构成物质的一种微粒。
(2)解释物质的三态变化。
知识讲解_《分子结构与性质》全章复习与巩固_提高
《分子结构与性质》全章复习与巩固编稿:宋杰审稿:张灿丽【学习目标】1、了解物质中存在的作用及强弱判断;2、学会用价键理论预测和判断分子的空间构型;3、掌握配合物的结构和组成判断;4、理解分子性质的预测和判断方法。
【知识络】【要点梳理】要点一、共价键与分子间作用力的本质及对物质性质的影响1、共价键的类型和成键方式【注意】①s—sσ键没有方向性。
②通常情况下σ键比π键稳定,但N2分子中π键比σ键稳定。
2、共价键与分子间作用力的比较【注意】①氢键不是化学键(原因:氢键是分子间一种较弱的作用力)。
②共价键影响结构特殊的物质(如原子晶体,后面将学到)的物理性质。
③化学键和分子间作用力都是电性作用。
要点二、分子空间构型的判断【注意】当中心原子上没有孤电子对时,杂化轨道理论和价层电子对互斥理论对分子空间构型的预测结论一致。
要点三、分子的性质②极性分子中一定有极性键,可能有非极性键(H2O2);非极性分子中不一定有非极性键(CH4);只含非极性键的分子一定是非极性分子。
③“相似相溶规律”:具有相同极性或结构相似的溶质和溶剂,溶质在溶剂中的溶解性较大。
2、手性碳原子、手性异构体与手性分子①手性碳原子:连接四个不同原子或基团的碳原子,称为手性碳原子,常用*C表示。
如。
②手性异构体:具有完全相同的组成和原子排列的一对分子,如同左手与右手一样互为镜像,却在三维空间里不能重叠,这对分子互称为手性异构体。
③手性分子:含有手性异构体的分子叫做手性分子。
3、无机含氧酸分子的酸性对于同一种元素的不同含氧酸,该元素的化合价越高,其含氧酸的酸性越强。
例如:酸性HClO<HClO2<HClO3<HClO4,H2SO3<H2SO4等。
将含氧酸的化学式写成(HO)m RO n的形式,则n越大,含氧酸的酸性越强。
要点四、配合物理论要点五、分子中的原子的价层电子(主族元素)是否达到8e-结构的判断分子中的原子的价层电子(主族元素)是否达到8e-结构的判断的要点:1、H原子为2e-的结构。
九年级上化学 分子和原子 (提纲、例题、练习、解析)

分子和原子【巩固练习】一、选择题 (每小题只有一个选项符合题意)1.(2014•四川中考)将塑料袋密封良好的方便面从平原带到高原时,塑料袋鼓起,是因为袋内的气体分子()A.质量增大B.个数增多C.间隔增大D.体积增大2.俗话说“酒香不怕巷子深”,从化学的角度来解释是由于()A.分子在不断地运动 B.分子间有间隔C.分子是由原子构成的 D.分子在化学变化中发生了变化3.下列关于分子和原子的说法,正确的是()A.分子构成物质,原子也能直接构成物质B.分子不停地运动,原子静止不动C.在化学反应前后,分子和原子的种类保持不变D.不同种类的原子,不能相互结合成分子4.保持水(H2 O)的化学性质的粒子是( )A.水分子B.氢原子C.氧原子D.氢原子和氧原子5.生活中的现象可以用分子等微粒的知识加以解释,其中正确的是()A.铝锭难被压缩,因为铝原子间没有间隙B.在花园里可嗅到花香,因为分子在不断运动C.石油气加压后贮存在钢瓶中,因为气体分子体积很小D.温度计里的汞柱下降,因为原子随温度的降低而变小6.(2014•广东中考)吸烟有害健康,非吸烟者会因吸烟者吸烟而造成被动吸烟,这是因为()A.分子在不断运动B.分子之间有间隔C.分子的体积很小D.分子的质量很小7.压瘪的乒乓球放入热水中重新鼓起,是因为球内的气体()A. 分子间隔增大B.分子个数增多C.分子质量增大D.分子体积增大8.某同学为探究分子的特性,设计了如下四个实验,其中能说明分子在不断运动的是()A.100mL酒精和100 mL水混合在一起体积小于200 mLB.品红放入水中,整杯水逐渐变红C.在过氧化氢溶液中加入二氧化锰后得到了氧气D.两支分别装有相同体积空气和水的注射器,前者比后者容易压缩9.分子和原子的根本区别是( )A.分子大,原子小B.分子可分,原子不可分C.在化学变化中,分子可以再分,原子不能再分D.分子可以构成物质,原子不能构成物质10.有关液氧变成氧气的说法正确的是( )A.氧分子间的空隙变小B.氧分子的体积变大,运动速度变快C.氧分子的质量变大D.氧分子间的空隙变大,但氧分子的质量和体积都不变11.(2014•山东中考)从分子的角度分析,下列解释错误的是()A.好酒不怕巷子深——分子在不断运动B.热胀冷缩——分子的大小随温度的改变而改变C.给轮胎打气——分子之间有间隔D.衣服在阳光下比在阴凉处干得快——温度高,分子运动快二、填空题12.100毫升酒精和100毫升水混合后的总体积小于200毫升,其原因是_______。
(完整版)物质结构与性质知识点总结

高中化学物质结构与性质知识点总结一.原子结构与性质.一.认识原子核外电子运动状态,了解电子云、电子层(能层)、原子轨道(能级)的含义.1.电子云:用小黑点的疏密来描述电子在原子核外空间出现的机会大小所得的图形叫电子云图.离核越近,电子出现的机会太,电子云密度越大;离核越远,电子出现的机会小,电子云密度越小. 电子层(能层):根据电子的能量差异和主要运动区域的不同,核外电子分别处于不同的电子层.原子由里向外对应的电子层符号分别为K、L、M、N、O、P、Q.原子轨道(能级即亚层):处于同一电子层的原子核外电子,也可以在不同类型的原子轨道上运动,分别用s、p、d、f表示不同形状的轨道,s轨道呈球形、p轨道呈纺锤形,d轨道和f轨道较复杂.各轨道的伸展方向个数依次为1、3、5、7.2.(构造原理)了解多电子原子中核外电子分层排布遵循的原理,能用电子排布式表示1〜36号元素原子核外电子的排布.(1).原子核外电子的运动特征可以用电子层、原子轨道(亚层)和自旋方向来进行描述.在含有多个核外电子的原子中,不存在运动状态完全相同的两个电子.(2).原子核外电子排布原理.①.能量最低原理:电子先占据能量低的轨道,再依次进入能量高的轨道.②.泡利不相容原理:每个轨道最多容纳两个自旋状态不同的电子.③.洪特规则:在能量相同的轨道上排布时,电子尽可能分占丕同的轨道,且自旋状态相同. 洪特规则的特例:在等价轨道的全充满(p6、d i0、f i4)、半充满(p3、d5、f7)、全空时(p0、d0、f0)的状态,具有较低的能量和较大的稳定性.如24Cr [Ar]3d54s i、29Cu [Ar]3d io4s i.(3).掌握能级交错图和1-36号元素的核外电子排布式.ns (n-2)f (n-l)d. up①根据构造原理,基态原子核外电子的排布遵循图⑴箭头所示的顺序。
②根据构造原理,可以将各能级按能量的差异分成能级组如图⑵所示,由下而上表示七个能级组,其能量依次升高;在同一能级组内,从左到右能量依次升高。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
分子的性质【学习目标】1、知道极性共价键和非极性共价键;结合常见物质分子立体结构会判断极性分子和非极性分子。
2、理解范德华力、氢键的概念及其对物质性质的影响。
3、从分子结构的角度,认识“相似相溶”规律。
4、了解“手性分子”的结构及其在生命科学等方面的应用。
5、能用分子结构的知识解释无机含氧酸分子的酸性。
【要点梳理】要点一、共价键的极性--极性键和非极性键1、分类依据:共用电子对是否偏移,发生偏移为极性键;不发生偏移为非极性键。
说明:极性键中共用电子对偏向的一方带负电荷用δ-表示;共用电子对偏离的一方带正电荷用δ+表示。
2、判断技巧:形成共价键的两原子是否为同种原子,如相同,为非极性键;如不同,为极性键。
原子电负性(元素非金属性)差值越大的,共用电子对偏移程度大,键的极性就越大。
要点诠释:化学键类型和物质类别的关系1)、不含有化学键的物质:稀有气体分子。
2)、只含非极性共价键的物质:同种非金属元素构成的单质。
如:H2、P4、金刚石等3)、只含极性共价键的物质:一般是不同非金属元素构成的共价化合物。
如:HCl、NH3等4)、既有非极性共价键又有极性共价键的物质:如:H2O2、C2H2、CH3CH3、C6H6等5)、只含有离子键的物质:活泼金属与活泼非金属元素形成的化合物。
如:Na2S、CsCl、K2O、NaH等6)、既有离子键又有非极性键的物质:如:Na2O2、CaC2等7)、既有离子键又有极性键的物质:如:NaOH8)、有离子键、共价键、配位键组成的物质:如:NH4Cl要点二、分子的极性1、非极性分子:正负电荷中心重合的分子称为非极性分子,它的分子中各个键的极性的向量和等于零。
例如:X2型双原子分子(如H2、Cl2、Br2等)、XY n型多原子分子中键的极性互相抵消的分子(如CO2、CCl4等)都属非极性分子。
2、极性分子:正负电荷中心不重合的分子称为极性分子,它的分子中各个键的极性向量和不等于零。
例如:XY型双原子分子(如HF、HCl、CO、NO等),XY n型多原子分子中键的极性不能互相抵消的分子(如SO2、H2O、NH3等)都属极性分子。
3、分子极性的判断方法:(1)全部由非极性键构成的分子一般是非极性分子。
(O3例外)(2)由极性键构成的双原子分子一定是极性分子。
(3)在含有极性键的多原子分子中,如果结构对称则键的极性得到抵消,其分子为非极性分子。
如果分子结构不对称,则键的极性不能完全抵消,其分子为极性分子。
(4)ABn型分子极性简便判别方法A.孤对电子法在ABn型分子中,若中心原子A无孤对电子(未成对电子),则是非极性分子,若中心原子A有孤对电子则是极性分子。
例如:CO2、CH4、SO3中心原子(C、S)无孤对电子,是非极性分子。
而像H2O、NH3、NP3中心原子(O、N)有孤对电子,则为极性分子。
B.空间形状法具有平面三角形、直线形、正四面体形等完全对称结构的分子为非极性分子;而折线形、三角锥形等非完全对称型分子为极性分子。
例如:SO3、BF3(平面三角形),CO2、CS2(直线形)、CH4、CCl4(正四面体形)的分子为非极性分子;H2O、H2S(折线形),NH3、PH3(三角锥形)的分子是极性分子。
C.化合价法ABn型分子中中心原子的化合价的绝对值等于该元素的价电子数(最高正价)时,该分子为非极性分子。
例如:PCl5中P的化合价为+5价,所以PCl5是非极性分子。
PCl3中P的化合价为+3价,所以PCl3是极性分子。
要点诠释:(1)极性键与极性分子,非极性键与非极性分子不存在对应关系。
(2)由非极性键形成的双原子、多原子分子,其正电中心和负电中心重合,所以一般都是非极性分子。
(3)含极性键的分子有没有极性,必须依据分子中极性键的极性向量和是否等于零而定。
要点三、范德华力1、概念:分子之间存在着一种较弱的相互作用,其结合能大约只有几个千卡·摩尔-1,比化学键能约小一二个数量级。
气体分子能凝聚成液体或固体,主要就靠这种分子间作用。
因为范德华第一个提出这种相互作用,所以常叫做范德华力。
2、影响因素:相对分子质量越大,范德华力越强;(主要因素)分子的极性越大,范德华力越强。
3、对物质性质的影响。
对于结构相似的物质来说,相对分子质量越大,分子间作用力越大,物质的熔点、沸点也越高要点四、氢键1、概念:氢原子与电负性很大、半径很小的原子X(F、O、N)以共价键形成强极性键H-X,这个氢原子还可以吸引另一个键上具有孤对电子、电负性大、半径小的原子Y,形成具有X-H∙∙∙Y形式的物质。
这时氢原子与Y原子之间的相互作用叫做氢键(以H∙∙∙Y表示)。
分类:分子间氢键与分子内氢键2、一般分子形成氢键必须具备两个基本条件:(1)分子中必须有一个与电负性很强的元素形成强极性键的氢原子。
(2)分子中必须有带孤对电子,电负性大,原子半径小的元素。
3、影响因素:(1)氢键的强弱与X和Y的电负性大小有关,电负性越大,氢键越强。
(2)氢键的强弱还和Y的半径大小有关,Y的半径越小,越能接近H-X键,形成的氢键也越强。
4、氢键的键长和键能:氢键的键长是指X-H∙∙∙Y中X与Y原子的核间距离。
氢键的键能是指被破坏H∙∙∙Y键所需要的能量。
氢键的键能约为15-30kJ mol-1,比一般化学键的键能小得多,和范德华力的数量级相同,比范德华力要大。
5、对物质性质的影响。
(1)对沸点和熔点的影响在同类化合物中,能形成分子间氢键的物质,其熔点、沸点要比不能形成分子间氢键的物质的熔点、沸点高些。
因为要使固体熔化或液体汽化,不仅要破坏分子间的范德华力,还必须提供额外的能量破坏氢键。
(2)对溶解度的影响在极性溶剂中,如果溶质分子和溶剂分子之间可以形成氢键,则溶质的溶解度增大。
说明:分子内氢键的形成,使分子具有环状闭合的结构。
一般会使物质的熔沸点下降,在极性溶剂中的溶解度降低。
要点诠释:(1)组成和结构相似的物质,相对分子质量越大,熔沸点越高。
例如:熔沸点:O2>N2,HI>HBr>HCl,CS2>CO2,CCl4>CH4。
说明:有机物中,同系物之间遵循这个规律。
(2)组成和结构不相似的物质,分子极性越大,熔沸点越高。
例如:CO与N2,前者为极性分子后者为非极性分子,所以熔沸点:CO>N2(3)在同分异构体中,一般的说,支链越多,熔沸点越低。
例如:沸点:正戊烷>异戊烷>新戊烷(4)芳香族化合物中,其熔沸点高低顺序是邻>间>对位化合物。
例如:沸点:邻二甲苯>间二甲苯>对二甲苯(5)当分子中存在氢键时,其熔沸点会突然增大。
例如:沸点HF>HI,H2O>H2Te要点五、溶解性1、相似相溶原理(1)极性溶剂(如水)易溶解极性物质(2)非极性溶剂(如苯、汽油、四氯化碳、酒精等)能溶解非极性物质(Br2、I2等)(3)含有相同官能团的物质互溶,如水中含羟基(-OH)能溶解含有羟基的醇、酚、羧酸。
2、影响物质溶解的因素(1)内因:相似相溶原理(2)外因:影响固体溶解度的主要因素是温度;影响气体溶解度的主要因素是温度和压强。
(3)其他因素:A.如果溶质与溶剂之间能形成氢键,则溶解度增大,且氢键越强,溶解性越好。
如:NH3。
B.溶质与水发生反应时可增大其溶解度,如:SO2。
要点六、手性1、概念原子组成和原子排列方式相同,但是不能重合,而互为镜像关系的两种物质,互称为手性异构体2.手性碳原子的判断同一个C原子连接4个不同的原子或原子团,为手性碳原子3.手性分子的判断一般来说,分子中有手性碳原子即为手性分子。
要点七、无机含氧酸的酸性1、经验规律:将酸改写成(HO)-m RO n的形式,n值越大,酸性越强2、规律:同主族,从上向下,非金属性减弱,最高价氧化物对应水化物酸性减弱;同周期,从左至右,非金属性增强,最高价氧化物对应水化物酸性增强;同一元素,不同价态的元素含氧酸酸性高价大于低价。
【典型例题】类型一:关于键的极性、分子的极性例1 下列有关叙述中,正确的是( )A.按共用电子对是否偏移可以把共价键划分为极性键和非极性键B.同种元素的原子间形成的共价键一定是极性共价键C.极性键肯定没有非极性键牢固D.两个原子之间共用两个电子对,形成的化学键一定有极性【思路点拨】本题考查共价键的极性以及共价键形成分子的极性,注意区分两者间的差别。
【解析】B中应该是非极性键;C中键能决定了共价键的稳定性,键的极性反映的是分子中电性分布情况,两者没有必然的联系;D中键的极性表示的是,共用电子对的偏离情况,只要是同种原子,吸引电子的能力是一样的,所以无论共有几对电子,都是非极性共价键。
【答案】A【总结升华】若形成共价键的两个原子相同,则该键必为非极性键;若不同则为极性键。
由共价键构成的分子,若高度对称、正负电荷中心重合,则该分子为非极性分子,反之为极性分子。
例2 NH3分子的空间构型是三角锥形,而不是正三角形的平面结构,其理由是( )A.NH3分子是极性分子B.NH3分子内三个N—H键的键长相等,键角相等C.NH3分子内三个N—H键的键长相等,3个键角都等于107°18′D.NH3分子内三个N—H键的键长相等,3个键角都等于120°【解析】本题可以通过反证法来分析。
假设NH3分子是正三角形的平面结构,则其键角应为120°,分子无极性;若NH3分子是极性分子,说明NH3分子不是正三角形的平面结构,故A正确。
若键角为107°18′则接近于正四面体的109°28′,说明NH3分子应为三角锥形。
【答案】A、C举一反三:【变式1】下列固体:(1)干冰,(2)石英,(3)白磷,(4)固态四氯化碳,(5)过氧化钠,由具有极性键的非极性分子构成的一组是( )A.(2)(3)(5)B.(2)(3)C.(1)(4)D.(1)(3)(4)(5)【解析】(2)石英:属于直接由原子构成的物质,不存在SiO2分子。
(3)白磷:P4中只存在非极性键,属于非极性分子。
(5)过氧化钠:属于离子化合物。
【答案】C【变式2】下列分子是极性分子的是( )A.PCl3B.SO3C.BF3D.CS2【解析】PCl3中P的最外层有5个电子,其化合价为+3,中心原子的化合价的绝对值不等于原子的最外层电子数,属于极性分子,A正确;SO3中S的最外层有6个电子,其化合价为+6,中心原子的化合价的绝对值等于原子的最外层电子数,属于非极性分子,B错误;BF3中B的最外层有3个电子,其化合价为+3,中心原子的化合价的绝对值等于原子的最外层电子数,属于非极性分子,C错误;CS2中C的最外层有4个电子,其化合价为+4,中心原子的化合价的绝对值等于原子的最外层电子数,属于非极性分子,D错误。
【答案】A【变式3】CH4、NH3、H2O和HF分子中,共价键的极性由强到弱的顺序是( )A.CH4、NH3、H2O、HF B.HF、H2O、NH3、CH4C.H2O、HF、CH4、NH3D.HF、H2O、CH4、NH3【解析】非金属性越强,吸引电子的能力越强,电子对偏离的程度越大;所以,共价键的极性强弱与非金属性强弱成正比。
