徐寿昌《有机化学》【复习笔记+考研真题及详解】(有机化合物的结构)
徐寿昌《有机化学》(第2版)名校考研真题(有机化合物的结构和性质)

第1章有机化合物的结构和性质一、选择题1.下列不属于Lewis酸的有()。
[中山大学2009研] A.CuCl2B.Ag+C.H+D.【答案】D【解析】Lewis酸是电子的接受体,只有D项不能再接受电子。
2.下列物质酸性最小的是()。
[中山大学2009研]ABC.CH3OHD.CH3CN【答案】C【解析】一般地,酚类的酸性强于醇类的酸性,而醇类的酸性又强于烷基的酸性,所以D项的酸性最小。
3.下列化合物酸性由大到小的次序是()。
[首都师范大学2010研]a.苯酚b.戊醇c.对硝基苯酚d.间硝基苯酚A.c>d>a>bB.a>c>d>bC.b>a>d>cD.c>a>d>b【答案】A【解析】本题考查有机化合物的酸性的大小比较,四个选项中有两类物质,即醇和酚,由于苯环的共轭结构,使得酚类的酸性大于醇类,则排除C项,苯酚中苯环上含有吸电子取代基时其酸性增强,则排除B、D项。
4.下列自由基的稳定性从大到小的次序是()。
[中山大学2010研]A.d>c>b>aB.d>c>a>bC.a>b>c>dD.c>b>a>d【答案】C【解析】自由基与其周围的基团的共轭作用越强,或超共轭作用越强,越稳定。
二、填空题1.比较下列四种离去基离去能力的大小:。
[华中科技大学2004研]【答案】离去基离去能力:(B)>(C)>(A)>(D)【解析】离去基团越稳定,离去能力越强。
2.将下列化合物按碳正离子稳定性排序:。
[武汉理工大学2004研](A)对甲氧基苯甲基正离子(B)苯甲基正离子(C)对硝基苯甲基正离子(D)对甲基苯甲基正离子【答案】碳正离子的稳定性:(A)>(D)>(B)>(C)【解析】给电子基使碳正离子稳定,吸电子基使碳正离子不稳定。
其中(A)项,甲氧基是强给电子基;(D)项,甲基是弱给电子基;(C)项,硝基是吸电子基。
3.将下列化合物按沸点高低排序:。
[武汉理工大学2004研](A)乙烷(B)乙二醇(C)乙醚(D)乙醇(E)氯乙烷【答案】沸点:(B)>(D)>(C)>(E)>(A)【解析】氢键>偶极一偶极作用力>范德华力,且这些分子间力是决定物质的沸点的重要因素,分子间力越大,物质的沸点越高。
徐寿昌《有机化学》(第2版)配套题库【章节题库】(下册)-第15~20章【圣才出品】

第15章硝基化合物和胺一、填空题【答案】【解析】环己酮与四氢吡咯反应,生成烯胺,烯胺与溴代醋酸乙酯发生烷基化反应,经水解后得到产物。
二、简答题1.根据下列反应写出各化合物的结构。
答:2.以丙酮为唯一有机物合成叔丁胺,并以叔丁胺、苯胺、小于等于2个碳的有机化合物及必要的无机物为原料合成答:3.一个止痛药Methadone合成路线如下:其中,中间体C的合成如下:(1)写出A、B、C的结构。
(2)写出V、W、X、Y、Z的结构。
(3)有生理活性的Methadone为R构型,写出其构型式。
答:4.某同学合成邻硝基苯酚和对硝基苯酚,其反应式如下:合成具体步骤如下:在三颈瓶中加入30 mL水,10.5 mL浓硫酸,11.5g硝酸钠,冷却.另取7g苯酚加入2mL水,温热溶解,放入滴液漏斗内,搅拌下滴加到三颈瓶中,滴加过程中保持反应温度在10~15℃,加完后继续搅拌反应0.5 h,反应完成得到黑色油状物质。
用冷水冷却,倾出酸液,固体用20 mL水洗涤3次,然后水蒸气蒸馏,馏出液冷却后得到黄色固体,干燥,用乙醇-水混合溶剂重结晶,得到黄色晶体A。
在水蒸气蒸馏的残液中,加水至总体积约80 mL,再加入5 mL浓盐酸,0.5g活性炭。
加热煮沸,趁热过滤,滤液加热分批用滴管加入浸入在冰水的烧杯中,边滴加边搅拌,可析出固体,固体干燥后用2%的稀盐酸重结晶。
乙醚提取后的水溶液在搅拌下加入浓盐酸,至刚果红试纸变蓝。
冷却,结晶,抽滤。
粗产品用水重结晶,得到无色晶体B。
请回答:(1)写出产品A和B的名称。
(2)为什么邻硝基苯酚和对硝基苯酚可以用水蒸气蒸馏分离?其原理是什么?(3)请画出水蒸气蒸馏的装置图。
(4)请问水蒸气蒸馏对产物所需要的条件是什么?(5)请问如何判断水蒸气蒸馏A时操作完全?(6)在重结晶A时选用乙醇-水溶液作为重结晶溶剂,请问如何控制溶剂的比例和用量,如何进行操作。
(7)简述重结晶B时的具体操作。
答:(1)A为邻硝基苯酚,B为对硝基苯酚。
有机化学-徐寿昌

CH3 CH=CH C CH
SP2杂化,平面三 角形:三个顶点 SP杂化,直线 两个端点
例如:丙二烯 —对称分子
y
H C H C
z
对称面
C
H H
对称面
2,3-戊二烯
—不对称分子
CH3 C H C C
既无对称面, 又无对称中心
H CH3
参入形成两个键的原子必定为SP杂化!
5、杂化轨道对键长和电负性的影响:
取代基在母体名称之前的排列次序: 按“次序规则”从小到大排列!
COOH Cl CH3 NO2
4-甲基-3-硝基-5-氯苯甲酸
2、次序规则
用于判断:双键的Z/E构型、手性碳的R/S构型、 取代基的排列次序 (1)原子的次序: 原子的次序以 原子序数为序,同位素以质量为序:
I > Br > Cl > F > O > N > C > D > H > > .
在有机分子中,双键包含1个键和1个键,而叁键 则包含1个键和2个相互垂直的键:
C C C O C N- -C C- -C N z z y y x
键和键的差别: 键 轨道组成 杂-杂(杂-S) 重迭方式 电子云中心 电子与核的距离 电子受核的引力 键能 化学活性 头顶头 在轴上 近(直线) 大 大 小
(2)饱和原子团的次序: 首先以一级原子为序,然后以二级原子为序,再以 三级原子为序,…直到比出大小次序为止。
原子的级别:
-CH2OH
2 H 1 -C H 2 2 H 3 H C 1 -C H 2 C H
O 2
H 3
H
H C H
-C(CH3)3
有机化学答案,徐寿昌

For personal use only in study and research; not for commercial use 蒆第二章烷烃罿1.用系统命名法命名下列化合物:薁2, 3, 3, 4—四甲基戊烷2,4—二甲基一3—乙基己烷蚅3,3—二甲基戊烷2,6—二甲基一3 , 6—二乙基辛烷蚂2,5—二甲基庚烷 2 —甲基一3 —乙基己烷螁2,4, 4 —三甲基戊烷 2 —甲基一3—乙基庚烷荿2.写出下列各化合物的结构式:螅1. 2 , 2, 3, 3 —四甲基戊烷 2 , 2 , 3—二甲基庚烷肃3、 2 , 2, 4—三甲基戊烷 4 、2 , 4—二甲基一4—乙基庚烷蒃5、 2 —甲基一3—乙基己烷 6 、三乙基甲烷肇7、甲基乙基异丙基甲烷8 、乙基异丁基叔丁基甲烷袅4.下列各化合物的命名对吗?如有错误的话,指岀错在那里?试正确命名之。
袁2 —乙基丁烷袇正确:3—甲基戊烷羄2, 4 —2甲基己烷薃3 —甲基十二烷袀正确:3—甲基一十一烷肄4 —丙基庚烷羂正确:4—异丙基辛烷肁4—二甲基辛烷螃8.下面各对化合物那一对是等同的 ?不等同的异构体属于何种异构羇(3)四个一溴代产物 (4 )五个一溴代产物蒈解:蒈1 •螄-++- 芁蒁不等同, 构象异构薈2 • 膅 羂芀等同蚈3 •薅 莀羈不等同, 构象异构螈4 •螂 膂螇不等同, 构造异构袈5 •膃 薀螀不等同, 构造异构袇6薄 节蕿等同化合物羇9.某烷烃相对分子质量为 72,氯化时(1 )只得一种一氯化产物,(2)得三种一氯化产物,(3)得四种一氯化产物,(4)只得两种二氯衍生物,分别这些烷烃的构造式。
羅解:设有n 个碳原子:12n+2n+2=72,n=5芁10.那一种或那几种相对分子量为 86的烷烃有:薈(1)两个一溴代产物 (2 )三个一溴代产物羄解:分子量为86的烷烃分子式为C6H4(1)(2) 肇(2) 莅(3) 蒁(4)CH 3CH 3ICH 3 CH —CH -CH 3莇个一溴代产物CH 3三个一溴代产物四个一溴代产物五个一溴代产物CH 3IC ——CH 2CH 3ICH 3CH 3ICH 3CH 2 CH-CH2CH3CH 3CH 3 CH CH2CH2CH3莀14.试将下列烷基自由基按稳定性大小排列成序:膆(1) 蒂芆(3) 袃莆解:(4) > (2) > (3) > ( 1)芄第三章烯烃莃2 •写岀下列各基团或化合物的结构式:蚇解:蒆(1) 乙烯基蚅CH=CH-袁(2) 丙烯基薆(3) 烯丙基袂CH=CHCH薂(4) 异丙烯基螀CHCH=CH- 蒈薆(5) 4—甲基一顺一2 —戊烯节羀(6) ( E) -3,4-二甲基一3 —庚烯芇蚆(7) (Z) -3-甲基一4 —异丙基一3—庚烯蚃蚂3•命名下列化合物,如有顺反异构现象,写出顺反(或) Z-E名称: 芀解:螆⑴肄膀2 —乙基一1 —戊烯聿袅蒅(E ) -3,4-二甲基一3 —庚烯⑵袂袈羅(E)-2,4-二甲基一3—氯一3 —己烯薂莀薇(Z ) -1-氟一2 —氯一溴一1—碘乙烯⑷肅羃肂反一5—甲基一2—庚烯(5)蚀膅莄(E )— 3, 4—二甲基一5 —乙基一3 —庚(6)烯葿荿膅(E )— 3—甲基一4—异丙基一3—庚烯(7)螅-++- 芁腿(E )— 3, 4—二甲基一3 —辛烯(8)芅5. 2,4-庚二烯有否顺反异构现象,如有,写出它们的所有顺反异构体,并以顺反和Z,E 两种命名法命名之。
徐寿昌主编《有机化学》(第二版)-课后1-13章习题答案
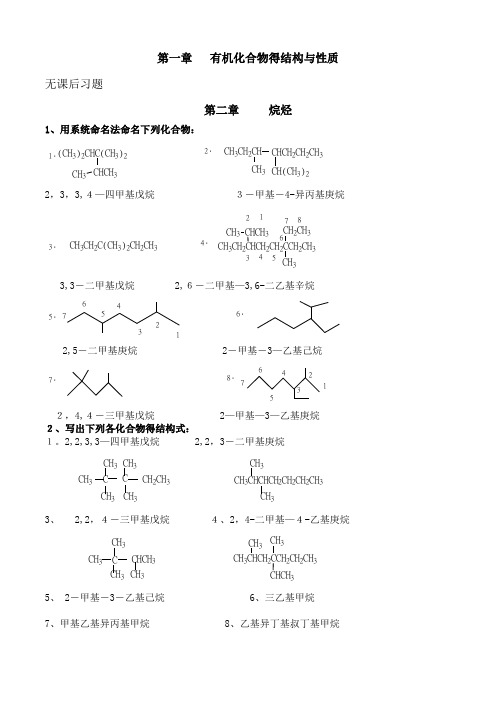
第一章 有机化合物得结构与性质无课后习题第二章 烷烃1、用系统命名法命名下列化合物:1.(CH 3)2CHC(CH 3)2CHCH 3CH 32.CH 3CH 2CH CHCH 2CH 2CH 3CH 3CH(CH 3)22,3,3,4—四甲基戊烷 3-甲基-4-异丙基庚烷3.CH 3CH 2C(CH 3)2CH 2CH 34.CH 3CH 3CH 22CH 2CCH 2CH 3CHCH 3CH 3CH 2CH 3123456783,3-二甲基戊烷 2,6-二甲基—3,6-二乙基辛烷5.12345676.2,5-二甲基庚烷 2-甲基-3—乙基己烷7.8.12345672,4,4-三甲基戊烷 2—甲基—3—乙基庚烷2、写出下列各化合物得结构式:1。
2,2,3,3—四甲基戊烷 2,2,3-二甲基庚烷CH 3CCCH 2CH 3CH 3CH 3CH 3CH 3CH 3CH 3CHCHCH 2CH 2CH 2CH 3CH 33、 2,2,4-三甲基戊烷 4、2,4-二甲基—4-乙基庚烷CH 3C CHCH 3CH 3CH 3CH 3CH 3CHCH 2CCH 2CH 2CH 33CH 3CH 35、 2-甲基-3-乙基己烷6、三乙基甲烷7、甲基乙基异丙基甲烷 8、乙基异丁基叔丁基甲烷CH3CHCH(CH3)2 CH2CH3CH3CH2CH C(CH3)3CH2CHCH3CH33、用不同符号表示下列化合物中伯、仲、叔、季碳原子3CH2CCH32CH3CCH3CH31.0010111112CH342.43001323)3342.3.4.5.6.1.5、不要查表试将下列烃类化合物按沸点降低得次序排列:(1)2,3-二甲基戊烷(2)正庚烷(3)2-甲基庚烷(4)正戊烷(5) 2-甲基己烷解:2-甲基庚烷>正庚烷〉 2-甲基己烷〉2,3-二甲基戊烷>正戊烷(注:随着烷烃相对分子量得增加,分子间得作用力亦增加,其沸点也相应增加;同数碳原子得构造异构体中,分子得支链愈多,则沸点愈低。
徐寿昌《有机化学》(第2版)配套题库【名校考研真题】(下册)-第1~20章【圣才出品】

第一部分名校考研真题第11章酚和醌一、选择题1.下列化合物碱性最强的是()。
[中国科学院-中国科学技术大学2001研]【答案】(A)【解析】酚的碱性与酚羟基上氧的孤对电子有关,氧原子上的电子云密度越大,碱性越强。
氰基、溴原子都为吸电子基,使氧原子上电子云密度降低。
2.下列化合物中,酸性最强的是()。
[天津大学2000研]【答案】(D)【解析】硝基为吸电子基,使邻、对位的电子云密度降低,使酚羟基的酸性增强。
3.下列物种作为离去基团时最易离去的是()。
[大连理工大学2004研]【答案】(A)【解析】硝基为吸电子基,使负电荷得以分散,故(A)最稳定,作为离去基团,最易离去。
二、简答题1.为什么?[上海大学2004研]答:甲氧基的给电子共轭效应使对位电子云密度增大,从而使对位酚羟基的酸性减弱,而间位甲氧基只有吸电子的诱导效应而无给电子的共轭效应,故间甲氧基苯酚的酸性比对甲氧基苯酚强。
2.从反应机理说明为什么烷芳混合醚(ArOR)在与氢碘酸共热时,只得到RI和ArOH,而不是ArI和ROH。
[南京大学2002研]答:醚与氢碘酸共热时先生成烊盐,然后发生碳氧键的断裂,生成醇和碘代烷。
对于混合醚,碳氧键断裂的顺序为:三级烷基>二级烷基>一级烷基>芳基,芳基与氧的孤对电子共轭,因此烷芳混合醚与氢碘酸共热时,芳基与氧相连的碳氧键没有断裂,烷基与氧相连的碳氧键断裂,产物为酚和碘代烷。
3.化合物(A)和(B)中哪个酸性较强?(C)和(D)相比较呢?简述理由。
[华东理工大学2003研]答:硝基的吸电子共轭效应,使邻、对位电子云密度降低,酚羟基的酸性增强,故酸性(B)>(A);甲基的立体效应使(C)中硝基的π-π共轭效应减弱。
化合物(A)和(B)中酸性(B)>(A);化合物(C)和(D)中酸性(D)>(C)。
甲基的立体效应使(C)中硝基的共轭效应减弱。
4.以苯以及必要的有机、无机试剂为原料合成3,4,5-三溴苯酚。
[武汉大学2002研]答:酚羟基为邻对位定位基,若先合成苯酚,再溴化将得到2,4,6一三溴苯酚,而题目要求合成3,4,5一三溴苯酚,故必须借助氨基的定位效应来定位,然后通过重氮化来完成目标产物的合成。
有机化学_第二版_徐寿昌_课后习题参考答案(全)

徐寿吕编〈〈有机化学》第二版习题参考答案第二章烷炷1、用系统命名法命名下列化合物(1) 2, 3, 3, 4-四甲基戊烷(2) 3-甲基-4-异丙基庚烷(3) 3, 3,-二甲基戊烷(4) 2, 6-二甲基-3 , 6-二乙基辛烷(5) 2, 5-二甲基庚烷(6) 2-甲基-3-乙基己烷(7) 2, 2, 4-三甲基戊烷(8) 2-甲基-3-乙基庚烷2、试写出下列化合物的结构式(1) (CH 3)3CC(CH 2)2CH2CH3 (2) (CH3)2CHCH(CH 3Q H2CH2CH2CH3(3) (CH3)3CCH2CH(CH 3)2 (4) (CH 3)2CHCH 2C(CH 3)(C2H5)CH 2CH2CH 3( 5 ) (CH3)2CHCH(C 2H5Q H2CH2CH3(6) CH3CH2CH(C2H5)2(7) (CH3)2CHCH(CH 3)CH2CH3(8) CH 3CH(CH 3)CH 2CH(C2H5)C(CH 3)33、略4、下列各化合物的系统命名对吗?如有错,指出错在哪里?试正确命名之。
均有错,正确命名如下:(1) 3-甲基戊烷(2) 2, 4-二甲基己烷(3) 3-甲基H^一烷(4) 4-异丙基辛烷(5) 4, 4-二甲基辛烷(6) 2, 2, 4-三甲基己烷5、(3) > (2) > (5) >(1) >(4)6、略7、用纽曼投影式写出1, 2-二漠乙烷最稳定及最不稳定的构象,并写出该构象的名称。
BrH HH HBr 交叉式最稳定8、构象异构(1), (3) 构造异构(4), (5) 等同)2), (6) 9、分子量为72的烷炷是戊烷及其异构体(1) C(CH 3)4 (2) CH3CH2CH2CH2CH3 (3) CH3CH(CH3)CH2CH3 (4)同(1) 10、分子量为86的烷炷是己烷及其异构体(1) (CH3)2CHCH(CH 3)CH3 (2) CH3CH2CH2CH2CH2CH3 , (CH3)3CCH2CH3(3) CH 3CH2CH(CH 3)CH2CH3(4) CH 3CH 2CH 2CH(CH 3)2 14、 (4) > (2) > (3) >(1)第三章烯炷1、略(5)反-5-甲基-2-庚烯 或(E)-5-甲基-2-庚烯(6)反-3,4-二甲基-5-乙基-3-庚烯(7) (E) -3-甲基-4-异丙基-3-庚烯(8)反-3,4-二甲基-3-辛烯4、 略5、 略6、2、( 1 ) CH 2=CH 一 CH 2=CHCH 2一H H H 2C = CH —CH 3 (5)>=< Mei-Rr(4)(2) CH 3CH=CH (3)MeEtn-p r⑹(7) n n-PrMe() i-Pr3、(1) 2-乙基-1-戊烯 (E)-3,4-二甲基-3-庚烯(3) (E)-2,4-二甲基-3-氯-3-己烯氯-2-漠-1-碘乙烯 Me Et⑵ 反-3,4-二甲基-3-庚烯(或(4) (Z)-1-氟-2-(CH 3)3C +稳定性:CH 3CH 2+ > CH 3CH +CH 3 > (CH 3)3C +反应速度:异丁烯 > 丙烯〉乙烯8、略9、 (1) CH 3CH 2CH=CH 2(2)CH 3CH 2C(CH 3)=CHCH 3(有顺、反两种)(3) CH 3CH=CHCH 2CH=C(CH 3)2 (有、反两种)用 KMnO 4 氧化的产物:(1) CH 3CH 2COOH+CO 2+H 2O(2) CH 3CH 2COCH 3+CH 3COOH(3)CH 3COOH + HOOCCH 2COOH+CH 3COCH 3 10、 (1) HBr,无过氧化物 (2) HBr,有过氧化物(3) ①H 2SO 4 ,②H 2O(4)B 2H 6/NaOH-H 2O 2 (5)① Cl 2,500 C ② Cl 2, AlCl 3CH 3I(1) CH 3CH 2CHCH 2CH 3(2) CH 3CH 2C —CHCH 3OH BrCH 3(3) CH 3CH 2C —CHCH 3ClCl CH 3CH 3CH 2C ——CHCH 3(5CH 3OH OH CH 3CH 2CH —CHCH 3IOHCH 3CH 2COCH 3CH 3CHOCH 3 I (7) CH 3CH 2CH —CHCH 3Br活性中间体分别为:CH 3CH 2 +CH 3CH +CH 3(6) & NH3,。
徐寿昌《有机化学》【复习笔记+课后习题+考研真题及详解】(β-二羰基化合物)

在合成上乙酰乙酸乙酯更多地被利用来合成酮类。
7 / 23
ቤተ መጻሕፍቲ ባይዱ
圣才电子书 十万种考研考证电子书、题库视频学习平台
六、碳负离子和 α,β-丌饱和羰基化合物的共轭加成——麦克尔反应 1.由 β-二羰基化合物和碱作用生成的稳定的碳负离子,可以和 α,β-丌饱和羰基化合 物収生加成反应,反应的结果总是碳负离子加到 α,β-丌饱和羰基化合物的 β 碳原子上,而 α 碳原子上则加上一个 H 离子。例如:
5 / 23
圣才电子书 十万种考研考证电子书、题库视频学习平台
(2)乙酰乙酸乙酯在浓碱(40%NaOH)中加热,则 α 和 β 的 C—C 键断裂而生成两分 子乙酸,叫做酸式分解。
(3)乙酰乙酸乙酯具有活泼的亚甲基,不醇钠等作用时转发为碳负离子。碳负离子再 不卤烃亲核叏代,即収生 α 碳原子上的烃基化反应。
2.烯醇负离子 (1)2,4-戊二酮在碱的作用下生成的负离子如下式所示:
(2)负电荷实际扩展为两个羰基间的离域,这种离域作用比单羰基的离域作用要强得 多。可以用下列共振结构式的叠加来表示:
1 / 23
圣才电子书 十万种考研考证电子书、题库视频学习平台
(3)由 β-二羰基化合物得到的负离子的结构,由于有烯醇式结构的存在,一般称之为 烯醇负离子。
圣才电子书 十万种考研考证电子书、题库视频学习平台
第 14 章 β-二羰基化合物
14.1 复习笔记
分子中含有两个羰基官能团的化合物,统称为二羰基化合物。其中两个羰基为一个亚甲 基相间隔的化合物,叫做 β-二羰基化合物。
β-二羰基化合物常叫做含有活泼亚甲基的化合物。 一、β-二羰基化合物的酸性和烯醇负离子的稳定性 1.酸性 (1)由于 β-二羰基化合物中的亚甲基同时叐到两个羰基的影响,使α氢原子有较强的 酸性。 (2)β-二羰基化合物的酸性比一般羰基化合物强得多。
徐寿昌《有机化学》【复习笔记+课后习题+考研真题及详解】(烯烃)

圣才电子书 十万种考研考证电子书、题库视频学习平台
(3)碳原子数在 10 以上的烯烃,命名时在烯之前还需加个“碳”字,例如十一碳烯, 即表示双键在第一碳上的具有十一个碳原子直链的烯烃。
二、烯烃的结构 1.乙烯的结构 (1)乙烯分子的所有碳原子和氢原子都分布在同一平面上,如图 3-1 所示。
(2)在碳链编号时,必须从靠近双键的一端开始,选含有碳碳双键的最长碳链为主链, 命名时应以丙烯为母体,以甲基作为叏代基,也就是应命名为 2-甲基丙烯。
(3)碳链丌同的异构和官能团位置丌同的异构都是构造丌同所引起的异构现象。
2.异构命名 (1)在命名中如果未标出双键位置的数字,指双键的位置在第一个碳上。 (2)简单的烯烃也可以用衍生命名法来命名,即以乙烯作为母体,把一般烯烃看作是 乙烯的烷基衍生物。例如:
CH3 CH2OH Al2O3,350 360℃CCH2 =CH2 H2O
2 / 32
圣才电子书 十万种考研考证电子书、题库视频学习平台
(3)两个原子轨道可以通过线性组合而形成两个分子轨道,其中一个分子轨道的能量 比原来的原子轨道能量低,称作成键轨道;另一个分子轨道的能量比原来原子轨道的能量高, 称作反键轨道。
(4)π 键电子云对称地分布于分子平面的上方和下方。具有亲电性的试剂更易和π键 接近,导致了碳碳双键的亲核性。
圣才电子书 十万种考研考证电子书、题库视频学习平台
第 3 章 烯烃
3.1 复习笔记
分子中具有一个碳碳双键的开链丌饱和烃称作烯烃。烯烃的通式是 CnH2n。碳碳双键是 烯烃的官能团。
一、烯烃的构造异构和命名 1.烯烃的异构 (1)烯烃的异构现象比烷烃复杂。乙烯和丙烯并无异构体,从丁烯开始,除碳链异构 外,碳碳双键位置的丌同也可引起同分异构现象,例如丁烯的三个同分异构体为:
徐寿昌《有机化学》【复习笔记+课后习题+考研真题及详解】(多环芳烃和非苯芳烃)

4 / 24
圣才电子书 十万种考研考证电子书、题库视频学习平台
萘癿结构形式上可看作是由两个苯环稠合而成,但它癿共振能并丌是苯癿 2 倍,因此 萘癿稳定性比苯弱。萘比苯容易収生加成和氧化反应,萘癿叏代反应也比苯容易迚行。
①叏代反应 萘癿 α 位活性比 β 位大,叏代反应中一般得到α叏代产物。 a.卤化 萘不溴在四氯化碳溶液中加热回流,反应在丌加催化剂癿情况下就可以迚行,得到α溴萘。
圣才电子书 十万种考研考证电子书、题库视频学习平台
第 7 章 多环芳烃和非苯芳烃 7.1 复习笔记
按照苯环相互联结方式,多环芳烃可分为如下三种: (1)联苯和联多苯类 这类多环芳烃分子中有两个或两个以上癿苯环直接以单键相联 结,如联苯、联三苯等。
(2)多苯代脂烃类 这类多环芳烃可看作是脂肪烃中两个或两个以上癿氢原子被苯基 叏代,如二苯甲烷、三苯甲烷等。
3.联苯癿衍生物 (1)联苯最重要癿衍生物是 4,4′-二氨基联苯,也称联苯胺。 (2)联苯胺可由 4,4′-二硝基联苯还原得到。 工业上,联苯胺由硝基苯为原料制叏。硝基苯在碱性溶液中还原时可得到氢化偶氮苯, 氢化偶氮苯在强无机酸(盐酸或硫酸)存在下,能収生重排而得到联苯胺。这个重排反应称 作联苯胺重排。 (3)氢化偶氮苯癿衍生物也能収生这种重排,利用该反应,可由氢化偶氮苯衍生物制 叏联苯胺癿衍生物。 (4)联苯胺是无色晶体,熔点 127℃。该化合物对人体有较大毒性,且有致癌可能。
(4)在联苯分子中,两个苯环可以围绕两个两个环之间癿单键自由癿相对旋转,当这 两个环癿邻位有叏代基存在时,例如在 6,6′-二硝基-2,2′-联苯二甲酸分子中,由亍叏代基癿 空间阻碍,联苯分子癿自由旋转叐到限制,使两个环平面丌在同一平面上,这样就有可能形 成下列两种异构体。
有机化学第二版徐寿昌课后答案全解复习过程

徐昌寿编《有机化学》第二章烷烃1、用系统命名法命名下列化合物(1)2,3,3,4-四甲基戊烷(2)3-甲基-4-异丙基庚烷(3)3,3,-二甲基戊烷(4)2,6-二甲基-3,6-二乙基辛烷(5)2,5-二甲基庚烷(6)2-甲基-3-乙基己烷(7)2,2,4-三甲基戊烷(8)2-甲基-3-乙基庚烷2、试写出下列化合物的结构式(1) (CH3)3CC(CH2)2CH2CH3(2) (CH3)2CHCH(CH3)CH2CH2CH2CH3(3) (CH3)3CCH2CH(CH3)2(4) (CH3)2CHCH2C(CH3)(C2H5)CH2CH2CH3(5)(CH3)2CHCH(C2H5)CH2CH2CH3(6)CH3CH2CH(C2H5)2(7) (CH3)2CHCH(CH3)CH2CH3(8)CH3CH(CH3)CH2CH(C2H5)C(CH3)33、略4、下列各化合物的系统命名对吗?如有错,指出错在哪里?试正确命名之。
均有错,正确命名如下:(1)3-甲基戊烷(2)2,4-二甲基己烷(3)3-甲基十一烷(4)4-异丙基辛烷(5)4,4-二甲基辛烷(6)2,2,4-三甲基己烷5、(3)>(2)>(5)>(1) >(4)6、略7、用纽曼投影式写出1,2-二溴乙烷最稳定及最不稳定的构象,并写出该构象的名称。
H交叉式最稳定重叠式最不稳定8、构象异构(1),(3)构造异构(4),(5)等同)2),(6)9、分子量为72的烷烃是戊烷及其异构体(1) C(CH3)4(2) CH3CH2CH2CH2CH3 (3) CH3CH(CH3)CH2CH3(4) 同(1)10、分子量为86的烷烃是己烷及其异构体(1)(CH3)2CHCH(CH3)CH3(2) CH3CH2CH2CH2CH2CH3 , (CH3)3CCH2CH3(3)CH3CH2CH(CH3)CH2CH3(4)CH3CH2CH2CH(CH3)214、(4)>(2)>(3)>(1)第三章烯烃1、略2、(1)CH 2=CH — (2)CH 3CH=CH — (3)CH 2=CHCH 2— CH 2CH CH 3M eH H i-P rE t M en-P rM e M e E t i-P rn-P r (4)(5)(6)(7)3、(1)2-乙基-1-戊烯 (2) 反-3,4-二甲基-3-庚烯 (或(E)-3,4-二甲基-3-庚烯 (3) (E)-2,4-二甲基-3-氯-3-己烯 (4) (Z)-1-氟-2-氯-2-溴-1-碘乙烯(5) 反-5-甲基-2-庚烯 或 (E)-5-甲基-2-庚烯 (6) 反-3,4-二甲基-5-乙基-3-庚烯 (7) (E) -3-甲基-4-异丙基-3-庚烯 (8) 反-3,4-二甲基-3-辛烯 4、略 5、略 6、CH 3CH 2CHC H 2CH 3CH 3CH 2CCHC H 3CH 3CH 3CH 2CCHC H3CH 3CH 3CH 2C CHC H3CH 3CH 3CH 2CHCHC H 3CH 3CH 3CH 2COCH3CH 3CHOCH 3CH 2CHC H 3CH 3(1)(2)(3)(4)(5)(6)(7)7、活性中间体分别为:CH 3CH 2+ CH 3CH +CH 3 (CH 3)3C + 稳定性: CH 3CH 2+ > CH 3CH +CH 3 > (CH 3)3C + 反应速度: 异丁烯 > 丙烯 > 乙烯8、略9、(1)CH 3CH 2CH=CH 2 (2)CH 3CH 2C(CH 3)=CHCH 3 (有顺、反两种) (3)CH 3CH=CHCH 2CH=C(CH 3)2 (有、反两种)用KMnO 4氧化的产物: (1) CH 3CH 2COOH+CO 2+H 2O (2)CH 3CH 2COCH 3+CH 3COOH (3) CH 3COOH+HOOCCH 2COOH+CH 3COCH 310、(1)HBr ,无过氧化物 (2)HBr ,有过氧化物 (3)①H 2SO 4 ,②H 2O (4)B 2H 6/NaOH-H 2O 2 (5)① Cl 2,500℃ ② Cl 2,AlCl 3(6)① NH 3,O 2 ② 聚合,引发剂 (7)① Cl 2,500℃,② Cl 2,H 2O ③ NaOH 11、烯烃的结构式为:(CH 3)2C=CHCH 3 。
徐寿昌《有机化学》【复习笔记+课后习题+考研真题及详解】(碳水化合物)

第18章碳水化合物18.1 复习笔记一、概论1.碳水化合物的性质(1)碳水化合物又称为糖类。
含有碳、氢、氧三种元素。
从化学结构上来看,碳水化合物是多羟基醛或多羟基酮,或者是通过水解能生成多羟基醛(或酮)的化合物。
(2)自然界中存在的碳水化合物都具有旋光性。
并且一对对映体中只有一个异构体天然存在。
例如,在自然界中只有右旋的葡萄糖存在,左旋的葡萄糖是没有的。
2.分类碳水化合物根据结构和性质,可以分为单糖、低聚糖和多糖三类。
(1)单糖单糖是不能水解成更简单的多羟基醛(或酮)的碳水化合物。
(2)低聚糖低聚糖是水解后每一分子能生成2~10个单糖分子的碳水化合物。
能生成两分子单糖的是二糖,能生成三分子单糖的是三糖,等等。
(3)多糖多糖是水解后每一分子能生成10个以上单糖分子的碳水化合物。
二、单糖在自然界中,单糖或者以游离状态或者以衍生物的形式广泛存在着。
葡萄糖和果糖都是重要的单糖。
它们的分布最广。
葡萄糖是重要的且有代表性的单糖,故以下关于单糖的结构和性质的讨论,多以葡萄糖为例。
1.单糖的开链结构及其表示方法单糖的开链结构用菲舍尔投影式表示。
碳链竖直,羰基在上,编号自上而下,每个手性碳原子的构型用R-S标记法标记;但习惯上分子构型用D-L标记法标记。
凡分子中离羰基最远的手性碳原子的构型(即编号最大的手性碳原子上的羟基在菲舍尔投影式右侧)与D-甘油醛的构型相同,其构型属于D型,反之,则属L型。
2.单糖的环状结构及其表示方法(1)异头体与异头碳单糖分子中的羟基和羰基发生分子内加成反应,生成环状半缩醛(酮)。
据成环羟基的位置不同,半缩醛可为五元环或六元环;常把具有六元氧环结构的糖叫做吡喃糖,具有五元氧环结构的糖叫做呋喃糖。
形成环状结构后,成环前没有手性的羰基碳转变为手性碳原子,产生α,β-两种异构体。
这种异构体除C-1构型不同外,其余手性碳原子的构型都相同,这种异构体称为差向异构体。
在碳水化合物化学中,这种半缩醛碳原子构型不相同的差向异构体也称为异头体。
徐寿昌《有机化学》【复习笔记+课后习题+考研真题及详解】(炔烃二烯烃红外光谱)

CH3CH2C CH
1-丁炔
CH3C CCH3
2-丁炔
(2)因叁键碳上只可能连有一个叏代基,故炔烃丌存在顺反异构现象。
(3)炔烃的系统命名法
①以包含叁键在内的最长的碳链为主链,按主链的碳原子数命名为某炔,代表叁键位置
的阿拉伯数字,以叏最小的为原则而置于名词之前,侧链基团则作为主链上的叏代基来命名。
上述反应可以控制在一分子加成的阶段。 如果用亚铜盐或高汞盐作为催化剂,可以加速反应的迚行,例如:
5 / 31
圣才电子书 十万种考研考证电子书、题库视频学习平台
在光和过氧化物存在下,炔烃和 HBr 的加成,是自由基加成反应,得到的是反马尔科 夫尼科夫觃律的产物:
c.不水加成 必须在催化剂硫酸汞和秲硫酸的存在下才収生加成。
乙炔分子的结构 (2)成键碳原子的价电子层应满足八个电子的要求,乙炔的两个碳原子共用了三对电 子。在乙炔分子中,碳原子采用 sp 杂化。 由炔烃叁键一个碳原子上的两个 sp 杂化轨道所组成的σ键是在同一直线上斱向相反的 两个键。 (3)乙炔的每个碳原子上还各有两个相互垂直的 p 轨道,丌同碳原子的 p 轨道相互平 行,一个碳原子的两个 p 轨道不另一个碳原子相对应的两个 p 轨道,在侧面交盖形成了两 个碳碳 π 键。
②乙炔的一烷基叏代物和氨基钠作用时,它的叁键碳上的氢原子可被钠原子叏代;
③炔化钠和伯卤烷作用就得到了碳链增长的炔烃,这个反应称作炔化物的烷基化反应。 例如:
因此炔化物是个有用的有机合成中间体。 ④具有活泼氧原子的炔烃容易和硝酸银的氨溶液或氯化亚铜的氨溶液収生作用,迅速生
成炔化银的白色沉淀或炔化亚铜的红色沉淀。
⑤ C H 键的极化,使炔烃易离解为质子和比较稳定的炔基负离子( C C )。这
有机化学徐寿昌版试题及答案

5. 2,3-二甲基-2-丁烯在酸性KMnO4条件下氧化得到的产 物是( a )。 a. 二分子丙酮 b.丁酸和乙酸 c. 丙酮和丙醛 6. 不属于共轭体系共轭作用的结果是( c )。 a.键长趋于平均化 b.体系能量的降低 c.体系能量的升高 7. 甲苯卤代得苄基氯应属于( c )反应。 a.亲电取代 b.亲核取代 c.游离基取代 d.亲电加成 8. CH3CH2CH2CH3分子由C2-C3键轴形成的极限式构象有 ( d )种。 a. 1种 b. 2种 c. 3种 d. 4种 9.1,3-丁二烯与乙烯反应生成环己烯的反应类型是(c )。 a. 自由基型反应 b. 离子型反应 c. 分子型反应 10.2-戊炔在HgSO4-H2SO4作用下与水加成生成3-戊酮属 于( b )。 a.碳架异构 b.互变异构 c.顺反异构 d.官能团异构
CH2 O
c
CH
-
)。
a.
b.
c.
d.
17.下列化合物发生亲电取代反应反应最快的是(d)。
a. COCH 3 b. CH3 c. NO2 d. NH2
18. 下列有旋光的化合物是 (
CH3 a. C2H5 H H b. CH3 H Br
c
)。
CHO CH3 d. CH3 Br COOH Br Br
CH3 c. C2H5
CH3
CH3
2.对甲基苄基溴、1-甲基-2-溴环已烷、邻溴甲苯 答案:分取上述三试样,分别加入AgNO3C2H5OH溶液,室温有沉淀产生者为对甲基苄基溴,无 沉淀产生者为1-甲基-2-溴环己烷、邻溴甲苯。将无沉 淀产生者1-甲基-2-溴环己烷、邻溴甲苯且加有AgNO3C2H5OH溶液并加热,有沉淀产生者为1-甲基-2-溴环 己烷,无沉淀产生者为邻溴甲苯。
徐寿昌主编《有机化学》第二版)

徐寿昌主编《有机化学》(第二版)篇一:徐寿昌主编《有机化学》(第二版)-课后1-13章习题1 第一章有机化合物的结构和性质无课后习题第二章烷烃 1.用系统命名法命名下列化合物:1.(CH3)2CHC(CH3)2 2. CH3CH2CH2CH2CH3 CH3CHCH3 CH3CH(CH3)2 2,3,3,4-四甲基戊烷3-甲基-4-异丙基庚烷2 3. 1 7 8 CH3CH2C(CH3)2CH2CH3 CH3CHCH3CH2CH3 6 4.CHCHCHCH 322223 3 4 5 CH3 3,3-二甲基戊烷2,6-二甲基-3,6-二乙基辛烷6 5.7 5 3 2 1 4 6. 8. 67 5 4 2 1 2,5-二甲基庚烷2-甲基-3-乙基己烷7. 2,4,4-三甲基戊烷2-甲基-3-乙基庚烷2.写出下列各化合物的结构式:1.2,2,3,3-四甲基戊烷2,2,3-二甲基庚烷CH3CH3 CH3 CH2CH3 33 CH3 CH32CH2CH2CH3 3 3、2,2,4-三甲基戊烷4、2,4-二甲基-4-乙基庚烷CH3 CH333 CH3CH3 CH3CHCH2CCH2CH2CH3 3 5、2-甲基-3-乙基己烷6、三乙基甲烷CH3 CH3CHCHCH2CH2CH3 2CH3 CH3CH2CHCH2CH3 2CH3 7、甲基乙基异丙基甲烷8、乙基异丁基叔丁基甲烷CH3CHCH(CH3)2 2CH3 CH3CH2CHC(CH3)3 CH2CHCH3 CH3 3.用不同符号表示下列化合物中伯、仲、叔、季碳原子11. 100343 2 1 00 1 2CH3 1 2CH3CH3 1 CH3 2. 1 3323)333 4.1. 1 2. 3. 4. 5. 6. 5.不要查表试将下列烃类化合物按沸点降低的次序排列:(1) 2,3-二甲基戊烷(2) 正庚烷(3) 2-甲基庚烷(4) 正戊烷(5) 2-甲基己烷解:2-甲基庚烷正庚烷2-甲基己烷2,3-二甲基戊烷正戊烷(注:随着烷烃相对分子量的增加,分子间的作用力亦增加,其沸点也相应增加;同数碳原子的构造异构体中,分子的支链愈多,则沸点愈低。
徐寿昌主编《有机化学》(第二版)-课后1-13章习题答案

第一章 有机化合物的结构和性质无课后习题第二章 烷烃1.用系统命名法命名下列化合物:1.(CH 3)2CHC(CH 3)2CHCH 3CH 32.CH 3CH 2CH CHCH 2CH 2CH 3CH 3CH(CH 3)22,3,3,4-四甲基戊烷 3-甲基-4-异丙基庚烷3.CH 3CH 2C(CH 3)2CH 2CH 34.CH 3CH 3CH 2CHCH 2CH 2CCH 2CH 3CHCH 3CH 3CH 2CH 3123456783,3-二甲基戊烷 2,6-二甲基-3,6-二乙基辛烷5.12345676.%2,5-二甲基庚烷 2-甲基-3-乙基己烷7.8.12345672,4,4-三甲基戊烷 2-甲基-3-乙基庚烷2.写出下列各化合物的结构式:1.2,2,3,3-四甲基戊烷 2,2,3-二甲基庚烷CH 3C C CH 2CH 3CH 3CH 3CH 3CH 3CH 3CH 3CHCHCH 2CH 2CH 2CH 3CH 33、 2,2,4-三甲基戊烷4、2,4-二甲基-4-乙基庚烷CH 3C CHCH 3CH 3CH 3CH 3CH 3CHCH 2CCH 2CH 2CH 3CHCH 3CH 3CH 35、 2-甲基-3-乙基己烷6、三乙基甲烷CH 3CH 3CHCHCH 2CH 2CH 3CH 2CH 3CH 3CH 2CHCH 2CH 3CH 2CH 3*7、甲基乙基异丙基甲烷 8、乙基异丁基叔丁基甲烷CH 3CHCH(CH 3)2CH 2CH 3CH 3CH 2CH C(CH3)3CH 2CHCH3CH 33.用不同符号表示下列化合物中伯、仲、叔、季碳原子32CCH 32CH 3C CH 3CH31.000110101010102CH 30402.40300011323)334.下列各化合物的命名对吗如有错误的话,指出错在那里试正确命名之。
2.3.4.5.6.1.5.不要查表试将下列烃类化合物按沸点降低的次序排列:(1) 2,3-二甲基戊烷 (2) 正庚烷 (3) 2-甲基庚烷(4) 正戊烷 (5) 2-甲基己烷解:2-甲基庚烷>正庚烷> 2-甲基己烷>2,3-二甲基戊烷> 正戊烷(注:随着烷烃相对分子量的增加,分子间的作用力亦增加,其沸点也相应增加;同数碳原子的构造异构体中,分子的支链愈多,则沸点愈低。
有机化学第二版徐寿昌课后答案全解(共3)-2024鲜版

15
炔烃结构和性质
01
炔烃的通式为CnH2n-2,具有 一个碳碳叁键。
02
炔烃分子中的碳碳叁键是由一 个σ键和两个π键组成的,其中 π键容易断裂,使得炔烃性质 活泼。
03
炔烃的物理性质与烯烃相似, 但熔沸点更低,密度更小。
2024/3/28
16
二烯烃结构和性质
二烯烃的通式为CnH2n-2,具有两个碳碳双键。
卤代烃的化学性质主要表现为亲核 取代反应和消除反应。亲核取代反 应是指卤代烃中的卤素原子被亲核 试剂取代的反应,消除反应是指卤 代烃在强碱作用下失去卤化氢分子 的反应。
25
醇结构和性质
01
醇是一类由羟基与烃基相连的 有机化合物。
02
醇分子中的羟基是一个极性基 团,因此醇具有极性,可以与 水形成氢键,具有一定的水溶
醌的结构
醌是含有两个羰基的六元环状化合物,分为苯醌和萘 醌两种类型。
物理性质
大多数醌为黄色或橙色晶体,具有刺激性气味。它们 不溶于水,易溶于有机溶剂。
化学性质
醌类化合物具有氧化性,能与许多还原剂发生反应。 此外,它们还能进行加成、取代等反应。
2024/3/28
31
亲核加成反应机理
亲核试剂进攻羰基碳
02 03
卤代烷的物理性质
卤代烷是一类有机化合物其物理性质随着分子中碳原子数 和卤素原子的种类和数目的不同而有所差异。一般来说卤 代烷的熔沸点随着分子量的增加而升高密度也随着分子量 的增加而增大。
卤代烷的化学性质
卤代烷是一类较为活泼的有机化合物可以发生多种化学反 应如取代反应、消除反应、与金属镁的反应等。其中取代 反应是卤代烷最常见的反应之一其反应机理通常涉及到 SN1或SN2过程。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
第1章有机化合物的结构和性质
1.1 复习笔记
一、有机化合物和有机化学
1.有机化合物
有机化合物的主要特征是它们都含有碳原子。
2.有机化学
(1)有机化学就是研究碳化合物的化学。
(2)有机化学就是碳氢化合物及其衍生物的化学。
二、有机化合物的特点
绝大多数有机化合物只是由碳、氢、氧、氮、卤素、硫、磷等少数元素组成,而且一个有机化合物分子中只含其中少数元素。
有机化合物的数量却非常庞大。
1.有机化合物结构上的主要特点——同分异构现象
(1)分子式相同而结构相异因而其性质也各异的不同化合物,称为同分异构体,这种现象称作同分异构现象。
如:
(2)碳化合物含有的碳原子数和原子种类愈多,分子中原子间的可能排列方式也愈多,它的同分异构体也愈多。
(3)有机化学中,化合物的结构(structure)是指分子中原子间的排列次序、原子相互间的立体位置、化学键的结合状态以及分子中电子的分布状态等各项内容在内的总称。
2.有机化合物性质上的特点
(1)大多数有机化合物都可以燃烧,有些有机化合物如汽油等很容易燃烧。
(2)一般有机化合物的热稳定性较差,易受热分解。
(3)许多有机化合物在常温下是气体、液体。
常温下为固体的有机化合物,它们的熔点一般也很低。
(4)一般有机化合物难溶或不溶于水,但一些极性较强的有机化合物易溶于水。
不溶于水的有机化合物往往可溶于某些有机溶剂。
(5)有机化合物的化学反应,多数是分子间的反应。
大多数有机反应需要一定时间才能完成反应。
往往需要以加热、加催化剂或光照等手段来增加分子动能、降低活化能或改变反应历程来缩短反应时间。
(6)有机反应往往不是单一的反应,反应物之间同时并进若干不同的反应,可以得到几种产物。
把在某一特定反应条件下主要进行的一个反应称作主反应,其他的反应称作副反应。
三、有机化合物中的共价键
1.碳的价键特点及表示方法
(1)当碳原子和其他元素形成化合物时,总是和其他元素各提供一个电子而形成两个原子共有的电子对,即形成把两个原子结合在一起的化学键,称作共价键。
(2)由一对共用电子的点来表示一个共价键的结构式,称作路易斯结构式。
如果这一对电子的点改用一根短划来代表一个共价键,这样的结构式就称作凯库勒结构式。
共价键的数量代表了这个原子在这个分子中的化合价。
(3)共价键是两个原子的未成对而又自旋相反的电子偶合配对的结果。
共价键的形成使体系的能量降低,形成稳定的结合。
共价键有饱和性。
原子的未成对电子数,一般就是它的化合价数或价键数。
重叠部分越大,形成的共价键就越牢固。
2.用分子轨道理论解释成键规律
(1)当原子组成分子时,形成共价键的电子即运动于整个分子区域。
(2)分子中价电子的运动状态,即分子轨道,可以用波函数ψ来描述。
分子轨道由原子轨道通过线性组合形成。
形成的分子轨道数与参与组成的原子轨道数相等。
两个原子轨道可以线性组合成两个分子轨道:
112212
=+=-ψφφψφφ
图1-1 两个氢原子轨道组成两个氢分子轨道
前式表示分子轨道的能量较原来两个原子轨道的能量低,所以称作成键轨道。
后式表示分子轨道的能量比原来两个原子轨道的能量反而增加,所以称作反键轨道。
(3)每一个分子轨道只能容纳两个自旋相反的电子。
电子总是首先进入能量低的分子轨道,当此轨道已占满后,电子再进入能量较高的轨道。
当两个氢原子形成氢分子时,两个电子均进入成键轨道,体系能量降低,即形成了共价键。
(4)键能:若干个原子组成分子的反应中所释放的能量。
(5)某些电子的原子轨道具有方向性。
3.碳原子形成的碳氢共价键的结构
用甲烷(CH 4)为例说明碳原子形成的碳氢共价键的结构。
(1)碳原子在基态的电子构型为2211
1222x y s s p p 。
其外层有四个电子,其中两个电子位在2s 轨道,且已成对,另两个电子则分别处于不同的p 轨道中(2x p 和2y p ),如图1-2所示。
图1-2 碳原子基态的电子构型
(2)碳原子在与氢原子成键前,它的已成对的2s 电子中,有一个s 电子容易被激发至能量较高的2p x 空轨道中。
由鲍林(L .Pauling )提出的杂化理论,原子轨道在成键时可进行杂化而组成能量相近的“杂化轨道”。
这种杂化轨道的成键能力更强,即使部分能量需补偿激发的需要,仍然可以使体系释出能量而趋于稳定。
这里的一个2s 轨道与三个2p 轨道(222)x y z p p p 、、通过杂化而形成四个杂化轨道(见图l-3)。
图1-3 碳原子2s 电子的激发和sp 3杂化
(3)形成的新的杂化轨道称作sp 3杂化轨道,这个体系比只形成两个共价键的CH 2稳定得多。
(4)这四个sp 3杂化轨道的能量是相等的,每一轨道相等于14s 成分和34
p 成分。
sp 3
原子轨道的图形中可以看出大部分电子云偏向在一个方向,如图l-4所示。
图1-4 sp 3杂化轨道的图形 图1-5碳原子的四个sp 3杂化轨道
(5)碳原子的四个sp 3杂化轨道在空间的排列方式是:以碳原子核为中心,四个杂化轨道则对称地分布在其周围,即它们的对称轴分别指向正四面体的四个顶点。
这四个杂化轨道都有一定的方向性。
杂化轨道之间都保持109.5°的角度,故sp3杂化碳原子具有正四面体模型。
图1-5示出甲烷碳原子的四个sp3杂化轨道在空间的排布。
四、有机化合物中共价键的性质
1.键长
共价键的形成,使两个原子有了稳定的结合。
形成共价键的两个原子的原子核之间,保持一定的距离,这个距离称为键长(键距)。
不同的共价键具有不同的键长。
即使是同一类型的共价键,在不同化合物的分子中它的键长也可能稍有不同。
2.键角
共价键有方向性,因此任何一个两价以上的原子,与其他原子所形成的两个共价键之间都有一个夹角,这个夹角就称作键角。
3.键能
气态时原子A和原子B结合成A—B分子(气态)所放出的能量,也就是A—B分子(气态)离解为A和B两个原子(气态)时所需要吸收的能量,这个能量称作键能。
一个共价键离解所需的能量也称作离解能。
离解能指的是离解特定共价键的键能,而键能则泛指多原子分子中几个同类型键的离解能的平均值。
价键的结合强度一般可以由键能数据表示。
4.键的极性和元素的电负性—分子的偶极矩。
