胶团萃取
胶团和反胶团萃取要点

由于周围水层和极性基团的保护,保持了蛋白 质的天然构型,不会造成失活。
◘ 蛋白质进入反胶团溶液是一协同过程。在有机溶 剂相和水相两宏观相界面间的表面活性剂层 ,同 邻近的蛋白质分子发生静电吸引而变形 ,接着两 界面形成含有蛋白质的反胶团 ,然后扩散到有机 相中 ,从而实现了蛋白质的萃取。(可能机理) ◘ 改变水相条件 (如pH值、离子种类或离子强度 ) ,又可使蛋白质从有机相中返回到水相中 ,实OT需要6~8个水分
子,而其它水分子则不受束缚,可与普通水一样自由流动 。
故当W > 16时,“水池”中的水逐渐接近主体水相粘 度,胶团内也形成二重电荷层。
见下图。
假定反胶团为球形(除了W或表面活性剂浓度很 大外),反胶团平均直径dm的增加和W的增加基本成 正比,W=0~50之间,dm=2~30nm。
向)胶团。
水
极性头
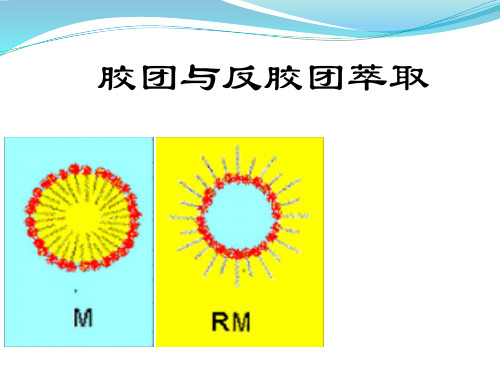
正胶团是在极性溶液中形成的,
其亲水性的极性端向外指向极 性(如水)溶液,疏水性的非 极性“尾”向内相互聚集在一
非极性的核 非极性尾
起。
反胶团是两性表面活性 剂在非极性有机溶剂中 亲水性基团自发的向内 聚集而成,内含微小水 滴,其疏水性的非极性 尾部向外,指向非极性 溶剂,而极性头向内, 与在水相中形成的微胶 团方向相反。
反胶团的分类
1、单一表面活性剂反胶团体系: 是指在使用时无须加入助剂的表面活性剂,具有多条中等长度的烷 基尾和一个较小的极性头。
A、 阴离子型,如AOT。该体系结构简单和稳定,反胶团体积较大 ,适用于等电点较高的、相对分子量较小的蛋白质的分离;
B、阳离子型,如CTAB,DAP等。该体系适用于等电点较低的、相对 分子量较大的蛋白质的分离; 分子量更大的蛋白质,但这类体系容易乳化。 C、非离子型表面活性剂,能形成更大的反胶团体系,能分离相对
胶团与反胶团萃取技术
极性基团两部分组成的两性分子。
表面活性剂的分类: 阴离子表面活性剂; 阳离子表面活性剂; 非离子型表面活性剂。
表面活性剂在溶液中开始形成胶团时的浓度称为临界胶束
浓度,简称CMC。当溶液中表面活性剂浓度低于CMC时,它 主要以单体形式,即分子或离子形式存在。表面活性剂形 成胶团后,溶液的许多物理化学质,如表面张力、摩尔电 导率、渗透压、密度、增溶性能等,在一个很窄的浓度范 围内呈现不连续变化。
从原理上,可当 做“液膜”分离操作 的一种。 如右图所示 :
(3)溶解法 将含有反胶团(W=3~30)的有机溶液与蛋白质固体粉末一齐搅 拌,使蛋白质进入反胶团中 。 用于非水溶性蛋白质。 该法所需时间较长,含蛋白质的反胶团体系稳定。 说明反胶团“水池”中的水与普通水的性质有区别。
二、反胶团萃取原理
从宏观上看反胶团萃取,是有机相-水相间的分配萃 取,和普通的液液萃取在操作上具有相同特征。 微观上,是从主体水相向溶解于有机溶剂相中的反胶 团微水相中的分配萃取。
表面活性剂 AOT CTAB TOMAC
有机溶剂 表面活性剂 有机溶剂 n-烃类(C6~C10)、异辛烷、 Brij60 辛烷 环己烷、四氯化碳、苯 己醇/异辛烷,己醇/辛烷
TritonX 己醇/环己烷 三氯甲烷/辛烷
磷脂酰胆碱 苯、庚烷 环己烷 磷脂酰乙醇胺 苯、庚烷
胶团分为正(向)胶团和反(向)胶团。
胶团与反胶团萃取
一、基本概念
二、萃取原理 三、影响因素 四、应用领域 五、胶团与反胶团萃取设备
一.基本概念
胶团萃取——是被萃取物以胶团或者胶体形式从水相 被萃取到有机相的溶剂萃取方法。它既可用于无机物的萃 取,也可用于有机物的萃取。
在无机物的方面:金属或其无机盐可以形成疏水胶体粒子粒子进入有
反相微胶团萃取技术培训课件

反相微胶团萃取技术培训 课件
欢迎参加反相微胶团萃取技术的培训课程。在本课程中,我们将深入探讨该 技术的背景、原理、应用领域、实验操作、案例研究、技术进展和应用前景, 并总结重要观点。
技术背景
掌握反相微胶团萃取技术,从理解其技术背景开始。该技术的原理基于微胶团的形成和提取过程。了解这些背 景知识是成功应用该技术的关键。
反相微胶团萃取技术的定义和 原理
反相微胶团萃取技术利用胶团结构的形成,将反相溶剂与目标组分结合。掌 握该技术的定义和原理,可以准确理解反相微胶团萃取的工作机制。
反相微胶团萃取技术的应用领 域
了解反相微胶团萃取技术的应用领域,包括环境监测、食品安全、药物分析 等。探索这些应用领域的案例,以及该技术在解决实际问题中的作用。
调整反相胶团体系
根据目标组分的特性,调整物质的浓度和 pH 值,以实现最佳萃取效果。
掌握操作步骤
详细了解每个步骤的操作要点,确保实验的可重复性和准确性。
案例研究
环境监测
食品安全
如何利用反相微胶团萃取技术进 行环境污染物的快速分析和监测。
探索反相微胶团萃取技术在食品 中农药和重金属残留检测中的应 用。
实验操作
1
准备实验样品
选择目标组分和适合的反相溶剂,以确保实验的成功。
2
构建微胶团体系ຫໍສະໝຸດ 通过调整物质的配比和 pH 值,形成稳定的反相微胶团体系。
3
胶团萃取过程
将待萃取的样品与反相溶剂的胶团混合,实现目标组分的高效提取。
反相微胶团萃取技术的步骤和操作注 意事项
准备实验条件
保持实验环境的洁净和适宜的温度,以确保实验结果的可靠性。
药物分析
了解反相微胶团萃取技术在药物 分析中的作用,提高药物检测的 准确性和灵敏度。
反胶团萃取技术

反胶团萃取法,亦称“逆胶束萃取法”。
利用反相微胶团在油相中形成的亲水空穴能选择性地溶解某些蛋白质分子的特性,来分离萃取蛋白质分子的一种方法。
反相微胶团是指油相中表面活性剂浓度超过临界胶团浓度后,在非极性油溶液中形成的聚集体,其内腔由表面活性剂分子的亲水头构成,外面被伸向连续油相的憎水尾部所包围,这种结构使其在连续油相中形成了许多亲水空穴,水相中的极性分子有可能溶解在油相中。
如水相中含有几种蛋白质,可调节系统的条件,使某些蛋白质溶于胶团中,而其他蛋白质则不能,以此达到分离的目的。
该法已成功地通过控制pH和氯化钾浓度,实现了α-核糖核酸酶、细胞色素C和溶菌酶的分离以及α-淀粉酶的连续萃取和反萃取操作。
反胶团萃取的原理

反胶团萃取的原理胶团是一种由胶原蛋白和其他蛋白质组成的胶体颗粒,它在食品加工和制备中具有重要的作用。
然而,在某些情况下,我们需要将胶团从食品中去除,这就需要用到反胶团萃取技术。
反胶团萃取的原理主要是利用一定的物理或化学手段,将胶团从食品中分离出来。
本文将介绍反胶团萃取的原理及其应用。
首先,反胶团萃取的原理涉及到胶团的特性。
胶团在溶液中通常呈现为胶态,其粒径较大,表面带有电荷,因此在溶液中具有一定的稳定性。
为了实现反胶团的萃取,我们需要破坏胶团的稳定性,使其聚集成团,从而可以被分离出来。
其次,反胶团萃取的原理可以通过改变溶液的物理条件来实现。
例如,可以通过调节溶液的pH值,改变离子强度,或者调节温度来破坏胶团的稳定性。
在酸性条件下,胶原蛋白的电荷状态会发生改变,从而导致胶团的聚集。
另外,通过加热或者冷却溶液,也可以改变溶液中胶团的稳定性,使其聚集成团。
此外,反胶团萃取的原理还可以通过添加特定的化学物质来实现。
例如,可以添加盐类、有机溶剂、蛋白酶等物质来改变溶液中胶团的性质,从而实现胶团的聚集和分离。
这些化学物质可以改变胶团表面的电荷状态,破坏其稳定性,使其聚集成团,便于分离。
最后,反胶团萃取的原理还可以通过物理手段来实现。
例如,可以利用超声波、高压处理、离心等方法来破坏胶团的稳定性,使其聚集成团,便于分离。
这些物理手段可以有效地改变胶团的结构和性质,从而实现胶团的萃取。
综上所述,反胶团萃取的原理主要是通过改变溶液的物理和化学条件,破坏胶团的稳定性,使其聚集成团,从而实现胶团的分离。
这种技术在食品加工和制备中具有重要的应用,可以有效地改善食品的质量和口感。
希望本文对反胶团萃取的原理有所帮助,谢谢阅读!。
第六章反向微胶团萃取与双水相萃取技术

• 6.4.2:相图 • 不同的双水相体系,其成相条件是不同的,相图常被用于 研究不同双水相体系中的成相现象。把双水相体系中 的组成成分,分别以不同的浓度相混,然后观察其成相过 程,把此过程以图的形式描绘下来,即称为此种双水相体 系的相图。
• 图中当体系的组成及浓度处于 TCB曲线的上方时,如M点,体系 分为两相。上相(轻相)的组成用 T表示,下相(重相)的组成用B点 表示。直线TMB曲线称为结线 (系线)。当体系的总组成由M变 到M‘,则体系组成为T‘和B’两相。 T‘、B’相间的差别比T、B相间的 差别要小。进一步改变体系的组 成,分相时形成的相间差别进一 步变小,达到C点时,则无成相现 象。C点可称为分相临界点,曲线 TCB称为双结点曲线。体系中的 组成处于TCB下方,体系中由于 不满足成相条件而呈现单相。
• 3、水相中的离子强度 • 微胶团 中水相的 离子强度 对反相微胶团萃取的影响,可 以用前面第二章中的盐溶和 盐析现象来解释 。在低离子 强度下,酶和蛋白质等生物大 分子表面上的荷电性和亲水 性得到了改善,溶解度上升,与 微胶团内表面的结合力增强。 当水相中的离子强度增加到 一定的程度时,由于抵消了生 物大分子表面上的电荷,并且 由于离子的水化作用而使蛋 白质分子表面上的水膜消失, 减少了与微胶团内表面的结 合作用,从而降低了溶解度。 使分离效率降低 •
• 关于蛋白质及酶等生物大分子是以何种形式被反相胶 团萃取的机理,有三种不同的见解。 – 一种认为是在反相胶团中,由表面活性剂的极性部分 围成一个中心,中心为水等极性溶剂占有,生物大分 子就溶解于其中,并且在生物大分子周围包膜着一层 水壳,对生物大分子起保护作用。此种见解即是所 谓的水壳模型。见4-2(a,b); – 第二种见解认为是生物大分子虽然溶解于由表面活 性剂极性部分围成的中心部分,但在中心部分生物大 分子是以被吸附的状态附着于胶团的极性壁上。见 图4-2(c); – 第三种见解则认为生物大分子的非极性部分与多个 微胶团的非极性部分连接,由此形成生物大分子溶解 于多个微胶团之间的一种状态。见图4-2(d)。上述 几种见解中,以所谓的“水壳模型”解释具有较多 的说服力。
反胶团萃取的原理

反胶团萃取的原理
胶团是一种由胶原蛋白和其他蛋白质组成的三维网络结构,广泛存在于动物组
织中,如皮肤、骨骼、软骨等。
在医学和生物工程领域,胶团的提取和分离是一项重要的技术,而反胶团萃取则是其中的一种关键方法。
反胶团萃取的原理基于胶团的特性,利用化学或物理手段将胶团从生物组织中
提取出来。
其过程主要包括预处理、溶解、分离和纯化等步骤。
首先,预处理阶段是为了改变胶团所处的环境,使得其易于被溶解和分离。
这
一步通常包括清洗、去除杂质和改变PH值等操作,以提高后续步骤的效率。
接下来是溶解步骤,通过加入适当的溶剂或改变温度、压力等条件,使得胶团
分子间的相互作用减弱,从而使胶团逐渐溶解于溶液中。
这一步需要根据胶团的特性和所处的生物组织来选择合适的溶解条件,以避免对胶团结构和性质的破坏。
随后是分离步骤,将溶解的胶团与其他生物组织成分分离开来。
这一步通常采
用离心、过滤、沉淀等方法,将胶团从溶液中分离出来,并去除残余的杂质和溶剂。
最后是纯化步骤,通过进一步的化学或物理处理,去除残余的杂质和溶剂,使
得提取的胶团达到所需的纯度和活性。
这一步通常包括柱层析、凝胶过滤、超滤等技术,以获得高纯度的胶团制品。
总的来说,反胶团萃取的原理是通过一系列的预处理、溶解、分离和纯化步骤,将胶团从生物组织中提取出来,并获得所需的纯度和活性。
这项技术在医学、生物工程和食品工业等领域具有重要的应用前景,为胶团的利用和开发提供了重要的技术支持。
反胶团萃取的原理

反胶团萃取的原理
反胶团萃取是一种从溶液中去除胶体颗粒的方法。
它利用与胶体颗粒相反的电荷特性,通过添加电荷相反的染料或胶体颗粒,使胶体颗粒与添加剂发生吸附作用,形成重叠反胶团结构。
这些重叠的反胶团结构会相互吸引,从而形成更大的聚集体,使胶体颗粒变得更易沉淀。
该方法的原理是通过添加电荷相反的剂量,改变胶体颗粒表面的电荷性质。
胶体颗粒通常具有带负电或带正电的表面电荷分布,造成它们在溶液中的稳定分散。
当添加具有相反电荷的反胶团剂,如阳离子染料或阳离子胶体颗粒时,这些反胶团剂会吸附到胶体颗粒表面,改变胶体颗粒电荷的分布。
反胶团剂与胶体颗粒的吸附作用导致胶体颗粒之间的吸引力增强,形成更大的组块。
这些组块比起单个胶体颗粒更重,因此在重力或离心力的作用下更容易沉淀。
此外,重叠的反胶团结构还可以通过减少胶体颗粒与溶剂之间的接触面积,进一步促进沉淀。
反胶团萃取方法简单易行,并且可以有效地去除溶液中的胶体颗粒。
通过调整反胶团剂的剂量和溶液的pH值等条件,可以
控制胶体颗粒的去除效果。
然而,需要注意的是,该方法可能对一些溶液中的其他成分产生影响,因此在具体操作中需要仔细考虑和控制实验条件。
05反向微胶团萃取及双水相萃取

(3)认为生物大分子的非极性部分与多个微 胶团的非极性部分连接,由此形成生物大 分子溶解于多个微胶团之间的一种状态。
三、影响反相微胶团形成的因素
• 反相微胶团的形成、大小及形状,与表面活性剂 的种类、浓度以及操作时的温度、压力等有关。 反相微胶团一般比水相微胶团要小,其分子聚集 数一般都小于50。而水相微胶团的分子聚集数在 50~100之间。反相微胶团中的水分含量通常用 非极性溶剂中的水浓度和表面活性剂之比ω 0来表 示: • ω 0=[H2O]/[表面活性剂] ω 0值越大,反相微胶团内的水分含量就越多,形成 的反相微胶团的半径就越大。能溶解水溶性成分 的量就越多。因此, ω 0值大小可以反应出反相 微胶团的大小和溶解能力。
二、影响组分在双水相系统中分配的主要因 子 1.聚合物的相对分子质量 聚合物的相对分子质量增加,生物大分子 或颗粒在该聚合物在该相中的分配系数会 下降。 2.成相溶液的浓度 当成相溶液浓度接近临界点时,可溶性组 分会均匀的分配在两相中,当远离临界点 时则趋向一侧分配。
3、无机盐 对于带负电荷的蛋白质,其分配系数因阳离子 的存在按下列顺续降低 Li+<NH4+<Na+<Cs+<K+ 一价阴离子则按下列顺序降低: F-<Cl-<Br-<I所以为了增加带负电的蛋白质的分配系数应使 用Li+、HPO42-、SO42-和-2价柠檬酸根离 子等,降低分配系数则用KCI、和NaCl。
2、水相酸碱度 微胶团内水分的酸碱度主要影响到生物大分 子的荷电性,进而影响到生物大分子和反 相微胶团的结合。 AOT属于阴离子型表面活性剂,其亲水部 分带负电荷,形成的反相微胶团内表面带 负电。当反相微胶团内水相的pH值小于生 物大分子的等电点pI时,可使生物大分子 带正电,这样生物大分子可与反相微胶团 中带负电性的内表面相吸,形成比较稳定 的含生物大分子的反相微胶团,可以较容 易的进行萃取。
胶体萃取

• 有机溶剂通常采用异辛烷。
• 表面活性剂AOT能迅速溶于有机溶剂,也能 溶于水而形成液晶态(非球状)胶团。 • AOT作为反向微胶团的表面活性剂的优点: 所形成的胶团的含水率高(0为50-60), 比季铵盐高一个数量级以上; AOT形成反向微胶团时,不需要助表面
活性剂。
(2) 水相pH值
• 蛋白质为两性分子,各种蛋白质有确定的等电 点(pI),当pH<pI时,蛋白质荷正电,AOT为阴 离子表面活性剂,所形成的反向胶团内表面荷 负电,蛋白质分子与胶团内表面作用强,能形 成稳定的含蛋白质的微胶团。 • 当pH>pI时,蛋白质分子和表面活性剂内表面 都荷负电,相互排斥,蛋白质难溶于胶团中。 • pH过低时,蛋白质会变质,溶解度也降低。
• pH=9,[KCl]=0.1M时,核糖核酸酶不溶于胶团,而留在
水相。
• 进入有机相胶团中的细胞色素C和溶菌酶用 pH=9,[KCl]=0.5M的水溶液反萃取,只有细胞色素C进
入水相。
• 仍留在有机相中的溶菌酶再用pH=11.5,[KCl]=2.0M的 水相反萃取。
• 陆九芳p128-323
双水相萃取
生物物质在双水相体系中的分配
• 生物样品的复杂性 分配机理的复杂性 包括可溶性物质(蛋白质、核酸)、悬 浮颗粒(细胞或细胞器); 各种物质的大小、形状和性质不同;
存在形式不同(离解状态、聚集状态)
• 分配机理的解释 界面张力作用 电位差作用(Donnan效应)
• 界面张力作用
微小粒子在液体中由于热运动而随机分布,界 面张力的影响使它呈不均匀分布,并聚集在双 水相体系中具有较低能量的一相中。 • 电位差作用 带电大分子(粒子)在两相中分配时,会在两 相产生电位—Donnan效应。Donnan效应使得某
胶团与反胶团萃取

反胶团萃取 (reverse micellar extraction)
极性的“核”
反 向 胶 团 非极性有机溶剂
反胶团内 溶解的水 称为微水 相或水池
反胶团萃取技术的产生
传统的分离方法,如液-液萃取技术很 难应用于对生化产品(如蛋白质、氨基酸 、抗生素等)的提取与分离,原因在于这 类物质多数不溶于非极性有机溶剂,或与 有机溶剂接触后会引起变性和失活;而盐 析、沉淀、层析、电泳等生化分离方法又 不能实现连续和放大操作。 因此,针对这两大难题,在20世纪70 年代中期反胶团萃取技术就发展起来了。
不同蛋白质具有 不同的等电点, 可调节pH,分离 不同蛋白质,但 要注意避免蛋白 质的变性。
(2)水相离子强度的影响
a:离子强度影响到反胶团内壁的静电屏蔽程度,增 大离子强度可降低蛋白质分子和反胶团内壁的静电作 用力。 b:增大离子强度可减小表面活性剂极性头之间的相 互斥力,使反胶团变小。
蛋白质性质不同, 其在反胶团相中溶 解度达到最低时所 对应最小离子强度 也不相同,利用这 种差别,即可实现 不同蛋白质间分离 和浓缩。
胶团萃取与反胶团萃取
Review
胶团概念
当向水溶液中加入表面活性剂达到一定浓度
(CMC)时,会形成表面活性剂聚集体。
胶团萃取(micellar extraction)
水
正 向 胶 团 非极性“尾”
极性“头”
非极性的“核”
胶团萃取是被萃取物以胶团或者胶体形式从水相 被萃取到有机相的溶剂萃取方法。 胶团萃取多用于无机物萃取,但也用于有机物 萃取。 被萃取物主要限于金、银、硫酸钡等,溶剂主 要限于氯仿、四氯化碳和乙醚等。
反胶团萃取使用最多的是阴离子型AOT
极性基团 较小,所 形成的反 胶团空间 较大,利 于生物大 分子进入
反向微胶团萃取与双水相萃取

3、无机盐
对于带负电荷的蛋白质,其分配系数因阳离子 的存在按下列顺续降低 Li+<NH4+<Na+<Cs+<K+
一价阴离子则按下列顺序降低:
F-<Cl-<Br-<I-
所以为了增加带负电的蛋白质的分配系数应使 用Li+、HPO42-、SO42-和-2价柠檬酸根离子 等,降低分配系数则用KCI、和NaCl。
一、概述
双水相萃取技术是60年代以来研究开发的新型分离技术, 已广泛应用于生物化学、细胞生物学和生物工程等领域, 实现了生物产品的分离和纯化。90年代以来,采用双水 相萃取技术提取分离生物小分子的研究已有报道。 1、概念 双水相系统是指某些高聚物之间或高聚物与无机盐之间 在水中以适当的浓度溶解,形成的互不相溶的两水相或多 水相系统。
性剂形成微胶团的临界浓度(CMC)。
不同表面活性剂的CMC值在0.1~1mmol/L之间,随温
度、压力、溶剂的变化而变化。
最常用:表面活性剂----丁二酸二异辛酯磺酸钠
(Aerosol OT,简称AOT),
溶剂----异辛烷(2,2,4-三甲基戊烷)。AOT 能溶解在有机溶剂中,也能溶解在水中,形成反相 微胶团。AOT在形成反相微胶团时的ω0值较大,可达 60。
通过溶质在相间的分配系数的差异,进行组分分离或多水
相提取的技术即为双水相萃取。
混合物的不溶性最初是由贝杰林克 (Beijerinck)通过把(明胶+琼脂)溶液 与(明胶+可溶性淀粉)溶液相混合时发现 的。之后发现这是一种普遍现象,把多种不 相溶的聚合物溶液混合在一起,可以得到多 相体系,最多的有时达18个相。
反胶团萃取的原理及应用

反胶团萃取的原理及应用1. 背景介绍反胶团萃取是一种从混合物中分离和纯化胶团的方法。
胶团是由胶束组成的自组装体,其直径通常在1到100微米之间。
胶团在各种领域中具有广泛的应用,如医药、食品、化工等。
反胶团萃取是一种快速高效的方法,因此受到了广泛的关注。
2. 原理反胶团萃取的原理是通过添加适当的反胶团剂来破坏胶团的结构,从而使胶团分解为胶束和溶液中的其他成分。
反胶团剂的选择非常重要,它必须能够与胶团内的成分相互作用,从而引起胶团的破坏。
常用的反胶团剂包括表面活性剂、有机溶剂等。
3. 反胶团萃取的步骤反胶团萃取一般包括以下几个步骤:3.1 添加反胶团剂将适量的反胶团剂加入混合物中。
反胶团剂的添加量应根据胶团的性质和目标分离物的特性进行优化。
3.2 搅拌混合通过搅拌或者其他形式的混合作用,使反胶团剂与混合物中的胶团充分接触和作用。
3.3 胶团破坏反胶团剂的作用下,胶团结构被破坏,形成胶束和溶液中的其他成分。
3.4 分离采用物理或化学方法,将胶束与溶液中的其他成分进行分离,如离心、过滤、萃取等。
3.5 再生可对胶体溶胶体系进行再生,以减少废弃物的产生和资源的浪费。
4. 应用反胶团萃取在许多领域中具有广泛的应用,如下所示:4.1 食品工业反胶团萃取可用于分离和纯化食品中胶团的成分,如乳蛋白、植物蛋白等。
这对于食品加工中的产品改进和质量控制非常重要。
4.2 医药领域反胶团萃取可用于药物的纯化和制备。
通过反胶团萃取,可以从复杂的混合物中分离出目标药物,提高纯度和药效。
4.3 化工工业反胶团萃取可用于分离和纯化化工原料和中间体。
通过优化反胶团剂的选择和添加量,可以高效、快速地分离出目标物质。
4.4 环境保护反胶团萃取可用于处理废水中的胶团和悬浮物。
通过破坏胶团结构,可以将其中的污染物和悬浮物与水体分离,达到环境保护的目的。
5. 总结反胶团萃取是一种高效、快速的分离和纯化方法。
通过添加适当的反胶团剂,胶团的结构可以被破坏,从而实现目标物质的分离。
胶团和反胶团萃取

在AOT反胶团中,水合化一分子AOT需要6~8个水分
子,而其它水分子则不受束缚,可与普通水一样自由流动 。
故当W > 16时,“水池”中的水逐渐接近主体水相粘 度,胶团内也形成二重电荷层。
见下图。
假定反胶团为球形(除了W或表面活性剂浓度很 大外),反胶团平均直径dm的增加和W的增加基本成 正比,W=0~50之间,dm=2~30nm。
2、混合表面活性剂反胶团体系: 是指两种或两种以上表面活性剂构成的体系,一般来 说,混合表面活性剂反胶团对蛋白质有更高的分离效率。 3、亲和反胶团体系: 是指除了有组成反胶团的表面活性剂以外,还有具有 亲和特征的助剂,它的亲和配基与蛋白质有特异的结合能 力,往往极少量亲和配基的加入就可使萃取蛋白质的选择 性大大提高。
三.影响反胶团萃取因素
(1)水相pH值的影响 表面活性剂的极性头是朝向反胶团的内部,使反胶团的内壁带有一 定的电荷,而蛋白质是一种两性电解质,水相的pH 值决定了蛋白质分 子表面可电离基团的离子化程度,当蛋白质所带电荷与反胶团内所带 电荷的性质相反时,由于静电引力,可使蛋白质转移到反胶溶入反胶团的蛋
向)胶团。
水
极性头
正胶团是在极性溶液中形成的,
其亲水性的极性端向外指向极 性(如水)溶液,疏水性的非 极性“尾”向内相互聚集在一
非极性的核 非极性尾
起。
反胶团是两性表面活性 剂在非极性有机溶剂中 亲水性基团自发的向内 聚集而成,内含微小水 滴,其疏水性的非极性 尾部向外,指向非极性 溶剂,而极性头向内, 与在水相中形成的微胶 团方向相反。
机相。
◘ 被萃取物主要限于金、银、硫酸钡等, 溶剂主要限于氯仿、四氯化碳和乙醚等。
胶团—— 胶团是双亲(即亲水又亲油)物
反向微胶团萃取

反向微胶团萃取
反向微胶团萃取(Reverse Micelle Extraction)是一种分离和提取化合物的方法,常用于溶液中的水溶性或极性物质的富集。
反向微胶团是由表面活性剂分子组成的胶束结构,外部是疏水性的,内部则是亲水性的。
在反向微胶团萃取过程中,通常使用疏水性有机溶剂(如正庚烷、环已烷等)作为反向微胶团载体,并通过添加表面活性剂(如十二烷基苯磺酸钠等)来形成反向微胶团。
反向微胶团萃取具体步骤如下:
1. 载体制备:将疏水性有机溶剂与表面活性剂混合,在适当的条件下形成反向微胶团载体。
2. 萃取液制备:将待提取的溶液与反向微胶团载体混合,使目标物质被封闭在反向微胶团中。
3. 目标分离:利用相分离的原理,通过调整溶剂的极性和pH值等条件,使反向微胶团中的目标物质分离出来,通常是转移到水相中。
4. 提取物回收:对分离出的目标物质进行后续的处理和回收,可以
使用浓缩、溶剂挥发、萃取、析出等方法。
反向微胶团萃取方法具有操作简单、提取效果好、选择性强等优点,在分析、制药、化工等领域中得到广泛应用。
然而,由于反向微胶团萃取过程的复杂性和实际应用的差异,具体的操作条件和提取效果可能会有所不同,因此在实际应用中需要根据具体情况进行优化和调整。
反胶团萃取应用原理的综述

反胶团萃取应用原理的综述1. 引言反胶团萃取(反胶团法)是一种常用的化学分离技术,广泛用于分离和纯化化合物。
本文将综述反胶团萃取的应用原理及其在不同领域的应用。
2. 反胶团萃取原理反胶团萃取是一种基于化学反应的分离技术,其原理基于胶团形成和胶团破碎的动力学平衡。
反胶团萃取过程包括胶团的形成、添加反胶团剂、胶团的破碎、分离和纯化。
其原理可概括如下:•胶团的形成:在合适的条件下,溶液中的目标化合物会自组织形成胶团结构。
•添加反胶团剂:在胶团形成后,添加一种具有亲和性的反胶团剂,这种剂型具有与胶团中目标化合物相互作用的性质。
•胶团的破碎:反胶团剂与胶团中目标化合物发生作用,导致胶团结构的破碎。
•分离和纯化:破碎的胶团中的目标化合物可以通过各种物理和化学分离方法进行分离和纯化。
3. 反胶团萃取的应用3.1 医药领域反胶团萃取在医药领域有广泛的应用。
以下列举几个例子:•药物分离和纯化:反胶团萃取可用于分离和纯化药物,如天然产物、合成药物等。
通过调整反胶团剂的性质,可以选择性地分离目标化合物。
•药物传递系统:反胶团萃取可以用于药物传递系统的制备,通过胶团的形成和破碎,将药物包裹在胶团中,达到缓释和靶向传递的效果。
•体内药物释放控制:通过在胶团中嵌入药物,反胶团萃取可以实现对体内药物释放的精确控制,提高药物的生物利用度。
3.2 环境监测领域反胶团萃取在环境监测领域也有广泛的应用。
•水质监测:反胶团萃取可以用于水中有机污染物的提取和富集,通过胶团的形成和破碎,可以获得更高的提取效率。
•大气污染物监测:反胶团萃取可以用于大气中挥发性有机物的富集和分离,提高对空气质量的监测和评估的准确性。
3.3 食品领域反胶团萃取在食品领域也有重要的应用。
•食品安全监测:反胶团萃取可以用于食品中农药、重金属等有害物质的提取和分离,提高对食品安全的监测和评估的准确性。
•食品加工:反胶团萃取可用于提取和纯化食品中的营养物质、香味物质等,用于食品加工和调味。
第五章反胶团萃取与双水相萃取

反胶团溶液形成的条件和特性
5. 反胶团的含水率、大小
Wo
C水 C表面活性剂
R 3WoVW As
一般为10-100 nm
反胶团萃取蛋白质的基本原理
反胶团的溶解作用
由于反胶团内存在微水池,故可溶解氨基酸、肽和蛋白 质等生物分子,为生物分子提供易于生存的亲水微环境。 因此反胶团萃取特别蛋适合白质类生物大分子。
反胶团溶液形成的条件和特性
3. 胶团、反胶团的形成
将表面活性剂溶于水中,当其浓度超过临界胶束浓 度(CMC)时,表面活性剂就会在水溶液中聚集在一起 而形成聚集体,在通常情况下,这种聚集体是水溶 液中的胶束,称为胶团。
若将表面活性剂溶于 非极性的有机溶剂中, 并使其浓度超过临界胶 束浓度(CMC),便会在 有机溶剂内形成聚集体, 这种聚集体称为反胶团。
3、混合澄清槽
混合-澄清式萃取器是一种最常用的液 -液萃取设备,该设备由料液与萃取剂的混 合器和用于两相分离的澄清器组成,可进 行间歇或连续的液-液萃取。
但该设备最大的缺点是反胶团相与水 相相混合时,混合液易出现乳化现象,从 而增加了相分离时间。
反胶团萃取的应用
➢ 蛋白质分离
反胶团萃取的应用
➢ 浓缩α-淀粉酶
将亲和配基(活性色素辛巴蓝)加入 到大豆卵磷酯-正已烷系统中,制成亲和反 胶团相,并将此胶团相固定于聚丙烯中空 纤维膜内,从而构建起亲和反胶团萃取膜 的分配色谱装置(AMPC)。
2、离心萃取器
反胶团溶液-水-蛋白质所组成的萃取体 系,由于表面活性剂的存在,界面张力低, 易乳化。另外,由于萃取的目标产物是蛋 白质,易变性失活。为了尽量避免蛋白质 的变性,应尽量缩短操作时间,因而反胶 团离心萃取是一项很合适的蛋白质萃取分 离技术。
溶剂萃取和胶团萃取的最新进展

溶剂萃取和胶团萃取的最新研究进展溶剂萃取,是溶液从料液转移到溶剂萃取剂的过程称为溶剂萃取。
近些年来溶剂萃取在各方面都取得了广泛的应用,例如加速溶剂萃取技术在植物源食品农药残留分析中的应用进展中加速溶剂萃取(ASE)已经成为一种常用绿色分离技术,能够在多种植物中萃取出不同种类的残留农药.而在修复石油污染土壤中运用溶剂萃取技术首先对土壤进行预处理,除去土壤中的石块和残骸,其次使溶剂和土壤经过充分混合后可使得污染物溶解到溶剂中,其次通过一定的分离手段使萃取剂与污染物分离,然后循环回收使用,最后处理土壤中的参与溶剂,达到一定标准后将土壤回填从而实现污染物与土壤分离。
溶剂萃取技术具有选择性高、分离效果好和适应性强等特点,易于实现大规模连续化的生产,因此近些年来在国内外都得到了广泛的应用。
例如在钴和镍的溶剂萃取的研究进展中,《Research progress of synergistic solvent extraction of cobalt and nickel》中就介绍了不同萃取系统的分别。
和协同的特征提取进行了分析通过比较相同的协同萃取体系。
最后,有关协同萃取系统的一些问题,提出了应进一步研究。
《Solvent extraction as a means of preparing homogeneous lignin fractions》中发现溶剂萃取分离木质素根据分子量:小分子量木质素溶解在有机溶剂和木质素分子量较高的浓缩成渣。
木质素的分离丙酮分数与窄分子量分布更均匀。
基于31 p NMR 的结果,总羟基含量和酚羟基的含量单位是丙酮的分数高于残渣。
Pyrolysis-GC / MS的lignins表明对羟基苯酚残留丰富。
优惠解散syringyl类型木质素在丙酮观察硬木卡夫木质素,而相反的行为被认为硬木organosolv木质素。
玻璃化转变温度的丙酮可溶分数明显低启动和残留lignins相比,这使可能性为未来的应用程序作为一个材料与特定的属性。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
B、高聚合物的浓度
❖ 聚合物分相的最低浓度为临界点,系线的长度为零, 此时分配系数为1,即组分均匀的分配于上下相.
❖ 随着成相聚合物的总浓度或聚合物/盐混合物的总浓 度增大,系统远离临界点,系线长度增加,两相性 质的差别(疏水性等)增大,蛋白质分子的分配系数 将偏离临界点处的值(m=1),即大于1或小于1。因 此,成相物质的总浓度越高,系线越长,蛋白质越容 易分配于其中的某一相。
双水相系统(aqueous two-phase system, ATPS)
PEG = 聚已二醇(polyethylene glycol) Kpi = 磷酸钾 DX = 葡聚糖(dextran)
2、双水相萃取的原理
• 是生物物质在双水相体系中的选择性分配,当物 质进入双水相体系后,由于表面性质、电荷作用 和各种作用力(如憎水键、氢键和离子键等)的 存在和环境的影响,使其在上、下相中的浓度不 同,即分配系数不同。
❖ 反之.如pH大于PI,蛋白质在微胶团的溶解 度将很低或不溶。
❖ 但如pH过低。蛋白质会变性,溶解度也下降。
AOT体系中,三种低分子量的在较低PH时,几乎能完 全溶解于反胶团相。不过,PH过低时,蛋白质变性, 溶解度随之降低。显然,对于多中蛋白质自混合物的 分离,只要它们的PH有差异,就可以通过控制溶液的 PH是他们达到分离。
表面活性剂在溶液中开始形成胶团时的浓度称为临 界胶束浓度,简称CMC。当溶液中表面活性剂浓度 低于CMC时,它主要以单体形式,即分子或离子形 式存在。 表面活性剂形成胶团后,溶液的许多物理化学质, 如表面张力、摩尔电导率、渗透压、密度、增溶性 能等,在一个很窄的浓度范围内呈现不连续变化。
水
胶团分为正(向)胶 团和反(向)胶团。
四、 反胶团萃取的应用
❖ 分离蛋白质混合物; ❖ 浓缩α-淀粉酶; ❖ 从发酵液中提取胞外酶 ; ❖ 直接提取胞内酶; ❖ 用于蛋白质复性。
反胶团萃取在生物样品分离中的应用
表示核糖核酸酶、溶菌酶和细胞色素C 蛋白质混合溶液约分离过程。在pH =9时.核糖核酸酶不溶.而其他两种酶可溶,故在pH=9,[KCl]= 0.1mol/L时.核糖核酸酶只留在水相中.而溶菌酶和细胞色素C则完全溶 于反相微胶团中。再将含有溶菌酶和细胞色素C有机相与0.5mol/LKCl的水 相接触.细胞色素C转入水相。最后将含有溶茵酶的有机相与含有 2.0mol/LKCl.pH=11.5的水溶液混合,就可将溶菌酶转入到水相中,这样 就达到了三种蛋白质分离约目的。
第三节 双水相萃取
❖ 双水相体系的形成与分配机理 ❖ 双水相的相图 ❖ 双水相萃取体系的影响因素 ❖ 双水相萃取的应用
3.1双水相体系的形成与分配机理
双水相萃取?
利用物质在互不相溶的两水相间分配系数的 差异来进行萃取的方法。
双水相的形成
将两种不同的水溶性聚合物的水溶液混合时,当聚合 物浓度达到一定值,体系会自然的分成互不相溶的两相, 这就是双水相体系。这种含有不同聚合物分子的溶液发生 分相的现象叫聚合物的不相容性。
(2) 盐类
盐的种类和浓度对分配系数的影响主要反 映在对相间电位和蛋白质疏水性的影响。
①盐的种类
❖ 在双聚合物系统中,无机离子具有各自的分配系 数,不同电解质的正负离子的分配系数不同,从 而产生不同的相间电位。由于各相要保持电中性, 使得带电生物大分子,如蛋白质和核酸等分别向 两相移动分配。
②盐的浓度
萃取过程
第五章 萃取分离法
第五章 萃取分离法
影响超临界流体萃取的因素 压力:压力大,密度大,溶解力强; 温度:复杂,先升高后降低。 超临界流体的性质和被萃取物的极
性:CO2极性小,对于极性大的物质的萃 取,必须加入添加剂,称为提携剂或改 性剂。 流量:扩散慢的溶质流量不宜大。
第五章 萃取分离法
❖ 盐的浓度不仅影响蛋白质的表面疏水性, 而且扰乱双水相系统,改变各相中成相物 质的组成和相体积比。
❖ 例如,PEG/磷酸盐体系中上下相的PEG和磷酸盐 浓度及Cl-在上下相中的分配平衡随添加NaCl浓 度的增大而改变,这种相组成即相性质的改变直 接影响蛋白质的分配系数。
❖ 离子强度对不同蛋白质的影响程度不同,利用这 一特点,通过调节双水相系统的盐浓度,可有效 地萃取分离不同的蛋白质。
❖ 目前研究中常用的AOT反胶束体系和其他体系有许 多不足:如不能用于分子量较大的蛋白质的萃取和 往往在两相界面上形成不溶性的膜状物等等。为克 服这些不足,可通过在单一表面活性剂中加入具有 亲和作用的生物表面活性剂或另一种非离子型表面 活性剂的方法来改善萃取性能。
2、水相pH值对萃取的影响
❖ 蛋白质是一种两性物质,具有确定的等电点 (pI).
3、离子强度
❖ 水相盐浓度(离子强度)决定了带电荷的反胶 团的内表面以及带电荷的蛋白质分子表面被静 电屏蔽的程度。离子强度增加时,增大了离子 向反胶束内“水池”的迁移并取代其中蛋白质 的倾向,使蛋白质从反胶束内被盐析出来.因此, 低的离子强度有利于蛋白质的萃取,高的离子 强度有利于蛋白质的反萃取。
形成原因:由于高聚物之间的不相溶性,即高聚物分子 的空间阻碍作用,相互无法渗透,不能形成均一相,从而 具有分离倾向,在一定条件下即可分为二相。
常用的双水相体系
高聚物/高聚物体系:聚乙二醇(简称PEG) / 葡聚糖(简称Dextran) 高聚物/无机盐体系: 硫酸盐体系。常见的高聚物/ 无机盐体系: PEG/ 硫酸盐或磷酸盐体系。
持活性。
二、反胶团萃取原理
由于周围水层和极性基团的保护,保持了蛋白 质的天然构型,不会造成失活。
(a)水壳模型;(b)插入模型
反
(c)吸附模型;(d)溶解模型
胶
团
的
溶
解
模
型
❖ 蛋白质进入反胶团溶液是一协同过程。在有 机溶剂相和水相两宏观相界面间的表面活性 剂层 ,同邻近的蛋白质分子发生静电吸引而变 形 ,接着两界面形成含有蛋白质的反胶团 ,然 后扩散到有机相中 ,从而实现了蛋白质的萃取。 (可能机理)
原料颗粒的粒度:原料的颗粒度小,利于 萃取,但太小会出现堵塞或结块造成沟 流等不利现象;
萃取时间:增加萃取强度,可以缩短时间。 可能的机理是组分之间的“溶解互助” 效应,即先萃取出来的物质起到改性剂 的作用,增加了溶解能力。
第五章 萃取分离法
超临界流体萃取的应用
中药有效成分的提取。植物原料,生物碱、黄酮、 有机酸、皂苷、萜类、挥发油、糖类、油脂、氨 基酸、色素、鞣质、蛋白质、酶等,传统方法复 杂,流程长,SPE简单快速效率高。
【表面活性剂】在水或有机溶剂中自发形
成的聚集体。
胶团的形成——当向水溶液中加入表面活
性剂达到一定浓度时就会形成表面活性剂 聚集体,即胶团。
❖ 表面活性剂——是由亲水憎油的极性基团 和亲油憎水的非极性基团两部分组成的两 性分子。
❖ 表面活性剂的分类:
阴离子表面活性剂;阳离子表面活性剂; 非离子型表面活性剂。
(3)在贵金属分离中的应用
例如采用PEG2000-硫酸铵-偶氮胂双水相体系可以 分离Ti和Zr。
第五章 萃取分离法
5.4 超临界流体萃取
压力增大,P(Mpa)
supercritical fluid
纯
liquid
流动相密
物
度增加,
solid
质
溶剂力增
gas
大
的
相
T(oC)
图
临界点附近温度和压力的微小变化会引起密 度的显著变化,即溶解能力的显著变化。
正胶团是在极性溶液中形成的,
其亲水性的极性端向外指向极
性(如水)溶液,疏水性的非
极性“尾”向内相互聚集在一
起。
非极性的
“核”
极性“头” 非极性“尾”
非极性有 机溶剂
反胶团 是两性表面活性剂
在非极性有机溶剂中亲Βιβλιοθήκη 性基团自发地向内聚集而成的,
内含微小水滴。其疏水性的
非极性尾部向外,指向非极
性溶剂,而极性头向内,与
(5)低分子量化合物 (6)双水相体系的性质
黏度、两相密度差、表面张力、相间电势差、相分离 时间。
双水相萃取的应用
(1)在生物工程领域的应用
主要应用于生物物质,如酶、核酸、生长激素、 病毒等的分离纯化。常用的是PEG-葡聚糖双水相 体系。
(2)在中草药有效成分分离中的应用
例如采用PEG6000-K2HPO4双水相体系分离中草药 中的黄岑苷和黄岑素。
胶团萃取
一、基本概念
胶团萃取——是被萃取物以胶团或者胶体形式从
水相被萃取到有机相的溶剂萃取方法。它既可用于 无机物的萃取,也可用于有机物的萃取。 ❖ 在无机物的方面:金属或其无机盐可以形成疏水胶 体粒子粒子进入有机相。 ❖ 被萃取物主要限于金、银、硫酸钡等, 溶剂主要限于氯仿、四氯化碳和乙醚等。
胶团——是双亲(即亲水又亲油)物质
双节线:把均相区和两相区域分隔开。 系线:连接双节线上两点的直线。
两相区
均相区
在同一条系线上的各点分成的两相具有相同的组成, 但体积比不同
临界点:当系线长度趋向于零时,即在图中的C点, 两相差别消失,任何溶质在两相中的分配系数均为 1,成为单相体系。
ATPS相图
双节线(bi-nodal):
图中的曲线。双节线以下的区域为均相区, 以上的区域为两相区,即ATPS 。
双水相萃取体系的影响因素
(1)高聚合物的分子量和浓度
A、高聚合物分子量
对于PEG/Dextran所形成的双水 相体系中,若降低PEG相对分子质量, 则生物分子分配于富含PEG的上相中, 使分配系数增大;而降低Dextran相 对分子质量,则分配系数减小。
若想在上相获得较高的蛋白质收 率,对于PEG聚合物,应降低它的平 均分子量,相反,若想在下相获得较 高的蛋白质收率,则平均分子量应增 加。
