诺和力注射液说明书
诺和力

被二肽基肽酶(DPP-4)降解 T½=1.5 –2.1 分钟
97% 氨基酸序列与人 GLP-1 同源
通过酰基化与白蛋白结合;自联作用 • 从皮下组织缓慢吸收 • 不易被DPP-4降解,不从肾脏滤过 • 血浆半衰期长达13 小时,降糖作用>24小时
Knudsen et al. J Med Chem 2000;43:1664–9; Degn et al. Diabetes 2004;53:1187–94
*p≤0.05, ***p<0.0001 利拉鲁肽 vs. 安慰剂
Marre et al. Diabetic Medicine 2009;26:268–78 (LEAD-1); Nauck et al. Diabetes Care 2009;32:84–90 (LEAD-2)
尽早使用利拉鲁肽可显著降低体重高达2.8kg
单剂量利拉鲁肽可恢复β细胞的葡萄糖敏感性
14 12
(pmol/min/kg) 胰岛素分泌率
健康对照 (n=10) 利拉鲁肽7.5 μg/kg 安慰剂
• 试验前 9 小时,对 2 型
糖尿病患者注射利拉
鲁肽或安慰剂(交叉) • 检测胰岛素分泌情况 • 利拉鲁肽可使 β细胞对 葡萄糖浓度升高的反 应性恢复至健康对照 水平
2.5
LEAD-2 (联合MET)
LEAD-1 (联合SU)
+2.1
2.0
1.5 1.0+1.0体重变化 (kg)0.5 0.0 -0.5 -1.0
-1.5
+0.3 -0.2 -0.1
-1.5
-2.0 -2.5 -3.0 -3.5
−2.6 −2.8
-4.0
利拉鲁肽1.2 mg 利拉鲁肽1.8 mg 罗格列酮4mg 格列美脲4mg 安慰剂
诺适得说明书

核准日期:2011年12月31日修改日期:2014年02月18日2014年10月31日2016年01月12日2017年01月16日2018年04月28日2018年11月08日2018年11月21日2020年04月07日2020年06月24日2021年XX月XX日雷珠单抗注射液说明书请仔细阅读说明书并在医师指导下使用。
【药品名称】通用名称:雷珠单抗注射液商品名称:诺适得®/Lucentis®英文名称:Ranibizumab Injections汉语拼音:Leizhu Dankang Zhusheye【成份】活性成份:雷珠单抗化学名称:G1,抗-(人血管内皮生长因子)Fab片断(人-鼠单克隆rhuFabV2γ1-链),二硫键结合人-鼠单克隆rhuFabV2κ-链分子量:48KD处方组成:1mL含10mg雷珠单抗。
本品所含辅料为:α,α-海藻糖二水合物;组氨酸;盐酸组氨酸一水合物;聚山梨醇酯20。
【性状】透明至微乳白色液体。
【适应症】雷珠单抗注射液适用于成人:∙用于治疗湿性(新生血管性)年龄相关性黄斑变性(AMD)。
∙用于治疗糖尿病性黄斑水肿(DME)引起的视力损害。
∙用于治疗糖尿病视网膜病变(DR)[增殖性糖尿病视网膜病变(PDR)和中重度至重度非增殖性糖尿病视网膜病变(NPDR)]。
∙用于治疗继发于视网膜静脉阻塞(RVO)(视网膜分支静脉阻塞(BRVO)或视网膜中央静脉阻塞(CRVO))的黄斑水肿引起的视力损害。
∙用于治疗脉络膜新生血管(CNV,即继发于病理性近视(PM)和其它原因的CNV)导致的视力损害。
雷珠单抗注射液适用于早产儿:∙用于治疗I区(1+、2+、3或3+期)、II区(3+期)早产儿视网膜病变(ROP)和AP-ROP(急进性后极部ROP)。
【规格】10mg/mL,每瓶装量0.20mL。
【用法用量】本品应在有资质的医院和眼科医生中使用。
医院应具备疾病诊断和治疗所需的相关仪器设备和条件,眼科医生应具备确诊湿性年龄相关性黄斑变性,糖尿病性黄斑水肿,糖尿病视网膜病变(DR)[增殖性糖尿病视网膜病变(PDR)和中重度至重度非增殖性糖尿病视网膜病变(NPDR)],继发于视网膜静脉阻塞(RVO)的黄斑水肿,脉络膜新生血管疾病以及早产儿视网膜病变的能力和丰富的玻璃体内注射经验。
利拉鲁肽注射液生物类似药临床试验设计指导原则

2020年5月目录一、概述 (1)二、利拉鲁肽生物类似药临床研发要求 (2)三、利拉鲁肽生物类似药临床试验设计要点 (2)(一)健康受试者药代动力学比对试验 (2)(二)临床有效性比对试验 (3)(三)其他需要重点关注的问题 (4)1、安全性和免疫原性研究 (4)2、患者药代动力学研究 (5)四、小结 (5)五、参考文献 (5)一、概述利拉鲁肽注射液为丹麦诺和诺德公司开发的一种人胰高血糖素样肽-1(GLP-1)类似物产品,采用酿酒酵母表达系统制备前体即第34位精氨酸替代赖氨酸的GLP-1(7-37)多肽链,再通过谷氨酸在第26位赖氨酸ε氨基经酰化连接含16个碳的脂肪酸侧链。
2009年开始先后获得欧、美批准上市[1-2],用于治疗2型糖尿病,2011年获准进口注册,目前上市许可持有人为丹麦诺和诺德公司(Novo Nordisk A/S),商品名:Victoza/诺和力[3]。
随着利拉鲁肽原研产品各项专利陆续到期,国内有多家制药企业启动了利拉鲁肽生物类似药的研发。
截至目前全球尚无利拉鲁肽生物类似药获批上市。
原国家食品药品监督管理总局于2015年2月发布了《生物类似药研发与评价技术指导原则(试行)》[4](以下简称“生物类似药指导原则”)。
本指导原则为在生物类似药指导原则基础上,结合药物研究进展、相关的技术指导原则及目前沟通交流经验,形成的对利拉鲁肽生物类似药临床研究策略和临床试验设计的建议,供药物研发的申办者和研究者参考。
本指导原则仅代表药品监管部门当前的观点和认识,不具有强制性的法律约束力。
随着科学研究的进展,本指导原则中的相关内容将不断完善与更新。
应用本指导原则时,还请同时参考药物临床试验质量管理规范(GCP)、国际人用药品注册技术协调会(ICH)和其他国内外已发布的相关指导原则。
二、利拉鲁肽生物类似药临床研发要求原则上,利拉鲁肽生物类似药应以在我国上市的上市许可持有人为丹麦诺和诺德公司的原研药(诺和力)为参照药,开展药代动力学比对试验和临床安全有效性比对试验。
帕拉米韦氯化钠注射液力纬中文说明书

帕拉米韦氯化钠注射液(力纬)中文说明书【通用名称】帕拉米韦氯化钠注射液【商品名称】力纬【英文名称]Peramivir and Sodium Chloride Injection【汉语拼音】Palamiwei Luhuana Zhusheye【成分】本品主要成份为帕拉米韦。
化学名称为:(1,2,35,4刈-3-[(15)-1-乙酰氨基2乙基-丁基]-4-服基-2-羟基-环戊基-1-竣酸三水合物。
化学结构式:HO分子式:C15H28N4O4 ∙ 3H2O分子量:382.45本品所川辅料为:氯化钠、稀盐酸。
【性状】本品为无色的澄明液体。
【适应症】用于甲型或乙型流行性感冒。
用于甲型和乙型流感的治疗(帕拉米韦能够有效治疗甲型和乙型流感,但是乙型流感的临床应用数据尚不多)。
患者应在首次出现症状48小时以内使用。
【规格】IoomI:帕拉米韦(按C15H28N4O4计)0∙3g与氯化钠0.9gIOOmI:帕拉米韦(按C15H28N4O4it)0.15g 与氯化钠0.9g【用法用量】静脉滴注给药。
在出现流感症状的48小时内开始治疗。
成人:一般用量为300mg,单次静脉滴注,滴注时间不少于30分钟。
严重并发症的患者,可用600mg,单次静脉滴注,滴注时间不少于40分钟。
症状严重者,可每日一次,1~5天连续重复给药。
另外可以根据年龄和症状等酌情减量。
儿童:通常情况下可以采用帕拉米韦一日一次,每次IOmg∕kg体重,30分钟以上单次静脉滴注,也可以根据病情,采用连日重复给药,不超过5天。
单次给药量的上限为600mg以内。
用法用量方面的使用注意事项:L出现流感症状之后尽快开始给药。
尚无在出现症状48小时后才开始给药的临床有效性数据。
2 .重复给药,要根据体温等临床症状判断是否需要继续给药,不要盲目地持续给药。
3 .对于肾功能不全患者,由于可能存在血浆中药物浓度持续增高的风险,必须根据肾功能损伤情况调整给药量。
4 .本药品仅限于静脉滴注使用。
使用无针注射器注射百泌达和诺和力,如何确定注射的剂量?

使用无针注射器注射百泌达和诺和力,如何确定注射的剂量?
简介:注射胰岛素控糖是不少糖尿病患者每天都要做的事情,无针注射器的出现,让越来越多使用胰岛素控糖的患者避免了传统注射器注射胰岛素带了的各种问题。
那么初次使用无针注射器注射百泌达和诺和力,如何确定注射的剂量?
工具:无针注射器、百泌达注射液、诺和力注射液
无针注射器目前只适用胰岛素的注射,而百泌达和诺和力这两种注射液并非胰岛素,但是确有一些糖尿病患者使用这两种方案进行控糖。
如果糖尿病患者需要无针注射器注射这两种药剂,需要换算这两种注射液的注射剂量。
步骤一、
百泌达(艾塞那肽注射液)有两种注射方案:每次注射5微克和每次注射10微克。
每次注射5微克(等于2单位药液),不能使用无针注射器进行注射;
每次注射10微克(等于4单位药液),可以使用无针注射其进行注射。
步骤二、
诺和力(利拉鲁肽注射液),目前有三种不同的治疗方案,对应的注射剂量分别为:
一支注射笔注射30次用完,等于每次注射10单位药液;
一支注射笔注射15次用完,等于每次注射20单位药液;
一支注射笔注射10次用完,等于每次注射30单位药液。
注意事项:
1、初次使用快舒尔无针注射器时严格按照说明书操作,或者是相关人员指导下操作
2、不是什么药剂都能使用无针注射器进行注射,所以尽量选择无针注射器适用的药剂。
注射用重组人凝血因子VIII说明书

在各个频率分组内,不良反应按严重性的递减顺序列出。
表 2. 本品的不良反应
系统器官分类 血液和淋巴系统疾病
很常见 ≥ 1/10
因 子 VIII 抑 制 (PUP)
常见 ≥ 1/100 至< 1/10 因子 VIII 抑制(PTP)
少见 ≥ 1/1,000 至
< 1/100
免疫系统异常
过敏反应
Version No: 20170315
根据每个甲型血友病患者当前的治疗方案,应建议在旅行时携带充足的因子 VIII 产品,以满足 预期的治疗需要。应建议患者在旅行之前咨询医师。
使用说明 使用本品包装中所提供的预装注射器中的稀释剂(0.9 %氯化钠溶液)复溶冻干粉后,进行静
脉注射给药。 配制:
在进行下列操作前须洗净双手。
Version No: 20170315
Version No: 20170315
第 7 页,共 18 页
度患者中,其中 10 位已开始 ITI。11 例在免疫耐受处理后最近一次检测时滴度< 0.6 BU。在 16 例 低滴度(≤ 5 BU)患者中,10 例接受了本品前一代产品的免疫耐受治疗,其中 9 例最近一次检测结 果< 0.6 BU。因此,免疫耐受治疗的总体有效性为 80%(20/25),高应答者为 73%,低应答者为 90%。其余 6 例没有接受免疫耐受治疗的低应答患者中有 5 例最近一次检测结果< 0.6 BU。
Version No: 20170315
第 3 页,共 18 页
7. 折断注射器护套的穿孔处,从注射器上折下防启塑料尖嘴护套。不要触摸护套的内侧或注 射器尖部。由于稀释液注射器可能需要用护套重新盖住(如果已复溶的本品不立即使用), 因此需将护套倒置放在一个干净、最不易被环境污染的台面上。
注射用氯诺昔康说明书
核准日期: 年 月 日注射用氯诺昔康说明书请仔细阅读说明书并在医师指导下使用【药品名称】通用名称:注射用氯诺昔康英文名称:Lornoxicam for Injection 汉语拼音:Zhusheyong Lünuoxikang 【成 份】 本品主要成份为氯诺昔康,其化学名为(6-氯-4-羟基-2-甲基-N-2-吡啶基-2H-噻吩-〔2,3-e〕-1,2-噻嗪-3-碳乙二酰乙二胺-1,1-二氧化物。
其结构式为: 分子式:C 13H 10ClN 3O 4S 2分子量:371.82 本品辅料为甘露醇、三羟甲基氨基甲烷、EDTA-2Na 。
【性 状】本品为黄色冻干块状物。
汃 S N S 䡏 C 䡃 ijijO ij䡎 N急性中度手术后疼痛以及与急性腰坐骨神经痛相关的疼痛。
【规格】8mg(每瓶实际装氯诺昔康8.6mg)【用法用量】氯诺昔康只能由医师或护士作肌肉注射(>5秒)或静脉注射(>15秒)。
在注射前必须将氯诺昔康冻干粉用2ml注射用水溶解。
氯诺昔康8mg注射剂常规剂量是:起始剂量8mg。
如8mg不能充分缓解疼痛,可加用一次8mg。
有些病例在术后第一天可能需要另加8mg,即当天最大剂量为24mg。
其后氯诺昔康的剂量为8mg,每日2次。
每日剂量不应超过16mg。
不要超过医师医嘱所开剂量。
大于推荐剂量的用药量并不增强氯诺昔康的疗效,相反,可能会引起副作用。
【不良反应】氯诺昔康可能引起以下不良反应:(1)出现频率在10%以上的不良反应:无(2)出现频率在1%至10%的不良反应:与注射部位相关的不良反应(如疼痛、发热、刺痛样紧张感)、胃痛、恶心、呕吐、眩晕、思睡、嗜睡加重、头痛、皮肤潮红。
(3)出现频率在1%以下的不良反应:胃肠胀气、躁动、消化不良、腹泻、血压增高、心悸、寒战、多汗、味觉障碍、口干、白细胞减少、血小板减少、排尿障碍。
如出现上述以外的不良反应,请与医师联系。
-对氯诺昔康或处方中的成分过敏者-对非甾体类抗炎药(如乙酰水杨酸)过敏者-有出血性素质、凝血障碍或手术中有出血危险或止血机制不健全的病人-急性胃/肠出血或急性胃或肠溃疡-中度到重度肾功能受损-脑出血或疑有脑出血者-大量失血或脱水者-肝功能严重受损者-心功能严重受损者【注意事项】对有以下情况的病人,应慎用:-肝、肾功能受损者-有胃肠道出血或十二指肠溃疡病史者-凝血障碍者【孕妇及哺乳期妇女用药】禁用。
邦罗力Bondronat(伊班膦酸钠注射液)_说明书

由于非甾体类抗炎药会引起胃肠道刺激症状,在和本品同时口服时应特别注意。 如不小心经动脉内或静脉外途径给予未明确说明适合这些给药途径的制剂可引起组织损伤, 因此,必须确保本品浓缩注射液经静脉给药。 下颌骨坏死在接受双膦酸盐治疗的患者中已有报道。多数病例来自于接受牙科治疗的癌症患 者,但部分来自于绝经后骨质疏松症及其他疾病的患者。已知下颌骨坏死的危险因素包括癌症, 伴随治疗(如化疗,放疗,皮质类固醇激素)及伴随疾病(如贫血,感染,已有齿科疾病)。多 数报道病例来自于静脉注射双膦酸盐的患者,但部分来自于口服治疗的患者。 在治疗期间,这些患者应尽可能避免进行有创齿科手术。对于在双膦酸盐治疗期间发生下颌 骨坏死的患者,齿科手术可能导致病情恶化。对需要进行齿科手术的患者,目前尚无资料表明中 断双膦酸盐治疗是否能够降低下颌骨坏死的危险。主治医师应根据患者个体的受益/风险评价进行 临床判断,指导每个患者的管理计划。 在乳腺癌引发的转移性骨病患者中开展了随机、安慰剂对照的临床研究,尚未发现长期接受 本品治疗可引起肾功能恶化的证据。尽管如此,根据对各个患者的临床评价,还是需要检测接受 本品治疗患者的肾功能、血清钙浓度、磷酸盐浓度和镁浓度。 有心衰危险性的病人应避免水中毒。
[药理毒理] 伊班膦酸属双膦酸盐化合物,能特异地作用于骨组织,对骨骼的特异性选择作用是由于双膦
酸盐对骨骼中的无机物具有高度亲和性。双膦酸盐通过抑制破骨细胞的活性起作用,但其确切的 作用机理尚不清楚。
体内试验中,伊班膦酸能预防因性腺功能丧失、维甲酸类化合物、肿瘤或肿瘤提取物引起的 骨质破坏。通过对 Ca45 的代谢动力学研究和试验中观察到与骨结合的带放射性标记四环素从骨骼 中的释放,证实了伊班膦酸能抑制骨的内源性重吸收。
利拉鲁肽注射液诺和力中文说明书

利拉鲁肽注射液(诺和力)中文说明书警告:甲状腺C细胞肿瘤风险详细的警告信息请参见说明书・利拉鲁肽在临床相关的暴露水平可能导致啮齿类动物甲状腺C细胞肿瘤。
尚不清楚利拉鲁肽能否导致人类甲状腺C细胞肿瘤,包括甲状腺髓样癌(MTC),因为临床或非临床研究均无法确定其与人类的相关性.・利拉鲁肽不得用于有MTC既往史或家族史患者以及2型多发性内分泌肿病综合征患者(MEN2).【通用名称】利拉鲁肽注射液【商品名称】诺和力®(Victoza e)【英文名称】1irag1utideInjection【汉语拼音】1i1a1utaiZhusheye【成份】活性成份:利拉鲁肽(通过基因重组技术,利用酵母生产的人胰高糖素样肽-1(G1P-I)类似物)0化学名称:Arg341ys26-(N-ε-(γ-G1u(N-α•十六酰基)))-G1P-I[7・37]化学结构式:7 10 X Q30 37Pi1mhx*dd分子式:C172H265N43O51分子量:3751.20Da本品以苯酚作为抑菌剂,每IOOmI本品中加入苯酚0.55g<,其他成份:二水合磷酸氢二钠、丙二醇、盐酸和/或氢氧化钠(仅作为PH调节剂)和注射用水。
【性状】本品为无色或几乎无色的澄明等渗液体;pH=8.15β【适应症】本品适用于成人2型糖尿病患者控制血糖:适用于单用二甲双服或磺胭类药物最大可耐受剂量治疗后血糖仍控制不佳的患者,与二甲双肌;或磺服类药物联合应用。
适用于降低伴有心血管疾病的2型糖尿病成人患者的主要心血管不良事件(心血管死亡、非致死性心肌梗死或非致死性卒中)风险。
【规格】3m1:18mg(预填充注射笔)。
【用法用量】用盘为了改善胃肠道耐受性,利拉鲁肽的起始剂量为每天0.6mg。
至少1周后,剂量应增加至1∙2mg.预计一些患者在将剂量从12mg增加至1.8mg时可以获益,根据临床应答情况,为了进一步改善降糖效果,在至少一周后可将剂量增加至18mg°推荐每日剂量不超过1.8mg。
Injectomat TIVA Agilia 巧致注射泵说明书

Injectomat TIVA Agilia Bomba de seringa Instruções de uso1.INTRODUÇÃO (4)Sobre os modelos farmacocinéticos (4)Modelos farmacocinéticos na Injectomat® TIVA Agilia (5)Modos de programação (8)Modos de infusão (9)Finalidade de uso (10)Precauções a serem tomadas (10)2.DESCRIÇÃO (11)3.INSTALAÇÃO (13)4.OPERAÇÕES (16)Operações gerais (16)Modos Sem nome de droga e Lista de drogas (18)Modo de taxa de infusão (19)ou Modo de taxa de dose (1/3) (19)Modo de Taxa de dose (2/3) (20)Modo de Taxa de dose (3/3) (21)Modos Volume-dose / Tempo (V/T) ou (D/T) (22)Modo TIVA (1/2) (23)Modo TIVA (2/2) (24)Bolus manual (25)Bolus programado (1/2) (25)Bolus programado (2/2) (26)Modo de Limite de Volume (VL) (27)Modo TCI (28)Histórico (35)5.O VISOR E SEUS SÍMBOLOS (38)6.ALARMES E RECURSOS DE SEGURANÇA (41)7.MENU (44)Menu permanente (44)Menu selecionado no modo de opção (45)8.OPÇÕES (47)9.TESTE DO USUÁRIO (51)10.DESEMPENHOS (52)Faixa das taxas (52)Faixa de dose (52)Limite de volume (52)Volume-dose / Tempo (53)Faixa de duração da infusão (53)Faixa de diluição (53)Dados do paciente (53)Lista de seringas (54)Biblioteca de drogas (54)24087-4_nu_injectomat_TIVA_agilia_BRPrecisão (54)Pausa programável (55)Administração da pressão (55)Tempo de resposta do alarme de oclusão e Volume de bolus na liberação de oclusão (56)Unidades e regras de conversão (57)11.CARACTERÍSTICAS TÉCNICAS (58)Energia elétrica (58)Bateria (58)Porta de comunicação (58)Comunicação por infravermelho (58)Conformidade (58)Dimensões - Peso (59)Curvas tipo "trombeta" (59)12.DIRETRIZES E DECLARAÇÃO DO FABRICANTE SOBRE EMC (60)Emissões eletromagnéticas - Tabela 201 (60)Imunidade eletromagnética - Tabela 202 (61)Imunidade eletromagnética - Tabela 204 (62)Distâncias de separação recomendadas entre equipamentos de comunicação de RF portáteise móveis e a Injectomat®TIVA Agilia-Tabela206 (63)13.LIMPEZA E CONDIÇÕES DE USO (64)Limpeza e desinfecção (64)Condições ambientais (64)Uso da bateria interna (64)Recomendações (65)14.SERVIÇOS (66)Condições de garantia (66)Controle de qualidade (66)Manutenção preventiva (66)Requisitos de manutenção (67)Assistência Técnica (67)Racks de dados, acessórios e ferramentas de manutenção (68)Válida para a versão 4.3 do software.31.A TIVA Agilia Injectomat® é voltada para as exigências anestésicas. O dispositivo pode ser utilizado para administrar drogas anestésicas intravenosas (IV) no modo Infusão alvo-controlada (TCI) e outras drogas intravenosas seguindo os perfis de infusão padrão, como taxa de infusão contínua, bolus e dose de indução. O dispositivo consiste de um sistema aberto, que combina a facilidade de uso com a mais completa gama de recursos, incluindo os modelos farmacocinéticos (PK).As bibliotecas de drogas podem ser ajustadas com o Vigilant® Drug'Lib.Sobre os modelos farmacocinéticosO equipamento é projetado para infundir drogas anestésicas no modo alvo-controlado. Neste modo, a bomba de infusão segue um perfil de taxa de infusão para obter rapidamente a concentração ideal já definida e mantê-la. O perfil de taxa de infusão segue um modelo farmacocinético. Os modelos farmacocinéticos incluídos na Injectomat® TIVA Agilia foram estabelecidos e previamente validados por estudos clínicos.O objetivo desses estudos é avaliar a precisão de cada modelo.Foram realizadas ainda análises clínicas para selecionar os modelos farmacocinéticos que melhor se enquadram nas práticas clínicas. Como um modelo farmacocinético é uma representação matemática da distribuição e eliminação da droga, pode-se dizer que está muito próximo da realidade.O erro de um modelo pode ser computado pela seguinte fórmula:PE =100 x (Cm-Cp)/Cp,onde Cm é a concentração medida e Cp a concentração prevista.A partir deste valor, é possível obter o MADPE. Que é a média do valor absoluto de PE.Os modelos farmacocinéticos incluídos na Injectomat® TIVA Agilia têm demonstrado possuir um MADPE<30%. Todos os modelos farmacocinéticos incluídos na Injectomat® TIVA Agilia são modelos de 3 compartimentos que podem ser representados da seguinte maneira:onde:⏹V1 é o compartimento central (principalmente o sangue),⏹V2 e V3 são, respectivamente, os volumes de distribuição rápida e lenta,⏹k ij representa o coeficiente de partição que determina a velocidade na qual a droga passa de um compartimento para outro.⏹K10 corresponde à eliminação da droga pelo corpo.Em um modelo como esse, a concentração plasmática é equivalente à concentração da droga no compartimento central.Uma concentração no local do efeito é a estimativa da concentração em um 4º compartimento que representa o órgão onde a droga está atuando. Este compartimento está virtualmente ligado ao compartimento central por meio de um coeficiente de partição denominado ke0. Este compartimento não possui volume físico. A concentração no local do efeito e a concentração plasmática se equilibram após um determinado período, dependendo do valor ke0. Este valor varia conforme a droga utilizada e foi estabelecido por meio de estudos clínicos que compararam o nível plasmático (após o equilíbrio) e o efeito aferido (principalmente com uma resposta do EEG).45Modelos farmacocinéticos na Injectomat ® TIVA AgiliaOs modelos farmacocinéticos incluídos na Injectomat ® TIVA Agilia não foram desenvolvidos especificamente para o dispositivo, mas foram obtidos e validados por inúmeros estudos clínicos. Para obter mais informações sobre os parâmetros farmacocinéticos, consulte a documentação clínica.LBM: para os homens 1,1xPeso-128(Peso/altura)2 para as mulheres: 1,07xPeso-148(Peso/altura)2 Peso em kg; Altura em cm; Idade em anos.BMI: Peso/Altura 2 ; Peso em kg; Altura em m.* O modelo farmacocinético Alfentanil está disponível apenas em uma opção.Obs.:Deve-se prestar atenção especial ao usar os modelos Marsh e Schnider para o propofol. Esses doismodelos levam a diferentes perfis de taxas de infusão, cuja concentração apropriada pode variar de acordo com o modelo escolhido.Referências bibliográficas sobre os modelos farmacocinéticos1.Marsh - White - Morton - Kenny. Infusão de propofol em crianças baseada em modelos farmacocinéticos. Revista Britânica de Anestesia, 1991; 67: 41-48.2.Schnider - Minto - Shafer - Gambus - Andresen - Goodale - Youngs. A influência da idade na farmacodinâmica do propofol. Anestesiologia 1999; 90: 1502 - 1516.3.Schnider - Minto - Gambus - Andresen - Goodale - Shafer - Youngs. A influência do método de administração e covariáveis na farmacocinética de propofol em voluntários adultos. Anestesiologia, 1998; 88: 1170 - 1182.4. Minto - Schnider - Egan - Youngs - Lemmens - Gambus - Billard - Hoke - Moore - Hermann - Muir - Mandema - Shafer.Influência da idade e gênero na farmacocinética e farmacodinâmica de remifentanil Anestesiologia, 1997; 86: 10 - 23.5.Gepts, Shafer, Camu, Stanski, Woestenborghs, Van Peer, Heykants. Linearidade da farmacocinética e estimativa de modelos de sufentanil. Anestesiologia, 1995; 83: 1194-1204.6. Scott J, Ponganis K, Stanski D. Quantificação pelo EEG do efeito narcótico: os comparativos farmacodinâmicos entre fentanil e alfentanil. anestesiologia, 1985; 62: 234-241.7.James C Scott e Donald R. Stanski «Redução das doses necessárias de Fentanil e Alfentanil em função da idade.Uma avaliação simultânea de farmacocinética e farmacodinâmica» - Revista de Farmacologia e Terapêuticas Experimentais, 1987; N 53855/1 Vol. 240 n°1Controle da concentração no local do efeitoA Injectomat ® TIVA Agilia permite que a concentração no local do efeito seja controlada. Este controle édiferente do controle de concentração plasmática, uma vez que permite uma ampliação da concentração plasmática para obter rapidamente uma concentração no local do efeito. Antes de usar o modo de concentração no local do efeito, você deve avaliar se tal ampliação corresponde à situação do paciente. Para pacientes debilitados (ASA 3 ou 4) ou em idade avançada, o uso do controle no local do efeito deve ser feito com muito cuidado.PropofolMarsh 1991Ref. 1Propofol Schnider et al. 1998, 1999Ref. 2/3Remifentanil Minto et al. 1997 Ref. 4Sufentanil Gepts et al.1995Ref. 5Alfentanil Scott et al. 1987Kapilla et al.1995 Ref. 6/7 *V (L)0,228 x Peso 4.275,1-0,0201 (Idade - 40) + 0,072 (LBM - 55)14.3 2.19K 10 (mín -1)0.119[1,89 + 0,0456 x (Peso - 77) -0,0681x(LBM - 59) + 0,0264 x(Altura - 177)] / Vc[2,6 - 0,0162 x (Idade - 40) + 0,0191 x (LBM - 55)] / Vc 0.06450.0894K 12 (mín -1)0.1120,302 - 0,0056 (Idade - 53)[2,05 - 0,0301 x (Idade - 40)] / Vc 0.10860.6540K 13 (mín -1)0.04190.196[0,076 - 0,00113 x (Idade - 40)] / Vc 0.02290.2090K 21 (mín -1)0.055[1,29 - 0,024 (Idade - 53)] /[18,9 - 0,391 (Idade - 53)][2,05 - 0,0301 x (Idade - 40)] /[9,82 - 0,0811 x (Idade - 40) + 0,108 x (LBM - 55)]0.02450.1180K 31 (mín -1)0.00330.0035[0,076 - 0,00113 x (Idade - 40)] / 5,420.00130.0177K e0 (mín -1)1.210.4560,595 - 0,007 x (Idade - 40)0.1120.776PopulaçõesAo usar o modo TCI, deve-se sempre titular a concentração. Isto significa que a concentração apropriada para o seu paciente pode ser obtida pelo aumento progressivo do fator ideal até que se alcance o efeito desejado.Os modos TCI podem ser usados em pacientes adultos de 15 a 100 anos de idade. Deve-se prestar muita atenção principalmente na aplicação do modelo Marsh, uma vez que não leva em conta a idade do paciente.Nos pacientes acima de 55 de idade, o modelo Schnider tem apresentado resultados mais precisos.Os modos TCI podem ser utilizados em pacientes com 30 a 200 kg. Nos casos de pacientes com obesidade mórbida, a exatidão dos modelos farmacocinéticos não foram avaliadas e por isso os modos TCI devem ser utilizados com cuidado.Além disso, os modelos Schnider e Minto, por serem dependentes do fator MCM (Massa Corporal Magra), não podem ser selecionados quando os parâmetros do paciente apontarem um IMC (Índice de Massa Corpórea)superior a 42 para os pacientes homens e 35 para as pacientes mulheres.Uma vez que os modelos farmacocinéticos foram determinados com bases estatísticas, recomenda-se sempre,antes de iniciar a infusão, controlar o perfil da taxa de infusão e verificar se este perfil corresponde àquele que seria administrado em um modo não TCI.Controle do perfil da taxa de infusãoDurante a configuração do alvo, a Injectomat ® TIVA Agilia exibe sempre o perfil da taxa de infusão a ser aplicada. Este perfil corresponde à dose de bolus e às taxas de infusão mínima e máxima para se atingir o alvo.Em alguns casos, um destes valores pode estar além das prescrições recomendadas da droga. Assim, o usuário terá de decidir entre reduzir a o alvo ou aceitar o perfil da taxa de fluxo validando o alvo.No modo plasma TCI, o perfil da taxa de infusãoé apresentado como:No modo TCI, o perfil da taxa de infusão é apresentado como:Diluições recomendadas das drogasNo modo TCI, a taxa de infusão é ajustada automaticamente para alcançar e manter a concentração-alvo. Para garantir resultados mais precisos, a taxa de infusão deve ser superior a 1 ml/h. Esta taxa de infusão depende da diluição da droga, do valor ideal e da duração da infusão (quando o equilíbrio é alcançado, a taxa de infusão é encerrada para a diluição da droga).Como na infusão padrão, quanto maior a capacidade de diluição da droga, mais elevada será a sua taxa de infusão.Para possibilitar a definição de metas de baixa concentração, recomendamos adaptar a diluição. A biblioteca de drogas contém a seguinte fixa de diluição:⏹Propofol: 1 % e 2 %,⏹Remifentanil: 5 a 50 µg/ml,⏹Sufentanil: 0,05 a 5 µg/ml,⏹Alfentanil: 50 a 500 µg/ml.Estes valores podem ser alterados de acordo com sua própria experiência, utilizando o software Vigilant® Drug’Lib.Configuração padrãoAs drogas que podem ser fornecidas em TCI estão definidas na biblioteca de drogas. A biblioteca de drogas padrão foi definida para permitir a administração de Propofol, Sufentanil e Remifentanil em TCI.Obs.: O modelo farmacocinético Alfentanil está disponivel apenas em uma opção.Drogas disponíveis em TCI Propofol - Remifentanil - Sufentanil - AlfentanilModelos farmacocinéticos Propofol: Marsh/Schnider Sufentanil: Gepts Remifentanil: Minto Alfentanil: ScottFaixa de concentrações Propofol: 0-15 µg/ml Sufentanil: 0-3 ng/ml Remifentanil: 0-20 ng/ml Alfentanil: 0-500 ng/mlFaixa de diluições Propofol: 1 % (10 mg/ml) e 2 % (20 mg/ml) Sufentanil: 5 µg/ml máx.Remifentanil: 50 µg/ml máx.Alfentanil: 500 µg/ml máx.Modo TCI Controle plasmáticoControle sobre o local do efeitoPrecisão(% de erros na concentraçãocalculada do volume fornecido)± 3 % com um volume mínimo de ± 0,1 ml78Precauções a serem tomadas no modo TCI⏹Os modelos farmacocinéticos de uma droga têm sido estabelecidos para pacientes sem nenhuma administração anterior desta droga. Antes de infundir no modo TCI, certifique-se de que o paciente não tenha recebido nenhuma medicação com a droga contemplada.⏹Se, durante o uso do modo TCI, o dispositivo de infusão for desligado, o registro farmacocinético serárestabelecido a zero. Se o dispositivo for novamente ligado e o mesmo paciente infundido, a dose anterior não será considerada. Por isso, recomendamos o prosseguimento da infusão no modo TIVA.⏹Ao administrar uma dose de indução de uma droga de meia vida curta em uma baixa taxa de infusão, o volume real fornecido inicialmente poderá ser diferente da informação do modelo exibido. Para garantir uma maior precisão, consequentemente, recomenda-se o uso de seringas de menor capacidade e/ou a diluição das drogas.⏹Os valores padrão são resultantes de avaliações feitas por especialistas e informadas nas publicações médicas. São fornecidos a título de orientação e devem ser cuidadosamente verificados antes de aplicados,para que atendam às suas aplicações clínicas específicas.⏹Todas as outras drogas podem ser administradas em modo contínuo em ml/h ou com o ajuste da taxa de dose programada no modo TIVA.⏹Ao usar a Injectomat ® TIVA Agilia para administrar drogas anestésicas em TCI, recomendamos sempre titular a concentração, aumentando-a progressivamente até que se obtenha o efeito desejado. Também érecomendável verificar sempre o perfil da taxa de infusão a ser fornecida, e validar esse perfil. Para cada alteração da meta, a Injectomat ® TIVA Agilia exibe o valor do bolus e as taxas de infusão mínima e máxima a serem infundidas para o paciente. Uma vez que os modelos farmacocinéticos são determinados estatisticamente, o usuário deve avaliar se este perfil da taxa de infusão corresponde àquele que seria administrado em um modo não TCI.Modos de programaçãoA Injectomat ® TIVA Agilia pode ser programada em quatro modos diferentes. A alteração do modo deve ser feita antes do início do processo de infusão.Obs.: Nos modos TIVA e de lista de drogas, você pode selecionar “Droga X (ml/h)” ou “Droga X (taxa dedose)” para definir todos os parâmetros de uma droga não especificada (não incluída em uma lista e nem em uma biblioteca de drogas) sem alterar o modo de programação.Sem nome de droga Todos os parâmetros de infusão devem ser definidos. O nome da droga não foi selecionado.No modo de Taxa de dose, devem ser definidos os valores e unidades de diluição, o peso do paciente, as unidades e os valores de taxa de infusão.A droga pode ser infundida em Taxa de infusão (ml/h), Taxa de dose, Volume-dose / Tempo (V/T) ou Volume / Limite (VL).Lista dedrogas O nome da droga é selecionado durante a programação de infusão e exibido na tela durante a infusão.A lista de drogas pode ser modificada utilizando-se o software Vigilant ® Drug’Lib, que permite que a lista seja baixada, modificada e novamente carregada.TIVA Os parâmetros da droga são definidos na biblioteca de drogas: faixas de valores e unidadesde diluição autorizadas, unidades e valores da taxa de infusão padrão, modos de infusão autorizados (ml/h, Taxa de dose, V/T), bolus e parâmetros de bolus autorizados, dose de indução e parâmetros da dose de indução autorizados, valores de limite máximo e flexível da taxa de infusão, etc. A biblioteca de drogas deve ser criada e baixada utilizando-se o software Vigilant ® Drug ‘Lib.TCIO modo TCI é dedicado à anestesia. Nele estão incluídos os modelos PK. A biblioteca dedrogas pode ser ajustada graçao ao Vigilant ® Drug'Lib para a Agilia. Em TCI, é possível ajustar a lista inicial de drogas em combinação com os seus dados de diluição, modelo e local-alvo (plasma ou efeito). O TCI pode ser executado tanto em modo plasmático como no modo de efeito.9Modos de infusãoOs seguintes modos de infusão são autorizados:A Injectomat ® TIVA Agilia também permite a infusão de bolus manuais ou programados e a indução de doses.Taxa de infusão (ml/h)Infusão da droga em ml/h.Taxa de doseInfusão da droga com diluição, peso do paciente e taxa de infusão por kg (se selecionado).Volume-dose / Tempo(V/T)Infusão da droga com um volume ou com uma dose e tempo.Limite de Volume (VL)Infusão da droga com volume e/ou limite de dose.Finalidade de uso⏹ A Injectomat® TIVA Agilia foi projetada para infundir drogas anestésicas no modo alvo-controlado. Neste modo, a bomba de infusão segue um perfil de taxa de infusão para obter rapidamente a concentração-alvo jádefinida e mantê-la. Ela deve ser usada exclusivamente por profissionais treinados que trabalham em hospitais e/ou ambulâncias, junto com o acessório obrigatório Suporte da Bomba Agilia para Ambulância (Agilia Holder Ambulance).Precauções a serem tomadas⏹O símbolo visível no dispositivo recomenda que este guia do operador seja lido em sua totalidade.⏹ A Injectomat® TIVA Agilia foi testada de acordo com os padrões aplicáveis de compatibilidade eletromagnética dos dispositivos médicos. Sua imunidade possibilita a garantia de uma operação correta. A limitação das radiações emitidas evita a interferência indesejável em outros equipamentos, como EEG, ECG, etc. Se a Injectomat® TIVA Agilia for colocada próxima a dispositivos como equipamentos cirúrgicos de alta frequência, aparelhos de raio X, telefones celulares ou pontos de Wifi, é essencial que sejam mantidas distâncias mínimas entre os equipamentos (vide página 62).⏹Uso em unidade de Imagem de Ressonância Magnética: a bomba pode ser operada com segurança com o dispositivo MRI Guard Agilia apenas para prevenir interferências eletromagnéticas. Consulte as Instruções de Uso específicas do MRI Guard Agilia.⏹Devido ao uso em ambulâncias na rua, o desempenho da bomba Agilia IV pode sofrer alterações. A equipe médica deve permanecer perto da bomba Agilia IV para tomar uma ação apropriada, caso seja necessário. Consulte as Instruções de Uso do Suporte da Bomba Agilia para Ambulância.⏹ A Injectomat® TIVA Agilia não deve ser usada na presença de agentes anestésicos inflamáveis, devido a risco de explosão. Use-a sempre distante de todas as áreas de risco. O dispositivo deve ser utilizado em um ambiente anestésico com todos os equipamentos necessários para garantir a segurança do paciente, como ventiladores e monitores de sinais vitais.⏹O dispositivo pode ser influenciado pela pressão ou por variações de pressão, choques mecânicos, fontes de ignição por calor, etc. Caso deseje usar os dispositivos em uma condição específica, favor contatar nosso Departamento de Pós-Vendas. A bomba deve ser usada em uma posição horizontal e estável para funcionar corretamente.⏹ A bomba não deve ser usada para administrar soluções insolúveis em água ou fluidos não estéreis.⏹Os efeitos fisiológicos da medicação podem ser influenciados pelas características do dispositivo e da seringa descartável. Verifique se eles são compatíveis com as prescrições, as características de curvas tipo "trombeta" e tempos de configuração de alarme de oclusão em relação à taxa de infusão programada.⏹Antes de iniciar a infusão, fique atento a possíveis interações com outras drogas anestésicas.⏹Em caso de situação inesperada relativa aos controles da bomba ou ao ambiente, o sistema de segurança de última geração emitirá um alarme, interromperá a infusão e exibirá um código de erro. Os usuários são orientados a ter ciência desses alarmes (vide capítulo 6) e em casos onde o dispositivo é usado para fornecer terapias de suporte à vida, como medicações com meia-vida curta e considerar as provisões adequadas para soluções de fornecimento de terapias de apoio.102.1 -Fixação do cilindro da seringa 5 -Alça9 -Conexão de rede elétrica 2 -Suporte do flange da seringa 6 -Parafuso de montagem 10 -Botão de fixação 3 -Êmbolo7 -Célula infravermelha 11 -Prendedor "swinglock"4 -Proteção "Push-guard"8 -Porta de comunicação eentrada/saída de energia CC123411987651012 -Aviso de rede elétrica 17 -CORREÇÃO / VOLTAR 21 -13 -Tela18 -PARAR infusão a Seleção de valor14 -SILENCIAR ALARME 19 -Validação24 -15 -GRÁFICO 20 -Avisos de funcionamento, pré-alarme e alarme.25 -BOLUS ouPREENCHIMENTO 16 -MENU26 -Liga / Desliga 2625241918172322212013121416153.Se instalar em um suporte sobre rodas, não incline o sistema mais do que 5º: ele pode tombar.em uma mesa em um suporte vertical em um trilhoAté dois dispositivos, no máximo, podem ser instalados durante uma infusão.Até três dispositivos, no máximo, podem ser instalados em um suporte ou durante o transporte.Três dispositivos em umsuporte vertical: pelo menos dois prendedores de fixação devem ser travados.Quando os dispositivos são instalados, os parafusos demontagem devem estar na posição fechadaO prendedor swinglock só pode ser direcionado quando estiver fechado na direção da bomba. Ele é mantido em sua posição vertical ou horizontal com o botão de fixação.As imagens a seguir demonstram como modificar a instalação da bomba, de uma posição de suporte a uma de trilho.❶Afrouxe o parafuso do prendedor (A) e solte o dispositivo do suporte. Pressione o botão de fixação (B).❷Dobre o prendedor de fixação na direção da bomba.Esta é a posição recomendada para o prendedor swinglock quando o dispositivo é fixado em uma superfície plana.❸Gire o prendedor de fixação 90 graus para baixo.❹Movimente o prendedor de fixação para fora (A).O botão de fixação é liberado automaticamente. Encaixe o dispositivo no trilho e use o parafuso do prendedor (B) para fixá-lo.ABBA❶Conecte o extensor à seringa, de acordo com aspráticas adequadas.Verifique se não há bolhas de ar deixadas naseringa.❷Coloque a seringa em seu suporte, com osflanges inseridos corretamente na fenda ↑↓fornecida. Prenda a seringa com o suporte defixação do cilindro da seringa.❸Movimente o êmbolo para frente, na direção dacabeça da seringa.❹Verifique a instalação geral.4.Operações geraisEstas operações podem ser repetidas e/ou modificadas durante o processo de infusão.Para inicializar o dispositivo, consulte a página 18.Obs.: Para obter informações sobre leds, consulte Luzes indicadoras no capítulo Display e símbolos, na página 38.⏹Conecte o extensor à seringa.⏹Verifique que o paciente não está conectado.⏹Para iniciar o preenchimento, pressione a tecla <PRIME> [Preenchimento] 2 vezes: uma pressão curta e depois uma contínua até que todas as bolhas de ar sejam eliminadas da linha.⏹Para interromper o preenchimento, solte a tecla <PRIME>.⏹Conecte o paciente.Obs. 1: É possível configurar o preenchimento como obrigatório ou aconselhado com a opção Proteção [Par 7] (vide página 49).Obs. 2: Durante o preenchimento, o nível de pressão de oclusão é ajustado para seu valor máximo (900mmHg).⏹Para interromper a infusão, pressione a tecla <STOP> [Parar].⏹Para iniciar a infusão, pressione start [Iniciar].⏹Para programar uma pausa, pressione a tecla <STOP> [Parar] duas vezes, depois selecione a duração da pausa.A pausa também pode ser programada pelo menu.⏹Quando a duração da pausa tiver terminado,pressione start [Iniciar] para continuar a infusão.⏹Se desejar, pressione o botão da caixa deseleção para ativar a opção "Iniciar infusão Final de pausa". O ciclo será reiniciado automaticamente.⏹Pressione a tecla <SILENCE ALARM> [Silenciar Alarme] para que o sinal sonoro não seja emitido.Silêncio preventivo: para trocar uma seringa sem nenhum sinal sonoro, interrompa a infusãopressionando a tecla <STOP> [Parar]. Pressione a tecla <SILENCE ALARM> [Silenciar Alarme] e troquea seringa.。
诺和灵50R(精蛋白生物合成人胰岛素注射液(预混50R))说明书

诺和灵50R(精蛋白生物合成人胰岛素注射液(预混50R))药品名称:商品名称:诺和灵50R通用名称:精蛋白生物合成人胰岛素注射液(预混50R)英文名称:Isophane Protamine Biosynthetic Human Insulin Injection(Pre-mixed50R)主要成份:本品主要成份及其化学名称为:双时相低精蛋白锌胰岛素。
活性成分:生物合成人胰岛素(它是通过基因重组技术,利用酵母生产的)。
1IU(国际单位) 相当于0.035mg无水人胰岛素。
其它成分:硫酸鱼精蛋白,氯化锌,甘油,磷酸氢二钠二水合物,间甲酚,苯酚,氢氧化钠,盐酸和注射用水。
诺和灵50R笔芯是短效和中效胰岛素混悬液的混合物。
诺和灵50R笔芯是双时相低精蛋白锌胰岛素注射液,含有50%可溶性胰岛素和50%低精蛋白锌胰岛素混悬液。
诺和灵50R笔芯3毫升卡式瓶是为诺和诺德胰岛素注射系统及诺和针特别设计的。
只有将笔芯3性状及剂型:白色或类白色混悬液。
适应症:本品用于糖尿病的治疗。
规格:300IU/3ml/支(笔芯),5支/盒。
用法用量:本品为双效胰岛素制剂。
本品的双时相组份包含短效胰岛素和中效胰岛素。
当需要同时使用短效胰岛素和中效胰岛素时,通常给予预混胰岛素一天一次或一天二次。
1.用量剂量因人而异,由医生根据患者的需要而定。
用于糖尿病治疗时,平均每日胰岛素需要量在每公斤体重0.5-1.0国际单位之间。
青春期前的儿童,胰岛素的需要量在每日每公斤体重0.7-1.0国际单位之间。
当病情得到部分缓解时,胰岛素的需要量可明显减少;然而,当患者存在胰岛素抵抗时(如处于青春期或肥胖状态),每日的胰岛素需要量将会大量增加。
对糖尿病患者进行良好的血糖水平控制,可以有效延缓糖尿病晚期并发症的发生和发展。
因此,建议加强血糖水平监测。
注射后30分钟内必须进食含有碳水化合物的正餐或加餐。
老年患者治疗的主要目的是减轻症状和避免低血糖症。
2.剂量调整伴发其他疾病时(特别是感染和发热),通常患者的胰岛素需要量会增加。
胰岛素制剂贮藏要求2016.6.
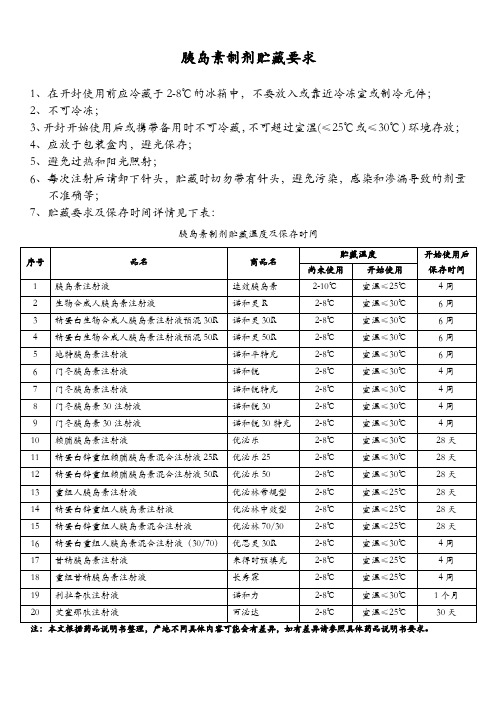
1、在开封使用前应冷藏于2-8℃的冰箱中,不要放入或靠近冷冻室或制冷元件;
2、不可冷冻;
3、开封开始使用后或携带备用时不可冷藏,不可超过室温(≤25℃或≤30℃)环境存放;
4、应放于包装盒内,避光保存;
5、避免过热和阳光照射;
6、每次注射后请卸下针头,贮藏时切勿带有针头,避免污染,感染和渗漏导致的剂量不准确等;
诺和锐30特充
2-8℃
室温≤30℃
4周
10
赖脯胰岛素注射液
优泌乐
2-8℃
室温≤30℃
28天
11
精蛋白锌重组赖脯胰岛素混合注射液25R
优泌乐25
2-8℃
室温≤30℃
28天
12
精蛋白锌重组赖脯胰岛素混合注射液50R
优泌乐50
2-8℃
室温≤30℃
28天
13
重组人胰岛素注射液
优泌林常规型
2-8℃
室温≤25℃
28天
14
精蛋白锌重组人胰岛素注射液优泌林中效型源自2-8℃室温≤25℃
28天
15
精蛋白锌重组人胰岛素混合注射液
优泌林70/30
2-8℃
室温≤25℃
28天
16
精蛋白重组人胰岛素混合注射液(30/70)
优思灵30R
2-8℃
室温≤30℃
4周
17
甘精胰岛素注射液
来得时预填充
2-8℃
室温≤25℃
4周
18
重组甘精胰岛素注射液
长秀霖
2-8℃
室温≤25℃
4周
19
利拉鲁肽注射液
诺和力
2-8℃
室温≤30℃
1个月
利拉鲁肽注射液

药品名称:
【通用名称】
【商品名称】
【英文名称】
【汉语拼音】 利拉鲁肽注射液 诺和力Victoza
Liraglutide Inject ion lilaluzhusheye
成份:
活性成份为利拉鲁肽(通过基因重组技术,利用酵母生产的人胰高糖素样肽 类似物)。
化学名称:Arg34Lys26-(N-£-(丫-Glu(N-a-十六酰基)))-GLP-1[7-37]
经验有限。目前不推荐诺和力用于包括终末期肾病患者在内的重度肾功能损害患者(见药代
动力学)。 肝功能损害:在肝功能损害患者中的治疗经验有限,因此不推荐诺和力用于轻、中、重度肝 功能损害患者(见药代动力学)。
用量: 诺和力每日注射一次, 可在任意时间注射, 无需根据进餐时间给药。 诺和力经皮下注射给药, 注射部位可选择腹部、大腿或者上臂。在改变注射部位和时间时无需进行剂量调整。然而, 推荐诺和力于每天同一时间注射, 应该选择每天为方便的时间。 多有关给药的指导参见使用 及其他操作的注意事项。 诺和力不可静脉或肌肉注射。
不良反应:
在5项大规模的氏期临床试验中,己有超过 力与二甲双呱、磺脲类药物(加或不加二甲双胍 不良反应发生的频率定义如下:000, <1/100),罕见不良反应 不详(根据现有的数据无法评价 列出。
临床试验期间常见的不良反应为胃肠道不适:恶心和腹泻非常常见,呕吐、便秘、腹痛和消 应发生频率可能高。 应通常在治疗持续数天或数周内减轻。头痛和上呼吸道感染也是常见不良反应。 此外, 低血糖事件为常见不良反应, 而当诺和力与磺脲类药物联用时则非常常见。 糖主要发生在诺和力与磺脲类药物联用时。 常见的不良事件为胃肠道疾病以及感染与侵染。
的患者至少报告了1次腹泻事件。 大部分事件均为轻至中度, 且呈剂量依赖性。 大部分初出 现恶心症状患者在继续治疗情况下,这些症状的频率和严重程度均有所降低。70岁以上患
利拉鲁肽注射液

利拉鲁肽注射液药品名称:【通用名称】利拉鲁肽注射液【商品名称】诺与力Victoza【英文名称】Liraglutide Injection【汉语拼音】lilaluzhusheye成份:活性成份为利拉鲁肽(通过基因重组技术,利用酵母生产得人胰高糖素样肽—1(GLP—1)类似物)。
ﻫ化学名称:Arg34Lys26- (N—ε-(γ-Glu(N—α-十六酰基)))—GLP-1[7-37]ﻫ化学结构式:分子式:C172H265N43O51分子量:3751、 20 Da其她成份:二水合磷酸氢二钠、丙二醇、盐酸与/或氢氧化钠(仅作为pH调节剂)、苯酚与注射用水。
性状:为无色或几乎无色得澄明等渗液;pH=8、15.适应症:适用于成人2型糖尿病患者控制血糖;适用于单用二甲双胍或磺脲类药物可耐受剂量治疗后血糖仍控制不佳得患者,与二甲双胍或磺脲类药物联合应用.规格:3ml:18mg(预填充注射笔)用法用量:用量:利拉鲁肽得起始剂量为每天0、6mg。
至少1周后,剂量应增加至1、2mg.预计一些患者在将剂量从I、2mg增加至1、8mg时可以获益,根据临床应答情况,为了进一步改善降糖效果,在至少一周后可将剂量增加至1、8mg。
推荐每日剂量不超过1、8mg。
ﻫ诺与力可用于与二甲双胍联合治疗,而无需改变二甲双胍得剂量。
诺与力可用于与磺脲类药物联合治疗。
当诺与力与磺脲类药物联用时,应当考虑减少磺脲类药物得剂量以降低低血糖得风险(见注意事项)。
调整诺与力得剂量时,无需进行自我血糖监测。
然而,当诺与力与磺脲类药物联合治疗而调整磺脲类药物得剂量时,可能需要进行自我血糖监测。
ﻫ特殊人群:ﻫ肾功能损害:轻度肾功能损害得患者不需要进行剂量调整。
在中度肾功能损害患者中得治疗经验有限。
目前不推荐诺与力用于包括终末期肾病患者在内得重度肾功能损害患者(见药代动力学)。
ﻫ肝功能损害:在肝功能损害患者中得治疗经验有限,因此不推荐诺与力用于轻、中、重度肝功能损害患者(见药代动力学).ﻫ用量:诺与力每日注射一次,可在任意时间注射,无需根据进餐时间给药。
(用药参考)利拉鲁肽注射液说明书

利拉鲁肽注射液药品名称:【通用名称】利拉鲁肽注射液【商品名称】诺和力 Victoza【英文名称】Liraglutide Injection【汉语拼音】li la lu tai zhu she ye成份:活性成份为利拉鲁肽(通过基因重组技术,利用酵母生产的人胰高糖素样肽-1(GLP-1)类似物)。
化学名称:Arg34Lys26- (N-ε-(γ-Glu(N-α-十六酰基)))-GLP-1[7-37]化学结构式:分子式:C172H265N43O51分子量:3751. 20 Da其他成份:二水合磷酸氢二钠、丙二醇、盐酸和/或氢氧化钠(仅作为pH调节剂)、苯酚和注射用水。
所属类别:化药及生物制品>> 代谢及内分泌系统药物>> 降糖药>> 胰高血糖素样肽-1(GLP-1)受体激动剂化药及生物制品>> 代谢及内分泌系统药物>> 减肥药性状:为无色或几乎无色的澄明等渗液;pH=8.15。
适应症:本品适用于成人2型糖尿病患者控制血糖:适用于单用二甲双胍或磺脲类药物最大可耐受剂量治疗后血糖仍控制不佳的患者,与二甲双胍或磺脲类药物联合应用。
规格:3ml:18mg(预填充注射笔)用法用量:用量:利拉鲁肽的起始剂量为每天0.6mg。
至少1周后,剂量应增加至1.2mg。
预计一些患者在将剂量从1.2mg增加至1.8mg时可以获益,根据临床应答情况,为了进一步改善降糖效果,在至少一周后可将剂量増加至1.8mg。
推荐每日剂量不超过1.8mg。
本品可用于与二甲双胍联合治疗,而无需改变二甲双胍的剂量。
本品可用于与磺脲类药物联合治疗。
当本品与磺脲类药物联用时,应当考虑减少磺脲类药物的剂量以降低低血糖的风险(见【注意事项】)。
调整本品的剂量时,无需进行自我血糖监测。
然而,当本品与磺脲类药物联合治疗而调整磺脲类药物的剂量时,可能需要进行自我血糖监测。
特殊人群:肾功能损害:轻度肾功能损害的患者不需要逬行剂量调整。
(用药参考材料)利拉鲁肽注射液使用说明

利拉鲁肽注射液药品名称:【通用名称】利拉鲁肽注射液【商品名称】诺和力Victoza【英文名称】 Liraglutide Injection【汉语拼音】 li la lu tai zhu she ye成份:活性成份为利拉鲁肽(通过基因重组技术,利用酵母生产的人胰高糖素样肽-1(GLP-1)类似物)。
化学名称:Arg34Lys26- (N-ε-(γ-Glu(N-α-十六酰基)))-GLP-1[7-37]化学结构式:分子式:C172H265N43O51分子量:3751. 20 Da其他成份:二水合磷酸氢二钠、丙二醇、盐酸和/或氢氧化钠(仅作为pH调节剂)、苯酚和注射用水。
所属类别:化药及生物制品>> 代谢及内分泌系统药物>> 降糖药>> 胰高血糖素样肽-1(GLP-1)受体激动剂化药及生物制品>> 代谢及内分泌系统药物>> 减肥药性状:为无色或几乎无色的澄明等渗液;pH=8.15。
适应症:本品适用于成人2型糖尿病患者控制血糖:适用于单用二甲双胍或磺脲类药物最大可耐受剂量治疗后血糖仍控制不佳的患者,与二甲双胍或磺脲类药物联合应用。
规格:3ml:18mg(预填充注射笔)用法用量:用量:利拉鲁肽的起始剂量为每天0.6mg。
至少1周后,剂量应增加至1.2mg。
预计一些患者在将剂量从1.2mg增加至1.8mg时可以获益,根据临床应答情况,为了进一步改善降糖效果,在至少一周后可将剂量増加至1.8mg。
推荐每日剂量不超过1.8mg。
本品可用于与二甲双胍联合治疗,而无需改变二甲双胍的剂量。
本品可用于与磺脲类药物联合治疗。
当本品与磺脲类药物联用时,应当考虑减少磺脲类药物的剂量以降低低血糖的风险(见【注意事项】)。
调整本品的剂量时,无需进行自我血糖监测。
然而,当本品与磺脲类药物联合治疗而调整磺脲类药物的剂量时,可能需要进行自我血糖监测。
特殊人群:肾功能损害:轻度肾功能损害的患者不需要逬行剂量调整。
脂肪乳氨基酸(17)葡萄糖(11%)注射液说明书--卡文

增加以及基础值设计的。
为满足患者全部的营养需求,应考虑添加微量元素以及维生素。
按患者体重计葡萄糖的最大输注速率为按体重一小时0.25g/kg,氨基酸的输注速率按体重不宜超过一小时0.1g/kg,脂肪按体重则不超过一小时0.15g/kg。
本品输注速率按患者体重不宜超过一小时3.7ml/kg(相当于0.25g葡萄糖、0.09g氨基酸、0.13g脂肪/kg)。
推荐输注时间为12~24小时。
为避免可能发生的静脉炎,建议每日更换输液针刺入的位置。
【不良反应】本品与所有高渗性输液一样,如采用周围静脉输注有可能发生静脉炎。
导致静脉炎的因素很多,包括输液管类型、直径与长度、输注时间长短、液体的pH和渗透压、感染/静脉被穿刺的次数。
因此建议已输注本品的静脉不再用于其它输液或添加剂注射使用,并建议每日更换输液针刺入的位置。
输注英脱利匹特(脂肪乳注射液)可能会引起体温升高(发生率<3%),偶见寒战、恶心/呕吐(发生率<1%)。
另有输注过程中出现肝功能酶一过性升高的报道。
输注英脱利匹特产生其它不良反应更为罕见。
超敏反应(过敏反应、皮疹、荨麻疹)、呼吸症状(如呼吸急促)、高/低血压、溶血、网织红细胞增多、腹痛、头痛、疲倦、阴茎异常勃起少见报道。
脂肪超载综合症:脂肪廓清受损后会出现脂肪超载综合症,脂肪超载综合症也会出现在虽以推荐剂量速率输注,但由于临床情况突然发生改变的患者(如肾功能损伤与感染)。
脂肪超载综合症表现有高脂血症,发热,脂肪浸润,肝肿大,脾肿大,贫血,白细胞减少症,血小板减少症、凝血机制障碍,昏迷。
若停止输注所有症状通常均可逆转。
【禁忌】·对鸡蛋或大豆蛋白或处方中任一成份过敏者·重度高脂血症·严重肝功能不全·严重凝血机制障碍·先天性氨基酸代谢异常·严重肾功能不全且无法进行腹透与血透者·急性休克·高糖血症(胰岛素治疗超过6单位/小时)·血电解质(指本品处方中所含有的)水平出现异常升高·其它一般禁忌(如急性肺水肿,水潴留,失代偿性心功能不全,低渗性脱水)·吞噬血细胞综合症·疾病状态处于非稳定期(如严重创伤后期,失代偿性糖尿病,急性心梗,代谢性酸中毒,严重败血症,高渗性昏迷等)【注意事项】须经常检测脂肪廓清能力。
注射用拉罗尼酶浓溶液Laronidase-详细说明书与重点

注射用拉罗尼酶浓溶液Laronidase 英文名:Laronidase concentrate for solution for infusion汉语拼音:Zhe She Yong La luo Ni Mei Nong Rong Ye【成份】活性成分:拉罗尼酶,化学名称:重组人α-L-艾杜糖苷酶,分子式(根据氨基酸序列):C3169H4889O884N901S12拉罗尼酶是重组人α-L-艾杜糖苷酶,是利用哺乳动物中国仓鼠卵巢(CHO)细胞培养、采用重组DNA技术制成。
辅料:氯化钠、磷酸二氢钠一水合物、磷酸氢二钠七水合物、聚山梨酯80、注射用水警告:速发过敏反应风险,在本品输注期间,在部分患者中观察到危及生命的速发过敏反应。
因此,当给予本品时,应随时提供适当的医疗支持。
伴有呼吸功能受损或急性呼吸系统疾病的患者,可能因输注反应而出现呼吸系统损伤的、严重的急性加重,并需要额外监测。
详见【注意事项】。
【性状】本品应为无色至淡黄色澄明或略微浑浊的液体。
【适应症】本品适用于确诊为黏多糖贮积症I型(MPS I;α-L-艾杜糖苷酶缺乏症)患者的长期酶替代治疗,用于治疗疾病的非神经系统表现。
【规格】500U(5ml)/瓶【用法用量】本品治疗应在具有MPS I或其他遗传性代谢疾病管理经验的医生的监督下进行。
应在适合的临床环境中给予本品治疗,并准备好处理紧急医疗事件所需的复苏设备。
推荐剂量:本品的推荐给药方案为100 U/kg体重,每周一次。
肾损害与肝损害:尚未评价过肾损害或肝损害患者使用本品的安全性和疗效。
对于这些患者,没有推荐的给药方案。
用法:本品应静脉输注。
处置和操作时的特殊注意事项:一瓶本品仅供单次使用。
Aldurazyme输注用浓溶液必须用氯化钠9 mg/mL(0.9%)输注溶液进行稀释,使用无菌技术进行输注。
建议稀释后的溶液通过与输液管相连的0.2um 滤器膜过滤(该滤器膜不吸附蛋白或蛋白吸附甚微)输注给患者。
新型的降糖药物-GLP-1受体激动剂PPT参考幻灯片

2020/4/8
10
4
2020/4/8
5
2020/4/8
6
GLP-1受体激动剂的临床疗效
药物 艾塞那肽 利拉鲁肽 利司那肽 艾塞那肽周 抑制剂
降低 HbA 降低 HbA 降低体重
1c
பைடு நூலகம்
1c
(kg)*
(%)* (%)#
0.5~1.0
0.82
0.7~2.7
1.0~1.4
1.18
0.1~2.6
0.3~0.9
0.47
0~1.3
2020/4*/8安慰剂对照研究结果;# 基于安慰剂对照研究的荟萃分析结果;NA:不适用
7
利拉鲁肽注射液储存条件
• 本品应冷藏于2~8 ℃冰箱中(勿进冰箱冷冻室),不可冷冻 • 首次使用后,应在30 ℃以下储藏或冷藏在2~8 ℃冰箱中,不可冷冻 • 首次使用后的效期为一个月 • 盖上笔帽避光储存
利拉鲁利拉鲁肽使用简单方便
• 美 国 临 床 内 分 泌 医 师 协 会(AAC E)联合美国内 分 泌 学 会(ACE)共 识 声 明 中 将 GLP-1受体激动剂列为 一线治疗选择之一;
• 《中国2型 糖尿病防治指南(2017年 版)》也将其列入二联降糖治疗 选 择 之 一。
2020/4/8
3
GLP-1主要由回肠和结肠中的 L 细 胞 分泌,GLP-1与其受体特异性结 合后,主要通过环腺苷酸信号途径发挥血糖依赖性的肠促胰岛素分泌作用。
0.6~0.7
NA
1.2~1.5
降低体重 (kg)# 1.69
2.51
0.90
NA
降低SBP 调节血脂 (mmHg)
心血管结局
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
【诺和力药品名称】商品名称:诺和力通用名称:利拉鲁肽注射液英文名称:Liraglutide Injection【诺和力成份】活性成份为利拉鲁肽(通过基因重组技术,利用酵母生产的人胰高糖素样肽-1(GLP-1)类似物)。
【诺和力性状】为无色或几乎无色的澄明等渗液;pH=8.15。
【诺和力功能主治】适用于成人2型糖尿病患者控制血糖;适用于单用二甲双胍或磺脲类药物最大可耐受剂量治疗后血糖仍控制不佳的患者,与二甲双胍或磺脲类药物联合应用。
【诺和力规格】3ml:18mg(预填充注射笔)【诺和力用法用量】用量:利拉鲁肽的起始剂量为每天0.6mg。
至少1周后,剂量应增加至1.2mg。
预计一些患者在将剂量从I.2mg增加至1.8mg时可以获益,根据临床应答情况,为了进一步改善降糖效果,在至少一周后可将剂量增加至1.8mg。
推荐每日剂量不超过1.8mg。
诺和力可用于与二甲双胍联合治疗,而无需改变二甲双胍的剂量。
诺和力可用于与磺脲类药物联合治疗。
当诺和力与磺脲类药物联用时,应当考虑减少磺脲类药物的剂量以降低低血糖的风险(见注意事项)。
调整诺和力的剂量时,无需进行自我血糖监测。
然而,当诺和力与磺脲类药物联合治疗而调整磺脲类药物的剂量时,可能需要进行自我血糖监测。
特殊人群:肾功能损害:轻度肾功能损害的患者不需要进行剂量调整。
在中度肾功能损害患者中的治疗经验有限。
目前不推荐诺和力用于包括终末期肾病患者在内的重度肾功能损害患者(见药代动力学)。
肝功能损害:在肝功能损害患者中的治疗经验有限,因此不推荐诺和力用于轻、中、重度肝功能损害患者(见药代动力学)。
用量:诺和力每日注射一次,可在任意时间注射,无需根据进餐时间给药。
诺和力经皮下注射给药,注射部位可选择腹部、大腿或者上臂。
在改变注射部位和时间时无需进行剂量调整。
然而,推荐诺和力于每天同一时间注射,应该选择每天最为方便的时间。
更多有关给药的指导参见使用及其他操作的注意事项。
诺和力不可静脉或肌肉注射。
【诺和力不良反应】在5项大规模的氏期临床试验中,己有超过2500例患者接受了诺和力单药治疗或诺和力与二甲双呱、磺脲类药物(加或不加二甲双胍)或二甲双胍加罗格列酮联合治疗。
不良反应发生的频率定义如下:非常常见(1/10),常见(1/100, <1/10>:少见不良反应(1/1, 000, <1/100),罕见不良反应(1/10, 000, <1/1, 000),非常罕见不良反应(<1/10, ooo> ; 不详(根据现有的数据无法评价)。
在每个频率分组中,不良反应都是按照严重性降低的顺序列出。
临床试验期间最常见的不良反应为胃肠道不适:恶心和腹泻非常常见,呕吐、便秘、腹痛和消化不良常见。
在诺和力治疗的开始阶段,这些胃肠道不良反应发生频率可能更高。
上述不良反应通常在治疗持续数天或数周内减轻。
头痛和上呼吸道感染也是常见不良反应。
此外,低血糖事件为常见不良反应,而当诺和力与磺脲类药物联用时则非常常见。
重度低血糖主要发生在诺和力与磺脲类药物联用时。
最常见的不良事件为胃肠道疾病以及感染与侵染。
低血糖:临床研究中大部分确认的低血糖事件均为轻度。
未在诺和力单药治疗的研究中观察到重度低血糖事件。
重度低血糖比较罕见,主要发生在诺和力与磺脲类药物联用时((0.02事件/患者年)。
诺和力与磺脲类药物之外的口服抗糖尿病药物合用时所观察到的低血糖事件非常少(0.001事件/患者年)。
胃肠道不良反应:大部分恶心均为轻至中度,呈一过性,且很少会导致治疗停止。
当诺和力与二甲双胍联用时,20.70/a的患者至少报告了1次恶心事件,12.6%的患者至少报告了1次腹泻事件。
当诺和力与磺脲类药物联用时,9.1%的患者至少报告了1次恶心事件,7.9%的患者至少报告了1次腹泻事件。
大部分事件均为轻至中度,且呈剂量依赖性。
大部分最初出现恶心症状患者在继续治疗情况下,这些症状的频率和严重程度均有所降低。
70岁以上患者接受诺和力治疗时,可能会出现更多的胃肠道反应。
轻度肾功能损害(肌酐清除率为60-90m1/min)的患者接受诺和力治疗时,可能会出现更多的胃肠道反应。
退出:在长期(26周或更长)对照试验中,诺和力治疗组患者中由于不良反应导致的退出率为7.8%,而在对照组患者中为3.4%。
诺和力治疗组中最常见的导致退出的不良反应为恶心(2.8% )和呕吐(<1.5%) 。
免疫原性:与其他含蛋白质或肚类的药物可能具有免疫原性相一致,患者在接受诺和力治疗之后可能会产生抗利拉鲁肽抗体。
平均有8.6%的患者会产生抗体。
抗体形成不会导致诺和力疗效的降低。
注射部位反应:在长期(26周或更长)对照试验中,约2%接受诺和力的受试者报告了注射部位反应。
这些反应通常都为轻度,而且不会导致停用诺和力。
胰腺炎:在诺和力长期临床试验期间已经报告了少数(<0. 2%)急性胰腺炎病例。
诺和力与胰腺炎之间的因果关系尚不明确。
甲状腺事件:在所有中、长期临床试验中,全部利拉鲁肚、安慰剂和全部对照药组中甲状腺不良事件的总体发生率分别为33.5, 30.0和21.7事件/1000患者年,而严重甲状腺不良事件的发生率分别为5.4. 2.1和0.8事件/1000患者年。
在诺和力治疗组患者中,甲状腺肿瘤、血降钙素升高和甲状腺肿是最常见的甲状腺不良事件,其发生率分别为0.5%, 1%和0.8%。
【诺和力注意事项】诺和力不得用于1型糖尿病患者或用于治疗糖尿病酮症酸中毒。
诺和力不得用于有甲状腺髓样癌(MTC)既往史或家族史患者以及2型多发性内分泌肿瘤综合征患者(MEN 2)。
诺和力在纽约心脏病学会(NYHA)分级I- II级的充血性心力衰竭患者中的治疗经验有限。
尚无在NYHA 分级111一W级的充血性心力衰竭患者中应用的经验。
在炎症性肠病和糖尿病性胃轻瘫患者中的治疗经验有限,因此不推荐诺和力用于这些患者。
诺和力治疗过程中会伴随有一过性的胃肠道不良反应,包括恶心、呕吐和腹泻。
已经发现使用其他GLP-1类似物与发生胰腺炎风险相关。
已有少数急性胰腺炎的报道。
应当告知患者急性胰腺炎的特征性症状:持续、严重的腹痛。
如果怀疑发生了胰腺炎,应该停用诺和力和其他潜在的可疑药物。
一些临床试验已经报告了包括血降钙素升高、甲状腺肿和甲状腺肿瘤在内的甲状腺不良事件,尤其是在之前患有甲状腺疾病的患者中(见不良反应)。
接受诺和力联合磺脲类药物治疗的患者发生低血糖的风险可能增加(见不良反应)。
减少磺脲类药物的剂量可以降低低血糖的风险。
对驾驶和机械操作能力的影响尚未研究诺和力对驾驶和机械操作能力的影响。
应告知患者在驾驶和操作机械时预防低血糖发生,特别是当诺和力与磺脲类药物合用时。
使用和其他操作的特别注意事项诺和力仅在呈无色澄明时才可使用。
诺和力不得在冷冻后使用。
诺和力应与长至8mm以及细至32G的诺和针,配合使用。
【诺和力药理毒理】药理作用:利拉鲁肽是一种GLP-1类似物,与人GLP-1具有97%的序列同源性,人GLP-1可以结合并激活GLP-1 受体。
GLP-1受体为天然GLP一的靶点,GLP-1是一种内源性肠促胰岛素激素,能够促进胰腺p细胞葡萄糖浓度依赖性地分泌胰岛素。
与大然GLP-1不同的是,利拉鲁肽在人体中的药代动力学和药效动力学特点均适合每大一次的给药方案。
皮下注射给药后,其作用时间延长的机理包括:使吸收减慢的自联作用;与白蛋白结合;对二肽基肽酶IV CDPP-IV)和中性内肽酶CNEP)具有更高的酶稳定性,从而具有较长的血浆半衰期。
利拉鲁肽的活性由其与GLP-1受体间特定的相互作用介导,导致环磷酸腺苔(CAMP)的增加。
利拉鲁肽能够以葡萄糖浓度依赖的模式刺激胰岛素的分泌,同时以葡萄糖浓度依赖的模式降低过高的胰高糖素的分泌。
因此,当血糖升高时,胰岛素分泌受到刺激,同时胰高糖素分泌受到抑制。
与之相反,在低血糖时利拉鲁肽能够减少胰岛素分泌,且不影响胰高糖素的分泌。
利拉鲁肽的降血糖机理还包括轻微延长胃排空时间。
利拉鲁肽能够通过减轻饥饿感和能量摄入降低体重和体脂量。
毒性研究:遗传毒性:遗传毒性研究数据显示,利拉鲁肽对人体没有特殊危害。
生殖毒性:动物研究并未显示出利拉鲁肽会对生育力会产生直接的有害作用,但是在最高剂量下会轻度增加早期胚胎的死亡率。
孕中期给予利拉鲁肽可以导致母体动物体重下降和胎仔生长减慢,并伴有意义不明的大鼠肋骨及家兔骨骼变异。
大鼠接受利拉鲁肚后新生仔鼠的生长减慢,且高剂量组在断乳期后此效应仍然存在。
尚不清楚新生仔鼠生长减慢系因为直接GLP-1效应导致新生仔摄取母乳量减少,或者因为热量摄取减少导致母乳产量下降所致。
致癌性:在大鼠和小鼠为期2年的致癌性试验中观察到非致死性的甲状腺C细胞肿瘤。
在大鼠中,未观察到未见不良反应的剂量水平(NOAEL)。
猴在接受20个月的给药后未观察到这些肿瘤。
在啮齿类动物中的这些发现系一种非遗传毒性的、GLP一受体介导的特定作用所致,啮齿类动物对该作用尤为敏感。
此作用与人体的相关性可能较低,但是不能完全排除。
未发现其他与给药相关的肿瘤。
【诺和力贮藏】诺和力应冷藏于2℃-8℃冰箱中(勿接近冰箱的冷冻室)。
不可冷冻。
首次使用后,应在30℃以下贮藏或冷藏在2℃-8℃冰箱中,盖上笔帽避光保存。
应当告知患者在每次注射后按照当地的要求丢弃注射针头,这可以避免污染、感染和渗漏,同时能确保给药准确。
不可冷冻,首次使用后的效期为1个月。
同时,贮藏诺和力笔芯时切勿带有针头。
【诺和力批准文号】注册证号J20110026【诺和力生产企业】企业名称:诺和诺德(中国)制药有限公司分包装。
